


| {1} |
ДЛЯ СРЕДНЕГО ВОЗРАСТА
Рецензент
кандидат технических наук
доцент Е. М. Якимец
| {2} |
ДОРОГИЕ РЕБЯТА!
Из книги «Путешественники-невидимки» вы узнаете о мельчайших частичках вещества — химических элементах, из которых состоит вся окружающая нас природа, их путешествиях, особенностях и о том, как их использует человек
| {3} |
| {4} |

| {5} |
| {6} |
Мягкий металл
Было мне не более семи лет, когда случилось то, о чём я хочу рассказать. Среди ребят, населявших нашу шумную весёлую улицу, изредка появлялся долговязый паренёк в аккуратно застёгнутом пиджаке и плоской кепочке.
У него были большие красные руки и близорукие глаза. Он носил очки, и ребята дразнили его «профессором».
Впрочем, не только очки дали повод к этой кличке. Говорили, что он работает учеником в какой-то лаборатории, приносит оттуда всякие порошки и «химические» банки и продымил «опытами» весь домик своей старой бабушки, где живёт после смерти матери.
Каждый раз, завидя его, ребята кричали:
— Профессор, покажи опыт!
А он, ничуть не обижаясь, добродушно отвечал:
— Можно, только, чур, не все сразу...
Так перебывало у него на «химических сеансах» множество ребят не только с нашей, но и с соседних улиц. А однажды и мне посчастливилось попасть в просторную кухню дома, который ребята между собой называли «профессорским». {7}
Пришло нас человек двенадцать. Мы чинно расселись на полу у стенок, наблюдая, как наш «профессор» расставляет на кухонном столе тарелки, узкие высокие стаканы, аптечные склянки с жидкостями, маленький таз и спиртовую горелку.

С того дня прошли десятки лет. Но как свежи в памяти эти воспоминания! Отчётливо помню каждое движение нашего «профессора». Помню и собственное волнение, при виде того как две бесцветные жидкости, слитые в один стакан, вдруг приобрели малиновый цвет, а затем от прибавления нескольких капель третьей жидкости малиновый цвет исчез.
Затем на глазах у всех сама собой зажглась свеча. Изумлённые зрители ахнули, а Петя (так звали нашего «профессора») снисходительно улыбнулся: {8}
— Никакого чуда нет. Просто на свечке у меня насыпана бертолетова соль с сахаром, а на стеклянной палочке, которой я задел свечку, капелька серной кислоты.
Один за другим следовали чудесные опыты, сопровождавшиеся объяснениями.
— Кто хочет сам сделать опыт? — спросил Петя.
Желающими оказались все присутствующие. Понятно, и я вместе со всеми кричала: «я! я!»
И произошло необыкновенное. Петя указал на меня:
— Пусть идёт самая маленькая...
И вот я выхожу на середину кухни. Дрожащей рукой беру из Петиных рук стеклянную палочку, которая, как и всё здесь, кажется мне волшебной.
— Макни палочку сюда,— указывает Петя на одну из склянок,— и рисуй на этой бумажке. Рисуй, что хочешь.
Я так и делаю. Опускаю палочку в склянку, а затем осторожно вывожу на бумаге чёрточки, кружочки, стараюсь изобразить человека, но на бумаге остаются только мокрые бесцветные следы. Ребята смеются надо мной, а я готова заплакать от неудачи и стыда.
— Рано смеётесь! — загадочно говорит наш юный «профессор» и пододвигает ко мне зажжённую спиртовку.
— Суши свой рисунок.
Я покорно выполняю приказание.
— А теперь опусти сюда,— Петя указывает на алюминиевый таз, куда он налил какую-то жидкость из большой бутыли.
Я опускаю бумажку в таз. Ребята соскакивают {9}
 |
Самый эффектный опыт, так сказать «гвоздь программы», был показан на прощание.
Подвязавшись кухонным полотенцем и поправив очки, наш «профессор» достал из шкафчика, висевшего на стене, жёлтую банку с плотной стеклянной пробкой.
Осторожно открыв её и придерживая краем полотенца, Петя предложил нам подходить по-одному и нюхать содержимое банки. Мы охотно сделали это. Но из банки пахло всего лишь керосином.
— Так и должно быть,— важно сказал Петя.— А теперь смотрите!
Он достал из банки какой-то кубик, обрезал его со всех сторон перочинным ножом, и кубик заблестел, как серебряный. Затем Петя сделал лодочку из тонкой бумаги, отрезал от кубика маленький кусочек, положил его в лодочку и опустил в ковш с водой.
Быстро-быстро забегала лодочка по воде. Она кружилась и кружилась. А блестящий кусочек на наших глазах становился всё меньше и меньше. Вдруг мы услышали такой звук, словно что-то лопнуло. Вспыхнуло жёлтое пламя и... в ковше не осталось ничего, кроме воды.
Ошеломлённые и напуганные, мы не двигались с места. А Петя, довольный произведённым впечатлением, похвастался: {10}
— Опыт этот надо умеючи делать. Он опасный! Но я умею... Видали? Этот блестящий кусок (он указал на кубик в керосине) — металл. Называется натрий. Видали, как он плавал по воде, а потом исчез? Куда? Он соединился с водой, и она стала щёлочью. Смотрите, красная бумажка от неё посинеет...
Действительно, узенькая бумажная лента красного цвета, опущенная в ковш, посинела.
Я попросила у Пети на память эту «волшебную» бумажку. Тогда я ещё не знала, что она называется лакмусовой и обладает свойством синеть от щёлочи и краснеть от кислоты, но, как и всё Петино «химическое хозяйство», казалась мне удивительной, полной волшебства.
А металл, похожий на серебро, но мягкий, как сыр, плавающий на воде и с шумом исчезающий в ней, надолго поразил моё детское воображение.
Натрий! Само слово звучало, как имя сказочного героя. Стеклянная банка с керосином представлялась мне темницей. Бедный натрий томился в керосиновом плену. Мне хотелось выпустить его на волю... Пусть бы побегал по воде, да не в ковше, а по городскому пруду!
Много лет спустя на уроках химии в школе, а позднее и на лекциях в институте я с благодарностью вспоминала Петю-«профессора» и его химические опыты. Теперь его нет в живых. В годы Отечественной войны, будучи уже известным учёным, он ушёл на фронт и не вернулся.
На уроках химии
В школе мне снова пришлось увидеть натрий. Он хранился в банке, наполненной прозрачным жидким маслом. Было такое чувство, {11} словно я встретила старого друга. Но теперь я, как и другие ребята нашего класса, понимала, что натрий, хранящийся в масле и керосине, совсем не пленник!
Наоборот, пленником он был раньше, до тех пор пока химики не освободили его.
— Вот, взгляните! — говорила нам учительница, показывая горсточку соли, мыло, белый порошок соды, кусок стекла...— В этих веществах содержится натрий. Здесь он действительно живёт, как пленник, как бы связанный по рукам и ногам. В таком «пленённом» состоянии он находится во многих веществах: в минералах, горных породах.
Химики научились освобождать его из плена, защищать от злейших врагов: воды и воздуха. Такой защитой служит керосин или масло...
Мы особенно хорошо поняли это после того, как учительница позволила нам вынуть кусочек натрия из банки и оставить его на открытом воздухе. Мы положили его на стеклянную пластинку и каждый день приходили смотреть, как меняется наш натрий.
А изменялся он поразительно. Его серебристый блеск исчез, весь он покрылся белой корочкой и стал рыхлым, влажным и на ощупь напоминал мыло. Натрия не стало. Вместо него лежала бесформенная серая масса.
Куда же он девался? Почему мы его не видим?
На эти вопросы отвечала химия.
Оказывается, натрий не исчез, а только спрятался. Он стал невидимым. Если бы наши глаза увеличивали в десятки миллиардов раз, мы могли бы рассмотреть натрий в бесформенной серой массе. {12}
Имей мы такое зрение, весь мир выглядел бы совсем иным. Например, кристаллик соли показался бы нам огромным стройным сооружением в виде куба. Мы не могли бы даже весь его охватить взглядом, так велик он показался бы!
Наше зрение показывает нам мир далеко не таким, каков он на самом деле. И всё же человек проникает в самые сокровенные тайны природы. Наука делает его могучим! Она вооружает человека дополнительным зрением.
Благодаря науке мы знаем, что все вещества в природе не сплошные. Их можно раздробить на множество мельчайших частичек, которым дали название — молекулы. Молекулы состоят из ещё более мелких частичек — атомов.
В природе имеются атомы различных сортов.
Есть вещества, в которых обнаруживают атомы только одного какого-либо сорта, например, в золоте — атомы золота, в железе — атомы железа. Такие вещества называют простыми.
Но большинство веществ в природе не простые, а сложные. В них находят различные атомы. Например, в соли имеются атомы натрия и хлора. Хлор — газ жёлто-зелёного цвета, противного удушливого запаха.
Учёные говорят, что всё многообразие мира происходит от того, что атомы разных сортов сочетаются между собой в самых различных комбинациях.
Один какой-либо сорт атомов называют химическим элементом. Кислород и водород, из которых образовалась вода,— химические элементы. Натрий и хлор — тоже химические элементы.
Так постепенно на уроках химии по-новому начал выглядеть для меня давно знакомый мир, {13} с зелёными травами и цветными камешками, с яркими цветами и прозрачными водами...
Хотелось без конца спрашивать: а из чего это состоит? А это? Всё вокруг было полно тайн и загадок. Вещи словно скрывали своё настоящее лицо под шапкой-невидимкой.
А заглянуть под эту шапку-невидимку позволяла химия.
Священное искусство
Достоверно о происхождении слова «химия» учёные до сих пор ничего не знают. Одни утверждают, что оно появилось в Египте, другие говорят, что это греческое слово.
Но дело, в конце концов, не в слове! Гораздо важнее узнать, когда и где зародилась эта наука.
И на этот вопрос точного ответа пока нет. Ясно лишь, что химия — одна из древнейших наук, знакомых человечеству. Её возраст исчисляется не сотнями лет, а тысячами.
Её истоки уходят в те времена, когда на Земле появились первые мыслящие существа — люди. И невозможно назвать первого химика, так же как и имя гения, который открыл огонь и первый применил его для человеческих нужд.
А кто первый догадался вспахать землю? Кто научился изготовлять ткани из волокон, а затем окрашивать их?
Всё это — изобретатели далёкого прошлого. Они стремились найти средства обеспечить людей пищей, одеждой, различными материалами, необходимыми для жизни.
Они были зачинателями первых производств, превращали одни вещества в другие. {14} А это значит, что они бессознательно пользовались химическими процессами.
История не сохранила нам имён этих безвестных гениев. Возможно, что среди них были и философы. Они задумывались над загадками природы и как-то по-своему представляли строение окружающих человека веществ. Но их мысли не дошли до нас. Мы знаем о жизни первобытных людей то немногое, что может выяснить наука археология.
Археологи изучают историю жизни народов, населявших Землю в самые отдалённейшие времена. Чем древнее народ, тем труднее добыть какие-либо сведения о нём. Но археологи — люди упрямые и настойчивые.
Производя раскопки, они восстанавливают картины жизни наших древних предков.
Землю можно сравнить с гигантской книгой. Тот, кто потрудится, разберёт её немой язык, найдёт много интересного. В ней сохранились различные изделия людей прошлых эпох: глиняная и металлическая посуда, остатки жилищ, а кое-где и целых городов.
 |
Иногда археологам удаётся найти в земле даже «письменные документы». Правда, эти «документы» написаны не на бумаге.
В Ираке проводились археологические раскопки. Здесь нашли много бронзовой посуды, серебряных и медных украшений. Больше {15} всего заинтересовали учёных глиняные дощечки с непонятными клинообразными надписями. Целая глиняная библиотека хранилась под землёй.
«На каком же языке она написана?» — размышляли учёные.
Нелегко было прочесть эти письмена. Пришлось каждую букву сравнивать с буквами древнееврейского, древнегреческого и других древних языков, сохранившихся на земле.
Так постепенно, букву за буквой, учёные прочли всю глиняную библиотечку. Оказалось, что её написали люди, жившие шесть тысяч лет тому назад. Это были вавилоняне.
Они описывали, как из руды выплавляют медь, серебро, свинец, как по морю отправляют свои изделия в другие страны, как изготовляют стекло бесцветное и окрашенное в различные цвета.
Производство красок и стекла, выплавка металлов, да и самое изготовление хорошо обожжённых глиняных табличек требовали знаний химии.
Не приходится сомневаться, что у вавилонян были свои одарённые инженеры, изобретатели и, конечно, химики.
Но гораздо больше знаем мы о химии древнего Египта. Учёных не перестаёт поражать умение египтян бальзамировать трупы. Какие химические вещества употребляли они? Как достигли такого совершенства? Ведь египетские мумии пролежали тысячелетия и не поддались разрушительному действию времени!
А их краски! Яркоголубая, пурпурная, густосиняя... Ткани, найденные на мумиях, которым {16}
 |
Среди развалин старинной столицы Египта — города Фивы — сохранились стены с изображениями работы стеклодувов, металлургов, гончарников.
Египтяне умели изготовлять румяна, душистые масла, мыло, знали секреты консервирования мяса, рыбы, овощей, варили пиво, обрабатывали кожу.
А ведь все эти производства связаны с химией.
Но к занятиям наукой в Египте простые люди не допускались. Они выполняли роль безмолвной рабочей силы.
Всей жизнью управляли жрецы. В их руках находились и производства, и искусства, и науки, которые тоже считались «священными искусствами».
И хотя в Египте ещё не существовало химии в виде той точной науки, какую мы изучаем теперь, но египетские жрецы, среди которых были, конечно, очень образованные люди, понимали, что одни вещества природы могут переходить в другие, и умели управлять этими превращениями.
Для занятий «священной» наукой в Египте был выстроен храм Сераписа. Это был не обычный храм, где молятся богу или приносят жертвы. Здесь располагались лаборатории, музеи,
| {17} |

мастерские. Будущие инженеры, строители и даже надсмотрщики над рабами обучались в этом храме...
Во главе каждого отдела стоял сын фараона или знатный сановник. Всё, что делалось в храме, соблюдалось в строгой тайне. Простой человек считался недостойным того, чтобы ему открывали «божественные» тайны.
Но истинные причины были иными! Вооружённые научными знаниями, жрецы могли властвовать над народом. Время от времени они показывали народу какие-либо «чудеса». Этим они укрепляли своё могущество, веру народа в их связь с богами. А между тем «чудеса» были не чем иным, как эффективными физическими или химическими опытами!
Сохранились сведения и о других древних странах, где занимались химическими превращениями. Есть одна старинная книга индийского учёного Каутилайа. Она написана несколько тысячелетий тому назад. Из неё мы узнаём, что индусы издавна знали многие {18} производства, где требовалось понимание химии.
Такие же старинные книги обнаружили у китайцев. Вообще о науке этой страны нам было известно мало. Но исследования последнего времени приоткрывают завесу над историей науки в Китае. Учёные предполагают, что именно здесь зародилась химия.
Китайские философы уже за много веков до европейцев высказывали мысль о том, что все окружающие нас вещества состоят из элементов. Правда, их «элементы» были не те, о которых мы знаем теперь. Элементами оми называли воду, огонь, землю, дерево и золото.
Им казалось, что из сочетания этих «элементов» устроены все вещества природы.
Более поздние китайские химики выяснили, что вода — вещество сложное. И задолго до европейцев знали, что в её состав входит газ водород. Только называли его, конечно, не этим именем. Водород они изображали двумя значками: «огонь» и «газ».
Есть у китайцев старинное произведение, написанное философом Вей-по-Иангом. Он жил более двух тысяч лет назад. Называется это произведение «Книга перемен» и почти всё посвящено химии.
В средневековой лаборатории
Химия! Наука чудес и мечтателей... Именно такой была она у древних народов. Искусные химики Вавилона и Египта, Индии и Китая проводили очень сложные химические опыты, но найти им правильное объяснение они не умели. {19}
Представьте себе учёного, склонившегося над котлом, где кипит смесь олова и меди. Два эти металла сплавятся вместе и превратятся в вещество золотистого цвета.
Мы теперь знаем (это покажет нам анализ), что золотистый цвет полученного сплава не имеет никакого отношения к золоту. В нём есть только атомы химических элементов меди и олова.
Но в те времена самого понятия «химический элемент» не существовало. Мы уже говорили о древних китайцах, которые считали, что всё в природе состоит из воды, огня, земли, дерева и золота.
Со временем элементами начали называть не вещество, а его свойства: тепло, холод, влажность и сухость.
Постепенно пришли к мысли, что от сочетания тепла, холода, влаги и сухости зависят качества всех окружающих нас веществ. В металлах видели одно общее свойство — метал-личность и думали, что если прибавить к какому-нибудь простому металлу немного тепла или сухости, то, наверное, можно будет получить золото.
Вот почему золотистый сплав меди и олова заставлял химика древности радоваться. Он был убеждён, что в его котле «сварился» драгоценный металл.
«Я нашёл способ стать богатым...» — взволнованно размышлял он.
И новые порции меди и олова бросал химик в котёл.
Но проходило немного времени и кусок «золота» тускнел, покрывался зелёными пятнами.
| {20} |

— Моё сокровище заболело,— сокрушался наивный исследователь,— в него вселился злой дух. Надо изгнать его... или умилостивить...
А когда химики ознакомились с ртутью, они обрадовались:
— Да ведь она совсем как серебро! Только жидкая...
— Может быть, из неё надо убрать влажность, прибавить сухость и какую-нибудь жёлтую краску и получится золото?
Много веков бесплодного труда ушло на попытки изобрести «способ» превратить простые металлы в драгоценные. Таинственные рецепты передавались из поколения в поколение. За большие деньги секреты продавались в другие страны. Люди теряли целые состояния, сходили с ума, лишались жизни во время неосторожных опытов.
Особенно усердно занимались подобными превращениями учёные средних веков. В Германии,
| {21} |

во Франции, в Италии сотни химиков, которых тогда звали алхимиками, закрывались в своих лабораториях. Таясь друг от друга, они добывали «философский камень».
Что это за философский камень, никто из них точно объяснить бы не мог. Но его необыкновенные свойства не давали покоя средневековым мечтателям.
Все надежды человечества должен был выполнить этот камень! Излечивать неизлечимые болезни, делать стариков молодыми и главное — превращать простые металлы в золото.
Алхимики кипятили, выпаривали, высушивали различные смеси, прокаливали их на огне, читали над ними заклинания, призывали на помощь бога и дьявола. Искали таинственные связи между своей работой в лабораториях и положением звёзд на небе. Каждому металлу, по их мнению, соответствовало какое-нибудь светило: золоту — Солнце, серебру — Луна, {22} меди — Венера, железу — Марс, свинцу — Сатурн, олову — Юпитер, ртути — Меркурий.
Дело дошло до того, что когда в шестнадцатом веке стала известна сурьма, учёные отказались признать её металлом.
— Каждый металл должен иметь на небе свою планету, а сурьма не имеет! — говорили они.
Ни небесные светила, ни заклинания не помогли алхимикам.
Атомы химического элемента железа, олова или ртути, сколько над ними ни мудрили, не изменялись. Они не становились атомами другого химического элемента — золота.
Учёные последующих веков смеялись над алхимиками.
— Как можно надеяться на превращение химических элементов! — рассуждали они.— Ведь каждый химический элемент — это атомы определённого сорта. Переходить в атомы другого сорта они не могут.
Но оказалось, что и эти учёные ошиблись. Всемогуществу науки нет предела. Мы живём в такое время, когда мечты алхимиков о превращении одних химических элементов в другие сбываются.
В нашем обиходе появилось новое слово — радиоактивность. Слово это происходит от названия металла радия.
С тех пор, как открыли радий, учёным пришлось пересмотреть свой взгляд на неизменяемость химических элементов.
Радий проявил неожиданные свойства: он превращался в другие химические элементы. И оказалось, что он не одинок. У него обнаружилась большая группа родственников — {23} элементов, обладающих такими же свойствами.
Прежде чем стала известна радиоактивность, наука прошла длинный и трудный путь. Надо было открыть и хорошо изучить химические элементы, из которых состоят вещества природы. Понять, какая разница и какое сходство между химическими элементами, выяснить, каким законам они подчиняются.
Химия должна была стать точной наукой. Ведь она в течение тысячелетий была всего лишь служанкой египетских жрецов и средневековых алхимиков. Словно лёгкое судно, плыла она по неизведанным морям. Не было у неё ни капитана, ни ясного направления. Она обросла предрассудками, как дно корабля обрастает ракушками.
Химии предстояло очиститься от ложных представлений и выйти на настоящую дорогу.
Это случилось только в восемнадцатом веке. Капитаном, который дал верное направление химии, стал великий русский учёный — Михаил Васильевич Ломоносов.
И труды, и сама жизнь этого человека интересны и поучительны.
«Юноши с особенным вниманием и особенной любовью должны изучать его жизнь»,— писал о Ломоносове Белинский.
И образ крестьянского парнишки, который отправился пешком от берегов Белого моря до Москвы, чтобы учиться, действительно стал одним из любимых образов нашей молодежи.
Кто не мечтает в детстве о подвигах, о доблести, о геройстве! Жизнь Ломоносова — неисчерпаемый пример настоящего героизма. Не о {24}
 |
Ломоносов |
Трудно назвать науку, которукНш не изучал Ломоносов. И не только изучал, но впоследствии внес в нее много нового и ценного.
Пушкин говорил, что «соединяя необыкновенную силу воли с необыкновенною силою понятия, Ломоносов обнял все отрасли просвещения... Он всё испытал и всё проник...»
От всеобъемлющего ума этого человека не ускользнуло ничего: жизнь мельчайшей травинки и великие законы природы. И не только естественные науки привлекали его. Он занимался историей, металлургией, экономикой, писал стихи, создавал картины из стекла...
Ломоносов сделал такие открытия в науке, которые лишь через десятки лет после его смерти стали понятны учёным.
Мера и вес
Как устроены вещества, окружающие нас? Где найти ключ, который откроет неведомые тайники? И где глаза, способные заглянуть в скрытый от нас мир? {25}
Эти вопросы волновали мыслящих людей всех времён. Искал на них ответа и Ломоносов. «Химия первая проникнет во внутренние чертоги тел»,— предсказывал он.
Но истинным химиком Ломоносов считал не того, кто проделывает бесчисленное множество опытов, а того, кто находит им объяснения, кто, исследуя природу, мог выведать у неё самые сокровенные секреты. Химик должен быть вооружён знаниями математики, геометрии, физики и химии.
Именно таким учёным был сам Ломоносов. Он взял от науки всё, что можно было получить от неё в восемнадцатом веке. По крупицам собирал он истинные знания, очищая их от религиозных предрассудков, от всего наносного, что накопилось за тысячелетия.
И как из маленького семечка садовод выращивает высокое, стройное дерево, Ломоносов из крупиц истины сумел создать целое учение, объясняющее законы природы.
За две тысячи лет до Ломоносова жил в древней Греции философ Демокрит. Это он первый высказал мысль о том, что все вещества, окружающие нас, только кажутся сплошными, а на самом деле состоят из очень маленьких невидимых частичек.
«Если бы этого не было, то как бы могла растворяться в воде соль?» — спрашивал Демокрит.
Предположение древнего философа объясняло многие необъяснимые явления природы.
Почему вода превращается в пар?
Почему мы ощущаем запах цветов?
Почему железные предметы от нагревания расширяются? {26}
На все эти вопросы Демокрит давал ответы.
Частички воды благодаря сильному нагреванию отрываются от всей массы воды и улетают в виде пара.
Частички пахучих веществ отделяются от цветов, разлетаются по воздуху, и мы можем их ощущать.
Частички железа от нагревания расходятся, предмет становится шире, больше.
Демокрит утверждал, что всякое вещество можно дробить на всё меньшие и меньшие части. И в конце концов получить такие мельчайшие частички, которые уже будут неделимыми. Он назвал эти частички «атомами», что по-гречески обозначает «неделимые».
Теперь-то мы знаем, что это название неточно. Для нас слово «атом» утратило своё первоначальное значение «неделимого». Каждый школьник в наши дни знает, что учёные раздробили атом на ещё более мелкие частички. При этом удалось извлечь из атома огромное количество энергии. А эту энергию можно по-разному использовать. Учёные, которые хотят мирной жизни, трудятся над тем, как бы атомной энергией двигать поезда, теплоходы и самолёты, помогать врачам бороться с болезнями. А те, кто не хочет мира, угрожают уничтожить человечество атомной бомбой.
Вот как по-новому зазвучало для нас слово «атом».
А ведь ещё совсем недавно атом считался самой мельчайшей частичкой вещества, неспособной больше дробиться.
На долгие века были забыты высказывания Демокрита. Но зерно истины, брошенное в глубокой древности, не потерялось. Михаил {27} Васильевич Ломоносов вдохнул новую жизнь в идеи Демокрита.
Он нарисовал отчетливую картину строения веществ; рассказал о химических элементах, сочетание которых создаёт многообразие мира; показал, как мельчайшие невидимые частички — атомы — соединены в более крупные частички — молекулы. Ломоносов не употреблял названий, к которым мы привыкли. Химический элемент он называл «началом», молекулу — «корпускулой». Но созданная им теория и теперь — двести лет спустя — является основой научной химии.
Древним же философам принадлежит мысль о том, что в природе ничего не исчезает бесследно и ничего не создаётся вновь.
Римский поэт Тит Лукреций Кар, живший на несколько столетий позднее Демокрита, оставил поэму «О природе вещей». В этом произведении излагаются философские взгляды того времени:
|
«Первоначальное правило ставит природа такое: из ничего даже волей богов ничего не творится...» — |
писал поэт.
|
«Из ничего не рождаются вещи. Также не могут они, народившись, в ничто обратиться». |
Эти мысли древних философов были известны учёным. Однако никто до Ломоносова не пытался доказать их опытами и вывести из этих опытов всеобщий закон природы.
На каждом шагу в жизни мы найдём подтверждение этого закона. {28}
Представим себе для примера поле, засеянное рожью.
На один гектар надо затратить около ста шестидесяти килограммов зерна.
К осени с этого же гектара, если хорошо обработать землю и дать растениям хорошее удобрение, можно снять более двух тысяч килограммов зерна.
Откуда же взялся прирост?
Может быть, из ничего? Но тот, кто изучал жизнь растений, знает, что растение питается воздухом и солями из почвы. За счёт этой пищи оно растёт, созревает и даёт урожай.
Из «ничего» — прироста урожая не будет!
А вот другой пример.
Возьмём тридцать килограммов дров. Сожжём их в печи. А теперь взвесим золу. Ведь это всё, что у нас осталось от дров! Она весит всего полкилограмма.
Куда же девались двадцать девять с половиной килограммов? Может быть, бесследно исчезли?
Так кажется только с первого взгляда. Но представьте себе, что в дымоходе нашей печи установлен газоуловитель. Да такой мощный, что ни один пузырёк газа не удерёт от этого строгого контролёра!
Если мы взвесим всё собранное уловителем и прибавим к весу золы, то получим цифру большую, чем тридцать килограммов.
 |
Откуда же взялся дополнительный вес?
Чтобы понять, что здесь произошло, надо вспомнить {29} об одном химическом элементе, который входит в состав воздуха. Называется он кислородом. Это очень деятельный элемент. Он легко вступает в самые различные «химические дружбы». Он употребляется животными и людьми для дыхания, он участвует в горении.
Так вот, когда дерево горело, к каждому его элементу присоединился кислород. Весь углерод, соединившись с кислородом,, улетел в виде углекислого газа, водород превратился в водяные пары. Азот и сера тоже образовали летучие вещества. А металлы, входившие в состав дерева, обратились в горсточку золы...
Но если даже мы не поставим газоуловителя в трубе нашей печи, дым не пропадёт бесследно. Он рассеется в воздухе. Водяные пары осядут в виде капель влаги, а углекислый газ пойдёт в пищу растениям. Может быть, ветер унесёт частички газа, который вылетел из нашей трубы, далеко-далеко на юг. И им будет питаться зелёный лист виноградной лозы или лист орехового дерева. А может быть, он улетит на север, где из-под снега выглядывает веточка мха. Ей тоже нужен углекислый газ.
Закон Ломоносова помогает нам понять жизнь невидимых путешественников — химических элементов. Они никогда не исчезают, хотя беспрерывно меняют своё местожительство. Они всегда в движении, соединяются друг с другом, расходятся и вновь встречаются.
Словно герои древних сказок, они меняют облик, прячутся под шапками-невидимками. Но ни один атом ни одного химического элемента не может ни потеряться, ни создаться из ничего.
Ломоносов писал: {30}
«Сколько у одного тела отнимется, столько присовокупится к другому. Так ежели где убудет несколько материи, то умножится в другом месте...
Сей всеобщий закон простирается и в правила движения: ибо тело, движущее своей силой другое, столько же теряет, сколько сообщает другому...»
Мы теперь называем этот закон — законом сохранения материи и энергии.
Ломоносов доказывал его убедительными опытами. Он брал вещества и точнейшим образом взвешивал их до и после опыта. И оказывалось, что какие бы химические изменения ни происходили с этими веществами, общий их вес не изменялся.
Размышляя над различными явлениями природы, Ломоносов задавал себе вопрос: что происходит с металлом, который подвергают прокаливанию?
«Нет никакого сомнения,— писал он,— что частички воздуха, непрерывно текущего над обжигаемым телом, соединяются с ним и увеличивают его вес».
Теперь это утверждение Ломоносова нам понятно. Мы знаем о вездесущем газе кислороде, который является составной частью воздуха и соединяется со многими элементами во время горения, а особенно охотно с металлами.
Но современники Ломоносова иначе объясняли процессы горения.
Среди некоторых учёных утвердилась вера в особое загадочное вещество «теплотвор». Где оно находится, как выглядит и какие имеет свойства, никто точно не знал. Но учёные думали,
| {31} |
 |
М. В. Ломоносов за опытами. |
что «теплотвор» входит в нагретые тела, а когда они охлаждаются — из них выходит.
Убеждение это было прочно, и никто не осмеливался подвергнуть его сомнению.
Один английский учёный, Роберт Бойль, проделал такой опыт. Он поместил кусок свинца в тугоплавкую стеклянную колбу с узким изогнутым горлом. Такие колбы называются ретортами. Отверстие реторты он запаял и взвесил её. Затем поставил на огонь. Два часа длилось нагревание. Кусок свинца за это время {32} превратился в порошок — в окалину. Тогда Бойль снял реторту с огня и вскрыл её. Воздух со свистом ворвался внутрь реторты, но Бойль не обратил на это никакого внимания.
Взвесив реторту с окалиной свинца и сравнив с первоначальным весом, учёный увидел прибавку.
Какой же вывод из этого сделал Бойль? Не подозревая о роли газа кислорода, о его способности соединяться с металлами, Бойль и не искал никаких новых объяснений своему опыту. Он удовольствовался старым.
«Всё дело в теплотворе! — решил Бойль.— Во время нагревания он проник сквозь стеклянные стенки реторты, вошёл внутрь металла и отяжелил его...»
Ломоносов не верил в существование загадочного теплотвора.
«Что происходит в запаянной реторте во время прокаливания? — думал он. И сам себе отвечал: — Химическая реакция. Частички воздуха, которые остались в реторте, присоединяются к частичкам свинца. Образуется новое вещество — окалина. Вес металла, конечно, становится при этом больше. Но одновременно должен убавиться вес воздуха, потому что часть его использовалась на образование окалины. Значит, общий вес всех веществ, заключённых в реторте, не убавился и не прибавился. Таков закон природы...»
Когда Ломоносов все эти свои сомнения излагал перед учёными, они только плечами пожимали.
— Дерзкий человек! Он хочет нарушить основы науки! — говорили учёные.— Он не верит в «теплотвор»! {33}
Ломоносов решил повторить опыт Роберта Бойля и показать, в чём была его ошибка. Он взвесил запаянную реторту, в которой находился свинец, прокалил её и снова взвесил.
После прокаливания вес не изменился. В чём же дело? Почему у Бойля получилось иначе?
— Очень просто,— объяснил Ломоносов.— Бойль открыл реторту до взвешивания. Впустил в неё внешний воздух. Он занял место того, который во время опыта соединился с металлом. Вот за счёт этого ворвавшегося внешнего воздуха реторта и стала тяжелее...
А Ломоносов взвешивал, не открывая. В его реторту не проникло ничего извне. И, конечно, результаты его опыта надо было признать более точными. Так просто и наглядно доказал великий учёный справедливость своих слов о том, что материя не может ни исчезнуть, ни возникнуть из ничего.
Несмотря на убедительность опытов и ясность мыслей, учение Ломоносова мало распространялось. Русские цари и все те, кто правил Россией, относились с недоверием к своим отечественным учёным.
Многие труды Ломоносова остались нена-печатаннбши. Проходили десятки лет, рукописи Ломоносова лежали покрытые архивной пылью. Другие учёные открывали то, что давно было открыто Ломоносовым. Слава о них гремела на весь мир, а имя гениального русского учёного оставалось неизвестным.
Так случилось и с законом сохранения вещества.
Много времени спустя после Ломоносова его вновь открыл французский учёный Лавуазье. {34} Некоторые исследователи утверждают, что Лавуазье знал о работах Михаила Васильевича Ломоносова. Другие считают, что Лавуазье открыл закон самостоятельно. Но как бы там ни было, документы, письма и статьи, найденные в архивах, свидетельствуют, что первооткрывателем величайшего закона природы надо признать Ломоносова.
Сложная судьба была у этого человека! Во многом переросший своих современников, горячий патриот родины, он с трудом добивался признания и сносных условий для работы.
Придавая огромное значение точным измерениям в химии, Ломоносов долгие годы не имел лаборатории, где мог бы экспериментировать, искать подтверждение своим гениальным мыслям. Уже будучи профессором химии, он всё ещё писал: «Хотя имею я усердное желание в химических трудах упражняться и тем отечеству честь и пользу приносить, однако без лаборатории принуждён только одним чтением химических книг и теорией довольствоваться». Много усилий затратил он, пока добился строительства первой в России химической лаборатории.
В проекте, который Ломоносов представил Академии наук, он писал:
«В химических действиях намерен я поступать таким порядком: 1. Нужные в химических трудах употребительные натуральные материи сперва со всяким старанием вычистить, чтобы в них никакого постороннего примесу не было, от которого обман быть может... 2. Вычищенные материи разделять сколько можно на те, из которых они натурально сложены. 3. Для лучшего доказательства, что разделённые {35} материи из оных простых состоят, намерен оные снова соединять сколь возможно. 4. Разные натуральные и сделанные материи соединять разными химическими способами для произведения новых действий и материй, которые могут часто пользовать в познании натуры и к прирощению художеств. 5. Сделанные другими химиками важные опыты, которые хотя и вероятны, однако несколько сомнительны... или неточно описаны, повторить и тем их справедливость или подлог исследовать».
И последнее:
«При всех помянутых опытах буду я примечать и записывать... самые действия, вес или меру употребляемых к тому материй...»
В проекте этом изложена огромная программа действий. Ломоносов выполнил свой план. Он исследовал много сложных веществ, разлагал их на составные части, соединял из этих составных частей новые вещества, проверял опыты других учёных.
И всегда помнил главное правило работы химика — соблюдал меру и вес.
С тех пор все многочисленные лаборатории нашей страны не забывают эту основную заповедь ломоносовского учения.
В гостях у химиков
Пройдём же в какую-либо химическую лабораторию и посмотрим, как там работают. В каждом городе их можно найти десятки. В одних исследуют руду, в других — металлические сплавы, в третьих — пищу.
Трудно перечислить все ветви и ответвления, которые появились в современной химической {36} науке. И, конечно, лаборатория мукомольного завода, где проверяют качество муки, будет отличаться от лаборатории горного рудника или завода, где варят сталь.
Но, заглянув и туда и сюда, мы найдём много общего. Мы увидим высокие лабораторные столы, покрытые линолеумом или стеклом, полки с расставленными на них склянками, причудливо изогнутые стеклянные приборы, сушильные шкафы, электрические печи и удивительную химическую посуду.
Я говорю «удивительную» потому, что она не похожа на обычную посуду, какой пользуются в домашнем обиходе. Наполненные цветными жидкостями стоят на столах высокие стаканы и колбы. У колб самые разнообразные горлышки. У одних — короткие и широкие, у других — узкие и длинные, а у третьих — изогнутые.
В лаборатории пользуются и фарфоровой посудой, но и она не похожа на нашу домашнюю. Это — узкие лодочки, стаканы, тигли разных размеров от маленького, как детский напёрсток, до больших, как чайная чашка.
Тот, кто хоть раз побывал в химической лаборатории, надолго запомнит ту особую тишину, которая царит здесь. Тысячи солнечных зайчиков играют в стекле приборов. Работники лабораторий в халатах, с полотенцами через плечо, переходят от прибора к прибору, сосредоточенно склоняются над своими записями, вглядываются в еле видные осадки на дне колб или сидят на высоких круглых табуретках около весов.
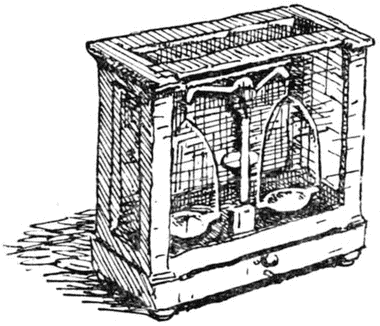
Но как не похожи эти весы на те, что мы постоянно видим в магазинах! {37}
Эти — лабораторные — качаются от малейшего прикосновения. Они находятся в стеклянных футлярах и приводятся в движение особым винтом. Но не так-то просто ими пользоваться!
Неопытный человек не только не сумеет взвесить на них, но ещё вдобавок и весы испортит. «Расстроит» — говорят химики, будто это не весы, а музыкальный инструмент!
А гирьки! Ты посмотри на эти гирьки! Вес легчайшей пушинки можно определить ими.
Если взять один грамм какого-либо порошка и разделить его на десять тысяч частей, то каждую десятитысячную долю можно будет взвесить на этих весах.
Что было бы, если бы мы вздумали обратиться к продавщице с просьбой взвесить нам один грамм конфет? Продавщица решила бы, что мы шутим. А вот для химика грамм — очень большая величина. Он привык обращаться с десятыми, сотыми, тысячными и десятитысячными долями грамма.
Точные лабораторные весы называются аналитическими, потому что они помогают химикам производить химические анализы. Пользуясь ими, химики могут определять такие ничтожные количества, какие на обычных весах будут совершенно неощутимы.
Но, как это ни удивительно, химикам известны ещё более точные способы исследования. Например, в некоторых лабораториях имеются электромагнитные весы. Они в десять тысяч раз точнее аналитических. Но и это ещё не предел точности!
Есть способы, при которых можно определить миллиардные доли грамма. Способы эти {38} основаны на особых свойствах того или иного вещества. Одни из них окрашивают пламя, придают ему то зелёный, то жёлтый, то лиловый цвет. Другие сами светятся, третьи имеют отличительный аромат...
Всякий раз, когда я вхожу в химическую лабораторию, меня охватывает особое волнение. Ведь здесь проникают в тайны всех окружающих нас веществ, узнают, что из чего состоит.
Мне всегда кажется, что здесь незримо присутствуют все те, кто отдал свою жизнь изучению природы.
И среди них возвышается светлоглазый сын русского помора, чьё учение до сих пор неугасимо светит современной науке.
В какую бы лабораторию мы ни заглянули, всюду правило Ломоносова о соблюдении меры и.веса не забыто.
Высушивает ли химик какое-либо вещество в сушильном шкафу, прокаливает ли что-нибудь в печи, смешивает ли в фарфоровой чашке цветные растворы,— везде и во всём соблюдает он это правило.
Он должен работать чётко, чисто и аккуратно.
Стоит ему уронить крошечную каплю раствора, потерять почти невидимую крупинку исследуемого порошка, не смыть в стакане едва заметный осадок — и результаты его работы будут ошибочными.
Вес окажется не точным.
Не удивительно, что химик относится к своим весам, да и ко всем своим приборам, бережно, как скрипач к своей скрипке.
Работа химика требует точности не меньшей, {39} чем исполнение музыкального произведения.
Вот эти-то тщательность и чистота приёмов и помогли химикам в изучении окружающей нас природы.
Всевидящий глаз
Можно с уверенностью сказать, что нет ни одного вещества в природе, которое не побывало бы в руках у химиков.
Разнообразный мир окружает нас. Мы радуемся его беспрерывному движению, краскам, формам, звукам.
Химики, как и мы с тобой, любят землю с её травами, рудами, металлами, красотой гор и.запахом цветов. Но химики не только любуются миром, они изучают его. В течение многих веков они исследуют сложное хозяйство природы.
А попробуй только назвать все известные тебе вещества. Ты насчитаешь их не одну сотню. Только оглядевшись в своей комнате, ты увидишь их множество: хлеб, вода, фарфор, дерево, бумага, стекло, краска, которой покрыты стены, чернила в чернильнице.
В кухне ты найдёшь новые вещества: алюминий, из которого сделаны кастрюли, пластмасса электрических выключателей, медь водопроводного крана, холст полотенца...
А на улице? Здесь ещё десятки веществ: асфальт, кирпич, глина, песок, камень. Зайдём в горный музей, и там за стеклянными витринами нам откроются сотни минералов, драгоценных камней, имеющих каждый свой особый химический состав.
Поднимемся на высокие горы или спустимся {40} к реке, пойдём в лес или поле — и всюду, всюду мы найдём разнообразнейшие вещества природы.
Одни из них жидкие, другие твёрдые, одни имеют резкий запах, другие отличаются яркой окраской, третьи обладают сладким вкусом...
Одни из них окружают нас всюду, другие представляют собой редкость в природе. На для всевидящего глаза науки и это не препятствие. Химикам известны составы не только веществ, имеющихся на нашей планете, они заглянули не только на дно океанов и проникли вглубь земли, им удалось узнать, из чего состоят солнце, луна, звёзды и планеты.
Далеко от нас расположены небесные светила, никто из людей ещё никогда не бывал ни на одной планете и не мог привезти оттуда образцов для химического анализа. Однако, исследуя особыми остроумными способами свет солнца, луны и звёзд, химики узнали их состав. Оказалось, что далёкие небесные светила — близкие родственники нашей планеты. Они состоят из тех же химических элементов, что и наша Земля.
Сведений о характере и поведении химических элементов накопилось огромное количество. Эти сведения интересуют не только химиков, но и учёных других специальностей.
Взять для примера медиков. Что им, казалось бы, заниматься химическими элементами? Их дело лечить людей!
Однако лечить людей, не зная, как и из чего устроено человеческое тело, брались только колдуны и шаманы, но их время давно прошло.
Современная медицина изучает человека, {41} знает строение всех его органов, знает химический состав каждой клеточки. Это знание привело медиков к необходимости изучать, как влияют те или иные химические элементы на живой организм.
Агрономы, постоянно заботясь об урожае, тоже вынуждены заниматься этими невидимками. Ведь и растения состоят из элементов. Во время роста они берут их из пищи, которую находят в воздухе и в почве.
Но этой пищи растению не всегда хватает. Агрономам приходится подкармливать растение солями, содержащими необходимые химические элементы.
Геологи тоже интересуются химическими элементами. Они знают, где надо их искать: в минерале или морской воде, в теле водоросли или вулканической лаве.
Они знают, какой элемент более распространён в природе, а какой трудно отыскать.
И, наконец, каждый человек в своей повседневной жизни то и дело сталкивается с целым рядом химических элементов.
Глубоко проникает химия во все отрасли человеческой деятельности. И чем культурнее становились народы, тем большую потребность испытывали они в химических знаниях.
О характере и поведении элементов
Некоторые учёные для большей ясности называли химические элементы «кирпичиками мироздания».
Они говорили, что все вещества в природе сложены из химических элементов, как дома из кирпичей. {42}
Но это сравнение нельзя признать верным! Ведь кирпич остаётся самим собой в любой постройке, будь то одноэтажный домик или высотный дворец: ни цвет, ни форма, ни другие его качества не меняются. Иное дело химический элемент! Соединяясь с другими химическими элементами, он как бы утрачивает свои личные свойства.
Мне это стало понятно после того, как я узнала, что натрий и хлор вместе составляют поваренную соль, которую мы каждый день употребляем в пищу.
Натрий — блестящий серебристый металл, хлор — газ жёлто-зелёного цвета, удушливого запаха.
Куда же девается блеск натрия, цвет и запах хлора? Ведь соль совсем иная — белая, кристаллическая, солёная на вкус!
Все личные свойства химических элементов скрылись. Они могут проявиться только при каких-либо совсем особых обстоятельствах. Если, например, действовать на соль электрическим током или подвергать её очень сильному нагреванию, тогда элементы разлучатся и проявится характер каждого. Но обычное дружеское сожительство химических элементов в соли вырабатывает новые черты, характерные именно для соли, а не отдельно для натрия или хлора.
Сочетаясь во множестве различных комбинаций, химические элементы образовали цветные минералы и зелёные деревья, морскую воду и металлические руды, нашу пищу и наше собственное тело.
В настоящее время известно около ста химических элементов. У каждого из них свои {43} особые приметы, свой характер, свои вкусы, симпатии и поведение.
Конечно, слова «поведение», «характер» и «симпатии» элемента нельзя понимать буквально. Атомы химического элемента — неодушевлённые, невидимые частички материи — не могут быть добрыми или злыми, чуткими или грубыми, дружелюбными или враждующими. Эти выражения лишь помогают понять сущность взаимоотношений химических элементов.
Много лет после окончания института я работала в химических лабораториях. Приходилось исследовать и металлические сплавы, и руды, и песок, и состав почвы, и воду, и многое-многое другое.
И вот здесь-то в практической работе, при «личном» общении с химическими элементами, их характер и поведение стали мне знакомы, как характер и поведение самых близких друзей.
Случалось ли тебе, взглянув в лицо товарища, догадаться без слов, весел он или задумчив, здоров или болен, боится отвечать урок или твёрдо знает его?
Так длительное общение с химическими элементами в лаборатории приучает химика по каким-то едва уловимым признакам догадываться о многом таком, чего ни в одном учебнике не прочтёшь.
И так же как ты среди своих друзей отличаешь ребят замкнутых или, наоборот, очень общительных, так и химик говорит об одних элементах, что они «гордецы» и не желают вступать ни в какие «химические дружбы», а другие, наоборот, легко соединяются со многими химическими элементами. {44}
И больше того, у химика возможны даже свои «любимцы» — химические элементы, которые его больше интересуют, с которыми ему веселее работать.
Наверное, какой-нибудь равнодушный, сухой человек, прочитав эти строки, рассмеётся.
— Как можно «любить» химический элемент? — скажет он.
Правда, химия — наука строгая. Но тому, кто не побоится её трудностей, она откроет многое.
Отказываясь зачастую от отдыха, от развлечений, рискуя здоровьем, а иной раз и жизнью, химики во все времена самоотверженно трудились. Они стремились подчинить природу воле человека. А для этого надо было выведать все её тайны, узнать, как и из чего построены окружающие нас вещества.
О том, как были открыты некоторые химические элементы, изучены их превращения и странствия в природе, будет рассказано в следующих главах.
| {45} |
| {46} |

| {47} |
| {48} |
Гемфри Дэви
В 1778 году в маленьком английском городке Пензэнс родился человек, который сыграл немалую роль в истории химии. Звали его Гемфри Дэви.
Пока Гемфри учился в школе, ни учителя, ни родные не замечали в нём особых способностей к наукам. Он был обычным шаловливым мальчишкой. Больше всего Гемфри любил валяться на берегу моря, смотреть, как плывут по синему небу белые облака. И ещё одно занятие привлекало будущего учёного — ловля рыбы.
Лишь после смерти отца Гемфри понял, что так больше продолжаться не может! Отец его был резчиком по дереву. И при его жизни семья жила очень бедно, а после смерти нужда хозяйкой поселилась в их доме.
Гемфри пошёл работать учеником к местному аптекарю. Работа была не сложная, но скучная. Изволь-ка целые дни растирать мази да разливать микстуры по бутылям! Но, как это ни странно, именно аптекарское ремесло привело Гемфри к науке.
Ему нравилось смешивать жидкости и смотреть, что из этого получится. Он пристрастился {49}
 |
Гемфри Дэви. |
Но учиться никогда не поздно. Гемфри засаживается за книги, изучает анатомию, физику, химию, философию. На удивление всем, Гемфри оказывается очень способным человеком. Его лучшие друзья — книги раскрывают перед ним новый мир, а опыты, которые становятся всё сложнее и значительнее, помогают ему постичь многие тайны наук.
В короткий срок о Гемфри Дэви распространилась слава, как об одном из самых образованных людей своего города. Покинув Пензэнс, Гемфри поработал несколько лет в научном институте города Бристоля, потом Лондонский королевский институт принял его на должность помощника профессора химии. Это был очень высокий пост для двадцатидвухлетнего Гемфри. Он получил возможность развить свой талант учёного. К его услугам были лучшие лаборатории Англии. И он полностью отдался любимой науке — химии.
В конце восемнадцатого и начале девятнадцатого {50} века, когда жил Дэви, химия ещё не была такой обширной наукой, как в наши дни. Но учёные неутомимо стремились разгадать тайны строения всех веществ природы. Изучали состав горных пород, воды, почвы, питательных продуктов. Сжигали растения и исследовали оставшуюся золу, интересовались газами, из которых состоит воздух...
Химики понимали, что, только разобравшись, как и из чего построена природа, можно будет научиться управлять ею.
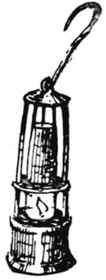 |
А кроме того, практическая жизнь требовала от учёных безотлагательной помощи. Гемфри Дэви испытал это на себе. К молодому профессору то и дело обращались люди различных производств. Кожевники просили указать им, какими веществами лучше дубить кожу. Земледельцы хотели проведать секреты земледелия и приносили на химический анализ землю, перегной, навоз. Шахтёрам нужна была безопасная лампа для работы в шахте...
И Дэви помогал и кожевникам, и земледельцам, и шахтёрам. Изобретённым им составом дубили кожу, его лекции по химии земледелия посещало много людей, а безопасная лампочка, изобретённая Дэви, до сих пор служит шахтёрам и носит его имя.
Но вся эта практическая деятельность не отвлекала Дэви от решения больших научных задач — от открытия химических элементов.
В начале восемнадцатого века их было известно пятнадцать. К концу века называли уже тридцать пять. А открытия всё продолжались. {51}
То и дело в журналах и газетах появлялись сообщения: открыт ещё один химический элемент!
Случались и ошибки в этом нелёгком деле. За химический элемент иной раз принимали сложное вещество. Например, известь долго считалась элементом, пока не выяснили, что она состоит из кальция и кислорода.
Гемфри Дэви главным занятием своей жизни считал поиски новых химических элементов.
И в этих поисках он оказался впереди многих своих современников.
Блестящие шарики
Гемфри Дэви пришёл в науку в то время, когда уже было сделано одно величайшее открытие. Учёные создали первый аппарат, дававший электрический ток.
Электричество... Для нас, людей двадцатого века, за этим словом кроются самые обыденные понятия: свет в квартирах, электрические приборы, трамвай, электропоезд.
А двести лет тому назад люди ещё не знали, какое огромное применение наддёт себе невидимая сила электричества. Но многие учёные .начали пользоваться ею для различных нужд науки.
Гемфри Дэви оказался одним из первых, кто понял, что электрический ток может помочь химику.
Дэви смотрел на кусок извести или глины, на порошок магнезии и думал:
«Что таят в себе эти знакомые незнакомцы? Как поведут они себя, если атаковать их электрическим током?» {52}
И вот атака началась. Первыми жертвами стали вещества, которые известны под названием «едкие щёлочи». Куски щёлочи похожи на сахар-рафинад. Хранят щёлочь в плотно закупоренных банках, берегут от влаги и воздуха. Стоит взять такой кусочек в руки, как сразу поймёшь — не случайно этим щелочам дано название «едкие»: кожа на руках воспалится, покраснеет, особенно, если на ней есть ссадины
или царапины. А если уронить щёлочь на платье — дыра неизбежна!
Решив исследовать едкие щёлочи, Дэви начал готовиться к этому делу, как полководец к большому сражению.
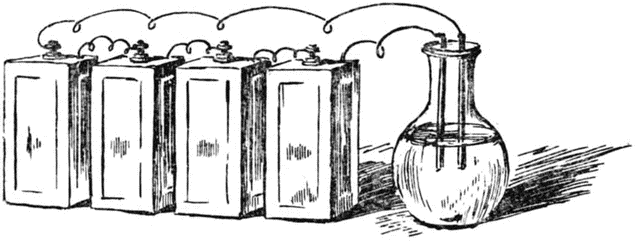
Он собрал несколько электрических батарей, проверил их действие и соединил все вместе. Получилась батарея огромной мощности. Всю её силу Дэви решил обрушить на едкую щёлочь, чтобы узнать, из каких веществ она состоит.
В раствор щёлочи в воде Дэви опустил две проволочки, идущие от батареи и заменявшие электрический провод.
И вот ток побежал по проволокам, достиг жидкости в колбе. Она забурлила, зашевелилась. Один за другим в ней начали возникать пузырьки газа. Но вид их не радовал Дэви. Он {53} понимал, что это кислород и водород, из которых состоит вода.
«А щёлочь? Где же её составные части? Может быть, она не поддаётся разложению?
Может быть, надо действовать электричеством на сухую щёлочь?» — думал учёный.
Но в сухом виде она не пропускает сквозь себя электрический ток!
Дело казалось безнадёжным. Бывали минуты, когда у Дэви появлялось желание всё бросить, но он гнал от себя сомнения и работал ещё настойчивее.
Сотни опытов проделал он, пока набрёл на правильный способ.
Когда после многих бессонных ночей, после огорчений и тревог счастливая мысль пришла ему в голову, он даже вскрикнул от радости:
— Да! Именно так! Именно так надо поступить! Щёлочь для этого опыта должна быть не очень сухой и не очень влажной...
Дэви взял небольшой сухой кусочек щёлочи, подержал его на открытом воздухе несколько секунд — пусть чуть-чуть увлажнится — и быстро соединил его с электрической батареей.
Долгое терпение и настойчивость учёного были вознаграждены великолепным зрелищем.
На этот раз картина была совсем иной, нежели в прежних опытах!
Щёлочь начала плавиться, а из неё, как пленники из заточения, выпрыгивали блестящие металлические шарики,
В первую минуту они показались Дэви похожими на капли ртути, но он тут же отказался от этого сравнения. Его шарики жили всего несколько минут. Они взрывались, вспыхивая
| {54} |
 |
Сотни опытов проделал Дэви. |
ярким пламенем, а те, которые не сгорали, быстро теряли свой металлический блеск, покрывались белым налётом.
Молодого учёного не тревожила судьба металлических шариков, он считал, что вопрос о сохранении шариков — второй вопрос. А сейчас можно порадоваться великому открытию, совершённому им.
Он, Гемфри Дэви, открыл в щёлочи новый металл. Ни один учёный мира и не подозревает о существовании такого!
Гордостью переполнилось сердце Гемфри. Он вспомнил покойного отца. Как жаль, что ему не удалось дожить до этого часа, когда его сын становится великим учёным!
Однако предаваться раздумьям и печали было не время. С новым металлом предстояло ещё немало хлопот.
Во-первых, надо было разложить не одну порцию щёлочи, чтоб извлечь из неё неведомый металл, во-вторых, необходимо было сохранить металл, чтобы изучить его свойства.
И хотя победа была совершенно очевидной, капризный металл лишил Дэви покоя. Сохранить {55} его не было никакой возможности: он упрямо не хотел жить ни в воздухе, ни в воде, ни в спирте, ни в кислоте, и ни в какой другой «квартире», которую предлагал ему учёный.
Металлы-близнецы
Я думаю, читатель давно догадался, что Дэви освободил из щёлочи нашего старого знакомого — натрий.
«А если это не натрий,— думает, вероятно, читатель,— то это какой-нибудь другой металл, похожий на натрий, как могут быть похожи только родные братья...»
Так оно и есть. В своих опытах Дэви брал две щёлочи. Одна называется едкий натр, из неё Дэви получал натрий. А из другой, по названию едкое кали,— металл калий.
И они имеют большое сходство. Оба серебристого цвета, оба лёгкие, не тонут в воде, а плавают на ней; оба настолько мягкие, что их можно резать ножом, как сыр; оба плавятся при очень невысокой температуре.
Поставим на горячую электрическую плиту три сосуда. Пускай в одном будет кусочек металлического натрия, в другом — калий, а в третьем — железо. Калий начнёт плавиться, когда градусник покажет 62,3 градуса, натрий немного позднее, при температуре 93 градуса. А железо? Оно даже не успеет покраснеть. Чтобы расплавиться, ему нужна температура в полторы тысячи градусов!
Свойство калия и натрия расплавляться при невысокой температуре отличает их от большинства знакомых нам металлов. Даже легкоплавкому олову нужна температура в 232 градуса, не говоря уже о золоте и меди. {56} Те начинают плавиться лишь после того, как измерительные приборы покажут выше тысячи градусов.
И все же калий и натрий — металлы. Кроме свойственного обоим металлического блеска, они обладают ковкостью. Но увы! Изделиями из этих металлов можно было бы пользоваться только в безвоздушном пространстве! Самое незначительное присутствие воздуха, воды заставляет их немедленно изменяться, превращаться в сложные вещества, присоединяя к себе атомы других химических элементов.
А в металлическом натрии, как и в металлическом калии, никаким самым точным химическим анализом невозможно обнаружить атомов какого-либо другого сорта.
Калий и натрий — химические элементы. Одни из тех, сочетание которых с другими элементами создаёт окружающую нас природу. Они, как братья, во всем похожи друг на друга, и в природе их можно всегда найти рядом — в одних и тех же горных породах.
В каменном жилище
Возьми кусок простого серого гранита, вглядись в его пёстрый рисунок. Нетрудно заметить, что гранит неоднороден. Он состоит из трёх минералов. Среди тёмных пластинок слюды и полупрозрачных кристалликов кварца поблескивают белые, желтоватые, серые или розовые точки. Это — полевой шпат.
Сочетание трёх минералов — полевого шпата, слюды и кварца — придаёт граниту не только красоту. Само слово «гранит» связывается в нашем представлении с чем-либо особенно крепким, устойчивым. {57}
Пойдём за город, к обрывистому берегу реки, туда, где выступают обнажённые гранитные скалы. Здесь мы увидим картину разрушения твёрдого гранита.

Народная пословица гласит: «вода камень точит». К этому надо прибавить, что солнце и воздух старательно помогают воде.
На Урале, да и в других местах Советского Союза, встречаются причудливые формы камней. Эти камни жгло летним зноем, охлаждало морозом, размывало быстрой водой горных речек, обдувало резкими ветрами. И силы природы нарушили целость гранита. Потускнели листочки слюды, выпали кристаллики кварца, измельчились, превратились в песок. {58}
Но больше всего нас интересует судьба серых, жёлтых и розовых полевых шпатов. В них, в этих цветных минералах, дремлют два брата — калий и натрий.
От действия воды, солнца и ветра полевой шпат рассыпается в порошок. И тут у калия и натрия начинается новая жизнь. Выброшенные природными силами из каменного жилища, они отправляются путешествовать каждый своей дорогой.
Начало путешествия
За кем же из них отправимся мы? Натрий более знаком нам. Пойдём за ним. Вот бежит горный ручеёк. Он торопливо несётся с горы, увлекая за собой мелкие песчинки, глинистый ил. Исследуем его воду и мы найдём здесь много натрия.
Но, конечно, не надо думать, что в воде ручейка плавают кусочки серебристого металла натрия! Ведь мы уже знаем, что в природе — на открытом воздухе или в воде — натрий не может оставаться неизменённым.
В природе он как бы постоянно скрывается под шапкой-невидимкой.
В воде ручья мы найдём натрий в виде различных солей. Одна из них тебе хорошо знакома. Она постоянно перед тобой на обеденном столе, называют её поваренной. Но в ручье есть ещё множество других солей! Может быть, тебе знакомы их названия: углекислые, сернокислые, фосфорнокислые?
Тот же, кто впервые слышит, что вода в ручье содержит соли, может удивиться, почему она не кажется солёной, когда её пьёшь? И {59} колодезная вода тоже не имеет солёного вкуса. Наоборот, пить её очень приятно. Причём в каждом ручье или колодце вода имеет свой особый вкус, цвет и запах.
Вот это-то как раз и зависит от солей, которые в них находятся. Самая безвкусная вода — дождевая. В ней нет никаких солей.
 |
Разумеется, соли в ручейке не лежат, как в солонке, они растворены в воде и вместе с ней мчатся всё дальше и дальше, вливаясь в большую реку. И на всём пути воды мы найдём в ней mhofo солей, содержащих натрий.
Но вот большая река добралась до моря. Всё, что несла она с собой: песчинки, ил, растворённые соли,— вливается в море.
Каждый знает, что морская вода, в отличие от речной, солёная. Этот вкус придаёт ей поваренная соль. В морской воде её очень много.
В каждом литре черноморской воды её пятнадцать граммов. В океанской воде больше — тридцать граммов на литр. А общее количество соли в морях и океанах выражается цифрой, которую и представить себе трудно. Это десятки тысяч биллионов тонн.
Чтобы нагляднее представить, как много соли в морях и океанах, замечательный советский геохимик Александр Евгеньевич Ферсман подсчитал, что солью этой можно было бы покрыть всю территорию Европейской части СССР слоем в пять километров.
Невольно возникает вопрос, как могло в море накопиться столько соли? {60}
Учёные полагают, что вода в море стала солёной ещё в те далёкие времена, когда моря и океаны только создавались на нашей молодой планете.
Самые различные химические элементы свободно носились в атмосфере Земли. Водяные пары сгущались и выпадали на Землю горячими ливнями. В своём движении дождевая вода захватывала из атмосферы много различных газов, в том числе хлор.
В горячих потоках дождя происходили всевозможные «химические встречи». И уже тогда могли образоваться соли. Вместе с водой они наполняли первые земные водоёмы, первые моря и океаны. С течением миллионов лет моря становились всё солонее и солонее, потому что реки приносили сюда соли, вымытые из горных пород. И среди всех этих солей самое значительное место занимает соль, состоящая из натрия и хлора, которую мы называем поваренной.
Рассказы каменной книги
Поваренная соль — один из продуктов, имеющихся в природе в готовом состоянии. И запасы её огромны. Море — главный источник соли, но немало её и в солёных озёрах. Одно только озеро Баскунчак, расположенное в Астраханской области, содержит почти миллиард тонн чистейшей соли.
Издали кажется, что озеро покрыто снегом. Это — соль. Она лежит здесь, как в большой чаше. Сверх неё местами проступает густой рассол. Но он не мешает проехать по озеру на лошади. Берега озера изрезаны оврагами, а по {61} ним текут соляные ручьи, питающие озеро. Они-то и приносят соль, вымытую из глубины земли.
А разве в глубине земли имеется соль? Да. И таких мест на земном шаре известно немало. Например, неподалёку от города Кракова расположены старинные соляные копи. На восемьсот километров в длину тянутся под землёй скопления белой чистой соли. Её добывают здесь издавна. В её толще пробиты коридоры, ведущие в подземные залы, столовые и даже в устроенные под землёй церкви.
Известны также соляные горы в Испании.
Много соли в землях нашей страны. Прославились Илецкие копи под Чкаловом, Брян-цевские на Украине; от верховьев Камы до уральских предгорий захоронены большие залежи соли. А в Средней Азии есть гора Ходжа-Мумыя. Она имеет вид огромного купола и возвышается в районе дороги от Сталинабада на Кочуляб. Ходжа-Мумыя покрыта мелким кустарником. Но в её обрывах видны стены сплошной каменной соли. А по склонам текут соляные источники. В одной этой горе десятки миллионов тонн соли.
Откуда же в земле оказалась соль? Об этом известно людям, которые изучили далёкое прошлое Земли.
Они знают, что не всегда наша планета была такой, какую мы видим сейчас. В прошлые далёкие времена на ней жили животные и растения, не похожие на современных. Кости и отпечатки этих живых существ кое-где сохранились. Случается, что горняки, землекопы или строители, роясь в земле, расположенной далеко от моря, находят остатки морских животных. {62}
 |
Все это позволяет учёным сделать интересные выводы.
Оказывается, миллионы лет назад на том месте, где теперь расположены большие города, где растут хлеба и цветут сады, плескались солёные моря.
Куда же они девались?
Об этом тоже рассказывают каменные страницы Земли. Разбирая в ней строку за строкой, учёные узнали, что на Земле менялся и климат. Об этом свидетельствуют следы тропических растений под вечными льдами Севера.
Видимо, в периоды жаркого климата вода из древних морей сильно испарялась. Моря мелели, превращаясь во множество мелководных бассейнов, которые тоже постепенно мелели, а соль, растворённая в воде, оставалась на дне бассейнов.
За долгую историю существования Земли море и суша не раз менялись местами. Возвращаясь в свои прежние бассейны, морская вода вновь испарялась и оставляла новые слои соли. Позднее их прикрыли глина, песок и различные
 |
Велики запасы каменной соли, оставленной древними морями. Несметны количества соли в современных морях, океанах и солёных озёрах.
И всё же есть места на земном шаре, где люди едят несолёную пищу, считают соль дорогим лакомством.
Ломоносов писал, что в его время за четы-ре-пять плиток соли в Абиссинии можно было купить раба. Путешественники по Центральной Африке рассказывают, что многие племена отдавали за чашку соли чашку золота. Лишены соли обитатели островов Тихого океана. Они обмакивают пищу в морскую воду, которую держат в специальных сосудах.
Соль — вещество, не изменяющееся даже в огне. Она не поддаётся порче, а, наоборот, предохраняет от порчи другие пищевые вещества. Наверное, поэтому у всех народов она издревле считается символом постоянства.
В нашей стране сохранился старинный обычай в особо торжественных случаях встречать гостей «хлебом-солью».
А на тихоокеанских островах малокультурные, угнетённые жители, которые верят в существование «злых духов», считают, что отогнать их можно фразой: «Я ем соль!»
Сколько соли надо человеку
А думал ли ты когда-нибудь о том, сколько соли за свою жизнь съедает человек?
Есть такая поговорка: «Чтобы хорошо узнать человека, надо съесть с ним вместе пуд {64} соли». За сколько же времени вдвоём можно съесть пуд соли? На первый взгляд пуд (шестнадцать килограммов) кажется большой величиной. А между тем двум человекам пуда соли хватает всего лишь на год с небольшим. Для нормального питания человеку требуется не менее семи килограммов в год.
Наши предки издавна употребляли соль в пищу.
Трудно сказать достоверно, где и как впервые познакомились люди с солью. Возможно, что помог случай. Может быть, инстинктивно ощущая в ней потребность, первые люди лакомились попадавшимися кусочками каменной соли, а позднее начали сознательно искать и добывать её.
Чем культурнее становились народы, тем больше добывалось и расходовалось соли. В питании поваренную соль ничем невозможно заменить. И хотя природа богата самыми различными солями, но ни одна из них не может употребляться в пищу вместо поваренной. А в наше время её добывают не только для питания. Несмотря на такое «кухонное» название, поваренная соль используется в различных производствах. Их можно насчитать до полутора тысяч.
Соль нужна и в мыловаренном деле, и в производстве красок, и в текстильной промышленности, и в изготовлении кожаных вещей, в металлургии, в производстве пластмассы...
Добыча соли — один из старинных промыслов. В нашей стране, богатой морями и солёными озёрами, семьсот лет тому назад жители берегов Белого моря уже получали много соли, {65} выпаривая морскую воду. Соль увозили в Москву и Новгород, употребляли для засолки рыбы, сала, тюленьих шкур.
Пользовались поморы и способом вымораживания соли. Во время очень сильных холодов ледяная гладь замёрзшего моря покрывается нежными, полупрозрачными ледяными цветами. Странное и незабываемое впечатление производят эти цветы! Они ломаются под ногами, звенят стеклянным збоном и превращаются в солёную пыль.
Ледяные цветы — это кристаллы соли, выделившиеся из морской воды.
Если на Севере холод является союзником человека в добыче соли, вымораживая её, то на юге людям помогает солнце. На южных побережьях для добычи соли не расходуют топливо. Вода выпаривается в мелких бассейнах, устроенных на берегу. Сюда весной напускают морскую воду. За лето под горячими лучами солнца она испаряется, а на дне бассейнов, остаётся чистая белая соль.
Таков путь натрия от гранита, где он находился как составная часть полевого шпата, до поваренной соли, добываемой людьми для различных своих нужд.
Путь калия
Мы увлеклись путешествиями натрия и совсем забыли, что рядом с ним жил его брат — калий. Что же произошло с калием после разрушения полевого шпата?
Учёные установили, что пока оба элемента спокойно лежали в твёрдой горной породе, количества их были почти одинаковы. Натрия {66} немного больше двух с половиной процентов, калия немного меньше.
Но вот полевой шпат разрушился. Горные ручейки понесли к рекам мелкие песчинки, ил и растворённые соли, где, как мы уже знаем, много натрия. А калий? Имеется ли он в реках? Да, но его в три раза меньше, чем натрия.
Куда же девался калий? Может быть, он какими-либо другими путями добрался до моря? Исследуем морскую воду.
В море калий имеется. Он так же, как и натрий, соединяясь с хлором, образует соль, которая называется хлористым калием. Но хлористого калия в морской воде в тридцать раз меньше, чем хлористого натра.
Куда же исчез калий? Кто похитил его?
Тайну эту разгадал один русский учёный-почвовед. Звали его Константин Каэтонович Гедройц.
Константин Каэтонович Гедройц был одним из тех учёных, которые стремятся использовать науку для нужд практической жизни. Он изучал составы различных почв.
«В чём тайна плодородия?—думал он.— Какие химические элементы должны находиться в почве, чтобы растение хорошо росло и давало хороший урожай?»
В поисках ответов на этот вопрос Константин Каэтонович выяснил, что похитителем калия является не что иное, как почва.
Из вод, протекающих по ней, она забирает большое количество калия.
Почему же это происходит? На этот вопрос теперь ответят не только почвовед и агроном. Любой школьник знает, что без калия почва теряет своё плодородие. {67}
Вместе с другими питательными веществами соли калия проникают через корень в растение и поднимаются к верхушке стебля, в молодые листья, в почки.
Молодое растение особенно нуждается в калии. Его можно было бы назвать элементом юности растения, так необходим он для его роста и развития.
Но калий нужен любому живому существу. И, конечно, человеку тоже. В нашем организме калий и натрий — братья, которые когда-то расстались,— встречаются вновь. Они оба участвуют в работе нашего тела. Калий находится, главным образом, в самих тканях: в селезёнке, б печени, в почках, в сердце. А натрий — в крови, в желудочном соке.
И ещё одно различие есть между ними. Оба они нужны для работы сердца, но роль их прямо противоположна. Калий возбуждает сердечную, деятельность, а натрий успокаивает.
Так, попав в живой организм, элементы, похожие между собой, как родные братья, ведут себя неодинаково.
Мне хотелось бы, дорогой читатель, чтобы, дочитав до этой страницы, ты задумался над тем, как связаны между собой различные явления природы.
Вспомни: вода, воздух, солнце разрушают гранитную породу, размывают содержащийся в граните минерал — полевой шпат. Какое, казалось бы, отношение имеет это к работе человеческого сердца? Оказывается, имеет!
Путешествия калия и натрия, входивших в состав полевого шпата, могут длиться веками или даже миллионами лет.
Но вот на их пути встал человек. Он стал {68} добывать каменную соль из глубины земли, выпаривать морскую воду, чтоб извлечь из неё соль. И те самые атомы натрия, которые находились в полевом шпате, а потом передвигались в шапке-невидимке по ручьям и рекам, вошли в состав человеческой крови.
Может быть, ещё много веков блуждали бы эти атомы по морям или лежали бы в соляном пласте древнего озера, если бы их не добыл и не использовал человек.
Ещё более сложен путь калия. Он не идёт прямо к морю, а рассевается в почве, благодаря чему она способна родить растения. Человек получает калий, съедая хлеб, картофель или плоды. Учёные вычислили, что ежегодно из почвы вместе с урожаем уносятся десятки миллионов тонн калия. Почва, теряя калий, становится менее плодородной.
И тут-то человек активно вмешивается в судьбу калия. Он не может допустить, чтобы плодородие земли снижалось. Наоборот, он должен сделать её плодороднее, чтобы получать богатые урожаи. Для этого нужен калий.
Где же добыть драгоценный химический элемент?
Этот вопрос до сих пор волнует многие страны. И учёные немало труда кладут на изучение земных недр в надежде найти в ней залежи калиевых солей.
Рядом с каменной солью иногда находили хлористый калий, тоже в виде окаменевших слоев, но количества его были незначительны. Лишь кое-где были обнаружены большие скопления ценной калиевой соли. Долгие годы Германия считалась страной наиболее счастливой в этом отношении. {69}
Лишь сравнительно недавно — лет тридцать тому назад — стало известно, что богата калием и русская земля.
История его открытия связана с именем старинного русского города Соликамска.
В царстве цветных солей
Само название — Соликамск — говорит о том, что город этот расположен на Каме и славится добычей соли.
Великолепны камские берега. Спокойная река величаво плывёт между ними, отражая в себе высокие густые леса, крутые скалы и светлое северное небо.
Недалеко от пристани расположен старый Соликамск. С горки на горку бегут его неширокие улички с крепкими старинными домами, и церквами, которые здесь охраняются как

| {70} |
художественные памятники древнего русского зодчества.
В нескольких километрах от старого города выросли новые посёлки, заводы, шахты. Здесь-то и сосредоточена главная деловая жизнь Соликамска.
Отсюда можно спуститься в подземное соляное царство. Для этого надо пройти на рудник, войти в кабину подземного лифта. Кабину эту горняки называют клетью. Захлопнется дверь, зазвенит звонок, и клеть стремительно понесётся вниз. Не пройдёт и двух минут, как клеть остановится. Пора выходить! Мы спустились под землю на глубину двухсот пятидесяти метров.
И вот мы на улицах подземного города. Стены тоннеля, вдоль которого мы идём, блестят в свете электрических ламп. Так и тянет потрогать рукой прихотливые пёстрые узоры на стенах. Они словно вытканы сказочным мастером. Синие звёзды, оранжевые полосы, сургучно-красные змейки, бархатисто-лиловые и молочно-белые пятна переплетаются в неповторимых сочетаниях.
Центральная подземная улица широка и просторна. По ней проложены рельсы, которые на десятки километров уходят в боковые улички, такие же светлые и нарядные. Улички ведут в громадные залы с высокими сводчатыми потолками и блистающими стенами. Зайдя в такой зал, невольно испытываешь чувство робости. Вспоминаются сказки о подземных окаменевших великанах — хозяевах земных недр...
И вскоре я действительно увидела его хозяев. Но они совсем не были похожи на воображаемых мною великанов! Напротив, это были {71} весёлые молодые пареньки в шахтёрских шапках и брезентовых куртках. Одни из них бурили отверстия в блестящих стенах, другие управляли электровозами, которые то и дело появлялись и уезжали дальше по бесконечным стальным рельсам. Третьи работали у вагонеток, куда
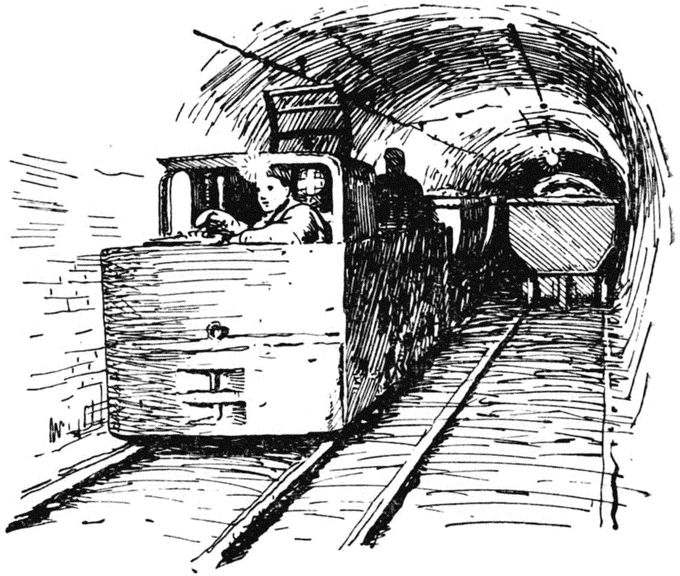
ссыпались глыбы вывороченных цветных камней.
Пареньки шутили между собой, дружелюбно улыбались на моё приветствие. А когда я, смеясь, поделилась своими фантастическими размышлениями, один из них сказал:
— А ведь здесь даже балы устраивали. Только не какие-то там великаны, а сами шахтёры... Было это в тридцатых годах, я тогда ещё в школе учился. Вот в таком же зале, {72} как этот, настелили пол деревянный... здесь танцевали, а в другом буфет устроили. Музыка во всю гремит! Огня — море! И всё это под землёй. Праздновали Октябрь.
На реке Усолке
В далёком прошлом на месте города Соликамска, как во многих местах нашей Родины, было огромное солёное море. Высыхая и отступая, оно оставляло слои каменной соли.
Подземные ручейки размывали каменные соляные пласты и текли под землёй в виде соляных рек. Кое-где воды подземных рек выбивались на поверхность, образуя соляные родники. К этим родникам приходили лоси полакомиться солью. О соляных источниках узнали местные жители—манси, охотники и рыболовы.
И постепенно слава о них докатилась до Новгорода. А там нашлись предприимчивые люди — братья Калинниковы. Они приехали из Новгорода в незнакомый край в пятнадцатом веке. В Соликамске сохранилась память об этих первых солеварах.
Расположившись на безлюдном берегу речки Боровицы — одного из притоков Камы, — братья Калинниковы начали выкачивать соляной раствор из земли, выпаривали его и полученную соль сплавляли в Новгород.
Недолго поработали они на Боровице. Обследуя берега других камских притоков, братья Калинниковы нашли речку Усолку и вскоре перебрались туда. Рассолы на берегу Усолки показались им более богатыми солью. Здесь Калинниковы пробурили в земле скважины и построили деревянные трубы, по которым соляной раствор поступал из-под земли.
| {73} |

Трубы эти и чаны для выпаривания рассола установили в высоких деревянных постройках, похожих на сторожевые башни средневековых крепостей. Эти постройки назывались варницами.
Так на берегу Усолки возникли первые строения села Соль Камская.
А в шестнадцатом веке на Каму пришли знаменитые купцы Строгановы. Московский царь Иван Грозный подарил им пустынные камские берега от устья Лысьвы до устья реки Чусовой. И Строгановы принялись хозяйничать на камских берегах, сеять хлеб, разводить скот, заниматься рыбной ловлей. Но больше всего богатели Строгановы от добычи соли.
Они построили несколько новых варниц, в дополнение к старым, сохранившимся ещё от братьев Калинниковых. Соль отправляли в Москву и в Казань, в Нижний Новгород, в Калугу, {74}
 |
Герб Соликамска |
Год от году увеличивались добыча соли и количество варниц. Село Соль Камская выросло в город Соликамск.
Вначале город строился из дерева, его часто постигали пожары, разоряли и набеги местных жителей, которых притесняли и угнетали богатевшие солепромышленники. Но ничто не мешало развитию солеварения.
У Соликамска появился даже свой герб, на котором была изображена соляная варница, указывающая на то, что главное занятие жителей этого города — солеварение.
Вслед за Строгановыми в Соликамск потянулись и другие купцы, соблазнённые слухами о сказочных прибылях от добычи соли.
В течение нескольких веков одно поколение купцов-солепромышленников сменялось другим, а подземные соляные рассолы оставались неистощимыми. Они так же, как двести и триста лет тому назад, текли по деревянным трубам из скважин к варницам.
Соликамск отстраивался красивыми каменными домами, храмами художественной архитектуры, в садах богатых купцов вырастали невиданные в том краю фруктовые деревья, а в духоте солеварен гибли сотни людей. Это были крепостные крестьяне, беглые арестанты и просто закрепощённые жители окрестных селений.
Они ютились в тесных лачугах на окраинах Соликамска и от зари до зари работали, добывая своим хозяевам сокровища древних морей.
| {75} |
Красный кристаллик
Больше всего солеваров интересовала белая кристаллическая соль, которую они получали, выпаривая рассолы.
Всё остальное, что, как им казалось, «засоряет» соль, выбрасывалось вон. Случалось, что из какой-нибудь скважины шла только «грязная» соль, имеющая красный цвет и горький вкус. Такую скважину приходилось оставлять и рыть новую.
Старожилы Соликамска рассказывают, что в начале этого века красная соль особенно часто поступала по деревянным трубам в варницы. И всякий раз это вызывало огорчение хозяев-солепромышленников.
Красный цвет соли был сигналом из Соликамских недр. Красный кристалл как бы рассказывал о том, что миллионы лет назад, когда здесь было море, одновременно с каменной солью образовались соли калия. У них другой цвет. Но не надо бояться этого цвета! Красные соли принесут пользу полям, сделают плодородной почву...
Но солепромышленники не обратили внимания на этот сигнал.
Калиевые удобрения покупали в Германии по очень дорогой цене.
Во время войны с Германией в 1914 году русские хлебопашцы особенно остро почувствовали необходимость в калиевых удобрениях. Ввоз из Германии прекратился. Надо было срочно принимать какие-то меры.
Правительство царской России не отпускало денег на разведку недр своей земли. И всё же разведка велась. Целая группа учёных-патриотов {76} делала это за свой счёт. Среди них видное место занимал Николай Семёнович Курнаков.
Найти свой отечественный калий... Помочь русскому крестьянству в его труде... обеспечить его ценным удобрением...
Это было мечтой учёного.
Не раз приходилось ему бывать в Соликамске. Мысль о том, что здесь, по соседству с каменной солью, должна находиться соль калия, давно приходила Николаю Семёновичу в голову.
Приехав в Соликамск, Николай Семёнович обошёл заброшенные скважины. Старики-солевары удивлялись тому, что учёный больше всего расспрашивал их о всяких случаях неудач в работе.
Белая чистая соль не привлекала его внимания, а в «бросовой» он охотно рылся и однажды, извлёк из неё блестящий красный кристаллик.
Николай Семёнович долго любовался его яркой окраской. Этот вестник глубин многое говорил учёному... В Германии на калиевых рудниках видел он точно такие же кристаллы. Это были карналиты и сильвиниты — минералы, содержащие калий.
Николай Семёнович увёз кристаллик с собой в Петербург. Вскоре он опубликовал результаты исследования. «В Соликамске имеются соли калия. Надо выяснить, каковы их запасы. Необходима срочная разведка...» — писал Николай Семёнович.
Но к его голосу никто не прислушался. Только после Октябрьской революции началось изучение Соликамских земных богатств. Результаты показали, что почвы всего земного шара {77} можно «накормить» досыта Соликамским калием!
Это была замечательная победа над природой. И не только над природой, но и над некоторыми учёными, сомневающимися в успехе начатого дела. Эти учёные говорили, что в древних морях, так же как и в воде современных морей, солей калия мало. Откуда же могли бы они накопиться?
Там же, где скопления образовались, например, в Германии, были, очевидно, какие-то особые условия. Поэтому нет смысла искать их на территории России. Не стоит тратить средств. Выгоднее покупать калий в Германии.
Жизнь разбила сомнения учёных-маловеров. Древнее море оставило под Соликамском несметные богатства.
...На моём столе лежит пёстрый камень редкой красоты. Молочно-белые крупные кристаллы перемежаются в нём с кристаллами водянисто-голубыми, нежно-оранжевыми, красными. Четкие грани кристаллов блестят, как полированные, а когда на них падает свет, они искрятся, словно драгоценные рубины и горные хрустали.
Этот камень я получила в подарок от одного старого Соликамского шахтёра. Я храню его, как память о скромных тружениках шахт, которые подчинили себе подземные богатства древних морей.
Камень называется сильвинитом. Я смотрю на него и вспоминаю всё, что пришлось услышать и увидеть на родине советского калия.
— Почему кристаллы разного цвета? — спросила я в шахте.
И мне объяснили, что красный и оранжевый {78} цвет зависят от примеси железа. Белый же цвет объясняют тем, что в этих кристаллах много пу-стоток, наполненных газами. Стоит поцарапать кристалл ногтем, как тотчас почувствуется запах этих газов.
Откуда же газы взялись в кристаллах? Среди многих других невыясненных вопросов науки стоит и этот.
Может быть, они попали в то далёкое время, когда хлористый калий осаждался на дно древнего моря. В море было много остатков различных живых существ. Разлагаясь, эти остатки выделяли газы, а хлористый калий захватывал их в своём движении и «заключал» в образовавшиеся кристаллы.
Сильвиниты, добываемые в Соликамске, бывают самой разной окраски. И пёстрые, как камень, лежащий на моём столе, и полосатые, и оранжевые.
Всё это многоцветное богатство поступает на фабрику, где отделяют хлористый калий от примесей и родственной ему соли — хлористого натра. Цветные камни дробят, просеивают, растворяют.

| {79} |
Длинный путь химической очистки заканчивается в сушильном отделении. Здесь в больших баках можно увидеть белый, как снег, порошок. Это и есть чистый хлористый калий, который так нужен для повышения плодородия. Его погрузят в вагоны и отправят в колхозы и совхозы Советского Союза. Рассыпанный по полям, он повысит плодородие почвы. На ней вырастут хлеба, овощи, ягодные кусты и плодовые деревья. И в каждом зёрнышке пшеницы, в каждой ягоде и картофелине поселятся атомы калия.
Придёт человек, снимет урожай, и вместе с пищей атомы калия войдут в его тело. А здесь, как мы уже говорили, у калия начнётся новый жизненный путь.
Рассказ о главных путешествиях и превращениях калия и натрия закончен.
Мы видели, что во многом они очень схожи, хорошо уживаются с хлором, образуя соли, имеющие такое большое значение в жизни человека. И теперь нам предстоит познакомиться с хлором, имя которого часто называлось в этом рассказе.

| {80} |

| {81} |
| {82} |
В погоне за таинственным мурием
Интересно, что биография хлора, как и биография натрия и калия, с которыми он дружно уживается в солях, связана с именем Гемфри Дэви.
Но не будем забегать вперёд. Родословную хлора надо искать в работах учёных, живших четыреста-пятьсот лет назад.
В одной из книг того времени рассказывается, как учёный Базилий Валентинус, прокаливая поваренную соль с медным купоросом и квасцами, получил новое, никому до него неизвестное, вещество.
Это вещество имело вид тяжёлого белого дыма. Оно наполняло комнату едким удушливым запахом. От него першило в горле, слезились глаза.
Исследователь собрал белый дым в стеклянный сосуд. Покашливая и вытирая слёзы, он охладил сосуд с дымом и добавил в него воды. Получилась бесцветная жидкость, на вид совсем неопасная.
«Что у меня за варево получилось?» — подумал учёный. Он помешал стеклянной палочкой свой раствор и затем сполоснул палочку в {83} стакане с водой. Воду же эту решил попробовать. И... болезненно поморщился. Его язык и нёбо точно пламенем обожгло...
«Что же это за вещество? Надо его испытать...»
Учёный отлил немного жидкости в стакан и бросил в него кусочек мела. Мел с шипением растворился, выделяя много пузырьков газа.
В другой стакан с жидкостью учёный бросил железную стружку. Она, как и мел, начала растворяться, тоже выделяя много газа.
Когда Базилий Валентинус рассказал о своём открытии друзьям-учёным, они посоветовали ему назвать новое вещество «кислым спиртом». Спирт тогда хорошо знали. А слово «кислый» прибавили потому, что он имел кислый вкус.
Потом это название заменили другим. Учёные говорили:
— Этот спирт изготовлен из соли, значит, надо назвать его «соляной» спирт.
Так под названием соляной спирт дожило это вещество до восемнадцатого века. Лишь тогда учёные поняли, что это не спирт, а кислота. Теперь мы называем её соляной, а в восемнадцатом веке ей дали красивое имя — «муриевая» кислота. Предполагалось, что в ней имеется какой-то ещё неизвестный элемент, который заранее назвали «мурием».
И вот началась погоня за мурием. Учёные исследовали муриевую кислоту в надежде обнаружить в ней таинственный элемент, но он не давался в руки.
Учёные задыхались в удушливых парах, обжигали себе руки и одежду, но не отступали. {84}
Одному из охотников за мурием удалось в 1774 году наблюдать странную картину. Во время работы он увидел, что из сосуда, где находилась соляная кислота, пошёл газ жёлто-зелёного цвета. Газ этот был собран и подвергнут исследованию. Свойства его не были похожи на свойства других газов, а скорее напоминали кислоту.
Учёные без конца сравнивали новый газ то с другими газами, то с кислотами. И пришли к убеждению, что газ этот — кислота ещё более сильная, чём муриевая, и дали ей название «окси муриевая».
Но прежде чем продолжать рассказ о жёлто-зелёном газе, познакомимся с кислотами — теми веществами, к числу которых причислили таинственного незнакомца.
Старые знакомые
О кислотах учёные знали давно. Их умели получать ещё в глубокой древности. Из лимонов— лимонную, из винограда — винную. Были знакомы и с их опасными свойствами.
Более двух тысяч лет тому назад знаменитый карфагенский полководец Ганнибал при переходе через Альпы применял уксусную кислоту для взрыва скал.
Для химиков кислоты всегда были первейшими помощниками. Вещества, отказывающиеся растворяться в воде, не могут устоять против действия кислоты.
Кроме кислот растительного происхождения, химики научились получать кислоты из минералов. Например, серную, азотную и, наконец, ту, которую назвали муриевой, а мы теперь зовём соляной. {85}
Минеральные кислоты оказались ещё большими врагами металлов. Они разъедают железо, алюминий, ртуть и другие металлы. Металлическая стружка, брошенная в кислоту, растворяется с шипением и выделением пузырьков газа. Вскоре металл исчезает, а жидкость перестаёт быть кислой и превращается в раствор соли — цинковой, алюминиевой, железной, в зависимости от того, какой растворили металл.
И ещё одну особенность знали за кислотами. Они изменяли цвет многих веществ. Например, лиловый сок фиалки от кислоты становился зелёным, а синяя вытяжка из цветков василька краснела.
В современных лабораториях не пользуются ни лиловым соком фиалки, ни вытяжками из васильков. Современные химики приготовили другие очень чувствительные вещества, которые изменяют свою окраску и от кислоты и от щёлочи.
Тот, кто хоть раз в жизни побывал в химической лаборатории, конечно, запомнил коротенькие ленты лакмусовой бумаги. Сам по себе лакмус фиолетового цвета. Но достаточно одной капли даже очень разведённой кислоты, чтобы бумажка покраснела. Если же капнуть на эту покрасневшую бумажку щёлочью — она приобретёт синий цвет.
Есть на вооружении химиков другие помощники, не менее чувствительные, чем лакмус. Например, фенолфталеин. Это твёрдое белое вещество. Его бесцветный спиртовой раствор становится малиновым от щёлочи и снова обесцвечивается от кислоты.
Лакмус и фенолфталеин химики называют индикаторами. {86}
Не знаю, как других химиков, но меня всегда волновали свойства индикаторов. Может быть, потому, что первое знакомство с ними произошло в тот знаменательный день, когда я впервые увидела химические чудеса в кухне у «профессора» Пети.
Лишь много позднее я поняла, что бумажка, которую он опустил в воду, где плавал натрий, пропитана лакмусом, а жидкость, которая то становилась малиновой, то снова обесцвечивалась, содержала фенолфталеин.
Таковы в общих чертах особенности кислот. И вот, когда из муриевой кислоты получили жёлто-зелёный газ, учёные решили, что это тоже кислота, так как этот газ, подобно любой кислоте, разъедал металлы; даже благородные — золото и серебро — не могли устоять против его воздействия.
Первый солерод
— Если это кислота,— рассуждали учёные,— в ней должен быть кислород. Ведь все известные нам кислоты обязательно его содержат...
Все старания исследователей были направлены на то, чтобы найти в жёлто-зелёном газе кислород и тот таинственный элемент «му-рий», который всё ещё не был обнаружен.
Заинтересовался новым газом и Гемфри Дэви.
Применив все известные ему методы химического анализа, Дэви решил сообщить о результатах своей работы. Произошло это 15 ноября 1810 года.
Гемфри Дэви заявил, что в жёлто-зелёном {87} газе нет и следов кислорода. Нет в нём и какого-либо другого постороннего вещества. Газ этот не поддаётся никакому химическому разложению.
И он, Дэви, разрешает себе вычеркнуть этот газ из списка кислот, да и вообще из списка сложных тел.
Отныне жёлто-зелёный газ надо считать химическим элементом. А назвать его надо «хлором», что вполне соответствует его зелёной окраске (по-гречески «хлорос» означает «зелёный»).
Учёные не соглашались с Дэви.
— Как же так? — говорили они.— Разве есть хоть один элемент, который бы сам мог вступать в соединения с металлами и образовывать соли? Ведь эти свойства принадлежат только кислотам.
— Да,— отвечал Дэви,— до сих пор нам не были известны такие элементы... Но было время, когда мы не подозревали о существовании калия и натрия. Наука идёт вперёд и открывает нам всё новые и новые тайны природы.
Хлор, несомненно, химический элемент, хотя в нём и проявляются какие-то новые свойства, смущающие нас. Но давайте же дальше изучать природу! Может быть, мы найдём ещё много других химических элементов, которые будут обладать не менее интересными свойствами.
Единственно, с чем согласился Дэви,— это дать хлору ещё одно имя — солерод. Он вполне заслуживает это имя, так как родит соль. Нет ни одного металла в природе, который устоял бы против действия хлора. Платина и золото, медь и никель, цинк и свинец, железо, мягкие {88} металлы — калий и натрий, да и десятки других образуют с хлором соли. Называют их хлористыми.
А соляная кислота перестала называться муриевой; второе её имя — хлористоводородная, потому что, кроме хлора, в ней ещё имеется водород.
Случай в цехе
Прошло не больше года с тех пор, как хлор был объявлен химическим элементом. Кое-кто из старых учёных всё ещё упорствовал, не желая согласиться с этим.
Но в одном заводе произошло событие, заставившее поколебаться самых несговорчивых противников Дэви.
Говорят, что в этом событии немаловажную роль сыграла... обыкновенная серая кошка.
Произошло оно в Париже в 1811 году. В это время Наполеон вёл опустошительные войны в Европе, и ему требовалось очень много пороха. Для производства пороха употреблялась селитра. В Париже был построен селит-ренный завод.
Одним из материалов, которые здесь использовались, была зола морских водорослей.
Большие количества морских водорослей сжигались, зола их высушивалась, а затем растворялась в больших медных котлах. Из растворов золы извлекали соли калия, необходимые для изготовления селитры.
Рабочие завода не раз указывали хозяину на то, что внутренние стенки медных котлов очень быстро портятся. Их точно . кислотой изъедает. Обратили внимание и на то, что после извлечения солей калия на дне котлов {89} остаётся ещё какой-то белый осадок. Обычно его выскабливали и выбрасывали вместе с мусором.
Однажды в цех вошла кошка. По своей кошачьей привычке она начала тереться головой у ног кого-то из рабочих. Её оттолкнули, и она бросилась бежать. На ходу кошка опрокинула банку с серной кислотой. Рабочие испуганно ахнули, но кошка успела умчаться раньше, чем кислота вылилась из банки.

Густая, как масло, серная кислота потекла по полу. Неподалёку лежала кучка белого осадка, выскобленного из котла. Струйка кислоты приблизилась к кучке, и в тот же миг присутствующие в цехе увидели необыкновенное зрелище. С полу поднялся красивый фиолетовый пар. Запах его был неприятным, но цвет радовал глаз, и кто-то из рабочих сказал:
— Пар похож на цвет фиалок!
Случай этот наделал в Париже много шума. Химики, узнав о нём, не могли оставаться равнодушными.
«Что это за пар, похожий на цвет фиалок?» — думали они. {90}
Может быть, рассказ о кошке относится к числу тех анекдотов, которые нередко сопровождают великие научные открытия. Может быть, никакой кошки и не было. И не в ней суть.
Важно другое. Выскобленный со дна котлов осадок не выбрасывался больше в мусорный ящик. Его уносили в лабораторию на исследование, обливали серной кислотой, и всякий раз повторялось одно и то же: густой фиолетовый пар поднимался кверху.
Новое вещество назвали по-гречески — иодом, что обозначает «похожий на цвет фиалок».
Честь открытия иода история науки приписывает химику Бернгарду Куртуа. Это он открыл в Париже селитренный завод, в цехе которого произошёл случай с появлением фиолетового пара.
Естественно, что на заводе, где работали с водорослями, содержащими много иода, рано или поздно должно было совершиться это открытие. Тем более что Куртуа был большим любителем химии. Много сил и времени отдавал он своей любимой науке и не успевал руководить заводом. Дела пошли плохо. Вскоре производство зачахло, химия тоже не приносила ни денег, ни славы. Даже открытие нового элемента — иода — не сделало имя Бернгарда Куртуа широко известным среди учёных мира. Семья Куртуа нищенствовала.
Лишь через сто лет его земляки — жители города Дижона, где родился и вырос Куртуа, назвали его именем улицу, которая помнила Куртуа маленьким. Торжественно было отпраздновано столетие со дня открытия иода. Его {91} значение для человечества к тому времени уже хорошо поняли.
Ещё при жизни Куртуа выяснилось, что, охлаждаясь, фиолетовый пар превращается в тёмносерые, почти чёрные кристаллы. По блеску они похожи на металлические.
Слово «иод» знакомо каждому школьнику. В каждом доме имеется флакончик с бурой жидкостью, которой прижигают ранки, царапины, чтобы предостеречь от заражения микробами.
Эта жидкость не что иное, как спиртовая настойка, раствор йодистых кристаллов в спирте. Если высушить весь спирт, то на дне флакончика останутся блестящие игольчатые кристаллики иода, обладающие интересными свойствами.
Вот какой случай произошёл с ними у одного лаборанта. Ему очень нравились эти блестящие чёрносерые кристаллы! Он рассматривал их на свет, и ему казалось, что они просвечивают фиолетовым цветом.
Он взял несколько кристалликов, сложил их в пробирку и закупорил пробкой. Пробирку же спрятал в ящик, где хранились блестящие ножницы, красивый металлический нож для разре-зывания бумаги и такая же рамочка.
Прошло недели две.
«Посмотрю-ка я свои кристаллы!» — подумал лаборант.
Открыв ящик, он почувствовал неприятный резкий запах.
Пробирка оказалась пустой! Лаборант отчётливо помнил, что он положил в пробирку блестящие кристаллики иода, закупорил её и собственноручно запер в ящике стола. {92}
Куда же они девались? Таинственное исчезновение йодистых кристаллов встревожило лаборанта. Разгадка пришла вскоре же.
— Бедная рамочка! Что с ней случилось? — воскликнул он, вынимая из ящика проржавевшую рамку. Из блестящей узорчатой она превратилась в жёлто-грязную. Так же точно изменился нож для разрезывания бумаги. Так же оказались испорченными блестящие ножницы...
На внутренних стенках ящика лаборант обнаружил жёлтый налёт, который не смывался ни холодной, ни горячей водой.
— Как же я не сообразил! — сокрушался он.— Ведь слышал же я, что кристаллы иода даже в плотно закупоренной банке снова превращаются в пар. А моя пробирка, к тому же, была не очень хорошо закупорена... Вот почему весь иод из неё улетучился. И мало этого! Он испортил мне вещи, они заржавели.
Выходит, что иод соединился с железом! Так ли это?
Вскоре выяснилось, что иод соединяется и с ртутью. Растирая ртуть с йодными кристаллами, удалось получить соль, да ещё не одну, а две. Если взять больше кристаллов и меньше ртути, соль получается красная.. Если же, наоборот, взять больше ртути, получится соль зелёного цвета.
Тогда попробовали и другие металлы соединять с кристаллами нового вещества, и оказалось, что оно, подобно хлору, охотно соединяется с металлами и образует соли.
Учёные недоумевали, появился ещё один химический элемент — солерод! Не родственник ли он хлора?
Пока химики решали этот вопрос, иодом {93} заинтересовались медики. В госпиталях того времени тысячами умирали раненые солдаты. В руках у врачей не было никаких средств, предохраняющих раны от заражения.
В поисках такого средства врачи попробовали действовать иодом. Он оказался незаменимым лекарством.
Его спиртовую настойку начали применять для дезинфекции ран, останавливали ею кровотечения.
Но самое большое значение иода в жизни и здоровье человека выяснилось много позднее.
Непонятная болезнь
Есть такая болезнь. Называется она зобом. На шее больного появляется опухоль. Она часто разрастается до огромных размеров и висит под подбородком, как круглая дыня. Больной делается раздражительным, теряет трудоспособность, у него ослабевает память, заболевает сердце.
Долго не могли медики объяснить происхождение этой болезни. Знали, что зоб — опухоль щитовидной железы. Но почему она опухает и как её лечить, было неясно.
Щитовидная железа — маленький неприметный орган нашего тела, но роль его огромна. Железа эта выделяет в кровь особые вещества, которые влияют на работу сердца, мозга, нервной системы. Если почему-либо нарушается её деятельность, это тотчас же отражается на самочувствии человека.
И вот оказалось, что для точкой и бесперебойной работы щитовидной железы нужен иод. Это было установлено совершенно точно. Стоило {94} регулярно добавлять в пищу зобных больных йодистые соли, как болезнь постепенно проходила.
Но почему же в одних местах земного шара совсем не встречаются больные зобом, а в других болеет чуть ли не поголовно всё население?
В распределении иода на земном шаре имеется необъяснимое противоречие. Иод встречается абсолютно везде: в пище, почве, воздухе, море, реках и даже в дождевой воде. Он входит в состав каждого живого организма, встречается в граните, мраморе, горном хрустале, он пронизывает все горные породы.
И вместе с тем распределение его неравномерно. На высоких гористых местах его очень мало, в низинах, на берегах морей — больше.
Сопоставляя сведения о распространении иода со сведениями о больных зобом, учёные увидели полное совпадение.
Там, где иода мало: в высокогорных аулах Центрального Кавказа, на Альпах, кое-где в Америке, на Урале,— люди чаще болеют зобом.
Могли ли думать рабочие парижского селит-ренного завода, что фиолетовый пар, который они увидели, играет такую роль в жизни людей. Они и не догадывались, что являются участниками большого научного открытия.
Качества иода заставили подумать о добыче его в больших количествах.
В этом были заинтересованы не только медики. Иод с успехом начали использовать и в промышленности. Его добавляют к стеклу, из которого готовят лупы и стёкла для очков лётчиков.
Но добыча иода — дело сложное. Несмотря на то, что он распространён больше, например, {95} серебра, добыть его труднее. Минералов, содержащих серебро, в природе имеется больше ста, а йодистых минералов и пятнадцати не наберётся. Кроме того, йодистые минералы рассеяны в горных породах, и извлечь их оттуда очень трудно.
 |
Чтобы добыть один грамм иода из гранита, надо переработать пятьдесят тонн этой породы. Мрамора для этого же понадобится тридцать тонн.
Не легче добыть его из морской воды. Чтобы освободить один грамм иода, надо выпарить четыре тысячи вёдер воды!
Добытый такими способами иод стоил бы дороже драгоценных металлов.
Понятно, что учёные искали другие источники иода. Где же они находятся? Как образовались?
Тайна ламинарии
Об этом могла бы рассказать скромная морская водоросль — ламинария.
Ламинария не похожа на растения, к которым привык наш глаз. Окрашенная в самые различные цвета — розовый, красный, фиолетовый,— она и форму имеет различную. У неё нет привычного для нашего глаза деления на лист, стебель, корень.
Иные ламинарии похожи на длинные, изящно разветвлённые нити, другие — на огромные толстые листья, третьи имеют вид круглого кочана капусты и так и называются «морской капустой».
К ламинариям же относится самое большое растение на земном шаре. Длина его триста {96} метров. Целые подводные леса образует оно в морях и океанах. У этого растения трудное латинское название — «макроцистис пирифера».
 |
Так вот, ламинария и могла бы поведать, как удаётся ей накапливать в себе иод, как она отыскивает его в морской воде и извлекает оттуда, как хранит в себе накопленные атомы иода, превращаясь в живой склад этого ценного химического элемента.
Из обычных продуктов питания иодом богаты морская рыба и наш обыкновенный лук. Много иода содержат в себе морские губки. Их золой китайцы давно излечивали зоб.
Но ни лук, ни морская рыба, ни губки не могут стать источниками промышленной добычи иода. Иное дело — морские водоросли.
Целые поля её растут на берегах Белого и Чёрного морей, в Японском море. Во многих местах земного шара её употребляют в пищу, как салат или овощи.
Кормят морскими водорослями и скот. У коров, которым добавляют в пищу морские водоросли, увеличивается удой молока, у овец быстрее растёт шерсть, свиньи делаются жирнее, а куры кладут больше яиц.
Трудно сказать, почему именно водоросли сделались в природе собирателями и хранителями йодистых запасов.
Началось это в те далёкие времена, о которых не осталось достоверных сведений. Нам {97} трудно сейчас представить, как выглядела тогда Земля. Не было на ней ни человека, ни животных. Суровые скалы, безжизненные утёсы да ветры над ними...
 |
И только в морях плавали живые существа. Они всячески приспосабливались к среде, в которой жили. Извлекали из неё всё, что укрепляло их тело, давало им возможность жить, расти и родить потомство.
Морская вода — колыбель, в которой появились и развились первые растения, первые животные. Она питала их тем, чем сама была богата: солями и газами, принесёнными из атмосферы.
А среди этих газов несомненно был иод. Его фиолетовые пары вместе с жёлто-зелёным хлором свободно летали над молодой Землёй, пока горячие ливни не унесли их с собой вниз, на Землю, в только что образовавшиеся моря.
И нашлись в морях какие-то живые существа, прародители современных водорослей, которым «по вкусу» пришёлся иод. Они извлекали его из воды и впитывали в себя в больших количествах. А эта способность питаться иодом передавалась из одного поколения в другое.
И вот теперь мы находим огромные заросли растений; содержащих в себе много иода. Тысячами тонн добывают их из моря специалисты-ловцы. Они выезжают в лодках, вооружившись особыми жнейками, и привозят огромные количества мокрой буроватой травы. {98}
А во время прибоя море само выбрасывает на берег целые горы морских водорослей.
Но прежде чем извлечь из них иод, надо удалить девяносто процентов воды, которая в них находится. От травяной горы после сушки остаётся небольшая кучка. Теперь можно сжечь эту кучку и освободить накопленный в них иод.
Таков наиболее простой способ. Долгие годы применялся он в приморских районах. Но этот способ не выгоден. Пары иода при сжигании водорослей улетают вверх, разносятся ветром в разные стороны. Собрать иод при этом способе очень трудно.
Поэтому учёные изобрели особые печи, в которых водоросли подвергаются действию тепла, но не горят, а медленно разлагаются на составные части. Такая печь обогревается снаружи, внутрь её не попадает ни один пузырёк воздуха.
В Советском Союзе добывают много иода из водорослей Чёрного и Белого морей, в морях Дальнего Востока.
Тайна ламинарии перестала быть тайной. Её богатства служат советской медицине и советской промышленности.
Приманка
Но есть ещё один источник иода, причём настолько богатый, что его запасов хватило бы на сотни человеческих поколений. Это вода солёных озёр и бросовые воды, которые остаются после добычи нефти. Около Баку такие воды образовали целые озёра.
Советские химики нашли остроумный способ «выманить» иод из воды. Для этого послужил крахмал. Иод с ним образует вещество синего цвета. Этим всегда пользуются, если хотят {99} узнать, есть ли в каком-либо продукте крахмал. От одной капли иода он синеет.
Прибавив к солёной воде озера или источника крахмал, химики заставили иод к нему немедленно присоединиться. Образовалось сложное вещество синего цвета.
Затем это вещество отделили от всей остальной воды и занялись тем, чтобы разлучить крахмал и иод. Для этого у химиков есть много различных приёмов.
Советский Союз богат иодом. Много в наших морях живых хранителей иода — водорослей, немало и озёр, где растворены йодистые соли.
Богата наша Родина и людьми, изобретающими различные способы добычи этого ценного химического элемента.
Семейное сходство
В семье иной раз бывает так: один брат белокурый, невысокого роста, другой, наоборот, высокий, темноволосый, а третий — рыжеватый, среднего роста. И всё же, вглядишься в их лица и увидишь много общего: одинаковый разрез глаз, одна и та же форма носа, те же зубы, улыбка.
Так и химические элементы. Среди них есть настолько похожие между собой, будто они члены одной семьи.
Вспомним калий и натрий. Вполне справедливо было назвать их братьями-близнецами. Они и внешне мало отличаются друг от друга и в природе встречаются рядом, а по соседству с ними учёным удалось открыть ещё несколько металлов, сходных с нашими близнецами. Это цезий, литий, рубидий. Они такие же серебристые, {100} мягкие, также плавятся при низких температурах, не могут существовать на открытом воздухе.
И «вкусы» у них такие же, как у калия и натрия. Они дружат с одними и теми же элементами. Разница лишь в том, что калий и натрий встречаются в природе гораздо чаще, чем цезий, рубидий, литий. Но всё же их смело можно назвать одной семьёй, у которой даже есть фамилия: «щелочные металлы».
Когда стали известны хлор и иод, учёные задумались: может быть, нам удалось открыть новую химическую семью?
Правда, иод — твёрдое тело, а хлор — газ, но ведь иод легко превращается в фиолетовый пар! И при этом имеет такой же неприятный раздражающий запах, как хлор.
Но это ещё не самое главное. Больше всего химиков поразило то, что и хлор и иод соединялись с металлами, образуя соли. Оба были солеродами.
При этом обнаружилась некоторая разница в их характерах. Хлор оказался более сильным, более энергичным. Если на какую-нибудь йодистую соль действовали хлором, иод уступал своё место, уходил из соли в виде фиолетового пара. А хлористые соли не менялись от действия иода. Хлор цепко держался за металл и не хотел уступать своё место.
К водороду у них тоже оказалось одинаковое отношение. Они оба соединялись с водородом и образовывали кислоты. Но хлористо-водородная кислота более устойчива. В ней хлор и водород соединены крепко. А в йодисто-водородной кислоте иод и водород соединены не так прочно. Даже под действием солнечного света, {101} иод легко уходит из кислоты в виде фиолетового пара.
Окончательно уверились учёные в сходстве этих элементов, когда обнаружили и третьего, похожего на них.
Мы с ним хорошо знакомы, хотя и не подозреваем, что он брат хлора и иода. Я думаю, каждый школьник слышал слово «бром», может быть, кому-нибудь пришлось пить лекарство, которое называют бромом.
Название это, применительно к лекарству, очень неточное. Ошибка заключается в том, что бромом медики сокращённо называют раствор соли бромистого калия. Сам же по себе бром — тяжёлая ядовитая жидкость тёмнокрасного цвета. Пить её, конечно, нельзя! От неё отходят бурые пары отвратительного удушливого запаха. Бром даже название получил из-за этого запаха. «Бромос» по-гречески означает «зловонный». Уже эта одна особенность брома напоминала и хлор и иод! Ведь оба они тоже отличаются неприятным раздражающим запахом.
Если большинство школьников незнакомо со вкусом бромистого лекарства, то уже, конечно, каждый видел фотографическую пластинку. А те, кто занимаются фотографией, знают, что она покрыта бромистым серебром.
Бромистое серебро — соль. В её состав входят бром и серебро.
Оказывается, в обыденной нашей жизни мы довольно часто встречаемся с двумя бромистыми солями: с бромистым калием в лекарстве, с бромистым серебром в фотографии.
В природе есть много других солей, содержащих бром и какой-нибудь металл. И эти бромистые соли встречаются там же, где йодистые {102} и хлористые. Они насыщают морскую воду, воду солёных озёр и ручейков.
Как же было не признать все эти элементы: хлор, иод, бром — братьями, членами одной семьи солеродов! Способность с металлами родить соли — главная их семейная черта.
Но и во многом другом они схожи. Бром, так же как хлор и иод, соединяется с водородом, образуя бромисто-водородную кислоту.
Бром, так же как иод, рассеян по всей планете, пронизывает горные породы и воздух и странствует из воды в живые организмы...
Вот как много общего нашли мы между бромом, иодом и хлором, хотя внешне они и не похожи. Хлор — газ. Бром — жидкость. Иод — твёрдые кристаллы.
Эти химические элементы теперь объединены общим названием — галлоиды.
Есть у них ещё один брат. Имя его фтор. Но у него настолько интересный характер, что о нём надо рассказать особо.
Неудавшаяся картина
Вернувшись после летней поездки по Уралу, я была удивлена тем, что оконное стекло в комнате у моих соседей стало матовым. Как ни терли его, как ни мыли, оно не делалось прозрачнее. Все жильцы нашей квартиры недоумевали, в чём тут дело!
Только виновник происшествия ходил, не глядя никому в глаза, и помалкивал. Это был Сеня Чижиков, художник по натуре и мастер на все руки.
Он выпиливал из дерева изящные полочки, сам сконструировал радиоприёмник, вылепил {103} из пластилина портрет своей сестры и мечтал изобрести ракетный самолёт новой конструкции.
Надо было поскорее окончить школу и приняться за изобретение, а до окончания ещё целых два года!
О том, что именно Сеня был виновен в порче стекла, сообщила его мать.
И вот что мы узнали.
В самом конце прошлого учебного года Сеня решил сделать картину на стекле, но нарисовать её не красками, а выжечь плавиковой кислотой.
Незадолго до этого учительница на занятиях химического кружка показывала эту кислоту и рассказывала о том, что ее летучими парами можно разрисовать хрустальную вазу, графин или рюмку. Рисунок получается тонкий и очень красивый.
Хрусталя у Сени, конечно, не было, но его и не требовалось. Сеня достал кусок толстого стекла, покрыл его слоем растопленного парафина и гвоздём выцарапал на парафине рисунок.
Это было высотное здание с башнями и шпилем. А вокруг — аккуратно подстриженные деревья с круглыми кронами.
Дело оставалось только за плавиковой кислотой. Если осторожно накапать её в те места «картины», где гвоздём сцарапнут парафин, она начнёт разъедать стекло. В этих местах на стекле появятся углубления, ко всему остальному стеклу парафин не допустит кислоту. Так получатся прозрачные контуры рисунка на прозрачном фоне.
Но можно получить и матовый рисунок. Это {104} было бы ещё интереснее, но зато значительно сложнее. Матовый рисунок получается от действия не самой кислоты, а её паров.
Где же этим заняться? Хорошо бы освободить платяной шкаф от всяких там платьев, повесить в нём свою картину на гвоздь, а перед ней поставить в чашке плавиковую кислоту.
 |
Но разве мать позволит это сделать? Сеня обдумывал способы своей будущей работы и заранее предвкушал удовольствие от ее результатов. Он принесёт картину в класс... Все будут очень удивлены.
Да, это так. Но где взять плавиковую кислоту? В химическом кабинете стоит парафиновая литровая бутыль, полная этой кислоты...
После очередного занятия химического кружка Сеня предложил дежурному заменить его в уборке кабинета.
— А ты за меня в другой раз подежуришь...— сказал он.
И вот ребята уходят. А Сеня остаётся один с учительницей.
— Вера Петровна,— говорит он заикаясь,— я... я обещал нашему соседу выпросить у вас немножко плавиковки.
— Для чего? — удивилась учительница.
— Да он какую-то картину на стекле выжечь хочет. Для нашего кружка химического подарок.
Вера Петровна задумалась. {105}
— Ну что ж, возьми. Но смотри, будь осторожен, ты ведь знаешь, какая она опасная...
Сеня не стал терять времени зря. Перемыть химическую посуду и расставить её по шкафам было делом нескольких минут. За это время на плитке успела вскипеть вода. Сеня опустил в неё пустую стеклянную банку, а когда она хорошо
 |
Теперь можно спокойно налить в банку плавиковую кислоту. Парафин не допустит её к стеклу.
Соблюдая всяческие предосторожности, Сеня откупорил бутыль с плавиковой кислотой и отлил из неё немного в свою баночку.
При этом он был очень осторожен, надел резиновые перчатки, костюм закрыл халатом и легко вздохнул, когда водрузил кислоту на старое место. А свою заветную баночку он закупорил пробкой, которую тоже смазал парафином внутри и снаружи.
— Смотри же, не обожгись,— напутствовала его учительница,— неси осторожно...
Но, к сожалению, воспользоваться плавиковой кислотой Сене так и не пришлось. Весь вечер у них в комнате сидели гости, на следующий день мать отправила его на рентген в поликлинику, затем началась предотъездная суета — собирались в пионерский лагерь. И Сеня решил, что закончит картину позднее, вернувшись из лагеря.
Банку с кислотой он завернул в две газеты, налепил на неё этикетку, где были нарисованы {106} череп и две скрещенные кости, и поставил на подоконник.
А матери и сестре небрежно сказал:
— Вы тут у меня не трогайте. Приеду — картину нарисую.
Но никто и не интересовался Сениной банкой. В семье привыкли к его постоянным затеям и не очень в них вникали.
 |
Вскоре после Сениного отъезда в лагерь, уехали в деревню его мать и сестра. А когда возвратились и мать вошла в комнату, ей бросились в глаза матовые стёкла в окне.
В первую минуту ей показалось, что окно очень запылилось. Но так как отмыть его не удавалось, да к тому же в комнате стоял неприятный запах, мать заподозрила, что беда произошла от Сениной «краски». А Сеня, перепуганный происшествием и строгим допросом матери, вынужден был признаться в своей вине.
Заглянув в банку, он убедился, что кислоты в ней не осталось. Она вся улетучилась. Нечем было теперь Сене «раскрасить» свою картину, зато по стеклу в их комнате все жильцы квартиры могли изучать действие плавиковой кислоты.
Трудная победа
С плавиковой кислотой учёные были знакомы давно. Знали, что её нельзя было оставлять в стеклянной посуде. Она разрушает стенки и {107} дно банки и выливается вон, сжигая на своём пути металлические и стеклянные предметы.
Химики научились хранить плавиковую кислоту в бутылях из каучука и парафина.
Более ста лет учёные мужественно наступали на плавиковую кислоту, стараясь выведать, какой элемент в ней обладает такой разрушительной силой?
Ни с одним химическим элементом за всю историю химии не было связано столько тяжёлых и даже трагических случаев, как с тем, который заключён в плавиковой кислоте.
Даже название он получил за свои опасные свойства. Его назвали — фтор. «Фторос» — слово греческое, означающее «разрушающий». Химики хотели изучить фтор поближе, но многие из них умирали, как солдаты в бою с неравным коварным врагом. Другие до конца своих дней оставались инвалидами.
Говорят, что Гемфри Дэви тоже отравился фтором, пытаясь открыть его в плавиковой кислоте. Но ему это так и не удалось.
Только в 1886 году долгожданную победу одержал французский химик Анри Муассал.
С помощью электрического тока он разложил плавиковую кислоту на водород и другой бесцветный газ, которому дали название фтор.
Газ этот имел одуряющий запах. Самые небольшие количества его в воздухе вызывали боль в глазах, раздражение кожи и мучительный кашель.
Конечно, знакомясь с этими его неприятными особенностями, учёные вспоминали хлор,, пары иода, бром... Ведь и они проявляют себя также!
А в отношении металлов фтор вёл себя ещё {108} активнее, чем все его братья. Он соединялся с многими элементами, производя при этом взрыв или яркое накаливание. Он вытеснял хлор, иод, бром из солей и становился на их место.
Это оказался буйный брат всех уже известных науке солеродов.
Где же в природе находится фтор? Какие сложные вещества таят в себе этого опасного разрушителя?
Так же, как атомы хлора словно в шапке-невидимке скрыты в кристаллах поваренной соли, фтор живёт в минерале по имени плавиковый шпат. И, глядя на розовые, фиолетовые и прозрачные кристаллы этого редкого прекрасного камня, никому в голову не придёт, что в нём хранится буйный, всё разъедающий фтор.
Много плавикового шпата в Таджикистане, в предгорьях Тянь-Шаня, в Забайкалье. Его чудесные тона привлекали гранильщиков, и до сих пор в музеях хранятся вазы и статуэтки, вырезанные из плавикового шпата.
У плавикового шпата есть интересная особенность. Она была известна очень давно. И даже название «плавиковый» этот минерал получил благодаря своей способности придавать многим рудам легкоплавкость.
При изготовлении чугуна и стали плавиковый шпат добавляют в шихту. Он помогает рудным примесям расплавляться, они всплывают кверху в виде шлака, и их отделяют от жидкого металла.
Есть ещё один фтористый минерал, который используют в промышленности.
Называется он криолитом. Это белоснежный твёрдый камень. Родина его — ледяные берега Гренландии. Без криолита невозможно было бы {109} выплавлять один из наиболее употребимых металлов — алюминий.
Теперь на наших химических заводах умеют получать искусственный криолит, и он помогает металлургам не хуже природного.
Но не надо думать, что фтор встречается только в виде кристаллов плавикового шпата или белоснежного криолита. Огромное количество его атомов распылено по различным горным породам, много его в почве, встречается он в воздухе и в воде.
В теле человека и животного фтор играет немалую роль. Он входит в состав эмали, покрывающей наши зубы, в состав костей. Среди растений фтором богаты лук и чечевица.
Повышенное количество фтора в воде или в воздухе приводит к хроническим отравлениям. Люди заболевают. У них начинает разрушаться зубная эмаль, кости делаются хрупкими и легко ломаются. Некоторые учёные даже утверждают, что излишек фтора, как и недостаток иода, вызывает зоб.
Таковы особенности и пути странствий деятельного члена интересной семьи химических элементов.
На этом можно было бы закончить и весь рассказ об этой семье, но он будет неполным, если не упомянуть ещё об одном химическом элементе. Его имя — астатин. Он брат хлора, брома, иода и фтора. Но судьба его совсем особенная.
До 1940 года астатин не был известен химикам. Однако этот химический элемент усиленно искали. И причиной поисков было предсказание великого русского учёного Дмитрия Ивановича Менделеева. {110}
Задолго до того, как химики открыли астатин, Менделеев предсказал его существование.
Он утверждал, что будет открыт пятый член химической семьи, к которой относится хлор, бром, иод, фтор. И больше того, говорил, что неведомый элемент из всех своих братьев проявит наибольшее сходство с иодом. Менделеев даже дал ему название — «эка-иод».
Прошли десятки лет после смерти великого учёного, и вот элемент, похожий на иод, получен.
Правда, учёные назвали его не «эка-иод», а иначе. Астатин — значит неустойчивый. Имя это соответствует характеру элемента. Он действительно очень неустойчив! Как только ученые получат его, он тут через семь с половиной часов исчезает.
Свойства же его, как и предсказывал Менделеев, заставляют химиков считать астатин пятым членом семьи элементов-солеродов, или, как теперь их называют,— галлоидов.
До сих пор учёные не перестают удивляться уму Менделеева, проникшему в глубочайшие тайны природы, способному предвидеть то, что будет открыто лишь через десятки лет.
Кто же был этот великий предсказатель?

| {111} |
| {112} |

| {113} |
| {114} |
Патриот и учёный
Дмитрий Иванович Менделеев родился в 1834 году.
Так же, как другой гениальный русский учёный Михаил Васильевич Ломоносов, он вырос вдали от столицы, на одной из суровых окраин необъятной России в семье директора Тобольской гимназии. Когда умер отец и семья осталась без средств к существованию, мать открыла небольшой стекольный завод.
Маленький Митя с детства познакомился с запахом кислот, щелочей и мог наблюдать различные химические превращения. Часами простаивал он около стеклоплавильных печей, живо интересуясь работой стеклодувов и химиков.
Может быть, эти детские впечатления сыграли роль в развитии его будущих интересов... Когда же после окончания гимназии он попал в Петербургский педагогический институт, его любовь к химии стала совершенно очевидной, а впоследствии сделалась главным занятием жизни.
Правда, он немало пользы принёс и в развитии других наук. Он первый предложил отыскивать железные руды с помощью магнита,
| {115} |
 |
Д. И. Менделеев. |
горячо пропагандировал разработку нефти, каменного угля, горных пород. Он поднялся на воздушном шаре, чтобы обследовать верхние слои атмосферы. Он организовал первое в России опытное поле, где показывал, как влияют удобрения на плодородие почвы; изучал промышленность и стремился к тому, чтобы увеличить в России выплавку чугуна, стали, цветных металлов. {116}
Это был смелый, мужественный человек, справедливый и горячий патриот. Он вникал в хозяйственную жизнь своей родины, боролся за усовершенствование её производств и сельского хозяйства.
Гениальный ум Менделеева охватывал и большие вопросы практической жизни страны и глубокие теоретические проблемы науки.
Когда в пасмурный зимний день 1907 года Менделеева не стало, толпы людей пришли проводить его в последний путь.
Перед гробом Менделеева несли большую таблицу, разграфлённую на клетки. В клетках были вписаны названия химических элементов. А надпись сверху гласила: «Менделеевская таблица элементов».
Ученики Менделеева, его друзья, да и все провожавшие великого учёного, понимали, что среди множества заслуг Менделеева перед науками создание этой таблицы — заслуга величайшая.
Что же это за таблица?
В поисках закона
К середине девятнадцатого века, когда жил и работал Дмитрий Иванович Менделеев, химики знали шестьдесят три химических элемента. Были известны все их особенности: отношение к теплу, к холоду, к свету, знали, как они соединяются друг с другом, какой имеют атомный вес, где их надо искать в природе и многое, многое другое.
Чуть ли не каждый год приносил новые открытия. Трудно стало разбираться в огромном количестве разрозненных фактов, которые накопились в науке. И это беспокоило учёных. {117}
Тревожило это и Менделеева. В 1867 году его назначили профессором химии Петербургского университета. Влюблённый в химию молодой профессор хотел так рассказать студентам о своей науке, чтобы они поняли всё её величие, всё её значение для жизни.
Готовясь к лекциям, Менделеев ещё глубже почувствовал, какой хаос царит в химии.
Не было ничего, что объединяло бы разрозненные сведения об элементах.
Правда, уже было известно, что такие элементы, как фтор, бром, хлор, иод, составляют как бы единую семью. Также объединялись в родственную группу металлы - калий, натрий и похожий на них литий.
Но Менделеева это не удовлетворяло.
«Установить, что существуют родственные группы химических элементов, ещё мало! — думал он.— Надо найти общую связь между всеми ими».
Почему одни больше похожи друг на друга, а другие резко различаются? Нет ли тут какого-то закона, которому все они подчинены?
Позднее, в письмах к сыну, Менделеев рассказывал об этих своих размышлениях.
Оказывается, ещё в студенческие годы он задумывался над тем, какое свойство элементов надо признать основным, общим для всех.
Может быть, цвет? Нет, это признак ненадёжный. Есть химические элементы, меняющие свой цвет: то он жёлтый, то он красный. Например, фосфор. Что же делать с такими?
А если запах? В этом случае тоже будет немало затруднений. Многие химические элементы не имеют никакого запаха...
Одним словом, ни цвет, ни запах, ни отношение {118} к электричеству или теплу, к свету или холоду — не могли служить для этого дела.
Менделеев нашёл другой признак! Это — атомный вес элемента.
Атомный вес имеют все химические элементы: и окрашенные и бесцветные, и газы и твёрдые тела, и те, которые хорошо проводят электричество, и те, которые его совсем не проводят.
Размышляя над свойствами элементов Дмитрий Иванович увидел, что все они находятся в зависимости от атомного веса.
Что же такое атомный вес?
Когда жил Менделеев, учёные ещё не умели определять настоящего веса атомов. Впервые это сделали через год после его смерти.
Особыми очень точными способами определили, что атом водорода, например, весит 0,000 000 000 000 000 000 000 001 66 грамма, а кислорода — 0,000 000 000 000 000 000 000 027 грамма.
Но попробуй-ка пользоваться такими ничтожно маленькими величинами! Это крайне неудобно. Вот почему химики и теперь их не употребляют. Учёные уже давно условились принять за единицу измерения атомный вес самого лёгкого химического элемента — водорода. А все остальные атомные веса сравнивали с ним. Например, определили, что атомный вес натрия — 23. Это значило, что атом натрия в двадцать три раза тяжелее атома водорода.
Сосчитали, что атомы хлора в тридцать пять раз тяжелее водородных, а атомы химического элемента урана (самого тяжёлого из всех, которые были известны при Менделееве) — в двести тридцать восемь раз.
Но современная химия узнала так много {119} нового о химических элементах, что старое определение атомного веса пришлось пересмотреть. И теперь за единицу измерения принимают не атомный вес водорода, a Vie атомного веса кислорода. По этой величине перечислили атомные веса всех химических элементов.
В девятнадцатом веке расчёты были не так точны. Сопоставляя свойства элементов с их атомными весами, Менделеев обнаружил несколько ошибок в вычислениях.
И прежде чем выводить какие-то общие законы, пришлось исправить эти ошибки... Постоянно думал он о своих элементах.
«Я искал это обобщение,— пишет Менделеев,— с помощью усидчивого труда во всех возможных направлениях... Я пересмотрел массу источников, сопоставлял огромный материал...»
Изучая элементы от самого лёгкого — водорода до самого тяжёлого — урана, Менделеев после долгих трудов увидел то, чего никто из учёных до сих пор не наблюдал.
Оказалось, что свойства химических элементов, расположенных по атомному весу, периодически повторяются.
Например, атомный вес лития — 7. Это лёгкий серебристый металл, который не может жить на открытом воздухе, взрывается на воде, образует щёлочи. Через некоторый промежуток от лития находится натрий. А ведь мы уже знаем, что у него почти такие же свойства. Атомный вес натрия — 23. Через такой же определённый промежуток стоит калий с атомным весом 39, похожий на натрий...
Такая же закономерность обнаружилась в положении фтора, хлора, брома и иода. {120}
И другие химические элементы, схожие между собой, также располагались на совершенно определённых расстояниях друг от друга.
Менделеев с радостью увидел, что периодические повторения разбивают построенный им ряд элементов на несколько отчётливых родственных групп. Чтобы облегчить свой труд и сделать его более наглядным, Менделеев приготовил из картона шестьдесят три карточки и выписал на них все известные тогда химические элементы. На каждой карточке под названием элемента он записал атомный вес и все остальные его свойства.
«Это был,— как он пишет,— заключительный аккорд, итог всего предыдущего труда».
Расположив карточки в порядке возрастания атомного веса, Менделеев получил несколько групп химических элементов. Так объединились все щелочные металлы. Нельзя было больше считать случайностью семейное сходство между фтором, бромом, иодом и хлором.
Эти элементы, как и все остальные, подчинялись строгому закону природы. Он получил название периодического закона.
В сложном хозяйстве природы вечно существовал этот железный порядок, но до Менделеева его никто не увидел.
Нашлись у Менделеева противники. Они пытались доказать, что Менделеев фантазирует, выдумывает несуществующие законы. А когда множество фактов подтвердило верность взглядов русского учёного, появились люди, желающие приписать себе честь открытия периодического закона.
В одной из книжечек иностранного учёного {121} излагалась сущность периодического закона. Автор сообщал, что не Менделеев его открыл, а он, этот учёный. Менделеев прочёл эту книжку и возмутился:
— Очень дикое переложение моего закона!
Он доказывал своё первенство не из честолюбия. Ему хотелось отстоять честь русской науки!
И Менделеев вышел победителем из этой борьбы. Его противники сдались, почувствовав свою неправоту, слабость своих доказательств.
Открыв периодический закон, Дмитрий Иванович Менделеев определил место каждому элементу. Он построил особую таблицу, которая носит его имя: Менделеевская таблица химических элементов.
В клеточках этой таблицы расположились элементы. Учёный словно выдал каждому элементу документ с точным указанием всех его примет и особенностей.
Некоторые клеточки в таблице остались пустыми.
— Здесь, — говорил Менделеев, — встанут те химические элементы, которые ещё не открыты...
Он заранее вычислил их атомные веса, описал их вид и сообщил все свойства.
Это было не колдовство, не гадание на картах. Это было научное предвидение, основанное на точном знании закона природы.
Ведь каждый предсказанный им элемент существовал не сам по себе, а как член какой-то определённой «химической семьи», как член всего ряда химических элементов. Он, этот ещё не открытый, но существующий элемент, тоже подчинялся периодическому закону. {122}
А это значит, что «семейные» свойства в нём зависели от того, между какими элементами в общем строю находится его место.
Случай с предсказанием астатина не единственной. Ещё при жизни Менделеева химики открыли предсказанные им несколько элементов. Сам он не надеялся, что это произойдёт при его жизни.
Но, к счастью, наука его порадовала.
В 1906 году он писал:
«Я не думал, что доживу до оправдания следствия периодического закона. Но действительность ответила иначе. Описаны были мною три элемента... Не прошло 20 лет, как я имел уже величайшую радость видеть все три открытыми.»
Более восьмидесяти пяти лет прошло с тех пор, как Менделеев создал свою таблицу. За это время во многих областях науки свершились целые революции. Подверглись изменениям и химия и физика. Но ни одна из научных революций не поколебала периодического закона.
Наоборот, всякое новое открытие вновь его укрепляло.
Учёные открыли за эти годы много новых элементов, и все они разместились в пустых клетках Менделеевской таблицы. Встали на те самые места, которые предназначил для них великий учёный.
Таблица Менделеева известна всему миру. Пользуясь ею, учёные ещё глубже изучают природу, раскрывая новые черты и свойства химических элементов.
| {123} |
Дорогой читатель!
Ты так привык к целому ряду веществ, тебя окружающих, что даже не задумываешься о их химическом происхождении.
Ты умываешься мылом, которое приготовили химики; пишешь чернилами на бумаге, которые выпустили заводы, где работают химики. Твоя пища и одежда, кирпичи дома, где ты живёшь, телефонный аппарат, тарелка, из которой ты ешь, целлулоидная игрушка твоего младшего брата... Всё, всё это создано с помощью химии.
Наш век смело можно назвать веком химии.
Химики древности тоже занимались различными производствами. Но их знания о строении веществ были ограничены. Они не могли так свободно управлять превращениями одних веществ в другие, как современные учёные.
Наши же химики, подобно сказочным волшебникам, творят чудеса. В их руках вода и воздух превращаются в удобрения; кусок дерева — в шёлковую ткань; лёгкий хлопок — в ткань, а если нужно,— в динамит; газы — в детали автомобилей, в патефонные пластинки, киноплёнку или капроновые чулки. {124}
Во многих местах, где раньше требовались драгоценные камни, кость, дорогие цветные металлы, с успехом используются вещества, созданные химиками.
Они изобрели вещества прозрачные, как стекло, и при этом прочные, как сталь; лёгкие, как дерево, но не поддающиеся гниению; устойчивые против ржавчины и по своим свойствам превосходящие самые дорогие металлы — золото и платину.
Эти удивительные создания человеческого гениального ума носят скромное название — пластические массы.
Химики умеют из сыпучего песка создавать твёрдые камни. И, наоборот, они научились расплавлять несокрушимые каменные породы, превращать их в жидкую массу, из которой готовят трубы, орнаменты, статуи.
Глядя на сверкающие рубины, топазы или сапфиры нельзя поверить, что их можно приготовить искусственно. Однако химики и этого добились. В особых печах выплавляют искусственные самоцветы.
Проникая в тайны строения всех веществ природы, изучая свойства невидимых молекул и атомов, химики создают свои особые «химические чертежи». Пользуясь этими чертежами, они вмешиваются в строения молекул, располагают атомы по своему усмотрению.
На наших заводах изготовляют искусственные краски. Атомы химических элементов расположились в этих красках так, как этого хотел химик. Химик может и дальше вмешаться в порядок их расположения. Чуть-чуть изменить сочетание, как бы передвинуть, переставить, заменить один элемент другим, и получатся {125} лекарства: сульфидин, стрептоцид. Ещё немного изменить расположение элементов, и получаются превосходные духи, напоминающие запахи живых цветов. Дальнейшее вмешательство приведёт к получению взрывчатых веществ...
Вот какую власть даёт человеку химия!
Она не только помогает понять окружающий мир. Изучив характер и поведение элементов, человек распоряжается ими, создаёт из них новые вещества.
Может быть, и ты, мой читатель, окончив школу, пойдёшь на химический завод или в лабораторию, чтобы там, соревнуясь с природой, создавать полезные людям вещества, такие, каких и в природе не было.

| {126} |
СОДЕРЖАНИЕ
5 | |
47 | |
Рассказ третий. Семья солеродов . . . . | 81 |
Рассказ четвёртый. Великий пред- | 113 |
| {127} |
Издательство просит читателей и библиотекарей
присылать отзывы и замечания об этой книге
по адресу:
г. Свердловск, ул. имени Ленина, 49,
Свердловское Книжное Издательство.
Дижур Белла Абрамовна
Путешественники-невидимки
Редактор Л. Чумакова
Художник А. Зыков
Художественный редактор Н. Крижановская
Технический редактор М. Ульянова
Корректор М. Епимахова
|
Подписано к печати 2/1 1956 г. Уч.-изд. л. 4,76. Бума- га 54×84/16 = 4,0 бумажного — 3,28 печатного листа. НС 01101. Тираж 30000. Заказ № 186. Цена 2 р. 45 к. |
Типография издательства «Уральский рабочий».
Свердловск, ул. имени Ленина, 49.