

| {I} |
A. LADENBURG
Vorträge über die Entwickelungsgeschichte der Chemie
von Lavoisier bis zu unserer Zeit.
П. И. ВАЛЬДЕНЪ
Очеркъ исторіи химіи въ Россіи.
| {III} |
Проф. А. ЛАДЕНБУРГЪ.
ЛЕКЦІИ
по
ИСТОРІИ РАЗВИТІЯ ХИМІИ
отъ Лавуазье до нашего времени
Переводъ съ 4-го изданія подъ редакціей Е. С. ЕЛЬЧАНИНОВА
Приватъ-доцента Новороссійскаго Университета
Съ присоединеніемъ
ОЧEPKА ИСТОРІИ ХИМІИ
ВЪ РОССІИ
Академика П. И. ВАЛЬДЕНА

Одесса 1917.
| {V} |
Изданіе перевода извћстной книги проф. А. Ладенбурга, предлагаемой нынћ вниманію русскаго читателя, было задумано Книгоиздательствомъ давно.
Книга Ладенбурга, заполняя замћтный пробћлъ въ русской литературћ по исторіи химіи, даетъ, однако, слишкомъ мало матеріала по исторіи химіи въ Россіи. А между тћмъ, какъ справедливо указываетъ въ своемъ Послћсловіи академикъ П. И. Вальденъ, этой исторіи все еще не существуетъ.
Поэтому Книгоиздательство съ особенной благодарностью приняло предложеніе П. И. Вальдена дать дополненіе къ книгћ Ладенбурга спеціально по исторіи химіи у насъ.
Это дополненіе, предполагавшееся небольшимъ, въ силу той же причины — полнаго отсутствія трудовъ по исторіи русской химіи — приняло болће значительные размћры: авторъ даетъ больше подробностей и охватываетъ періодъ отъ первыхъ начатковъ химіи на Руси вплоть до нашихъ дней. Трудъ академика П. И. Вальдена, такимъ образомъ, выросъ до размћровъ книги Ладенбурга.
Книгоиздательство надћется, что русскій читатель съ интересомъ отнесется къ появленію перваго значительнаго труда по исторіи химіи въ Россіи, не поставивъ издательству въ упрекъ получившейся, по указаннымъ причинамъ, нћкоторой неоднородности двухъ частей предлагаемаго изданія, и не посћтуетъ на присоединеніе къ книгћ проф. А. Ладенбурга труда, принадлежащаго столь компетентному перу, какъ перо академика П. И. Вальдена.
Книгоиздателъство Матезисъ.
Одесса. декабрь 1916.
| {VI} |
Предлагая настоящія лекціи вниманію широкой публики, я считаю необходимымъ указать свою точку зрћнія. Я смотрю на эти лекціи, какъ на попытку прослћдить развитіе современныхъ идей изъ прежнихъ.
При этомъ я началъ лишь съ эпохи Лавуазье потому, что благодаря этому изслћдователю наша наука получила новый обликъ, и можно смћло сказать, что мы еще и теперь переживаемъ тотъ періодъ развитія науки, начало которому было положено Лавуазье.
Содержаніе книги расположено такимъ образомъ, что оно даетъ изучающему, безъ большого труда съ его стороны, обзоръ указаннаго періода исторіи химіи. Вмћстћ съ тћмъ книга должна служить руководствомъ и для тћхъ, кто желаетъ углубиться въ спеціальныя историческія изслћдованія. Я старался поэтому быть, какъ можно, болће краткимъ, но зато даю вездћ довольно полный указатель источниковъ. Мнћ кажется, что я такимъ образомъ достигъ двоякой цћли: читателю непосредственно дается возможность судить о достоинствћ изложенія и исправлять ошибки и упущенія, и, кромћ того, облегчается работа будущимъ изслћдователямъ.
Считая почти невозможнымъ дать совершенно точную картину этой эпохи, столь богатой открытіями, я желалъ, по крайней мћрћ, дать пригодные матеріалы по исторіи химическихъ фактовъ и теорій.
Едвали нужно говорить о томъ, что предлагаемый небольшой трудъ никоимъ образомъ не претендуетъ на полноту. Я считалъ необходимымъ разсматривать только тћ изслћдованія и идеи, которыя оказывали вліяніе на развитіе науки. Относительно же прочихъ трудовъ, которые, по моему мнћнію, будутъ имћть такое вліяніе лишь въ будущемъ, я ограничиваюсь лишь упоминаніемъ. Мнћ казалось, что этого требуетъ объективное изложеніе предмета.
Я не побоялся прослћдить исторію развитія химіи вплоть до нашего времени, несмотря на то, что мой трудъ, вслћдствіе этого, {VII} значительно усложнился. Несомнћнно, что потребуется еще много исправленій раньше, чћмъ цћль будетъ достигнута. Вћдь главнћйшія фазы нашей науки будущимъ изслћдователямъ покажутся въ совершенно иномъ свћтћ! Однако, мнћніе современника тоже не лишено извћстной цћнности, особенно, если оно отличается умћренностью и свободно отъ предразсудковъ и тенденціозныхъ стремленій. Именно этого я и старался достигнуть. Но весьма возможно, что не всегда это удавалось мнћ. Быть можетъ, я въ различныхъ частяхъ книги недостаточно оцћнилъ заслуги однихъ и слишкомъ преувеличилъ заслуги другихъ; это происходило, во всякомъ случаћ, безъ предвзятаго намћренія. Можетъ быть, я иногда былъ слишкомъ суровъ въ своихъ сужденіяхъ, но никогда я при этомъ не руководствовался какой-либо личной непріязнью: я нападалъ всегда только на дћло, а не на личность. Если я въ нћкоторыхъ случаяхъ погрћшилъ противъ исторической правды, если я былъ несправедливъ къ тому или другому изслћдователю, то я готовъ исправить всякую свою ошибку, лишь только мнћ ее докажутъ.
Если мои коллеги заинтересуются содержаніемъ настоящей книги и пожелаютъ мнћ помочь своими знаніями и совћтами, то, можетъ быть, въ скоромъ времени окажется возможнымъ дать объективное изложеніе химическихъ теорій, возникшихъ въ теченіе послћднихъ ста лћтъ. На предлагаемый же трудъ я прошу смотрћть лишь, какъ на опытъ, къ которому нужно поэтому отнестись съ нћкоторымъ снисхожденіемъ.
А. Ладенбургъ.
Гейдельбергъ. Іюль 1869 г.
| {VIII} |
Если теперь, спустя почти 38 лћтъ послћ перваго изданія этой книги, я выпускаю ее четвертымъ изданіемъ, то дћлаю это не безъ нћкотораго чувства грусти.
При появленіи перваго изданія, въ 1869 г.; жили еще такіе великіе химики, какъ Либихъ, Вёлеръ, Бунзенъ, Кольбе, Кекуле, Дюма, Вюртцъ, Франкландъ и Вильямсонъ. Co всћми ими я лично былъ знакомъ, и нћкоторыхъ изъ нихъ я вправћ назвать своими учителями. Въ настоящее время ихъ уже нћтъ въ живыхъ, и за ними послћдовали еще и многіе изъ моихъ знаменитыхъ современниковъ, съ которыми я отчасти работалъ совмћстно: Фридель, Гримо, Бейльштейнъ, В. Мейеръ и др. У кормила стоитъ теперь новое поколћніе, мнћ лично большею частью незнакомое.
Вотъ причина того грустнаго чувства, съ которымъ я представляю эту книгу снисходительному суду своихъ коллегъ.
Иногда мнћ кажется, что развитіе нашей науки, протекавшее раньше спокойно и увћренно, приняло теперь быстрый и бурный темпъ. Можно думать, что поспћшность и стремительность, характеризующія современную жизнь, отразились также и въ наукћ. Такого рода движеніе особенно даетъ себя чувствовать историку, такъ какъ становится необыкновенно труднымъ сохранить объективность, выдћлить то, что имћетъ пребывающее и существенное значеніе для развитія науки. Но я считалъ всетаки нужнымъ и сообразнымъ съ характеромъ этой книги прослћдить развитіе химіи до настоящихъ дней, и, такимъ образомъ, возникла семнадцатая лекція.
Въ этой работћ мнћ помогли мои друзья и ученики, изъ которыхъ я чувствую потребность назвать д-ра Герца.
А. Ладенбургъ.
Бреславль, январь 1907 г.
| {1} |
Введеніе — Теорія флогистона — Ея первоначальное и позднћйшее значеніе — Научныя познанія флогистиковъ — Крушеніе системы.
Значеніе историческаго метода изложенія неоспоримо. Хотя оно мћняется въ зависимости отъ затрагиваемыхъ имъ областей, но во всякомъ случаћ исторія человћческихъ дћяній и знаній принадлежитъ къ наиболће интереснымъ изслћдованіямъ. Если мы причисляемъ себя къ послћдователямъ дарвиновской теоріи и признаемъ за нею право на болће широкое примћненіе, то ретроспективный взглядъ на минувшія столћтія пріобрћтаетъ для насъ особенное значеніе.
Именно, мы принуждены тогда признать, что развитіе человћчества совершается путемъ непрерывной эволюціи. Исторія, въ такомъ случаћ, не будетъ уже больше простымъ чередованіемъ отдћльныхъ фактовъ, случайно слћдующихъ другъ за другомъ въ хронологическомъ порядкћ, а явится школой развитія человћческаго духа и его культуры. Она намъ покажетъ результаты вліянія, оказываемаго разнообразнћйшими причинами на самые различные характеры, и, можетъ быть, она же насъ приведетъ когда-нибудь къ открытію законовъ, управляющихъ этими вліяніями. Нельзя отрицать, что съ этой точки зрћнія особенное значеніе пріобрћтаетъ развитіе современной культуры изъ состоянія предшествовавшаго и поэтому вполнћ понятенъ интересъ, проявленный всею мыслящей публикой къ „Исторіи цивилизаціи” Бокля.
Конечно, я не пойду такъ далеко и не стану настаивать на томъ, что для надлежащей оцћнки прошлаго необходимо стоять именно на этой точкћ зрћнія, но, во всякомъ случаћ, нельзя не признать, что знаніе само по себћ приноситъ человћческому духу извћстное удовлетвореніе и что, наконецъ, каждый старается извлечь изъ судебъ народовъ въ прошломъ урокъ для настоящаго. {2} Такимъ образомъ, даже самые рћшительные противники Дарвина принуждены допустить существованіе связи между главными чертами характера какого-нибудь народа и его судьбой. Они также должны приписывать успћхъ или неудачу великихъ предпріятій причинамъ и отношеніямъ матеріальнаго характера.
Можно утверждать, становясь на эту точку зрћнія, что историческое изложеніе какой-нибудь науки представляетъ интересъ, далеко выходящій за предћлы ея узкой спеціальности. Сравнительное изученіе исторіи всћхъ научныхъ дисциплинъ, можетъ быть, дастъ намъ возможность выяснить опредћленныя, общія направленія отвлеченнаго мышленія, преобладавшія въ отдћльныя эпохи и обязанныя, въ свою очередь, своимъ существованіемъ опредћленнымъ, реальнымъ условіямъ. Въ этомъ отношеніи для прошедшаго имћло особенно важное значеніе изученіе исторіи философіи, для нашего же времени, по моему мнћнію, такое же, если еще не бóльшее, значеніе имћетъ историческое изложеніе естественныхъ наукъ. Предметъ, подлежащій нашему разсмотрћнію, можетъ быть, когда-нибудь будетъ использованъ историкомъ человћческой мысли, какъ необходимый подготовительный трудъ.
Но если, сузивъ нашъ кругозоръ, мы спросимъ, какую пользу принесетъ данной наукћ историческое изложеніе ея развитія, или же, что еще интереснће, примемъ во вниманіе только выгоду отъ такого изложенія для изученія предмета и для лица, его изучающаго, то намъ придется разсмотрћть вопросъ еще и съ другой точки зрћнія, которая въ данномъ случаћ будетъ имћть рћшающее значеніе.
Именно, въ точныхъ наукахъ обзоръ прошлаго гарантируетъ правильное пониманіе всего, нынћ общепринятаго. Только знакомство съ теоріями предшествующими дастъ ясное и точное пониманіе нынћ господствующихъ, такъ какъ почти всегда между ними существуетъ внутренняя связь. Можно было бы думать, что въ нашей наукћ, гдћ послћднее слово всегда остается за опытомъ, прежнія теоріи, построенныя на весьма ограниченномъ числћ фактовъ, не только должны быть замћнены новћйшими, обнимающими бóльшее количество явленій, но что даже и память о нихъ можетъ свободно исчезнуть. Однако такое заключеніе въ бóльшей части случаевъ неправильно. Наоборотъ, чаще всего, слћдя за эволюціей идей, мы видимъ извћстную связь между различными гипотезами, слћдовавшими другъ за другомъ. При этомъ выясняется вліяніе болће раннихъ идей на позднћйшія, что приводитъ конечно къ болће правильному пониманію {3} этихъ послћднихъ. He всегда даже отреченіе отъ какой-либо теоріи сопровождается переворотомъ. Такой порядокъ врядъ ли былъ бы и мыслимъ при болће высокомъ развитіи науки. Всегда, когда прокладываются новые пути изслћдованія, въ нихъ возможно обнаружить слћды прошлаго.
Но если совершенно отвлечься отъ преимущества, которое дћйствительно дается изученіемъ исторіи и которое, по моему мнћнію, состоитъ въ болће глубокомъ пониманіи современнаго состоянія науки, то можно указать еще и на другую цћнность этого изученія, пожалуй, еще болће важную для учащагося. Именно оно способствуеть правильной оцћнкћ теорій. Взглядъ, брошенный на прошедшее, показываетъ, какъ мћняются мнћнія, и убћждаетъ насъ, что гипотезы, съ виду даже наиболће обоснованныя, со временемъ должны быть оставлены. Историческое изученіе приводитъ къ сознанію, что мы всегда находимся въ переходномъ состояніи, что наши нынћшнія идеи — не что иное, какъ предтечи другихъ, грядущихъ, которыя также не долго будутъ удовлетворять требованіямъ науки. Историческое изложеніе насъ учитъ, что законы природы не представляютъ собой абсолютныхъ истинъ или откровеній, но что ихъ надо считать лишь временнымъ выраженіемъ для опредћленнаго ряда фактовъ, которые приводятся такимъ образомъ въ наиболће цћлесообразную систему или, какъ мы говоримъ, объясняются. Мы убћждаемся, что эти законы не возникаютъ внезапно въ головћ одного лица, подобно Минервћ, вышедшей изъ головы Юпитера. Идеи, лежащія въ ихъ основаніи, зрћютъ лишь медленно, а необходимый фактическій матерьялъ былъ добытъ работою многихъ, пока, наконецъ, обобщающій данные факты законъ не былъ выведенъ однимъ лицомъ, иногда же одновременно нћсколькими. Кромћ того, изученіе исторіи способствуетъ умаленію нашей вћры въ авторитеты, вћры для науки вредной, препятствующей свободному развитію индивидуальности.
Правда, съ другой стороны мы узнаемъ, что теоріи необходимы для дальнћйшаго прогрессивнаго развитія, и хотя реальное содержаніе науки заключается въ фактахъ, тћмъ не менће свое дћйствительное интеллектуальное значеніе наука пріобрћтаетъ только вслћдствіе связи отдћльныхъ наблюденій посредствомъ гипотезъ; другими словами, что настоящее состояніе науки гораздо рћзче опредћляется способомъ истолкованія наблюденій, чћмъ самими этими наблюденіями. {4} .
Теперь, ознакомившись съ моей точкой зрћнія, которую я считаю существенной для изученія нашего предмета, вы поймете, почему я обращаю вниманіе, главнымъ образомъ, на теоріи и принимаю въ соображеніе только тћ экспериментальныя изслћдованія, которыя вызывали возникновеніе или паденіе основныхъ идей.
Древняя исторія химіи была подробно и превосходно изложена Германомъ Коппомъ, почему я ограничусь обзоромъ лишь послћднихъ ста тридцати лћтъ, т. е. новћйшаго періода химіи или, если вамъ угодно, вћка количественныхъ изслћдованій1). Но при этомъ я не могу обойтись безъ изложенія вкратцћ теорій, господствовавшихъ въ химіи до Лавуазье.
Всћмъ настолько извћстно вліяніе грековъ на искусство и литературу въ эпоху возрожденія, что неудивительно, если такое же вліяніе мы усмотримъ и въ области науки. Всћ вы знаете четыре элемента Эмпедокла, именно Воду, Землю, Огонь и Воздухъ, соотвћтствующіе четыремъ первоначаламъ ученія Аристотеля: Влажности, Сухости, Теплотћ и Холоду2). Я придаю особенное значеніе тому факту, что огонь былъ причисленъ къ элементамъ и разсматривался, какъ матерія. Какъ вы увидите впослћдствіи, первыя химическія теоріи относятся къ явленіямъ горћнія; теорія флогистона поэтому станетъ для васъ яснће, если вы ближе познакомитесь со взглядами грековъ и римлянъ. Они уже считали, что процессъ горћнія состоитъ въ выдћленіи огненной матеріи, а Плиній видитъ въ явленіи легкаго сгоранія сћры доказательство того, что въ ней содержится много этой матеріи3). Позже такой матеріей считалась сама сћра и вотъ откуда, несомнћнно, произошла гипотеза, что всћ металлы содержатъ сћру.
Этихъ замћчаній о химическихъ теоріяхъ древнихъ, кажется мнћ, вполнћ достаточно для того, чтобы вы поняли теорію Бехера и его ученика Сталя. Они опирались въ своихъ взглядахъ на идеи греческихъ и римскихъ философовъ и въ этомъ отношеніи они поступали такъ же, какъ въ томъ же XVII вћкћ многіе представители искусства, которые подражали античнымъ образцамъ.
Между тћми и другими можно было бы найти, конечно, нћкоторое отличіе, а именно: въ то время какъ послћдніе сознательно {5} и намћренно шли по стопамъ древнихъ, Бехеръ и Сталь называли себя противниками ихъ. Такъ, Бехеръ говоритъ: „хорошій перипатетикъ—плохой химикъ”. Онъ замћняетъ четыре элемента Эмпедокла тремя другими: стекловидной, горючей и ртутной землей4).
Я не буду трудиться надъ выясненіемъ, кто изъ двухъ, Бехеръ или Сталь, больше размышлялъ и работалъ надъ теоріей флогистона, но нельзя не указать на замћчательную скромность Сталя, отказывавшагося отъ своихъ собственныхъ заслугъ въ пользу своего учителя и друга Бехера. „Becheriana sunt quae profero”, говорилъ онъ5). Такіе примћры рћдки.
Приверженцы теоріи флогистона считали процессъ горћнія распаденіемъ: „только сложныя тћла могутъ горћть”. Всћ они содержатъ одинъ общій принципъ, который Бехеръ называетъ terra pinguis, a Сталь флогистономъ. При горћніи этотъ принципъ выдћляется, а другая составная часть горящаго тћла остается.
Эта теорія была примћнена ко всћмъ горючимъ тћламъ; такъ, по мнћнію Сталя, сћра состоитъ изъ сћрной кислоты и флогистона, металлъ—изъ флогистона и металлической извести, называемой нами теперь окисью металла. Сћра, по Сталю, не идентична флогистону, но, какъ и у Плинія, она очень богата этимъ принципомъ горћнія, который ему не былъ извћстенъ въ изолированномъ состояніи. Сажа казалась веществомъ наиболће богатымъ флогистономъ, т. е. почти чистымъ флогистономъ. Поэтому-то превращеніе металлической извести въ металлъ такъ хорошо и удавалось при нагрћваніи ея съ сажей. Флогистонъ послћдней переносился на известь, вслћдствіе чего вновь образовывался металлъ. Сталь старается доказать своимъ experimentum novum, что флогистонъ сћры и флогистонъ сажи тождественны. Онъ показываетъ, какъ посредствомъ угля можно превратить сћрнокислую соль въ сћрную печень, изъ которой затћмъ кислота осаждаетъ сћру. Изъ этого факта — возстановленія металлическихъ известей сажей — Сталь выводитъ заключеніе о тождественности флогистона металловъ съ горючимъ принципомъ сажи и сћры. Онъ и приходитъ, такимъ образомъ, къ выводу, что существуетъ только одинъ такой принципъ, названный имъ флогистономъ (отъ jlogistoV — горючій).
Впродолженіе цћлаго столћтія теорія флогистона лежала въ основаніи всћхъ химическихъ воззрћній. Однако мы сможемъ {6} убћдиться, что въ теченіе этого періода времени понятіе „флогистонъ” не всегда сохраняло свое первоначальное значеніе и что сообразно съ этимъ глубоко измћнялся и весь характеръ научныхъ взглядовъ.
Можно хорошо понять Сталя и его ближайшихъ послћдователей, если вездћ, гдћ они трактуютъ о поглощеніи флогистона, мы будемъ подразумћвать потерю кислорода и наоборотъ; тћло съ флогистономъ есть для насъ вещество, лишенное кислорода или же содержащее его очень мало, однимъ словомъ, можно было бы сказать, что флогистонъ это—отрицательный кислородъ.
Сталь заимствовалъ у древнихъ представленіе, что горћніе связано съ распаденіемъ; онъ оставался при своемъ мнћніи несмотря на то, что уже въ то время были извћстны опыты, указывавшіе на увеличеніе вћса при горћніи. Уже Геберу, алхимику VIII столћтія, удалось наблюдать нћчто подобное при опытахъ съ оловомъ и свинцомъ. Въ химической литературћ, предшествовавшей Сталю, можно найти неоднократныя подобныя же указанія. Въ особенности интересны наблюденія Жана Рея, Майова и Гука такъ же, какъ и заключенія, которыя они изъ нихъ вывели. Къ нимъ я вернусь въ слћдующей лекціи.
Неудивительно ли, что Сталь и Бехеръ, зная объ этихъ опытахъ, тћмъ не менће упорно отстаивали свои взгляды; что увеличеніе вћса они считали лишь случайнымъ, несущественнымъ явленіемъ? Что давало имъ основаніе игнорировать факты, которые должны были бы поколебать воздвигнутое ими зданіе? Быть можетъ, они находились подъ слишкомъ сильнымъ вліяніемъ авторитета древнихъ? Можетъ быть, само по себћ явленіе горћнія, именно образованіе пламени, внушало имъ идею, что этотъ процессъ неизбћжно сопровождается распаденіемъ? Но особенно страннымъ намъ кажется положеніе Бойля. Онъ былъ однимъ изъ замћчательнћйшихъ мыслителей XVII вћка, предшественникомъ Сталя, и принадлежалъ къ школћ Бэкона. По собственнымъ опытамъ онъ зналъ объ увеличеніи вћса при горћніи; онъ зналъ также, что воздухъ необходимъ для горћнія, и самъ же произвелъ опыты, доказавшіе, что при горћніи часть воздуха поглощается. Несмотря на все это этотъ самый Бойль не могъ рћшить, является ли сћрная кислота составной частью сћры или, наоборотъ, сћра входитъ въ составъ сћрной кислоты6). {7}
Среди послћдователей Сталя встрћчаются, правда, и такіе, которые обращаютъ значительно больше вниманія на увеличеніе вћса при горћніи. Въ концћ XVII вћка объ этомъ подробно трактуетъ Лемери7). Его вћра въ существованіе флогистона при этомъ не была поколеблена, но горћніе носило уже какъ бы двойственный характеръ: оно сопровождается разложеніемъ, такъ какъ горящее тћло теряетъ свой флогистонъ, но вмћстћ съ тћмъ это тћло соединяется съ нћкоторымъ вћсомымъ веществомъ огня. Лемери заимствуетъ такое предположеніе о вћсомомъ веществћ огня изъ того же источника, изъ котораго Бехеръ беретъ свою terra pinguis или Сталь свой флогистонъ: „элементъ огня” выступаетъ на сцену въ новой двойственной роли. Съ одной стороны, это принципъ горћнія, съ другой же, онъ—вћсомая матерія. Такимъ образомъ химики конца XVII вћка, по своему, удовлетворительно и всесторонне объяснили явленіе горћнія. Эти теоріи были поколеблены только Ньютономъ, не признавшимъ огонь самостоятельной субстанціей; онъ указывалъ, что каждое раскаленное и сильно нагрћтое тћло горитъ, что поэтому всякое раскаленное докрасна желћзо или дерево надо было бы называть огнемъ. По его мнћнію горятъ съ пламенемъ всћ тћла, дающія много дыма.
Гипотеза о вћсомости матеріи огня была признана лишь послћ въ высшей степени интереснаго опыта Бургаве, взвћшивавшаго однћ и тћ же металлическія массы въ раскаленномъ и холодномъ состояніи и установившаго тожественность ихъ вћса въ обоихъ случаяхъ8).
Увеличеніе вћса при горћніи вызывало расколъ въ мнћніяхъ среди химиковъ XVIII вћка. Когда они пытались объяснить это явленіе, то одни, какъ Сталь, смотрћли на увеличеніе вћса, какъ на несущественное обстоятельство, заслуживающее полнћйшаго пренебреженія; другіе, наоборотъ, и среди нихъ Бургаве, допускали соединеніе съ нћкоторыми (солеобразными) частицами воздуха и такимъ образомъ старались одновременно объяснить и необходимость присутствія воздуха при горћніи и увеличеніе при этомъ вћса. По мнћнію другихъ воздухъ служитъ лишь для воспріятія флогистона, который не могъ бы отдћлиться отъ одного тћла, еслибы не встрћтилъ какого-либо иного, съ которымъ онъ способенъ соединиться. Въ срединћ XVIII вћка возникаетъ идея, что флогистонъ {8} имћетъ отрицательный вћсъ, что онъ абсолютно легокъ. Защитникамъ этой теоріи казалось естественнымъ, что при выдћленіи флогистона вћсъ увеличивается. Другіе же такой абсолютной легкости не допускали и считали флогистонъ просто веществомъ болће легкимъ, чћмъ воздухъ. Эта идея въ особенности поддерживалась Гюитономъ де Морво9). Надо признаться, что его объясненіе увеличенія вћса, основанное на принципћ Архимеда, не говоритъ въ пользу ясности представленій знаменитаго химика. Онъ разсуждаетъ такъ: „Приведемъ въ равновћсіе на вћсахъ подъ водой два свинцовыхъ шара приблизительно одного вћса; затћмъ къ одной чашкћ вћсовъ подвћсимъ кусокъ пробки, предметъ болће легкій, чћмъ вода; тогда эта чашка со свинцовымъ шаромъ подымется вверхъ и будетъ казаться болће легкой, несмотря на то, что вћсъ ея очевидно увеличился. Подобное же происходитъ при горћніи, только здћсь взвћшиваніе происходитъ въ воздухћ; металлъ, соединеніе металлической извести съ флогистономъ, кажется легче извести, такъ какъ удћльный вћсъ флогистона точно такъ же, какъ и пробки, легче среды, въ которой мы производимъ взвћшиваніе”10). Я предполагаю, что вы поймете всю неправильность этого объясненія и въ этомъ отношеніи будете выше знаменитаго Маккера, считавшаго такое объясненіе достойнымъ удивленія. Еще Бойль замћтилъ, что удћльный вћсъ металлической извести меньше вћса металловъ, но Гюитонъ де Морво не принялъ этого во вниманіе.
Я, какъ вы видите, не побоялся показать всћ противорћчія въ теоріи флогистона и всю ея несостоятельность въ разрћшеніи вопроса объ увеличеніи вћса при горћніи. Однако, несмотря на всю туманность представленій, лежащихъ въ основаніи химическихъ теорій той эпохи, среди флогистиковъ было нћсколько ученыхъ, которыхъ по плодотворности ихъ открытій не можетъ превзойти почти никто изъ химиковъ современной эпохи. Это обстоятельство не даетъ ли основанія для нћкотораго общаго положенія? Можетъ быть, вы найдете правильнымъ слћдующее мое утвержденіе, именно, что ложныя теоріи не всегда вредятъ развитію науки; болће того, я беру на себя смћлость утверждать, что лучше имћть извћстныя теоретическія основанія, даже если они не въ состояніи объяснить всћхъ фактовъ, чћмъ считать эти послћдніе единственнымъ пріобрћтеніемъ, достойнымъ науки. Правда, факты {9} играютъ громадную роль при возникновеніи, какъ и при паденіи какой-либо теоріи, и они-то собственно и должны были бы одни имћть рћшающее значеніе.
Если мы теперь обратимся къ исторіи крушенія теоріи флогистона, то своевременно будетъ разсмотрћть, хотя бы въ общихъ чертахъ, свћдћнія и работы послћдователей этой теоріи.
Именно, ихъ наука состояла въ неполномъ, конечно, знакомствћ съ физическими и химическими свойствами цћлаго ряда тћлъ, находящихся въ природћ. Исходя изъ этихъ тћлъ, они выучились производить новыя соединенія и всћ ихъ стремленія были направлены къ открытію и изученію такихъ новыхъ веществъ. Поэтому мы уже встрћчаемъ у нихъ удивительное совершенство качественнаго анализа, который развился главнымъ образомъ благодаря трудамъ Бергманна; количественный же анализъ былъ имъ почти совершенно незнакомъ. Естественно, что теоретическія основанія того времени не позволяли придавать какое-либо значеніе вћсовымъ отношеніямъ.
Чтобы дать хотя бы поверхностный обзоръ извћстныхъ въ тћ времена тћлъ, я назову нћкоторыя изъ нихъ: сћра, уголь, золото, серебро, мћдь, желћзо, олово и свинецъ; всћ они были навћрное извћстны еще древнћйшимъ народамъ; открытіе ртути относится ко временамъ грековъ, средневћковью принадлежитъ честь открытія сурьмы, висмута и цинка, во время эпохи флогистона были открыты мышьякъ, фосфоръ, кобальтъ, никкель, платина и др. Шееле, изъ всћхъ теоретиковъ флогистона наиболће обогатившій химію открытіями, открылъ марганецъ и хлоръ. Металлическія извести, или, какъ мы ихъ теперь называемъ, окиси, считались всћми химиками того времени веществами, отличными другъ отъ друга, хотя Маккеръ думалъ, что возможно обьяснять это отличіе степенью болће или менће полнаго выдћленія флогистона. Такимъ образомъ, онъ предполагалъ, что всћ металлы содержатъ одну и ту же землистую составную часть11). Были извћстны еще землистыя вещества, которыя не причислялись къ металлическимъ известямъ, а именно: известь, глиноземъ и горькоземъ. Шееле открылъ еще баритовую землю. Они раздћляли щелочи на ћдкія и на мягкія (углекислыя); послћднія, по ихъ мнћнію, при поглощеніи огненной матеріи превращались въ первыя. Поташъ былъ употребляемъ еще въ древнћйшія {10} времена. Арабы умћли уже, по всей вћроятности, получать ћдкое кали изъ поташа и извести; селитра также была имъ извћстна и служила для приготовленія пороха. Сода употреблялась уже египтянами для выдћлки стекла12); но только Сталь нашелъ, что въ поваренней соли содержится щелочь, отличная отъ кали.
Изъ числа извћстныхъ въ то время кислотъ я назову: соляную, азотную, сћрную и уксусную; царскую водку употребляли еще арабскіе алхимики. Шееле значительно увеличилъ число органическихъ кислотъ. Онъ открылъ кислоты синильную, виннокаменную, яблочную, мочевую, молочную, лимонную, щавелевую и галловую; мы ему обязаны также открытіемъ плавиковой кислоты. Отсюда видно, какимъ большимъ количествомъ солей располагали въ флогистическій періодъ. Я не буду останавливаться на нихъ, а перейду къ изложенію того, что было извћстно въ то время о газахъ. Этотъ вопросъ оказывается интереснымъ особенно потому, что именно газы привели теорію флогистона къ паденію.
Долгое время различные газы считались тождественными съ воздухомъ, который считался элементомъ. Лишь въ срединћ XVII вћка ванъ Гельмонтъ впервые предположилъ возможность существованія различныхъ газовъ. Однако, отъ этого предположенія до опредћленнаго знанія, именно знанія газа, ясно отличнаго отъ воздуха, прошло опять-таки около цћлаго столћтія. Это объясняется, конечно, трудностью манипуляцій. Затрудненія, впрочемъ, были преодолћны и мы обязаны этимъ преимущественно англійскимъ химикамъ: Блэку, Кавендишу и Пристлею. Первый изслћдовалъ угольную кислоту, которая называлась „фиксируемымъ” воздухомъ. Онъ доказывалъ правильность раздћленія щелочей на ћдкія и мягкія. Его изслћдованіе было однимъ изъ самыхъ значительныхъ, относящихся ко времени господства теоріи флогистона. Въ немъ авторъ, какъ важнћйшій доводъ аргументаціи, выдвигаетъ, что впослћдствіи сдћлалъ и Лавуазье, вћсовыя отношенія. Кавендишъ изучалъ свойства водорода и, наконецъ, Пристлей открылъ кислородъ, закись азота, окись углерода, а также газы сћрнистой и соляной кислотъ, амміакъ и фтористый кремній.
Въ слћдующей лекціи я подробно изложу объ открытіи кислорода и сообщу о переворотћ въ наукћ, явившемся слћдствіемъ этого открытія. Теперь же ограничусь добавленіемъ нћкоторыхъ {11} подробностей относительно изслћдованія водорода, произведеннаго Кавендишемъ, именно я хочу указать на то измћненіе теоріи флогистона, которое этотъ ученый и нћкоторые другіе химики внесли на основаніи указаннаго изслћдованія.
Кавендишъ получалъ свой водородъ изъ желћза, олова или цинка, растворяя ихъ въ соляной кислотћ; онъ изучалъ его физическія свойства, констатировалъ, что онъ совершенно отличенъ отъ воздуха, и назвалъ его „air inflammable”. Способъ добыванія этого газа далъ Кавендишу основаніе объявить его тожественнымъ съ флогистономъ. To же уже сдћлалъ и Лемери13). Пристлей и Кирванъ развили дальше эту идею, причемъ первый опирался на свои собственныя наблюденія, что водородъ возстановляетъ металлическія извести14).
Теорія флогистона въ этомъ новомъ для нея видћ покоится главнымъ образомъ на слћдующихъ положеніяхъ: если на какой-нибудь металлъ дћйствовать разведенной кислотою, то онъ распадается на свободный флогистонъ (водородъ) и металлическую известь, растворяющуюся въ кислотћ. Если эта кислота концентрированная (азотная или сћрная кислота), то флогистонъ соединяется съ кислотою и образуется флогистированная сћрная или азотная кислота (сћрнистая или азотистая кислота). Такъ же просто объяснялись возстановленія водородомъ известей: происходитъ поглощеніе флогистона и соединеніе его съ известью, вслћдствіе чего возстановляется металлъ.
Такія идеи, которымъ нельзя отказать въ нћкоторой геніальности, были приняты почти всћми флогистиками того времени. Это былъ послћдній лучъ солнца, озарившій ихъ теорію. Тотъ самый человћкъ, который открылъ факты, придавшіе ей нћкоторую жизненность, произвелъ вскорћ новыя изслћдованія, приведшія ее къ паденію.
Теорія флогистона въ томъ смыслћ, въ которомъ ее толковали Кавендишъ и Кирванъ, была, вообще говоря, легко устранима. Она объясняетъ превращеніе металловъ въ ихъ извести при дћйствіи кислотъ. Однако, это превращеніе съ трудомъ мирилось съ самой теоріей флогистона въ ея начальномъ видћ и, кромћ того, совершенно не считалось съ явленіями настоящаго горћнія. Куда исчезаетъ флогистонъ, нынћ уже водородъ, при превращеніи металла {12} въ известь? Прежнее объясненіе Шееле15) состояло въ томъ что при горћніи сћры въ воздухћ этотъ послћдній вбираетъ въ себя флогистонъ и соединяется съ нимъ, вслћдствіе чего уменьшается объемъ воздуха. Такое объясненіе легко опровергалось, когда свойства флогистона (водорода) стали хорошо извћстны. Такимъ образомъ, теорія флогистона въ ея новой формћ стала менће примћнимой къ тому именно разряду явленій, для объясненія которыхъ она была вначалћ создана.
Число фактовъ, направлявшихъ эту теорію къ крушенію, увеличивалось изъ года въ годъ. Байенъ замћтилъ въ 1779 году, нћсколькими мћсяцами ранће открытія кислорода, что окись ртути при нагрћваніи превращается въ ртуть; откуда же явился флогистонъ, необходимый для этого превращенія? Байенъ понялъ важное значеніе своего опыта и призналъ окись ртути веществомъ, отличнымъ отъ другихъ, настоящихъ металлическихъ известей. Одновременно онъ замћтилъ, что потеря въ вћсћ при возстановленіи окиси ртути равна вћсу образовавшагося воздуха. Какъ вообще мало значенія придавали такому важному факту, показываетъ мнћніе Маккера, допускавшаго, что окисленіе и послћдующее затћмъ возстановленіе металла сопровождается уменъшеніемъ вћса. Еще позже, именно, когда Лавуазье уже началъ свои выступленія противъ теоріи флогистона, Маккеръ былъ смущенъ появленіемъ важныхъ открытій, несогласныхъ съ его теоріей, но увидћвъ, что они касаются только вћсовыхъ отношеній, онъ успокоился16).
Другіе химики думали, конечно, иначе, напримћръ, Тилле, который въ докладћ Парижской Академіи наукъ въ 1762 году вновь констатировалъ увеличеніе вћса при превращеніи свинца въ свинцовую окись; замћчая, что еще никто не объяснилъ этого поразительнаго факта, онъ надћется, что ближайшее будущее дастъ разрћшеніе этой загадки.
Послћ того какъ былъ выясненъ составъ воды, теорія флогистона не могла, по моему мнћнію, держаться дольше и должна была быть оставленна, такъ какъ появилась уже другая теорія, болће согласующаяся со всћми фактами.
Еще 10 или 12 лћтъ спустя можно было встрћтить защитниковъ доктрины Сталя. Это показываетъ, какъ трудно отдћлаться отъ господствующихъ взглядовъ и какъ люди отъ природы {13} консервативны. Приведенный примћръ долженъ былъ бы побудить насъ употребить всћ силы къ тому, чтобы стряхнуть съ себя вћру въ авторитеты въ вопросахъ научныхъ17).
Понадобилось много времени, чтобы взгляды Лавуазье проникли также и въ Германію. Наши предки боролись съ идеями, шедшими изъ революціонной Франціи, и только значительно позже, приблизительно къ 1795 году, научились они понимать все то, что до этихъ поръ отвергалось ими.
| {14} |
Переворотъ во взглядахъ на горћніе — Пристлей—Шееле—Лавуазье — Постоянство матеріи.
Въ періодъ времени 1774—1794 годовъ происходила борьба, имћвшая громадное значеніе для химіи; дћло шло не о чемъ иномъ, какъ объ освобожденіи мыслителей того времени отъ путъ, наложенныхъ на нихъ греческими философами; задача состояла въ томъ, чтобы послћдовательно проложить дорогу принципамъ экспериментальнаго и индуктивнаго метода изслћдованія. Необходимо было установить, что только экспериментъ и при опредћленныхъ условіяхъ произведенное наблюденіе могутъ быть положены въ основаніе всћхъ теоретическихъ выводовъ и умозрћній; надо было искоренить изъ человћческаго разума предразсудки, внћдренные и поддерживаемые господствовавшимъ впродолженіе вћковъ методомъ, который ставилъ на первый планъ умозрћніе, а наблюденіе заставлялъ примћняться, по мћрћ возможности, къ заранће конструированной системћ.
Упомянутый двадцатилћтній періодъ выдћлился не только рядомъ блестящихъ экспериментальныхъ изслћдованій, но кромћ того, онъ имћлъ также универсальное значеніе для химіи и главнымъ образомъ потому, что въ теченіе этого времени былъ установленъ и принятъ всћми новый принципъ. Этотъ принципъ, служащій основаніемъ всћхъ нашихъ химическихъ опытовъ, до такой степени связанъ съ нашими общими научными воззрћніями, что какое бы то ни было уклоненіе отъ него кажется намъ немыслимымъ и необходимы весьма большое напряженіе и крайняя объективность, чтобы понять научныя работы, лишенныя этого основанія.
Несмотря на то, что безчисленные опыты согласуются съ принципомъ нерушимости матеріи, мы тћмъ не менће должны быть вдвойнћ осторожны при установленіи подобнаго закона, лежащаго въ основаніи всћхъ нашихъ научныхъ взглядовъ; мы и въ этомъ {15} случаћ должны стараться избћгать слћпой вћры; нельзя смотрћть на законъ, какъ на нћчто абсолютно истинное, и, какъ бы намъ ни казалось затруднительнымъ что-либо научно созидать безъ него, мы все же не должны забывать, что, какъ и всћ законы, этотъ законъ также есть не что иное, какъ выраженіе наблюдаемыхъ фактовъ, что сами наши наблюденія не чужды ошибокъ и потому не должна исключаться возможность, что въ будущемъ разсматриваемый законъ можетъ быть отвергнутъ1).
Пока же слћдуетъ разсматривать его, какъ величайшее пріобрћтеніе химіи, какъ одну изъ самыхъ твердыхъ опоръ всћхъ естественныхъ наукъ. Съ утвержденіемъ этого закона начинается новая эра химіи, эра новћйшей химіи или нашей химіи. Вы поймете теперь, почему я хотћлъ бы обратить ваше особенное вниманіе на тћ годы, когда этотъ законъ былъ впервые формулированъ и испытанъ, и почему я даю детальное изложеніе опытовъ Лавуазье, которыми была доказана его справедливость.
Нћкоторые придерживаются взгляда, что кислороду, открытому въ то время, и притомъ вовсе не случайно, можно приписать реорганизующее и оживляющее вліяніе на нашу науку. Однако, какъ доказывается исторіей химіи, это не соотвћтствуетъ дћйствительности. Вћдь кислородъ открыли Шееле и Пристлей, реформаторомъ же химіи былъ Лавуазье. Я не могу устоять противъ желанія показать, какъ даже уже послћ открытія кислорода дћлались еще попытки къ сохраненію теоріи флогистона и какъ сами Шееле и Пристлей, его открывшіе, всячески старались согласовать поразительныя свойства этого газа со свойствами проблематичнаго флогистона.
Пристлей открылъ кислородъ 1-го августа 1774 года, онъ изолировалъ его и изучилъ его свойства, но нћсколько мћсяцевъ передъ тћмъ сдћлалъ то же открытіе Шееле2), такъ что первенство принадлежитъ ему. Во всякомъ случаћ, Пристлей опубликовалъ свои наблюденія раньше, чћмъ это сдћлалъ Шееле, поэтому обыкновенно и считаютъ, что именно первый открылъ кислородъ. Оба они пользовались почти одинаковымъ способомъ его полученія. {16} Этотъ газъ они добывали изъ окиси ртути, перекиси марганца, сурика, селитры и др. Лавуазье тоже написалъ статью о кислородћ, но Пристлей указываетъ, что онъ передъ тћмъ сообщилъ Лавуазье о своемъ открытіи3)4), но послћдній не упомянулъ объ этомъ. Весьма печально, но къ сожалћнію это, кажется, доказано, что Лавуазье неоднократно старался присваивать себћ заслуги другихъ. Я не останавливаюсь на этомъ подробнће, такъ какъ считаю это обстоятельство несущественнымъ для исторіи химіи. Личныя качества людей принадлежатъ ихъ эпохћ, исторію же интересуютъ ихъ творенія. Лавуазье искупилъ своею жизнью и содћянныя и не содћянныя имъ ошибки. Современники и осудили его. Потомство же должно вспоминать о немъ лишь съ уваженіемъ и удивленіемъ.
Насъ должно интересовать одно обстоятельство, именно, различныя концепціи, сложившіяся подъ вліяніемъ открытія кислорода у лицъ, его открывшихъ.
Пристлей былъ поклонникомъ случая. Онъ считалъ себя ему обязаннымъ своими величайшими открытіями5). Для него каждое новое изслћдованіе было новымъ источникомъ удивленія6). Онъ подробно описываетъ, какъ имъ былъ открытъ кислородъ и изучены его свойства. Пристлей находитъ, что въ этомъ газћ горћніе происходитъ лучше, чћмъ въ какомъ-либо другомъ, и признаетъ также, что воздухъ своими свойствами поддерживать дыханіе и горћніе обязанъ открытому имъ газу; онъ находитъ, что послћдній поглощается окисью азота, благодаря чему получается возможность опредћлять количество кислорода, находящагося въ газовой смћси. Но что же выводитъ Пристлей изъ всего этого и какъ объясняетъ онъ всћ эти явленія? По его мнћнію, при горћніи какого-нибудь тћла его флогистонъ долженъ освобождаться7), но для этого необходимо, чтобы при этомъ было другое тћло, съ которымъ флогистонъ могъ бы соединиться. Въ воздухћ горћніе возможно, слћдовательно воздухъ можетъ поглощать флогистонъ, но только до извћстной степени, такъ какъ {17} спустя нћкоторое время воздухъ не въ состояніи больше поддерживать горћніе: онъ уже насыщенъ флогистономъ. Въ кислородћ, открытомъ Пристлеемъ, тћла горятъ лучше, чћмъ въ воздухћ, такъ какъ это „дефлогистированный воздухъ”, т. е. воздухъ, лишенный флогистона; такое имя далъ Пристлей новооткрытому имъ тћлу. Воздухъ, лишенный флогистона, болће годенъ для воспріятія послћдняго, чћмъ обыкновенный воздухъ. Азотъ, который остается послћ поглощенія кислорода и который, какъ зналъ Пристлей, неспособенъ поддерживать горћніе и дыханіе, есть воздухъ, насыщенный флогистономъ, это „флогистированный воздухъ”. Для Пристлея существованіе кислорода не могло служить опроверженіемъ теоріи флогистона, защищавшейся имъ до конца жизни. Даже въ началћ XIX вћка, въ то время, когда большая часть химиковъ отказалась отъ нея, онъ изъ Америки, куда религіозные взгляды принудили его бћжать, пишетъ письма Парижской Академіи наукъ, въ которыхъ настоятельно проситъ опровергнуть его взгляды8). Это было нетрудно сдћлать, и хотя французское ученое общество отказалось, мы все же не можемъ не указать ошибокъ въ его взглядахъ.
„Если тћло горитъ въ воздухћ, то послћдній насыщается флогистономъ” — если мы сожжемъ въ воздухћ фосфоръ, то получимъ твердую фосфорную кислоту (или фосфористую кислоту) и азотъ, флогистированный воздухъ, остается; но если мы сожжемъ свћчу или уголь, то мы получимъ смћшанный съ угольной кислотой, прекращающій горћніе газъ, который отчасти можетъ поглощаться ћдкой щелочью; такимъ образомъ, мы здћсь получимъ флогистированный воздухъ съ другими свойствами, нежели предыдущій. Сожжемъ фосфоръ въ воздухћ, лишенномъ флогистона, и мы увидимъ, что никакого газа не останется,— насыщенный флогистономъ воздухъ исчезнетъ. Вы замћчаете здћсь противорћчія, къ которымъ привела система Пристлея, когда ее примћнили къ фактамъ, тогда извћстнымъ. Пристлей не признавалъ этого вслћдствіе ограниченности въ общемъ его химическихъ познаній9) и благодаря тому, что онъ не придавалъ никакого значенія результатамъ, достигнутымъ другими; кромћ того, разъ примкнувъ къ какимъ-нибудь взглядамъ, онъ ихъ всегда защищалъ съ чрезвычайнымъ упорствомъ.
Какіе же теоретическіе взгляды на кислородъ были у Шееле? Это былъ идеалъ химика-экспериментатора; онъ открылъ безчисленное {18} количество тћлъ и производилъ съ ничтожнћйшими средствами самыя трудныя изслћдованія. Онъ обладалъ такимъ даромъ наблюденія, что во всемъ громадномъ количествћ его работъ едва ли можно найти хоть одну ошибку; отъ вниманія Шееле не ускользаетъ, какъ это случается даже и въ настоящее время съ самыми искусными и старательными экспериментаторами, значительная часть явленій; онъ схватываетъ явленіе въ цћломъ, со всћми деталями, которыя подробно и разбираетъ; для него каждый новый опытъ являлся источникомъ замћчательныхъ открытій. Разсмотримъ же, какимъ идейнымъ прогрессомъ обязана ему наша наука? Я принужденъ, къ моему глубокому сожалћнію, признать, что прогрессъ этотъ очень невеликъ. Его главныя идеи были такъ смутны, что я лишь съ неохотой сообщу ихъ вамъ.
Шееле изложилъ свои взгляды главнымь образомъ въ небольшомъ трудћ „Воздухъ и огонь” (Luft und Feuer). Мы не можемъ ясно понять его идеи главнымъ образомъ потому, что онћ основаны на незнакомомъ намъ веществћ — флогистонћ, которому Шееле приписывалъ всевозможныя свойства, такъ что въ концћ концовъ, слћдуя за нимъ, мы то отожествляемъ его съ какимъ-нибудь знакомымъ намъ элементомъ, то ставимъ его на мћсто среды, извћстной у физиковъ подъ именемъ эќира. Иногда кажется даже, что Шееле соглашается съ гипотезой Кавендиша-Кирвана и подразумћваетъ подъ флогистономъ водородъ10), но въ такомъ случаћ съ этимъ не согласуются его многія другія воззрћнія. Въ общемъ, флогистонъ представляется ему весьма тонкой мало вћсомой субстанціей, которая, предполагаетъ онъ, проникаетъ сквозь стћнки сосудовъ. Онъ считаетъ кислородъ соединеніемъ воды съ гипотетической солеобразной матеріей11); это соединеніе содержитъ, по его мнћнію, лишь малое количество флогистона. При горћніи флогистонъ сгорающаго тћла выдћляется вмћстћ съ гипотетической субстанціей кислорода въ видћ теплоты и свћта, а другая составная часть горящаго тћла остается — напримћръ, металлическая известь, связанная съ водою кислорода. Водородъ для Шееле почти чистый флогистонъ, но содержащій небольшое количество той гипотетической субстанціи (теплоты), которая находится также и въ кислородћ. При горћніи водорода съ кислородомъ изъ послћдняго выдћляется вода, и къ водороду, соединенію флогистона съ небольшимъ количествомъ тепловой матеріи, {19} присоединяется тепловая матерія кислорода, образующая тогда теплоту и свћтъ. Такимъ образомъ, для превращенія водорода въ тепло и свћтъ требуется лишь присоединеніе къ нему вышеуказанной гипотетической субстанціи.
Идеи Шееле находились въ противорћчіи со всћми вћсовыми отношеніями, о которыхъ, впрочемъ, онъ мало заботился. По его мнћнію металлическая известь, напримћръ, вћсила меньше суммы вћса металла и употребленнаго кислорода, такъ какъ флогистонъ перваго въ связи съ тепловой матеріей второго выдћляется въ видћ тепла и свћта. Допускаемое Шееле существованіе вћсомой тепловой субстанціи, играющей большую роль въ его теоріяхъ, находилось въ противорћчіи съ прежними опытами Бургаве (см. стр. 7). По своимъ теоретическимъ взглядамъ Шееле принадлежалъ скорће къ химикамъ, поддерживавшимъ во что бы то ни стало доктрину Сталя, чћмъ къ ученымъ, свободнымъ отъ предубћжденій и искавшимъ лишь объясненія наблюдавшихся фактовъ. Я со всћмъ этимъ, однако, кончаю и тћмъ охотнће, что предполагаю теперь обратиться къ изученію взглядовъ и идей Лавуазье, понятныхъ каждому, такъ какъ они служатъ основаніемъ современной химіи.
He ждите отъ меня перечисленія и описанія всћхъ работъ этого геніальнаго изслћдователя: это превышаетъ требованія, предъявляемыя къ тому историческому обозрћнію, которое я намћреваюсь вамъ представить; но все же значеніе этого человћка среди его современниковъ было таково, что его изслћдованія заслуживаютъ спеціальнаго разсмотрћнія
Какія же особенности ставятъ работы Лавуазье выше работъ всћхъ химиковъ его времени? Это, конечно, то вниманіе, которое онъ обращалъ на количественныя отношенія, ставшія для него рћшающимъ критеріемъ явленій. Я нарочно напоминаю вамъ, что еще до Лавуазье Рей, а послћ него Гукъ и Майовъ обратили вниманіе на увеличеніе вћса при горћніи12). Теоретическіе взгляды формулированные ими, очень близки къ истинному толкованію явленія, но ближе всћхъ къ истинћ подошелъ Майовъ. Для него главнымъ условіемъ горћнія является присутствіе въ воздухћ Spiritus nitro-aereus (такое названіе должно напоминать намъ объ единовременномъ происхожденіи его и изъ селитры, и изъ воздуха), {20} который при превращеніи въ известь соединяется съ металломъ. По его мнћнію для процесса горћнія необходимы не только сгораемыя частицы, названныя имъ particulae sulphureae, но и присутствіе того spiritus nitro-aereus, поглощеніемъ котораго объясняетъ онъ прибавленіе вћса13). Какъ плохо прививались тогда подобные взгляды и какъ мало убћдительными они казались, видно изъ того, что появившаяся въ то время теорія флогистона встрћтила такое широкое признаніе.
Хотя Лавуазье и не могъ имћть притязанія на первенство объясненія процесса горћнія, все же онъ не заимствовалъ своего взгляда на это явленіе у вышеупомянутыхъ химиковъ, труды которыхъ были мало распространены и на которыхъ никто не обратилъ вниманія. Но преимущество Лавуазье надъ этими учеными заключается въ томъ, что онъ не только выразилъ мысль, способную послужить объясненіемъ нћкоторыхъ явленій, но и оправдалъ, съ вћсами въ рукахъ и посредствомъ ряда блестящихъ изслћдованій, широту принципа постоянства матеріи. Онъ доказалъ этимъ, что обладалъ не только наблюдательностью, но былъ глубокимъ мыслителемъ и настойчивымъ работникомъ, провћрявшимъ свои взгляды геніально придуманными опытами, изъ которыхъ онъ опять черпалъ новыя идеи.
Нельзя утверждать, по крайней мћрћ я не встрћчалъ этого въ его произведеніяхъ, что принципъ неразрушимости матеріи онъ считалъ аксіомой. Но Лавуазье призналъ правильность этого закона; если бы это не было такъ, то онъ не построилъ бы себћ для своей первой работы „О превращеніи воды въ землю” вћсовъ, по точности превосходившихъ всћ извћстные тогда этого рода инструменты. Считая свой принципъ вћрнымъ, онъ не предлагалъ признать его a priori; онъ хотћлъ доказать его фактами, а не словами и поэтому ждалъ подходящаго случая. Такъ же выжидалъ онъ удобнаго случая для нападенія на теорію флогистона, пока, наконецъ, не увидћлъ, что пришло уже время однимъ ударомъ перевернуть этотъ карточный домикъ, поддерживаемый лишь устарћвшими предразсудками. Поэтому-то лишь изрћдка въ своихъ произведеніяхъ онъ выражаетъ мысли, касающіяся этого основного вопроса, и то лишь тогда, когда надо привести доказательство идеямъ, не подкрћпленнымъ еще вполнћ законченными опытами. Напримћръ, въ первомъ сочиненіи Лавуазье {21} о водћ, состоящей, по его мнћнію, изъ кислорода и водорода, ему очень хочется доказать, что вћсъ ея равняется суммћ вћсовъ составляющихъ газовъ; это, однако, онъ не успћлъ еще подтвердить опытомъ; но, по его мнћнію, иначе и не можетъ быть, такъ какъ цћлое непремћнно должно равняться суммћ своихъ частей14), и при горћніи водорода ничего другого, кромћ воды, образоваться не 'можетъ. Собственно тогда шелъ сцоръ о пріоритетћ этого открытія, вполнћ справедливо приписываемаго Кавендишу, а не Лавуазье. Послћдній, какъ это видно изъ одного письма Благдена15) и изъ сообщенія Лапласа Ледюку16), зналъ уже о работћ Кавендиша, предшествовавшей произведеннымъ имъ опытамъ, и поспћшилъ опубликовать полученные имъ результаты. Такимъ образомъ мы узнаемъ о принципћ, выяснившемся ему уже давно, но воспринятомъ лишь немногими изъ химиковъ. Позже Лавуазье выражается весьма опредћленно: „Можно, говоритъ онъ, вещества взятыя и полученныя включить въ одно алгебраическое уравненіе, которое дастъ возможность вычислить какой-либо изъ членовъ, остающійся неизвћстнымъ”17). Это была первая идея того химическаго уравненія, которымъ мы ежедневно пользуемся. Очень ясныя и опредћленныя замћчанія были сдћланы Лавуазье относительно спиртоваго броженія. Онъ пишетъ: „ничто не создается ни при искусственныхъ, ни при естественныхъ операціяхъ, и можно принять за правило принципъ, что въ каждомъ процессћ въ начальный и конечный моментъ находится неизмћнное количество матеріи”18).
Однако, не будемъ опережать ходъ развитія идей этого великаго мыслителя, а прослћдимъ за нимъ, по крайней мћрћ хоть въ общихъ чертахъ, начавъ съ его первыхъ изслћдованій. Можно съ увћренностью сказать, что исторія е г о развитія есть исторія развитія химіи того времени.
Первая работа Лавуазье посвящена вопросу о превращеніи воды въ землю19); онъ доказываетъ неправильность этого мнћнія, тогда широко распространеннаго. Интересно прослћдить за нимъ въ этомъ его изслћдованіи. Онъ заключаетъ взвћшенное количество воды въ стеклянный сосудъ, извћстный тогда подъ именемъ пеликана, такимъ {22} образомъ устроенный, что изъ его горлышка выходитъ согнутая трубка. возвращающаяся въ расширенную часть сосуда. Онъ взвћшиваетъ сосудъ пустымъ и наполненнымъ водою, затћмъ взвћшиваетъ опять все, закрывъ сосудъ стеклянной пробкой. Послћ этого впродолженіе 100 дней онъ кипятитъ воду. Спустя мћсяцъ начинается уже образованіе земли, но Лавуазье продолжаетъ кипяченіе воды до тћхъ поръ, пока количество образовавшейся земли, по его мнћнію, не становится достаточнымъ. Тогда онъ опять взвћшиваетъ аппаратъ и констатируетъ, что въ сосудъ не проникла огненная матерія; въ противномъ случаћ, думаетъ онъ, вћсъ бы увеличился. Онъ открываетъ сосудъ, взвћшиваетъ вновь воду съ землей и находитъ ихъ вћсъ увеличеннымъ, тогда какъ вћсъ сосуда уменьшился. Это приводитъ его къ предположенію, что вода разъћла стекло и что образованіе земли происходитъ не отъ превращенія воды, а отъ разложенія стекла. Его выводы логически вытекаютъ изъ опытовъ; однако, онъ не слћпо слћдуетъ за ними. Онъ находитъ, что увеличеніе вћса воды на нћсколько грановъ превышаетъ уменьшеніе вћса стекла. Другой на его мћстћ сдћлалъ бы изъ этого выводъ объ образованіи матеріи. Лавуазье же объясняетъ это ошибкой опыта. Такое предположеніе для того времени могло показаться слишкомъ рискованнымъ, но оно свидћтельствуетъ, насколько его представленія были ясны и въ какой мћрћ онъ умћлъ подвергать строгой критикћ свои собственныя дћйствія. Всћ послћдующіе опыты подтвердили правильность сдћланнаго Лавуазье предположенія.
Почти въ то же время подобными же опытами былъ занятъ и Шееле20); онъ пришелъ къ подобнымъ результатамъ; но какое различіе въ способћ производства опытовъ у шведскаго химика и у Лавуазье! Шееле анализируетъ землю и находитъ, что она состоитъ изъ тћхъ же веществъ, что и стекло, въ которомъ согрћвалась вода.
Въ слћдующемъ сочиненіи Лавуазье изслћдуетъ вопросъ объ увеличеніи вћса при горћніи; уже въ 1772 году онъ представилъ Академіи наукъ въ запечатанномъ пакетћ докладъ, въ которомъ доказываетъ, что продукты, получившіеся послћ сгоранія фосфора и сћры, тяжелће ихъ самихъ. Онъ приписываетъ это поглощенію воздуха при горћніи, такъ какъ кислородъ не былъ еще тогда {23} открытъ21). Онъ производитъ также опытъ обжиганія олова въ закрытомъ сосудћ, взвћшенномъ до и послћ опыта22), и при этомъ не замћчаетъ никакого измћненія въ вћсћ, изъ чего заключаетъ, что не произошло поглощенія огненной матеріи. Далће Лавуазье доказываетъ, что металлъ въ вћсћ увеличился настолько, насколько воздухъ уменьшился.
Какъ только былъ открытъ кислородъ, Лавуазье повторяетъ опыты Пристлея и Шееле, но его выводы совершенно расходятся съ выводами этихъ двухъ химиковъ; онъ былъ подготовленъ къ этому открытію, и оно становится для него основаніемъ новой теоріи. Онъ тотчасъ же признаетъ кислородъ составной частью воздуха, при горћніи соединяющейся съ горящимъ тћломъ, и называетъ его „air eminemment pur”. Въ упомянутомъ сочиненіи Лавуазье доказываетъ, что углекислый газъ есть соединеніе угля съ этимъ „air pur” и что послћдній содержится также и въ селитрћ23). Спустя нћкоторое время, въ 1777 году, онъ устанавливаетъ полную теорію горћнія24). Лавуазье говоритъ:
1) При каждомъ горћніи развиваются теплота и свћть.
2) Тћла горятъ только въ чистомъ воздухћ (air eminemment pur).
3) „Чистый воздухъ” поглощается при горћніи, и увеличеніе вћса горћвшаго тћла совершенно равно уменьшенію вћса воздуха.
4) Горящее тћло обыкновенно, соединяясь съ „чистымъ воздухомъ”, превращается въ кислоту; при тћхъ же условіяхъ металлы превращаются въ металлическія извести.
Послћднее положеніе, значеніе котораго выяснится впослћдствіи при разсмотрћніи теоріи кислотъ, Лавуазье старается доказать въ статьћ о составћ азотной кислоты25). Тамъ онъ указываетъ на количество кислорода, содержащагося въ ней, а не на количество азота, ему еще неизвћстнаго, такъ какъ лишь нћсколько лћтъ спустя, въ 1785 году, Кавендишъ установилъ составъ азотной кислоты, пропуская черезъ смћсь азота и кислорода рядъ электрическихъ искръ26).
Лавуазье доказалъ затћмъ, что угольная кислота состоитъ изъ углерода и кислорода, сћрная кислота — изъ сћры и кислорода, фосфорная кислота — изъ фосфора и кислорода, азотная кислота —изъ „air nitreux” и кислорода. Далће онъ показываетъ, какъ при обработкћ {24} сахара азотной кислотой, т. е. при доставленіи ему кислорода, получается кислота. Изъ этого онъ заключаетъ, что въ составћ дефлогистированнаго воздуха Пристлея долженъ находиться окисляющій принципъ (principe acidifiable — principe oxygine27). Ha основаніи всего изложеннаго онъ считаетъ, что всћ кислоты состоятъ изъ одного основанія, радикала, и этого окисляющаго начала. Его же „air pur”, „чистый воздухъ”, содержитъ, кромћ окисляющаго принципа, еще и тепловую матерію (matiere de chaleur). Слћдуетъ отмћтить, что и Лавуазье также говоритъ объ „огненной матеріи” — выраженіе, замћненное имъ впослћдствіи словомъ „calorique”, значеніе котораго я вамъ постараюсь выяснить.
„Огненная матерія” вћса не имћетъ. Лавуазье доказываетъ это, сжигая фосфоръ въ закрытыхъ сосудахъ, при этомъ происходитъ освобожденіе теплоты, но нћтъ никакой потери вћса28). Далће онъ замораживаетъ воду также въ закрытомъ сосудћ, но и въ этомъ случаћ не находитъ никакого измћненія въ вћсћ, а такъ какъ онъ знаетъ изъ своихъ собственныхъ опытовъ, что при изучаемомъ явленіи выдћляется теплота, то и считаетъ себя въ правћ заключить, что она не имћетъ вћса. Вы получите болће точное понятіе о томъ, что Лавуазье называетъ „matiere du feu”, если я приведу его взгляды на строеніе матеріи, извлеченные мною изъ его сочиненія „Reflexions sur le phlogistique”29). По его мнћнію матерія состоитъ изъ мельчайшихъ частицъ, между собой не соприкасающихся, иначе нельзя было бы объяснить сокращеніе объема при охлажденіи30). Между частичками находится теплородъ. Чћмъ болће нагрћто тћло, тћмъ больше теплорода оно содержитъ. Но тћла при одинаковомъ повышеніи температуры не поглощаютъ равнаго количества теплоты. Это Лавуазье доказалъ, произведя совмћстно съ Лапласомъ изслћдованія удћльной теплоты различныхъ тћлъ31). Но я не могу останавливаться на этихъ опытахъ такъ же, какъ и на опытахъ опредћленія теплоты горћнія32). Лавуазье знаетъ, что ледъ, по мћрћ поглощенія теплоты, превращается сперва въ воду, а затћмъ въ паръ. Поэтому-то въ газахъ должно содержаться наибольшее количество „теплорода”. Вслћдствіе этого становится яснымъ, когда онъ говоритъ, что его „air eminemment pur” состоитъ изъ окисляющаго принципа и теплорода. При горћніи первый соединяется съ {25} горящимъ тћломъ, а теплородъ, освобождаясь, производитъ теплоту и свћтъ.
Слћдующее положеніе прекрасно характеризуетъ точку зрћнія Лавуазье33): „Теплота есть результатъ невидимыхъ движеній молекулъ; она измћряется суммой произведеній изъ массъ на квадраты скорости”. Но вћдь это вполнћ совпадаетъ съ основнымъ положеніемъ механической теоріи теплоты. Также имћютъ очень большое значеніе, хотя они и не совсћмъ правильны, его взгляды на освобожденіе теплоты при горћніи. Онъ говоритъ34): „Если твердое тћло (фосфоръ) сгораетъ въ газћ (кислородћ) и продуктъ горћнія будетъ твердымъ, то образованіе свободной теплоты объясняется тћмъ сгущеніемъ, которое претерпћваетъ газъ, превращаясь въ это твердое состояніе”.
Если же продуктъ сгоранія — тћло газообразное (угольная кислота), то образованіе свободной теплоты Лавуазье старается объяснить измћненіемъ удћльной теплоты. Наибольшее выдћленіе теплоты, по его мнћнію, наблюдается, когда при соединеніи двухъ газовъ получается твердое тћло.
Насколько правильно Лавуазье умћлъ примћнять эти свои основныя положенія, видно изъ того, какъ онъ объяснялъ охлажденіе, наблюдаемое при раствореніи солей въ водћ. Онъ такъ же, какъ и мы, допускаетъ, что измћненіе аггрегатнаго состоянія является причиной поглощенія теплоты35). Далће онъ показываетъ, что выдћленіе теплоты при смћшеніи сћрной кислоты съ водой сопровождается уменьшеніемъ объема. Максимумъ этихъ обоихъ явленій совпадаетъ и, такимъ образомъ, здћсь теорія согласуется съ опытомъ. Но не будемъ слишкомъ углубляться въ эти теоріи, относящіяся частью къ области физики, а вернемся къ работамъ чисто химическимъ.
Лавуазье былъ сторонникомъ того опредћленія понятія „элементъ”, которое принадлежало Бойлю36) и котораго мы сейчасъ придерживаемся. Для него элементомъ является каждое вещество, которое нельзя болће разложить37). Гельмгольтцъ выяснилъ значеніе этого опредћленія и опредћлилъ важность именно такого понятія объ элементћ при изученіи всћхъ естественныхъ наукъ38). {26}
Лавуазье первый сталъ считать металлы простыми тћлами. Въ обширной статьћ онъ опровергаетъ39) господствовавшій въ то время взглядъ, что металлы содержатъ флогистонъ. Эти интересныя изслћдованія, уничтожившія господствовавшія раньше системы, появились лишь къ концу его короткой, но блестящей научной карьеры; въ началћ ея онъ не могъ дать объясненія цћлому ряду явленій, со гласующихся съ теоріей флогистона Кирвана. Я имћю въ виду реакцію между металлами и кислотами, выдћленіе при этомъ водорода и реакціи возстановленія, произведенныя Пристлеемъ съ помощью этого газа. Лишь послћ того какъ Кавендишъ, Ваттъ и самъ Лавуазье40) установили составъ воды, Лапласу пришла идея, какъ объ этомъ упоминаетъ Лавуазье41), что при раствореніи металла въ кислотћ вода разлагается, водородъ выдћляется, а кислородъ, соединясь съ металломъ, образуетъ окись. Послћ этого редукціонныя явленія становятся ясными: водородъ съ кислородомъ окиси металла соединяются въ воду, а металлъ остается. Лавуазье старается доказать всћ эти положенія рядомъ блестящихъ опытовъ; въ осо бенности же интересны его изслћдованія, касающіяся разложенія воды42). Онъ проводитъ водяные пары черезъ раскаленныя желћзныя опилки, заранће взвћшенныя, и собираетъ водородъ въ эвдіометръ. Затћмъ онъ снова все взвћшиваетъ: воду, водородъ и ставшее болће тяжелымъ желћзо. Такимъ образомъ ему удается опредћлить количественный составъ воды, что, вмћстћ съ опредћленіемъ количественнаго состава угольной кислоты, произведеннымъ имъ немного позже43), является исходнымъ пунктомъ его работъ по анализу органическаго вещества44).
Прошу у васъ позволенія упомянуть о нћкоторыхъ деталяхъ, касающихся этихъ опытовъ. Если даже найденныя имъ числа не совсћмъ точны, то самые методы имћютъ такое большое значеніе, что я не могу обойти ихъ молчаніемъ.
Въ колоколъ, установленный надъ ртутью и содержащій измћренный уже объемъ кислорода, Лавуазье помћщаетъ чашку, въ которой находится взвћшенный кусокъ угля, слћды фосфора и трутъ. Посредствомъ согнутаго раскаленнаго желћзнаго стержня зажигается {27} фосфоръ, въ свою очередь зажигающій сперва трутъ, а затћмъ и уголь. Послћ того какъ уголь сгораетъ, Лавуазье вынимаетъ чашку, снова взвћшиваетъ и такимъ образомъ находитъ вћсъ сгорћвшаго угля; тогда онъ измћряетъ объемъ газа въ колоколћ, затћмъ поглощаетъ ћдкимъ кали угольную кислоту и снова измћряетъ остающійся газъ. Этимъ путемъ онъ опредћляетъ объемы образовавшейся угольной кислоты и поглощеннаго при горћніи кислорода, т. е. всћ данныя, необходимыя для вычисленія состава угольной кислоты.
Выяснивъ его, Лавуазье уже могъ пользоваться имъ, когда производилъ анализъ органическихъ тћлъ: виннаго спирта, масла и воска. Уже до того онъ убћдился, что при горћніи этихъ веществъ образуются лишь вода и угольная кислота; на основаніи этого онъ вполнћ правильно заключилъ, что они состоятъ только изъ углерода, водорода и кислорода. Для опредћленія ихъ количественнаго состава Лавуазье употребляетъ аппаратъ, сходный съ вышеприведеннымъ. Подъ колоколъ онъ помћщаетъ спиртовую лампу, которую до и послћ опыта взвћшиваетъ; кромћ того, опредћляется еще количество образовавшейся угольной кислоты и поглощеннаго кислорода.
По этимъ даннымъ онъ можетъ вычислить составъ алкоголя.
Этимъ я закончу разсмотрћніе трудовъ Лавуазье. Я сдћлалъ лишь поверхностную оцћнку его заслугъ. Только послћ внимательнаго изученія его произведеній вы сможете получить ясное представленіе о его значеніи и понять, въ какой степени наша наука обязана его выдающемуся уму. О нћкоторыхъ областяхъ его дћятельности я даже не упомянулъ; такъ, напримћръ, я еще не сказалъ о его изслћдованіяхъ, касающихся дыханія. О нихъ всетаки надо сказать хоть нћсколько словъ. Уже Пристлей зналъ, что для дыханія необходимъ кислородъ45). Лавуазье же показалъ, какъ потребляется кислородъ для образованія въ легкихъ угольной кислоты и воды и какъ этотъ процессъ, который онъ съ полнымъ правомъ уподобляетъ горћнію, доставляетъ человћку необходимую для его существованія теплоту46). Онъ указываетъ, что выдћляемая угольная кислота беретъ свой углеродъ изъ крови, такъ сказать, изъ самого человћка, такъ что при дыхательномъ процессћ мы въ извћстной степени сами себя сжигаемъ и такимъ образомъ истребили бы себя, если бы питаніемъ не возстановляли сжигаемое нами. Далће {28} онъ доказываетъ особыми опытами, что наше дыханіе учащается при напряженной дћятельности, т. е. что при этомъ увеличивается потребленіе углерода. На основаніи этого онъ приходитъ къ выводу, что бћдный, а, слћдовательно, и принужденный работать, человћкъ потребляетъ болће углерода, чћмъ богатый и праздный, но что послћдній, благодаря несправедливому способу распредћленія имуществъ, свой менће значительный расходъ углерода, вслћдствіе лучшаго питанія, пополняетъ значительно скорће, чћмъ бћдный рабочій. Поэтому онъ предлагаетъ, чтобы общество своими установленіями исправило такой порядокъ вещей, облегчило бы судьбу бћднаго класса и сгладило бы по возможности соціальныя неравенства, происходящія, повидимому, изъ природныхъ основаній. Онъ заканчиваетъ это глубокомысленное разсужденіе слћдующими словами47).
„Нћтъ необходимости быть непремћнно должностнымъ лицомъ и состоять членомъ государственной организаціи, чтобы заслужить благодарность людей и заплатить дань своему отечеству.
Натуралистъ въ лабораторіи также можетъ исполнять патріотическія обязанности, онъ своими трудами можетъ уменьшать всевозможныя бћдствія и болћзни человћчества, увеличивать его благосостояніе и его счастье. Если бы ему только удалось какимъ-нибудь вновь добытымъ научнымъ способомъ продолжить хоть на нћсколько лћтъ, хотя бы на нћсколько дней среднюю продолжительность человћческой жизни, то онъ могъ бы надћяться заслужить имя благодћтеля человћчества”.
Современники плохо наградили Лавуазье за его усердную дћятельность — четыре года спустя, въ 1794 году, онъ былъ гильотинированъ по постановленію революціоннаго комитета.
| {29} |
Химическая номенклатура — Таблицы сродства — Взгляды Бертолле—Споръ о постоянствћ состава
Вы теперь понимаете, почему новая эра въ исторіи химіи начинается со времени Лавуазье и почему его называютъ реформаторомъ химіи; вы также уже знаете, каковы были теоретическіе взгляды до него и какими они стали ко времени его смерти. Лавуазье дожилъ до торжества своихъ идей; по крайней мћрћ, во Франціи онћ сдћлались общепринятыми и все болће завоевывали почву въ Англіи и Германіи, гдћ труды его были переведены. Можно съ увћренностью сказать, что съ начала XIX столћтія теорія флогистона исчезла изъ научныхъ трудовъ.
Лавуазье не только опровергъ старую теорію, но главная его заслуга заключается въ томъ, что на ея мћсто онъ установилъ новую; можетъ быть, будетъ полезнымъ привести здћсь наиболће существенныя ея положенія:
1. При всћхъ химическихъ реакціяхъ измћняется только форма матеріи, количество же ея остается неизмћннымъ. Поэтому можно изъ взятыхъ веществъ и полученныхъ продуктовъ составить алгебраическое уравненіе, которое позволяетъ вычислить какой-нибудь членъ его, если онъ неизвћстенъ.
2. При горћніи горящее тћло соединяется съ кислородомъ, и обыкновенно такимъ образомъ образуется кислота; при горћніи же металловъ образуются металлическія извести.
3. Всћ кислоты содержатъ кислородъ, соединенный, какъ онъ говоритъ, съ основаніемъ, или радикаломъ. Въ неорганическихъ тћлахъ это обыкновенно элементъ, въ органическихъ же онъ составленъ изъ углерода и водорода, иногда же содержитъ фосфоръ или азотъ.
Противопоставьте эти три положенія взглядамъ флогистиковъ и другимъ теоріямъ, господствовавшимъ до Лавуазье, и вы поймете {30} значеніе реформы, произведенной имъ въ нашей наукћ. Благодаря ему совершенно измћнилось химическое мышленіе и найденные до того времени факты предстали въ совершенно новомъ освћщеніи. Химики были принуждены для удобства пониманія излагать ихъ особымъ образомъ и вскорћ признали, что для новаго пониманія нуженъ также новый языкъ; такимъ образомъ, стала ощущаться потребность въ химической номенклатурћ.
Я обойду молчаніемъ попытки, сдћланныя для созданія общаго способа выраженія до того времени: онћ не привели къ результатамъ, заслуживающимъ вниманія; кромћ того, онћ были сдћланы въ то время, которое я могъ разсматривать здћсь лишь поверхностно. Все же надо упомянуть, что Бергманнъ неоднократно обращался къ французскимъ химикамъ съ предложеніемъ установить однообразіе въ наименованіи соединеній. Можетъ быть, побужденный этимъ Гюитонъ де Морво отправился въ 1782 году въ Парижъ, гдћ и представилъ Академіи наукъ проектъ химической номенклатуры. Этотъ проектъ содержалъ много новаго и хорошаго, но не могъ получить одобренія извћстнћйшихъ химиковъ того вреімени, такъ какъ онъ предполагалъ существованіе флогистона, тогда уже горячо оспариваемое Лавуазье. Но послћднему удалось убћдить Гюитона въ правильности своихъ взглядовъ. Гюитонъ согласился переработать свою систему, и въ 1787 году онъ издалъ въ сотрудничествћ съ Лавуазье, Бертолле, Фуркруа свою „Nomenclature chimique”. Я не могу обойти молчаніемъ этотъ трудъ въ виду того, что въ немъ уже содержатся принципы нынћшняго химическаго языка, и что онъ еще до сихъ поръ служитъ основаніемъ нашего способа выраженія. По крайней мћрћ, приведу изъ него самое существенное. Я принужденъ буду употреблять при этомъ иногда французскія слова, въ особенно тамъ, гдћ нельзя сдћлать точнаго перевода общепринятыхъ выраженій.
Тћла подраздћляются на элементы и на сложныя тћла. Къ первымъ причисляются всћ вещества, которыхъ еще не умћютъ разложить на болће простыя. Они подраздћлены на пять классовъ. Къ первому принадлежатъ наиболће распространенныя тћла, свойства которыхъ сами свидћтельствуютъ о невозможности дальнћйшаго разложенія. Къ нимъ относятся: 1) теплота (calorique), 2) свћтъ, 3) кислородъ, 4) водородъ, 5) азотъ. Ко второму классу причислены тћла, производящія кислоты, какъ, напримћръ, сћра, фосфоръ, углеродъ и др. Въ третій классъ входятъ металлы, въ четвертый— {31} земли, въ пятый — щелочи, которыя, какъ извћстно, тогда еще не были разложены. Названія веществъ, принадлежащихъ ко 2-му, 3-му и 4-му классамъ, остались, въ общемъ, неизмћненными; щелочи были названы: кали, натръ и амміакъ1). Всћ эти тћла, считавшіяся, за исключеніемъ амміака, простыми, авторы принципіально старались назвать лишь однимъ словомъ.
Дополненіемъ къ этимъ элементамъ служатъ радикалы; ихъ считали веществами разлагаемыми, но имћющими нћкоторое сходство съ простыми тћлами.
Далће слћдуютъ двойныя тћла, т. е. вещества, состоящія изъ двухъ элементовъ. Къ нимъ прежде всего принадлежатъ кислоты. По теоріи Лавуазье всћ онћ содержатъ кислородъ; ихъ наименованія состоятъ изъ двухъ словъ, изъ коихъ первое (acide), для нихъ всћхъ общее, указываетъ на ихъ кислое свойство; затћмъ слћдуетъ второе слово, специфическое названіе, происшедшее отъ вошедшаго въ ихъ составъ элемента или радикала. Такимъ образомъ, получились названія кислотъ: сћрной, угольной, фосфорной, азотной (acide sulfurique, carbonique etc). Двћ кислоты, содержащія одинъ общій элементъ или радикалъ, различаются окончаніемъ специфическаго наименованія; для кислотъ, менће богатыхъ кислородомъ, это окончаніе будетъ еих, напримћръ acide sulfureux, azoteux2) и т. д. (Примћчаніе: Въ русской терминологіи окончанію „eux” соотвћтствуетъ „истая”). Соляной кислотћ дано названіе „acide muriatique”, въ ней также предполагали присутствіе кислорода, который еще въ большемъ количествћ долженъ былъ содержаться въ хлорћ — acide muriatique oxygene3).
Совершенно такимъ же образомъ были составлены названія 2-ой группы двойныхъ тћлъ (основныхъ кислородныхъ соединеній)! для нихъ ввели общее названіе: окиси, къ которому прибавляли специфическое наименованіе, взятое въ родительномъ падежћ, напримћръ, окись цинка, окись свинца и т. д. (oxide de zinc, oxide de plomb). Остальныя двойныя соединенія раздћлены были на соединенія сћры, фосфора, углерода и др.; они получили классовыя названія: sulfures, phosphures. carbures... Соединенія металловъмежду собой были названы сплавами (alliages), но для соединенія ртути съ другимъ {32} металломъ удержано было наименованіе амальгамы (amalgames).
Изъ тройныхъ соединеній надо упомянуть только о соляхъ. Онћ получаютъ свое родовое наименованіе по кислотћ, содержащейся вънихъ: sulfates, nitrates, phosphates... Въ соляхъ, содержащихъ кислоты менће богатыя кислородомъ, окончаніе ate замћняется ite. Это наименованіе сопровождается именемъ основанія, напримћръ, sulfite de zinc, de baryte и т. д. (сульфитъ цинка, барія). Если у данной соли кислая реакція, то для ея обозначенія употребляется слово acidule (кислая соль) ; основныя же соли получаютъ названіе: sursature de base4) (пересыщенная основаніемъ). Въ тћ времена съ двойными солями были знакомы сравнительно мало. Принятыя для нихъ наименованія были не очень удобны, такъ, напримћръ, рвотный камень назывался „tartrite de potasse tenant d'antimoine”5).
Такимъповерхностнымъ обзоромъ вы, вћроятно, удовлетворитесь. Какъ извћстно, Берцеліусъ значительно развилъ этотъ зародышъ раціональной номенклатуры, и при обзорћ его времени я упомяну о нћкоторыхъ его поправкахъ и дополненіяхъ.
Если вы сравните современное состояніе науки съ состояніемъ ея, о которомъ я говорилъ въ предыдущей лекціи, въ эпоху Лавуазье, то вы сами сможете судить, какъ много изъ его взглядовъ еще удержалось. Теоріи Лавуазье, однако, во многихъ пунктахъ нуждались въ измћненіяхъ; нћкоторыя изъ нихъ пытались даже опровергнуть, но безуспћшно, такъ что пришлось къ нимъ снова вернуться. Такъ, напримћръ, его теорія кислотъ большинствомъ химиковъ въ настоящее время не признается, но надо помнить, что новые взгляды возникли лишь значительное время спустя послћ смерти Лавуазье. Я ихъ разсмотрю въ одной изъ послћдующихъ лекцій. Теперь же мы займемся другимъ; именно, интересны нападенія, которымъ подвергался Лавуазье; они въ концћ концовъ кончились для него благопріятно и имћпи даже большое значеніе, такъ какъ благодаря имъ было установлено строгое различіе между смћсями и соединеніями.
Требовалось рћшить вопросъ, во всћхъ ли отношеніяхъ возможно образованіе химическихъ соединеній или же тћла могутъ соединяться другъ съ другомъ лишь въ нћкоторыхъ опредћленныхъ {33} пропорціяхъ. Къ послћдней точкћ зрћнія примыкалъ и Лавуазье, какъ это видно изъ многихъ его сочиненій, и она, кажется, была принята современными ему химиками, какъ сама собой понятная, хотя вообще и не была доказана. Лишь въ 1803 году появился трудъ, который какъ по своему содержанію, такъ и по изложенію долженъ былъ произвести большую сенсацію въ научномъ мірћ. Въ этомъ трудћ, между прочимь, оспаривалось постоянство химическихъ отнОшеній на основаніи какъ теоретическихъ соображеній, такъ и экспериментальныхъ изслћдованій.
Трудъ, о которомъ я говорю, есть Statique chimique Бертолле. Но чтобы уяснить значеніе содержащихся въ немъ возраженій, необходимо изложить, хоть поверхностно, въ высшей степени интересныя общія теоретическія идеи Бертолле. Я извлекаю ихъ и изъ упомянутаго труда, и изъ нћкоторыхъ другихъ разбросанныхъ его статей, касающихся того же вопроса6).
Книга Бертолле всегда сохранитъ въ химіи свое значеніе главнымъ образомъ пот.ому, что основныя положенія, которььмъ онъ подчиняетъ всћ химическія реакціи,—принципы механики и физики; указанные принципы должны имћть значеніе и въ химіи. Если даже многіе выводы Бертолле съ опытами и несогласны и давно опровергнуты, то это обстоятельство нисколько не вредитъ основнымъ его взглядамъ.
Въ цћломъ трудъ Бертолле направленъ, главнымъ образомъ, противъ невћрныхъ взглядовъ на сродство тћлъ, господствовавшихъ въ то время, и противъ злоупотребленій, возникшихъ изъ такъ называемыхъ „таблицъ сродства”. Это были карты, на которыхъ тћла распредћлялись по предполагаемой степени ихъ сродства. Такого рода карты составлялись многими химиками. Первая изъ нихъ, относящаяся къ 1718 году, обязана своимъ происхожденіемъ Жоффруа7). Она состояла изъ различныхъ таблицъ, въ которыхъ тћла были расположены въ такомъ порядкћ относительно одного опредћленнаго тћла что соединенія послћдняго съ предшествующимъ разлагались послћдующимъ. Напримћръ, одна таблица для кислотъ содержала тћла, въ слћдующемъ порядкћ: твердыя и летучія щелочи, земли, металлы. Построеніе такихъ таблицъ было главнымъ занятіемъ химиковъ средины XVIII вћка; они исходили изъ того {34} неправильнаго взгляда, что сродство одного тћла къ другому не измћняется; только постепенно химики стали убћждаться въ ошибочности такого воззрћнія. Въ 1783 году Боме обращаетъ вниманіе на то, что сродство однихъ и тћхъ же тћлъ при обыкновенной температурћ и при очень высокой температурћ бываетъ различньшъ; кромћ того, имћетъ значеніе сухое и влажное состояніе, и поэтому для выраженія отношенія въ этихъ двухъ различныхъ условіяхъ каждаго вещества ко всћмъ другимъ требуется двћ разныхъ таблицы8). Разрћшеніе этой задачи взялъ на себя Бергманнъ9), и дћйствительно достойно удивленія, сколько невћроятнаго труда онъ положилъ на это дћло. Для каждаго вещества онъ составилъ двћ таблицы, въ которыхъ сопоставилъ отношеніе его къ каждому изъ остальныхъ 58 веществъ; эти послћднія, въ свою очередь, расположены были въ такомъ порядкћ, что предыдущее разлагаетъ соединеніе даннаго вещества съ послћдующимъ. Съ помощью такихъ таблицъ, казалось, можно было предвидћть теченіе всћхъ реакцій, поэтому онћ пользовались большой популярностью. Когда открывалось какое-нибудь новое тћло, тотчасъ же для него составлялась подобная таблица сродства. Лавуазье пользовался такими таблицами при изслћдованіи кислорода, но онъ при этомъ замћчаетъ, что по настоящему, слћдовало бы имћть отдћльную таблицу для каждаго градуса температуры10).
Впервые лишь Бертолле указываетъ на ошибку, допускаемую при построеніи такихъ таблицъ, и совершенно подрываетъ ихъ значеніе, установивъ принципъ, что дћйствіе вещества зависитъ отъ его массы.
Бертолле выяснилъ законы, регулирующіе образованіе химическихъ соединеній, главнымъ образомъ на соляхъ. Онъ признаетъ, что нейтрализація опредћленнаго количества основанія (или кислоты) сопровождается всегда однимъ и тћмъ же химическимъ эффектомъ, получаемымъ изъ произведенія сродства А на емкость насыщенія S (количество кислоты, необходимое для нейтрализаціи единицы вћса щелочи), поэтому получается:
AS = const.
|
A = |
const. S |
| {35} |
т. е. сродства двухъ кислотъ обратно пропорціональны ихъ ёмкостямъ насыщенія11). Этотъ выводъ противоположенъ правилу Бергманна12). По мнћнію Бертолле количество вещества Q, находяиіееся въ наличности, оказываетъ всегда совершенно одинаковое химическое вліяніе, которое пропорціонально произведенію количества этого вещества на его сродство. Это произведеніе онъ называетъ химической массой13). Для кислотъ, какъ указалъ Бертолле, химическая масса пропорціональна отношенію емкости насыщенія S къ наличному количеству вещества Q14). Ho эффектъ, вызванный сродствомъ, не зависитъ исключительно отъ химической массы; онъ видоизмћняется въ зависимости отъ степени плотности даннаго тћла, а слћдовательно и отъ условій опыта (давленія, температуры и т. д.). Что касается состоянія плотности матеріи, то, по мнћнію Бертолле, оно является слћдствіемъ двухъ противоположныхъ силъ: сцћпленія и упругости. Преобладаніемъ первой обусловливается твердое состояніе, преобладаніемъ второй газообразное; въ жидкости же эти двћ силы находятся въ равновћсіи. Если бы всћ кислоты находились въ одинаковомъ состояніи плотности, т. е. степень ея была бы одинакова, то сильнћйшей считалась бы та, наименьшее количество которой достаточно для насыщенія даннаго вћса основанія или, какъ мы теперь бы сказали, эквивалентъ которой наименьшій.
Бертолле примћняетъ эти основныя положенія къ простому и двойному разложенію. По его мнћнію, если къ раствору соли прибавить кислоту, то происходитъ распредћленіе основанія между двумя кислотами по мћрћ ихъ сродства, соотвћтственно ихъ химической массћ (masse chimique15). Въ растворћ, слћдовательно, находятся двћ соли и двћ кислоты, но это происходитъ дћйствительно лишь тогда, когда у обћихъ солей растворимость приблизительно одинакова; тогда получается равновћсіе, зависящее не только отъ силы кислотъ, но главнымъ образомъ отъ имћющагося количества ихъ. Онъ обращаетъ еще вниманіе на то, что нельзя доказать правильность этой точки зрћнія посредствомъ выпариванія и кристаллизаціи, потому что, какъ только количество воды станетъ недостаточнымъ для полнаго растворенія, то произойдутъ явленія, зависящія уже главнымъ образомъ отъ сцћпленія и {36} кристаллизаціонной способности, а слћдовательно и отъ различной растворимости вещества16).
Такъ, при смћшеніи азотнокислаго калія съ сћрной кислотой при кристаллизаціи выпадаетъ лишь сћрнокислый калій, какъ менће растворимый, тогда какъ по Бертолле въ растворћ находятся и азотнокислый, и сћрнокислый калій.
Если одна соль значительно болће растворима, чћмъ другая, то послћдняя и образуется въ большемъ количествћ, если же она совсћмъ нерастворима, то происходитъ не распредћленіе, но полное разложеніе. Такимъ образомъ Бертолле объясняетъ, напримћръ, полное осажденіе барія при дћйствіи на азотнокислый барій сћрной кислотой. Вслћдствіе нерастворимости соли она не входитъ въ реакцію, происходитъ непрерывное раздћленіе, продолжающееся до тћхъ поръ, пока весь сћрнокислый барій не осядетъ17).
Подобное же происходитъ съ летучими кислотами или основаніями; здћсь также происходитъ распредћленіе въ отношеніи masse chimique, но такъ какъ одна часть, напримћръ, угольная кислота, удаляется, то разложеніе идетъ до конца18).
Такимъ образомъ, только въ случаяхъ преобладанія сцћпленія (нерастворимость) или упругости (летучесть) можно наблюдать полное раздћленіе; гораздо чаще встрћчаются случаи частичнаго обмћннаго разложенія. По мнћнію Бертолле, напримћръ известковыя соли не вполнћ осаждаются щавелевой кислотой19).
Подобнымъ же образомъ смотрћлъ онъ и на двойное разложеніе. Въ этихъ случаяхъ, вообще, образуются четыре соли, и лишь тогда число ихъ ограничивается двумя, когда сцћпленіе или растворимость у нихъ совершенно различны.
Такова теорія, объясняющая такъ называемыя обратимыя реакціи. Къ нимъ прежде всего принадлежатъ различныя кристаллическія образованія, которыя можно получить изъ одной и той же смћси солей при различныхъ температурахъ, если эти соли обладаютъ растворимостью, весьма неравномћрно мћняющейся съ температурой. Бертолле приводитъ нћсколько относяицихся сюда примћровъ20), изъ которыхъ я упомяну объ одномъ. Если растворъ содержитъ ћдкій натръ, магнезію, сћрную и соляную кислоты, то при низкой температурћ, около 0°, изъ него выкристаллизовывается {37} глауберова соль, тогда какъ при выпариваніи получается хлористый натрій. Слћдовательно, при 0° сћрнокислый магній и хлористый натрій превращаются въ сћрнокислый натрій и хлористый магній, тогда какъ при высшихъ температурахъ происходитъ обратное.
Такимъ образомъ Бертолле считаетъ возможнымъ объяснить явленія, находящіяся, по мнћнію Бергманна, въ зависимости отъ сродства, при изслћдованіи „мокрымъ и сухимъ путемъ”. Такъ, напримћръ, растворенныя кремнекислыя соли разлагаются почти всћми кислотами, тогда какъ при прокаливаніи кремневая кислота вытћсняетъ большую часть кислотъ изъ ихъ солей.
Но Бертолле идетъ еще дальше: сцћпленіе опредћляетъ не только свойства образующагося соединенія, но также еще и отношенія, въ которыхъ происходитъ это соединеніе. Для него понятіе „химическое соединеніе” не связано съ представленіемъ о постоянствћ отношеній, какъ это уже было установлено. Онъ думаетъ, что химическія соединенія существуютъ во всевозможныхъ постоянно растущихъ отношеніяхъ21), и только особыя причины обусловливають постоянныя пропорціи; такой причиной можетъ быть, напримћръ, значительное уплотненіе при соединеніи, т. е. измћненіе сцћпленія составныхъ частей. Такъ кислородъ и водородъ соединяются въ опредћленномъ отношеніи лишь потому, что продуктъ горћнія, вода — жидкость, и потому возникающее сжатіе представляетъ слишкомъ большое препятствіе для образованія другихъ соединеній22). Но если при соединеніи не происходитъ совсћмъ или же происходитъ лишь малое измћненіе сцћпленія, то получаются соединенія въ перемћнныхъ отношеніяхъ. Какъ примћры таковыхъ, Бертолле приводитъ металлическіе сплавы, стекла и растворы. Онъ говоритъ, что въ этихъ случаяхъ границы опредћляются лишь количествами взаимныхъ насыщеній, но что въ этихъ границахъ возможно полученіе самыхъ разнообразныхъ отношеній23).
Вы замћчаете, что Бертолле причисляетъ растворы и сплавы къ соединеніямъ, и поэтому вамъ становится понятно, какъ онъ изъ среды ихъ могъ выдћлить соединенія съ измћняющимися отношеніями. Но еще болће замћчательно, что Бертолле и въ окисяхъ предполагаетъ измћняемыя отношенія. Въ одной изъ своихъ статей {38} о законахъ сродства24), гдћ рћчь идетъ объ осажденіи металловъ, онъ признаетъ, согласно со своими принципами, что оба металла распредћляютъ между собою кислородъ; поэтому, думаетъ онъ, здћсь получаются окиси, различныя по содержанію кислорода. Впослћдствіи онъ еще яснће развиваетъ свой взглядъ на этотъ вопросъ25) и говоритъ: „Я хочу теперь доказать, что количество кислорода въ окисяхъ зависитъ отъ тћхъ же условій, которымъ подчинены количественныя отношенія другихъ соединеній; что эти отношенія непрерывно измћняются, начиная съ той границы, гдћ соединеніе только становится возможнымъ, до другого крайняго предћла, гдћ оно достигаетъ послћдней возможной степени”. Сами же границы обусловливаются, по его мнћнію, отношеніями сцћпленія. To же самое думаетъ онъ относительно солей съ измћняющимся содержаніемъ основанія. Если осадить щелочью нерастворимое основаніе соли, то въ соединеніи съ нимъ осадится извћстное количество кислоты, и это количество Бертолле считаетъ измћняющимся26). Однимъ словомъ, по мнћнію Бертолле, соединенія въ постоянныхъ пропорціяхъ составляютъ исключеніе; правило же состоитъ въ томъ, что количества, въ которыхъ вещества соединяются, зависятъ отъ условій опыта.
Резюмируя еще разъ воззрћнія Бертолле, мы можемъ сказать, что сродство представлялось ему силой, идентичной тяготћнію27), проявленія ея только потому бываютъ разнообразнће, что эта сила приводитъ въ движеніе самыя молекулы и оттого дћйствіе ея находится въ зависимости отъ величины и формы частицъ. Примћняя эти принципы физики къ химическимъ реакціямъ, онъ приходитъ къ идећ о химической массћ, опредћляемой имъ, какъ произведеніе сродства на количество даннаго вещества. Химическое дћйствіе зависитъ отъ количества послћдняго и отъ силы сцћпленія тћла, т. е. отъ его растворимости, отъ его большей или меньшей летучести. Далће все это приводитъ его къ двумъ общимъ выводамъ: 1) таблицы сродства безполезны, такъ какъ въ нихъ сродство понимается, какъ нћчто постоянное, отъ физическихъ условій независящее; 2) существуютъ соединенія, составныя части которыхъ находятся въ отношеніяхъ измћняющихся и постоянно растущихъ.
Первое положеніе было принято всћми, и мы видимъ, что вскорћ послћ появленія „Statique chimique” Бертолле таблицы {39} сродства исчезаютъ. Напротивъ, второе положеніе горячо оспаривалось; въ особенности же противъ него возставалъ соотечественникъ Бертолле Пру. Такимъ образомъ возчикла знаменитая по лемика двухъ ученыхъ, замћчательная какъ глубиной ума, обнаруженной обоими противниками, такъ и изысканною учтивостью, соблюденною обћими сторонами.
Бертолле пользоваіся въ то время большимь значеніемъ въ ученомъ мірћ. Всћ по справедливости восторгались его проницательностью, проявленной въ столь высокой мћрћ при составленіи указанной книги, и потому вполнћ понятно, что нелегкая задача была оспаривать его взгляды, которые онъ выражалъ съ такой увћренностью и которые онъ пытался доказать опытными изслћдованіями. Впрочемъ, я долженъ кстати тутъ же замћтить, что именно экспериментальная часть его „Statique chimique” осгавляетъ желать многаго. Когда Бертолле утверждаетъ, что при прокаливаніи, т. е. при окисленіи металловъ кислородныя соединенія образуются въ сильно измћняющихся отношеніяхъ, то это объясняется тћмъ, что онъ анализировалъ прямо сырой продуктъ и не старался сперва убћдиться, что имћетъ дћло не со смћсью; большею же частью имћлъ мћсто именно этотъ случай. Если, кромћ того, вспомнить, на какой низкой ступени въ то время находился количественный анализъ, то легко понять, какъ Бертолле могъ прійти къ такимъ ошибочнымъ выводамъ.
Наоборотъ, Пру поступалъ очень осторожно; прежде чћмъ приступить къ анализу, онъ старался убћдиться въ чистотћ продукта, подлежащаго изслћцованію. Опредћленіе составныхъ частей онъ производилъ съ величайшей тщательностью. Такимъ образомъ ему удалось открыть гидраты окисей, остававшіеся до тћхъ поръ незамћченными и разсматривавшіеся, какъ окиси съ особымъ содержаніемъ кислорода28). Мы обязаны Пру изслћдованіями большинства металловъ; онъ публиковалъ ихъ обыкновенно подъ заглавіемъ „Faits pour servir a l'histoire”29). Сверхъ того онъ написалъ нћсколько очень пространныхъ статей о соединеніяхъ сћры и кислорода30), въ которыхъ доказываетъ, что многіе металлы образуютъ одну только окись, другіе же даютъ двћ, а въ случаћ полученія {40} трехъ окисей промежуточную окись можно считать соединеніемъ двухъ другихъ31). Онъ также старается доказать неправильность взгляда Бертолле относительно существованія соединеній сћры съ измћняющимся содержаніемъ ея. Во всћхъ этихъ трудахъ онъ подчеркиваетъ различіе между смћсями и соединеніями. „Соединенія, говоритъ онъ, какъ встрћчаемыя въ природћ, такъ и полученныя въ лабораторіи, характеризуются совершенно опредћленными пропорціями составныхъ частей”. Это pondus naturae, зависимое такъ же мало отъ произвола химика, какъ и законъ сродства, кото рому подчинены всћ соединенія32).
Но Бертолле отвћчаетъ также фактами; онъ изслћдуетъ углекислыя ицелочныя соли33) и находитъ, что при насыщеніи осно ванія угольной кислотой подъ давленіемъ получаются кристаллы, составъ которыхъ отличается отъ прежде извћстныхъ углекислыхъ солей. Онъ показываетъ, что эти же кристаллы отдаютъ при раствореніи и нагрћваніи угольную кислоту и превращаются въ соли опять другого состава. Онъ оспариваетъ факты, установленные Пру34), именно, что отъ дћйствія слћдовъ угольной кислоты на щелочный растворъ насыщаются только немногія молекулы, а остальныя остаются несоединенными. По мнћнію Бертолле подобный растворъ съ прибавленіемъ капли соляной кислоты выдћляетъ углекислый газъ, слћдовательно онъ содержитъ „souscarbonate” („подкарбонатъ”35), т. е., по его мнћнію, упомянутые слћды угольной кислоты распредћляются во всемъ количествћ основанія.
Бертолле, послћ возраженій и превосходныхъ работъ Пру, становится осторожнће и больше не настаиваетъ на томъ, что дћйствительно встрћчаются всевозможныя отношенія между кислородомъ и металлами. Ограничиваясь лишь немногими случаями, онъ все же утверждаетъ, что при изслћдованіи окисей свинца ему удалось изолировать четыре различныхъ степени окисленія, образующихся при нагрћваніи металла въ воздухћ36). Итакъ, хотя на одинъ шагъ, но онъ приблизился къ Пру. Однако борьба этимъ не кончилась. Бертолле по прежнему не желаетъ признавать того отличія смћсей отъ соединеній, которое было выдвинуто Пру. Онъ требуетъ точнаго опредћленія обоихъ понятій37). {41}
Ho Пру, конечно, не можетъ дать его; однако же, онъ указываетъ, какъ въ нћкоторыхъ спеціальныхъ случаяхъ смћси отдћляются отъ соединеній, и уже этимъ ему удается опровергнуть многое изъ утвержденій Бертолле. Я не могу, конечно, здћсь входить во всћ подробности этой полемики, но хочу лишь на одномъ примћрћ показать методы, которыми пользовался для своего доказательства Пру. Бертолле прежде утверждалъ, что при обработкћ ртути азотной кислотой получается цћлый рядъ окисей, въ которыхъ содержаніе кислорода непрерывно возрастаетъ, начиная отъ извћстнаго минимума38). Далће, онъ наблюдалъ, что эти окиси при дћйствіи соляной кислоты переходятъ въ два хлорида, и считалъ, что нерастворимость хлористой ртути заставляетъ ,,окиси покинуть тћ ступени шкалы, на которой онћ находятся, и перейти на ея края”39), Пру же думаетъ, что такого рода предположеніемъ оказывается слишкомъ много довћрія разуму окисей. Онъ показываетъ, что и сухимъ путемъ получаются только два хлорида, соотвћтствующихъ только двумъ существующимъ кислороднымъ соединеніямъ ртути, на которыя можетъ быть раздћлена смћсь Бертолле.
Такимъ образомъ, этотъ споръ, начатый въ 1801 году, продолжается до 1807 года; интересъ, вначалћ посвяицаемый ученымъ міромъ обоимъ противникамъ, къ этому времени значительно ослабћлъ. Авторитетъ Бертолле имћлъ такое значеніе, что принципъ, раньше считавшійся a priori правильнымъ, послћ его нападокъ сталъ сомнительнымъ въ глазахъ многихъ. Однако, работы Пру съ одной и Клапрота и Воклена съ другой стороны вновь вернули принципу довћріе. Возраженія Бертолле начали терять свое дћйствіе; онъ принужденъ былъ все въ болће широкихъ областяхъ признавать существованіе соединеній съ постоянными отношеніями, чего, впрочемъ, онъ никогда категорически не отрицалъ. Хотя еще въ 1809 году онъ считаетъ возможными40) соединенія съ измћняющимися пропорціями, но, держась этого взгляда, онъ стоитъ въ совершенномъ одиночествћ. Перетянула на вћсахъ чаша противниковъ, такъ какъ на ней собралось очень много вћскаго.
Стали извћстны, наконецъ, изслћдованія Рихтера (съ 1791 г. по 1800 г.); Дальтонъ предложилъ уже свою атомистическую теорію, начавшую стзновиться главнымъ основаніемъ {42} химическихъ воззрћній; были закончены классическіе опыты Гэ-Люссака относительно объемныхъ отношеній, въ которыхъ соединяются газы, и Берцеліусъ опубликовалъ свои первые важные труды. Все это было несовмћстимо съ взглядами Бертолле. Такимъ образомъ этотъ споръ окончился полнћйшимъ его пораженіемъ.
Я разсмотрћлъ этотъ предметъ детально, такъ какъ считалъ его очень важнымъ. Мы здћсь имћемъ дћло съ общимъ принципомъ, съ одной изъ основъ нашихъ теоретическихъ воззрћній. Онъ выясняетъ различіе между смћсями и соединеніями. Только къ послћднимъ примћнимы наши химическіе законы, смћси же имъ не подчинены. Въ нћкоторыхъ случаяхъ однако представляется очень важнымъ знать, съ какимъ родомъ тћлъ предстоитъ имћть дћло. Но каковъ же будетъ нашъ критерій?
Вы изъ учебниковъ знаете, что соединенія имћютъ однородный характеръ, тогда какъ смћси очень часто разлагаются, уже механически, на свои составныя части. Въ учебникахъ же далће говорится, что въ соединеніяхъ составныя части теряютъ свои свойства, тогда какъ въ смћсяхъ послћднія сохраняются. Въ заключеніе приводится, какъ отличительная черта соединеній, постоянство отношеній.
И на это послћднее обстоятельство я также хотћлъ обратить ваше вниманіе. Иногда бываютъ случаи, когда смћси по ихъ общимъ свойствамъ нельзя отличить отъ соединеній. Тогда мы для рћшенія вопроса прибћгаемъ къ анализу. Мы получаемъ вещество различными способами и смотримъ, соотвћтствуетъ ли ему всегда одинъ и тотъ же составъ. Такимъ образомъ мы поставили иначе вопросъ, вызвавшій разногласіе между Бертолле и Пру. Первый считалъ возможными соединенія съ измћняющимися пропорціями составныхъ частей, тогда какъ по мнћнію Пру тћла соединяются лишь въ немногихъ опредћленныхъ отношеніяхъ. Мы же назывaeмъ вещество соединеніемъ тогда, когда оно содержитъ свои составныя части въ неизмћнномъ отношеніи.
Я не знаю, достаточно ли ясно вы представляете себћ различіе этихъ двухъ точекъ зрћнія; чтобы оцћнить все значеніе этого вопроса, надо самому встрћтиться съ необходимостью рћшить, съ чћмъ имћешь дћло, со смћсью ли или съ соединеніемъ. Намъ все еще недостаетъ обицаго, подходящаго къ каждому случаю опредћленія, такого именно, какого Бертолле многократно требовалъ отъ {43} Пру. Для химическихъ соединеній у насъ, дћйствительно, имћются извћстные критеріи, какъ напримћръ, способность кристаллизоваться и опредћленная точка плавленія для твердыхъ тћлъ, постоянная точка кипћнія для жидкостей и т. д. Но всего этого часто недостаточно. Я лишь напомню вамъ явленіе изоморфизма, и вы должны будете со мной согласиться, что и смћси могутъ кристаллизоваться. Я упомяну о растворахъ въ водћ соляной кислоты, іодистаго водорода и т. п., которые, какъ доказалъ Роско, оказываются смћсями, но вы опять должны будете со мной согласиться, что и онћ также имћютъ постоянную точку кипћнія. Короче говоря, рћшеніе этого вопроса составляетъ наитруднћйшую и важнћйшую задачу. Часто, конечно, на нее обращается недостаточно вниманія. При изученіи химическихъ работъ вы часто можете имћть случай убћдиться, что именно вслћдствіе этого игнорированія и происходили многія ошибки. Сколько разъ уже устанавливались для веществъ формулы, изъ нихъ затћмъ выводились теоретическія заключенія, и все это дћлалось раньше, чћмъ несомнћнно убћждались, что эти вещества имћютъ характеръ соединеній. Все сказанное и имћло цћлью уберечь васъ отъ подобныхъ ошибокъ, поэтому вы мнћ должны простить это временное уклоненіе отъ моей темы.
| {44} |
Изслћдованія Рихтера — Атомистическая теорія Дальтона — Объемный законъ Гэ-Люссака — Гипотеза Авогадро — Эквиваленты Волластона
Я постараюсь изложить сегодня развитіе атомистической теоріи, поскольку она представляла интересъ въ научномъ отношеніи и въ какой мћрћ она развилась къ концу перваго десятилћтія XIX вћка. Въ мои расчеты не входитъ желаніе посвящать васъ въ гипотезы строенія матеріи, созданныя греческими и римскими философами. To обстоятельство, что Лейкиппъ и Демокритъ представляли себћ матерію построенной изъ мельчайшихъ частицъ и что впослћдствіи этотъ взглядъ подробно былъ развитъ Лукреціемъ, доказываетъ лишь давно, впрочемъ, извћстное, что среди грековъ и римлянъ были люди, во всћхъ отношеніяхъ сравнимые съ нашими мыслителями. Методъ, которымъ пользовались вышеупомянутые философы, былъ дедуктивный; они исходили изъ общихъ положеній, изъ которыхъ дћлали выводы, правда, не всегда совпадавшіе съ опытомъ; впрочемъ, этотъ послћдній былъ сравнительно невеликъ, особенно потому, что тогда почти не знали эксперимента, т. е. наблюденія при данныхъ условіяхъ. Поэтому и нельзя ставить Демокрита выше Канта, который, исходя изъ противоположнаго взгляда, именно изъ такъ называемой динамической гипотезы, быть можетъ, столь же логично конструировалъ міровой порядокъ. Но такая затрата ума и проницательности, наблюдаемая нами у представителей различныхъ направленій, была напрасной; имъ всћмъ недоставало матеріала — наблюденій, съ которымъ только и возможно рћшеніе подобныхъ вопросовъ.
Научное развитіе атомистической теоріи покоится именно на открытіи ряда фактовъ, благодаря ей связанныхъ другъ съ другомъ {45} и получившихъ простое объясненіе. Въ мою задачу входитъ познакомить васъ съ опытной стороной вопроса и изложить тћ химическія изслћдованія, которыя сдћлали необходимымъ принятіе атомистической теоріи и которыя, благодаря послћдней, приняли законченную форму.
Въ послћдней лекціи я уже разсматривалъ одинъ изъ такихъ законовъ химіи, именно законъ постоянныхъ отношеній, но его одного было недостаточно для атомистической гипотезы, необходимъ былъ еще одинъ законъ, именно законъ кратныхъ отношеній. Онъ былъ установленъ Дальтономъ въ 1804 году, т. е. еще до окончанія спора о постоянствћ отношеній, въ которыхъ соединяются тћла. Я намћренно не придерживался хронологическаго порядка, чтобы изложить чередованіе фактовъ въ ихъ логической послћдовательности. Законъ кратныхъ отношеній не имћетъ никакого смысла, пока не доказанъ законъ по стоянныхъ отношеній. Онъ можетъ существовать лишь рядомъ съ послћднимъ, въ немъ заключающимся. Вы, можетъ быть, будете удивлены, что законъ кратныхъ отношеній былъ формулированъ въ то время, когда еще возникали сомнћнія въ правильности предположеній о постоянствћ отношеній. Объяснено это можетъ быть тћмъ обстоятельствомъ, что Бертолле и Пру жили во Франціи, тогда какъ Дальтонъ сдћлалъ свое открытіе въ Англіи. Онъ воздержался съ опубликованіемъ своихъ изслћдованій до 1808 года, и до этого времени ученый міръ былъ освћдомленъ о полученныхъ имъ результатахъ лишь изъ краткаго сообщенія, помћщеннаго въ учебникћ химіи Томсона. Конечно, теорія Дальтона, получившая скоро большую извћстность, оказала рћшающее вліяніе на взгляды химиковъ того времени относительно постоянства отношеній. Нужно приписать отчасти трудамъ Рихтера, Дальтона и Волластона тотъ результатъ, что Бертолле, хотя прямо и не отказался отъ своихъ прежнихъ утвержденій, однако болће не пытался ужъ придавать имъ такое значеніе.
Очень можетъ быть, что Дальтонъ, какъ это утверждаетъ его біографъ Смитъ1), не зналъ ничего или же очень мало о работахъ Рихтера, которыя могли бы существеннымъ образомъ способствовать установленію атомистической теоріи; онъ могъ придти вполнћ самостоятельно къ идеямъ, оказавшимъ громадное вліяніе {46} на послћдующее развитіе химіи; но мы должны заняться разсмотрћніемъ всћхъ фактовъ, бывшихъ полезными для этой теоріи, и потому не должны оставить безъ вниманія предшественниковъ Дальтона.
Почти одновременно съ понятіемъ объ атомћ возникло и понятіе объ эквивалентћ; послћднее подготовило почву для атомистической теоріи и способствовало ея, въ общемъ, благопріятному пріему. Вслћдствіе этого я и намћренъ разсматривать оба понятія въ ихъ хронологическомъ порядкћ. Вы при этомъ увидите, что атомъ Дальтона возникъ независимо отъ эквивалента, но что именно Волластонъ пробовалъ первый замћнить послћднимъ. Это привело впослћдствіи къ отожествленію обоихъ понятій и оказало въ наукћ вредное вліяніе.
Первые опыты, которые могли привести къ возникновенію понятія объ эквивалентныхъ количествахъ, были произведены Бергманномъ во второй половинћ XVIII вћка”2). Этотъ ученый замћтилъ, что нейтральные растворы металловъ могутъ быть осаждены другими металлами, причемъ не получалось ни кислой реакціи, ни выдћленія газовъ. Какъ послћдователь теоріи флогистона, Бергманнъ объяснялъ эти явленія совершенно согласно съ основными ея положеніями. По его мнћнію, осажденный металлъ поглощаетъ столько флогистона, сколько его отдаетъ металлъ осаждающій. Бергманъ думаетъ, что такимъ образомъ онъ получаетъ возможность измћрять количества флогистона въ различныхъ металлахъ: количества раствореннаго и осажденнаго металловъ обратно пропорціональны предполагаемымъ количествамъ флогистона, содержащагося въ одинаковыхъ вћсовыхъ количествахъ обоихъ металловъ.
Лавуазье, нћсколько лћтъ спустя повторившій и расширившій опыты Бергманна3), признаетъ, что по его теоріи эти опыты даютъ количества кислорода, соединяющіяся съ равными вћсами металловъ. Тамъ, гдћ Бергманнъ говоритъ о поглощеніи флогистона, Лавуазье понимаетъ потерю кислорода и наоборотъ: обратное отношеніе количествъ осажденнаго металла А и раствореннаго В по Лавуазье не что иное, какъ отношеніе количествъ кислорода, соединенныхъ съ равными вћсами металловъ A и В; другими словами: количества осажденнаго металла и раствореннаго, опредћляемыя непосредственно опытомъ, способны соединяться съ равными количествами кислорода. Однако {47} ни Лавуазье, ни Бергманнъ не выразили этого положенія категорически въ данной формћ, иначе оно, по всей вћроятности, привело бы ихъ къ понятію объ эквивалентности. Этого не прои.зошло и на эти опыты было обращено мало вниманія. He лучшая судьба постигла и наблюденія Рихтера, относящіяся къ 1791—1802 годамъ и опирающіяся на значительно большее число изслћдованій. Рихтеръ первый высказалъ законъ нейтрализаціи и вывелъ изъ него правильныя заключенія4). Эту заслугу въ прежнее время несправедливо приписывали Венцелю, который пришелъ къ выводамъ, совершенно противоположнымъ. Эта ошибка, перешедшая во всћ старые учебники, обязана своимъ происхожденіемъ, кажется, Берцеліусу5) и была исправлена6) лишь значительно позже Смитомъ7). Заслуга же Венцеля состояла въ томъ, что онъ впервые выразилъ основное гюложеніе теоріи сродства (см. 16 лекцію).
Рихтеръ замћтилъ, что при смћшеніи двухъ нейтральныхъ солей нейтральность сохраняется, хотя бы даже происходило двойное разложеніе, и отсюда онъ дћлаетъ выводъ, что количества а и b двухъ основаній, нейтрализованныхъ опредћленнымъ количествомъ с кислоты, насыщаются однимъ и тћмъ же количествомъ d другой кислоты и что, наоборотъ, вћсъ двухъ кислотъ, насыщенныхъ количествомъ основанія а, требуетъ для нейтрализаціи то же самое количество b другого основанія. Замћчателенъ способъ выраженія, употребляемый Рихтеромъ. Онъ говорилъ8): „Пусть Р будетъ масса детерминирующаго элемента, a a, b, c, d, e и т. д. массы детерминируемыхъ имъ элементовъ; Q пусть будетъ массой другого детерминирующаго вещества и α, β, γ, δ, ε и т. д. массы детерминируемыхъ имъ элементовъ, такимъ образомъ, что а и α, b и β, с и γ, d и δ, е и ε обозначаютъ въ каждый данный моментъ элементы одного рода; тогда наблюдается, что нейтральныя массы P + а и Q + β, Р + b и Q + γ, Р + c и Q + α разлагаются {48} двойнымъ сродствомъ такъ, что полученные продукты также нейтральны и массы a, b, c, d, e и т. д. между собой находятся въ томъ же количественномъ отношеніи, что и массы α, β, γ, δ, ε, или же наоборотъ”.
Я долженъ прибавить, что Рихтеръ подъ детерминирующими и детерминируемыми элементами понималъ количество кислотъ и основаній, взаимно нейтрализующихся. Рихтеръ сумћлъ вћрно оцћнить важность своего положенія. Онъ замћчаетъ:9) „Это положеніе послужитъ настоящимъ пробнымъ камнемъ для опытовъ, касающихся отношеній, нейтрализаціи, такъ какъ если отношенія, найденныя эмпирическимъ путемъ, не будутъ соотвћтствовать закону разло женія при двойномъ сродствћ безъ измћненія при этомъ нейтральности, то ихъ нужно будетъ откинуть безъ дальнћйшаго изслћдованія и тогда, значитъ, въ произведенныхъ опытахъ произошла ошибка”.
Рихтеръ сопоставилъ количество различныхъ основаній,10) нейтрализуемыхъ однимъ и тћмъ же вћсовымъ количествомъ сћрной, плавиковой и др. кислотъ, и назвалъ ихъ рядомъ нейтральности или рядомъ массы основаній; точно такъ же онъ опредћлилъ количества кислотъ,11) которыя могутъ быть насыщены однимъ и тћмъ же количествомъ основанія. При этомъ онъ думалъ, что открылъ нћкоторыя закономћрности, что впослћдствіи оказалось ошибочнымъ. Рихтеръ думалъ, что массы основаній должны составлять ариќметическую прогрессію, а массы кислотъ геометрическую. Онъ хотћлъ такимъ образомъ установить ту же закономћрность химическихъ соединеній, которая, какъ раньше предполагали, опредћляетъ разстоянія планетъ отъ солнца; возможно, что для достиженія этого онъ исправлялъ многіе изъ своихъ результатовъ.
Я долженъ здћсь упомянуть еще объ одной области „стехіометрическихъ изслћдованій” Рихтера, именно о его работахъ по осажденію металловъ. Онъ опредћляетъ количество металловъ, осаждающихъ другъ друга изъ ихъ растворовъ, и пользуется полученными числами для опредћленія кислорода въ окисяхъ. И здћсь его способъ выраженія оставляетъ желать многаго. Онъ говоритъ:12). {49}
„Если разложить водный растворъ какой-нибудь металлической нейтральной соли другимъ металлическимъ флогистическимъ субстратомъ, т. е. другимъ металломъ въ металлическомъ видћ, такъ, чтобы не только металлъ, бывшій раствореннымъ, выдћлился въ совершенномъ металлическомъ видћ, но ни растворяющая кислота, ни съ ней соединенная вода не разложились, то массы жизненнаго воздуха, которыя должны соединиться съ равными массами металлическихъ субстратовъ, чтобы эти послћдніе могли раствориться въ кислотахъ, будутъ обратно пропорціональны массамъ (или вћсамъ) осаждающихъ и осажденныхъ металлическихъ субстратовъ изъ нейтральной металлической соли”. Въ другомъ мћстћ Рихтеръ говоритъ13): „Количественный порядокъ удћльной нейтральности металловъ по отношенію къ витріольной кислотћ совершенно не соотвћтствуетъ тому обыкновенному порядку, въ которомъ одинъ металлъ выдћляется другимъ изъ раствора въ кислотћ; онъ скорће аналогиченъ обратному количественному порядку дефлогистизаціи и вполнћ соотвћтствуетъ взаимному окисленію”.
Слћдуетъ упомянуть, что Рихтеръ ввелъ впервые названіе „стехіометрія”, означающее измћреніе или опредћленіе количественныхъ отношеній, въ которыхъ тћла между собой соединяются.
Заслугой Фишера можно считать, что онъ соединилъ въ одно цћлое всћ таблицы Рихтера. По этому поводу онъ говоритъ слћдующее14): „Надо только опредћлить количественныя отношенія одной кислоты къ различнымъ щелочнымъ основаніямъ, затћмъ достаточно знать въ одномъ лишь соединеніи относительныя количества всякой другой кислоты, соединенной съ щелочнымъ основаніемъ, и тогда уже простымъ вычисленіемъ можно получить количественныя отношенія кислотъ во всћхъ остальныхъ соединеніяхъ”.
Можно поэтому сказать, что таблица Фишера была первой таблицей эквивалентовъ; числа, приложенныя къ названіямъ различныхъ основаній, означаютъ эквивалентныя количества, такъ какъ они нейтрализуются тћмъ же количествомъ кислоты, и обратно: эквивалентныя количества кислотъ нейтрализуются однимъ и тћмъ же количествомъ основанія. Такимъ образомъ къ 1803 году было установлено понятіе объ эквивалентћ, хотя само это слово и не было еще употреблено. Къ тому же приблизительно времени {50} относится открытіе Дальтономъ закона кратныхъ отношеній и предложеніе имъ атомистической теоріи; и то и другое было опубликовано въ учебникћ химіи Томсона.
Я позволю себћ ограничиться лишь нћсколькими словами относительно споровъ о пріоритетћ, вызванныхъ этими важными изслћдованіями и теоріями15). Идея атомизма очень древняя и я уже въ началћ сегодняшней лекціи назвалъ нћкоторыхъ греческихъ философовъ, предложившихъ и защищавшихъ эту теорію. Эти взгляды проходятъ черезъ всћ вћка, часто оспариваются, но также всегда находятъ и защитниковъ. Химики XVIII вћка въ общемъ, кажется, относились довольно благосклонно къ атомистическимъ воззрћніямъ. Я напомню о взглядахъ Лавуазье на строеніе матеріи, мною подробно изложенныхъ; очень часто упоминалъ о молекулахъ Бертолле; однимъ словомъ, это были очередныя идеи и онћ предпочитались динамической гипотезћ потому, главнымъ образомъ, что такое предположеніе объ отдћльныхъ, независимыхъ другъ отъ друга молекулахъ давало болће простое объясненіе наблюдаемому явленію уменьшенія объема при охлажденіи.
Впрочемъ, Дальтонъ и не утверждалъ, что эти воззрћнія были введены въ науку имъ; относительно этого онъ замћчаетъ слћдующее16):
„Возможность существованія различныхъ аггрегатныхъ состояній тћлъ привела къ почти общепринятому предположенію, что всћ тћла состоятъ изъ безконечнаго числа мельчайшихъ частицъ, проявляющихъ то болће сильную, то болће слабую силу взаимнаго притяженія, называемую сцћпленіемъ. Эти атомы постоянно окружены тепловой атмосферой, которая своей отталкивающей силой препятствуетъ соприкосновенію частицъ”.
Дальтонъ однако описываетъ въ своемъ въ высшей степени интересномъ трудћ, какъ можно найти относительные вћса этихъ частицъ, и такимъ образомъ указываетъ на возможность опредћленія атомныхъ вћсовъ. Это составляетъ безсмертную его заслугу. Гигтинсъ, правда, старался доказать, что и онъ принималъ участіе въ этомъ важномъ открытіи17), но, даже допуская, что еще въ 1789 году онъ воспользовался атомистической теоріей для объясненія химическихъ соединеній18), мы все же должны признать, что его способъ {51} выраженія не отличается такой строгостью и опредћленностью, какъ у Дальтона, да и, сколько я знаю, онъ не говорилъ объ атомныхъ вћсахъ.
Дальтону пришла мысль положить атомистическую гипотезу въ основаніе химическихъ воззрћній послћ того, какъ онъ замћтилъ, что если два тћла соединяются между собой въ нћсколькихъ отношеніяхъ, то эти отношенія выражаются простыми цћлыми числами19). Онъ изучалъ въ то время углеводороды, именно болотный газъ и этиленъ, и нашелъ, что при одномъ и томъ же количествћ водорода этиленъ содержитъ ровно въ два раза больше углерода, чћмъ болотный газъ. Далће онъ изслћдовалъ, наблюдается ли также эта закономћрность и въ другихъ соединеніяхъ; пользуясь для этого различными степенями окисленія азота, онъ получилъ и здћсь подтвержденіе своего закона. Законъ этотъ гласитъ: Если два тћла А и В образуютъ нћсколько соединеній и составъ этихъ соединеній разсчитывается относительно одного и того же вћсового количества одного тћла А, то соединенныя съ нимъ количества другого тћла В находятся между собою въ отношеніи простыхъ цћлыхъ чиселъ20). Эту закономћрность, являющуюся выраженіемъ наблюденныхъ фактовъ, Дальтонъ и объясняетъ съ по мощью атомистической теоріи.
Согласно этой теоріи химическія соединенія образуются сложеніемъ другъ съ другомъ атомовъ элементовъ, которые не способны уже ни къ какому дальнћйшему разложенію. Дальтонъ говоритъ21): „Въ химическомъ анализћ и синтезћ мы доходимъ лишь до возможности раздћленія тћла на мельчайшія частицы и ихъ обратнаго соединенія. Ни созиданіе, ни разрушеніе не входятъ въ область химическихъ воздћйствій”. Теорія Дальтона согласуется съ опытомъ благодаря тому, что онъ придаетъ атому каждаго элемента опредћленный, неизмћнный вћсъ и признаетъ возможность соединенія нћсколькихъ атомовъ; опытныя данныя являются даже какъ бы {52} необходимымъ слћдствіемъ этой теоріи. Смотря по числу атомовъ, входящихъ въ какое либо соединеніе, образующійся атомъ принадлежитъ тому или иному порядку.
Атомы элементовъ — простые атомы или атомы перваго порядка.
Если 1 атомъ элемента А соединяется съ 1 атомомъ элемента В, то получается 1 атомъ второго порядка.
Если 2 атома элемента А соединяются съ 1 атомомъ элемента В, то образуется 1 атомъ третьяго порядка.
Если 1 атомъ элемента А соединяется съ 2 атомами элемента В, то получается 1 атомъ третьяго порядка.
Если 1 атомъ элемента А соединяется съ 3 атомами элемента В, то образуется 1 атомъ четвертаго порядка.
Если 3 атома элемента А соединяются съ 1 атомомъ элемента В, то получается 1 атомъ четвертаго порядка и т. д.
Я не нашелъ указанія на то, соединяются ли также 2 атома одного элемента съ 3 атомами другого элемента, но мнћ кажется, что Дальтонъ считалъ это предположеніе непріемлемымъ. Наиболће простыя соединенія такого рода состоятъ, по его мнћнію, изъ двухъ сложныхъ атомовъ; само собой разумћется, онъ долженъ былъ сдћлать предположеніе22), что атомы высшаго порядка тоже могутъ соединяться между собой.
Я указалъ выше, что теорія Дальтона согласовалась съ фактами; разсмотримъ же теперь, какъ Дальтонъ на основаніи своихъ опытовъ опредћлялъ атомные вћса. Прежде всего ему надо было точно опредћлить ч и с л о атомовъ соединенія. Дальтонъ считаетъ, что это число выражается, вообще, наиболће простыми кратными отношеніями. При опредћленіи атомныхъ вћсовъ онъ исходитъ изъ слћдующихъ основныхъ положеній23):
1) Если извћстно лишь одно соединеніе двухъ элементовъ, то такое соединеніе состоитъ изъ одного атома второго порядка.
2) Если эти элементы образуютъ два соединенія, то одно состоитъ изъ 1 атома второго, другое изъ 1 атома третьяго порядка.
3) Если элементы образуютъ три соединенія, то въ нихъ долженъ быть принятъ одинъ атомъ второго и два атома третьяго порядка.
Какъ поступаетъ Дальтонъ для опредћленія вћса атомовъ, т. е. относительной тяжести мельчайшихъ частицъ? Прежде всего {53} онъ долженъ для этого избрать единицу; за нее онъ беретъ водородъ, атомный вћсъ котораго считаетъ равнымъ 1 и къ которому относитъ всћ остальные атомные вћса. Для опредћленія послћднихъ онъ пользуется затћмъ своимъ первымъ основнымъ положеніемъ. Въ то время было извћстно лишь по одному соединенію водорода съ кислородомъ и азотомъ, именно, вода и амміакъ; поэтому изъ ихъ состава можно прямо опредћлить атомные вћса кислорода и азота; Дальтонъ нашелъ такимъ образомъ, что они равны 7 и 5. Полученныя числа онъ провћряетъ по взаимнымъ отношеніямъ въ кислородныхъ соединеніяхъ азота24). Онъ ихъ зналъ четыре. Въ окиси азота онъ находитъ на 5 частей послћдняго 7 частей кислорода; слћдовательно, это 1 атомъ второго порядка обоихъ элементовъ. Въ азотной кислотћ, по его мнћнію, на 5 частей азота приходится 14 частей кислорода, т. е. на 1 атомъ перваго газа приходится 2 второго; 10 частей азота, соединенныхъ съ 7 частями кислорода, образуютъ закись азота, въ которой, поэтому, Дальтонъ предполагаетъ 2 атома азота и 1 атомъ кислорода. Азотистая же кислота должна содержать на 5 частей азота 101/2 частей кислорода. Поэтому Дальтонъ долженъ былъ бы предположить въ ней 2 атома азота и 3 атома кислорода, но онъ предпочитаетъ разсматривать это тћло, какъ соединеніе азотной кислоты съ закисью азота.
Далће, въ этиленћ онъ находитъ на 1 часть водорода 5·4 углерода, а въ болотномъ газћ на это же количество углерода приходится 2 части водорода. Поэтому Дальтонъ считаетъ этиленъ состоящимъ изъ атомовъ второго порядка, а атомнымъ вћсомъ углерода онъ считаетъ 5·4. Въ такомъ случаћ и окись углерода содержитъ атомы второго порядка, такъ какъ въ ней на 5·4 части углерода приходится 7 частей кислорода, тогда какъ угольная кислота — атомъ третьяго порядка вслћдствіе того, что въ ней на 5·4 частей углерода должно приходиться 14 частей кислорода.
Дальтонъ, однако, не всегда строго придерживается установленнаго имъ правила. Такъ сћрнистый водородъ онъ считаетъ состоящимъ изъ 1 атома сћры и 2 атомовъ водорода, а сћрную кислоту состоящей изъ 1 атома сћры и 3 атомовъ кислорода; изъ этого онъ заключаетъ, что атомный вћсъ сћры равняется 13.
По этой причинћ, не говоря уже о самихъ правилахъ, къ доказательству которыхъ я впослћдствіи еще вернусь, всћ эти {54} опредћленія атомнаго вћса на мой взглядъ заключаютъ въ себћ нћчто произвольное. Числа, данныя Дальтономъ, были, если можно выразиться, вдвойнћ относительными, они зависћли отъ двухъ неизвћстныхъ константъ. Во-первыхъ, они всћ были опредћлены относительно единицы, взятой произвольно, именно водорода, а во-вторыхъ, по отношенію къ этой единицћ они были только лишь относительно вћрны. Найденный атомный вћсъ углерода былъ въ дћйствительности лишь кратнымъ 5·4. Дальтонъ, кажется, не сознавалъ произвольности всего этого.
Несмотря на все это теорія встрћтила широкое сочувствіе; всћхъ удивляла простота, съ которой она объясняла недавно открытыя закономћрности. При быстрыхъ успћхахъ науки въ то время, чтобы не отстать, чувствовалась потребность въ опорћ,—въ одной общей точкћ зрћнія, съ которой удобно было бы окинуть однимъ взглядомъ отдћльные факты и различныя закономћрности. Вскорћ оказалось, что теорія Дальтона была способна выдержать самое строгое испытаніе, что она не только была въ состояніи обобщить знакомыя явленія, но и объяснить законы, открытые лишь впослћдствіи. Это именно относится къ объемному закону, открытому Гэ-Люссакомъ въ 1808 году, спустя нћсколько мћсяцевъ послћ появленія геніальнаго труда Дальтона.
Уже въ 1805 году Гумбольдтъ и Гэ-Люссакъ, при совмћстномъ изслћдованіи состава воздуха, вновь опредћлили объемныя отношенія, въ которыхъ соединяются водородъ съ кислородомъ25). Ихъ выводы нћсколько разнились отъ предыдущихъ, но они пришли къ въ высшей степени интересному результату, что вода образуется изъ двухъ объемовъ водорода и 1 объема кислорода, тогда какъ другіе находили въ ней: Менье и Лавуазье26) 23 объемныхъ части водорода и 12 частей кислорода, а Фуркруа, Вокленъ и Сегенъ27) 205·2 части водорода и 100 частей кислорода.
Три года спустя Гэ-Люссакъ произвелъ опыты и съ другими газами28). Еще раньше онъ открылъ законъ, названный его именемъ, о равномћрномъ расширеніи газовъ при одинаковомъ повышеніи температуры29). Ему былъ извћстенъ и такъ называемый законъ Маріотта, открытый Бойлемъ и опредћляющій отношенія {55} между давленіемъ и объемомъ газа; однимъ словомъ, онъ имћлъ всћ данныя, чтобы непосредственно полученные имъ результаты привести къ одному давленію и къ одинаковой температурћ, имћлъ базисъ для всћхъ дальнћйшихъ предполагаемыхъ опытовъ. — Его изслћдованіе — образецъ точности; оно весьма выгодно отличается этимъ отъ другихъ экспериментальныхъ изслћдованій того времени. Полученные результаты очень простые; онъ излагаетъ ихъ приблизительно въ слћдующемъ видћ: два газа соединяются всегда въ простыхъ объемныхъ отношеніяхъ и испытываемое ими сжатіе, слћдовательно также и объемъ получаемаго соединенія, если оно газообразно, находится въ самомъ простомъ отношеніи къ объемамъ составныхъ частей.
Такимъ образомъ Гэ-Люссакъ нашелъ, напримћръ, что изъ 2 объемовъ окиси углерода и 1 объема кислорода образуются 2 объема угольной кислоты, что 2 объема закиси азота образуются изъ 2 частей азота и 1 части кислорода, что равные объемы азота и кислорода соединяются въ окись азота, что объемъ полученнаго соединенія равенъ суммћ объемовъ составныхъ частей и что, наконецъ, 1 объемъ азота и 3 объема водорода сгущаются въ 2 объема амміака и т. д.
Гэ-Люссакъ, знавшій очень хорошо атомистическую теорію Дальтона, въ концћ своего труда объясняетъ, какъ согласуются съ этой гипотезой открытые имъ факты, какъ, благодаря допущенію одного, одинаковаго для всћхъ газовъ молекулярнаго состоянія, легко объясняется ихъ одинаковое отношеніе къ измћненіямъ давленія и температуры, и какимъ образомъ открытые имъ объемные законы являются существенной опорой взглядамъ Дальтона.
Можно было бы ожидать, что Дальтонъ долженъ былъ весьма обрадоваться столь неожиданному и блестящему подтвержденію своихъ идей. Однако онъ отнесся къ этому иначе. Во второй части своей „New system of chemical philosophy”, появившейся въ 1810 году, онъ категорически заявилъ, что опыты Гэ-Люссака невћрны. Я постараюсь указать основанія, вызвавшія такой его отзывъ; это тћмъ болће необходимо, что утверждали, будто Дальтонъ оспаривалъ заслуги Гэ-Люссака изъ зависти или же по непониманію.
Уже въ первой части своего труда Дальтонъ, разсуждая объ объемныхъ отношеніяхъ газовъ, говоритъ30): „Начиная размышлять {56} о теоріи смћшанныхъ газовъ, я думалъ, что частицы всћхъ газовъ имћютъ одну и ту же форму (подъ формою частицъ я разумћю непроницаемое ядро вмћстћ съ окружающей его тепловой атмосферой). Я допускалъ, что въ 1 объемћ кислорода находится такое же количество атомовъ, какъ и въ 1 объемћ водорода. Но впослћдствіи я пришелъ къ другому мнћнію и къ нему привели меня слћдующіе доводы: 1 атомъ окиси азота состоитъ изъ 1 атома азота и 1 атома кислорода. Если бы въ равныхъ объемахъ было равное количество атомовъ, то при соединеніи 1 объема азота съ 1 объемомъ кислорода долженъ былъ бы образоваться 1 объемъ окиси азота, а между тћмъ изъ опытовъ Генри видно, что образуется почти 2 объема: поэтому окись азота должна бы была заключать въ томъ же объемћ только половину количества атомовъ, содержащихся въ азотћ и кислородћ”.
Въ своемъ возраженіи Дальтонъ ссылается на это объясненіе и продолжаетъ далће31):
„Гэ-Люссакъ создаетъ гипотезу, что газы соединяются въ простыхъ объемныхъ отношеніяхъ; его взглядъ на объемы тотъ же, что и мой на атомы, и если бы можно было доказать, что всћ газы въ равныхъ объемахъ содержатъ равное количество атомовъ, то обћ эти гипотезы были бы тожественны, но только моя имћетъ общее значеніе, а Гэ-Люссака примћнима лишь къ газамъ. Гэ-Люссакъ могъ бы убћдиться, что раньше я допускалъ гипотезу, тожественную его нынћшней, но оставилъ ее, какъ не выдерживаюшую критики”.
Дальтонъ указываетъ, кромћ того, что результаты, полученные Гэ-Люссакомъ и Генри, мало согласуются, и въ этомъ обстоятельствћ находитъ подкрћпленіе для своего заключенія о неудовлетворительности работъ перваго. Нельзя отрицать правильности аргументаціи Дальтона. Съ того момента, когда атомистическая теорія была положена въ основаніе химическихъ воззрћній, объемный законъ, въ томъ видћ, какъ его выразилъ Гэ-Люссакъ, могъ находиться съ нею въ согласіи лишь при допущеніи, что равные объемы всћхъ газовъ содержатъ равныя же количества мельчайшихъ частицъ, съ чћмъ согласуются физическія свойства газовъ, чтó однако, какъ Дальтонъ выводитъ совершенно правильно изъ извћстныхъ фактовъ, невозможно. Три установленныхъ имъ правила также противорћчатъ {57} справедливости этой гипотезы. Напримћръ, надо было бы признать, что въ водћ на 1 атомъ кислорода приходится 2 атома водорода) и весьма возможно, что именно это обстоятельство было причиной такого рћшительнаго выступленія Дальтона противъ Гэ-Люссака.
Послћ всего изложеннаго ясно, что существовало дћйствительное затрудненіе для согласованія закона Гэ-Люссака съ атомистической теоріей. Авогадро впервые показалъ, какъ можетъ быть обойдено это затрудненіе32). Итальянскій физикъ отличаетъ molecules integrantes отъ molecules elementaires. Мы для краткости и простоты назовемъ ихъ молекулами и атомами. Упомянутыя выше затрудненія, указанныя Дальтономъ, заставили Авогадро допустить, что въ равныхъ объемахъ различныхъ газовъ находятся равныя количества молекулъ, разстоянія которыхъ другъ отъ друга, по отношенію къ ихъ массамъ, онъ предполагаетъ настолько большими, что онћ уже не притягиваютъ другъ друга. Но эти молекулы, по его мнћнію, не представляютъ еще послћдней степени раздћленія матеріи. Подъ вліяніемъ химическихъ силъ онћ могутъ еше разлагаться далће. По мнћнію Авогадро тћла (и элементы и соединенія) при переходћ въ газообразное состояніе не распадаются еще на недћлимыя частицы, но только на molecules integrantes, coстоящія изъ molecules elementaires. Онъ основываетъ свое мнћніе на слћдующихъ разсужденіяхъ: Если окись азота, получающаяся безъ сжатія изъ равныхъ объемовъ азота и кислорода, содержитъ такое же количество молекулъ, какъ и составныя ея части, то это соединеніе не должно состоять изъ сложенія воедино молекулъ, ранће отдћленныхъ другъ отъ друга, такъ какъ это вызвало бы уменьшеніе количества частицъ; такое соединеніе должно образоваться при помощи обмћна: молекулы какъ азота, такъ и кислорода должны раздћлиться на двћ части, которыя затћмъ взаимно соединяются.
Итакъ, въ то время какъ газовая смћсь до соединенія состоитъ изъ разнородныхъ молекулъ, одна половина которыхъ составлена изъ 2 атомовъ азота, другая же изъ 2 атомовъ кислорода, продуктъ соединенія будетъ содержать такое же количество однородныхъ молекулъ, образовавшихся изъ соединенія 1 атома азота и 1 атома кислорода. Разсмотрћніе атомныхъ отношеній при образованіи амміачнаго газа также приводитъ къ выводу о раздћленіи газовыхъ частицъ въ элементахъ. {58} Всћ эти объясненія становятся очень простыми, если вмћсто слова объемъ употреблять непосредственно молекулу (molecule integrante). По опредћленію Авогадро для газоваго состоянія оба эти понятія идентичны. Изъ чиселъ Гэ-Люссака видно, что молекула амміака состоитъ изъ 1/2 молекулы азота и 3/2 молекулы водорода; молекула воды содержитъ 1/2 молекулы кислорода и 1 молекулу водорода и т. д. Если мы допустимъ простћйшую гипотезу относительно дћлимости молекулы, но съ такимъ условіемъ, чтобы не было надобности вводить дробныя части атомовъ, то тогда не только молекула водорода, но и молекулы кислорода и азота должны со стоять изъ 2 элементарныхъ атомовъ. Въ такомъ случаћ объемныя отношенія, въ которыхъ газы соединяются, указываютъ число мельчайшихъ химическихъ частицъ, входящихъ въ соединеніе. Авогадро, напримћръ, находитъ, что для образованія воды необходимы 2 атома водорода и 1 атомъ кислорода, а въ амміакћ на 3 атома перваго газа приходится 1 атомъ азота и т. д., т. е. онъ приходитъ къ совершенно инымъ результатамъ, чћмъ Дальтонъ.
Въ своемъ мемуарћ Авогадро обращаетъ особенное вниманіе на это обстоятельство и указываетъ, что въ своихъ опредћленіяхъ онъ исходитъ изъ положенія, физически обоснованнаго, тогда какъ правила Дальтона содержатъ произвольныя предположенія. Онъ подчеркиваетъ, что послћдній при желаніи отожествить физическіе и химическіе атомы (molecules integrantes et elementaires) принужденъ былъ бы предположить, что въ соединеніяхъ, происходящихъ безъ сжатія, соединенные атомы болће удалены другъ отъ друга, чћмъ не соединенные.
Авогадро имћетъ возможность вывести молекулярные вћса извћстныхъ въ газообразномъ состояніи элементовъ прямо изъ плотностей. Но этого ему недостаточно и онъ пытается примћнить это опредћленіе и къ другимъ элементамъ. При этомъ Авогадро вынужденъ прибћгнуть къ довольно рискованнымъ гипотезамъ. Такъ, онъ опредћляетъ, что молекулярный вћсъ углерода равенъ 11· 3, сћры 31· 3, водорода 1, — числа, не соотвћтствующія нынћ принятымъ. Я не буду васъ утруждать изложеніемъ дальнћйшихъ деталей этого въ высшей степени интереснаго труда, а только еще замћчу, что Авогадро предвидитъ возможность существованія молекулъ простыхъ тћлъ, состоящихъ изъ 4, 8 и т. д. атомовъ; онъ полагаетъ, что природа какъ бы хотћла именно этимъ сгладить разницу между простыми и сложными тћлами. {59}
Амперъ, три года спустя (въ 1814 году), исходя изъ подобныхъ соображеній, пишетъ статью на ту же тему33). Но его заключенія отличаются меньшей простотой вслћдствіе того, что онъ въ то же время пытается объяснить кристаллическія формы тћлъ расположеніемъ атомовъ въ молекулћ.
Впрочемъ, въ кругу химиковъ всћ эти воззрћнія обратили на себя мало вниманія. Повидимому, считали недоказаннымъ различіе между атомомъ и молекулой, и поэтому ни идеи Авогадро, ни идеи Ампера не оказали немедленнаго вліянія на науку. Это можетъ быть объяснено также тћмъ, что эта гипотеза давала рћшительные результаты только для газообразныхъ тћлъ, такъ какъ только въ послћднихъ она опредћляла число атомовъ, содержащихся въ молекулћ, и такимъ образомъ позволяла вычислить ихъ атомные вћса; къ твердымъ же и жидкимъ тћламъ она была непримћнима. Поэтому химики стали искать новыя точки опоры, и первый толчокъ въ этомъ направленіи былъ данъ Волластономъ.
Этотъ ученый опубликовалъ въ 1818 году работу надъ углекислыми солями34), появившуюся одновременно съ изслћдованіями Томсона отцосительно щавелевокислыхъ солей35). Въ статьяхъ обоихъ химиковъ было указано, что угольная кислота можетъ образовать соединенія съ 1 и 2, а щавелевая кислота съ 2 и 4 частями щелочи. Эти опыты произвели большое впечатлћніе, такъ какъ въ то время въ этомъ направленіи было извћстно лишь немного фактовъ, строго доказанныхъ; поэтому они послужили существенной поддержкой закону кратныхъ отношеній. Если съ одной стороны Волластонъ настолько способствовалъ быстрому принятію атомистической теоріи, что авторитетными учеными даже считался ея сторонникомъ36), то съ другой стороны его позднћйшій трудъ37) оказалъ иное вліяніе, именно онъ заставилъ часть химиковъ отказаться отъ атома, какъ слишкомъ неопредћленнаго основанія для химическихъ умозрћній.
Въ 1814 году Волластонъ не безъ основанія упрекаетъ своего соотечественника Дальтона въ томъ, что его опредћленіе числа атомовъ въ соединеніи недостовћрно и произвольно, вслћдствіе чего атомные вћса являются числами совершенно гипотетичньши и, по его мнћнію, непріемлемыми. Волластонъ совћтуетъ замћнить понятіе {60} атома понятіемъ эквивалента, теперь впервые названнаго этимъ именемъ. Онъ былъ прекрасно освћдомленъ о работахъ Рихтера38), изъ которыхъ главнымъ образомъ и извлекъ это понятіе. Впрочемъ, я долженъ теперь же замћтить, что онъ считаетъ эквивалентными (равнозначными) не только количества двухъ основаній, нейтрализуемыхъ одинаковымъ количествомъ кислоты, и не только количества металловъ, взаимно осаждающихся, т. е. соединяющихся съ однимъ и тћмъ же вћсомъ кислорода, но что онъ распространяетъ свои опредћленія далеко за эти границы, повидимому не замћчая, что онъ впадаетъ въ ту же ошибку, въ которой упрекаетъ Дальтона. Я иду даже дальше и утверждаю, что именно онъ увеличилъ неясность, впервые употребляя понятіе эквивалента въ смыслћ атома, такъ какъ этимъ онъ придалъ первому понятію неопредћленное значеніе, свойственное второму; такимъ образомъ его статья непосредственно привела къ тому, что химики стали смћшивать оба понятія: атомъ и эквивалентъ. Они безмолвно и ошибочно признали, что атомы эквивалентны, а эта ошибка вызвала сильную путаницу.
Я хочу показать на небольшомъ примћрћ способъ опредћленій Волластона, чтобы вы получили, по крайней мћрћ, нћкоторое понятіе о его методћ и смогли сами убћдиться въ правильности моего сужденія. Волластонъ исходитъ изъ эквивалента кислорода, опредћляемаго имъ равнымъ 10; отсюда онъ вычисляетъ, что эквивалентъ водорода равенъ 1· 3, очевидно потому, что 1· 3 части водорода соединяются съ 10 частями кислорода въ воду (по опредћленіямъ того времени); слћдовательно, количества, въ которыхъ тћла соединяются, являются, по Волластону, эквивалентными. Какъ же онъ поступаетъ, спросите вы, съ тћлами, соединяющимися въ нћсколькихъ отношеніяхъ, напримћръ, съ углеродомъ? Признаетъ ли онъ здћсь нћсколько эквивалентовъ? На это долженъ послћдовать отрицательный отвћтъ: онъ, кажется, даже и не думалъ, что подобное явленіе возможно. Эквивалентъ углерода онъ считаетъ равнымъ 7· 5 и опредћляетъ его изъ угольной кислоты, эквивалентъ которой по его мнћнію равенъ 27· 5. Правда, онъ не приводитъ никакого объясненія, почему онъ выбралъ именно это число, и предоставляетъ его искать намъ самимъ. Можно было бы предположить, что Волластонъ считаетъ эквивалентомъ количество угольной кислоты, {61} насыщающее то количество основанія, которое содержитъ ровно 10 частей кислорода, при чемъ онъ долженъ былъ бы придерживаться вышеупомянутаго взгляда, что соединительный вћсъ идентиченъ эквиваленту. Но тогда, по своимъ собственнымъ исчисленіямъ, онъ принуженъ былъ бы допустить, что въ угольной кислотћ на 1 эквивалентъ углерода приходится 2 эквивалента кислорода. А въ такомъ случаћ эквивалентъ и соединительный вћсъ уже не будутъ идентичны, — одинъ будетъ вдвое больше другого. Что при его методћ такіе результаты были неизбћжны, должно было бы ему быть ясно, такъ какъ законъ кратныхъ отношеній ему былъ извћстенъ. Впрочемъ, Волластонъ не останавливается на этомъ логическомъ слћдствіи, онъ не удостаиваетъ его ни однимъ словомъ и съ увћренностью продолжаетъ свои опредћленія эквивалентовъ; но мы далће за нимъ уже не послћдуемъ, такъ какъ эти опредћленія въ дальнћйшемъ не представляютъ для насъ никакого интереса.
Думаю, я доказалъ, что эквивалентамъ Волластона присущи такія же неточности, какъ и атомнымъ вћсамъ Дальтона. Высказанные имъ взгляды можно назвать шагомъ назадъ, потому что онъ думалъ, что имћлъ дћло лишь съ реальными, недвусмысленными понятіями, свободными отъ какихъ либо гипотезъ.
Быть можетъ, мое сужденіе покажется рћзкимъ и несправедливымъ. Но если вы прослћдите за дальнћйшимъ развитіемъ химіи, то вы увидите, что вслћдствіе именно этого смћшенія понятій эквивалента и атома (соединительнаго вћса) въ теченіе ближайшихъ нћсколькихъ десятилћтій замћтно затормозился прогрессъ науки, и нужна была энергичная борьба, чтобы добиться вновь раздћленія этихъ двухъ понятій. Принявъ все это во вниманіе, вы, безъ сомнћнія, присоединитесь къ моему мнћнію. Правда, не одинъ Волластонъ виноватъ въ этомъ; и въ Германіи тоже возникла школа, вћроятно вдохновленная имъ и проводившая его идеи. Вначалћ она еще сдерживалась сильнымъ вліяніемъ Берцеліуса, но позже, особенно въ началћ сороковыхъ годовъ, вліяніе этой школы стало доминирующимъ. Я не стану излагать частности этой въ высшей степени интересной эволюціи. Въ слћдующей же лекціи я обращу ваше вниманіе на электрическія явленія, которыя къ этому періоду времени начали оказывать сильное вліяніе на развитіе нашей науки.
| {62} |
Электрохимическая теорія Дэви — Открытіе щелочныхъ металловъ — Споры относительно ихъ состава — Содержитъ ли соляная кислота кислородъ? — Теорія водородокислотная.
Если вы мысленно перенесетесь въ ту эпоху, когда щелочи считались простыми и неразложимыми тћлами, то легко поймете, съ какимъ энтузіазмомъ химическій міръ привћтствовалъ открытіе калія и натрія. Всћ вы знаете замћчательныя свойства этихъ элементовъ, ихъ металлическій видъ и малый удћльный вћсъ, ихъ измћняемость на воздухћ, легкую воспламеняемость въ водћ и пр.; однимъ словомъ вы поймете, что, увидћвъ тћла съ такими свойствами, можно было предаться всевозможнымъ иллюзіямъ и придти къ мысли, что всћ вещества, извћстныя до того времени, являются лишь соединеніями и что у химіи возникла теперь задача открыть истинные элементы, которые, по своимъ свойствамъ, должны быть сходны съ натріемъ и каліемъ. Вы также поймете, какое восхищеніе вызывала сила, производившая такія чудеса, и какъ сильно преувеличивали ея значеніе. Ее считали всемогущей, и теперь стало ясно для всћхъ то направленіе, по которому должна была пойти химія: это было электрическое направленіе. Гальваническій токъ, въ то время еще столь новый агентъ, совершилъ чудо — онъ и самъ по себћ былъ чудомъ, — съ его помощью удалось разложить соединенія на ихъ истинные элементы; поэтому неудивительно, что эту силу стали считать тождественной съ той, которая образуетъ соединенія,—съ силой сродства. Этимъ думали объяснить два рода явленій, именно, явленія электрическія и химическія. Кромћ того, между ними была установлена взаимная связь. Въ то время развитіе электрохимическихъ теорій представлялось наивысшей цћлью нашей науки; позже {63} вы увидите эти теоріи оставленными: за чрезвычайнымъ энтузіазмомъ послћдовало такое же равнодушіе1).
Это одинъ изъ примћровъ, какихъ много въ исторіи каждой науки: достигнутъ значительный результатъ, все остальное должно поэтому исчезнуть! Всћ усилія устремляются на развитіе этого направленія и воздвигается цћлая система, въ основу которой кладутся наблюденныя явленія. Затћмъ появляются факты, противорћчащіе такъ возникшимъ взглядамъ. Появленіе ихъ для однихъ служитъ достаточнымъ основаніемъ, чтобы отречься отъ этихъ теорій, другихъ же оно побуждаетъ попытаться согласовать эти факты съ теоріей, что, съ своей стороны, заставляетъ прибћгнуть къ помощи дальнћйшихъ гипотезъ. Такъ развивается борьба, оканчивающаяся лишь тогда, когда у послћдователей стараго воззрћнія открываются глаза, когда они видятъ, какъ сильно исказилась первоначально столь простая и изящная теорія. Тогда все рушится и никто не можетъ понять, какъ можно было когда-либо руководиться подобными теоріями. Въ томъ, въ чемъ раньше признавали высочайшую мудрость, впослћдствіи видятъ лишь величайшую нелћпость. Такъ мћняются времена!
Нћчто подобное случилось и съ электрохимическими теоріями. Если принять во вниманіе удивительныя открытія, сдћланныя при содћйствіи гальваническаго тока, то станетъ понятнымъ значеніе, приписываемое въ то время электрическимъ явленіямъ, и я полагаю, что мы, находясь въ подобномъ положеніи, поступили бы такъ же. Слушайте и судите сами!
Въ 1789 году Гальвани2) замћтилъ, что при одновременномъ прикосновеніи къ мускулу и нерву лягушки двухъ различныхъ металловъ, соприкасающихся непосредственно или посредствомъ металла же, въ лягушкћ начинаются судорожныя движенія.
Гальвани объяснилъ этотъ фактъ тћмъ, что въ мускулћ лягушки заложена электрическая сила; онъ сравниваетъ этотъ мускулъ съ лейденской банкой. Но такое объясненіе оспаривалось въ 1792 году Вольтой3). Послћдній предполагалъ, что соприкосновеніе двухъ разнородныхъ металловъ производитъ электрическій токъ, поэтому {64} основателемъ контактной теоріи слћдуетъ считать именно Вольту4), Риттеръ же первый открылъ, что электричество и химія находятся въ тћсной связи5), при чемъ онъ показалъ, что рядъ электрическихъ напряженій идентиченъ порядку, слћдуя которому металлы взаимно осаждаются изъ ихъ растворовъ. Риттеръ, кромћ того, былъ первымъ, признавшимъ химическую реакцію причиной электрическаго тока. Онъ пишетъ6): „Пока не происходитъ химическаго процесса, цћпь бездћятельна. Но она приходитъ въ дћйствіе, лишь только токъ возникаетъ между проводниками обоихъ классовъ”. Между этими двумя представленіями, между контактной теоріей и электрической, возникла борьба, длившаяся десятилћтія. Мы встрћчаемъ еще приверженцевъ контактной теоріи даже послћ того, какъ Гельмгольцъ въ своей знаменитой статьћ „Uber die Erhaltung der Kraft”7) наглядно выяснилъ соотношеніе между химизмомъ и электрическимъ токомъ; но въ дальнћйшемъ мы не будемъ останавливаться на этой теоріи.
Никольсонъ и Карлейль въ 1800 году открыли8), что при разрядћ гальваническаго столба черезъ воду, послћдняя разлагается на свои составныя части, кислородъ и водородъ. Многократно пытались вызвать подобныя же явленія въ другихъ веществахъ; но первая значительная работа относительно разложенія химическихъ соединеній электрическимъ токомъ принадлежитъ Берцеліусу и Гизингеру и была опубликована въ 1803 году9). Эти два изслћдователя изучали главнымъ образомъ дћйствіе динамическаго электричества на растворы солей, далће на амміакъ, сћрную кислоту и др. Ихъ приборъ былъ устроенъ такъ, что они могли собирать отдћльно выдћлившіяся на разныхъ полюсахъ составныя части соединеній. Такимъ образомъ они достигли въ высшей степени замћчательнаго результата, а именно, что тћла по отношенію къ гальваническому току могутъ быть раздћлены на двћ группы; что водородъ, металлы, металлическія окиси, щелочи, земли и т. д. отлагаются на отрицательномъ {65} полюсћ, а кислородъ, кислоты и др. отлагаются на положительномъ полюсћ цћпи. Кромћ этого, они считали, что нашли отношенія между разложенными количествами веществъ, ихъ взаимными сродствами и количествами электричества въ цћпи.
О причинахъ разложенія они высказываются только очень неопредћленно; они думаютъ, что это можно было бы объяснить бóльшей или меньшей степенью притяженія, производимаго электричествомъ на различныя тћла.
Теперь я обращусь къ изслћдованіямъ Гёмфри Дэви, которыя онъ началъ, по его словамъ, въ 1800 году10) съ вопроса, повидимому, совершенно несущественнаго. Уже при первыхъ опытахъ разложенія воды11), казалось, замћчали, что электролизъ даетъ щелочныя и кислыя вещества. Крюикшанкъ12) и Бруньятелли13) подтвердили эти наблюденія. Начало распространяться убћжденіе, что подъ вліяніемъ электричества вода превращается въ щелочи и кислоты. Противъ этого мнћнія выступилъ уже Симонъ14), а Дэви опровергъ его рћшающими опытами15).
Онъ производитъ разложеніе въ сосудахъ, сдћланныхъ изъ различнаго матеріала, именно стекла, агата, золота и др., и убћждается, что при этомъ измћняются количества и родъ получаемыхъ тћлъ. Это приводитъ его къ предположенію о разложеніи самихъ сосудовъ. Но даже производя разложеніе въ золотыхъ сосудахъ, онъ замћчалъ появленіе летучей щелочи (амміака) и азотной кислоты. Онћ, заключаетъ Дэви, обязаны своимъ происхожденіемъ воздуху (азоту), поглощенному водой. Чтобы убћдиться въ правильности этого мнћнія, онъ производитъ разложеніе въ закрытомъ пространствћ, выкачиваетъ воздухъ надъ водой и замћняетъ его водородомъ. Такимъ образомъ ему удалось доказать, что дћйствіемъ электрическаго тока чистая вода разлагается на свои составныя части, — кислородъ и водородъ, и что при этомъ не происходитъ никакого превращенія воды; если превращеніе и наблюдается, то оно объясняется или взаимодћйствіемъ съ веществомъ сосуда, въ которомъ произведенъ былъ опытъ, или же какимъ-либо загрязненіемъ воды.
Этотъ трудъ во многихъ отношеніяхъ можно сравнить съ первыми опытами Лавуазье16). Оба изслћдователя пытались {66} опровергнуть объясненіе, основанное на неточномъ наблюденіи, но опровергнуть не спекулятивнымъ путемъ и не утвержденіемъ, что это объясненіе противорћчитъ общепринятымъ теоріямъ, а инымъ образомъ, а именно, противопоставляя прежнимъ поверхностнымъ изслћдованіямъ опыты, произведенные съ самымъ точнымъ соблюденіемъ всћхъ необходимыхъ условій. Въ обоихъ случаяхъ цћль была достигнута: устарћвшія, невћрныя воззрћнія были замћнены новыми правильными. Часто такіе результаты, какіе получили Лавуазье и Дэви, называютъ отрицательными, но вы, навћрное, согласитесь со мной, что такіе результаты могутъ имћть большую положительную цћнность.
Конечно, Дэви на этомъ не остановился. Онъ изслћдуетъ разложеніе растворовъ солей и подтверждаетъ выводъ Берцеліуса и Гизингера. Однако, онъ дћйствуетъ съ еще бóльшей осмотрительностью и старается точнће прослћдить явленія. Къ его услугамъ всевозможныя средства, и онъ ни отъ одного изъ нихъ не отказывается.
Непосредственное наблюденіе показало Дэви, что при гальваническомъ токћ на отрицательномъ полюсћ отлагается водородъ, щелочи, металлы и т. п., а на положительномъ — кислородъ и кислоты. Изъ этого онъ заключаетъ, что первыя вещества получаютъ положительную электрическую энергію, кислородъ же и кислоты — отрицательную. Въ этомъ случаћ, какъ и всегда, тћла съ противоположными зарядами электричества взаимно притягиваются, а потому положительныя тћла выдћляются на отрицательномъ полюсћ и наоборотъ. Благодаря такому предположенію, Дэви составилъ себћ представленіе или, если угодно, объясненіе явленій разложенія, наблюдаемыхъ въ цћпи при прохожденіи тока. Онъ пошелъ еще далће: онъ попытался свести всякое химическое соединеніе и разложеніе къ подобнымъ же причинамъ.
Какъ вы знаете17), Вольта признавалъ, что достаточно простого соприкосновенія двухъ разнородныхъ тћлъ, чтобы привести ихъ въ взаимно противоположное электрическое состояніе; эта гипотеза объясняла ему и его многочисленнымъ сторонникамъ происхожденіе электрическаго тока. Дэви соглашался съ этимъ мнћніемъ и старался непосредственными опытами18) доказать его правильность. {67} Онъ приводилъ въ соприкосновеніе безводныя, изолированныя кислоты и металлы. Посредствомъ электрометра съ золотыми листочками онъ показалъ, что при этомъ кислоты заряжались отрицательнымъ электричествомъ, а металлы — положительнымъ. Подобное же явленіе онъ наблюдалъ и при треніи сћры о мћдь: первая наэлектризовалась положительно, вторая же отрицательно. Далће, Дэви нашелъ, что подобныя электрическія напряженія, какъ въ послћднемъ опытћ, проявляющіяся лишь очень слабо при обыкновенной температурћ, при нагрћваніи значительно возрастаютъ, а при температурћ плавленія сћры очень велики. При дальнћйшемъ повышеніи температуры оба тћла, накаливаясь, соединяются, и полученное соединеніе не наэлектризовяно. Изъ этого Дэви заключаетъ, что процессъ соединенія зависитъ отъ обмћна противоположныхъ электричествъ, и что одновременно появляющіеся теплота и свћтъ суть лишь слћдствія этого обмћна. Химическое сродство, по его мнћнію, вызывается различіемъ электрическихъ свойствъ тћлъ и увеличивается или уменьшается сообразно увеличенію или уменьшенію этого различія. При значительной разности напряженій выравниваніе сопровождается появленіемъ пламени, въ слабо же наэлектризованныхъ тћлахъ наблюдается лишь малое выдћленіе теплоты; но всегда, если только происходитъ соединеніе, электрической энергіи приходится преодолћвать сцћпленіе веществъ. Дэви старается доказать непосредственную зависимость химическаго сродства отъ электрическаго состоянія, при чемъ онъ говоритъ19):
„Подобно тому, какъ химическое притяженіе двухъ тћлъ прекращается, если искусственно привести одно изъ нихъ въ электрическое состояніе, отличное отъ того, которымъ оно обладаетъ въ своемъ обыкновенномъ видћ, т.-е. если ему сообщаютъ то же электрическое состояніе, въ которомъ находится другое тћло, точно также можно увеличить ихъ сродство, повышая ихъ природную электрическую энергію. Такъ, напримћръ, цинкъ становится неспособнымъ къ окисленію, если его наэлектризовать отрицательнымъ электричествомъ, серебро же, напротивъ, очень легко соединяется съ кислородомъ, если оно сильно наэлектризовано положительнымъ электричествомъ. To же самое происходитъ и съ другими металлами”.
Въ другомъ мћстћ Дэви замћчаетъ, что если бы не было сцћпленія, то химическое притяженіе должно было бы быть {68} пропорціональнымъ электрическимъ силамъ; и то, и другое, по его мнћнію, есть дћйствіе одной и той же силы: если послћдняя дћйствуетъ на цћлыя массы, то возникаетъ электричество, при возбужденіи же мельчайшихъ частицъ получается сродство20). Электрическій токъ возвращаетъ атомамъ электричество, выдћлившееся при соединеніи, и вслћдствіе этого наступаетъ разложеніе; при этомъ положительное тћло направляется къ отрицательному полюсу и наоборотъ.
Вы согласитесь со мною, что эти взгляды исходятъ изъ простой и ясной идеи и что они весьма удобно объясняютъ наблюдаемые факты. Они удовлетворяютъ, слћдовательно, требованіямъ, предъявляемымъ къ научной гипотезћ, и обезпечиваютъ Дэви, предложившему эту гипотезу, имя оригинальнаго изслћдователя. Его слава быстро распространилась, и когда ему удалось, годъ спустя, открыть щелочные металлы, то казалось, что онъ первый указалъ химіи правильный путь. Правда, то были лучи солнца, ненадолго лишь озарившіе теорію Дэви, такъ какъ уже черезъ десять лћтъ мы видимъ ее оставленной всћми. Она должна была пасть съ того момента, когда перестали считать соприкосновеніе различныхъ тћлъ источникомъ возбужденія электричества. Именно этотъ взглядъ въ скоромъ времени и подвергся энергичному нападенію. Риттеръ доказалъ21), что гальваническій токъ можетъ возникнуть, лишь если одновременно совершается процессъ химическаго разложенія. Онъ предполагалъ, что электрическія явленія представляютъ собою лишь слћдствіе химическихъ процессовъ, и что одного лишь соприкосновенія тћлъ недостаточно.
Съ этимъ не согласовалась теорія Дэви; она была оставлена по соображеніямъ физическаго порядка, а не химическаго. Но къ тому времени уже возникла новая система, которая была способна съ успћхомъ занять мћсто прежней. Это была элекгрическая теорія Берцеліуса. Я откладываю разсмотрћніе этой теоріи до другой лекціи, такъ какъ для ея пониманія необходимо сперва познакомиться, вообще, съ трудами Берцеліуса. Теперь же, чтобы полнће охарактеризовать вліяніе Дэви на химію, я остановлюсь на сдћланчомъ имъ открытіи калія и натрія и въ связи съ этимъ изложу споръ относительно природы этихъ тћлъ. {69}
При своихъ изслћдованіяхъ относительно превращенія воды въ основныя и кислыя тћла Дэви имћлъ случай познакомиться съ разлагающей силой электрическаго тока, которому не могли противостоять даже стекло, агатъ и полевой шпатъ. Такимъ образомъ, ему пришла мысль подвергнуть дћйствію тока щелочи, чтобы раздћлить ихъ на составныя части, если таковыя дћйствительно существуютъ22). Сперва онъ подвергалъ изслћдованію концентрированные водные растворы кали и натра, и такъ какъ при этомъ ему не удалось получить продуктовъ разложенія, то онъ пропускалъ токъ черезъ расплавленное ћдкое кали. Онъ замћчалъ при этомъ образованіе мелкихъ металлическихъ шариковъ, сгоравшихъ при соприкосновеніи съ воздухомъ съ яркимъ блескомъ. Ему удалось, однако, съ помощью цћлесообразно устроенныхъ приспособленій изолировать небольшія количества калія и натрія и изучить ихъ важнћйшія свойства. Мимоходомъ замћчу, что онъ получилъ калій только въ жидкомъ видћ. Гэ-Люссакъ и Тэнаръ въ 1808 году выработали методъ полученія щелочныхъ металловъ посредствомъ возстановленія ихъ желћзомъ23); употребляя болће чистые матеріалы, они этимъ способомъ получали въ свое распоряженіе значительно бóльшія количества новыхъ тћлъ; такимъ образомъ имъ удалось доказать, что калій при обыкновенной температурћ есть твердое тћло.
Я не могу излагать здћсь полную исторію калія и натрія; она представляетъ интересъ благодаря тому, что всћ опыты Дэви тотчасъ же провћрялись французскими химиками, получавшими съ своей стороны самостоятельные результаты, которые въ свою очередь оспаривались Дэви, и т. д. Но одинъ пунктъ этой довольно оживленной полемики кажется мнћ настолько важнымъ, что я не могу обойти его молчаніемъ: это, именно, взглядъ на конституцію калія и натрія и на отношеніе ихъ къ ћдкимъ щелочамъ.
Дэви наблюдалъ, что при разложеніи ћдкихъ щелочей на отрицательномъ полюсћ отлагаются калій и натрій, а на положительномъ одновременно выдћляется кислородъ24). Онъ, кромћ того, нашелъ, что новыя тћла обладаютъ свойствомъ возстановлять окиси металловъ25), и думалъ26), что при ихъ сгораніи въ кислородћ снова образуется ћдкая щелочь. Изъ этихъ результатовъ онъ выводитъ заключеніе, что ћдкія щелочи являются металлическими окисями, a {70} открытыя имъ тћла представляютъ собою металлы этихъ окисей27). Въ пользу такого мнћнія говорятъ физическія свойства этихъ тћлъ, именно, ихъ металлическій блескъ, тогда какъ свойственный имъ малый удћльный вћсъ могъ считаться доказательствомъ противнаго, — доказательствомъ, правда, недостаточнымъ. Поэтому Дэви предложилъ дать этимъ веществамъ названія Potassium и Sodium, которыя своимъ окончаніемъ должны были выражать ихъ металлическую природу.
Дэви былъ такъ твердо увћренъ въ правильности своей гипотезы относительно состава щелочей, что считалъ окисями многія другія тћла, составъ которыхъ не былъ вполнћ ясенъ для химиковъ того времени. Такъ, напримћръ, подобно многимъ своимъ современникамъ онъ признаетъ присутствіе кислорода въ соляной кислотћ и, вопреки опытамъ Бертолле28), утверждаетъ, что амміачный газъ также есть кислородное соединеніе29); онъ предполагаетъ присутствіе этого элемента въ кремневой кислотћ, которую пытается возстановить30), а также въ „земляхъ”, возстановленіе которыхъ ему, какъ извћстно, удалось31); наконецъ, онъ предполагаетъ присутствіе кислорода даже въ фосфорћ и сћрћ32), но это мнћніе было опровергнуто Гэ-Люссакомъ и Тэнаромъ33).
Спустя нћкоторое время, Дэви занялся изслћдованіемъ амальгамы аммонія34), открытой незадолго передъ тћмъ Зеебекомъ35) и болће подробно изслћдованной Берцеліусомъ и Понтеномъ36). Онъ нашелъ. что она по своимъ свойствамъ аналогична всћмъ другимъ амальгамамъ и призналъ, что эта амальгама представляетъ собой соединеніе ртути съ металлоподобнымъ гипотетическимъ веществомъ аммоніемъ, содержащимъ водородъ и амміакъ. Сравнивая затћмъ аммоній съ металлами, Дэви нашелъ возможнымъ приписать имъ одинаковое строеніе, т.-е. предположить, что въ металлахъ также содержится водородъ, присутствіемъ котораго и можетъ быть объяснена ихъ горючесть. Дэви считаетъ это предположеніе лишь возможностью; онъ совершенно справедливо признаетъ такую гипотезу {71} идентичной теоріи флогистона Кэвендиша и, разумћется, распространяетъ ее на калій и натрій.
Приблизительно въ то же время Гэ-Люссакъ и Тэнаръ пришли къ тому же мнћнію37). Они изслћдовали дћйствіе калія на амміачный газъ и наблюдали образованіе зеленаго вещества (амида калія), сопровождаемое выдћленіемъ водорода. При этомъ опытћ, произведенномъ ими количественно, они нашли, что количество выдћляющагося водорода равно тому, которое выдћлялось бы изъ воды, при дћйствіи на нее такого же вћса калія; кромћ того, они показали, что при разложеніи водою зеленаго вещества, кромћ ћдкаго кали, регенерируется еще и все взятое количество амміака. Они объясняли эти явленія предположеніемъ, что калій состоитъ изъ кали и водорода, и что послћдній освобождается какъ при дћйствіи воды, такъ
и амміака, и одновременно съ этимъ щелочь соединяется съ водой или амміакомъ. Такимъ образомъ, по ихъ мнћнію, амидъ калія состоитъ изъ амміака и кали, и на эти составныя части онъ долженъ разлагаться при дћйствіи воды.
Между тћмъ Дэви вернулся къ своему первому объясненію и выступилъ противъ новћйшихъ результатовъ, полученныхъ Гэ-Люссакомъ и Тэнаромъ38). Но если въ отношеніи точности опытовъ онъ уступаетъ своимъ противникамъ, зато его интерпретація явленій болће удачна и болће остроумна. По его мнћнію, выдћленіе водорода при дћйствіи калія на амміакъ происходитъ отъ разложенія послћдняго, зеленое же вещество состоитъ изъ калія и остатка амміачнаго газа. Это соединеніе при обработкћ водой распадается на свои составныя части, амміакъ регенерируется, а кислородъ воды, присоединяясь къ калію, превращаетъ его въ кали39). — Такъ какъ, кромћ того, Дэви считаетъ расплавленное ћдкое кали безводнымъ, то онъ полагаетъ, что его условія полученія калія служатъ доказательствомъ отсутствія въ немъ водорода.
Гэ-Люссакъ и Тэнаръ сначала настаивали на своемъ первомъ представленіи о каліи и натріи, какъ о водородныхъ соединеніяхъ40); въ этомъ ихъ поддержали появившіяся въ то время сообщенія Бертолле41) и Дарсе42) относительно содержанія воды въ расплавленномъ кали. Но въ 1811 году они присоединяются къ мнћнію Дэви43). {72} Причину такой перемћны мнћнія можно найти въ слћдующихъ фактахъ: замћтивъ, что тћло, происходящее отъ сгоранія калія, отличается отъ кали большимъ содержаніемъ кислорода44), они указываютъ, что содержаніе воды въ новой окиси обусловливается присутствіемъ водорода въ каліи, такъ какъ при сжиганіи его не замћчалось появленія свободной воды. Кромћ того, такъ какъ полученное ими тћло разлагается сухой углекислотой на кислородъ и углекислый калій, то, слћдовательно, гипотеза о составћ калія приводитъ къ признанію присутствія воды въ соляхъ, тогда какъ это совершенно не обнаруживается анализомъ.
Съ того времени неразложимость металловъ уже болће не подвергалась серьезному сомнћнію. Тогда же рћшающими опытами Гэ-Люссака и Тэнара была вновь доказана элементарная природа фосфора и сћры45), благодаря же Бертолле-сыну былъ признанъ ошибочнымъ взглядъ на амміакъ, какъ на тћло, содержащее кислородъ46).
Позвольте мнћ упомянуть еще о научномъ спорћ между Гэ-Люссакомъ и Тэнаромъ, съ одной стороны, и Дэви — съ другой. Этотъ споръ важенъ тћмъ, что онъ прйвелъ къ паденію кислотной теоріи Лавуазье. Дћло касалось состава соляной кислоты. Лавуазье признавалъ въ этой кислотћ, какъ и во всћхъ другихъ, присутствіе кислорода. Это, конечно, никогда не было доказано, но такъ требовала общая теорія, и, такъ какъ она была принята почти всћми безъ исключенія, то присутствіе кислорода въ соляной кислотћ, повидимому, не подвергалось сомнћнію. Я говорю „почти всћми принята”, такъ какъ Бертолле, напримћръ, былъ другого мнћнія. Онъ еще въ 1787 году изслћдовалъ открытую Шееле синильную кислоту47) и нашелъ въ ней только углеродъ, водородъ и азотъ; кромћ того, изъ изслћдованій Шееле извћстно было, что сћроводородъ содержитъ лишь вещества, указываемыя его названіемъ, и потому Бертолле считалъ себя въ правћ допускать, что кислоты могутъ быть образованы и другими элементами, а не только кислородомъ48). Кажется, это мнћніе не нашло большого числа сторонниковъ; что же касается соляной кислоты, то онъ также признавалъ въ ней присутствіе кислорода. Хлоръ разсматривался, какъ окисленная соляная {73} кислота: онъ получается путемъ присоединенія къ ней кислорода.
Эти взгляды были подтверждены опытами Генри и объясненіемъ, которое онъ имъ далъ49). Генри пропускалъ электрическія искры черезъ газообразную хлористоводородную кислоту, находившуюся надъ ртутью, и получалъ водородъ; дћйствіе же, которому подвергался при этомъ металлъ, Генри приписывалъ освободившемуся кислороду. Это привело его къ заключенію, что въ соляной кислотћ находится вода. Такое объясненіе встрћтило всеобщее сочувствіе, такъ какъ оно видимо согласовалось съ изслћдованіями другихъ ученыхъ.
Въ 1808 году Дэви разложилъ натріемъ хлористоводородную кислоту50), и этимъ способомъ получилъ водородъ и поваренную соль; послћднюю онъ получалъ также путемъ сжиганія натрія въ хлорћ. Въ 1809 году онъ доказалъ, что хлористые металлы (muriates) не разлагаются при нагрћваніи съ ангидридами фосфорной и кремневой кислотъ, но что при пропусканіи черезъ эту смћсь водяныхъ паровъ тотчасъ же наступаетъ разложеніе51). Дэви думалъ найти объясненіе этого опыта въ гипотезћ Генри, что соляная кислота выдћляется лишь тогда, когда она встрћчаетъ количество воды, достаточное для ея существованія. Къ этому же времени Гэ-Люссакъ и Тэнаръ показали, что при дћйствіи этой кислоты на окись серебра, кромћ хлористаго серебра образуется еще и вода, которая, по ихъ мнћнію, уже раньше находилась въ соляной кислотћ52). Они произвели затћмъ синтезъ самой кислоты; для этого они подвергли дћйствію солнечнаго свћта смћсь хлора и водорода53). По этому случаю они установили полную теорію относительно соляной кислоты и хлора, съ помощью которой могли объяснить всћ произведенные ими опыты54). Первое тћло, по ихъ мнћнію, есть соединеніе неизвћстнаго радикала, muriaticum, съ кислородомъ и водой, хлоръ же, напротивъ, есть безводная соляная кислота, соединенная съ большимъ количествомъ кислорода, или же обыкновенная соляная кислота съ меньшимъ количествомъ водорода; этимъ очень просто объясняется вышеупомянутый опытъ синтетическаго образованія хлористаго водорода. Такъ же логически вытекаютъ изъ этой гипотезы {74} и другіе относящіеся сюда факты. Впрочемъ, оба французскіе ученые напрасно старались доказать предполагаемое присутствіе кислорода; безуспћшно пропускали они солянокислый газъ черезъ раскаленный уголь: въ немъ не было замћтно никакого измћненія. Возможно, что этотъ отрицательный результатъ и привелъ ихъ къ другому объясненію55). Они высказались, правда, что въ основаніи наблюдаемыхъ явленій можетъ лежать иная гипотеза, а именно, что хлоръ (acide muriatique oxygené) — простое тћло, а соляная кислота есть его водородное соединеніе; но сами они предпочли оставаться вћрными прежней теоріи.
Дэви, пришедшій, кажется, самостоятельно къ тому же заключенію, называетъ себя рћшительнымъ сторонникомъ этой гипотезы56). Онъ придаетъ большое значеніе тому, что она согласуется съ первоначальной идеей Шееле, согласно которой хлоръ считался дефлогистированной соляной кислотой, и пытается подкрћпить теорію новыми доводами и опытами. Онъ указываетъ, что хлоръ переходитъ въ соляную кислоту не вслћдствіе отнятія кислорода, но лишь при дћйствіи на него тћлъ, содержащихъ водородъ, что хлоръ — тћло нейтральное и что, если признать вћрной прежнюю гипотезу, это не согласуется съ теоріей Лавуазье, такъ какъ тогда необходимо была бы также признать, что соединеніе кислорода съ кислотой образуетъ вещество, индифферентное къ лакмусу. Въ заключеніе онъ доказываетъ химикамъ, что они, для сохраненія старой теоріи, принуждены будутъ допустить большее количество гипотетическихъ веществъ, тогда какъ новћйшая теорія объясняетъ факты самымъ простымъ образомъ.
Гэ-Люссакъ и Тэнаръ не соглашаются съ этимъ. Они напечатали въ 1811 году трудъ подъ заглавіемъ: „Recherches physico-chimiques”; здћсь они излагаютъ свои изслћдованія, сравниваютъ обћ теоріи и доказываютъ, что онћ обћ удовлетворяютъ фактамъ57). Тћмъ не менће они высказываются противъ новой системы. Слћдуетъ упомянуть приводимый ими доводъ: если бы хлоръ былъ простымъ тћломъ, то сухая поваренная соль, растворяясь въ водћ, должна была бы ее разложить, образуя солянокислый натрій (natron), a это имъ казалось болће чћмъ невћроятнымъ. Кромћ того, они были {75} слишкомъ большими поклонниками Лавуазье, чтобы такъ дешево уступить установленный имъ принципъ, что всћ кислоты содержатъ кислородъ.
Но это сопротивленіе новой теоріи длилось недолго, факты оказались сильнће ихъ, а Гэ-Люссакъ обладалъ слишкомъ яснымъ умомъ, чтобы оставаться относительно нихъ слћпымъ. Впрочемъ, сторонникомъ теоріи Дэви онъ сдћлался, главнымъ образомъ, благодаря своимъ собственнымъ опытамъ съ іодомъ58), открытымъ Куртуа и описаннымъ Клеманомъ59). Гэ-Люссакъ категорически призналъ его аналогію съ хлоромъ. Въ этомъ же направленіи содћйствовало сдћланное имъ въ 1813 году открытіе іодисто-водородной кислоты. Съ этого времени новая теорія утверждается все болће и болће прочно, и даже Берцеліусу не удается измћнить направленіе идей, несмотря на то, что въ 1815 году онъ въ одной своей статьћ прилагаетъ всевозможныя усилія, чтобы удержать химиковъ отъ рискованнаго шага60). Указавъ, что гипотеза „muriaticum”a попрежнему въ состояніи объяснять факты, онъ обращаетъ вниманіе, что только она одна согласуется съ общей теоріей кислотъ; если же признать отсутствіе кислорода въ соляной кислотћ, то придется провести разграничительную черту между этимъ соединеніемъ и остальными кислотами, съ которыми оно, однако, имћетъ очень много общаго. Въ такомъ случаћ и соли пришлось бы раздћлить на два класса, т.-е. признать различную конституцію въ тћлахъ одной группы, свойства которыхъ являются во всћхъ отношеніяхъ сходными. Основываясь далће на законахъ соединеній, онъ считаетъ, что хлоръ не элементъ. Я близко этого касаться не буду, такъ какъ его доводы имћли лишь неболыиой успћхъ: онъ слишкомъ запоздалъ. Изслћдованіе синильной кислоты, произведенное Гэ-Люссакомъ въ томъ же году61), неопровержимо доказало кислую природу этого соединенія и отсутствіе въ немъ кислорода; поэтому представленіе Лавуазье и Берцеліуса, о кислотахъ и о кислото-производящемъ началћ не могло болће удержать подъ собой почвы.
Тогда стали искать какую-либо другую причину, которая могла бы опредћленнымъ тћламъ сообщать кислый характеръ. Въ то время {76} понятіе о кислотћ казалось настолько опредћленнымъ, и тћла, причисленныя къ этому классу, были такъ рћзко выдћлены изъ всћхъ другихъ веществъ, что неизбћжно возникалъ вопросъ о причинахъ, обусловливающихъ это разграниченіе. Кромћ того, нельзя отрицать, что Лавуазье и даже химики начала 19-аго столћтія находились еще подъ вліяніемъ идей греческихъ философовъ. Послћдніе объясняли общія свойства тћмъ присутствіемъ одной одинаковой составной части, которая какъ бы олицетворяла собой эти свойства; такъ, напримћръ, способность горћнія они объясняли присутствіемъ огненной матеріи; подобно этому, Лавуазье и его сторонники считали, что въ кислородћ содержится начало, производящее кислоты.
Сообразно съ этимъ, Дэви, убћжденный, что соляная кислота содержитъ лишь водородъ и хлоръ, выражаетъ слћдующее мнћніе: кислото-производящимъ началомъ этой кислоты является хлоръ, а основаніемъ, или радикаломъ, является водородъ62). Впослћдствіи Гэ-Люссакъ ввелъ63) для кислотъ, лишенныхъ кислорода, названіе водородныхъ кислотъ „Hydracides”; къ нимъ онъ причисляетъ соляную и синильную кислоты, сћроводородъ и іодисто-водородную кислоту. Хотя и было найдено, что причина кислотности заключается скорће въ хлорћ, іодћ и т. д., чћмъ въ водородћ, но послћдній являлся болће подходящимъ для образованія общаго имени, такъ какъ онъ является составной частью всћхъ этихъ кислотъ. Изслћдованія Дэви надъ хлорноватой и іодноватой кислотами привели его къ значительно болће общимъ взглядамъ: „Кислыя свойства необусловливаются соединеніемъ съ однимъ особеннымъ элементомъ, новозникаютъ вслћдствіе особеннаго соединенія различныхъ элементовъ64)”.
Тогда же онъ пытался доказать, что не въ кислородћ кроется причина, вызывающая своеобразный характеръ кислотъ. Такъ, напримћръ, если кислородъ прибавить къ поваренной соли, то нейтральность соединенія не будетъ нарушена и, съ другой стороны, жадность (Sattigungskapacitat) хлорноватой кислоты не измћнится, если отъ нея отнять весь кислородъ. Это побуждаетъ Дэви не считать болће хлорноватую кислоту окисью радикала хлора (согласно {77} взглядамъ Лавуазье), образующую съ водой гидратъ кислоты; онъ находитъ, что хлорноватая кислота не можетъ существовать безъ воды и потому считаетъ ее тройнымъ соединеніемъ водорода, хлора и: кислорода. Также и существованіе euchlorin'a, полученнаго изъ хлорноватой и соляной кислотъ65), дало ему аргументъ противъ гипотезы Лавуазье о кислотахъ.
Въ разсужденіяхъ Дэви можно найти основаніе новой теоріи кислотъ, но онъ недостаточно ее развилъ; если бы онъ это сдћлалъ, то, можетъ быть, было бы избћгнуто разграниченіе, которое въ то время начали дћлать между кислотами съ кислородомъ и безъ него. To же можно сказать и относительно Дюлонга. Послћдній въ 1815 году прочиталъ во Французской Академіи мемуаръ, въ которомъ излагалъ свой взглядъ на кислоты; къ сожалћнію, этотъ трудъ, кажется, не былъ напечатанъ in extenso, поэтому я могу сообщить о немъ лишь немногое66). Дюлонгъ изучалъ въ то время щавелевую кислоту. Характерныя особенности нћкоторыхъ солей ея, которыя при нагрћваніи выдћляютъ воду, внушили ему идею, что щавелевую кислоту можно разсматривать какъ водородное соединеніе угольной кислоты, т. е. какъ гидроуглекислоту. При насыщеніи окисью металла, кислородъ окиси соединяется съ водородомъ щавелевой кислоты, образуя воду, которая можетъ быть удалена, и остается соединеніе углекислоты съ металломъ. Здћсь мы впервые встрћчаемся со взглядомъ (у Дюлонга, какъ и у Дэви), что вода, получаемая при образованіи соли, ранће не содержалась въ кислотћ (кислородной), и что въ соли находится металлъ, какъ таковой, a не въ видћ окиси.
Говорятъ, что Дюлонгъ высказывалъ подобное же мнћніе и относительно другихъ кислотъ, но, къ сожалћнію, его идеи не дошли до насъ полностыо. Впрочемъ, въ то время подобныя гипотезы встрћчали лишь малое сочувствіе, и со всћхъ сторонъ противъ нихъ высказывались возраженія. Гэ-Люссакъ рћшительно высказался противъ этой гипотезы67). Берцеліусъ, который въ то время уже пользовался значительнымъ вліяніемъ, былъ вынужденъ признать существованіе безкислородныхъ кислотъ, но онъ ввелъ теперь {78} строгое разграниченіе между этими послћдними и кислородными соединеніями того же класса, между галоидными и амфидными солями.
Однако, нельзя выхватывать этотъ отдћльный пунктъ изъ всей системы Берцеліуса; эту послћднюю нужно разсматривать въ ея цћломъ. Взгляды Берцеліуса имћютъ очень большое значеніе, такъ какъ они господствовали въ теоретической химіи въ теченіе 20 лћтъ. Мы посвятимъ имъ слћдующую лекцію
| {79} |
Берцеліусъ и его химическая система. — Законъ Днрлонга и Пти. — Изоморфизмъ. — Гипотеза Проута. — Опредћленіе плотности пара по Дюма.— Гмелинъ и его школа.
Берцеліусъ въ основаніе своихъ теорій кладетъ дуализмъ. Еще до него считалось, что соединенія въ большинствћ случаевъ состоятъ изъ двухъ частей. Единообразная точка зрћнія стала возможной здћсь лишь послћ знакомства съ электрохимическими явленіями; заслуги же Берцеліуса, и притомъ весьма значительныя, состоятъ въ томъ, что онъ ввелъ эти начала въ науку и провелъ ихъ черезъ всю систему.
По его мнћнію, сложныя тћла образуются путемъ сложенія атомовъ1). Изъ мельчайшихъ частицъ элементовъ такимъ образомъ возникаютъ соединенія перваго порядка, которыя, въ свою очередь, способны образовать соединенія второго порядка, и т. д. Берцеліусъ, какъ и его предшественники, пытается найти причину соединенія двухъ атомовъ въ ихъ сродствћ. Съ другой стороны, онъ, какъ и Дэви, полагаетъ, что это сродство есть лишь слћдствіе электрическихъ свойствъ мельчайшихъ частицъ. Но въ своихъ воззрћніяхъ на распредћленіе электричества Берцеліусъ существенно расходится съ англійскимъ химикомъ. Помимо того обћ теоріи имћли въ нашей наукћ совершенно различное значеніе. Конечно, идеи Дэви о соотношеніи между электрическими и химическими явленіями были геніальны; но изъ этихъ гипотезъ, съ помощью которыхъ можно было превосходно объяснить цћлый рядъ фактовъ, Дэви не {80} создалъ теоріи, способной служить основаніемъ химической системы. Это впервые сдћлалъ Берцеліусъ. Онъ поставилъ задачей своей жизни, ввести въ химію такую единообразную систему, которая была бы примћнима ко всћмъ извћстнымъ фактамъ. Эта цћль была имъ достигнута. Поэтому-то для развитія химіи взгляды Берцеліуса имћютъ несравненно большее значеніе, чћмъ взгляды Дэви.
По мнћнію Берцеліуса электричество возникаетъ не отъ соприкосновенія двухъ тћлъ, но является свойствомъ матеріи: въ каждомъ атомћ предполагается существованіе двухъ противоположныхъ электрическихъ полюсовъ2). Полюсы, однако, не содержатъ равныхъ количествъ электричества; атомы униполярны, т.-е. электричество одного полюса преобладаетъ надъ электричествомъ другого такъ, что каждый атомъ (слћдовательно, и каждый элементъ) оказывается электрически положительнымъ или отрицательнымъ. Въ этомъ отношеніи всћ простыя тћла могутъ быть распредћлены въ рядъ, въ которомъ каждый предыдущій членъ оказывается болће электроотрицательнымъ, чћмъ послћдующій (рядъ напряженій). На первомъ мћстћ стоитъ кислородъ, онъ абсолютно электроотрицателенъ3), тогда какъ другія тћла лишь относительно положительны или отрицательны, смотря по тому, гдћ стоятъ въ электрическомъ рядћ тћ элементы, съ которыми они сравниваются: впереди нихъ или послћ нихъ. Впрочемъ, рядъ напряженій не представляетъ собою таблицы сродства въ родћ предложенной Жоффруа-Бергманномъ: онъ не выражаетъ сродства отдћльныхъ тћлъ, напримћръ, по отношенію къ кислороду, — Берцеліусъ не забылъ ученія Бертолле, — сродство не есть нћчто постоянное, не зависящее отъ физическихъ условій, каковой должна быть удћльная униполярность. Шведскому ученому, далће, было хорошо извћстно, что кислородъ можетъ быть отнятъ отъ металловъ съ помощью угля, сћры, т.-е. другихъ электроотрицательныхъ тћлъ. Сродство обусловливается, главнымъ образомъ, интенсивностью полярности, т.-е. количествомъ электричества, содержащагося на обоихъ полюсахъ. Но это количество непостоянно, оно измћняется съ температурой. Вообще оно повышается при увеличеніи температуры, и этимъ объясняется, почему нћкоторыя соединенія образуются лишь при высокой температурћ4). {81}
При соединеніи двухъ элементовъ атомы сходятся своими противоположными полюсами и обмћниваются свободными электричествами, что вызываетъ свћтовыя и тепловыя явленія. Этимъ одно временно объясняется старое положеніе: Corpora non agunt nisi soluta, такъ какъ только въ жидкомъ состояніи возможно свободное движеніе мельчайшихъ частицъ. — Если какое-нибудь соединеніе подвергнуть дћйствію электрическаго тока, то онъ сообщаетъ атомамъ ихъ первоначальную полярность, вслћдствіе чего это соединеніе распадается на свои составныя части.
Соединеніе перваго порядка электрически (какъ и химически) не недћятельно, такъ какъ при соединеніи только одинъ полюсъ нейтрализуется; оно остается еще унигюлярнымъ и можетъ образовать дальнћйшія соединенія (второго порядка), которыя еще обладаютъ электрическими силами; но эти силы будутъ ослабћвать по мћрћ повышенія порядка соединенія, такъ какъ, вообще, сперва выравниваются болће сильные полюсы. По мнћнію Берцеліуса специфическая униполярность окисей зависитъ лишь отъ связаннаго съ кислородомъ радикала или элемента. Кислородъ производитъ наиболће электроположительныя и наиболће электроотрицательныя тћла (щелочи и кислоты); онъ не можетъ быть причиной въ обоихъ случаяхъ, и потому онъ не является таковой ни въ одномъ5).
Всћ химическія реакціи, какъ и сопровождающія ихъ свћтовыя и тепловыя явленія, по мнћнію Берцеліуса, вызываются электричествомъ: „электричество есть первая дћйствующая сила окружающей насъ природы”6).
Если тћло C должно разложить соединеніе АВ такъ, чтобы В освободилось, то C должно нейтрализовать большее количество электрической полярности тћла А, чћмъ это можетъ тћло В. Далће, двойной обмћнъ между АВ и CD наступитъ лишь въ томъ случаћ, если въ AC и BD электрическія полярности выравнены лучше, чћмъ это имћло мћсто ранће. Берцеліусъ, подобно Бертолле, признаетъ, что происходящія въ такихъ реакціяхъ явленія зависятъ отъ массы и сцћпленія, но въ отличіе отъ Бертолле онъ считаетъ сродство функціей электрической полярности независящей отъ способности къ насыщенію.
Эта теорія сдћлалась основаніемъ дуалистическаго ученія, которое Берцеліусъ излагаетъ въ слћдующихъ выраженіяхъ7): {82}
„Если электрохимическія воззрћнія вћрны, то изъ этого слћдуетъ, что каждое химическое соединеніе зависитъ единственно отъ двухъ противоположныхъ силъ, положительнаго и отрицательнаго злектричества, и что каждое соединеніе должно состоять изъ двухъ частей, соединенныхъ дћйствіемъ ихъ электрохимической реакціи, такъ какъ никакой третьей силы не существуетъ. Изъ этого слћдуетъ, что каждое сложное тћло изъ сколькихъ бы частей оно ни состояло, можетъ быть раздћлено на двћ,части, изъ которыхъ одна будетъ электрически-положительной, а другая — отрицательной. Такъ, напримћръ, сћрнокислый натрій состоитъ не изъ сћры, кислорода и натрія, а изъ сћрной кислоты и натра, которые, въ свою очередь, могутъ быть раздћлены на положительную и отрицательную части. Точно также нельзя считать, что квасцы составлены непосредственно изъ своихъ элементарныхъ частей: квасцы являются результатомъ реакціи между сћрнокислымъ алюминіемъ — отрицательнымъ элементомъ — и сћрнокислымъ каліемъ — положительнымъ; такимъ образомъ, электрохимическая теорія оправдываетъ то, что я говорилъ о сложныхъ атомахъ перваго порядка, второго, третьяго и т. д.”.
Какъ видите, Берцеліусъ составилъ себћ опредћленный взглядъ, на строеніе соединеній; онъ зашелъ такъ далеко, что считалъ недопустимымъ самое естественное предположеніе, т.-е. что вещество состоитъ изъ своихъ элементарныхъ составныхъ частей. Онъ полагалъ, что вполнћ точно знаетъ расположеніе атомовъ въ соединеніи, главнымъ образомъ, на основаніи разложенія, производимаго электрическимъ токомъ, и свой взглядъ считалъ единственно пріемлемымъ.
Въ видћ дополненія къ соединеніямъ Берцеліусъ разсматриваетъ растворы; онъ не помћщаетъ ихъ въ одинъ классъ съ первыми уже потому, что при раствореніяхъ наблюдается поглощеніе теплоты и, слћдовательно, при этомъ не можетъ происходить никакого электрическаго выравниванія8).
Прежде чћмъ обратиться къ дальнћйшему изложенію системы Берцеліуса, а именно къ его интереснымъ и въ высшей степени важнымъ методамъ опредћленія атомныхъ вћсовъ, я хотћлъ бы упомянуть о предложенныхъ имъ за нћсколько лћтъ передъ тћмъ {83} номенклатурћ9) и системћ обозначенія10). Я коснусь этого лишь вкратцћ потому, что его номенклатура является лишь усовершенствованіемъ хорошо вамъ извћстнаго метода Гюитона, Лавуазье, Бертолле и Фуркруа11); я ограничусь лишь самымъ существеннымъ и наиболће характернымъ для точки зрћнія Берцеліуса.
Всћ тћла раздћляются на вћсомыя и невћсомыя. Къ послћднимъ принадлежатъ: электричество, магнитизмъ, теплота и свћтъ. Первыя же раздћляются на элементы и соединенія, растворы и смћси. Къ простымъ тћламъ Берцеліусъ относитъ металлы и металлоиды. Здћсь онъ употребляетъ слово, которымъ до него пользовался Эрманъ для обозначенія щелочныхъ и земельныхъ металловъ12); но лишь Берцеліусъ придалъ ему значеніе, сохранившееся до нашего времени.
Кислородныя соединенія носятъ названіе окисей или кислотъ. Тћла этого класса, не обладающія ни основными, ни кислыми свойствами и содержащія сравнительно малое количество отрицательнаго элемента, носятъ названіе закисей. Основныя кислородныя соединенія, образующія соли, называются просто окисями; если элементъ или радикалъ образуетъ въ соединеніи съ кислородомъ два тћла этого рода, то ихъ различаютъ по окончанію, прибавляемому къ спеціальному названію; это легко выполнимо въ латинской номенклатурћ, предложенной Берцеліусомъ, напримћръ, oxydum ferrosum (съ меньшимъ содержаніемъ кислорода) и oxydum ferricum. Наконецъ, различаютъ еще перекиси, которыя содержатъ сравнительно много кислорода, и которыя для образованія солей должны быть предварительно возстановлены.
Интересны взгляды Берцеліуса на различныя соединенія съ водой; послћдняя, по его мнћнію, можетъ образовать соединенія троякаго рода. Вода играетъ либо роль кислоты, какъ въ ћдкихъ щелочахъ, либо же роль основанія, когда соединяется съ кислотами. Въ обоихъ случаяхъ она называется гидратной водой и отличается отъ кристаллизаціонной воды, которая входитъ въ составъ солей и можетъ быть отнята безъ существеннаго измћненія ихъ характера.
Выработанный Берцеліусомъ способъ обозначенія вполнћ оригиналенъ и настолько практиченъ, что сохранился до нашихъ дней почти безъ измћненія. Атомный вћсъ элемента обозначается начальными буквами его латинскаго названія; если поставить рядомъ знаки {84} элементовъ, то получается атомъ (атомный вћсъ) соединенія. Если въ одномъ соединеніи встрћчается нћсколько атомовъ одного и того же элемента, то число ихъ обозначается цифрой, поставленной справа вверху (или внизу) отъ знака элемента. Исключеніе сдћлано для такъ называемыхъ двойныхъ атомовъ (два атома одного элемента, встрћчающіеся вмћстћ), ихъ обозначаютъ перечеркнутымъ атомнымъ знакомъ13). Такъ, напримеръ, H = Н2 обозначаетъ два атома водорода, HО = Н2O — одинъ атомъ воды, состоящій изъ двухъ атомовъ водорода и одного атома кислорода и т. д.
При болће сложныхъ соединеніяхъ нћкоторыя буквы отдћляются отъ другихъ знакомъ +; способъ раздћленія обусловленъ дуалистическимъ воззрћніемъ. Для большей краткости атомъ кислорода изображается иногда точкой, а атомъ сћры вертикальной чертой, помћщенными въ соединеніяхъ надъ знакомъ соотвћтственнаго элемента, соединеннаго съ кислородомъ или сћрой; но этотъ способъ обозначенія уже оставленъ.
Мы ограничимся этими указаніями и перейдемъ къ гораздо болће важному пункту въ системћ Берцеліуса, а именно, къ способу опредћленія числа атомовъ въ соединеніи. Онъ первый при этомъ опредћленіи основывался лишь на химическихъ и физическихъ данныхъ. Онъ совершенно отказывается отъ правилъ Дальтона, вполнћ правильно указывая на ихъ необоснованность: „Даже когда извћстно лишь одно соединеніе двухъ тћлъ, мы поступили бы произвольно, если бы мы, не считаясь со всћми другими свойствами этого соединенія, предположили, что оно содержитъ по одному только атому каждаго элемента”14).
Берцеліусъ старается въ слћдующихъ выраженіяхъ доказать, что должны существовать правила, регулирующія число атомовъ, соединяющихся между собою15).
„Если бы неограниченное число атомовъ одного элемента могло соединяться съ безконечнымъ числомъ атомовъ другого элемента, то получилось бы безчисленное количество соединеній, которыя такъ мало различались бы по своему составу, что даже наши лучшіе анализы не могли бы обнаружить въ нихъ никакихъ различій. Такимъ образомъ, для объясненія закона кратныхъ отношеній недостаточно гипотезы, что тћла состоятъ изъ недћлимыхъ атомовъ, {85} отъ сложенія которыхъ возникаютъ химическія соединенія; необходимо, чтобы были еще особые законы, регулирующіе соединеніе атомовъ и ограничивающіе число этихъ соединеній. Отъ такихъ законовъ преимущественно и зависятъ химическія отношенія”.
Берцеліусъ находитъ первую точку опоры въ объемномъ законћ Гэ-Люссака.
По мнћнію Берцеліуса, этотъ законъ даетъ возможность опредћленно рћшить вопросъ, потому что для простыхъ газовъ Берцеліусъ считаетъ атомъ идентичнымъ съ объемомъ. Намъ, напримћръ, достовћрно извћстны относительныя количества атомовъ азота и водорода въ амміакћ, количество атомовъ хлора и кислорода въ кислородныхъ соединеніяхъ перваго и т. д.”16). Для газовъ законъ кратныхъ отношеній подтверждается правиломъ Гэ-Люссака; поэтому, измћряя объемы газовъ, Берцеліусъ получаетъ возможность сосчитать число атомовъ, соединяющихся между собой. Такъ какъ, напримћръ, 2 объема водорода соединяются съ 1 объемомъ кислорода, то вода состоитъ изъ 2 атомовъ водорода и 1 атома кислорода. Берцеліусъ не понимаетъ, какъ можно придерживаться другого мнћнія, и полемизируетъ съ Томсономъ, который предполагаетъ, что въ одномъ объемћ водорода вдвое меньше атомовъ, чћмъ въ такомъ же объемћ кислорода.
Было предположено, что вода состоитъ изъ 1 атома кислорода и 1 атома водорода; но такъ какъ она содержитъ 2 объема второго газа на 1 объемъ перваго, то отсюда вывели заключеніе, что въ водородћ и въ горючихъ тћлахъ, вообще, на объемъ приходится лишь половина вћса атома, тогда какъ объемъ и атомъ кислорода имћютъ одинъ и тотъ же вћсъ. Такъ какъ это предположеніе произвольно, и справедливость его не можетъ быть когда-либо провћрена, то мнћ кажется, что будетъ проще и вћроятнће допустить въ горючихъ тћлахъ такое же вћсовое отношеніе, какъ и въ кислородћ, такъ какъ нћтъ повода предполагать между ними различіе. Если мы примемъ, что вода состоитъ изъ 2 атомовъ радикала и 1 атома кислорода, то теоріи корпускулярная (атомная) и объемная совпадутъ, такъ что различіе между ними зависитъ лишь отъ аггрегатнаго состоянія, въ которомъ онћ представляютъ намъ тћла”17). {86}
Слћдуетъ отмћтить, что Берцеліусъ не распространяетъ своихъ воззрћній о тождественности объема и атома на сложные газы: атомы этихъ послћднихъ по объему отличны какъ между собою, такъ и отъ простыхъ газовъ. Правильность этого предположенія выясняется изъ опредћленій атомнаго вћса. Для Берцеліуса H = 1 = 1 объему 1 атома водорода, Н2O = 18 = 2 объемамъ 1 атома воды. HCl = 73 = 4 объемамъ 1 атома соляной кислоты и т. д.18).
Берцеліусъ не признаетъ различія, введеннаго Авогадро и Амперомъ, между химическимъ и физическимъ атомами; онъ старается обойти затрудненія заставившія Дальтона отрицать законъ Гэ-Люссака, тћмъ, что совершенно разграничиваетъ простые и сложные газы.
Вполнћ понятно, что объемный законъ и заключенія, выведенныя изъ него Берцеліусомъ, недостаточны. Онъ примћнимъ лишь для опредћленія относительнаго количества атомовъ весьма немногихъ соединеній, и потому основатель первой химической системы долженъ былъ искать другія, общепримћнимыя точки опоры. Онъ устанавливаетъ слћдующія правила19), примћнимыя, однако, лишь къ неорганическимъ тћламъ.
I. Одинъ атомъ одного элемента соединяется съ 1, 2, 3 и т. д. атомами другого элемента.
Границы Берцеліусъ не указываетъ. Въ 1819 году онъ, правда, полагалъ, что только въ рћдкихъ случаяхъ возможны соединенія болће чћмъ четырехъ атомовъ одного элемента съ 1 атомомъ другого элемента, но позже (1828 г.) онъ отказался отъ этого ограниченія.
II. Два атома одного элемента могутъ соединяться съ 3 или 4 атомами другого элемента.
Это правило приводитъ къ обсужденію вопроса, будетъ ли соединеніе изъ 2 атомовъ одного элемента съ 4 или 6 атомами другого идентично съ соединеніемъ атома перваго элемента съ 2 или съ 3 атомами второго или нћтъ. Въ своемъ учебникћ (1828 г.) онъ склоненъ рћшить этотъ вопросъ отрицательно; въ то время уже были извћстны изомерныя тћла. {87}
Совершенно аналогичны законы соединеній сложныхъ атомовъ 1-го, 2-го и 3-го порядка; къ нимъ, однако, слћдуетъ примћнить извћстныя ограниченія, зависящія отъ того, что „если соединяются сложные атомы, то они содержатъ одну общую составную часть, наэлектризованную либо отрицательно, либо же, что рћже, положительно; тогда отношенія, въ которыхъ эти атомы соединяются, опредћляются ихъ общимъ элементомъ такъ, что количества его, находящіяся въ двухъ составныхъ частяхъ, относятся между собою, какъ 1 къ 1, 2, 3, 4, 5, 6 и т. д. или какъ 3 къ 2 или къ 4, или, наконецъ, какъ 5 къ 2, 3, 4, 41/2 и 6”20).
Интересно видћть, какимъ образомь Берцеліусъ опредћляетъ съ помощью этихъ правилъ число атомовъ въ какомъ-либо комплексћ. Для примћра я возьму кислородныя соединенія, которыя безспорно имћютъ наиболће важное значеніе.
Берцеліусъ считалъ установленнымъ (именно путемъ изслћдованія объемныхъ отношеній газовъ), что обыкновенно изъ электроотрицательной составной части образуется нћсколько атомовъ, и тогда вышеупомянутыя правила для даннаго случая переходятъ въ слћдующія21):
I. Если одинъ элементъ или радикалъ образуетъ нћсколько окисей, въ которыхъ количество кислорода относится къ опредћленному количеству другого элемента, какъ 1 къ 2, то нужно допустить, что первое соединеніе состоитъ изъ 1 атома радикала и 1 атома кислорода, второе же — изъ 1 атома радикала и 2 атомовъ кислорода (или же изъ двухъ атомовъ радикала и 4 атомовъ кислорода). Если же отношеніе равно 2:3, то первое соединеніе состоитъ изъ 1 атома радикала и 2 атомовъ кислорода, а второе — изъ 1 атома радикала и 3 атомовъ кислорода и т. д.
На основаніи этого правила Берцеліусъ въ 1819 году обозначаетъ окись натрія посредствомъ NaO2, a перекись — NaO3; аналогичный видъ имћютъ его формулы и для другихъ окисловъ. Вслћдствіе этого атомные вћса металловъ, установленные имъ въ то время, оказались вдвое больше тћхъ, которые онъ впослћдствіи {88} (1828 г.) призналъ окончательно22). Въ своемъ учебникћ онъ дћлаетъ слћдующее добавленіе23) къ правилу, на основаніи соображеній, съ которыми мы сейчасъ познакомимся:
I. Если количества кислорода въ двухъ соединеніяхъ относятся, какъ 2 къ 3, то въ первомъ соединеніи 1 атомъ радикала можетъ быть соединенъ съ 1 атомомъ кислорода, во второмъ же 2 атома радикала могутъ быть соединены съ 3 атомами кислорода.
II. Если положительная окись соединяется съ отрицательной, напримћръ, основаніе съ кислотой, то кислородъ послћдней будетъ кратнымъ числа атомовъ кислорода въ первомъ, и обыкновенно это число указываетъ въ то же время количество кислородныхъ атомовъ въ отрицательномъ окислћ.
Въ 1819 году Берцеліусъ въ своей теоріи химическихъ отношеній установилъ только эти два правила. Но къ переводу второго изданія его учебника (1-ое нћмецкое изданіе) были добавлены новыя правила, вызванныя открытіемъ изоморфизма, сдћланнымъ Митчерлихомъ, и соотношеніями, которыя Дюлонгъ и Пти (въ 1819 г.) установили между атомнымъ вћсомъ твердыхъ элементовъ и ихъ удћльной теплотой.
Такъ какъ оба изслћдованія имћютъ громадное значеніе для взглядовъ Берцеліуса на разбираемый здћсь вопросъ, то, прежде чћмъ продолжать объ опредћленіи атомныхъ вћсовъ, я приведу результаты этихъ работъ.
Дюлонгъ и Пти доказали при помощи точныхъ опытовъ24), что произведенія удћльной теплоты на атомные вћса элементовъ: висмута, свинца, платины, олова, серебра, цинка, теллура, мћди, никкеля, желћза, кобальта и сћры почти равны между собой; отсюда они вывели заключеніе, что это правило приложимо ко всћмъ простымъ тћламъ и можетъ служить для точнаго опредћленія атомнаго вћса.
При выводћ этого закона Дюлонгъ и Пти взяли для атомныхъ вћсовъ большинства металловъ по отношенію къ атомному вћсу сћры числа вдвое меныиія, чћмъ тћ, которыя Берцеліусъ далъ {89} въ 1819 году. Для атомнаго вћса сћры они, подобно Берцеліусу, принимали 201 (O = 100), но для атомнаго вћса желћза они взяли Fe = 339, тогда какъ по Берцеліусу Fe = 693. Согласно ихъ закону, атомный вћсъ серебра былъ въ четыре раза меныие числа, которое даетъ Берцеліусъ. Для теллура и кобальта они получили еще болће отклоняющіеся результаты, но эти числа не заслуживаютъ довћрія, такъ какъ послћдующіе изслћдователи Реньо25) и Коппъ26) нашли другія, болће подходящія числа.
Пользуясь случаемъ, я замћчу, что Нейманъ въ 1831 г.27) указалъ, что законъ Дюлонга и Пти можно распространить и на соединенія съ аналогичнымъ составомъ, т.-е. что удћльная теплота ихъ, умноженная на эквивалентный вћсъ (какъ говоритъ Нейманъ), даетъ для всћхъ такихъ соединеній постоянное произведеніе. Это правило было доказано для углекислыхъ и сћрнокислыхъ солей.
Прежде чћмъ перейти къ интереснымъ результатамъ изслћдованія Митчерлиха, я приведу нћкоторыя историческія данныя. По Гаюи кристаллическая форма (основная форма) служитъ существеннымъ признакомъ при опредћленіи природы тћла, различіе же формы даетъ основаніе предполагать различіе состава28); но это оспаривалъ Бертолле29). Гэ-Люссакъ въ 1816 году нашелъ, что кристаллы калійныхъ квасцовъ въ растворћ амміачныхъ квасцовъ увеличиваются въ объемћ, но формы своей не измћняютъ30); относительно этого далъ также очень интересныя указанія Бёданъ31), a Ж. Н. фонъ-Фуксъ32) указалъ уже въ 1817 году на сходство кристаллическихъ формъ аррагонита, стронціанита и церуссита. Гейленъ указалъ, что ему удалось получить кристаллы натріевыхъ квасцовъ33).
Все это были отдћльныя наблюденія, которыя не могли поколебать ученіе Гаюи и получили значеніе лишь послћ того, какъ Митчерлихъ открылъ явленіе изоморфизма34). Этотъ изслћдователь въ 1820 году установилъ, что соотвествующія одна другой фосфорно-кислыя и мышьяковокислыя соли съ одинаковымъ числомъ атомовъ воды имћютъ одну и ту же кристаллическую форму, такъ что даже {90} вторичныя формы совпадаютъ. Тогда уже было признано, что обћ кислоты содержатъ равное число атомовъ, и это навело Митчерлиха на мысль, что именно сходство атомистическаго строенія вызываетъ идентичность формъ. И дћйствительно, ему удалось доказать это положеніе на цћломъ рядћ фактовъ. Онъ назвалъ изоморфными тћ тћла, которыя въ соотвћтственныхъ соединеніяхъ имћютъ одинаковую кристаллическую форму; такія соединенія могутъ вмћстћ кристаллизоваться, а также замћщать другъ друга въ неопредћленныхъ отношеніяхъ. Онъ указалъ на изоморфизмъ селеновой и сћрной кислотъ, магнезіи, окиси цинка, закиси никкеля, закиси желћза и др. въ ихъ нейтральныхъ сћрнокислыхъ соляхъ; изоморфны также окиси алюминія, желћза и марганца. Кромћ того, онъ указалъ еще на то, что наблюдавшаяся Бёданомъ совмћстная кристаллизація желћзнаго и мћднаго купороса, двухъ солей съ различнымъ содержаніемъ воды и разной кристаллической формы, основана на томъ, что содержаніе воды одного соединенія измћняется и становится равнымъ содержанію ея въ другомъ.
Другіе изслћдователи подтвердили правило Митчерлиха многочисленными наблюденіями35), вслћдствіе чего въ то время придавали большое значеніе кристаллической формћ тћлъ, и считали ее средствомъ для сужденія объ атомной конституціи тћлъ. Въ особенносги Берцеліусъ, тотчасъ оцћнившій все значеніе этого важнаго открытія, примћнилъ его для построенія своей системы. Изоморфизмъ привелъ его къ слћдующему правилу36):
III. Если одно тћло изоморфно съ другимъ, въ которомъ число атомовъ намъ извћстно, то тћмъ самымъ дћлается извћстнымъ число атомовъ въ обоихъ тћлахъ, такъ какъ изоморфизмъ есть лишь механическое слћдствіе одинаковаго атомнаго строенія.
Руководствуясь этими правилами, Берцеліусъ старается опредћлить число атомовъ въ соединеніи, откуда онъ можетъ затћмъ вывести атомные вћса. Онъ ясно понималъ, чго его правила во многихъ {91} случаяхъ не годятся для окончательнаго опредћленія и что они, собственно говоря, даютъ опредћленные результаты лишь для газообразныхъ элементовъ: но, сознавая всю шаткость почвы подъ своими ногами, онъ потому именно дћйствуетъ въ высшей степени осторожно; достойно удивленія, какъ часто Берцеліусъ, благодаря своему тонкому чутью, находитъ истину тамъ, гдћ у него нћтъ почти никакой точки опоры.
Берцеліусъ составляетъ для окисловъ рядъ, указывающій ему относительныя количества кислорода, съ которыми соединяются опредћленные вћса металловъ. При этомъ нћтъ необходимости устанавливать подобную таблицу для каждаго металла: пользуясь закономъ Митчерлиха, можно замћнить степени окисленія, недостающія какому-нибудь элементу, соединеніями изоморфнаго элемента.
Вотъ этотъ рядъ:37)
Относит. коли- | |
Закись мћди . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | 1 |
Окись мћди, закись желћза и т. д. . . . . . . . . . . . | 2 |
Окись желћза, закись марганца, сурикъ и т. д. . . | 3 |
Бурая перекись свинца, перекись марганца. . . . . . | 4 |
Марганцовистая кислота и т. д. . . . . . . . . . . . . . . | 5 |
Прилагаю подобную же, но болће правильную, таблицу 1835 года38).
Закись мћди . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | 1 |
Окись мћди, закись желћза и т. д. . . . . . . . . . . . . . | 2 |
Окись желћза, закись марганца и т. д. . . . . . . . . . . | 3 |
Бурая перекись свинца, перекись марганца и т. д. | 4 |
Азотная кислота, хлорноватая кислота и т. д. . . . . | 5 |
Хлорная кислота, марганцовая кислота и т. д. . . . . | 7 |
Въ упомянутыхъ здћсь соединеніяхъ Берцеліусъ допускаетъ 1, 2, 3, 4, 5, (и 7) атомовъ кислорода, и такимъ образомъ дћлаетъ наипростћйшее предположеніе. Затћмъ остается лишь опредћлить количества атомовъ радикала или элемента, соединенныхъ съ кислородомъ. Его таблица не даетъ для этого никакихъ указаній, и поэтому онъ ищетъ другой точки опоры. Гипотезу одного атома радикала, казавшуюся наиболће естественной и принятую имъ въ 1819 году, онъ отбрасываетъ теперь, такъ какъ она приводитъ къ {92} атомному вћсу, несогласующемуся съ закономъ Дюлонга и Пти. Онъ достигаетъ согласованія (за исключеніемъ серебра, теллура и кобальта) тћмъ, что предполагаетъ въ соединеніяхъ присутствіе д в у х ъ атомовъ соотвћтствующаго элемента, и получаетъ слћдующій рядъ степеней окисленія для большинства металловъ:
R2O, RO, R2O3, RO2, R2O5, (R2O7)
или также RO, RO, RO3, RO2, RO5, R(O7),
подставивъ RO вмћсто R2O2 и RO2 вмћсто R2O4.
Берцеліусъ приводитъ нћкоторые доводы, которые, повидимому, говорятъ въ пользу правильности его выбора: наиболће часто встрћчающіяся окиси, какъ окись мћди, магнезія, известь и т. д. получаютъ простћйшую формулу RO; далће слћдуютъ кислородныя соединенія азота и хлора, для которыхъ число атомовъ ему извћстно по объемамъ. Поэтому Берцеліусъ считаетъ этотъ рядъ общераспространеннымъ, называетъ его рядомъ азота и противоставляетъ ему рядъ сћры.
Берцеліусъ находитъ, что относительныя количества кислорода, соединяющіяся съ сћрой, равны 1, 2, 21/2 и 3. Поэтому окислы этого элемента онъ пишетъ такъ: SO, SO2, S2O5 и SO3. Онъ пытается ввести по возможности всћ кислородныя соединенія въ ряды сћры и азота; напримћръ, формулой кремневой кислоты онъ считаетъ SiO3, соотвћтственно сћрной кислотћ, что позже вызвало цћлую полемику.
Соединенія сћры (сульфиды) Берцеліусъ считаетъ аналогичными по составу съ кислородными соединеніями. Сћрнистому водороду онъ приписываетъ формулу HS, потому что формула воды HО.
На основаніи изложеннаго Берцеліусъ вычисляетъ атомные вћса, исходя изъ О = 100. Чтобы сдћлать возможнымъ сравненіе послћдующихъ данныхъ съ предыдущими, а также въ виду того, что дћло идетъ лишь объ относительныхъ величинахъ, я приведу здћсь атомные вћса, перечисленные на атомный вћсъ водорода, принятаго за единицу39):
| {93} |
Атомный |
Новћйшіе | |
Мышьякъ . . . . As | 75,33 | 74,40 |
Кальцій . . . . . Са | 41,03 | 39,7 |
Хлоръ . . . . . . Сl | 35,47 | 35,18 |
Желћзо. . . . . Fe | 54,36 | 55,5 |
Іодъ. . . . . . . . J | 123,20 | 126,01 |
Углеродъ . . . . С | 12,25 | 11.91 |
Марганецъ . . Mn | 57,02 | 54,6 |
Натрій. . . . . . Na | 46,62 | 22,88 |
Фосфоръ . . . Р | 31,43 | 30,77 |
Ртуть . . . . . . Hg | 202,86 | 198,5 |
Кислородъ . . O | 16 | 15,88 |
Сћра. . . . . . . S | 32,24 | 31,82 |
Серебро . . . . Ag | 216,61 | 107,11 |
Кремній . . . Si | 44,47 | 28,2 |
Азотъ. . . . . . N | 14,18 | 13,93 |
Прежде чћмъ закончить обозрћніе системы Берцеліуса, я скажу еще нћсколько словъ о формулахъ соляной кислоты и амміака. Атомы этихъ соединеній обозначались черезъ НСl и NH340). Эти формулы показываютъ, что Берцеліусъ не во всћхъ случаяхъ отождествлялъ понятія атома и эквивалента, хотя онъ употребляетъ оба названія, какъ синонимы. Правда, можно было бы признать недћйствительнымъ это исключеніе, такъ какъ въ большинствћ случаевъ Берцеліусъ употребляетъ формулу двойныхъ атомовъ НСl и NH3. Трудно, конечно, имћть вполнћ ясное представленіе о взглядахъ лица, уже не находящагося въ живыхъ; необходимо во всякомъ случаћ считаться съ особенностями различныхъ эпохъ. Я думаю, что вначалћ (приблизительно до 1830 года) Берцеліусъ {94} старался распространить объемный законъ возможно шире (также и на соединенія между собою). Я полагаю, что, между прочимъ, на этомъ основаніи онъ для соляной кислоты и амміака принялъ формулы НСl и NH3; но впослћдствіи, главнымъ образомъ, подъ вліяніемъ изслћдованій Дюма41), Берцеліусъ сталъ уже значительно менће довћрять этому закону и примћнялъ его лишь къ постояннымъ (и простымъ) газамъ42). Тогда ничто уже не мћшало ему считать также и въ этихъ тћлахъ атомъ и эквивалентъ тождественными, и потому онъ употребляетъ только формулы НСl и NH3.
Изъ предыдущаго слћдуетъ, что Берцеліусъ не соглашался съ тћмъ, что существуетъ различіе между физическимъ и химическимъ атомомъ; этимъ онъ установилъ существенную разницу между элементами и соединеніями. По его мнћнію атомы простыхъ газовъ имћютъ, вообще, половину (или четверть) объема, занимаемаго атомами сложныхъ газовъ. Одинаковое отношеніе къ измћненію температуры и давленія давало достаточное основаніе предполагать въ равныхъ объемахъ водорода и кислорода равное число атомовъ. Но та же самая причина оказывалась недостаточной, чтобы вывести одинаковое слћдствіе для хлора и хлористаго водорода. Здћсь кроется очевидная непослћдовательность, не имћвшая, однако, значенія, такъ какъ дальнћйшіе опыты, повидимому, говорили противъ всеобщей примћнимости объемнаго закона.
Воздвигнутая Берцеліусомъ система химіи въ законченномъ видћ, какой она имћла къ концу двадцатыхъ годовъ (для неорганическихъ тћлъ), достойна удивленія. Хотя нельзя утверждать, что основныя идеи ея исходили исключительно отъ Берцеліуса, такъ какъ онъ многимъ обязанъ Лавуазье, Дальтону, Дэви и Гэ-Люссаку, все же несомнћнно, что именно Берцеліусъ объединилъ эти идеи и теоріи въ одно гармоническое цћлое, къ которому прибавилъ много оригинальнаго; его электрохимическая гипотеза имћла, правда, много точекъ соприкосновенія съ теоріей Дэви, но въ то же время существенно отличалась отъ нея. Кромћ того, первый довольно широко примћнимый методъ опредћленія атомныхъ вћсовъ былъ выработанъ Берцеліусомъ, и этимъ онъ оказалъ наукћ исключительную услугу, такъ какъ далъ возможность установить эти важныя {95} для химіи числа съ такой большой точностью, что впослћдствіи понадобилось ихъ измћнять въ немногихъ только случаяхъ.
Теперь понятно, почему система Берцеліуса вскорћ сдћлалась господствующей и его мнћніе пріобрћло рћшающее значеніе. Изданіе „Jahresberichte”, начатое имъ въ 1831 году, еще болће усилило его значеніе; этотъ журналъ давалъ не только обозрћнія, но и критическіе разборы работъ по химіи. Идеи другихъ химиковъ представляютъ поэтому лишь второстепенное значеніе, но все же я сообщу взгляды нћкоторыхъ изъ современниковъ Берцеліуса, чтобы лучше охарактеризовать эту эпоху.
Англійскіе химики въ то время еще не пошли дальше понятій объ атомћ (Дальтона) и эквивалентћ (Волластона), и за этотъ періодъ времени тамъ было сдћлано мало существеннаго. Единственно, о чемъ я могу сообщить, это — о гипотезћ Пру, которая вызвала оживленную полемику.
Въ 1815 году Пру выступилъ съ утвержденіемъ, что атомные вћса газообразныхъ элементовъ суть кратныя числа атомнаго вћса водорода43). Въ такой формћ это положеніе не представляетъ, повидимому, особеннаго значенія; но оно пріобрћтаетъ большой интересъ, если его обобщить, такъ какъ оно приводитъ тогда почти неизбћжно къ предположенію о существованіи одной первичной матеріи, которая своимъ различнымъ распредћленіемъ въ пространствћ даетъ начало многообразнымъ особенностямъ тћлъ. Томсонъ44) поставилъ себћ задачей распространить гипотезу Пру на всћ элементы и съ этой цћлью произвелъ большое число опредћленій атомныхъ вћсовъ; впрочемъ его результаты были весьма малоцћнны, въ чемъ Берцеліусъ и упрекалъ его не безъ суровости45),
Гипотеза Пру впослћдствіи была возстановлена Дюма46), послћ того какъ обнаружилось, что въ ея пользу говорило болће точное опредћленіе атомныхъ вћсовъ. Атомные вћса наиболће извћстныхъ элементовъ, напримћръ, кислорода, водорода, азота, углерода, (хлора?), брома, іода и друг., казалось, согласовались съ этой гипотезой. Но Стасъ доказалъ своими опытами, которые до недавняго {96} времени считались образцовыми по точности47), что эта гипотеза не имћетъ полной силы, даже и для тћхъ элементовъ, которые, казалось, говорили въ ея пользу, и что ея значеніе лишь приблизительное.
Въ высшей степени важная теорія періодической зависимости свойствъ элементовъ отъ величины ихъ атомнаго вћса, установленная впослћдствіи Ньюлэндсомъ, Л. Мейеромъ и, въ особенности, Менделћевымъ, можетъ быть нами разсмотрћна лишь въ одной изъ слћдующихъ лекцій.
Во Франціи основой атомистическихъ воззрћній сдћлался объемный законъ въ его наиболће широкомъ смыслћ. Въ этомъ отношеніи весьма рћшительную позицію занялъ въ особенности Дюма. Онъ доказалъ, что понятіе эквивалента не можетъ служить основаніемъ какой-либо системы уже потому, что оно теряетъ свое значеніе, если не ограничиваться кислотами, основаніями и другими весьма сходными между собою соединеніями (окиси и сульфиды), и что понятіе эквивалента становится совершенно неопредћленнымъ, когда пытаются отождествить эквивалентъ съ соединительнымъ вћсомъ48), такъ какъ очень многія тћла могутъ соединяться болће чћмъ въ одномъ отношеніи. Такъ, напримћръ, въ закиси мћди 8 частей мћди соединяются съ 1 частью кислорода, въ окиси же мћди на 8 частей мћди приходятся 2 части кислорода. Поэтому эквивалентъ мћди (соединительный вћсъ), вычисленный по отношенію къ кислороду, какъ единицћ, можетъ быть равенъ 8 или 4.
Дюма считаетъ надежной опорой атомистическія воззрћнія, въ основу которыхъ онъ кладетъ гипотезу Авогадро. Онъ полагаетъ, что при одинаковыхъ температурћ и давленіи въ равныхъ объемахъ всћхъ газовъ содержится равное число атомовъ (физическихъ). Но послћдніе могутъ быть еще дћлимы химически. „Мы называемъ атомами группу химическихъ частицъ, существующихъ въ газахъ изолированно. Атомы простыхъ газовъ содержатъ опредћленное, но намъ неизвћстное число частицъ49)”. Изъ отношенія плотностей газовъ Дюма получаетъ отношеніе величинъ ихъ атомныхъ вћсовъ. При опредћленіи атомныхъ вћсовъ твердыхъ элементовъ онъ {97} пользуется правиломъ Дюлонга и Пти, которое онъ поэтому считаетъ примћнимымъ также къ группамъ мельчайшихъ химическихъ частицъ или, какъ мы теперь скажемъ, молекулъ. Кромћ того онъ для той же цћли пользуется удћльнымъ вћсомъ летучихъ соединеній, при чемъ онъ по аналогіи дћлаетъ предположенія объ объемныхъ отношеніяхъ содержащихся въ нихъ неизвћстныхъ элементарныхъ газовъ. Такимъ образомъ атомный вћсъ сћры Дюма находитъ изъ плотности сћроводорода, который, по его мнћнію, подобно водћ, состоитъ изъ 2 объемовъ водорода и 1 объема паровъ сћры; атомный вћсъ фосфора онъ получаетъ изъ фосфористаго водорода, который по своей конституціи, какъ полагаетъ Дюма, сходенъ съ амміакомъ. Замћчательно его опредћленіе атомнаго вћса углерода. Онъ выводитъ его изъ удћльнаго вћса этилена и метана. Дюма принимаетъ (какъ еще Гэ-Люссакъ раньше), что въ метанћ на 1 объемъ углерода въ парообразномъ состояніи приходятся два объема водорода; въ этиленћ же онъ считаетъ объемы обћихъ составныхъ частей равными; такимъ образомъ Дюма выводитъ, что атомный вћсъ углерода вдвое меньше вћса, опредћленнаго Берцеліусомъ т.-е. = 6, если атомный вћсъ водорода принять за 1. Въ общемъ же, величины атомныхъ вћсовъ, приписываемыя имъ болће извћстнымъ элементамъ, совпадаютъ съ величинами Берцеліуса. Исключеніе составляютъ ртуть, кремній и др. Вћсовъ химически мельчайшихъ частицъ Дюма не указываетъ.
Берцеліусъ оспаривалъ основныя положенія только-что разсмотрћнной системы, несмотря на ея близкое родство съ его собственной системой50). Онъ считаетъ безсмысленнымъ допускать существованіе дробныхъ частей атомовъ, и замћчаетъ, что въ прежнія времена было принято отвергать гипотезы, приводящія къ абсурду. Вообще, Дюма со своими взглядами стоитъ одиноко, но онъ, возможно, остался бы имъ вћренъ, если бы самъ же онъ не открылъ фактовъ, которые заставили его усомниться въ правильности гипотезы Авогадро.
Дюма обладалъ не только выдающимся умомъ, но былъ еще отличнымъ экспериментаторомъ; такъ какъ онъ положилъ въ основу своей атомной теоріи плотности газовъ и паровъ, то онъ считалъ себя обязаннымъ подробнће ихъ изучить. Ему удалось выработать {98} новьій методъ опредћленія плотности паровъ при высокой температурћ, и онъ воспользовался имъ для опредћленія удћльнаго вћса іода, фосфора, сћры, ртути и т. д.51). Полученные результаты, отъ которыхъ Дюма ожидалъ подтвержденія своихъ взглядовъ, заставили его однако отъ нихъ отказаться. Онъ нашелъ, что плотность фосфора вдвое, а сћры — втрое больше принятыхъ имъ раньше плотностей, тогда какъ удћльный вћсъ паровъ ртути оказался вдвое меньшимъ, чћмъ предположенный. Въ виду такихъ фактовъ онъ начинаетъ сомнћваться; больше того, онъ „заявляетъ, что даже простые газы не содержатъ въ равныхъ объемахъ одинаковаго числа химическихъ атомовъ”. По его мнћнію, все еще, конечно, можно предполагать, что „въ равныхъ объемахъ всћхъ газовъ находится одинаковое число молекулярныхъ или атомныхъ группъ. Но это лишь гипотеза, и притомъ не обћщающая быть полезной”52). Дюма долженъ былъ признать, что примћненіе закона Гэ-Люссака къ опредћленію атомныхъ вћсовъ въ томъ видћ, какъ онъ это дћлалъ, даетъ невћрные результаты. Поэтому онъ признаетъ законъ непримћнимымъ для этой цћли и отказывается отъ гипотезы Авогадро.
Берцеліусъ тоже не можетъ уже болће утверждать, что объемъ и атомъ у элементарныхъ газовъ идентичны. Онъ принужденъ ограничить свое правило случаями несгущаемыхъ упругихъ жидкостей53). Вы сами согласитесь со мной, что такимъ образомъ выраженный законъ не можетъ имћть особенно широкаго примћненія, и болће чћмъ недостаточенъ для опредћленія атомныхъ вћсовъ болыпинства элементовъ. Но какъ обстояло дћло съ прочими опорными точками? Гипотеза Дюлонга и Пти, какъ я уже замћтилъ, также не имћла абсолютнаго значенія. Числа, выведенныя на основаніи этой гипотезы для серебра, кобальта и теллура, не согласовались съ опредћленіями Берцеліуса, т.-е. съ атомной величиной, которой требовала химическая аналогія и изоморфизмъ. Эта гипотеза, слћдовательно, также не выдерживала строгихъ требованій. Оставался еще законъ Митчерлиха, и большинство химиковъ полагало, что онъ даетъ возможность составить безошибочное заключеніе объ атомной конституціи. Но вскорћ стали высказываться сомнћнія, въ особенности послћ того, какъ Митчерлихъ указалъ на возможность существованія {99} диморфныхъ веществъ, т.-е. способныхъ принимать двћ кристаллическія формы54). Указывали на то, что форма тћлъ, какъ показываетъ диморфизмъ, зависитъ не только отъ числа содержащихся въ нихъ атомовъ55).
Такимъ образомъ, изъ всћхъ физическихъ законовъ, пригодныхъ къ опредћленію атомнаго вћса, не осталось ни одного, къ которому можно было бы относиться съ полнымъ довћріемъ. Вслћдствіе этого понятіе атома стало считаться чћмъ-то неопредћленнымъ, гипотетическимъ, и поэтому химики считали необходимымъ удовлетвориться „соединительнымъ вћсомъ”, или эквивалентомъ; это представленіе, кстати, получило новую поддержку благодаря электролитическому закону Фарадэя56). Такимъ образомъ мы видимъ, что къ концу 30-хъ годовъ атомистическая теорія, лучшее изъ всего достиглутаго химіей, была оставлена большинствомъ химиковъ, какъ устарћлая и слишкомъ гипотетичная; возникла новая школа, исходившая изъ эквивалента Волластона и съ успћхомъ старавшаяся вытћснить систему Берцеліуса.
Во главћ этого направленія стоитъ Гмелинъ, взгляды котораго имћютъ тћмъ большее значеніе, что онъ изложилъ ихъ въ своемъ лревосходномъ и весьма полномъ руководствћ, которое пользовалось большимъ распространеніемъ.
Для Гмелина не существуетъ строгаго различія между соединеніями и смћсями. Этимъ самымъ онъ доказываеть, что онъ не вћритъ въ реальное существованіе атомовъ. По его мнћнію, два вещества, въ особенности имћющія слабое взаимное сродство, могутъ соединяться другъ съ другомъ въ безконечно многихъ отношеніяхъ; но чћмъ больше сродство, тћмъ сильнће выступаетъ стремленіе соединяться лишь въ немногихъ отношеніяхъ57); эти послћднія бываютъ тогда простыми. „Можно поэтому любому веществу приписать опрелћленный вћсъ, въ которомъ оно соединяется съ опредћленными вћсовыми количествами другихъ элементовъ. Этотъ вћсъ и есть стехіометрическое число, химическій эквивалентъ, вћсъ смћшенія, или атомный вћсъ и т. д. Соединенія составлены такъ, что вћсъ смћшенія одного вещества соединяется съ 1/4, 1/3, 1/2, 2/3, 3/4, 1, 11/2, 2, 21/2, 3, 4, 5, 6, 7 или бóльшимъ числомъ вћсовъ смћшенія другого вещества”. Законъ Гэ-Люссака {100} формулируется по Гмелину такъ: „Одинъ объемъ упругаго жидкаго вещества соединяется съ 1, 11/2, 2, 21/2, 3, 31/2 и 4 объемами другого вещества”.
Вамъ всћмъ извћстна, вћроятно, его таблица эквивалентовъ. Онъ положилъ въ ней Н = 1, O = 8, S = 16, C = 6 и т. д. Вода обозначалась формулой НО\ вообще мы замћчаемъ здћсь стремленіе компенсировать простотой формулъ то, что онћ потеряли въ содержаніи. Химія должна была оставаться лишь наблюдательной, чуть ли не описательной только наукой. Искусное экспериментированіе — вотъ все, что требовалось отъ химика, умозрћніе же было изгнано, какъ нћчто опасное.
Итакъ, неорганическая химія вмћстћ съ физикой не могли удержать понятія атома. Въ слћдующихъ лекціяхъ я постараюсь показать вамъ, какъ понятіе объ атомћ вновь было введено въ науку благодаря органической химіи.
| {101} |
Органическая химія въ началћ ея развитія. — Попытки опредћленія элементарныхъ составныхъ частей въ органическихъ соединеніяхъ.— Изомерія и полимерія. — Взгляды на строеніе. — Теорія радикаловъ.
Теперь я попытаюсь познакомить васъ съ развитіемъ органической химіи. Я намћренно отложилъ это до настоящаго момента по слћдующимъ причинамъ: во-первыхъ, я хотћлъ представить вамъ эту науку въ ея цћломъ; во-вторыхъ, органическая химія въ первыя три десятилћтія XIX вћка почти не оказывала никакого вліянія на формированіе общихъ теорій; въ-третьихъ, принципы, лежащіе въ основћ неорганической химіи, вначалћ казались непримћнимыми къ органической химіи. Такъ, мы видимъ, что еще въ 1828 году Берцеліусъ разсматриваетъ органическія соединенія совершенно отдћльно отъ другихъ соединеній. Тћла животнаго и растительнаго происхожденія, казалось, не подчинялись электрохимической теоріи, закону кратныхъ отношеній, объемнымъ законамъ и т. д.; они какъ-будто подчинялись только таинственной, жизненной силћ, сущность которой оставалась совершенно неизвћстной. Лишь когда изученіе органической химіи начало привлекать все возрастающее число изслћдователей, стало возможнымъ распространить и на эту часть химіи законы, установленные для неорганическихъ тћлъ. Взгляды и гипотезы, явившіеся результатомъ изслћдованія болће извћстныхъ веществъ, должны были теперь найти приложеніе и въ болће молодомъ отдћлћ нашей науки; въ частности дуализмъ былъ теперь введенъ также и въ органическую химію.
Какъ вамъ извћстно, Лавуазье полагалъ, что кислоты состоятъ изъ кислорода и основанія, и что въ неорганическихъ соединеніяхъ такимъ основаніемъ служитъ элементъ, а въ органическихъ — сложный {102} радикалъ. Это слово не было забыто. На немъ была основана химическая номенклатура, и дуализмъ Берцеліуса былъ лишь его удачнымъ развитіемъ. Всћ наблюденія, казалось, находились въ согласіи съ теоріей дуализма. Соли, наиболће въ то время извћстный классъ тћлъ, образуются изъ кислоты и основанія и могутъ быть вновь разложены на эти же составныя части. Естественно было предположить, что и органическія соединенія составлены точно такимъ же образомъ. Эти соединенія (какъ думали тогда) состоятъ, по меньшей мћрћ, изъ трехъ элементовъ; слћдовательно, при дћленіи ихъ на двћ части, одна должна быть непремћнно сложной. Такимъ образомъ органическая химія сдћлалась „химіей сложныхъ радикаловъ”. При этомъ за радикаломъ сохранилось его первоначальное опредћленіе: радикалъ есть свободный отъ кислорода остатокъ тћла, который играетъ роль элемента. Вёлеръ и Либихъ преобразовали это понятіе; они доказали въ своей замћчательной работћ относительно горько-миндальнаго масла и родственныхъ ему соединеній, что въ этихъ веществахъ можно допустить присутствіе содержащей кислородъ группы, остающейся безъ измћненія при большинствћ реакцій, и, слћдовательно, имћющей свойства простого тћла; эту группу они назвали поэтому радикаломъ горько-миндальнаго масла,
Такимъ образомъ былъ сдћланъ первый крупный шагъ. Органическая химія стала самостоятельной и освободилась отъ наложенныхъ на нее узъ. Если она и не создала совершенно новаго понятія, то, во всякомъ случаћ, самостоятельно разрћшила существовавшее понятіе и дала ему новое бóльшее значеніе. Съ этого времени она идетъ своимъ собственнымъ путемъ, не возвращаясь къ тћмъ ограниченіямъ, которыя на нее хотћли наложить. Отъ этого существенно страдаетъ гармоничносіь возведеннаго зданія химіи; но несмотря на всћ усилія приспособить старое зданіе къ новымъ идеямъ, ломка становится неизбћжной. Молодая наука, очень хорошо сознавая свою силу, отважно подкапывается подъ фундаментъ и, несмотря на всћ балки и поддержки, строеніе начинаетъ шататься. Нападеніе на электрохимическую теорію вызвало ожесточенную борьбу между послћдователями этой теоріи съ Берцеліусомъ во главћ и приверженцами теоріи замћщенія, или теоріи типовъ; послћдніе одержали блестящую побћду, и борьба привела въ результатћ къ полному отдћленію органической химіи отъ неорганической. Въ этой послћдней старались, по крайней мћрћ, попрежнему удержать зависимость {103} химическихъ силъ отъ электрическихъ, тогда какъ новћйшіе факты изъ области органической химіи казались съ этимъ несовмћстимыми. Такимъ образомъ наша наука распалась вновь на двћ дисциплины, и принципы, принятые въ одной, въ другой опровергались.
Отказавшись отъ электрохимической гипотезы, пришлось одновременно оставить и теорію радикаловъ. Послћдняя уже не представіяла существенной необходимости, и въ своемъ установившемся видћ она не удовлетворяла болће предъявляемымъ къ ней требованіяімъ. Многое было тогда выброшено за бортъ, какъ ни къ чему негодное; поэтому вполнћ умћстно будетъ спросить, какія же основныя положенія были сохранены представителями новой школы. Воззрћнія относительно сохраненія типа, относительно замћщенія, конечно, весьма цћнныя для пониманія нћкоторыхъ реакцій, едва ли могли быть использованы въ качествћ основы для законченной системы. Но подъ развалинами, покрывавшими поле брани, находилось настоящее сокровище; остававшееся мало замћтнымъ во время борьбы, оно могло пріобрћсти большое значеніе теперь, когда дћло шло не о вытћсненіи старыхъ воззрћній, a o созиданіи на ихъ мћстћ новыхъ. Атомистической теоріи, которую многіе презирали, а нћкоторые и совсћмъ забыли, суждено было вновь возстать въ прежнеімъ блескћ; но для этого, конечно, требовалась жестокая борьба. Чтобы опредћлить величины атомовъ, необходимо было отыскать новыя точки опоры. Въ этомъ вопросћ главная заслуга принадлежитъ Жерару, который настаивалъ на необходимости установить для величинъ атомовъ сравнимыя количества. Но гдћ же было взять масштабъ? Благодаря многоосновнымъ кислотамъ Либиха и правиламъ замћщенія Дюма, химики постигли, наконецъ, разницу между атомомъ и эквивалентомъ; поэтому о послћднемъ уже не могло быть и рћчи. Тогда опять вернулись къ гипотезћ Авогадро, но она оказалась еще недостаточной: чтобы убћдить химиковъ, требовались доказательства химическаго порядка. Напрасно Жераръ, при существенной поддержкћ Лорана, старался привести рћшительныя доказательства въ пользу правильности своихъ идей. Но къ этому времени появились изслћдованія Вилльямсона, придавшія реальную почву идеямъ, витавшимъ въ умћ Жерара; талантливый англійскій изслћдователь указалъ путь, по которому неоднократно слћдовали за нимъ другіе, и который давалъ возможность непосредственно сравнивать вступающія въ реакцію величины. Такъ возникло понятіе о химической {104} молекулћ, которое въ системћ Жерара, быстро завоевавшей теперь признаніе, нашло свое формальное выраженіе въ теоріи типовъ.
Позвольте мнћ заключить этимъ мой обзоръ; я представилъ вамъ въ общихъ чертахъ различныя стадіи исторіи развитія ближайшихъ 20 лћтъ; надћюсь, что вамъ будетъ интересно также познакомиться съ подробностями этого развитія.
Уже во второй половинћ XVII вћка Лемери отдћлилъ органическую химію отъ неорганической. Всћ тћла онъ раздћлилъ на три класса: минеральный, животный и растительный1). Флогистики занимались, главнымъ образомъ, изученіемъ тћлъ первой группы; впрочемъ, какъ мы уже упомянули выше2), Шееле открылъ цћлый рядъ органическихъ тћлъ. Лавуазье думалъ, что соединенія этого класса состоятъ изъ углерода, водорода и кислорода; Бертолле доказалъ присутствіе азота въ веществахъ животнаго происхожденія2); впослћдствіи убћдились въ томъ, что всћ элементы могутъ принимать участіе въ образованіи органическихъ соединеній, углеродъ же въ нихъ никогда не можетъ отсутствовать4).
Трудно сказать, что именно понимали въ началћ XIX вћка подъ названіемъ органическихъ тћлъ; къ этой категоріи, были конечно, причислены всћ вещества, встрћчающіяся въ организмћ. Но изъ этихъ соединеній было получено очень много другихъ, для которыхъ также было необходимо опредћлить мћсто въ системћ, и часто при этомъ поступали совершенно произвольно. Простота состава какого-нибудь тћла часто служила причиною причисленія его къ неорганической химіи. Взглядъ на природу нћкоторыхъ веществъ съ теченіемъ времени измћнился; такъ, ціанистыя соединенія, сперва считавшіяся органическими, позже были отнесены къ неорганическимъ тћламъ. Химики придерживались, поскольку это было удобно, идеи Лавуазье, согласно которой въ органическихъ веществахъ соединенное съ кислородомъ основаніе или радикалъ состоитъ изъ нћсколькихъ элементовъ; отсюда впослћдствіи возникло слћдующее опредћленіе Либиха: органическая химія есть химія сложныхъ радикаловъ. {105}
Изученіе относящихся сюда соединеній значительно отстало сравнительно съ изученіемъ тћлъ минеральнаго происхожденія. Причина заключается отчасти въ легкой измћняемости этого класса тћлъ, затруднявшей ихъ изолированіе, отчасти же въ томъ, что для изслћдованія ихъ недоставало аналитическихъ методовъ. Въ началћ XIX вћка, когда качественный анализъ достигъ уже весьма высокой точности и народились даже превосходные спеціалисты по количественному методу, именно Пру, Клапротъ и Вокленъ, изслћдованія Лавуазье надъ алкоголемъ, масломъ и воскомъ были единственными и притомъ, понятно, не очень точными опытами по опредћленію состава органическихъ соединеній.
Понятно поэтому, что еще въ 1819 году Берцеліусъ сомнћвался въ примћнимости закона кратныхъ отношеній къ органической химіи5). Онъ хорошо зналъ, что въ тћхъ случаяхъ, когда органическія тћла соединяются съ неорганическими, напримћръ, органическія кислоты съ окислами металловъ, то наблюдается та же закономћрность, что и въ неорганической химіи; однако, онъ считалъ, что отношенія, въ которыхъ соединяются углеродъ, водородъ и кислородъ такъ разнообразны, что законъ Дальтона теряетъ свою силу, такъ какъ 1, 2, 3, ...n атомовъ одного элемента могутъ соединяться съ 1, 2, 3,... m атомами другого элемента, Впрочемъ, впослћдствіи Берцеліусъ самъ болће другихъ способствовалъ распространенію стехіометрическихъ законовъ на органическую химію, при чемъ онъ существенно улучшилъ примћнявшійся тогда методъ элементарнаго анализа и тћмъ самымъ создалъ для себя и другихъ возможность изслћдовать составъ органическихъ тћлъ.
Можетъ быть, будетъ цћлесообразно сообщить здћсь нћко торыя свћдћнія по исторіи элементарнаго анализа, такъ какъ именно съ его усовершенствованіемъ существенно измћнились воззрћнія на органическія соединенія.
Я не буду болће возвращаться къ методу Лавуазье, уже упомянутому мною въ одной изъ первыхъ лекцій6). Между Лавуазье и его ближайшими послћдователями прошелъ почти 30-лћтній промежутокъ времени. Я пропускаю опыгы Соссюра7), Бертолле8) такъ же, {106} какъ и первыя относящіяся къ этому вопросу работы Берцеліуса9) и друг., занимавшихся анализомъ. Эти методы, можетъ быть, и годились для отдћльныхъ случаевъ, но ихъ никоимъ образомъ нельзя считать общепримћнимыми. Зато заслуживаетъ вниманія изслћдованіе Гэ-Люссака и Тэнара, относящееся къ 1811 году10). Они сжигали органическое вещество съ хлорноватокаліевой солью, бросая сдћланные изъ этой смћси маленькіе шарики въ раскаленную снизу, вертикально поставленную трубку. Вверху эта трубка закрывалась краномъ, имћвшимъ углубленіе для шариковъ; выдћлявшіеся при сгораніи газы отводились при помощи боковой трубки въ эвдіометръ, гдћ и измћрялись. Затћмъ Гэ-Люссакъ и Тэнаръ удаляли путемъ поглощенія образовавшуюся углекислоту и опредћляли оставшійся кислородъ; они знали количества сожженнаго вещества и смћшанной съ нимъ хлорноватокаліевой соли, по этому они могли по уравненію Лавуазье:
вещество + употребленный кислородъ = угольной кислотћ + вода
вычислить количество воды, образовавшейся при сожженіи, и, слћдовательно, могли также опредћлить составъ органическаго соединенія.
Такимъ образомъ Гэ-Люссакъ и Тэнаръ произвели анализъ 20 веществъ. Ихъ результаты довольно точны, но методъ оставляетъ желать многаго. Сгораніе совершалось очень энергично и сопровождалось взрывомъ, поэтому иногда оно бывало неполнымъ.
Слћдующій весьма значительный успћхъ въ дћлћ усовершенствованія элементарнаго анализа былъ достигнутъ Берцеліусомъ въ 1814 году11). Произведя сожженіе при помощи смћси изъ хлорноватокаліевой соли и хлористаго натрія, онъ достигъ болће равномћрнаго хода анализа. Его методъ изслћдованія существенно и выгодно отличается отъ прежнихъ еще тћмъ, что онъ не вводилъ сжигаемаго вещества постепенно въ раскаленную трубку, но дћйствовалъ иначе, а именно, все количество вещества, смћшаннаго съ окислителемъ, онъ помћщалъ въ трубку, которая находилась въ горизонтальномъ положеніи. Трубка затћмъ нагрћвалась и доводилась постепенно до накаливанія. Берцеліусъ, кромћ того, первый сталъ взвћшивать {107} непосредственно воду, поглощая ее хлористымъ кальціемъ, а угольную кислоту онъ опредћлялъ по объему или вћсу.
Этотъ родъ анализа уже весьма сходенъ съ современнымъ методомъ. Описанный способъ былъ усовершенствованъ тћмъ, что, вмћсто хлорноватокаліевой соли, стали употреблять окись мћди. Впервые это сдћлалъ Гэ-Люссакь для азотъ содержащихъ тћлъ12), а годъ спустя Дёберейнеръ примћнилъ окись мћди также для сожженія безазотистыхъ веществъ13).
Анализы производились по этому методу болће десяти лћтъ, пока въ 1830 году Либихъ придалъ ему форму, употребляемую еще и понынћ14). Благодаря Либиху, элементарный анализъ сдћлался легко выполнимой операціей, а что касается точности, то онъ не уступаетъ никакому другому. Съ этого времени начинается быстрое развитіе органической химіи; теперь, когда въ руки химиковъ былъ данъ простой и вћрный способъ опредћленія состава органическихъ соединеній, стали возможны и дћйствительно производились такія изслћдованія, которыя раньше представляли непреодолимыя трудности.
Правда, многіе анализы были произведены уже по методу Берцеліуса; химики все болће и болће убћждались въ томъ, что законъ кратныхъ отношеній примћнимъ также къ органическимъ соединеніямъ и что къ этимъ послћднимъ приложимы формулы, вошедшія уже въ употребленіе при изученіи минеральныхъ веществъ. Но въ двадцатыхъ годахъ все же еще считали оба класса тћлъ существенно различными. Предполагалось, что только минеральныя тћла могутъ быть получены искусственно, тогда какъ синтезъ органическихъ тћлъ при нашихъ средствахъ совершенно недостижимъ; такой синтезъ считался исключительнымъ даромъ живого организма, въ которомъ онъ совершается подъ вліяніемъ жизненной силы. Изъ такихъ встрћчающихся въ природћ тћлъ научились, правда, получать при помощи сухой перегонки, дћйствіемъ азотной кислоты, ћдкаго кали и др. способами вещества, также причисляемыя къ органическимъ соединеніямъ; но бóльшею частью это были болће простыя вещества, и исходнымъ началомъ всегда служилъ матеріалъ, встрћчающійся въ природћ. Въ этомъ отношеніи {108} заслуживаетъ упомянанія одно превосходное для того времени изслћдованіе Шеврейля15), доказавшаго, что жиры состоятъ изъ кислоты и открытаго Шееле глицерина и потому должны быть отнесены къ разряду сложныхъ эфировъ, къ которому тогда причисляли всћ тћла, разлагаемыя щелочью на кислоту и индифферентное вещество (алкоголь).
Но эти и другія аналогичныя изслћдованія не могли, конечно, поколебать вћры въ жизненную силу, подъ вліяніемъ которой, какъ предполагали, возникаютъ всћорганическія тћла. Въ то время еще не удалось искусственно получить какое-нибудь встрћчающееся въ организмћ соединеніе; но ждать этого пришлось недолго. Этой побћдой мы обязаны Вёлеру, который съ этого началъ свою многолћтнюю и блестящую научную дћятельность.
Вёлеръ открылъ въ 1822 году ціановую кислоту16). Занимаясь ея изслћдованіемъ, онъ въ 1828 году, замћтилъ, что при выпариваніи раствора амміачной соли этой кислоты получается мочевина, извћстный продуктъ животнаго происхожденія17). Конечно, этимъ вопросъ не рћшался окончательно, такъ какъ не было еще возможности произвести синтезъ, исходя изъ элементовъ; но самое важное все же было достигнуто, а именно, изъ неорганическаго соединенія, каковымъ многіе тогда считали ціановую кислоту, удалось получить вещество, которое до этого находили исключительно въ животномъ организмћ. Несмотря на это, измћненіе во взглядахъ происходило лишь медленно, все еще казалось, что нельзя обойтись безъ жизненной силы, и еще десятки лћтъ спустя возникали научные споры о ея существованіи. Нынћ, когда матеріалистическое направленіе все болће беретъ верхъ, лишь немногіе изслћдователи приписываютъ происхожденіе органическихъ тћлъ силамъ, отличнымъ отъ тћхъ, которымъ обязаны своимъ происхожденіемъ вещества минеральнаго царства. Конечно, экспериментальная наука сдћлала въ этомъ отношеніи большіе успћхи, такъ какъ ей удалось получить много органическихъ соединеній изъ элементовъ. Такъ, Кольбе произвелъ полный синтезъ трихлоруксусной кислоты19), а Бертело {109} синтезировалъ муравейную кислоту и алкоголь, положивъ этимъ начало ряду своихъ блестящихъ синтезовъ20).
Если кому-либо случайно попадется въ руки какое-нибудь сочиненіе по органической химіи, относящееся къ двадцатымъ или еще болће раннимъ годамъ 19-аго вћка, то ему покажется страннымъ, что въ то время, когда этотъ отдћлъ химіи былъ еще такъ мало развитъ, уже производились опыты съ цћлью выяснить строеніе соединеній, т.-е. расположеніе въ нихъ атомовъ. Это можно было бы считать празднымъ умозрћніемъ, если бы научной химіи, благодаря явленіямъ изомеріи, не пришлось уже рано заняться этими вопросами; поэтому мы должны здћсь остановиться подробнће на явленіяхъ изомеріи.
Послћ того какъ химики стали отдавать себћ отчетъ въ значеніи количественнаго состава тћлъ, и было установлено, что постоянныя вћсовыя отношенія составныхъ частей служатъ существеннымъ признакомъ химическихъ соединеній, стали считать очевиднымъ, что одинаковый процентный составъ тћлъ всегда обуславливаетъ ихъ одинаковыя свойства. Правда, было извћстно, что очень многія, даже почти всћ тћла встрћчаются въ нћсколькихъ состояніяхъ: твердомъ, жидкомъ и газообразномъ, въ кристаллическомъ и аморфномъ видћ и т. д.; но удивленіе, вызванное открытіемъ диморфизма, показываетъ, какъ сильна была тогда склонность видћть въ физическихъ и химическихъ свойствахъ тћлъ лишь функціи ихъ процентнаго состава (и температуры). Естественно, что тогда долженъ былъ показаться поразительнымъ тотъ фактъ, что сћра встрћчается въ двухъ кристаллическихъ формахъ, или что аррагонитъ есть чистая углекислая известь, т.-е. что онъ диморфенъ съ известковымъ шпатомъ21) и т. д.
Въ томъ же 1823 году обнаружилось вдобавокъ, что и химическія свойства могутъ измћняться безъ измћненія состава тћлъ: Либихъ получилъ при анализћ гремучей кислоты числа, вполнћ совпадавшія съ числами, установленными для ціановой22) кислоты. Вначалћ это считали ошибкой, но позднћйшія изслћдованія подтвердили {110} это наблюденіе, такъ что значительное различіе между этими двумя тћлами казалось совершенно непонятнымъ. Два года спустя Фарадэй открылъ другой фактъ подобнаго же рода23); онъ занимался изслћдованіемъ маслороднаго газа и нашелъ при этомъ углеводородъ, обнаруживавшій большое сходство съ маслороднымъ газомъ; онъ не давалъ, однако, на солнечномъ свћтћ соединенія съ хлоромъ и имћлъ плотность вдвое большую, чћмъ этиленъ24). Далће къ тому же времени относится изслћдованіе Кларка относительно фосфорной кислоты. Такъ какъ Кларкъ не принялъ въ расчетъ количества содержащейся въ соляхъ воды, то онъ пришелъ къ тому заключенію, что существуютъ двћ фосфорныя кислоты одного состава, но обладающія различными свойствами25). Подобныя же явленія Берцеліусъ обнаружилъ еще раньше на оловянной кислотћ26). Въ 1830 г. онъ же указалъ, что, кислота, образующаяся при производствћ винной кислоты, имћетъ одинаковый съ нею составъ. Онъ называетъ новое вещество виноградной кислотой и вводитъ для тћлъ этого рода терминъ изомеръ. По его мнћнію этотъ терминъ долженъ примћняться лишь къ соединеніямъ, имћющимъ одинаковый составъ, одинаковый атомный вћсъ, но различныя свойства27). Явленіе, наблюдавшееся Фарадэемъ въ углеводородахъ, Берцеліусъ назвалъ годъ спустя полимеріей; это названіе относится къ тћмъ случаямъ, когда тћла при одинаковомъ составћ имћютъ различныя свойства и различные атомные вћса28). Наоборотъ, метамерными тћлами будутъ тћ, которыя имћютъ одинаковый составъ и атомный вћсъ, но различныя свойства, если это различіе можетъ быть объяснено различнымъ расположеніемъ атомовъ, различнымъ строеніемъ29). Какъ примћръ, Берцеліусъ приводитъ сћрнокислую соль закиси олова и сћрнистокислую соль окиси олова, которыя онъ пишетъ такъ: SnO + SO2 и SnO2 + SO2.
Въ то время различныя состоянія какого-нибудь элемента также разсматривались, какъ случаи изомеріи, и лишь въ 1841 году {111} Берцеліусъ ввелъ для этихъ случаевъ названіе аллотропіи30. Давно уже былъ извћстенъ цћлый рядъ примћровъ, сюда относящихся; особенно замћчательна аллотропія алмаза, графита и сажи.
Ясно, что понятіе метамеріи имћло смыслъ лишь при томъ условіи, если въ понятіе о строеніи тћла вкладывается нћкоторое содержаніе; съ другой стороны, ясно, что явленіе изомеріи должно было навести химиковъ на гипотезы о способћ расположенія атомовъ. Какъ вы знаете, въ то время господствовало воззрћніе, которое Берцеліусъ старался все болће и болће расширить, — тотъ самый дуализмъ, о которомъ я говорилъ уже неоднократно; вытекающія изъ него слћдствія я теперь хочу изложить болће опредћленно.
Явленія горћнія привели Лавуазье къ предположенію, что тћла состоятъ вообще изъ двухъ частей. Эта точка зрћнія была очень понятна и легко примћнима къ солямъ, состоящимъ по этой теоріи изъ кислоты и основанія. Это вполнћ согласовалось съ общимъ характеромъ солей и давало возможность разсматривать ихъ съ одной опредћленной точки зрћнія. Какъ сильно эти идеи укоренились и какъ твердо на нихъ опирались, видно изъ приведенныхъ мною въ одной изъ предыдущихъ лекцій31) доводовъ Гэ-Люссака и Тэнара противъ элементарной природы хлора.
Послћ того какъ всћми было признано существованіе безкислородныхъ кислотъ, т. н. водородныхъ кислотъ, возникли различныя воззрћнія на природу ихъ солей. Нћкоторые изслћдователи, напримћръ, Дэви и Дюлонгъ, пытались разсматривать ихъ подобно другимъ солямъ, какъ металлическія соединенія32); но этотъ взглядъ не встрћчалъ тогда сочувствія. Другіе же оставались вћрны прежнимъ взглядамъ, и для нихъ поваренная соль все еще была солянокислымъ натріемъ, обладающимъ, правда, особеннымъ свойствомъ выдћлять „воду”. Иныеже совсћмъне считали эти тћла солями, а сравнивали ихъ съ окисями. Въ 1828 Булле открылъ двойные хлориды и іодиды, и это открытіе дало ему поводъ подробнће развить свои взгляды33). По его мнћнію хлориды, іодиды и др. подобныя соли щелочныхъ металловъ представляютъ собой основанія, изъ которыхъ настоящія соли образуются лишь при соединеніи съ хлоридами и іодидами тяжелыхъ металловъ, считавшимися, со своей стороны, аналогичными кислотамъ. Другіе же химики и въ томъ числћ Берцеліусъ, {112} мнћніе котораго въ то время имћло наибольшій вћсъ34), разсматривали поваренную соль и ей подобныя тћла, какъ солеобразныя соединенія, но различали ихъ отъ обыкновенныхъ солей. По ихъ теоріи вся группа солей распадалась на два отдћла, на амфидныя соли, къ которымъ принадлежали нейтральныя кислородныя, сћрныя и т. п. соединенія, и галоидныя соли, къ которымъ причислялись хлориды, іодиды и др. Галоидныя соли состояли изъ двухъ элементовъ или радикаловъ, одного металла и одного солероднаго элемента; это названіе „солеродъ” съ тћхъ поръ стало примћняться къ хлору, іоду, ціану и др. При этомъ оставалось совершенно невыясненнымъ, какимъ образомъ вещества съ такими аналогичными свойствами, какъ амфидныя и галоидныя соли, могутъ имћть столь различное строеніе.
Разсматривая кислородныя соли, какъ соединенія кислоты съ основаніемъ, тћмъ самымъ получали также почву для установленія этихъ понятій. Напримћръ, въ селитрћ группа КО должна представлять основаніе, a N2O535) кислоту, т.-е. то, что мы теперь называемъ ангидридами. Вслћдствіе этого уксусную кислоту обозначали черезъ C4H6O3 муравьиную черезъ C2H2O3 сћрную черезъ SO3 и т. д. т.-е. писали воображаемыя тћла вмћсто дћйствительно существующихъ. Предполагали, что свободныя кислоты „содержатъ извћстную часть воды, которую мы можемъ отдћлить только тогда, когда соединяемъ кислоту съ какимъ-нибудь другимъ тћломъ”36). Несмотря на то, что Берцеліусъ раньше уже самъ отличалъ гидратную воду отъ другой, содержащейся въ соляхъ и не необходимой для ихъ существованія37), все же въ большинствћ споровъ о строеніи кислотъ и основаній „эта вода” упускалась, какъ несуществующая. Вћроятно, вслћдствіе этого даже въ тћлахъ иныхъ классовъ, содержащихъ водородъ и кислородъ въ отношеніи необходимомъ для образованія воды, признавали ея присутствіе, и въ формулахъ ее не обозначали. Поводомъ къ подобнымъ заблужденіямъ служило между прочимъ объясненіе, которое Гэ-Люссакъ и Тэнаръ дали въ 1811 г. результатамъ своего анализа органическихъ соединеній38). По ихъ мнћнію, эти соединенія распадаются на 3 категоріи. Къ первой {113} принадлежатъ соединенія, содержащія ровно столько кислорода, сколько надо, чтобы съ водородомъ образовать воду (углеводы); ко второй — соединенія, содержащія меньше кислорода (смолы и масла), и къ третьей — содержащія бóльшее количество кислорода (кислоты).
Эти объясненія, быть можетъ, нћсколько подробныя, я считалъ необходимымъ сообщить вамъ прежде, чћмъ изложить подробнће воззрћнія на строеніе органическихъ соединеній. Но переходя теперь къ этому столь важному вопросу, я ставлю себћ задачей показать вамъ, какъ дуализмъ постепенно былъ введенъ и въ эту область, и какъ вслћдствіе этого возникла теорія радикаловъ.
Въ 1819 году Берцеліусъ заявилъ, что его электрохимическая теорія не можетъ быть распространена на органическую химію, такъ какъ въ послћдней, вслћдствіе вліянія жизненной силы, элементы имћютъ совершенно измћненныя электрохимическія свойства. По его мнћнію, гніеніе, тлћніе и броженіе — это все такія явленія, которыя указываютъ на стремленіе элементовъ вернуться къ ихъ нормальному состоянію39). Въ то время онъ считалъ еще возможнымъ разсматривать всћ органическія тћла, какъ бинарныя группы. Дуализмъ, правда, былъ имъ распространенъ, насколько это было возможно; кислородныя соединенія разсматривались, какъ „окиси сложныхъ радикаловъ. не существующихъ, однако, въ свободномъ видћ и совершенно гипотетичныхъ”40); это воззрћніе было примћнимо въ особенности къ кислотамъ. Такъ, иногда говорятъ о радикалћ уксусной кислоты C4H6, бензойной кислоты C14H10 и др., каковые являются остатками этихъ кислотъ, лишенными кислорода.
Съ другой стороны и въ другомъ направленіи тоже дћлались попытки установить гипотезы относительно природы органическихъ веществъ; я не буду однако останавливаться на тћхъ гипотезахъ, которыя не имћли общаго значенія и были примћнимы лишь къ немногимъ тћламъ. Но въ качествћ примћровъ позвольте мнћ, однако, привести нћкоторыя изъ этихъ гипотезъ, потому что идеи, лежавшія въ ихъ основаніи, довольно долго играли роль въ нашей наукћ. Дћло идетъ относительно взгляда на щавелевую кислоту, которой давали тогда формулу C2O3, такъ какъ на присутствіе элементовъ воды не обращали вниманія. Деберейнеръ, ближе изучившій {114} въ 1816 году свойства солей этой кислоты, доказалъ, что нћкоторыя изъ нихъ при нагрћваніи выдћляютъ углекислоту и окись углерода, почему онъ считалъ себя въ правћ разсматривать щавелевую кислоту, какъ углекислую окись углерода41). Это была попытка свести сложныя соединенія на болће простыя, попытка, не лишенная значенія, такъ какъ она опиралась на факты.
Гораздо важнће замћчаніе Гэ-Люссака о составћ алкоголя и эфира, относящееся приблизительно къ тому же времени42) и сдћлавшееся основаніемъ такъ называемой этериновой теоріи. Авторъ объемнаго закона указалъ на то обстоятельство, что плотности паровъ алкоголя, эфира, воды и маслороднаго газа таковы, что эфиръ можно считать состоящимъ изъ 1/2 объема воды и 1 объема маслороднаго газа, алкоголь же — изъ равныхъ объемовъ воды и маслороднаго газа.
Это наблюденіе легло въ основаніе теоріи Дюма и Булле относительно эфирообразныхъ соединеній. Она была высказана ими въ 1828 году послћ тщательнаго изслћдованія этихъ тћлъ43). Маслородный газъ они считаютъ радикаломъ, т.-е. атомной группой, которая, подобно элементамъ, вступаетъ въ соединенія. Они сравниваютъ его съ амміакомъ и стараются показать, что маслородный газъ долженъ быть признанъ радикаломъ эфировъ, подобно тому какъ амміакъ есть радикалъ амміачныхъ солей. При этомъ они пытаются провести аналогію слишкомъ далеко, такъ какъ они утверждаютъ даже, что этиленъ имћетъ основныя свойства, и что онъ не окрашиваетъ въ синій цвћтъ лакмусовой тинктуры лишь потому, что онъ нерастворимъ въ водћ. Щелочная природа его доказывается способностью нейтрализовать соляную кислоту, при чемъ образуется солянокислый эфиръ, открытый уже Василіемъ Валентиномъ. Въ особой таблицћ Дюма и Булле показываютъ, какъ радикалъ C4H4 или 2C2C2 (маслородный газъ) можетъ войти въ формулы анализированныхъ ими эфировъ. Изъ этой таблицы вытекаетъ полная аналогія этихъ эфировъ съ амміачными солями44).
| {115} |
|
|
У Дюма и Булле мы впервые встрћчаемъ взглядъ, что эфиры надо считать аналогичными солямъ; конечно, они не придерживались обычнаго воззрћнія, будто соли не содержатъ воды, но все же въ основћ здћсь лежитъ стремленіе разсматривать органическія соединенія съ той же точки зрћнія, что и неорганическія. Такъ какъ эта идея могла быть примћнена къ цћлому классу тћлъ, то она имћла большое значеніе. Эта точка зрћнія, конечно, была дуалистической, но не совсћмъ въ духћ того времени. Такъ, мы видимъ, что Берцеліусъ сперва относится къ этой теоріи весьма осторожно46). Онъ видитъ въ ней „символическій способъ выраженія, который нельзя считать отвћчающимъ дћйствительному составу тћлъ”. Лишь нћсколько лћтъ спустя онъ примкнулъ на короткое время къ идеямъ Дюма и сталъ называть тогда радикалъ C4H8 этериномъ47).
Мнћ кажется умћстнымъ изложить здћсь результаты одной работы Гэ-Люссака надъ ціанистыми соединеніями. Она была произведена имъ еще въ 1815 г. и существенно способствовала тому, что покятіе радикала пріобрћло опредћленное значеніе48). Провћривъ опыты Бертолле относительно состава синильной кислоты, Гэ-Люссакъ подтвердилъ его результаты, установивъ съ несомнћнностью, что эта кислота не содержитъ кислорода, а состоитъ лишь изъ углерода, азота и водорода. При изслћдованіи ея солей ему пришлось изучить также ея ртутное соединеніе при высокой температурћ. При этомъ онъ открылъ ціановый газъ. Въ работћ Гэ-Люссака для насъ существенно, какъ онъ понималъ описанныя имъ тћла. Для него они являются соединеніями радикала ціана, содержащаго углеродъ и азотъ и идентичнаго газу, выдћленному изъ ціанистой ртути. Этимъ была установлена возможность полученія радикаловъ, вслћдствіе чего понятіе о {116} радикалћ пріобрћло болће реальное значеніе. Надо еще замћтить, что, назвавъ ціанъ радикаломъ синильной кислоты, Гэ-Люссакъ позволилъ себћ нћкоторую вольность, такъ какъ это вћдь не былъ „освобожденный отъ кислорода остатокъ кислоты”. Очевидно, великій французскій ученый уподоблялъ синильную кислоту соляной кислотћ и незадолго передъ тћмъ открытой имъ іодисто-водородной кислотћ. Всћ онћ водородныя соединенія элементовъ или радикаловъ подобно тому, какъ обыкновенныя кислоты суть кислородныя соединенія. Конечно, желая опредћлить понятіе радикалъ и подвести подъ это понятіе ціанъ, теперь уже нельзя было повторять слова Лавуазье, что радикалъ „это — освобожденный отъ кислорода остатокъ тћла”, но приходилось напирать на другую половину опредћленія: „Радикалъ есть сложная группа, имћющая свойства элемента”49). Благодаря изслћдованію Гэ-Люссака и изолированію ціана, такое пониманіе пріобрћло подъ собой почву. Впрочемъ, подобныя соображенія не приходили въ голову химикамъ того времени, такъ какъ въ большинствћ случаевъ они искали радикалы лишь въ кислородныхъ соединеніяхъ, главнымъ образомъ, въ кислотахъ; но, съ другой стороны, фактъ признанія гипотезы Дюма и Булле объ этеринћ доказываетъ, что химики не ограничивались исключительно кислородными соединеніями.
Рћшающее вліяніе на теорію радикаловъ оказала относящаяся къ 1832 году работа Вёлера и Либиха50) о горькоминдальномъ маслћ и его производныхъ. Она привела обоихъ изслћдователей къ признанію содержащаго кислородъ радикала, что придало этому понятію новое значеніе.
Вёлеръ и Либихъ доказываютъ сперва, что переходъ горько-миндальнаго масла въ бензойную кислоту состоитъ въ присоединеніи кислорода, а именно они устанавливаютъ для этихъ тћлъ формулы C14H12O2 и C14H12O451). При этомъ, однако, они въ послћдней предполагаютъ одинъ атомъ воды Н2О, но пренебрегаютъ имъ и формулу бензойной кислоты пишутъ C14H10O3. Они, слћдовательно, разсматриваютъ оба тћла, какъ соединенія радикала бензоила C14H10O2: горькоминдальное масло, какъ водородное соединеніе бензоила, бензойную же кислоту — какъ кислородное соединеніе этого новаго радикала. Въ своей работћ они далће показываютъ, что присутствіе того же радикала можетъ быть допущено въ {117} составћ цћлаго ряда веществъ. При обработкћ горькоминдальнаго масла хлоромъ и бромомъ они получаютъ хлористый и бромистый бензоилъ — C14H10O2· Cl2 и C14H10O2· Br2, которые при дћйствіи іодистаго и ціанистаго калія образуютъ іодистыя соедиченія радикала, C14H10O2· J2 и C14H10O2· Cy2; наконецъ, въ соединеніи съ амміакомъ и алкоголемъ эти тћла даютъ бензамидъ и бензойный эфиръ.
Эта работа еще и понынћ считается однимъ изъ величайшихъ изслћдованій въ области органической химіи. Легко представить себћ, какое огромное впечатлћніе она произвела въ то время: впервые, исходя изъ соединенія, получили съ помощью простыхъ реакцій цћлый рядъ вполнћ опредћленныхъ тћлъ, пониманіе которыхъ весьма облегчается, если руководиться предложенной точкой зрћнія. Берцеліусъ, находившійся въ то время въ зенитћ своей славы и лишь изрћдка соглашавшійся съ мнћніями другихъ, расточаетъ обильныя похвалы этому изслћдованію52). Онъ выражаетъ надежду, что оно вызоветъ въ химіи наступленіе новой эры; онъ предлагаеть Либиху и Вёлеру назвать новый радикалъ проиномъ или ортриномъ (разсвћтъ), такъ какъ открытіе тройного радикала должно пролить яркій свћтъ на нашу науку.
Берцеліусъ былъ правъ! Правда, существенное значеніе этой работы заключается не въ радикалћ съ тремя элементами; но зато теперь даже въ этой обласги кислородъ теряетъ свою привиллегированную роль, которой онъ пользовался со времени Лавуазье. Кромћ того, то обстоятельство, что при выборћ радикала совершенно не принимался во вниманіе его составъ, показало, что значеніе понятія радикалъ надо искать въ чемъ-либо иномъ, и именно опытные результаты подтвердили правильность метода. Бензоилъ былъ радикалъ, такъ какъ онъ подобно элементу соединялся съ другими же элементами, и такъ какъ его можно было, не разлагая, переносить изъ однихъ соединеній въ другія. Бензоилъ сдћлался ключемъ интересныхъ реакцій Либиха и Вёлера; онъ послужилъ основаніемъ ряда бензойной кислоты подобно тому, какъ ціанъ сталъ основнымъ соединеніемъ для большой группы тћлъ.
Ціанъ и бензоилъ послужили столпами для теоріи радикаловъ, увћнчавшейся открытіемъ какодила. Я не могу ознакомить васъ здћсь со всћми подробностями чрезвычайно труднаго и блестяще {118} выполненнаго изслћдованія Бунзена, но все же мой долгъ изложить вамъ общіе результаты этой работы.
Каде въ 1760 году при дестилляціи уксуснокислаго калія съ мышьяковистой кислотой получилъ дымящуюся жидкость отвратительнаго запаха53), легко воспламеняющуюся на воздухћ; было также извћстно, что она ядовита и содержитъ мышьякъ. Повидимому, эти свойства удерживали химиковъ отъ дальнћйшаго изученія этого вещества, такъ какъ, за исключеніемъ нћскочькихъ незначительныхъ опытовъ Тэнара, въ продолженіе 70 лћтъ имъ не занимались вовсе, и довольствовались лишь тћмъ, что упоминали о немъ въ учебникахъ, какъ о жидкости Каде. Въ 30-ыхъ годахъ Дюма пытался выдћлить чистое соединеніе путемъ перегонки изъ сырого продукта, загрязненнаго различными примћсями, между прочимъ, металлическимъ мышьякомъ. По его анализамъ срединеніе должно было имћть формулу C8H12As2 (C=6, As = 75)54). Эта формула, повидимому, подтверждала первыя данныя Бунзена55). Но впослћдствіи была окончательно установлена иная формула, именно C4H12As2O (C = 12)56). Бунзенъ назвалъ это тћло окисью какодила и предположилъ, что радикаломъ его служитъ C4H12As2. Ему удалось получить при дћйствіи водородныхъ кислотъ хлоридъ, бромидъ, іодидъ, ціанидъ и фтористое соединеніе какодила. Дћйствіемъ сульфгидрата барія онъ получилъ сћрнистое соединеніе какодила, а при окисленіи — какодиловую кислоту C4H12As2· O3 + H2O. Наконецъ, ему удалось изолировать радикалъ какодилъ, разлагая его хлоридъ цинкомъ; это существенно содћйствовало тому, что его объясненія были приняты сочувственно. Можно себћ представить, какой толчокъ получило воображеніе химиковъ, когда они узнали о полученіи органическаго радикала, содержащаго металлъ и обладающаго къ тому же въ высшей степени замћчательнымъ свойствомъ самовозгоранія.
Я намћренно изложилъ вамъ сейчасъ это важное изслћдованіе Бунзена, которое было закончено лишь нћкоторое время спустя (1843). Я сдћлалъ это для того, чтобы выяснить вамъ понятіе о радикалћ въ его постепенномъ развитіи. Въ своемъ позднћйшемъ, существенно новомъ смыслћ понятіе о радикалћ явилось результатомъ цћлаго ряда {119} работъ, изъ которыхь главнћйшія я вамъ указалъ въ нћсколькихъ словахъ. При этомъ я старался изложить вамъ постепенное развитіе событій; теперь же позвольте мнћ охарактеризовать сущность этой идеи о радикалћ въ томъ видћ, какъ она утвердилась окончательно въ умахъ той эпохи.
Я начну съ знаменитаго опредћленія Либиха57). Въ 1837 г. въ своей критикћ теоріи Лорана онъ говоритъ. „Мы называемъ ціанъ радикаломъ, потому что 1) онъ составляетъ неизмћняющуюся составную часть цћлаго ряда соединеній, 2) онъ можетъ быть замћщенъ въ нихъ другими простыми тћлами, и 3) въ его соединеніяхъ съ простымъ тћломъ послћднее можетъ выдћляться и замћщаться эквивалентными количествами другихъ простыхъ тћлъ”.
Изъ этихъ трехъ условій, по мнћнію Либиха, по крайней мћрћ два должны быть удовлетворены для того, чтобы атомная группа могла называться радикаломъ. Они доказываютъ, что лишь изученіе природы соединенія можетъ опредћлить намъ находящійся въ немъ радикалъ. Для того, чтобы опредћлить въ какомъ-либо веществћ радикалъ, надо знать, какъ это вещество относится къ различнымъ элементамъ и сложнымъ тћламъ; уже отсюда вы можете заключить, какое значеніе имћло подобное опредћленіе. Выборъ радикала предопредћлялъ въ извћстной степени результаты всего изслћдованія, такъ какъ продукты расщепленія даны, коль скоро извћстенъ радикалъ; послћдній являлся, конечно, тћломъ сложнымъ, но съ его распадомъ прекращались родственныя отношенія, связывавшія одно съ другимъ тћла съ одинаковымъ радикаломъ. Все болће и болће подтверждалось, что свойства радикала и элемента одинаковы; радикалъ не только давалъ съ элементами соединенія, но и могъ быть отъ нихъ изолированъ. Какъ далеко пошли въ этомъ сравненіи, покажетъ вамъ цитата, извлеченная мною изъ одной статьи, опубликованной совмћстно Дюма и Либихомъ58). „Органическая химія обладаетъ своими собственными элементами, которые играютъ роль то хлора или кислорода, то какого-нибудь металла. Ціанъ, амидъ, бензоилъ, радикалы амміака, жировь, алкоголя и его производныхъ образуютъ истинные элементы органической природы, тогда какъ простћйшія составныя части, углеродъ, водородъ, кислородъ и азотъ, обнаруживаются лишь при разрушеніи органической матеріи”. Вы поймете поэтому, что атомы, входящіе въ составъ подобныхъ {120} группъ, считались соединенными между собой крћпче, чћмъ съ другими атомами. Такимъ образомъ радикалъ пріобрћлъ въ представленіи химиковъ того времени очень реальное значеніе: онъ существовалъ въ соединеніи, въ виду чего въ одномъ опредћленномъ тћлћ могло быть допущено существованіе лишь одного радикала. Но одновременно съ тћмъ, какъ увеличивалось значеніе радикала для выясненія строенія вещества, необходимо должны были обнаруживаться и разногласія относительно его выбора, смотря по тому, какіе продукты распада считались наиболће важными. Вызванные этимъ споры были очень полезны для дальнћйшаго развитія нашей науки. Каждый старался доказать свое мнћніе основательными доводами, a ихъ можно было найти лишь путемъ изученія реакцій соединенія, вызывавшаго разногласія. Такимъ образомъ, мы обязаны этимъ спорамъ очень точнымъ знаніемъ опредћленныхъ классовъ соединеній.
Я надћюсь, что вы не сочтете излишнимъ предыдущее изложеніе; оно должно было способствовать лучшему освћщенію теоріи радикаловъ. Дальнћйшее же развитіе ея мы прослћдимъ въ слћдующей лекціи.
| {121} |
Дальнћйшее развитіе теоріи радикаловъ. — Взгляды на алкоголь и его производныя. — Явленія замћщенія. — Правило Дюма. —Теорія ядеръ. — Эквивалентъ азота.
Мы остановились на исторіи развитія теоріи радикаловъ. Въ послћдней лекціи я пытался освћтить значеніе радикала, сегодня же хочу заняться болће близкимъ изученіемъ его природы. Я уже упомянулъ относительно тћхъ споровъ, которые возникали всякій разъ при выборћ какой-либо опредћленной группы атомовъ въ качествћ радикала; теперь я считаю своей задачей ознакомить васъ съ важнћйшими изъ этихъ споровъ. Наиболће рћзкія различія во взглядахъ возникли, главнымъ образомъ, при выясненіи строенія алкоголя и происходящихъ изъ него эфировъ. Такъ какъ пониманіе природы этихъ именно соединеній оказало существенное вліяніе на общіе теоретическіе взгляды, и, кромћ того, въ этихъ спорахъ приняли участіе наиболће выдающіеся представители нашей науки, то я попытаюсь показать вамъ именно на этой группћ тћлъ, сколь разнообразны и противорћчивы были взгляды на расположеніе атомовъ.
Уже въ послћдней лекціи я разсмотрћлъ такъ называемую теорію этерина, возникшую какъ результатъ сравненія различныхъ эфировъ съ амміачными солями. Въ послћднихъ допускали при этомъ присутствіе радикала NH3; хотя этому мнћнію нельзя отказать въ дуализмћ, однако оно не соотвћтствовало взглядамъ на соли. Въ то время существовала уже другая гипотеза амміачныхъ соединеній, согласно которой эти послћднія не занимали особаго положенія, a подчинялись принципамъ чистаго дуализма. {122}
Основой этой гипотезы служилъ радикалъ аммоній, который, какъ вы знаете, введенъ въ науку Дэви1). Амперъ2) же и Берцеліусъ3) способствовали главнымъ образомъ тому, что онъ былъ признанъ и другими. Нельзя отрицать, что съ точки зрћнія чистаго дуализма такое пониманіе амміачныхъ (аммонійныхъ) солей имћетъ неоспоримыя преимущества, такъ какъ здћсь эти соединенія аналогичны обыкновеннымъ солямъ, каковыми они должны были считаться по своимъ свойствамъ. И дћйствительно ихъ формулы таковы4):
|
|
Теперь очевидно, что эта же точка зрћнія можетъ быть примћнена и къ сложнымъ эфирамъ, если принять въ нихъ, вмћсто радикала C4H8, радикалъ C4H10. Берцеліусъ сдћлалъ этотъ шагъ въ 1833 г.5). Онъ поступилъ такъ не вслћдствіе своего пристрастія къ аммонійной теоріи, но подъ вліяніемъ вновь открытыхъ фактовъ, съ которыми я васъ сейчасъ и познакомлю.
Въ томъ же самомъ году Магнусъ, дћйствуя безводной сћрной кислотой на алкоголь и эфиръ, получилъ кислоты этіоновую и изэтіоновую6). Вторая была получена при разложеніи первой водою, и должна была согласно анализу быть изомерной съ ней. Ея баритовая соль получила, согласно господствовавшей этериновой теоріи, слћдующую формулу: C4H8 + 2SO3 + BaO + H2O. По мнћнію Магнуса, ее слћдовало разсматривать, какъ соединеніе эфира и безводной сћрной кислоты съ баритомъ. Анализы винносћрнокислаго барита7) (баріевой соли этилъ-сћрной кислоты), сдћланные Либихомъ и Вёлеромъ и подтвержденные Магнусомъ8), установили для этой соли слћдующій составъ: C4H8 + 2SO3 + BaO + 2H2O, т.-е. она должна была содержать однимъ атомомъ воды болће, чћмъ вновь открытое соединеніе. Берцеліусъ указалъ, что это соединеніе {123} при кипяченіи съ водой не можетъ быть превращено въ сћрно-винную кислоту, почему онъ считаетъ невћрнымъ лежащее въ основаніи этой формулы предположеніе, что эти вещества уже содержатъ готовую воду. Алкоголь и эфиръ представляютъ собою, по его мнћнію, окиси двухъ радикаловъ, именно C2Н6 и C2H5 = C4H10.
Оставалось принять, что сложные эфиры образуются изъ эфира katexochn и кислоты, они не содержатъ однако воды, и могутъ быть сравниваемы съ солями:
|
|
Берцеліусъ хорошо понималъ, какое важное значеніе имћетъ его предложеніе. Онъ достигъ теперь цћли, къ которой стремился издавна: дуалистическое воззрћніе нашло приложеніе также и къ органическимъ соединеніямъ, или, по крайней мћрћ, къ наиболће изслћдованной группћ ихъ; Берцеліусъ не скрываеть по этому поводу своей радости. Онъ высказываетъ мнћніе, что съ этого времени органическія тћла могутъ быть разсматриваемы, подобно минеральнымъ, какъ бинарныя группы, и что при этомъ роль неорганическихъ элементовъ играютъ только сложные радикалы. Этотъ взглядъ былъ впослћдствіи подробно развитъ Дюма и Либихомъ въ особой статьћ9).
Все это давало поводъ къ сильному разногласію. И дћйствительно ожесточенная полемика не заставила себя долго ждать. Первымъ началъ Либихъ, бросившій перчатку этериновой теоріи10). По его мнћнію эта теорія не можетъ считаться правшіыюй, и всћ доводы, которые можно было бы привести въ ея пользу, основываются на ложныхъ опытахъ. Къ числу послћднихъ принадлежитъ, вопервыхъ, наблюденіе Геннеля11), будто сћрная кислота поглощаетъ этеринъ (маслородный газъ) и непосредственно производитъ сћрновинную кислоту. Либихъ старается доказать, что къ этерину Геннеля были примћшаны алкоголь и пары эфира, чистый же газъ не поглощается сћрной кислотой12). Либихъ нападаетъ затћмъ на формулы {124} хлороплатиновыхъ соединеній Цейзе, состоящихъ, по мнћнію открывшаго ихъ, изъ этерина, хлористой платины и хлористаго калія13). Изъ анализовъ Цейзе и реакцій этого вещества Либихъ заключаетъ, что оно содержитъ не этеринъ, а эфиръ. Наконецъ, онъ оспариваетъ возможность существованія этилъ-щавелевокислаго (щавелевовиннокислаго), амміака который Дюма и Булле будто бы получили при дћйствіи сухого амміачнаго газа на щавелевый эфиръ14). По мнћнію Либиха то же самое вещество образуется и при дћйствіи воднаго амміака, и оно идентично оксамиду. — Этимъ, казалось, были разрушены всћ основы этериновой теоріи; подчеркивая это, великій нћмецкій ученый причисляетъ себя къ сторонникамъ гипотезы Берцеліуса относительно эфирообразныхъ соединеній, расходясь съ нимъ лишь въ пониманіи алкоголя. Либихъ и въ немъ предполагаетъ присутствіе радикала C4H10, который онъ называетъ э т и л о м ъ, при чемъ по его мнћнію алкоголь есть лишь гидратъ эфира C4H10О, H2О. Либиха не останавливало то обстоятельство, что въ одномъ объемћ алкоголя такимъ образомъ предполагалось вдвое меныие атомовъ, чћмъ въ такомъ же объемћ эфира. Въ то время химики были менће, чћмъ когда-либо, склонны признать гипотезу Авогадро. Это можно видћть изъ слћдующихъ словъ Либиха15):
„Было бы противорћчіемъ отрицать за эфиромъ, какъ окисью, способность давать съ водою гидратъ, тогда какъ онъ, подобно другимъ окисямъ, соединяется съ кислотами, а его радикалъ, подобно металламъ, можетъ соединяться съ галоидами; но, помимо этого, удћльный вћсъ паровъ алкоголя не можетъ служить основаніемъ, чтобы счигать это вещество окисью другого радикала. Напротивъ, тотъ фактъ, что эфиръ и водяной паръ соединяются въ равныхъ объемахъ и безъ уплотненія, по моему мнћнію, говоритъ скорће въ пользу того, что это соединеніе, т.-е. алкоголь, есть гидратъ эфира... Въ образованіи бензойнаго эфира изъ абсолютнаго алкоголя и хлористаго бензоила мы видимъ разложеніе воды, которое распространяется только на гидратную воду”.
Либихъ въ своемъ разсужденіи зашелъ слишкомь далеко: Цейзе и Дюма справедливо протестовали противъ этого. Первый повторилъ свое прежнее изслћдованіе горючей хлористой платины, {125} причемъ первоначальные результаты получили подтвержденіе. Въ соединеніи, освобожденномъ отъ кристаллизаціонной воды, нћтъ больше кислорода, и потому въ немъ нельзя уже предполагать присутствіе эфира, а лишь этеринъ16). Дюма также считаетъ результаты своихъ прежнихъ опытовъ вћрными17). Онъ показываетъ различіе между дћйствіемъ газообразнаго сухого амміака и воднаго: лишь во второмъ случаћ получается оксамидъ, амміачный же газъ образуеть соединеніе, описанное Дюма уже раньше и названное теперь оксаметаномъ; этому соединенію онъ приписываетъ формулу C4O3, NH3, C4H4 (C = 6)18). Поэтому Дюма остается при своемъ прежнемъ мнћніи и указываетъ на то, что ему принадлежитъ идея объ эфирћ (сћрномъ эфирћ), какъ основћ всћхъ сложныхъ эфировъ, въ чемъ, по его мнћнію, состоитъ все содержаніе теоріи этила; онъ дћлаетъ еще шагъ далће, представляя себћ, что эфиръ состоитъ изъ воды и маслороднаго газа.
Въ этомъ вопросћ Дюма былъ правъ. Это былъ какъ разъ тотъ единственный пунктъ, относительно котораго Дюма и Либихъ расходились и который уже былъ выдвинутъ Либихомъ раньше19): гипотеза Дюма о двухъ атомахъ водорода въ эфирћ, имћющихъ совершенно другое значеніе, чћмъ остальные водородные атомы, сильнће всего и оспаривалась нћмецкимъ изслћдователемъ. Открытіе меркаптана, сдћланное Цейзе20), даетъ Либиху поводъ привести новыя доказательства въ пользу своихъ идей21). Онъ считаетъ меркаптаны соединеніями, аналогичными алкоголю; они составлены изъ сћрнаго этила C4H10S и сћроводорода H2S, a ихъ интересныя металлическія соединенія доказываютъ, что въ нихъ дћйствительно имћются два атома водорода, играющіе иную роль, чћмъ остальные атомы водорода. Два года спустя, въ 1836 г., Либихъ вновь резюмируетъ всћ доводы за и противъ обоихъ мнћній22) и, въ концћ концовъ, признаетъ возможнымъ вывести изъ разнообразнћйшихъ фактовъ, главнымъ образомъ, изъ открытыхъ уже въ то время Дюма явленій замћщенія, заключеніе, что эфиръ есть не гидратъ, а окись. {126}
Ho вопросъ этимъ все еще не былъ исчерпанъ. Изслћдуя совмћстно съ Пелиго древесный спиртъ, Дюма нашелъ новыя данныя, подтверждавшія его взгляды23), Ему удалось опредћлить составъ этого тћла, — задача, надъ которой безуспћшно работали многіе химики. Дюма показалъ, что древесный спиртъ по всћмъ своимъ свойствамъ въ высшей степени сходенъ съ алкоголемъ и, подобно послћднему, съ кислотами даетъ эфирообразныя соединенія. Вслћдствіе этого онъ предполагаетъ въ древесномъ спиртћ радикалъ метиленъ, C2H4, полимерный съ этериномъ. Вновь выдвигаются преимущества этого воззрћнія, не требующаго допущенія гипотетическихъ радикаловъ24).
Полемика между Берцеліусомъ, Дюма и Либихомъ, изъ которой я вамъ привелъ нћкоторыя выдержки, принесла большую пользу нашей наукћ. Факты получили всестороннее освћщеніе, что было значительно полезнће для дальнћйшаго развитія науки, чћмъ если бы на первомъ планћ стояла лишь одна какая-либо химическая теорія. Названные химики были въ то время главными представителями нашей науки, и вокругъ нихъ группировались всћ другіе изслћдователи, изъ которыхъ лишь немногіе выступали съ собственными теоріями. Такимъ образомъ всћ химики раздћлились на три лагеря. Правда, въ 1837 г. было заключено нћчто въ родћ перемирія. При личномъ свиданіи Либихъ склонилъ Дюма на свою сторону, и оба ученые опубликовали сообща научную статью25). Въ ней они сообщаютъ, что съ этого времени они общими усиліями и съ одной и той же точки зрћнія приступаютъ къ обработкћ органической химіи; они будутъ анализировать въ своихъ лабораторіяхъ всћ еще не изслћдованныя ими вещества, организуютъ при содћйствіи своихъ учениковъ дальнћйшія изслћдованія по самымъ разнообразнымъ направленіямъ и будутъ подвергать работы всћхъ другихъ ученыхъ строгой критикћ и контролю. Но союзъ просуществовалъ лишь короткое время. Годъ спустя, онъ уже былъ расторгнутъ. Каждый пошелъ своимъ собственньшъ путемъ, и эти пути расходились, чћмъ дальше, тћмъ больше. Въ 1840 г. они уже вновь находятся во враждебныхъ лагеряхъ, хотя въ своихъ {127} выраженіяхъ, проявляютъ сравнительно съ прежнимъ нћсколько большую осторожность и вћжливость.
Тћмъ временемъ Дюма сдћлалъ наблюденія, заставившія порвать со всћми традиціями, отказаться отъ дуализма и электрохимической теоріи и высказать тћ взгляды, на которые Берцеліусъ обрушился особенно горячо. Берцеліусъ, до сихъ поръ содћйствовавшій самымъ существеннымъ образомъ развитію нашей науки, выдержавшій борьбу за свои теоріи со столькими противниками и оспаривавшій пальму первенства у Либиха и Дюма, теперь безуспћшно старается протовопоставить идеямъ Дюма и Лорана свои воззрћнія. Онъ опирается на необоснованныя гипотезы, которыя лишь много позже, благодаря работамъ Кольбе, получили реальное основаніе и вмћстћ научное значеніе.
Прежде чћмъ обратиться къ этому періоду времени, т.-е. къ теоріи замћщенія, теоріи ядеръ и парныхъ органическихъ соединеній, мы должны заняться обозрћніемъ дальнћйшаго развитія радикаловъ въ ихъ прежнемъ смыслћ. Этимъ я закончу изложеніе различныхъ воззрћній на природу алкоголя и происходящихъ отъ него соединеній.
Изслћдуя масло голландскихъ химиковъ, Реньо нашелъ, что оно при дестилляціи съ ћдкимъ кали теряетъ соляную кислоту и образуетъ тћло состава C4H6Cl226). Онъ считаетъ его хлоридомъ радикала альдегидена C4H6, и подтверждаетъ свой взглядъ тћмъ, что получаетъ еще бромистое и іодистое соединеніе этого радикала, присутствіе котораго онъ предполагаетъ также въ альдегидћ и уксусной кислотћ. Реньо пишетъ:
C4H6......... | гипотетическій радикалъ альдегиденъ |
C4H6, Cl2....... | хлоральдегиденъ |
C4H6, Br2....... | бромальдегиденъ |
C4H6, Cl2 + H2Cl2. . | хлористый углеводородъ (хлористый этиленъ) |
C4H6, Br2 + H2Br2 . . . | бромистый углеводородъ |
C4H6, O + H2O .... | альдегидъ |
C4H6, O3 + H2O .... | уксусная кислота |
Это изслћдованіе было выполнено Реньо въ 1835 году по совћту Либиха. Оно имћло цћлью доказать Дюма, что даже въ хлористомъ этиленћ нћтъ радикала этерина. Это изслћдованіе должно {128} было ниспровергнуть этериновую теорію, и въ дћйствительности оно, можетъ быть, сильно способствовало тому, что Дюма отказался отъ своихъ прежнихъ взглядовъ. Правда вслћдствіе этой же работы и Либихъ отказался отъ радикала этила, и пытался объяснить эфирообразныя соединенія гипотезой ацетила C4H627). Вновь эти тћла сравниваются съ амміачными солями, но въ послћднихъ уже предполагаютъ радикалъ амидъ.
|
|
Такимъ образомъ относительно солей и сложныхъ эфировъ были предложены три гипотезы. Онћ отличались другъ отъ друга лишь количествомъ атомовъ водорода принимавшихся въ радикалћ. Гипотезы эти слћдующія:
1. Амміачная теорія Лавуазье, соотвћтствующая этериновой теоріи Дюма и Булле.
2. Аммоніевая теорія Дэви, Ампера и Берцеліуса, соотвћтствующая этиловой теоріи Берцеліуса и Либиха.
3. Амидная теорія Дэви и Либиха, соотвћтствующая ацетиловой теоріи Реньо и Либиха.
Либихъ думалъ, что своей новой гипотезой онъ устранилъ всћ затрудненія и разрћшилъ всћ разногласія касательно этиловой и этериновой теоріи. Онъ заключаетъ свою статью словами: „Обћ эти теоріи, которыя были раньше противоположными, съ этой точки зрћнія, имћютъ, какъ легко замћтить, одинаковое основаніе, и этимъ самымъ устраняются всћ дальнћйшіе вопросы о вћроятности той или другой теоріи”.
Либихъ былъ въ нћкоторомъ отношеніи правъ. Вопросъ о томъ, содержится ли въ алкоголћ этеринъ или этилъ, уже больше {129} не обсуждался и, по всей вћроятности, не потому, что ацетилу было отдано предпочтеніе, но потому что понятію о радикалћ стали придавать иной смыслъ. Явленія замћщенія, извћстныя уже въ то время, стали постепенно все болће примћняться, а съ открытіемъ трихлоруксусной кислоты гипотезы, предложенныя Дюма и Лораномъ, пріобрћли большое вліяніе. Эти гипотезы не только угрожали теоріи радикаловъ въ той формћ, какую она приняла въ то время, но и самое основаніе химическихъ воззрћній, дуализмъ и электрохимическая теорія, подверглись нападенію и въ концћ концовъ были вытћснены изъ науки. Все это привело къ тому, что радикалы стали считать измћнчивыми, а соединенія начали разсматриваться, какъ нћчто единое (унитарное), предположеніе же о ихъ двойственной природћ было осуждено, какъ произвольное. Эти же гипотезы Лорана и Дюма привели нћсколько позже, въ связи съ понятіями, развившимися изъ теоріи многоосновныхъ кислотъ, къ пересмотру атомной величины соединеній, къ установленію понятія химической молекулы и къ теоріи типовъ. Одновременно съ этимъ понятіе объ эквивалентћ получаетъ болће точное опредћленіе и начинаетъ отдћляться отъ понятія атома. Становится общепризнаннымъ, что атомы не эквивалентны, но отличаются различной значностью; развивается, такимъ образомъ, теорія атомности, побуждающая къ опредћленію раціональнаго строенія въ нашемъ современномъ смыслћ.
He будемъ довольствоваться бћглымъ обзоромъ этой эпохи, столь богатой открытіями и гипотезами, и разсмотримъ ее поближе. Вы признаете при этомъ, что развитіе химіи въ теченіе этихъ послћднихъ семидесяти лћтъ не уступаетъ по интереснымъ и выдающимся моментамъ никакому другому періоду нашей науки. Число лицъ, участвующихъ въ ея разработкћ, все болће возрастаетъ, и весьма нелегко извлечь изъ разработаннаго за это время громаднаго матеріала все существенное и плодотворное; нужно, чтобы изложеніе было и логическимъ, и соотвћтствующимъ дћйствительности, нужно каждому воздать должное; нужно кромћ того не терять нити, разбираясь въ деталяхъ и спорахъ о пріоритетћ.
Исторія этой эпохи во всемъ ея цћломъ еще никогда не была написана28); рћшаясь на такой опытъ, я вполнћ сознаю, что объективное {130} изложеніе исторіи этой эпохи едва ли возможно, и что моя роль будетъ скорће ролью критика, чћмъ историка. Но для того, чтобы изложенные факты представляли собою нћкоторую цћнность для читателя, я употребилъ всћ усилія, чтобы придерживаться истины и не увлекаться ни предубћжденіями, ни лицепріятіемь.
Уже идея эквивалентности могла привести къ понятію о замћщаемости, или субституціи: количества двухъ кислотъ были эквивалентны, если они насыщали одно и то же количество основанія. Поэтому въ нейтральной соли одна кислота могла быть замћщена ея эквивалентомъ безъ уничтоженія нейтральности. Выраженіе „замћстимость” стало болће обоснованнымъ, послћ того какъ Митчерлихъ изучилъ явленія изоморфизма. Теперь уже можно было говорить, что въ кристаллћ опредћленные элементы могутъ быть замћщены другими безъ измћненія его формы. Такія замћщенія имћли ту особенность, что они не были связаны никакими опредћленными вћсовыми отношеніями. Тћмъ болће страннымъ можетъ показаться, что именно явленіе замћщенія сдћлалось существеннымъ орудіемъ при опредћленіи атомнаго вћса. Въ основћ этого лежала гипотеза, что одинъ какой-нибудь атомъ можетъ быть замћщенъ только однимъ какимъ-нибудь другимъ атомомъ, т.-е. число атомовъ въ изоморфныхъ соединеніяхъ предполагалось одинаковымъ. Но такъ какъ, вообще, сравнивали лишь химически сходныя вещества, то изоморфизмъм огъ способствовать развитію господствующихъ идей; однако этотъ родъ явленій не возбуждалъ никогда нападокъ на принятую систему.
Однако, нападеніе было сдћлано послћ того, какъ обнаружился рядъ фактовъ, съ которыми я васъ сейчасъ и познакомлю. Гэ-Люссакъ наблюдалъ, что при бћленіи воска хлоромъ на каждый освобождающійся объемъ водорода приходится равный объемъ поглощаемаго хлора29). To же было найдено при дћйствіи хлора на синильную кислоту. Вёлеръ и Либихъ въ упомянутомъ уже мною изслћдованіи соединеній бензоила открыли хлористый бензоилъ при обработкћ горькоминдальнаго масла хлоромъ. Они опредћленно указываютъ, что это соединеніе образуется изъ горькоминдальнаго {131} масла замћщеніемъ двухъ атомовъ водорода такимъ же количествомъ хлора30). Въ 1834 году Дюма изслћдовалъ дћйствіе хлора на терпентинное масло31), при чемъ опять оказалось, что каждый выдћлившійся объемъ водорода замћщался равнымъ объемомъ хлора. Дюма изслћдовалъ затћмъ продукты разложенія алкоголя хлоромъ и хлорной известью, чтобы выяснить природу и способъ образованія хлораля и хлороформа. Въ результатћ онъ формулируетъ въ общемъ видћ правило, эмпирически замћченное Гэ-Люссакомъ для частнаго случая32).
1. Если тћло, содержащее водородь, подвергается дегидрогенизирующему дћйствію хлора, брома или іода, то оно принимаетъ вмћсто каждаго теряемаго объема водорода равный объемъ хлора, брома и т. д.
2. Если тћло содержитъ воду, то оно теряетъ соотвћтствующій ей водородъ безъ замћщенія.
Второе правило было установлено главнымъ образомъ, чтобы объяснить образованіе хлораля, и вмћстћ съ тћмъ, чтобы подтвердить формулу алкоголя C8H8 + 2H2O (C = 6), принятую Дюма за шесть лћтъ передъ тћмъ. Явленія замћщенія должны были, по мнћнію Дюма, служить новымъ доказательствомъ различія водородныхъ атомовъ, изъ коихъ восемь связаны съ углеродомъ, а четыре съ кислородомъ. Замћщаться способны лишь первые, тогда какъ по слћдніе отнимаются безъ замћны ихъ другими.
Имћемъ:
(C8H8 + 2H2O) + 4Сl = | C8H8O2 + 4HСl |
Альдегидъ | |
C8H8O2 + 12Сl = | C8H2Cl6O + 6HСl |
Хлораль |
Дюма старается разнообразными примћрами доказать общепримћнимость установленной имъ закономћрности: правильно опредћливъ составъ масла голландскихъ химиковъ, онъ указываетъ, что образующійся изъ него при дћйствіи хлора хлористый углеродъ, изслћдованный Фарадэемъ33), служитъ новымъ доказательствомъ правильности его воззрћній. To же явленіе, по его мнћнію, происходитъ также при дћйствіи хлора на синильную кислоту и горько-миндальное масло и т. д. {132}
Этимъ Дюма не довольствуется. Онъ дћлаетъ еще шагъ далће и разсматриваетъ процессъ окисленія, какъ явленіе замћщенія, напримћръ, при переходћ алкоголя въ уксусную кислоту34). Въ этомъ случаћ каждый выдћляющійся объемъ водорода замћняется половиной объема кислорода. Происходитъ слћдующее:
(C8H8 + H4O2) | + O4 = | (C8H4O2 + H4O2) | + H4O2 |
Алкоголь | Уксусная кислота |
Такъ же точно объясняется образованіе бензойной кислоты изъ горько-миндальнаго масла.
C28H10O2· H2 | + O2 = | C28H10O2· O | + H2O |
Горько-миндаль- | Бензойная |
Чтобы объяснить при помощи своего правила дћйствіе кислорода, Дюма формулируетъ его слћдующимъ образомъ: если соединеніе подвергается дегидрогенизирующему дћйствію какого-нибудь тћла, то это послћднее присоединяется къ первому въ количествћ, эквивалентномъ потерянному водороду.
Въ такой формулировкћ предложеніе Дюма мнћ кажется наиболће многозначительнымъ. Оно показываетъ, что равные объемы водорода, хлора, брома и іода эквивалентны, и равнозначны лишь половинћ равнаго объема кислорода. Здћсь ясно обнаруживается различіе, и съ этого момента начали различать понятіе атома и эквивалента.
Явленія замћщенія или металепсіи, какъ ихъ назвалъ Дюма, въ теченіе слћдующихъ лћтъ изучались какъ имъ самимъ, такъ и Пелиго35), Реньо36), Малагути37) и особенно Лораномъ; мы разсмотримъ теперь главнымъ образомъ, какъ этотъ послћдній самостоятельно расширилъ правило Дюма.
Лоранъ обогатилъ химію рядомъ многочисленныхъ опытныхъ работъ, которыя къ сожалћнію, не всегда отличаются надлежащей точностью. Онъ располагалъ лишь очень ограниченными матеріальными средствами, но вмћсто того, чтобы въ виду этого ограничиться лишь немногими областями, Лоранъ, одаренный богатствомъ идей брался за многое и поверхностно все выполнялъ. Этимъ онъ {133} скомпрометировалъ себя, какъ экспериментаторъ. Лоранъ встрћтилъ враждебное отношеніе къ себћ съ самаго начала своей научной дћятельности, а позже онъ подвергся несправедливымъ нападкамъ со стороны Берцеліуса и Либиха. Это вызвало съ его стороны отпоръ; онъ продолжалъ итти своимъ путемъ и становился все менће понятнымъ, особенно же благодаря своей номенклатурћ, которой почти никто, кромћ него, не пользовался. Многія изъ его остроумныхъ и оригинальныхъ мыслей были вслћдствіе этого потеряны для нашей науки, или же поставлены въ заслугу другимъ. Многое было передано намъ лишь Жераромъ, который много лћтъ былъ другомъ и сотрудникомъ Лорана, и въ своемъ способћ выраженія и пониманія отличался, быть можетъ, меньшей глубиной, но за то значительно большей ясностью.
Лоранъ рано началъ заниматься явленіями замћщенія; сперва онъ изучалъ нафталинъ и его дериваты38); затћмъ одновременно съ Реньо онъ изслћдовалъ производныя хлористаго этилена39). Позже онъ изучалъ дћйствіе хлора на сложные эфиры40) и на продукты дестилляціи смолы, главнымъ же образомъ на фенолъ и т. д.41).
Эти разнообразныя изслћдованія очень скоро привелн Лорана къ убћжденію, что законъ замћщенія въ формулировкћ Дюма не всегда правиленъ, что въ очень многихъ случаяхъ присоединяется больше или меньше эквивалентовъ хлора или кислорода, чћмъ терялось эквивалентовъ водорода, и обратно, и что это имћетъ мћсто даже въ соединеніяхъ, которыя не содержатъ кислорода, и для которыхъ, слћдовательно, исключеніе не можетъ быть объяснено вторымъ правиломъ Дюма42). Но въ то же время Лоранъ указываетъ, что продуктъ замћщенія, происшедшаго съ сохраненіемъ эквивалентныхъ отношеній, сохраняетъ нћкоторую аналогію съ первоначальнымъ соединеніемъ; онъ утверждаетъ, что хлоръ, замћщающій выдћлившійся водородъ, въ нћкоторомъ родћ играетъ его роль. Взгляды Лорана можно приблизительно выразить слћдующимъ образомъ43):
Многія органическія вещества при обработкћ хлоромъ теряютъ нћсколько эквивалентовъ водорода, выдћляющихся въ видћ {134} соляной кислоты; элиминируемый водородъ замћщается равнымъ числомъ эквивалентовъ хлора, такъ что физическія и химическія свойства первоначальнаго вещества не измћняются существенно. Молекулы хлора поэтому занимаютъ мћсто, освободившееся отъ молекулъ водорода. Хлоръ въ новомъ соединеніи играетъ нћкоторымъ образомъ такую же роль, какъ водородъ въ первоначальномъ веществћ44).
Лоранъ пытается объяснить наблюдаемые факты и основанныя на нихъ гипотезы при помощи такъ называемой теоріи ядеръ45). Эта теорія, хотя и не встрћтила общаго сочувствія, имћла значеніе въ нашей наукћ потому, что многія изъ заложенныхъ въ ней идей были приняты, хотя и въ нћсколько иной формћ, а также и потому, что она легла въ основу органической части превосходнаго руководства Гмелина. Въ виду этого я приведу главныя ея положенія.
По мнћнію Лорана всћ органическія соединенія содержатъ извћстныя ядра, изъ которыхъ одни могутъ быть названы первоначальными (коренными, radicaux fondamentaux), другія же — производными. Первыя суть соединенія углерода и водорода, въ которыхъ взаимное отношеніе чиселъ атомовъ — простое: 1 : 2, или 1 : 3, или 1 : 4 и т. д., или 2 : 3 и т. д. Одному опредћленному отношенію соотвћтствуетъ нћсколько ядеръ, которыя полимерны между собою. Кромћ того эти основные радикалы подобраны такъ, что атомы водорода и углерода въ нихъ содержатся въ количествахъ, выраженныхъ четными числами.
Изъ основныхъ ядеръ путемъ замћщенія водорода другими элементами, напримьръ, хлоромь, бромомъ, іодомъ, кислородомъ, азотомъ и др., образуются побочныя ядра. Впослћдствіи Лоранъ допускалъ еще возможность замћщенія радикалами или атомными группами. При подобныхъ реакціяхъ всегда соблюдается правило Дюма, т.-е. освобожденный водородъ замћщается эквивалентными количествами другихъ элементовъ. Однако, ядро можетъ подвергнуться измћненію не только этимъ единственнымъ способомъ. {135} И именно въ данномъ вопросћ Лоранъ расходится съ Дюма. По мнћнію Лорана, атомы могутъ въ неопредћленномъ количествћ присоединяться къ радикалу или же отдћляться отъ него безъ всякой компенсаціи, между тћмъ какъ изъ ядра, какъ уже было указано, ни одинъ атомъ не можетъ быть удаленъ безъ замћщенія его какимъ-либо эквивалентомъ, такъ какъ въ противномъ случаћ послћдовало бы распаденіе всей группы. Такое распаденіе неизбћжно наступаетъ, лишь только изъ соединенія будетъ удаленъ углеродъ въ видћ угольной кислоты, окиси углерода и т. д. Тогда происходитъ либо полное разложеніе, либо же образуется новое ядро, отношеніе котораго къ первоначальному дальше не опредћляется. — По мнћнію Лорана, физическія и химическія свойства побочныхъ ядеръ весьма сходны со свойствами основныхъ радикаловъ; напротивъ, производныя ядра, образовавшіяся посредствомъ присоединенія, обладаютъ совершенно иными свойствами. Такъ, напримћръ, присоединеніе водорода и кислорода (воды) вызываетъ большею частью образованіе спиртовъ. При поглощеніи двухъ атомовъ кислорода получается нейтральная окись, при поглощеніи же четырехъ атомовъ кислорода образуется одноосновная кислота, а при поглощеніи шести атомовъ двухосновная кислота.
Лоранъ выработалъ себћ также геометрическое представленіе органическихъ соединеній. Ядра онъ изображаетъ въ видћ призмъ, въ вершинахъ ихъ расположены атомы углерода, а атомы водорода образуютъ ихъ ребра. Эти ребра могутъ быть удалены и замћнены другими, безъ существеннаго измћненія самой формы. Но если освободившееся мћсто оставить свободнымъ, то внутреннее равновћсіе нарушается, и цћлое распадается. Къ призмамъ можно еще пристроить атомы въ формћ пирамидъ и такимъ образомъ окружить всю фигуру, но этимъ, конечно, будетъ совершенно измћненъ ея видъ. Эти пирамиды могутъ быть удалены, и тогда первоначальная призма будетъ снова видна.
Мы въ нашей трезвой наукћ не привыкли къ такимъ образнымъ представленіямъ, и поэтому намъ можетъ показаться, что въ нихъ не скрывается ничего цћннаго для химіи. Чтобы опровергнуть такое мнћніе, я переведу гипотезы Лорана на нашъ обыкновенный языкъ, и вы тогда лучше поймете его идеи.
Теорія ядеръ произошла, очевидно, изъ теоріи радикаловъ. но путемъ ея существеннаго преобразованія. Радикалъ Лорана не имћетъ характера неизмћнной группы атомовъ, но представляетъ собой соединеніе, {136} которое можетъ измћняться при замћщеніи однихъ эквивалентовъ другими и при этомъ не терять своихъ характерныхъ свойствъ. Поэтому-то Лоранъ и можетъ всћ свои радикалы выводить изъ углеводородовъ, что находится, конечно, въ полномъ противорћчіи съ прежними идеями. Эти радикалы могутъ соединяться съ другими атомами, и въ тћлахъ, происшедшихъ такимъ образомъ, ядра существуютъ, какъ таковыя: они тамъ уже предсуществуютъ; въ этомъ пунктћ мнћніе Лорана согласуется съ мнћніемъ его предшественниковъ. Съ помощью этихъ двухъ гипотезъ онъ могъ объяснить всћ факты, наблюдаемые при явленіяхъ замћщенія, не только тћ, которые слћдуютъ правиламъ Дюма, но и тћ, которые имъ противорћчатъ; послћднихъ онъ нашелъ очень много. Въ то же время его теорія объясняетъ, почему возможны двоякаго рода реакціи. Вслћдствіе допущенія измћняемости радикаловъ, понятіе о нихъ, очевидно, стало охватывать значительно бóльшую группу соединеній, чћмъ это возможно было при прежней теоріи радикаловъ. Поэтому Лоранъ могъ открыть, выражаясь современнымъ языкомъ, значительно больше „генетическихъ отношеній”, и это было неоспоримымъ преимуществомъ. Такъ какъ онъ считалъ, что число атомовъ углерода въ ядрћ остается постояннымъ, то соединенія распадались на ряды по количеству содержащагося въ нихъ углерода, что послужило основаніемъ превосходной систематики. Между рядами, составленными такимъ образомъ, Лоранъ не находилъ никакого связующаго звена, и этимъ его классификація отличается отъ современныхъ классификацій, которыя стремятся выдвинуть какъ можно болће именно такихъ соотношеній. Конечно, въ то время это было еще неосуществимо.
Послћ всћхъ этихъ разъясненій я рћшаюсь утверждать, что въ теоріи ядеръ Лорана заключалось много новаго и хорошаго. Ея значеніе главнымъ образомъ заключается въ томъ, что она могла имћть широкое примћненіе и послужить основой для большого учебника; послћднее и доказалъ Гмелинъ. Въ этомъ отношеніи она очень выгодно отличается отъ теоріи радикаловъ, которая, вслћдствіе слишкомъ опредћленной формы, даваемой радикалу, могла быть полезна лишь въ опредћленныхъ направленіяхъ и многое оставляла безъ вниманія.
Я думаю, что будетъ полезно на нћсколькихъ примћрахъ показать, какимъ образомъ Лоранъ пользовался своими теоріями, и {137} каковы были его формулы для различныхъ соединеній. Я выберу знакомыя вамъ группы соединеній.
Этериновое ядро C4H8 (C = 12)46).
Хлористоводородный этеринъ..... | C4H8 + H2Cl2 |
Chloretherase | C4H6Cl2 |
Chlorhydrate de chloretherase..... | C4H8Cl2 + H2Cl2 |
Chloretherese............. | C4H4Cl4 |
Chlorhydrate de chloretherese..... | C4H4Cl4 + H2Cl2 |
Chloretherise............. | C4H2Cl6 |
Chlorhydrate de chloretherise...... | C4H2Cl6 + H2Cl247) |
Chloretherose............. | C4Cl8 |
Chlorure d'etherose.......... | C4Cl8 + Cl4 |
Хлораль.......... . . . . | C4Cl6O + H2O |
Бромаль | C4Br6O + H2O |
Хлоруксусная кислота (тогда неизвћстная) | C4H2Сl4O + О2 |
Метиленовое ядро | C2H4. |
Хлороформъ........... | C2Сl4 + Н2Сl2 |
Бромоформъ........... | C2Br4 + Н2Br2 |
Ціанъ.............. | C2Az2 |
Синильная кислота........ | C2Az2 + H2 |
Ціановая кислота........ | C2Az2 + О48) |
Ядро C14H14. | |
Горько-миндальное масло..... | C14H10О2 + Н2 |
Бензойная кислота........ | C14H10О2 + О |
Гидробензамидъ........ | C14H10Az4/3 + H249). |
Я намћренно выбралъ именно эти примћры. Они приводятъ насъ къ одному пункту во взглядахъ Лорана, котораго мы до сихъ поръ коснулись лишь поверхностно. Такъ какъ онъ считалъ возможнымъ замћщеніе водорода азотомъ, то мы можемъ спросить, каковъ же былъ эквивалентъ азота. Выводя ціанъ изъ метилена, мы видимъ, что Лоранъ считалъ 1 атомъ азота (т.-е. 14 частей азота) эквивалентнымъ двумъ атомамъ или вћсовымъ частямъ водорода. Но эта гипотеза не годилась для гидробензамида, полученнаго Лораномъ при обработкћ горькоминдальнаго масла амміакомъ. Если новое тћло {138} (гидробензамидъ) должно быть отнесено къ тому же самому ядру, про изводнымъ котораго, по Лорану, является бензойный альдегидъ, то 2/3 атома, т.-е. 9,33 частей азота должны быть эквивалентны 2 частямъ водорода. Лоранъ не могъ разрћшить этой дилеммы. Ее рћшилъ Бино50). Въ подробной статьћ, относящейся къ 1838 г., онъ пытается опредћлить эквивалентъ азота. Онъ выясняетъ сначала, что обычный способъ, примћняемый для опредћленія этой величины, заключаетъ въ себћ много произвольнаго. Обыкновенно берутъ количество вещества, которое въ своей низшей степени окисленія соединяется съ 100 частями кислорода, и считаютъ, что оно эквивалентно этому количеству кислорода; но вћдь съ такимъ же основаніемъ можно исходить и изъ любой другой степени окисленія. Бино ищетъ другой опорной точки и находитъ ее въ водородныхъ соединеніяхъ. Онъ сравниваетъ амміакъ съ водою и спрашиваетъ, сколько требуется атомовъ кислорода для полнаго окисленія водорода, связаннаго съ 1 атомомъ азота. Извћстно, что для этого необходимо 11/2 атома; такимъ образомъ Бино находитъ, что 14 частей азота эквивалентны 24 частямъ кислорода и 3 частямъ водорода, т.-е. что эквивалентъ азота по отношенію къ 16 частямъ кислорода есть 9,33 = Az2/3; онъ вводитъ для этого знакъ N и указываетъ, что теперь гидробензамидъ подчиняется правилу Дюма. Вполнћ понятно, что Лоранъ согласился съ опредћленіемъ Бино.
Теорія ядеръ почти ни у кого не встрћтила одобренія. При установленіи своей теоріи типовъ Дюма много ею пользовался, но, несмотря на то, что онъ цитировалъ при этомъ Лорана, мнћнія, безспорно выраженныя впервые послћднимъ, были приписаны Дюма. Правда, благодаря большему авторитету и болће высокому положенію Дюма, они скорће встрћтили признаніе.
Либихъ же высказался очень энергично противъ Лорана51), и его упреки были въ значительной степени справедливы. Примћняя свою систему, Лоранъ позволилъ себћ много произвольнаго, и Либихъ сумћлъ прекрасно обнаружить это. Далће онъ нападаетъ на факты, открытые Лораномъ и послужившіе опорой его взглядовъ; надо сознаться, что и эти факты не всегда могутъ устоять противъ строгой критики Либиха. {139}
Ho еще болће рћзки были нападки Берцеліуса52), ошибочно направленныя имъ противъ Дюма. Для творца электрохимической теоріи была совершенно непріемлема идея замћщенія положительнаго водорода отрицательнымъ хлоромъ безъ существеннаго измћненія характера продукта. Онъ употребляетъ неимовћрныя усилія, чтобы согласовать со своими теоріями все возрастающее число найденныхъ продуктовъ замћщенія; я откладываю подробное изложеніе его взглядовъ до одной изъ слћдующихъ лекцій, сегодня же закончу замћчаніемъ Жерара53), когорое познакомитъ насъ съ яснымъ и проницательнымъ взглядомъ этого въ то время еще совсћмъ молодого человћка.
Формула Лорана для масла голландскихъ химиковъ (этилена) была C4H6Сl2 + H2Сl2. Это соединеніе при дћйствіи хлора должно было бы перейти въ хлористый углеводородъ C4Сl1254). По мнћнію Жерара формула Лорана уже потому неправильна, что она предполагаетъ разложеніе соляной кислоты хлоромъ съ образованіемъ соляной же кислоты.
| {140} |
Грэмъ изслћдуетъ фосфорную кислоту. — Теорія многоосновныхъ кислотъ Либиха, его взгляды на кислоты вообще. — Признаніе гипотезы Дэви Дюлонга. Открытіе трихлоруксусной кислоты. — Теорія типовъ. — Нападки на электрическую теорію. — Возраженія Берцеліуса. — Парныя органическія соединенія.
Позвольте мнћ начать сегодня замћчаніемъ общаго характера, которое явится какъ бы добавленіемъ къ тому, что я говорилъ въ послћдней лекціи о явленіяхъ замћщенія, и въ частности о взглядахъ Дюма1) и Лорана2) на эти явленія.
Я хотћлъ бы указать вамъ именно на то, какъ вслћдствіе явленій замћщенія понятіе объ эквивалентћ получило болће опредћленную форму. Если допустить вмћстћ съ Дюма равнозначность замћщающихъ другъ друга количествъ, что оправдывалось взглядами Лорана, допускавшими прямое сравненіе между начальными и конечными продуктами, то все же для опредћленія эквивалентовъ замћщающихъ другъ друга тћлъ требовался еще цћлый рядъ опытовъ. Дћйствительно, часть химиковъ работала въ этомъ направленіи. Но въ виду того, что именно въ то время начала пріобрћтать большое вліяніе школа Гмелина, также пользовавшаяся эквивалентными формулами или желавшая ими пользоваться, нужно, разбирая опубликованные въ то время труды, внимательно слћдить за тћмъ, къ какой школћ принадлежитъ данный авторъ. Сторонники теоріи {141} замћщенія, пользовавшіеся эквивалентами, несмотря на многія ошибки и заблужденія, все же стремились разграничить понятія атома и эквивалента и изучать ихъ каждое въ отдћльности съ послћдовательностью; о противникахъ же этой теоріи можно сказать обратное. Было извћстно, что 1 эквивалентъ окиси алюминія Аl2О3 для своего насыщенія требуетъ въ три раза больше сћрной кислоты, чћмъ 1 эквивалентъ кали КО; было также извћстно, что 1 эквивалентъ фосфорной кислоты P2О5 для образованія нейтральной соли требуетъ въ три (въ дћйствительности въ два) раза больше основанія, чћмъ 1 эквивалентъ соляной кислоты; тћмъ не менће для всћхъ этихъ количествъ употреблялось выраженіе „эквиваленты”.
Именно потому, что современная химія основана существенно на различіи понятій атома и эквивалента, нужно особенно подчеркивать всћ тћ обстоятельства, которыя могли способствовать углубленію этого различія. Я желалъ вамъ указать, что въ тридцатые годы явленія замћщенія дали новый способъ опредћленія эквивалентовъ, и это было большимъ успћхомъ для вопроса, интересующаго насъ въ настоящій моментъ. Но съ другой стороны указывалось, что атомы сложныхъ тћлъ не должны быть непремћннооквивалентны. Были приведены убћдительные доводы, чтобы сдћлать очевидными различія, которыя съ этой точки зрћнія представляетъ классъ тћлъ, наиболће изученный, именно кислоты. Относящіеся сюда опыты по времени нћсколько предшествовали установленію теоріи типовъ Дюма, которая явилась слћдующей ступеныо въ развитіи явленій замћщенія, и потому я считаю необходимымъ сперва разсмотрћть эти изслћдованія. Несмотря на то, что въ то время обћ области, казалось, были совершенно раздћлены, тћмъ не менће ихъ взаимное вліяніе не только логически понятно, но даже можетъ быть доказано, и поэтому нельзя упускать изъ вида хронологической послћдовательности событій.
Рћдко случается, чтобы громадный успћхъ былъ достигнутъ такимъ малымъ количествомъ работъ, какое потребовалось для установленія теоріи многоосновныхъ кислотъ. Одинаково изящны и опредћленны были опытъ и идея, открывшіе экспериментальной наукћ такое широкое поле для изслћдованія, а теоріи — столь новыя и надежныя точки опоры. Лишь немногіе приняли участіе въ этомъ завоеваніи, столь важномъ для химіи, но эти немногіе завоеватели были храбрыми борцами. Какъ только мы вступили въ новую область, мы почувствовали твердую почву подъ ногами, несмотря на возраженія {142} авторитета, слова котораго, всегда считавшіяся непререкаемой истиной, на этотъ разъ не оказали никакого дћйствія.
Первый толчокъ къ изслћдованію теоріи кислотъ былъ данъ Грэмомъ. Его изслћдованіе фосфорной кислоты, способъ изложенія полученныхъ результатовъ, свободный отъ предвзятыхъ мнћній и гипотезъ, его ясныя и опредћленныя выраженія, — все это доказываетъ, что мы имћемъ дћло съ свћтлымъ и проницательнымъ умомъ. Если мы разсмотримъ идеи, вызванныя непосредственно этимъ изслћдованіемъ, и окинемъ взоромъ успћхи мысли, которымъ хотя и не исключительно, но все же въ громадной долћ способствовала работа Грэма, то должны будемъ сознаться, что рћдко случается, чтобы одна единственная статья сдћлала такъ много.
Изслћдованіе фосфорной кислоты3), произведенное Кларкомъ, привело къ убћжденію, что это тћло существуетъ въ двухъ изомерныхъ состояніяхъ, различіе которыхъ, какъ предполагалось, особенно проявляется въ ихъ соляхъ4). Обыкновенный фосфорнокислый натрій осаждалъ желтую нейтральную серебряную соль, и растворъ имћлъ кислую реакцію; пирофосфорная же соль, наоборотъ, осаждала бћлое пирофосфорнокислое серебро, при чемъ нейтральность сохранялась. Правда, было извћстно, что одна изъ этихъ натріевыхь солей кристаллизуется съ большимъ количествомъ воды, чћмъ другая. Но эту воду считали кристаллизаціонной и не придавали этому обстоятельству никакого значенія, такъ что обћ кислоты разсматривались, какъ изомерныя видоизмћненія5). Грэмъ устранилъ это заблужденіе, и ему удалось освћтить эту, въ то время еще темную, область тћмъ, что вода, содержащаяся въ гидратахъ кислоты, не была оставлена имъ безъ вниманія, какъ несущественная для ихъ строенія, и онъ доказалъ, что эта вода получаетъ роль основанія6). Знаменитый англійскій изслћдователь показалъ въ 1833 году, что обыкновенную фосфорную кислоту и всћ ея соли можно разсматривать, какъ соединенія одного атома фосфорной кислоты P2О5 съ 3 атомами основанія, которые способны всецћло или частью замћщаться водой. Такъ, обыкновенный (реагирующій нейтрально) фосфорнокислый натрій состоитъ, по его мнћнію, изъ 1 атома фосфорной кислоты, {143} соединеннаго съ 2 атомами ћдкаго натра и 1 атомомъ воды. При дћйствіи азотнокислаго серебра осаждается серебряная соль, содержащая 3 атома серебра, а азотнокислый натрій и азотная кислота остаются въ растворћ. Этимъ была объяснена замћченная уже Бертолле (въ сходныхъ случаяхъ) кислая реакція при смћшеніи двухъ нейтральныхъ солей7), — исключеніе изъ правила Рихтера. При этомъ 2 атома натра и 1 атомъ воды замћняются 3 атомами окиси серебра.
Другой очень важный результатъ изслћдованія Грэма получился изъ анализа пирофосфорной кислоты и ея соединеній. Грэмъ показалъ, что при нагрћваніи вышеупомянутой натріевой соли выше 350° содержащаяся въ ней вода освобождается, и такимъ образомъ образуется извћстный уже пирофосфорнокислый натрій, не изомерный, однако, какъ раньше думали, съ первоначальной солью, но отличающійся отъ нея тћмъ, что онъ содержитъ однимъ атомомъ воды меньше; зто имћетъ существенное значеніе для выясненія природы соли. Также и бћлый осадокъ, образующійся отъ солей серебра, содержитъ лишь 2 атома окиси серебра; свойство пирофосфорной кислоты состоитъ, вообще, въ томъ, что она насыщаетъ лишь 2 атома основанія (или воды), чћмъ она очень рћзко отличается отъ обыкновенной фосфорной кислоты. Въ послћдней количество кислорода основанія относится къ количеству его въ окиси, какъ 3 къ 5, а въ другой кислотћ, какъ 2 къ 5.
Грэмъ далће находитъ, что при нагрћваніи кислаго фосфорно кислаго натрія, состоящаго, по его мнћнію, изъ 1 атома фосфорной кислоты, 1 атома натра и 2 атомовъ (основанія) воды, оба атома воды уходятъ, и образуется соль, неизвћстная до того времени, именно метафосфорнокислый натрій. Содержащаяся въ этой соли кислота характеризуется тћмъ, что она насыщается однимъ атомомъ основанія, тогда какъ въ свободномъ состояніи она содержитъ 1 атомъ воды. Ея серебряное соединеніе также отличалось отъ обоихъ предыдущихъ; въ немъ количества кислорода въ основаніи и кислотћ относятся, какъ 1 къ 5.
Въ заключеніе изслћдованія доказывается, что мета- и пиро-фосфорныя кислоты такъ же, какъ и большинство ихъ солей, при кипяченіи съ водой переходятъ въ обыкновенную фосфорную кислоту или въ ея соль. {144}
Изъ работы Грэма непосредственно вытекаютъ два важныя теоретическія слћдствія.
1) Въ кислотахъ содержится опредћленное число атомовъ воды, черезъ замћщеніе которыхъ образуются соли.
2) Атомы кислотъ не всегда эквивалентны атомамъ основанія; въ нћкоторыхъ же случаяхъ измћняются даже отношенія. Такъ, напримћръ, изъ одного и того же фосфорнаго ангидрида Грэмъ получилъ три гидрата, способныхъ поглощать совершенно различныя количества основанія.
Въ 1838 году Либихъ формулировалъ эти заключенія очень ясно и опредћленно8). Но этотъ геніальный человћкъ не могъ удовлетвориться только изложеніемъ мыслей, вытекающихъ изъ чужихъ изслћдованій. Мы обязаны Либиху блестящимъ изслћдованіемъ ряда органическихъ кислотъ, изъ котораго вытекало, что фосфорная кислота въ вопросћ, касающемся отношеній ея къ основаніямъ, не представляетъ исключенія, но что и другія кислоты также обладаютъ свойствомъ насыщать однимъ атомомъ нћсколько атомовъ основанія. Такимъ образомъ Либихъ могъ, опираясь на болће широкое основаніе, ввести идею о многоосновныхъ кислотахъ.
Экспериментальныя изслћдованія Либиха простираются на слћдующія кислоты: гремучую, ціануровую, меконовую, коменовую, винную, яблочную и лимонную и др.. Въ соляхъ всћхъ этихъ кислотъ онъ находитъ отношенія, сходныя съ отношеніями фосфорной кислоты. Въ особенности Либихъ старается сопоставить съ тремя фосфорными кислотами, три ціановыя кислоты, т.-е. ціановую, гремучую9) и ціануровую. По его мнћнію въ этихъ кислотахъ, какъ и въ фосфорныхъ, имћется группа атомовъ, способныхъ насыщать то 1, то 2, то 3 атома основанія. Но въ то время, какъ въ одной атомный вћсъ остается неизмћннымъ, въ другой онъ увеличивается пропорціонально съ способностью насыщенія, такъ что образующіяся соли полимерньк Такимъ образомъ, въ послћднемъ случаћ частное отъ дћленія количества кислорода въ основаніи на количество его въ кислотћ остается неизмћннымъ, тогда какъ по Грэму въ разновидностяхъ фосфорной кислоты это не имћетъ мћста.
Либихъ пишетъ: {145}
3МО.Р2О5 — фосфорнокислая соль
2МО.Р2О5 — пирофосфорнокислая соль
МО.Р2О5 — метафосфорнокислая соль
3МОCy6О3 — ціануровая соль
2МОCy4О2 — соль гремучей кислоты
МОCy2О — ціановая соль
Несравненно важнће тћ соображенія Либиха, которыя привели его къ мысли отдћлить кислоты, аналогичныя фосфорной, отъ другихъ кислотъ. Онъ разсуждаетъ приблизительно такъ. He во всћхъ кислотахъ, раздћляющихъ съ фосфорной кислотой ея характерное свойство — однимъ атомомъ нейтрализовать нћсколько атомовъ основанія, — отношенія такъ же сложны, какъ у названной кислоты, и поэтому не для всћхъ кислотъ такъ легко доказать, что онћ принадлежатъ къ этой категоріи. Какой бы мы ни выбирали атомный вћсъ для фосфорной кислоты, мы все же никогда не достигнемъ, чтобы въ какомъ-либо изъ трехъ ея видоизмћненій 1 атомъ кислоты насытилъ одинъ атомъ основанія10). Каковы же отличительные признаки, указывающіе, что мы имћемъ дћло съ тћломъ этой группы?
Для рћшенія этого въ высшей степени важнаго вопроса Либихъ прибћгаетъ къ опыту. Онъ сравниваетъ свойства фосфорной кислоты со свойствами сћрной, т.-е. такого соединенія, которое онъ ни на какомъ основаніи не могъ бы причислить къ тому же разряду кислотъ; онъ говоритъ11):
„Если мы прибавимъ къ кислому сћрнокислому калію другое основаніе, которое не было бы изоморфно съ кали и образовало бы съ сћрной кислотой соль, лишенную гальгидратной воды12), напримћръ, натръ, то кислая соль раздћлится на двћ нейтральныя соли, глауберовую соль и сћрнокислый калій, кристаллизующіяся отдћльно одна отъ другой.
Напротивъ, если къ кислому фосфорно-кислому натрію прибавить опредћленное количество кали, то образуется фосфорно-кислый натрій-калій, совершенно аналогичный по своему составу съ кислою солью. Онъ содержитъ 3 атома основанія, изъ которыхъ два суть {146} натръ и кали; одинъ изъ двухъ раньше содержавшихся здћсь атомовъ воды замћщенъ черезъ кали, второй же остается въ составћ новой соли.
„Этимъ свойствомъ фосфорная и мышьяковая кислота отличаются отъ большинства всћхъ другихъ кислотъ; въ ихъ свойствћ соединяться съ нћсколькими атомами основанія заключается сама по себћ способность давать соли этой же группы съ разіичными основаніями, отличныя отъ тћхъ, которыя называются двойными. Я считаю, что эта характерная особенность является рћшающей для строенія какъ этихъ, такъ и всћхъ другихъ кислотъ, образующихъ соединенія, сходныя съ фосфорной кислотой”.
Такимъ образомъ былъ найденъ критерій для отличія фосфорной кислоты и ея аналоговъ отъ всћхъ другихъ кислотъ, и Либихъ, воспользовавшись этимъ, установилъ, что всћ изслћдованныя имъ тћла принадлежатъ именно къ этой категоріи. Очень интересны и важны причины, заставившія его причислить къ этой группћ также и винную кислоту. Это соединеніе въ то время обозначали черезъ C4Н4О5, такъ что его атомный вћсъ насыщалъ лишь 1 атомъ осно ванія. Существованіе сегнетовой соли и амміачнаго виннаго камня, которые можно получить изъ кислаго калійнаго соединенія посредствомъ нейтрализаціи соотвћтствующими основаніями, показали Либиху, что и винная кислота способна насыщать два атома основанія. Это обстоятельство побудило его удвоить ея атомный вћсъ, т.-е. обозначить его черезъ C8Н8О10. Проницательный авторъ этой знаменитой работы очень хорошо понялъ, что приведенныя соображенія даютъ новое орудіе для опредћленія атомнаго вћса.
Причины раздћленія кислотъ на различныя группы Либихъ объясняетъ въ слћдующихъ выраженіяхъ13): „Кислоты можно было бы подраздћлить на одноосновныя, двухосновныя и трехосновныя. Къ двухосновнымъ кислотамъ можно отнести тћ, 1 атомъ которыхъ соединяется съ двумя атомами основанія такимъ образомъ, что эти 2 атома основанія замћщаютъ въ кислотћ два атома воды. Понятіе объ основной соли отъ этого не измћняется. Если же 1 атомъ кислоты соединяется съ 2 или болће атомами основанія и при этомъ выдћляется лишь одинъ атомъ воды, т.-е. меньше, чћмъ число эквивалентовъ связаннаго основанія, то образуется собственно основная соль14). {147}
Такимъ образомъ былъ совершенъ этотъ великій шагъ, подготовленный работой Грэма, выполненный и обоснованный изслћдованіями Либиха. Если мы хотимъ быть вполнћ справедливыми, а это для насъ очень важно, то мы не должны умолчать, что въ 1837 году Либихъ опубликовалъ свою первую статью относительно этого вопроса въ сотрудничествћ съ Дюма15); это былъ единственный плодъ проектировавшагося союза обоихъ ученыхъ.
Въ этой же работћ, гдћ Либихъ подробно развиваетъ теорію многоосновныхъ кислотъ, согласно которой всћ кислоты распадаются на нћсколько группъ, онъ старается съ помощью одной „гипотезы” устранить различіе, до того времени существовавшее между водородными и кислородными кислотами. Эта „гипотеза” есть возвращеніе къ идеямъ Дэви и Дюлонга16).
Подобная же попытка, но съ гораздо меньшими результатами, была передъ тћмъ сдћлана Кларкомъ. По словамъ Гриффина17), Кларкъ уже въ 1826 г. высказывалъ подобные взгляды въ своихъ лекціяхъ. Въ 1836 г. онъ писалъ Митчерлиху18), что основаніемъ для такого пониманія онъ считаетъ изоморфизмъ сћрнокислаго натрія и марганцовокислаго барія. Этимъ соединеніямъ въ то время приписывали формулы
NaOSO3 и ВаОМп2О7
соотвћтственно чему они должны были содержать неодинаковое число атомовъ. Кларкъ предложилъ удвоить атомный вћсъ натрія (т.-е. сдћлать его въ четыре раза большимъ, чћмъ принятый теперь), и считать его величиной ту, которая принята была въ 1819 г. Берцеліусомъ19). Такъ какъ онъ разсматриваетъ кислоты какъ водородныя соединенія, изъ которыхъ черезъ замћщеніе водорода металлами образуются соли, то у него сћрная кислота имћетъ формулу H2SO4 и марганцовая НМпО4 слћдовательно, сћрнокислый натрій будетъ NaS2O8 и марганцовокислый барій BaMn2O8. Этимъ достигается равенство числа атомовъ въ обоихъ соединеніяхъ.
Совсћмъ другія соображенія, превосходящія только-что приведенныя какъ численностью, такъ и глубиной содержанія, привели {148} Либиха къ возстановленію гипотезы Дэви-Дюлонга. Грэмъ доказалъ, что пирофосфорная и метафосфорныя кислоты могутъ существовать въ водномъ растворћ, не переходя тотчасъ въ обыкновенную (трехосновную) фосфорную кислоту. Поэтому Либихъ спрашиваетъ, дћйствительно ли эти три кислоты отличаются одна отъ другой каждая 1 атомомъ воды, и дћйствительно ли измћненія въ основности фосфорной кислоты обусловливаются поглощеніемъ или выдћленіемъ в о д ы? Онъ не думаетъ, чтобы нашлись неоспоримыя доказательства въ пользу этой гипотезы, такъ что нельзя категорически отвергать противоположное предположеніе, согласно которому происхожденіе солей объясняется замћною водорода кислотъ (гидратовъ) металлами. Если признать эту идею вћрной, то кислоты не могли бы содержать воды въ готовомъ видћ, и ихъ нельзя было бы болће разсматривать, какъ соединенія, состоящія изъ ангидрида и воды точно такъ же, какъ и соли не могли бы болће считаться соединеніями кислоты (ангидрида) съ основаніемъ.
Существенную опору для гипотезы, по которой металлы въ соляхъ находятся, какъ таковые, Либихъ находитъ въ отношеніи рвотнаго камня къ высокой температурћ. На основаніи анализа, это соединеніе, высушенное при 100°, имћетъ формулу C8Н8КSb2O14. Полагали, что въ составъ его входитъ 1 атомъ безводной винной кислоты, 1 атомъ кали и 1 атомъ окиси сулемы, такъ что его формулу писали C8Н8O10 + КО + Sb2O3 (предполагая удвоенную формулу винной кислоты). По Либиху эта соль теряетъ при нагрћваніи до 300° еще два атома воды, что не наблюдается въ какихъ-либо другихъ соляхъ этой кислоты. Допустить присутствіе воды въ кислотћ, до сихъ поръ считавшейся безводной, Либиху казалось совершенно невозможнымъ въ виду тћхъ слћдствій, которыя изъ этого вытекали, и поэтому онъ думалъ, „что не остается ничего болће, какъ приписать образованіе воды возстановленію окиси сурьмы. Благодаря этому дћйствительное существованіе основанія въ металлическомъ состояніи, связаннаго съ кислородной кислотой, пришлось бы уже разсматривать, хотя бы лишь для нћкоторыхъ опредћленныхъ соединеній, не только какъ простое предположеніе20)”.
Въ другомъ случаћ Либихъ, обсуждая эти отношенія, пишетъ формулу винной кислоты C8Н4O12.Н8 формулу нагрћтаго до {149} 300 рвотнаго камня
C8Н4O12 | { |
K |
Sb2 |
при чемъ я долженъ замћтить, что въ этомъ случаћ предполагается замћщеніе трехъ атомовъ водорода однимъ атомомъ сурьмы21).
Либихъ соглашается, что трудно понять, какъ сћрной кислотой можно возстановить окись калія, но это необходимо допустить, если считать сћрнокислый калій соединеніемъ калія; онъ указываетъ случай, гдћ подобная гипотеза необходима для объясненія фактовъ. Разложеніе роданистаго серебра и свободной кислоты противорћчило бы всћмъ теоріямъ сродства, если бы составъ этой соли выражался формулой AgS + Cy2S, тогда какъ по формулћ Ag.Cy2S2 подобная реакція будетъ вполнћ нормальной. Кромћ того, эта гипотеза возстановленія окисей кислотами, на первый взглядъ мало удовлетворительная, въ концћ концовъ объясняетъ свойства многихъ кислотъ, которыя относительно окиси серебра обнаруживаютъ бóльшую способность насыщенія, чћмъ относительно натра, надћленнаго болће сильными основными свойствами.
Въ заключеніе Либихъ обращаетъ вниманіе на то, что признаніемъ гипотезы Дюлонга достигается объединеніе водородныхъ и кислородныхъ кислотъ, которое почти необходимо принять вслћдствіе тождества ихъ реакцій. Такъ, напримћръ, известь всегда отдаетъ одно и то же количество воды, будетъ ли она нейтрализована сћрной или же соляной кислотой. Въ то время это явленіе объясняли тћмъ, что въ одномъ случаћ вода уже находилась въ готовомъ видћ, а въ другомъ случаћ она лишь образовалась, но этимъ не объясняется, по мнћнію Либиха, существующая аналогія. Онъ пытается разрушить преграду, и его слова настолько важны, что ихъ стоитъ здћсь привести22).
„Для объясненія одного и того же явленія мы употребляемъ двоякаго рода выраженія. Мы принуждены приписывать водћ разнообразнћйшія свойства: есть основная вода, гидратная и кристаллизаціонная. Мы видимъ, что она входитъ въ соединенія, въ которыхъ она перестаетъ принимать одну изъ этихъ трехъ формъ. И все это объясняется исключительно воздвигнутой нами границей между галоидными и кислородными солями. Въ самихъ соединеніяхъ мы не находимъ такой границы, такъ какъ они обладаютъ во всћхъ отношеніяхъ одними и тћми же свойствами”. {150}
Такимъ образомъ Либихъ возвращается къ идеямъ Дэви: онъ въ слћдующихъ выраженіяхъ излагаетъ свои взгляды23).
„Кислотами называются опредћленныя водородныя соединенія, водородъ которыхъ можетъ быть замћщенъ металлами.
„Нейтральныя соли это — соединенія той же группы, въ которыхъ водородъ замћненъ эквивалентомъ какого-нибудь металла. Тћла, теперь называемыя нами безводными кислотами (ангидридами), обладаютъ способностью, соединяясь съ металлическими окисями, образовывать соли, но большею частью лишь при прибавленіи воды; или же это соединенія, разлагающія окиси при высокихъ температурахъ.
„При взаимодћйствіи кислоты съ металлической окисью водородъ выдћляется въ большинствћ случаевъ въ видћ воды. Для конституціи новаго соединенія совершенно безразлично, какимъ способомъ мы представляемъ себћ образованіе этой воды. Во многихъ случаяхъ вода образуется возстановленіемъ окиси, въ другихъ же случаяхъ она, можетъ быть, образуется на счетъ элементовъ кислоты; мы этого не знаемъ.
„Мы знаемъ только, что при обыкновенной температурћ никакая соль не можетъ образоваться безъ воды, и что строеніе солей аналогично водороднымъ соединеніямъ, которыя мы называемъ кислотами. Принципъ теоріи Дэви, который нужно имћть въ виду при ея оцћнкћ, состоитъ въ томъ, что насыщающая способность кислоты ставится имъ въ зависимость отъ количества содержащагося въ ней водорода или же отъ доли его, такъ что, если мы радикаломъ кислоты назовемъ совокупность всћхъ остальныхъ ея элементовъ, то составъ радикала не будетъ оказывать ни малћйшаго вліянія на эту насыщающую способность”.
Сущность этихъ положеній признается еще въ настоящее время. Вмћстћ съ тћмъ, что я вамъ раньше говорилъ о многоосновныхъ кислотахъ, они составляютъ основу нашихъ взглядовъ на кислоты. Правда, благодаря Жерару и Лорану, число признаковъ, отличающихъ многоосновныя кислоты отъ одноосновныхъ, было значительно увеличено, такъ что понятія и опредћленія также получили гораздо болће прочную и опредћленную формулу. Еще позже научились отдћлять основность кислоты отъ ея атомности и установили правила, по которымъ можно опредћлить также послћднюю. {151}
Ho это расширеніе произошло въ эпоху, слишкомъ отдаленную отъ разсматриваемой нами сейчасъ, такъ что я не буду на этомъ останавливаться.
Вы, конечно, понимаете, что Берцеліусъ не могъ раздћлять взглядовъ Либиха. Признать ихъ было для Берцеліуса равносильно тому, чтобы отказаться отъ основы своихъ теорій, — отъ дуализма. Правда, новая теорія не была чисто унитарной. Кислоты, согласно этой теоріи, должны были состоять изъ радикала и водорода, соли же — изъ радикала и металла; слћдовательно, двойственность существовала еще, но въ смыслћ, недопустимомъ для Берцеліуса. Въ особенности ему не могло нравиться представленіе Либиха о способћ образованія солей. По мнћнію послћдняго, это уже не были два соединенія перваго порядка, электроположительная и электроотрицательная составныя части, соединяющіяся между собой: образованіе соли должно было состоять въ замћщеніи водорода. Возможно ли было совмћстить этотъ взглядъ съ электрохимической теоріей, по которой соединенія происходятъ лишь оттого, что одни атомы связываются съ другими? Поэтому мы и видимъ, что Берцеліусъ протестуетъ противъ теоріи водородныхъ кислотъ (я позволяю себћ выразить этимъ словомъ идею Дюлонга24). Но его доводовъ было недостаточно, чтобы удержать отъ этихъ теорій большинство химиковъ; вслћдствіе этого я не буду ихъ касаться подробнће и возвращусь къ фактамъ, которые должны были привести къ унитарнымъ воззрћніямъ. Я имћю въ виду явленія субституціи, т.-е. замћщеніе водорода электроотрицательными элементами.
Кромћ Дюма и Лорана подобными же изслћдованіями занимались въ особенности Реньо и Малагути. Результаты, полученные ими, теоріи Лорана, а также взгляды Либиха на кислоты не остались безъ вліянія на Дюма. Въ высшей степени интересное открытіе, сдћланное имъ въ 1839, побудило его изложить свои новые взгляды на явленія замћщенія; онъ отказался отъ ранће высказанныхъ имъ положеній, по крайней мћрћ, отъ части ихъ, и замћнилъ ихъ другими, имћющими гораздо бóльшее значеніе. Такимъ образомъ изъ эмпирическихъ правилъ замћщенія возникла теорія типовъ.
При дћйствіи хлоромъ на уксусную кислоту въ солнечномъ свћтћ, Дюма получилъ кристаллическое тћло, составъ когораго {152} выражается формулой C4Cl6H2O425), почему его можно разсматривать, какъ уксусную кислоту C4H8O4, въ которой 6 атомовъ или объемовъ водорода замћнены 6 атомами хлора26). Весь интересъ и значеніе этой реакціи заключался въ свойствахъ полученнаго соединенія, названнаго Дюма хлоруксусной кислотой. Это была кислота съ такой же способностью насыщенія, какъ у уксусной кислоты. Поэтому Дюма могъ утверждать, что послћ вступленія хлора на мћсто водорода основной характеръ соединенія не измћняется или, какъ онъ выражается: „въ органической химіи существуютъ нћкоторые типы, остающіеся неизмћнными даже послћ замћщенія находящагося въ нихъ водорода равнымъ объемомъ хлора, брома или іода”.
Вы видите, что Дюма, открывъ хлоруксусную кислоту, пришелъ къ той же точкћ зрћнія, которая еще прежде была предложена Лораномъ, но отвергалась до сихъ поръ Дюма, какъ выходившая изъ области фактовъ27). Впрочемъ, было бы несправедливо по отношенію къ Дюма считать его теорію типовъ лишь приложеніемъ, или расширеніемъ идей Лорана. Послћдній обладалъ геніальнымъ спекулятивнымъ умомъ, и не боялся высказывать гипотезы, которыя еще невозможно было вполнћ доказать научнымъ путемъ. Это замћчаніе, я думаю, приложимо и къ его теоріи замћщенія. Что таково, по крайней мћрћ, было впечатлћніе, произведенное ею на его современниковъ, видно изъ критики этой теоріи Либихомъ28). Тогда еще недоставало фактовъ, которые доказывали бы опредћленнымъ и рћшительнымъ образомъ аналогію между начальнымъ и конечнымъ продуктомъ. Наша наука не можетъ прогрессировать съ помощью однихъ лишь идей, ея развитіе возможно лишь при условіи, чтобы мысль порождалась опытомъ, и до извћстной степени опредћлялась имъ. Если теоріи, которыя за годъ передъ тћмъ едва удостаивались вниманія, теперь были встрћчены съ сочувствіемъ, то это объясняется не только лишь положеніемъ и именемъ Дюма: химики того времени не настолько преклонялись передъ авторитетами. Но между теоріей ядеръ и теоріей типовъ лежало открытіе {153} хлоруксусной кислоты. Хотя можно „изъ словъ создать систему”*), но все же, къ счастью, въ химіи рћшающій опытъ цћнится больше, чћмъ рискованныя умозрћнія.
Нельзя было не замћтить сходства между уксусной и хлоруксусной кислотами. И когда Берцеліусъ, имћвшій свои основанія не признавать этого сходства, подчеркнулъ ихъ различія и не безъ ироніи спросилъ, въ чемъ же состоятъ родственныя отношенія этихъ двухъ тћлъ29), Дюма привелъ реакціи, происходящія въ нихъ подъ вліяніемъ ћдкаго кали, и указалъ на односторонность этихъ реакцій.
Именно, |
C4H2Cl6O4 = C2O4 + C2H2Cl6 |
C4H2H6O4 = C2O4 + C2H2H631) |
Слћдовательно, одновременно съ углекислымъ каліемъ въ одномъ случаћ образуется болотный газъ, а въ другомъ — хлороформъ. Эти два тћла такъ же отличаются между собой по составу, какъ и обћ уксусныя кислоты, и второе изъ этихъ тћлъ, какъ Дюма показалъ отдћльно32), можетъ образоваться изъ перваго при дћйствіи хлора.
Открытіемъ трихлоруксусной кислоты было положено основаніе для построенной Дюма теоріи типовъ33). Къ одному химическому типу, по Дюма, принадлежатъ тћла, которыя содержатъ одинаковое число эквивалентовъ, одинаково связанныхъ, и имћютъ сходныя главныя свойства. Таковы въ большинствћ случаевъ соединенія, которыя образуются одно изъ другого съ помощью очень простыхъ реакцій, напримћръ, уксусная и хлоруксусная кислоты; хлороформъ, бромоформъ и іодоформъ; этиленъ и его хлорозамћщенныя производныя.
Дюма считалъ, что въ понятіи химическаго типа онъ нашелъ основаніе для новой классификаціи, вполнћ приспособленной къ недавно открытымъ фактамъ. Но въ то же время онъ пользуется молекулярнымъ типомъ, введеннымъ Реньо34); Дюма {154} называетъ его также механическимъ типомъ. Сюда относятся напримћръ, слћдующія соединенія:
Болотный газъ.......... | C2H2H6 |
Метиловый эфиръ ....... | C2OH6 |
Муравьиная кислота....... | C2H2O3 |
Хлороформъ........... | C2H2Cl6 |
Хлористый метилъ..... . . | C2Cl2H6 |
Хлористый углеродъ ....... | C2Cl2Cl6. |
Эти тћла можно разсматривать, какъ происходящія одно изъ другого путемъ замћщенія, и они могутъ обладать весьма различными свойствами; ихъ соединяютъ въ естественное семейство. Въ основаніи этой идеи лежитъ точка зрћнія, гораздо болће общая, чћмъ та, которая привела Дюма къ установленію химическихъ типовъ. Тћла послћдняго ряда образуютъ лишь подотдћлъ соединеній, которыя должны быть причислены къ тому же механическому типу. Это очень хорошо понималъ и самъ Дюма, который говоритъ: „Каждый разъ, когда тћло измћняется, не выходя, однако, изъ своего молекулярнаго типа, это измћненіе происходитъ по закону замћщенія. Каждый разъ, когда тћло, измћняясь, переходитъ въ другой молекулярный типъ, законъ замћщенія при реакціи уже не соблюдается”. И далће: „Алкоголь, уксусная кислота и хлоруксусная принадлежатъ къ одному естественному семейству, а уксусная кислота и хлоруксусная принадлежатъ къ одному роду”. Поэтому можно утверждать, что какъ механическій типъ, такъ и ядро въ идећ сводятся къ одному и тому же; оба эти понятія охватываютъ тћла, которыя возникаютъ одно изъ другого путемъ эквивалентнаго замћщенія, или о которыхъ можно предположить, что они возникаютъ такимъ образомъ.
Какъ вы замћтили, Дюма теперь пришелъ къ заключенію, что его законъ замћщенія непримћнимъ ко всћмъ реакціямъ, и именно, что не всегда на мћсто уходящаго водорода становится эквивалентъ другого элемента. Дюма долженъ былъ съ этимъ согласиться тћмъ скорће, что въ органическихъ соединеніяхъ (напримћръ, въ алкоголћ) онъ теперь уже не допускалъ присутствія готовой воды36); вслћдствіе этого его второе правило теряетъ свою силу37). Дюма долженъ поэтому признать, и онъ это дћлаетъ совершенно {155} опредћленно, „что явленіе замћщенія не есть общее”. Онъ даже находитъ въ этомъ одинъ изъ его существеннћйшихъ признаковъ38).
Ограничивая такимъ образомъ примћнимость закона замћщенія, онъ расширяетъ его дћйствіе въ другомъ направленіи. По мнћнію Дюма, въ органическомъ веществћ можетъ быть замћщенъ не только водородъ, но и всћ находящіеся въ немъ элементы: кислородъ, азотъ и даже углеродъ39), ихъ могутъ замћщать не только другіе элементы, но также и сложныя группы, какъ ціанъ, окись углерода, сћрнистая кислота, амидъ и др. Это допущеніе замћстимости углерода, вызвало живћйшія возраженія и въ Германіи было даже осмћяно40). Это допущеніе, казавшееся безсмысленной гипотезой, явилось слћдствіемъ опытовь Вальтера41), который получилъ при обработкћ камфорной кислоты сћрнымъ ангидридомъ сульфокамфорную кислоту, при чемъ выдћлялась окись углерода. Эту кислоту Дюма считалъ камфорной кислотой, въ которой 1 атомъ углерода замћщенъ группой SO2.
Если идею молекулярнаго типа понимать въ самомъ широкомъ смыслћ, то можно утверждать, что эта идея Дюма о замћщеніи углерода вполнћ оправдалась позднћйшими опытами. Уже Вёлеръ указалъ42) на замћщеніе углерода кремніемъ, а Фридель и Крафтъ съ помощью реакцій, вполнћ аналогичныхъ реакціямъ, употребляемымъ для превращенія углеводорода въ соотвћтствующій алкоголь, перевели кремній-этилъ въ силико-нониловый спиртъ. Какъ видно изъ названія, это соединеніе считалось нониловымъ спиртомъ, въ которомъ 1 атомъ углерода замћщенъ 1 атомомъ кремнія43). Въ послћднее время были получены кремневыя соединенія, которыя не только могутъ считаться аналогичными нћкоторымъ углеродистымъ соединеніямъ, но и обнаруживаютъ подобныя имъ свойства, какъ, напримћръ, тріэтилсиликоль44). Еще болће замћчательно большое сходство тіофена съ бензоломъ, такъ какъ первый можетъ быть полученъ изъ второго при замћщеніи группы C2Н2 атомомъ S45). {156}
Здћсь я замћчу еще, что мнћніе Дюма о замћщеніи углерода противорћчило теоріи ядеръ Лорана и усложняло систему классификаціи органическихъ тћлъ по числу содержащихся въ нихъ атомовъ углерода. Обћ идеи мало отличаются между собою въ пониманіи радикала, но расходятся въ вопросћ о его составћ. Дюма теперь опредћленно указываетъ, что радикалъ не есть неизмћняемая группа, но, наоборотъ, въ немъ такъ же, какъ и во всћхъ соединеніяхъ, одни атомы замћняются другими. Впрочемъ, еще за два года передъ тћмъ Жераръ высказалъ подобное же мнћніе, и поэтому я въ одной изъ слћдующихъ лекцій подробно коснусь этого пункта.
Ближайшимъ и, быть можетъ, важнћйшимъ слћдствіемъ теоріи типовъ было то, что она вызвала необходимость унитарнаго воззрћнія. Нельзя было болће считать, что соединеніе состоитъ изъ двухъ частей: оно представляло одно цћлое, измћняющееся такимъ образомъ, что на мћсто одного атома могъ входить другой. Дюма сравниваетъ химическое соединеніе съ планетной системой. Небесныя свћтила — это атомы, а вмћсто силы тяготћнія ихъ удерживаетъ сила сродства. При этомъ одни атомы могутъ быть замћнены другими. Пока число эквивалентовъ и взаимное расположеніе атомовъ не измћняются, система также остается неизмћнной.
Согласно теоріи типовъ, свойства соединенія обусловливались значительно болће расположеніемъ атомовъ, чћмъ ихъ природой. Дюма теперь защищаетъ это положеніе, какъ провћренное на опытћ. Оно даетъ ему основаніе напасть на электрохимическую теорію. Послушаемъ его собственныя слова46):
„Однимъ изъ ближайшихъ слћдствій электрохимической теоріи является необходимость считать всћ химическія соединенія бинарными тћлами. Въ каждомъ изъ нихъ необходимо разыскивать обћ составныя части, различаемыя, какъ положительныя и отрицательныя. He было идеи болће вредной для развитія органической химіи, чћмъ эта”. Въ другомъ мћстћ47) Дюма говоритъ. „Вездћ, гдћ теорія замћщенія и теорія типовъ предполагаютъ однородныя молекулы, въ которыхъ допускается возможность замћщенія однихъ элементовъ другими, безъ видоизмћненія формы или внћшнихъ свойствъ {157} всего зданія, электрохимическая теорія раздћляетъ эти молекулы, можно сказать, единственно для того, чтобы найти въ нихъ двћ взаимно противоположныя группы. Эти группы затћмъ она представляетъ себћ связанными другъ съ другомъ силой ихъ взаимной электрической дћятельности”.
Дюма не отрицаетъ вліянія электрическихъ силъ на химическія реакціи. По его мнћнію, очень возможно даже, что химическія и электрическія силы тождественны. Но онъ критикуетъ электрохимическую теорію Берцеліуса, по которой водородъ долженъ быть всегда положительнымъ, а хлоръ всегда отрицательнымъ.
Онъ допускаетъ возможность вліянія электрическихъ силъ на образованіе или разложеніе соединеній, но считаетъ ошибочнымъ и несовмћстимымъ съ явленіями замћщенія представленіе о неизмћняемости электрическаго состоянія атомовъ.
Роковой моментъ наступилъ. Надо было защищать отъ враждебныхъ теорій дуализмъ и находившуюся съ нимъ въ полномъ согласіи электрохимическую теорію, господствовавшую почти самодержавно въ продолженіе 20 лћтъ. Надо было изыскивать пути и способы, чтобы связать вновь открытые факты, именно явленія замћщенія, съ электрохимическими идеями.
Берцеліусъ увидћлъ надвигавшуюся грозовую тучу еще прежде, чћмъ разразилась гроза, и принялъ мћры защиты. Уже когда Лоранъ въ своихъ первыхъ работахъ сдћлалъ допущеніе, что водородъ ядра, основного радикала, можетъ быть замћщенъ хлоромъ, Берцеліусъ, отлично понявшій опасность подобныхъ взглядовъ для своей теоріи, энергично выступилъ противъ утвержденія Лорана48). Вступленіе электроотрицательныхъ элементовъ въ радикалы онъ считаетъ непріемлемой гипотезой; теперь онъ отвергаетъ даже кисло родные радикалы, которые онъ привћтствовалъ съ такой радостью за нћсколько лћтъ передъ тћмъ. По мнћнію Берцеліуса, это предположеніе „подобнаго же рода, какъ если бы считать сћрнистую кислоту радикаломъ сћрной кислоты, а перекись марганца — радикаломъ марганцовистой кислоты. Окись не можетъ быть радикаломъ. Это понятіе по своему существу означаетъ тћло, которое въ окиси связано съ кислородомъ”.
Берцеліусъ теперь признаеть только радикалы, содержащіе углеродъ и азотъ, или азотъ и водородъ, или углеродъ, азотъ и {158} водородъ. „Сћра такъ же, какъ кислородъ, не можетъ входить въ составъ радикала”. При этомъ „тройные радикалы должны разсматриваться, какъ соединенія бинарнаго радикала съ простымъ, или какъ соединенія двухъ бинарныхъ тћлъ”49).
Основаніемъ соединеній, открытыхъ Либихомъ и Вёлеромъ, считаютъ теперь радикалъ C14H10, и это подтверждается аналогіей между бензойной кислотой, бензоиломъ и углеводородомъ C14H10 съ одной стороны, и марганцемъ — съ другой.
|
|
Берцеліусъ считаетъ хлористый бензоилъ сходнымъ съ хлорокисью хрома, при чемъ для послћдней онъ принимаетъ формулу Розе51). Онъ пишетъ:
2СrО3 + СrСl6 | хлорокись хрома |
2C14H10О3 + C14H10Cl6 | хлористый бензоилъ. |
Совершенно аналогична формула хлорокиси углерода. Дюма считалъ ее угольной кислотой, въ которой 1 атомъ кислорода замћщенъ 2 атомами хлора52).
Берцеліусъ пишетъ: СO2 + ССl4 фосгенъ.
Онъ считалъ эти формулы совершенно правильными съ точки зрћнія дуализма, который онъ теперь защищаетъ сильнће, чћмъ когда-либо. „Такъ какъ силы, производящія химическія соединенія, дћйствуютъ не болће чћмъ между двумя тћлами противоположныхъ электрохимическихъ свойствъ, то всякое соединеніе можетъ дћлиться на 2 составныя части, изъ которыхъ одна—электроположительная, другая же — электроотрицательная”53).
Слћдствіемъ этой теоріи является раздћленіе всћхъ тћлъ, содержащихъ вмћстћ съ углеродомъ и водородомъ еще кислородъ, хлоръ, бромъ или сћру, на нћсколько частей, выбранныхъ иногда, повидимому, совершенно произюлью. Для того, чтобы облегчить {159} это раздћленіе на бинарные радикалы, атомные вћса часто удваиваются и утраиваются. Но эго вызываетъ необходимость очень сложныхъ формулъ, изъ которыхъ я вамъ приведу лишь нћкоторыя:
Хлорный эфиръ Малагути:
C4H6O3 + 2C4H6Cl654)
Его же сћрнохлорный эфиръ:
C4H6O3 + 2C4H6Cl6 + (C4H6O3 + 2C4H6S3) и т. д.55)
Весьма большое значеніе имћетъ, какъ мы впослћдствіи увидимъ, взглядъ Берцеліуса на хлоруксусную кислоту. Онъ считаетъ ее соединеніемъ щавелевой кислоты съ хлористымъ углеродомъ:
C2Cl3 + C2O3
тогда какъ уксусная кислота остается трехокисью радикала ацетила C4H6 или C4H3. Еще въ 1840 году онъ отрицаетъ сходство строенія обоихъ соединеній, и настаиваетъ на ихъ различіи, несмотря даже на ихъ одинаковое отношеніе къ ћдкому кали56).
Въ концћ концовъ подобные взгляды не могли долго устоять противъ все возраставшаго числа продуктовъ замћщенія, изъ которыхъ очень многіе обнаруживали очевидное сходство съ кореннымъ веществомъ. Когда въ 1842 г. Мельсану удалось получить обратно уксусную кислоту изъ хлоруксусной дћйсгвіемъ амальгамы калія57), и когда онъ такимъ образомъ доказалъ, что хлоръ также можетъ быть замћненъ водородомъ, вслћдствіе чего возстановляется первоначальное вещество, то Берцеліусъ былъ принужденъ, наконецъ, сдћлать уступку. Онъ говоритъ58). „Если мы вспомнимъ о разложеніи хлоромъ уксусной кислоты на хлорощавелевую (хлоруксусную) кислоту, то представится возможность другого взгляда на составъ ацетиловой кислоты: именно, что эта кислота является парной (удвоенной) щавелевой кислотой59): часть ея „пары” (Рааrling) есть C2H3, подобно тому какъ часть „пары” въ хлоруглещавелевой кислотћ есть C2Cl3; сообразно съ этимъ дћйствіе хлора на ацетиловую кислоту должно состоять въ превращеніи парнаго члена C2H3 въ C2Cl3”. {160}
Берцеліусъ, можетъ быть, не замћтилъ, что этимъ онъ призналъ основной принципъ теоріи замћщенія, противъ котораго онъ такъ горячо выступалъ нћсколько лћтъ передъ тћмъ. Хлоръ могъ замћстить водородъ „пары”, и строеніе соединенія существенно этимъ не измћнялось. Берцеліусъ писалъ:
C2О3 + C2Сl3 | хлоруксусная кислота |
C2О3 + C2H3 | уксусная кислота. |
Но не былъ ли этимъ нарушенъ важнћйшій принципъ электрохимической теоріи? Я думаю, да. Теперь необходимо было допустить, что въ „парћ” находятся силы, отличныя отъ электрическихъ, или же что въ соединеніи измћнились электрическія свойства элементовъ, но оба эти предположенія одинаково рћзко противорћчили бы прежнимъ идеямъ Берцеліуса.
Такимъ образомъ побћда осталась за теоріей замћщенія. Правда, Берцеліусъ никогда не сознавался въ своемъ пораженіи, но въ дћйствительности онъ все-таки сдался. Электрическая теорія съ этихъ поръ была оставлена. Умирая, она произвела на свћтъ ученіе о „парахъ”. Но были ли они жизнеспособны? Вначалћ они такими не казались. Ихъ считали праздной выдумкой уставшаго ума. Я отчасти съ этимъ согласенъ. Однако въ нихъ все же таилась искорка жизни, такъ какъ въ противномъ случаћ они не были бы спо собны къ дальнћйшему развитію, и даже такому изслћдователю, какъ Кольбе, не удалось бы поднять теорію парныхъ соединеній до той высоты, какой она впослћдствіи достигла.
Но объ этомъ поговоримъ въ слћдующей лекціи.
| {161} |
Вліяніе школы Гмелина. — Теорія остатковъ. — Парныя соединенія. — Жераръ опредћляетъ эквиваленты. — Лоранъ разграничиваетъ понятія объ атомћ, молекулћ и эквивалентћ. — Новые критеріи для многоосновныхъ кислотъ. — Молекула элементовъ имћетъ сложный составъ.
Сраженіе было дано, и побћда рћшена. Основанная Берцеліусомъ электрохимическая гипотеза оказалась не въ состояніи объяснить разнообразныя реакціи органической химіи, и въ особенности явленія замћщенія. Фундаментъ ея былъ расшатанъ фактомъ замћщенія положительнаго водорода отрицательнымъ хлоромъ, и потому все зданіе, т.-е. электрохимическая теорія1) обрушилась. Органическая химія показала, что законы, при установленіи которыхъ она не была принята во вниманіе, не согласуются съ фактами. Но теперь возникаль вопросъ, могла ли органическая химія дать что-либо положительное? Возможно ли было, исходя изъ того, что достигнуто ею, или что должно было быть достигнуто, установить новыя точки зрћнія, которыя могли бы служить основою химической системы?
Для неорганическихъ соединеній остались въ силћ электрохимическая теорія и дуализмъ, но затћмъ выяснилась необходимость рћзко разграничить неорганическія соединенія отъ органическихъ, чтобы имћть возможность пользоваться для первыхъ ученіемъ, которое оказалось непригоднымъ для вторыхъ. Если бы органическая химія пожелала воспользоваться плодами своей побћды, чтобы совершенно вытћснить это ученіе, то она была бы обязана предложить взамћнъ {162} противной сторонћ, т.-е. неорганической химіи, такую опредћленную точку зрћнія, на которой та могла бы вновь базироваться. Но органическая химія вначалћ не была способна на это, такъ какъ до сихъ поръ усилія были направлены болће на ниспроверженіе стараго, чћмъ на созданіе новаго. Правда, многократно дћлались попытки разсматривать всћ органическія соединенія съ одной опредћленной точки зрћнія. Такимъ образомъ возникли теоріи радикаловъ, ядеръ и типовъ, которыя имћли каждая своихъ защитниковъ; но, именно, это многообразіе теорій и доказывало ихъ несостоятельность. Мы наблюдаемъ въ это время пеструю смћсь системъ, сторонники которыхъ ожесточенно боролись между собой, не всегда даже сохраняя приличный тонъ.
Поэтому трудно сказать, какія идеи были доминирующими въ сороковыхъ годахъ; мнћнія сильно расходились даже относительно самыхъ основъ каждой теоріи строенія. Вначалћ большимъ вліяніемъ пользовалась школа Гмелина, которой атомистическая теорія показалась слишкомъ гипотетичной. Мы не должны удивляться, что химики въ то время начинаютъ все болће склоняться къ этому воззрћнію, и что само слово „атомный вћсъ” начинаетъ постепенно вытћсняться словомъ „эквивалентъ”, при чемъ оно употребляется, какъ у Волластона, въ смыслћ соединительнаго вћса1). Co времени крушенія системы Берцеліуса, единственной, которая обнимала всю науку съ единообразной точки зрћнія, появились всевозможныя гипотезы и теоріи, которыя казались непригодными къ общему примћненію и потому недолговћчными; естественно, что у многихъ возникло отвращеніе ко всякимъ умозрћніямъ, каковыя считались несвоевременными и вредными для науки. Своевременнымъ считалось лишь трезвое толкованіе фактическаго матеріала. Типичнымъ представителемъ такого направленія былъ Гмелинъ, который съ обширными знаніями соединялъ необыкновенное прилежаніе. Оба эти качества онъ примћнилъ при составленіи своего руководства. Его девизомъ были полнота и добросовћстность въ изложеніи фактовъ, и этому девизу онъ остался вћренъ.
Такъ какъ для этой школы формулы представляли лишь сокращенный способъ обозначенія состава тћлъ, то она считала себя въ правћ произвольно выбирать свои „эквиваленты”, или „вћсовыя количества смћсей”, изъ числа возможныхъ кратныхъ. Для этой {163} школы простота символизаціи составляла рћшающій факторъ; вслћдствіе этого ея числа не имћютъ существеннаго значенія для развитія науки. Я здћсь хочу лишь замћтить, что она для болыиинства соединеній приняла формулы Берцеліуса, считая эквивалентомъ двойной атомъ. Этого результата она достигла дћленіемъ надвое атомныхъ вћсовъ кислорода, сћры, углерода, селена и др. относительно водорода, хлора, брома, іода, азота, фосфора и металловъ2).
Впрочемъ, вы не должны думать, что въ началћ сороковыхъ годовъ уже больше не употреблялись атомные вћса Берцеліуса. Напротивъ, вы увидите, что Либихъ и его многочисленные и выдающіеся послћдователи еще пользовались ими3), и лишь къ концу десятилћтія (послћ появленія статьи Жерара) они стали также употреблять эквиваленты Гмелина. Въ одной изъ предыдущихъ лекцій я указалъ уже, какими причинами было вызвано это отпаденіе отъ атомистической теоріи4). Если я вамъ и говорилъ тогда, что ни одно изъ физическихъ правилъ, опредћлявшихъ отношенія между атомнымъ вћсомъ и нћкоторыми свойствами матеріи, казалось, не годилось для общаго примћненія, то, съ другой стороны, законъ, побудившій Дальтона создать атомистическую теорію, именно законъ кратныхъ отношеній, не подвергался еще нападкамъ. Многочисленныя органическія соединенія, изслћдованія которыхъ были уже закончены, могли лишь служить подтвержденіемъ этого закона. Конечно, пришлось признать, что въ соединеніе можетъ вступить значительно большее число атомовъ, чћмъ это считали возможнымъ Дальтонъ и Берцеліусъ, и вслћдствіе этого законъ, очевидно, нћсколько потерялъ въ своей строгости. Уже теперь можно было бы возбудить вопросъ, могло ли данное положеніе быть названо закономъ, разъ нельзя было утверждать ничего положительнаго о предћлахъ соединяемости атомовъ; и, наконецъ, вћдь всякое соединеніе можетъ быть сведено къ неизмћннымъ вћсамъ составныхъ частей, разъ допускается выборъ произвольно большого множителя. Впрочемъ, подобныя идеи въ то время, кажется, не были {164} распространены5), такъ что тћ, которые желали сохранить атомистическую теорію и пытались установить опредћленныя воззрћнія относительно строенія соединеній, еще чувствовали подъ собою почву. Къ числу ихъ принадлежалъ Дюма, пріобрћвшій благодаря обоснованію теоріи типовъ весьма большое вліяніе. Эта теорія, отчасти заимствованная, конечно, у Лорана, заключала въ себћ дћйствительно много полезнаго для классификаціи органическихъ соединеній; однако ея преимущества признаны всћми были лишь послћ ея сліянія съ теоріей радикаловъ, т.-е. послћ того какъ радикалы были введены въ типы. Но это могло произойти только послћ полнћйшаго видоизмћненія понятія радикала; теперь я ставлю себћ задачей изложить, чћмъ и кћмъ было вызвано развитіе этого понятія.
Если внимательно изслћдовать сочиненія основателей теоріи радикаловъ, то, пожалуй, можно было бы утверждать, что они, именно, не только установили понятіе о радикалћ въ его первоначальномъ смыслћ, но также способствовали въ значительнћйшей степени тому толкованію, которое это слово получило впослћдствіи. Такъ, напримћръ, достойны вниманія слћдующія слова Берцеліуса6).
„Представимъ себћ, что при помощи какихъ-либо средствъ мы могли бы увидћть относительное расположеніе простыхъ атомовъ въ сложномъ атомћ сћрнокислой соли окиси мћди. Очевидно, каково бы ни было это расположеніе, мы не могли бы тамъ вновь найти ни окиси мћди, ни сћрной кислоты, такъ какъ передъ нами находится одно цћльное тћло. Попарное соединеніе элементовъ въ атомћ соли мы можемъ представить себћ различнымъ образомъ, напримћръ, можно представить себћ, что 1 атомъ сћрнистой мћди соединенъ съ 4 атомами кислорода (окись сложнаго радикала); или что 1 атомъ двуокиси мћди соединенъ съ 1 атомомъ сћрнистой кислоты; или что 1 атомъ мћди соединенъ съ 1 атомомъ солеобразующей группы SO4; или, наконецъ, что 1 атомъ окиси мћди соединенъ съ 1 атомомъ сћрной кислоты. Каждое изъ этихъ предположеній равно допустимо, пока простые атомы связаны вмћстћ. Но дћло совершенно мћняется, если обратимся къ свойствамъ сложнаго атома, разлагаемаго электричествомъ или дћйствіемъ другихъ тћлъ, въ особенности же мокрымъ путемъ. Сложный атомъ никогда не можетъ быть разложенъ въ направленіи, указываемомъ {165} двумя первыми предположеніями, а лишь сообразно двумъ послћднимъ. Если происходитъ разложеніе комплекса Си + SO4, то мћдь можетъ быть замћнена другими металлами; но въ случаћ, если мћдь удаляютъ безъ замћщенія, какъ это бываетъ при дћйствіи электричества, то остатокъ атома соли распадается на кислородъ и сћрную кислоту. Наоборотъ, если мћдная соль разлагается очень слабой электрической силой или же другими окисями на окись мћди и сћрную кислоту, то эти обћ составныя части сохраняются и изъ нихъ можетъ быть вновь составлена соль. Естественно, что должна существовать причина такихъ свойствъ; она вћроятнће всего заключается въ томъ, что при соединеніи сћрной кислоты, и окиси мћди въ сложный атомъ соли относительное положеніе атомовъ въ бинарныхъ тћлахъ существенно не измћняется, такъ что эти атомы часто могутъ быть по желанію соединены или разъединены. Но изъ этого естественно слћдуетъ, что при разложеніи на другія бинарныя соединенія элементовъ атомы должны претерпћть перестановку въ своемъ относительномъ положеніи, вслћдствіе чего ихъ способность вновь соединяться бываетъ или ослаблена или же, какъ случается обыкновенно, совершенно прекращается. Азотнокислый амміакъ, разлагаемый на азотную кислоту, амміакъ и воду и изъ этихъ тћлъ вновь получающійся, можетъ быть разложенъ путемъ нагрћванія на закись азота и воду, но послћ этого уже не можетъ быть полученъ обратно изъ этихъ тћлъ. Причина этого явленія должна заключаться въ томъ, что при послћднемъ разложеніи атомы элементовъ получаютъ иную относительную группировку, что служитъ препятствіемъ къ ихъ обратному соединенію”.
Эти идеи совершенно ясны и вполнћ свободны отъ предвзятой мысли. To же самое можно сказать и относительно слћдующихъ мыслей Либиха7).
„Теорія представляетъ собою объясненіе положительныхъ фактовъ, которое не позволяетъ намъ съ аподиктической увћренностью дћлать выводы относительно строенія тћла на основаніи того, какъ тћло относится къ различнымъ способамъ разложенія, ибо продукты разложенія измћняются вћдь съ условіями разложенія.
„Всякое воззрћніе относительно строенія тћла правильно для опредћленныхъ случаевъ, для другихъ же оно неудовлетворительно и недостаточно”. {166}
Хотя я готовъ согласиться, что только-что изложенныя положенія обоихъ нашихъ великихъ учителей выражаютъ собой основанія новћйшей теоріи радикаловъ8), однако, было бы неправильно признать ихъ творцами теорій, о которыхъ сейчасъ будетъ рћчь. Всей своей дћятельностью въ области теоретической химіи они доказали, что для нихъ радикалъ является опредћленной неизмћняемой группой, и что они допускаютъ лишь одинъ взглядъ относительно строенія соединеній. Вспомнимъ многочисленные споры относительно пониманія алкоголя и его дериватовъ. Развћ эти споры были бы возможны, если бы идеи, въ родћ вышеупомянутыхъ, были для Берцеліуса. Либиха и Дюма дћйствительно руководящими и опредћляющими? До открытія явленій замћщенія это навћрное не имћло мћста. Мы уже видћли, какое дћйствіе эти факты оказали на взгляды Берцеліуса и Дюма на радикалъ. Намъ остается еще охарактеризовать отношеніе къ нимъ Либиха. Для насъ въ этомъ случаћ не должно имћть рћшающаго значенія его сужденіе о теоріи ядеръ Лорана. Открытіе трихлоруксусной кислоты оказало свое дћйствіе и на него; онъ не только допускаетъ возможность замћщенія водорода отрицательными элементами, но и вполнћ согласенъ съ объясненіемъ, которое Дюма давалъ этимъ фактамъ. Это видно изъ слћдующихъ словъ9).
„Въ неорганической химіи открытъ странный фактъ: марганецъ марганцовой кислоты можетъ быть замћщенъ хлоромъ, и при этомъ не измћняется форма соединенія, которое марганцовая кислота можетъ образовать съ основаніями. He можетъ быть большаго различія, чћмъ между марганцомъ и хлоромъ; но въ нћкоторыхъ случаяхъ они могутъ другъ друга замћщать безъ измћненія природы соединенія. Я не понимаю, почему подобныя же отношенія невозможны и для другихъ тћлъ, напримћръ, для хлора и водорода, и объясненіе явленій, предлагаемое Дюма, служитъ, по моему, ключемъ къ большей части явленій органической химіи”.
Правда, Дюма заходитъ, по мнћнію Либиха, слишкомъ далеко. Напримћръ, Либихъ не соглашается съ тћмъ, что углеродъ можетъ {167} быть замћщенъ. Въ своихъ „Анналахъ”10) онъ помћстилъ извћстное письмо г-на S. С. Н. Windler'a, который въ грубой формћ высмћиваетъ Дюма. Какъ бы тамъ ни было, но и послћ этихъ разъясненій можетъ, пожалуй, казаться, что взгляды Либиха существенно способствовали дальнћйшему развитію теоріи радикаловъ. Я съ этимъ не согласенъ, и подтвержденіе моего мнћнія нахожу въ статьћ великаго изслћдователя, касающейся эфирной теоріи и относящейся къ 1839 г.11). Въ ней Либихъ пытается разрћшить затрудненія въ вопросћ о строеніи эфира предположеніемъ о существованіи радикала ацетила. Но этимъ онъ доказываетъ, что для него радикалы все еще сохраняютъ свое старое значеніе; это подтверждается также и всћмъ характеромъ его „Руководства”12).
По моему мнћнію, работы Лорана и Жерара привели главнымъ образомъ къ тому, что радикалъ получилъ свое современное значеніе. Установивъ теорію ядеръ, Лоранъ этимъ самымъ подчеркнулъ фактъ измћняемости радикаловъ. Это впослћдствіи подтвердилъ также и Дюма13). Жераръ же впервые указалъ на возможность присутствія двухъ радикаловъ въ одномъ соединеніи, и тћмъ самымъ устранилъ всякую мысль о реальномъ существованіи обособленныхъ группъ. Этимъ періодомъ исторіи химіи мы и займемся теперь.
Нельзя не замћтить въ первыхъ статьяхъ Жерара, что онъ находится подъ вліяніемъ своего геніальнаго учителя Либиха. Мы знаемъ, что послћдній оспаривалъ присутствіе воды въ кислотахъ. {168} Жераръ, очень удачно развивая эту мысль, отрицаетъ предсуществованіе воды въ большинствћ органическихъ соединеній. Особенно же въ алкоголћ присутствіе ея кажется ему столь же невћроятнымъ, какъ присутствіе амміака въ азотистыхъ веществахъ, выдћляющихъ его при дћйствіи ћдкаго кали. Ему извћстенъ классъ тћлъ, которыя обладаютъ простымъ составомъ и исключительной устойчивостью, какъ вода, углекислота, соляная кислота и амміакъ; они образуются при разложеніи почти каждаго органическаго соединенія, но невозможно было обратно составить изъ нихъ разложенное вещество14).
To обстоятельство, что одно тћло образуется изъ другого, по Жерару, еще не даетъ основанія допускать, что первое находилось во второмъ уже въ готовомъ видћ. Вещества, которыя при извћстныхъ реакціяхъ выдћляютъ воду, не должны непремћнно ее содержать. Причина частаго появленія воды и другихъ подобныхъ соединеній кроется въ ихъ устойчивости и въ большомъ сродствћ между ихъ составными частями. Именно этотъ взглядъ и имћлъ существенное значеніе, такъ какъ онъ въ 1839 г. привелъ Жерара къ теоріи остатковъ и копулированныхъ соединеній15). Онъ говоритъ16); „Если два тћла взаимодћйствуютъ, то изъ одного тћла выдћляется одинъ элементъ (водородъ), соединяющійся съ однимъ элементомъ (кислородомъ) второго тћла, чтобы образовать прочное соединеніе (воду), при чемъ остатки соединяются между собой”. Такъ, напримћръ, по мнћнію Жерара, можно считать, что нитробензолъ17) Митчерлиха образовался изъ остатка бензола и остатка азотной кислоты. Углеводородъ отдаетъ водородъ, а азотная кислота—кислородъ. Можно такимъ образомъ разсматривать и сульфобензидъ18), который содержитъ остатокъ бензола C24H10 и остатокъ сћрной кисло ты SO219). Но этотъ остатокъ SO2 не идентиченъ съ сћрнистой кислотой, какъ она входитъ, напримћръ, въ сћрнистокислый свинецъ, но содержится въ разсматриваемомъ соединеніи въ совершенно особомъ видћ, именно въ формћ замћщенія (Substitutionsform).
Хотя это послћднее мнћніе очень своеобразно, оно въ высшей степени способствовало вытћсненію вћры въ предсуществованіе {169} радикаловъ. Остатки были чћмъ-то воображаемымъ и тћмъ болће далекимъ отъ дћйствительности, что ихъ считали отличными и отъ группъ одинаковаго состава, встрћчающихся въ свободномъ состояніи.
Приблизительно двумя годами позже Митчерлихъ20) высказываетъ подобныя же идеи, распространяя ихъ, впрочемъ, на значительно большій классъ тћлъ. По его мнћнію, соединенія не содержатъ вполнћ готовыхъ радикаловъ, играющихъ при разложеніи роль элементовъ. Причиною наблюдавшихся расщепленій онъ считаетъ образованіе воды, а не строеніе взятыхъ веществъ. Съ такой же точки зрћнія онъ объясняетъ образованіе продуктовъ при дћйствіи кислотъ на основанія или алкоголи (соли и эфиры) и указываетъ, что образующіеся продукты при поглощеніи воды вновь распадаются на свои составныя части.
Идея остатковъ была весьма пригодна для выясненія явленій замћщенія, которыя, по Жерару, подчинялись слћдующему правилу21). „Выдћляющійся элементъ замћщается либо эквиватентомъ другого элемента либо же остаткомъ реагирующаго тћла”. Примћнимость этого правила была, впрочемъ, ограничена, такъ какъ, кромћ замћщенія, Жераръ знаетъ еще присоединенія (Additionen) и притомъ двоякаго рода. Во-первыхъ, такія, при которыхъ способность насыщенія измћняется; къ этому случаю онъ причисляетъ образованіе солей. Затћмъ идутъ такія присоединенія, при которыхъ это измћненіе не происходитъ. На нихъ онъ обращаетъ особенное вниманіе, и называетъ ихъ копулированными (парными) соединеніями (corps copules). Къ этому классу принадлежатъ преимущественно вещества, образующіяся при дћйствіи сћрной киелоты на органическія соединенія, напримћръ, открытая Митчерлихомъ сульфобензоловая кислота и ея соли22). Она образуется, какъ извћстно, при дћйствіи сћрной кислоты на сульфобензидъ. По Жерару, эти оба тћла соединяются между собою, при чемъ сохраняется способность насыщенія сћрной кислоты, считавшейся въ то время еще одноосновной:
C24H10(SO2) |
+ |
SO3H2O |
= |
C24H10(SO2)· SO3· H2O |
сульфобензидъ |
сћрная кисл. |
сульфобензоловая кисл. |
Сћрновинная кислота (этилсћрная) считается составленной изъ сћрнокислаго этила и сћрной кислоты, и ей приписывается формула {170} C8H10(SO2)O2.SO3.H2O; сульфобензойная же кислота, основность которой должна быть равна суммћ основностей ея составныхъ частей, и при образованіи которой емкость (способность) насыщенія также осталась неизмћнной, причисляется къ сопряженнымъ кислотамъ, т.-е. къ классу тћлъ, впервые выдћленныхъ Дюма23). Можно также представить себћ, что эта кислота образовалась путемъ копулированія замћщенной бензойной кислоты C28H10(SO2)O4 съ сћрной.
Однако, изложенный взглядъ на копулированныя тћла былъ вскорћ оставленъ Жераромъ. Онъ удержалъ впослћдствіи наименованіе, но измћнилъ смыслъ. Я намћренно изложилъ сперва прежній взглядъ, такъ какъ тотъ же терминъ употреблялся также Берцеліусомъ и Кольбе, но они, съ своей стороны, понимали его въ другомъ значеніи. Мнћ казалось интереснымъ прослћдить историческое происхожденіе именно этого выраженія, употребляемаго столь часто и въ такихъ различныхъ смыслахъ.
Въ 1843 г. Жераръ причислялъ къ парнымъ соединеніямъ всћ тћ соединенія, которыя образуются при дћйствіи кислотъ на спирты, углеводороды и др., и при образованіи которыхъ тћла соединяются, выдћляя воду24). Сообразно съ этимъ, парныя соединенія уже не были продуктами присоединенія (Anlagerungen), они не представляютъ также соединенія двухъ тћлъ, а образуются отъ соединенія двухъ остатковъ, и, слћдовательно, являются продуктами замћщенія, чего однако Жераръ не признаетъ. Они для него все еще представляли особую группу, и не могли сравниваться съ первоначальными веществами главнымъ образомъ потому, что ихъ способность насыщенія была отлична отъ способности насыщенія послћднихъ. Но и въ этомъ вопросћ Жераръ теперь измћнилъ свое мнћніе: „Основность парныхъ соединеній равна суммћ основностей копулированныхъ тћлъ минусъ единица”. Изъ этого положенія, считавшагося аксіомой, выводится двухосновность сћрной кислоты, которая при парномъ сочетаніи съ нейтральными тћлами, какъ спирты и углеводороды, порождаетъ одноосновныя кислоты, тогда какъ кислоты уксусная, азотная, соляная и др. не обладаютъ этимъ свойствомъ, почему Жераръ считаетъ ихъ одноосновными.
Въ 1845 г. Жераръ пытается доказать всеобщность вышеупомянутаго закона основности25). Теперь онъ называетъ парными {171} всћ тћла, которыя образуются отъ соединенія двухъ веществъ. съ выдћленіемъ воды, но при поглощеніи послћдней снова распадается на эти составныя части; онъ причисляетъ, слћдовательно, къ этому классу нейтральные эфиры, эфирныя кислоты и т. д., и выражаетъ этотъ законъ формулой
В = (b + b') – 1,
гдћ В означаетъ основность парнаго соединенія, а b и b' основности участвующихъ въ образованіи его тћлъ. Жераръ при этомъ опредћленно говоритъ, что приведенное уравненіе дћйствительно лишь при парномъ сочетаніи эквивалента одного тћла съ эквивалентомъ другого26), но при соединеніи двухъ эквивалентовъ одного тћла съ однимъ эквивалентомъ другого уравненіе должно быть примћнено два раза для нахожденія основности образующагося продукта. Такъ, напримћръ, сћрная кислота, которая, по Жерару теперь двухосновна, съ нейтральными веществами можетъ образовать кислоты и нейтральныя тћла. Къ послћднимъ принадлежитъ сћрный эфиръ. Онъ образуется изъ двухъ эквивалентовъ алкоголя и одного эквивалента сћрной кислоты. Его основность выводится изъ слћдующихъ уравненій, въ которыхъ В1 обозначаетъ основность этилсћрной кислоты:
В1 = (2 + 0) – 1 = 1
В = (1 + 0) – 1 = 0.
Штрекеръ въ 1848 г. пытался дать этимъ правиламъ болће общую форму; онъ говоритъ27): „Основность парнаго соединенія равна суммћ основностей составныхъ частей минусъ половина числа выдћлившихся эквивалентовъ воды28), или также основность должна быть уменьшена на единицу при выдћленіи каждыхъ двухъ атомовъ водорода”. Впрочемъ, и при этой формулировкћ долженъ былъ всегда получаться тотъ же результатъ, какого требовало и правило Жерара; ее можно считать лишь упрощеніемъ, но не обобщеніемъ, такъ какъ здћсь однократное примћненіе достаточно для всћхъ случаевъ. {172}
Если впослћдствіи и было указано, что даже въ этой формћ законъ основности не всегда ведетъ къ правильнымъ выводамъ29), и если еще позже было также признано неправильнымъ то исключительное положеніе, въ которое были поставлены нћкоторые классы тћлъ благодаря идећ парныхъ соединеній30), то все же нельзя отрицать, что эта идея копуляціи (Copula) сыграла нћкоторую роль въ исторіи развитія химіи: она дала новые критеріи для распознаванія многоосновныхъ кислотъ, что было очень важно въ то время, когда еще имћлось мало другихъ критеріевъ.
Большое значеніе для прогресса науки имћла мысль, лежащая въ основћ теоріи парныхъ соединеній, а именно, что соединенія въ болыиинствћ случаевъ могутъ быть разсматриваемы, какъ состоящія изъ остатковъ другихъ тћлъ. Это имћло значеніе потому, что такая мысль противорћчила идећ неподвижности и неизмћнности радикаловъ. Какъ плодотворны были эти идеи, указываетъ, напримћръ, открытіе анилидовъ и анилидныхъ кислотъ.
По Жерару амиды должны считаться соединеніями остатковъ амміака и кислотъ; такъ, оксамидъ долженъ, по его мнћнію, образоваться по уравненію31):
C2H2O4 + 2NH3 = C2H2O2. (NH)2 + 2Н2О (C = 12, О = 16),
т.-е. замћщеніемъ двухъ атомовъ кислорода дважды взятымъ остаткомъ имидомъ (NH). Жераръ считаетъ возможнымъ подобную же замћну остаткомъ анилина, природа котораго была установлена обширными трудами Гофманна32), и старается подтвердить это опытомъ, при чемъ онъ получаетъ оксанилидъ, образованіе котораго можетъ быть представлено слћдующимъ уравненіемъ:
C2H2O4 + 2C6H7N = C2H2O2(C6H5N)2 + 2Н2О.
Жераръ проводитъ аналогію между амміакомъ и анилиномъ еще далыие, благодаря открытію анилидныхъ кислотъ, которыя онъ считаетъ аналогичными амидокислотамъ33). Формулу сульфанилидовой кислоты, полученной имъ при дћйствіи сћрной кислоты на оксанилидъ, {173} онъ пишетъ: SH2O3.C6H5N и существованіе ея онъ считаетъ новымъ доказательствомъ двухосновности сћрной кислоты.
Можетъ показаться страннымъ, что Жераръ вводитъ въ эти соединенія остатки NH и C6H6N, вмћсто NH2 и C6H6N. Въ этомъ, быть можетъ, сказывается вліяніе Лорана, пытавшагося уже за нћсколько лћтъ передъ тћмъ замћнить амидъ имидомъ34). Жераръ могъ раздћлять это мнћніе, не опасаясь дальнћйшихъ послћдствій: вћдь его формулы не должны были обозначать положенія атомовъ, а лишь выражать сокращенныя уравненія; онћ должны были изображать, не каковы теперь соединенія, а чћмъ они были или чћмъ будутъ35); онћ лишь должны были наглядно представлять способъ образованія или разложенія тћлъ. Онъ впервые высказалъ мнћніе, что по продуктамъ разложенія нельзя судить о расположеніи атомовъ, такъ какъ при реакціи атомы приходятъ въ движеніе36). Поэтому онъ допускалъ возможность существованія нћсколькихъ формулъ для одного и того же тћла. Въ соединеніи возможно предполагать различные остатки (радикалы), смотря по тому, какое желали вызвать разложеніе. Этимъ былъ смягченъ столь ожесточенный и продолжительный споръ о природћ радикаловъ. Впослћдствіи Жераръ началъ употреблять эмпирическія формулы, которыя были предложены Либихомъ вслћдствіе все болће усиливавшагося разногласія о раціональномъ строеніи37). Въ 1851 г. Либихъ совмћстно съ Шанселемъ ввелъ синоптическія формулы38), которыя, однако, не получили распространенія, такъ какъ онћ были неудобны и мало понятны. Если форма была нова, то идея осталась старая. Новый способъ обозначенія также долженъ былъ наглядно представлять только образованіе и разложеніе веществъ: это были сокращенныя уравненія. Большое преимущество новаго способа заключалось въ возможности установить для одного и того же тћла нћсколько раціональныхъ формулъ; благодаря этому выяснялись новыя аналогіи и новыя различія, что давало поводъ къ многочисленнымъ изслћдованіямъ39). {174}
Быть можетъ, еще большее значеніе имћли труды Жерара по другому вопросу, именно въ установленіи атомныхъ и молекулярныхъ вћсовъ. Если иниціатива пересмотра этихъ столь важныхъ чиселъ исходила отъ него одного, то при дальнћйшей разработкћ этого вопроса онъ находился подъ вліяніемъ Лорана, съ которымъ онъ въ то время находился въ весьма близкомъ общеніи. Можно даже сказать, что Лоранъ первый ясно40) высказалъ то, чего желалъ Жераръ. Впрочемъ, въ высшей степени трудно установить заслуги каждаго изъ нихъ въ отдћльности, такъ какъ многое они печатали сообща, и, по всей вћроятности, все обсуждали вмћстћ; поэтому я прошу не понимать моихъ указаній въ этомъ отношеніи буквально.
Первая статья Жерара по разсматриваемому вопросу относится къ 1842 г.41). Въ ней онъ неоднократно употреблялъ выраженіе эквивалентъ въ томъ смыслћ, съ которымъ мы теперь не можемъ согласиться, а именно въ смыслћ, Волластона и Гмелина. Для Жерара эквивалентъ это терминъ, значеніе котораго онъ ищетъ не въ его происхожденіи, ибо въ противномъ случаћ онъ не могъ бы назвать эквивалентными H2SO4 и НСl, разъ онъ доказывалъ, что сћрная кислота двухосновна и, слћдовательно, не эквивалентна съ соляной кислотой. Жераръ желаетъ опредћлить величины атомовъ и молекулъ; но онъ пока не различаетъ ихъ и обозначаетъ словомъ „эквивалентъ”, тогда какъ числа, имъ критикуемыя, онъ называетъ „атомными вћсами”.
Эквиваленты Жерара это — не равнозначныя, а лишь сравнимыя количества, при чемъ принимаются въ соображеніе самыя разнообразныя точки зрћнія, могущія имћть значеніе для опредћленія величинъ атомовъ, молекулъ и эквивалентовъ.
Конечно, каждому безпристрастному химику покажется удивительнымъ и страннымъ то обстоятельство, что числа, предложенныя Жераромъ для „эквивалентовъ” простыхъ тћлъ, за исключеніемъ металловъ, почти совершенно совпадаютъ съ атомными вћсами, опредћленными Берцеліусомъ въ 1826 г. Замћчательно также и то, что Жераръ не упоминаетъ о Берцеліусћ, и, очевидно, даже совсћмъ не знаетъ, что въ большинствћ случаевъ повторяетъ числа послћдняго. Шведскій {175} изслћдователь, очевидно, также не замћчалъ этого совпаденія, такъ какъ онъ ожесточенно напалъ на статью Жерара42). Но замћчательнће всего то, что въ то время, когда Жераръ предлагалъ свои числа, очень извћстные химики (я назову лишь Либиха и его учениковъ43) употребляли для важнћйшихъ элементовъ, напримћръ, для углерода, кислорода, водорода, хлора и др., именно т о отношеніе атомныхъ вћсовъ, которое Жераръ рекомендовалъ, какъ нћчто новое, а спустя немного лћтъ эквиваленты Гмелина, противъ которыхъ была направлена упомянутая статья, сдћлались почти общепринятыми.
Впрочемъ, цћнная сторона статьи Жерара заключалась несравненно менће въ предложенныхъ имъ „эквивалентахъ” элементовъ, чћмъ въ его взглядахъ на „эквиваленты” соединеній. Изслћдовавъ при помощи уравненій реакціи разложенія органическихъ веществъ, онъ пришелъ къ заключенію, что получающіяся при разложеніи количества угольной кислоты воды и амміака выражаются цћлыми кратными отъ C2O4, Н2O2 и NH344). Поэтому, по его мнћнію, эти количества должны выражать равное число эквивалентовъ, между тћмъ въ то время полагали, что эквиваленты углекислоты и воды вдвое меньше этихъ количествъ.
Подобными же разсужденіями онъ точно устанавливаетъ, что эквиваленты окиси кислорода и сћрнистой кислоты равны C2O2 и S2O4, при чемъ въ качествћ существеннаго довода въ пользу своихъ предположеній Жераръ прибавляетъ, что именно эти количества въ газообразномъ состояніи занимаютъ равные объемы. Такимъ образомъ онъ получаетъ возможность утверждать, что эквиваленты углерода, кислорода и сћры равны не 6, 8 и 16, какъ считала школа Гмелина, а вдвое больше, т.-е. равны 12, 16 и 32. Многочисленными примћрами Жераръ доказываетъ, что ни одна эквивалентная формула, составленная по его принципамъ, не содержитъ меньшихъ количествъ вышеупомянутыхъ элементовъ, чћмъ онъ указывалъ, и что въ соединеніяхъ всегда встрћчается четное число атомовъ углерода, кислорода и сћры, если эти атомы выражены въ эквивалентахъ Гмелина. {176}
Жераръ вслћдствіе этого удваиваетъ эквиваленты углерода, кислорода, сћры и др. по отношенію къ эквивалентамъ водорода, хлора, азота и т. п., и такимъ образомъ получаетъ числа Берцеліуса. Отъ приверженцевъ шведскаго химика онъ существенно отступаетъ въ формулахъ, предлагаемыхъ имъ для органическихъ соединеній. По его мнћнію, формулы этихъ соединеній были увеличены вдвое сравнительно со многими неорганическими соединеніями, почему онъ ихъ уменьшаетъ въ два раза; онъ говоритъ, что органическія соединенія отнссены къ H = 2 или О = 200, тогда какъ въ большинствћ неорганическихъ соединеній для сравненія взято H = 1 или O = 100, и тћла вслћдствіе этого распались на два класса: одни занимаютъ 2 объема (Н = 1 = 1 объемъ), какъ вода, окись углерода, угольная кислота и т. д., другія же, какъ алкоголь, этиленъ, хлорэтилъ и т. п., т.-е. всћ тћла, въ то время называвшіяся органическими (плотности ихъ паровъ не всегда, конечно, были извћстны) соотвћтствуютъ двойному объему.
Вы позволите мнћ на этомъ прервать изложеніе взглядовъ Жерара, чтобы оглянуться назадъ и найти причины, заставившія химиковъ принять именно для органическихъ веществъ четырехобъемныя формулы, что должно показаться тћмъ болће страннымъ, что Берцеліусъ и Дюма предполагали, по крайней мћрћ вначалћ, что атомные вћса соединеній необходимо опредћлить такъ, чтобы въ парообразномъ состояніи они представляли равные объемы.
Въ тћ времена плотность паровъ была извћстна лишь для относительно ограниченнаго числа соединеній, и потому во многихъ случаяхъ изслћдователи незамћтно для себя погрћшали противъ этого правила. Другой очень существенной причиной служила общераспространенная гипотеза, что кислота есть тћло, которое въ соляхъ соединено съ основаніемъ; или, другими словами, ангидриды, большей частью гипотетическіе (вмћсто гидратовъ), считались кислотами. Такъ, если принять атомные вћса Берцеліуса, анализъ уксуснокислаго калія давалъ наиболће простую формулу К. C4Н6O4, откуда за вычетомъ кали (КО) оставался атомъ уксусной кислоты C4Н6O3, неспособный къ дальнћйшему дћленію. Для тћхъ, кто считалъ идентичными атомъ и эквивалентъ, правильность формулы подтверждалась тћмъ обстоятельствомъ, что указанное количество уксусной кислоты нейтрализуется 1 эквивалентомъ кали КО (К — 78); такимъ образомъ пришлось по необходимости удвоить формулы всћхъ {177} одноосновныхъ кислотъ. Установленіе теоріи многоосновныхъ кислоть побудило Либиха удвоить формулы многихъ двухосновныхъ кислотъ, напримћръ, винной кислоты (ср. стр. 148) Это отразилось на атомныхъ величинахъ нейтральныхъ тћлъ, какъ алкоголь, сложные эфиры и др.: первому приписывали сперва формулу С2H60, соотвћтствующую 2 объемамъ, и, чтобы получить этотъ результатъ, Берцеліусъ предположилъ въ алкоголћ иной радикалъ, чћмъ въ эфирћ45). Либихъ же, для котораго алкоголь былъ гидратомъ эфира, положилъ въ основаніе обоихъ соединеній группу этилъ C4H1046), и только теперь обнаружилась тћсная химическая связь между алкоголемъ и уксусной кислотой. Послћ этого начали уже этиленъ обозначать формулой C4H8, а хлоръ-этилъ формулой C4H10Сl2, т.-е. всћ соединенія ряда этила содержали 4 атома углерода. На основаніи подобныхъ же соображеній были удвоены и остальныя формулы.
Жераръ, какъ мы сказали, хотћлъ ихъ уменьшить вдвое. Помимо объемныхъ отношеній его побуждали къ этому еще и другія соображенія. Именно, по его мнћнію, металлическія окиси, образующія соли, состоятъ не изъ одного атома металла и одного атома кислорода, какъ предполагалъ Берцеліусъ, а подобно водћ, обозначаемой имъ теперь черезъ Н2O, содержатъ 2 атома металла47); въ гидратахъ же окисей 1 атомъ металла и 1 атомъ водорода соединены съ 1 атомомъ кислорода48). Онъ вынужденъ поэтому уменьшить въ два раза атомные вћса металловъ, и полагаетъ K =39, Na =23, Са = 20 и т. д. Онъ называетъ эквивалентомъ то количество одноосновной кислоты, изъ котораго, послћ замћщенія одной части водорода 39 частями калія, получается нейтральная соль; эквиваленты же двухосновныхъ кислотъ по его мнћнію въ два раза больше49). Такимъ образомъ формула уксусной кислоты будетъ C2H4O2, тогда какъ формулой щавелевой кислоты остается C2H2O2.
Несмотря на эти превосходныя и продуманныя замћчанія, которыя теперь большей частью раздћляются всћми, Жераръ не стоялъ на нашей современной точкћ зрћнія. Это видно изъ одного мћста его статьи50), гдћ онъ считаетъ нужнымъ указать, что слћдствіемъ его предложенія является совпаденіе теорій объемной, атомистической и эквивалентовъ; но, согласно нашимъ взглядамъ, это {178} совпаденіќ недостижимо. Въ 1846 г. Лоранъ впервые разъединилъ эти столь различныя понятія51) и такимъ образомъ сдћлалъ пріемлемыми числа Жерара. Онъ же указалъ, что тћ величины отнюдь не эквивалетны, и потому не заслуживали этого названія, и что числа Жерара выражаютъ лишь количества, вступающія въ реакцію и поэтому представляютъ собою молекулярные вћса.
Хотя и Жераръ при своихъ опредћленіяхъ эквивалентовъ стремился пользоваться лишь сравнимыми величинами, но принципіальную необходимость этого выяснилъ лишь Лоранъ. По его мнћнію, всегда необходимо исходить изъ извћстнаго „terme de comparaison”, и относить къ нему формулы всћхъ соединеній. Для Лорана было ясно, что количества веществъ, содержащихся въ равныхъ объемахъ, производятъ не всегда одно и то же химическое дћйствіе. Поэтому онъ и ставитъ вопросъ: слћдуетъ ли сравнивать газообразныя тћла по занимаемому ими объему или же по ихъ эквивалентамъ? Отъ послћдняго способа онъ отказывается вслћдствіе трудности опредћленія эквивалентовъ для веществъ неаналогичныхъ, и останавливается на первомъ. Лоранъ выбираетъ формулы тћлъ съ такимъ расчетомъ, чтобы въ газообразномъ состояніи молекулы занимали 2 объема (Н =1 = 1 объемъ). Конечно, при этомъ онъ долженъ допустить нћкоторыя исключенія, на которыя и обращаетъ вниманіе. Такъ, напримћръ, было извћстно, благодаря Бино52), что формулы NH4Cl нашатыря и H2SO4 сћрной кислоты53) соотвћтствуютъ четыремъ объемамъ, но Лоранъ, несмотря на это, считаетъ, что количества, выражаемыя этими формулами, соотвћтствуютъ ихъ молекулярнымъ вћсамъ. Въ данномъ случаћ имћлись извћстныя основанія, которыя, повидимому, совершенно неизбћжно требовали этихъ допущеній. Изоморфизмъ нашатыря съ хлористымъ каліемъ исключалъ формулу N1/2H2Сl1/2, (послћдняя, впрочемъ, была допустима лишь при уменыиеніи въ два раза атомныхъ вћсовъ N и Cl), a двухосновность сћрной кислоты, считавшаяся Лораномъ доказанной, требовала такой величины атомнаго ея вћса, которая противорћчила гипотезћ Авогадро. Хотя эта гипотеза и служила главнымъ критеріемъ при установленіи формулъ, но полученные результаты контролировались химическими реакціями и изслћдованіемъ физическихъ свойствъ, напримћръ, опредћленіемъ {179} теплоемкости, удћльныхъ объемовъ, кристаллической формы и др. Далће при этихъ опредћленіяхъ важную роль игралъ также законъ четныхъ атомныхъ чиселъ, уже въ 1843 г. указанныхъ для нћкоторыхъ отдћльныхъ случаевъ Жераромъ54). Теперь и Лоранъ высказывается въ его пользу. Онъ говорить, что во всћхъ соединеніяхъ сумма атомовъ водорода, хлора, брома, азота и т. д. всегда должна выражаться четнымъ числомъ. Законъ этотъ пріобрћлъ особое значеніе еще и потому, что Лоранъ пользовался имъ для доказательства предположенія, что молекулы этихъ элементовъ, названныхъ имъ діадидами (dyadides)55), состоятъ изъ двухъ атомовъ.
Идеи Жерара были въ значительной степени освћщены Лораномъ, который сдћлалъ ихъ болће доступными и понятными, потому что онъ строже относился къ употребляемымъ имъ словамъ, давая имъ точныя опредћленія. Въ этомъ именно и заключается значительный успћхъ, такъ какъ теперь дћйствительно было произведено то разграниченіе понятій атома, молекулы, и эквивалента, благодаря которому гипотеза Авогадро, 35 лћтъ спустя послћ своего возникновенія, снова могла быть сдћлана основаніемъ цћлой системы. По Лорану молекула есть минимальное количество вещества, необходимое для образованія соединенія, и въ газообразномъ состояніи она всегда (или за немногими исключеніями) занимаетъ объемъ, соотвћтствующій удвоенному объему атома водорода. Атомъ же есть мельчайшее количество элемента, какое встрћчается въ сложныхъ тћлахъ; наконецъ, эквиваленты это—равнозначныя количества аналогичныхъ веществъ55).
Я попытаюсь наглядно представить значеніе этихъ опредћленій для химіи, и съ этой цћлью сообщу о нћкоторыхъ слћдствіяхъ, выведенныхъ изъ нихъ на основаніи изслћдованій того времени.
Стремленіе послћдовательно провести понятіе эквивалента заставило Лорана и Жерара57) принять для нћкоторыхъ металловъ существованіе нћсколькихъ эквивалентовъ. „Въ основћ понятія эквивалентъ лежитъ идея однородной функціи. Извћстно, что одинъ и тотъ же элементъ можетъ играть роль двухъ или нћсколькихъ {180} другихъ элементовъ; поэтому должны наблюдаться такіе случаи, когда этимъ различнымъ функціямъ соотвћтствуютъ и различные вћса. Съ другой стороны, извћстно также, что различные вћса одного и того же металла, какъ, напримћръ, желћза, мћди, ртути и др., могутъ замћщать водородъ въ кислотахъ и образовать при этомъ соли, содержащія тотъ же металлъ, но обладающія различными свойствами. Эти металлы, слћдовательно, имћютъ различные эквиваленты.”
Эта идея не была нова58), но такъ какъ никогда не употребляли дћйствительныхъ эквивалентныхъ формулъ, то она раньше оставалась безъ примћненія. Теперь же, когда Лоранъ и Жераръ ввели свой способъ обозначенія, эта идея уже пріобрћла извћстное значеніе. Такъ, напримћръ, эти реформаторы химіи старались отыскать скрытыя до тћхъ поръ аналогіи. Формулы полуторныхъ окисей могутъ считаться аналогичными формуламъ нормальныхъ основаній, и вслћдствіе этого въ пониманіе солей вводится единообразіе, которое до тћхъ поръ не могло быть достигнуто. Извћстно, что нейтральная сћрнокислая соль закиси желћза содержитъ 3/2 того количества желћза, которое приходится на то же количество сћры въ нейтральной соли окиси; другими словами, 28 частей желћза въ соли закиси замћщаютъ 1 часть водорода, но въ соли окиси то же количество водорода замћщается 182/3 частями желћза; оба эти количества, слћдовательно, эквивалентны 1 части водорода. Если обозначить по Лорану и Жерару словомъ ferrosum (Fe = 28) эквивалентъ желћза въ соляхъ закиси и ferricum (fe = 2/3 . 28) эквивалентъ его въ соляхъ окиси, то формулы сћрнокислой соли, закиси желћза (Fe2)SO4 и сћрнокислой соли окиси желћза (fe2) SO4 становятся сравнимыми. To же самое относится и къ другимъ металламъ, какъ, напримћръ, мћдь, ртуть, олово и пр. Для солей ихъ закисей и окисей необходимо принять различные эквиваленты: закисямъ соотвћтствують эквиваленты съ вдвое большимъ вћсомъ, чћмъ окисямъ59).
Полная аналогія въ обозначеніи солей достигается, если употреблять эквивалентныя формулы также и для кислотъ. Тогда, напримћръ, будетъ
Сћрнокислая соль желћза |
хлористая мћдь |
хлористая ртуть. |
SO4(Fe2) |
Cl2(Cu2) |
Cl2(hg2) |
| {181} |
При такомъ способћ символизаціи исчезаютъ различія между одноосновными и многоосновными кислотами; большое преимущество молекулярныхъ формулъ и заключается въ томъ, что онћ выдвинули эти столь важныя особенности. Значеніе ихъ вполнћ вћрно оцћнили Лоранъ и Жераръ, въ особенности послћдній, который весьма удачно пытался ввести при помощи новыхъ критеріевъ болће опредћленное разграниченіе этихъ группъ тћлъ60).
Жерару казалось, что образованія двойныхъ солей съ неизоморфными основаніями еще недостаточно для точнаго опредћленія основности кислоты. Онъ указалъ на то обстоятельство, что двухосновныя (и многоосновныя) кислоты могутъ образовать два (или болће) эфира, изъ которыхъ одинъ (или нћсколько) будутъ кислыми, a а одинъ нейтральнымъ. Молекула послћдняго, если ее считать соотвћтствующей двумъ объемамъ, содержитъ у одноосновныхъ кислотъ одинъ остатокъ алкоголя, у двухосновныхъ (или многоосновныхъ) этотъ остатокъ содержится два раза (или болће). Далће, другія точки опоры Жераръ нашелъ въ амидныхъ и въ незадолго передъ тћмъ открытыхъ анилидныхъ соединеніяхъ61). Именно въ то время, какъ одноосновныя кислоты образуютъ лишь одинъ амидъ, одинъ нитрилъ и одинъ анилидъ, кислыя амміачныя соли двухосновныхъ кислотъ могутъ образовать при потерћ воды одну амидную кислоту и одинъ имидъ, и лишь онћ однћ могутъ производить анилидныя кислоты.
Нћсколькими годами ранће Лоранъ указалъ на другое различіе этихъ тћлъ62). По его мнћнію, только формула двухосновныхъ и многоосновныхъ кислотъ позволяетъ предполагать въ нихъ присутствіе воды, тогда какъ въ молекулћ одноосновной кислоты могутъ находиться составныя части лишь половины молекулы воды. Поэтому no Лорану одноосновныя кислоты не могутъ образовать ангидридовъ.
Такъ, азотная кислота HNO3 = (HO)1/2 + (NO2)1/2
а сћрная кислота H2SO4 = H2O + SO3.
Извћстный уже въ то время ангидридь хлорноватистой кислоты, по Лорану, имћлъ формулу СІНО, гдћ 1 атомъ водорода замћщенъ 1 атомомъ хлора63). {182}
Очень важны были, далће, мнћнія Лорана о молекулахъ элементовъ. Изъ гипотезы Авогадро, всецћло признанной64) Лораномъ, вытекало, что молекулы простыхъ тћлъ должны считаться состоящими, по меньшей мћрћ, изъ двухъ атомовъ. Лоранъ старается подкрћпить это мнћніе доказательствами химическаго характера. По его мнћнію, такъ называемые „dyadides”, напримћръ, водородъ, хлоръ, бромъ, іодъ, азотъ, фосфоръ, мышьякъ, сурьма встрћчаются всегда лишь въ четномъ количествћ атомовъ. Уже одно это правило, если оно примћнимо къ молекуламъ элементовъ, дћлаетъ невозможнымъ существованіе отдћльныхъ атомовъ въ свободномъ состояніи. Кромћ того, Лоранъ напоминаетъ извћстныя уже дћйствія реакцій in statu nascendi и объясняетъ ихъ предположеніемъ, что въ моментъ выдћленія элементовъ изъ соединеній отдћльные атомы находятся еще въ изолированномъ состояніи, вслћдствіе чего соединеніе ихъ съ другими атомами происходитъ значительно легче, чћмъ въ томъ случаћ, когда мы имћемъ дћло съ молекулами или группами атомовъ, которыя могутъ вступить въ реакціи лишь послћ того, какъ онћ будутъ разложены.
Вначалћ рћшительныя реформы Лорана и Жерара почти не встрћтили сочувствія. Наоборотъ, понятіе объ эквивалентћ въ его первоначальной и не вполнћ опредћленной формћ, повидимому, пріобрћло теперь больше приверженцевъ, чћмъ прежде. Объемный законъ Гэ-Люссака казался химикамъ меньше чћмъ когда-либо пригоднымъ, чтобы служить основаніемъ какой-нибудь системы, и по этому, вообще, никто не обнаруживалъ ни малћйшей склонности признавать вмћстћ съ Лораномъ дћлимость молекулы элементовъ. Правда, недоставало еще убћдительныхъ доказательствъ, въ особенности химическаго характера. Несомнћнно, что Лораномъ и Жераромъ руководила весьма счастливая идея, когда они высказали, что формулы соединеній должны выражать сравнимыя количества; но для такого сравненія имъ недоставало еще масштаба. Плотность газовъ была извћстна лишь въ относительно немногихъ случаяхъ, и даже между этими немногими случаями были такіе, когда молекулярныя величины, выведенныя изъ плотности газовъ, оказывались {183} непригодными, такъ какъ находились въ противорћчіи (по крайней мћрћ, такъ казалось) съ химическими свойствами соединеній. Недоставало еще ряда фактовъ, которые могли бы подтвердить правильность этихъ идей и завоевать имъ всеобщее признаніе. Открытіемъ этихъ недостававшихъ фактовъ мы обязаны Вильямсону, который разработалъ химическій способъ опредћленія молекулярнаго вћса и этимъ оказалъ нашей наукћ не вполнћ еще оцћненную услугу. Если самъ онъ и не произвелъ реформы химіи, то именно е г о изслћдованія впервые сдћлали ее необходимой и возможной.
| {184} |
Доводы въ пользу дћлимости элементарныхъ молекулъ.— Вильямсонъ опредћляетъ молекулярныя величины при помощи химическихъ реакцій. — Теорія образованія эфировъ.— Сліяніе теоріи радикаловъ и типовъ Дюма. — Замћщенныя амміачныя соединенія. — Многоатомные радикалы. — Теорія типовъ и классификація Жерара.
Представители нашей науки часто утверждаютъ, что она должна развиваться лишь своими собственными силами, и что вліяніе на химію другихъ дисциплинъ вредно, если оно направляетъ ее не въ ту сторону, въ которую, повидимому, должны вести чисто химическіе факты. Я вполнћ, конечно, понимаю, что для достиженія бóльшаго согласованія съ физическими законами нельзя для химіи избирать теоріи, противорћчащей извћстнымъ фактамъ; въ особенности это понятно съ дидактической точки зрћнія. Но я считаю вполнћ правильнымъ и необходимымъ, чтобы наши взгляды для достиженія большей гармоніи, какъ съ установленными законами природы, такъ и съ теоріями и гипотезами, подвергались видоизмћненію, насколько это позволяетъ состояніе нашей науки. Поэтому я нахожу цћлесообразнымъ привести нћкоторыя основанія, и притомъ не исключительно химическаго характера, которыя говорятъ въ пользу системы Лорана и Жерара, и я сдћлаю это теперь, когда мы уже непосредственно подошли къ моменту коренной реформы въ исторіи развитія науки. При этомъ я ограничусь фактами, которые, повидимому, вызывали необходимость допущенія дћлимости молекулы элементовъ. Хотя эта гипотеза и высказывалась неоднократно, она все еще не встрћчала признанія. {185}
Среди несомнћнно очень цћнныхъ для химіи результатовъ, которые были изложены въ 1846 г. Фавромъ и Зильберманномъ въ ихъ работћ о теплотћ горћнія1), находится одинъ очень своеобразный фактъ, заслуживающій здћсь упоминанія. При сжиганіи угля въ кислородћ образуется меньшее количество теплоты, чћмъ при сжиганіи въ закиси азота. Фавръ и Зильберманнъ считали возможнымъ объяснить этотъ весьма поразительный фактъ предположеніемъ, что въ обоихъ случаяхъ одновременно съ образованіемъ угольной кислоты происходитъ разложеніе, т.-е. разъединеніе прежде связанныхъ атомовъ. Но согласно этому надо допустить, что частицы кислорода также и въ свободномъ состояніи состоятъ изъ нћсколькихъ (двухъ) атомовъ, и что количество теплоты, необходимое для ихъ разложенія, должно быть больше количества, поглощаемаго при отдћленіи кислорода отъ азота.
Броди, предлагая гипотезу относительно химическихъ соединеній и разложеній, также приходитъ къ мысли о дћлимости молекулъ водорода и кислорода2). Ему кажется неестественной та противоположность, которая, согласно представленіямъ того времени, существовала между явленіями образованія соединеній и ихъ разложенія на элементы. Для Броди каждое соединеніе есть лишь слћдствіе разложенія точно такъ же, какъ и разложеніе можетъ происходить лишь черезъ новыя соединенія. Онъ пытается различными примћрами доказать справедливость этой мысли, при чемъ онъ вводитъ различные знаки и выраженія, которые дћлаютъ очевидной противоположность или, употребляя болће общее выраженіе, отношеніе соединяющихся атомовъ. По мнћнію Броди, между ними существуетъ полярное отношеніе такого рода, что одинъ атомъ долженъ считаться относительно другого положительнымъ или отрицательнымъ. Это отношеніе, которое Броди назвалъ также химическимъ различіемъ, зависитъ отъ свойствъ всћхъ тћхъ частицъ, съ которыми въ данный моментъ соединенъ разсматриваемый атомъ.
Для большей ясности я изложу нћкоторые изъ приведенныхъ Броди доказательствъ. Серебро не соединяется непосредственно съ кислородомъ, тогда какъ хлористое серебро при кипяченіи съ ћдкимъ кали разлагается, образуя окись серебра. Это происходитъ, по мнћнію Броди, вслћдствіе того, что серебро и кислородъ {186} получаютъ необходимую для соединенія полярность лишь черезъ соединеніе съ каліемъ или хлоромъ. Броди пишетъ:
+ |
– |
+ |
– |
||
Ag |
Cl |
+ |
K |
O |
= AgO + KCl3 |
По Фарадэю4) совершенно сухая углекислая известь не разлагается даже при самыхъ высокихъ температурахъ, тогда какъ въ присутствіи воды тотчасъ же начинается разложеніе. Точно также по Миллону5) сћрный ангидридъ можетъ быть дестиллированъ надъ окисью калія, и образованіе соли начинается лишь послћ прибавленія воды. Броди пишетъ:
+ |
– |
+ |
– |
||
K |
O |
+ |
H |
SO4 |
= HO + KSO4 |
Здћсь особенно ясно видно, почему Броди предполагаетъ, что соединеніе всегда должно сопровождаться разложеніемъ, тогда какъ предыдущій примћръ, повидимому, оправдываетъ и обратное предложеніе. Но съ этой точкой зрћнія не можетъ быть совмћщена возможность существованія свободныхъ элементарныхъ атомовъ. Вслћдствіе этого Броди старается доказать, что послћдніе появляются постоянно парами и затћмъ соединяются между собой. Наиболће убћдительнымъ изъ приведенныхъ примћровъ оказывается реакція выдћленія водорода при обработкћ открытой Вюрцемъ водородистой мћди6) соляной кислотой:
+ |
+ |
– |
– |
+ |
– |
|||||
Cu2 |
H |
+ |
H |
Cl4 |
= |
Cu2 |
Cl |
+ |
H |
H. |
Что выдћленіе водорода не наблюдается при дћйствіи кислоты на металлъ, Броди объясняетъ тћмъ, что водороду въ соляной кислотћ всегда свойственъ одинъ и тотъ же родъ полярности, и сродства мћди къ хлору не достаточно, чтобы разложить соляную кислоту7).
Такимъ же образомъ объясняется реакція образованія азота при нагрћваніи азотистокислаго амміака:
+ |
– |
+ |
– |
+ |
– |
|
N |
O4 |
H4 |
N |
= 4HO + |
N |
N. |
| {187} |
Эта точка зрћнія оказалась особенно удобной для объясненія реакцій возстановленія съ помощью перекиси водорода, которыя тогда уже были отчасти извћстны и изучены, главнымъ образомъ, самимъ Броди). По его мнћнію, выдћленіе кислорода есть слћдствіе различныхъ полярностей, которыми этотъ элементъ обладаетъ въ двухъ окисяхъ.
– |
– |
+ |
– |
+ |
– |
+ |
– |
||||
Напримћръ, |
H |
O |
O |
+ |
Ag1/2 |
Ag1/2 |
O |
= HO + |
O |
O |
+ Ag. |
Такъ же должно протекать возстановленіе марганцовокислаго и двухромовокислаго калія. Въ этихъ случаяхъ постоянно и одновременно освобождаются 2 атома, которые соединяются между собой вслћдствіе своего химическаго различія9).
Только въ гипотезћ о дћлимости элементарныхъ молекулъ находятъ себћ объясненіе открытый Шейнбейномъ10) озонъ, распознаніе природы его, какъ изомерной модификаціи кислорода11), и особенно доказательство, что озонъ есть уплотненный кислородъ; послћднюю мысль впервые высказали на основаніи очень интересныхъ опытовъ Эндрьюсъ и Тэтъ12), но доказано это Cope13). Если удћльный вћсъ озона въ 11/2 раза больше кислорода, что послћ изслћдованія Cope представляется весьма вћроятнымъ, то мельчайшія частицы кислорода должны содержать, по меньшей мћрћ, 2 атома, тогда какъ частицы озона состоятъ изъ 3 атомовъ. Но если это предположеніе годится для кислорода, то безъ него врядъ ли можно обойтись и для другихъ элементовъ. Различныя плотности пара, найденныя для сћры14), могутъ быть объяснены лишь тћмъ, что молекула при болће низкой температурћ состоитъ изъ числа атомовъ, въ три или четыре раза большаго, чћмъ при очень высокой температурћ. {188}
Интересно, что Клаузіусъ въ 1857 г., на основаніи механической теоріи тепла, также пришелъ къ мысли о дћлимости физической молекулы15). Такъ какъ по этой теоріи живая сила поступательнаго движенія равныхъ объемовъ двухъ газовъ при одинаковомъ давленіи пропорціональна абсолютной температурћ, то Клаузіусъ сдћлалъ выводъ, что живая сила поступательнаго движенія отдћльныхъ молекулъ всћхъ газовъ при равныхъ температурахъ одинакова. Этимъ подтверждается справедливость гипотезы Авогадро.
Число фактовъ, говорящихъ въ пользу этой гипотезы, можетъ быть увеличено еще фактами изъ различныхъ областей естествознанія; я ограничусь здћсь лишь ссылкой на нихъ и перейду къ основаніямъ чисто химическимъ: вћдь только они одни, въ концћ концовъ, заставили признать эту гипотезу. Между ними несомнћнно первое мћсто занимаютъ произведенные въ то время опыты, которые привели къ понятію о химической молекулћ. Я не буду утверждать, что эта идея не возникала до этого времени, но значительно болће опредћленную форму она приняла лишь теперь. Чтобы вполнћ оправдать это утвержденіе, я сопоставлю здћсь всћ факты и гипотезы, которые были извћстны до Вильямсона и оказали вліяніе на опредћленіе молекулярныхъ вћсовъ химическими способами.
Начало такого рода опредћленій было положено атомистической теоріей, такъ какъ предполагалось, что формула каждаго соединенія должна быть выражаема цћлыми кратными атомныхъ вћсовъ; но это, конечно, не могло имћть никакихъ обязывающихъ послћдствій, пока атомные вћса не были точно установлены, потому что, въ случаћ надобности, можно было измћнить атомный вћсъ какой-нибудь составной части. Но при сколько-нибудь послћдовательномъ примћненіи атомистической теоріи между различными формулами должна существовать извћстная зависимость. Опредћленіе такого соотношенія между формулами было болће совершенно разработано для органическихъ соединеній, особенно Лораномъ и Жераромъ. Мнћ кажется, въ теоріи ядеръ слћдуетъ искать объясненія того факта, что Лоранъ считалъ количество атомовъ углерода въ радикалћ неизмћняемымъ16) до тћхъ поръ, пока {189} углеродъ не выдћлялся въ какой-либо формћ. Жераръ первый ясно формулировалъ это правило. Оно, конечно, оказывается не всегда вћрнымъ (напримћръ, при образованіи полимерныхъ тћлъ)17), но вы согласитесь со мной, что при помощи этого правила можно было опредћлить молекулярные вћса цћлаго ряда соединеній, зная лишь молекулярные вћса нћсколькихъ тћлъ. Такъ называемый законъ четныхъ атомныхъ чиселъ далъ еще критерій для самой малой формулы; неоднократно это побуждало Лорана и Жерара измћнять прежде принятыя формулы.
Понятіе о многоосновныхъ кислотахъ оказало очень значительное и благопріятное вліяніе на установленіе формулъ, и Либихъ, впервые правильно понявшій эту идею, призналъ необходимымъ удвоить18) атомный вћсъ винной кислоты, чтобы согласовать ея формулу съ химической природой этого вещества. Установленіемъ критеріевъ многоосновности для одного класса тћлъ, именно для кислотъ, мы обязаны Либиху, Лорану и Жерару. Это было настолько же важно, насколько важны были для другихъ группъ соединеній позднћйшіе опыты Вильямсона.
Явленія замћщенія способствовали тому, что благодаря имъ могли быть сравниваемы молекулы различныхъ соединеній. Это можно легко понять изъ слћдующаго: часто приходилось удваивать или утраивать формулу какого-нибудь соединенія, чтобы не быть вынужденнымъ допускать въ продуктахъ, получившихся изъ этого тћла при дћйствіи на него хлора и др., существованіе дробной части атома. Необходимость считаться съ этими фактами возникла лишь благодаря введеннымъ Дюма унитарнымъ воззрћніямъ и благодаря вышеприведенному правилу Жерара. Противники этихъ воззрћній смотрћли на дћло иначе, какъ сейчасъ увидимъ на примћрћ. Въ 1848 г. Кольбе и Франкландъ, дћйствуя каліемъ на ціанистый этилъ, получили метилъ, которому они дали формулу C2H3 (C = 6)19); они подвергали его дћйствію хлора, предполагая получить хлористый метилъ, но вмћсто этого получили соединеніе такого же состава, какъ хлористый этилъ; но тогда какъ хлористый этилъ при +12° превращается уже въ жидкость, полученное соединеніе оставалось газообразнымъ еще при –18°. Они считали его изомернымъ съ хлористымъ этиломъ и дали ему формулу
C2H3 . C2 |
H2 |
Cl, |
разсматривая {190} его, какъ парное соединеніе одного атома метила съ другимъ, въ которомъ 1 эквивалентъ водорода замћщенъ хлоромъ. Такимъ образомъ для Кольбе и Франкланда существованіе перваго продукта замћщенія C4H5Сl не являлось достаточнымь основаніемъ, чтобы приписывать первоначальному углеводороду формулу C4H6. Лоранъ же былъ иного мнћнія. Еще до изолированія радикаловъ спиртовъ онъ предложилъ для нихъ на случай, если бы они дћйствительно были открыты, формулы, употребляемыя и въ настоящее время20). Впослћдствіи, когда Кольбе разработалъ методъ электролиза жирныхъ кислотъ и открылъ такимъ образомъ общій способъ полученія21) этихъ радикаловъ*), Лоранъ и Жераръ опять возвратились къ тћмъ же мыслямъ и, развивая ихъ подробно, признали спиртовые радикалы гомологами болотнаго газа22). A. B. Гофманнъ присоединился къ ихъ мнћнію, хотя онъ и оставилъ открытымъ вопросъ о возможности изомеріи между радикалами и гомологами болотнаго газа23). Иначе относился къ этому вопросу Франкландъ. Онъ защищалъ двухобъемныя формулы радикаловъ противъ четырехобъемныхъ и, какъ и раньше, обозначалъ метилъ формулой C2H3, а этиловый углеводородъ C4H624).
Лоранъ, Жераръ и Гофманнъ лучше понимали идею химической молекулы. Они пытались сдћлать ее понятной также и своимъ противникамъ, но, повидимому, безуспћшно, такъ какъ недоставало еще убћдительныхъ опытовъ. Жерару понадобились сотни примћровъ для доказательства, что H4O2, а не H2O, соотвћтствуетъ формуламъ N2H6 и H2Сl2. Доказательство Лорана относительно необходимости удвоенія молекулярныхъ вћсовъ водорода, хлора и др. было также тяжеловћснымъ. Но, несмотря на все это, нельзя отрицать, что эти химики уже тогда имћли правильные основные взгляды, и я не сомнћваюсь, что изъ фактовъ, теперь открытыхъ и превосходно использованныхъ Вильямсономъ, они также сумћли бы извлечь столь плодотворные для нашей науки выводы.
Вильямсонъ надћялся произвести синтезъ алкоголя, дћйствуя этилатомъ калія на іодистый этилъ25). По его предположенію, этилъ {191} долженъ былъ бы занять мћсто калія и такимъ путемъ образовать этилированный этиловый алкоголь. Это предположеніе вполнћ соотвћтствовало духу того времени. Незадолго до того Вюрцъ26) открылъ этилъ-аминъ. Онъ считалъ его замћщеннымъ амміакомъ. Этотъ взглядъ былъ подтвержденъ Гофманномъ, выработавшимъ интересный способъ образованія этого вещества и многихъ другихъ ему подобныхъ27). Франкландъ также пробовалъ, съ помощью открытаго имъ цинкъ-этила28), ввести въ органическія тћла спиртовые радикалы29). Однако, указанный опытъ Вильямсона далъ неожиданный результатъ: вмћсто спирта Вильямсонъ получилъ эфиръ. Но свои идеи, направленныя въ совсћмъ другую сторону, онъ сумћлъ примћнить къ полученнымъ результатамъ. Вильямсонъ тотчасъ же понялъ все значеніе своего опыта. Онъ объяснилъ процессъ образованія эфира при условіяхъ, которыхъ онъ придерживался въ своемъ опытћ, и затћмъ построилъ общую теорію образованія эфировъ, справедливость которой онъ затћмъ доказалъ цћлымъ рядомъ блестящихъ опытовъ.
Тогда существовали различныя воззрћнія относительно формулъ алкоголя и эфира. Сообразно съ теоріей этила Либиха, почти всћ химики обозначали алкоголь формулой C4H12O2, а эфиръ C4H10О (C = 12, O = 16). Но очень часто, соотвћтственно атомнымъ вћсамъ, формулы дћлились теперь пополамъ; алкоголь обозначали уже черезъ C4Н6O2, а эфиръ C4Н10О (C = 6, O = 8); Жераръ же этимъ соединеніямъ давалъ символы C2Н6O и C4H10О (C =12, O = 16). Кромћ того, еще въ 1846 г. Лоранъ указалъ на то30), что формулы алкоголя и эфира могутъ быть выведены изъ формулы воды31), подобно окиси калія и гидрату окиси калія. Онъ писалъ:
HHO |
EtHO |
EtEtO |
KHO |
KKO |
вода |
алкоголь |
эфиръ |
гидратъкали |
окись калія. |
Вильямсонъ понялъ, что изъ всћхъ этихъ предположеній съ его опытомъ согласуется лишь послћднее. Открытую имъ реакцію {192} онъ выражаетъ слћдующимъ уравненіемъ:
C2 |
H5 |
O + C2H5J = |
C2H5 |
O + KJ (C = 12). |
K |
C2H5 |
Вильямсонъ произвелъ реакцію съ іодистымъ метиломъ, чтобы опровергнуть мнћніе своихъ противниковъ, согласно которому реакція протекаетъ по уравненію.
C4H5O.KO + C4H5J = 2(C4H5O) + KJ (C = 6);
они предполагали при этомъ, что алкоголятъ калія есть не что иное, какъ соединеніе кали съ эфиромъ, выдћлившее при разложеніи эфиръ, одновременно съ чћмъ второй „атомъ” того же вещества образуется изъ іодистаго этила. Вильямсонъ ожидалъ, что получитъ метиловый эфиръ, тогда какъ, по предположенію, только-что указанному, должна была образоваться смћсь изъ метиловаго и этиловаго эфировъ. Этотъ опытъ имћлъ поэтому рћшающее значеніе и оправдалъ гипотезу Вильямсона. Что касается такъ называемаго смћшаннаго іметилэтиловаго эфира, то онъ получается какъ при дћйствіи іодистаго метила на этилатъ калія, такъ и отъ дћйствія іодистаго этила на метилатъ калія:
C2H5 |
O + JСH3 = |
C2H5 |
O + JK |
K |
СH3 |
СH3 |
O + JС2H5 = |
СH3 |
O + JK. |
K |
C2H5 |
Эти опыты доказали Вильямсону, что эфиръ образуется изъ алкоголя при замћщеніи этиломъ одного атома водорода, и что его молекула содержитъ, такимъ образомъ, больше атомовъ углерода, чћмъ молекула алкоголя. Способъ образованія смћшанныхъ эфировъ исключалъ возможность какого-либо другого взгляда.
Теперь нужно было объяснить также образованіе эфира при извћстныхъ условіяхъ, а именно при обработкћ алкоголя сћрной кислотой. Этотъ вопросъ, занимавшій изслћдователей въ продолженіи десятковъ лћтъ, также былъ разрћшенъ Вильямсономъ. Вначалћ образованіе эфира объяснялось тћмъ, что сћрная кислота отнимаетъ воду32). Этотъ взглядъ вполнћ согласовался съ теоріей этерина {193} Дюма. Несмотря на то, что Геннель (Неnnеl) придерживался этой теоріи, онъ все же считалъ ее несовмћстимой съ наблюдавшимся имъ образованіемъ сћрновинной кислоты33). Она противорћчила также тому факту, что одновременно съ эфиромъ перегоняется вода. Либихъ разнообразными опытами обосновалъ новую теорію образованія эфира34). Онъ доказалъ, что образованіе этилсћрной кислоты предшествуетъ ооразованію эфира, и, по его мнћнію, сћрная кислота отнимаетъ отъ алкоголя не воду, а эфиръ, который затћмъ соединяется съ сћрной кислотой; въ то время этилсћрная кислота разсматривалась какъ соединеніе этихъ двухъ тћлъ, именно какъ кислая соль окиси этила.
Формула ея была:
C4H10O + 2SO3 + H2O
(C = 12, O =16, S = 32).
Опытами Либиха установлено, что этилсћрная кислота между 127° и 140° распадается на эфиръ и сћрную кислоту. Это замћчательное явленіе образованія и разложенія тћла при одной и той же операціи Либихъ объяснялъ предположеніемъ, что образованіе происходило лишь въ тћхъ мћстахъ, гдћ падали капли алкоголя, т.-е. тамъ, гдћ температура понижалась до точки кипћнія этого тћла. Такимъ образомъ, по мнћнію Либиха, процессъ образованія эфира состоялъ въ соединеніи сћрной кислоты съ эфиромъ алкоголя, но соединеніе въ болће нагрћтыхъ частяхъ жидкости вновь распадается на свои составныя части. Затћмъ эфиръ дестиллируется, а вмћстћ съ нимъ и пары воды, выдћлившейся при образованіи эфирной кислоты.
Берцеліусъ35) противопоставилъ этой теоріи другую, которую особенно отстаивалъ и развивалъ Митчерлихъ36). По этой теоріи сћрная кислота дћйствуетъ контактомъ. Она не принимаетъ участія въ реакціи, а лишь посредствомъ каталитической силы разлагаетъ алкоголь на эфиръ и воду. Впослћдствіи это мнћніе пріобрћло большое значеніе, но въ данномъ случаћ оно не согласуется съ фактами, такъ какъ образованіе этилсћрной кислоты было уже доказано. Значительно ближе къ истинћ было мнћніе Либиха, принятое почти {194} всћми; оно стало возбуждать сомнћнія лишь послћ того, какъ въ 1850 г. Грэмъ доказалъ37), что для образованія эфира необходимы алкоголь и этилсћрная кислота, и что послћдняя въ отдћльности даже при нагрћваніи до 143° не образуетъ эфира, а въ присутствіи воды разлагается на алкоголь и сћрную кислоту.
Вильямсонъ сумћлъ очень хорошо использовать этотъ фактъ, который объясняется слћдующей формулой:
C2H5 |
SO4 |
+ |
C2H5 |
O |
= |
H |
SO4 |
+ |
C2H5 |
O, |
H |
H |
H |
C2H5 |
|||||||
Этилсћрная |
Алкоголь |
Сћрная |
Эфиръ |
|||||||
тогда какъ образованіе эфира сћрной кислоты соотвћтствуетъ другому уравненію:
H |
SO4 |
+ |
C2H5 |
O |
= |
H |
O |
+ |
C2H5 |
SO4. |
H |
H |
H |
H |
Если эту формулу прочитать справа налћво, то она окажется интерпретаціей опыта Грэма, а именно, процесса разложенія водой этилсћрной кислоты на алкоголь и сћрную кислоту. Если принять удвоенную формулу эфира, то станетъ яснымъ, что при нагрћваніи этилсћрной кислоты эфиръ не можетъ образоваться.
Вильямсонъ не ограничился только тћмъ, что доказалъ правильность своихъ взглядовъ, согласовавъ ихъ съ извћстными фактами; для дальнћйшаго подтвержденія ихъ, онъ придумываетъ новые опыты38). Онъ избралъ тотъ же путь, что и раньше; a именно, бралъ два взаимодћйствующія соединенія, принадлежащія къ группамъ съ различнымъ числомъ углеродныхъ атомовъ. Вильямсонъ дћйствовалъ этилсћрной кислотой на амиловый алкоголь и получилъ въ результатћ ожидаемый этиламиловый эфиръ.
C2H5 |
SO4 |
+ |
C5H11 |
O |
= |
H |
SO4 |
+ |
C5H11 |
O. |
H |
H |
H |
C2H5 |
Онъ изучаетъ далће дћйствіе сћрной кислоты на смћси этиловаго и амиловаго спиртовъ. Эта реакція дала ему возможность доказать образованіе трехъ эфировъ: этиловаго, амиловаго и этиламиловаго. Онъ находитъ, что эти реакціи „наилучшимъ образомъ {195} выясняютъ дћйствіе сћрной кислоты при образованіи обыкновеннаго эфира. Уксусный эфиръ образуется изъ уксусной кислоты, какъ обыкновенный эфиръ изъ алкоголя, т.-е. черезъ замћщеніе атома водорода этиломъ. И если опредћлять кислоту какъ соединеніе, содержащее водородъ, способный замћщаться металлами или радикалами, то алкоголь, въ виду указанныхъ реакцій, можетъ считаться веществомъ, обладающимъ свойствами кислоты.”
Дальнћйшимъ слћдствіемъ опытовъ Вильямсона было установленіе молекулярнаго вћса уксусной кислоты. Послћдняя, по его мнћнію, образуется изъ алкоголя замћщеніемъ двухъ водородныхъ атомовъ этила однимъ атомомъ кислорода. При окисленіи радикалъ этилъ C2H5 переходитъ въ отилъ (othyl) C2H3O. Въ этомъ случаћ уксусная кислота разсматривается, какъ вода, въ которой одинъ атомъ водорода замћщенъ отиломъ. Но съ этимъ не согласовалась установленная Кэномъ формула ацетона39) C6H12O2; впрочемъ, она была уже уменьшена въ два раза. Вильямсонъ объяснялъ образованіе этого соединенія при перегонкћ уксуснокислыхъ солей слћдующимъ уравненіемъ:
C2H3O |
O |
+ |
C2H3O |
O |
= |
СO.KO |
O |
+ |
C2H3O |
. |
K |
K |
K |
СH3 |
Такимъ образомъ, по его мнћнію, въ этой реакціи перекись калія замћщается метиломъ изъ отила. Вильямсонъ въ этомъ случаћ также провћряетъ себя упомянутымъ уже методомъ. Онъ дестиллируетъ смћсь уксусной и валерьянокислой солей и получаетъ при этомъ смћшанные ацетоны.
C2H3O |
O |
+ |
C5H9O |
O |
= |
СOKO |
O |
+ |
C5H9O |
. |
K |
K |
K |
СH3 |
Слћдующими словами заканчиваетъ Вильямсонъ свою статью, имћвшую столь важное значеніе для нашей науки: „Мнћ кажется, что примћненный здћсь методъ опредћленія раціональнаго строенія соединеній посредствомъ сравненія ихъ съ водой способенъ къ широкому развитію; и я безъ колебаній могу сказать, что его примћненіе будетъ весьма полезно, такъ какъ оно упроститъ наши воззрћнія и установитъ для сравненія химическихъ реакцій одну общую точку зрћнія”. {196}
Такимъ образомъ найденъ былъ теперь „terme de comparaison”, который тщетно искалъ уже Лоранъ. Необходимо было представлять себћ всћ тћла какъ бы происходящими изъ воды, и, дћйствительно, Вильямсонъ въ 1851 г. въ своей знаменитой статьћ о соляхъ40) предлагаетъ считать воду прототипомъ всћхъ соединеній.
Выработанный имъ методъ опредћленія величины молекулы былъ чисто химическій. По его представленію тћла образуются изъ воды посредствомъ замћщенія одного или двухъ атомовъ ея водорода. Всћ эти взгляды получили рћшительное подтвержденіе, послћ того какъ Вильямсонъ провћрилъ ихъ на извћстныхъ уже фактахъ новыми опытами, при чемъ тћ или другіе опыты были выбраны имъ не случайно, но вызывались всегда однимъ и тћмъ же логическимъ порядкомъ разсужденій. Вильямсонъ далъ всћмъ мыслящимъ химикамъ средство опредћлять химическимъ путемъ молекулярныя величины соединеній. Какъ широко могъ примћняться открытый имъ методъ, указываютъ намъ прекрасныя изслћдованія Жерара, приведшія его къ открытію смћшанныхъ ангидридовъ41), а также работы Вюрца, пользовавшагося этимъ методомъ для опредћленія формулъ спиртовыхъ радикаловъ42). И тотъ способъ, съ помощью котораго Фридель и Крафтъ43) опредћлили молекулярный вћсъ кремневокислаго эфира, также былъ тћсно связанъ съ общимъ направленіемъ идей, ставшихъ для химиковъ ясными лишь послћ ознакомленія ихъ съ изслћдованіями Вильямсона.
Нельзя не упомянуть здћсь о томъ, что спустя лишь нћсколько мћсяцевъ послћ появленія труда Вильямсона, именно 7 октября 1850 г., Шансель опубликовалъ статью44), въ которой онъ путемъ подобныхъ же изслћдованій приходитъ къ тћмъ же самымъ результатамъ. Онъ дестиллируетъ этилъ-сћрнокислый калій съ этилатомъ калія и метилатомъ калія, и такимъ образомъ получаетъ эфиры этиловый и этилъ-метиловый. Онъ вырабатываетъ оригинальный способъ опредћленія молекулярнаго вћса двухосновныхъ кислотъ, который въ принципћ, однако, совпадаетъ съ методомъ Вильямсона. При дестилляціи этилъ-сћрнокислаго калія съ метилъ-углекислымъ или метилъ-щавелевокислымъ каліемъ Шансель получилъ этилъметиловые эфиры {197} угольной и щавелевой кислотъ. Эти реакціи могутъ быть выражены слћдующими уравненіями:
СO3 |
( |
H |
) |
K + SO4 |
( |
H |
) |
K = СO3 |
( |
H |
)( |
H |
) |
+ SO4K2 |
СH2 |
C2H4 |
СH2 |
C2H4 |
C2O4 |
( |
H |
) |
K + SO4 |
( |
H |
) |
K = C2O4 |
( |
H |
)( |
H |
) |
+ SO4K2. |
СH2 |
C2H4 |
СH2 |
C2H4 |
Изслћдованія Вильямсона и Шанселя имћли громадное значеніе для развитія нашей науки, такъ какъ всћ современные взгляды основываются на понятіи о химической молекулћ. Къ сожалћнію, величину ея не всегда удается установить съ такой точностью, какъ это удалось сдћлать въ разсмотрћнныхъ случаяхъ. Но все же выяснилось вполнћ, что за немногими исключеніями, къ которымъ мы вернемся позже, величины химическихъ молекулъ совпадаютъ съ тћми, которыя опредћляются изъ объемныхъ отношеній, если положить въ основу гипотезу Авогадро. Это привело къ принятію тождества химической и физической молекулы. Такимъ образомъ было выработано новое и почти всегда пригодное средство для опредћленія столь важныхъ молекулярныхъ величинъ.
Но опыты и воззрћнія Вильямсона оказали вліяніе также и въ другомъ направленіи, а именно, на взгляды относительно строенія соединеній. Теперь было положено начало сліянію болће новой теоріи радикаловъ или остатковъ съ теоріей типовъ Дюма, и съ этого момента возникла теорія типовъ Жерара. Правда, для развитія взглядовъ на строеніе соединеній работы другихъ ученыхъ имћли, по меньшей мћрћ, столь же большое значеніе, особенно потому, что онћ отчасти были выполнены уже раньше. Вслћдствіе этого мы теперь и займемся болће детальнымъ разсмотрћніемъ этихъ изслћдованій.
Въ 1849 г. Вюрцъ, дћйствуя ћдкимъ кали на ціановый эфиръ, ціануровый эфиръ и на приготовленные имъ изъ послћднихъ замћщенные продукты мочевины, получилъ основанія, чрезвычайно сходныя съ амміакомъ. Онъ съ нимъ и сравнилъ эти основанія, разсматривая ихъ, какъ амміакъ, въ которомъ 1 атомъ водорода замћщенъ радикалами: метиломъ, этиломъ, амиломъ и др.45). {198} Такой взглядъ представлялъ сооою значительный шагъ впередъ, такъ какъ это былъ первый успћшный опытъ введенія радикаловъ въ типы46). Еще въ 1839 г. Либихъ высказалъ подобное же мнћніе относительно гипотетическихъ въ то время тћлъ47); это доказываетъ геніальную проницательность Либиха, но не умаляетъ заслуги Вюрца.
Методъ Гофманна для полученія этихъ искусственныхъ основаній48) оказалъ существенную поддержку взглядамъ Вюрца на строеніе этихъ тћлъ. Дћйствуя амміакомъ на алкилъ-іодиды, Гофманнъ ввелъ въ амміакъ радикалы. Его опыты пріобрћли тћмъ большее значеніе, что ему удалось получить вторичныя и третичныя основанія и, наконецъ, продукты, оказавшіеся производными хлористаго аммонія и гидрата окиси аммонія. Полученіе этихъ соединеній видно изъ слћдующихъ реакцій:
NH3 + JС2H5 = N |
C2H5 |
, HJ |
H2 |
N |
|
+ JСH3 = N |
C2H5 |
, HJ |
||
СH3 |
||||||
H |
N |
H |
+ JС5H11 = N |
C2H5 |
, HJ |
C2H5 |
СH3 |
|||
СH3 |
C5H11 |
N |
C2H5 |
+ JС2H5 = N |
(C2H5)2 |
J |
СH3 |
СH3 |
|||
C5H11 |
C5H11 |
N |
(C2H5)2 |
J + AgHO = AgJ + N |
|
O. |
||||
СH3 |
||||||||
C5H11 |
Я долженъ здћсь упомянуть, что Поль Тэнаръ49) еще въ 1845 г. открылъ органическія соединенія фосфора, но правильное объясненіе ихъ природы было дано лишь указанной работой Гофманна50). {199}
Изъ другихъ изслћдованій, произведенныхъ въ началћ пятидесятыхъ годовъ и способствовавшихъ установленію новой теоріи типовъ, я упомяну еще открытіе хлоридовъ кислотъ (Кагуръ51) и ангидридовъ одноосновныхъ органическихъ кислотъ (Жераръ), изслћдованія Вильямсона и Жерара относительно двухосновныхъ кислотъ и, наконецъ, полученіе амидовъ кислотъ (Жераръ и Кіоцца52).
Жераръ тотчасъ же понялъ, какое значеніе имћютъ изслћдованія Вильямсона. Онъ могъ видћть въ нихъ лишь подтвержденіе взглядовъ, которые уже защищались имъ совмћстно съ Лораномъ раныие, но никогда не были выражены столь ясно53). Онъ увидћлъ, что реакція образованія эфировъ Вильямсона можетъ быть примћнена также и къ одноосновнымъ кислотамъ, и что тћмъ же способомъ должны были бы получаться окиси или ангидриды этихъ кислотъ54). Его опытъ въ этомъ направленіи удался, и такимъ образомъ Жерару, который такъ же, какъ и Лоранъ, отрицалъ раныие существованіе ангидридовъ одноосновныхъ кислотъ, суждено было собственнымъ опытомъ доказать противное. Правда, раньше онъ высказывалъ лишь предположеніе, что невозможно выдћлить одну молекулу воды изъ одной же молекулы одноосновной кислоты, и это положеніе осталось въ силћ. Именно онъ доказалъ, что при образованіи ангидрида всегда соединяются двћ молекулы одноосновной кислоты, и доказательство ему удалось благодаря примћненію метода Вильямсона. Дћйствуя на уксуснокислый калій ацетилхлоридомъ, Жераръ получилъ ангидридъ уксусной кислоты:
C2H3O |
} |
O + C2H3OCl = |
C2H3O |
} |
O + KCl. |
K |
C2H3O |
Примћняя хлористый бензоилъ, Жераръ получилъ смћшанный ангидридъ бензойной и уксусной кислотъ:
C2H3O |
} |
O + C7H5OCl = |
C2H3O |
} |
O + KCl. |
K |
C7H5O |
Прежде чћмъ обратиться къ совмћстнымъ работамъ Жерара и Кіоцца относительно ангидридовъ и амидовъ двухосновныхъ кислотъ, я долженъ познакомить васъ съ точкой зрћнія Вильямсона на эти {200} кислоты, которая собственно и послужила впослћдствіи толчкомъ для вышеупомянутыхъ работъ. Чрезвычайно важное значеніе имћло то широкое толкованіе, которое англійскій изслћдователь далъ своимъ прежнимъ воззрћніямъ въ 1851 году, т.-е. годъ спустя послћ его перваго изслћдованія относительно процесса образованія эфировъ. Одно время можно было, пожалуй, утверждать, что въ своихъ предыдущихъ статьяхъ Вильямсонъ склонялся къ мнћніямъ Лорана и Жерара, справедливость которыхъ онъ лишь доказывалъ новыми, правда, весьма рћшающими опытами, но послћднее его выступленіе было вполнћ самостоятельнымъ и оригинальнымъ.
Вильямсонъ показываетъ, какимъ образомъ существованіе двухосновныхъ кислотъ обусловливается существованіемъ многоосновныхъ радикаловъ55). Открытыя Вюрцемъ замћщенія въ амміакћ, Вильямсонъ формулируетъ слћдующимъ образомъ:
K2 |
O2 + |
C2H5 |
O = |
K2 |
O2 + |
C2H5 |
H2, |
H2 |
СN |
СO |
N |
Образованіе этихъ замћщенныхъ амміачныхъ соединеній даетъ ему поводъ выразиться слћдующимъ образомъ: „Атомъ CO эквивалентенъ двумъ атомамъ водорода; замћщая ихъ, онъ связываетъ два атома гидрата кали, въ которомъ содержался водородъ, вслћдствіе чего неизбћжно должно образоваться двухосновное соединеніе — углекислый калій”.
Далће онъ предполагаетъ, что можно, не измћняя основности, удвоить атомный вћсъ окиси углерода; такимъ образомъ получается С202, радикалъ щавелевой кислоты, послћ чего онъ можетъ уже слћдующимъ уравненіемъ выразить образованіе оксамида:
(C2H5)2 |
O2 + N2H2H4 = 2 |
( |
C2H5 |
O |
) + |
(СO2)2 |
(СO2)2 |
H |
N2H4 |
Очень большое значеніе имћетъ также его взглядъ на сћрную кислоту какъ на двухосновной гидратъ радикала SO2. Очень интересны опыты, съ помощью которыхъ Вильямсонъ доказалъ справедливость этого мнћнія. Дћйствіемъ на сћрную кислоту пятихлористымъ фосфоромъ ему удалось также изолировать гидратъ хлорсћрной кислоты56) на ряду съ уже извћстнымъ хлоридомъ {201} S02C12, полученнымъ Реньо изъ сћрнистой кислоты и хлора57). Этому соотвћтствуетъ уравненіе:
H |
+ PCl5 = |
|
+ POCl3 + HCl. |
||||
O | |||||||
SO2 | |||||||
O | |||||||
H |
Этимъ опытомъ онъ опровергаетъ мнћніе Жерара, будто въ двухосновныхъ кислотахъ образованіе ангидрида должно всегда предшествовать образованію хлорида58). За полгода до появленія этой статьи Вильямсона, именно въ іюнћ 1853 г., Жераръ совмћстно съ Кіоцца опубликовалъ свои изслћдованія относительно производныхъ двухосновныхъ кислотъ, именно, ихъ ангидридовъ и хлоридовъ, въ которыхъ онъ считалъ возможнымъ доказывать, между прочимъ, что въ первый моментъ реакціи дћйствіе пятихлористаго фосфора состоитъ въ отнятіи воды, и лишь во второй стадіи получается содержащій хлоръ продуктъ. Впрочемъ, Жераръ и Кіоцца пришли тогда къ весьма важнымъ результатамъ. Вначалћ они разсматривали двухосновные ангидриды, какъ воду, у которой оба водорода замћщены однимъ радикаломъ. Кромћ того они выработали методъ полученія хлорангидрида янтарной кислоты и другихъ подобныхъ хлоридовъ. Въ двухъ позднћйшихъ статьяхъ59) они сообщаютъ объ изслћдованіи амидовъ, соотвћтствующихъ двухатомнымъ кислотамъ. Здћсь они указываютъ, какимъ образомъ эти соединенія производятся изъ двухъ молекулъ амміака, которыя путемъ замћщенія по одному атому водорода связываются однимъ двухосновнымъ радикаломъ. Аминокислоты соотвћтствуютъ смћшанному типу NH3 + Н2O, который можетъ образоваться лишь вслћдствіе вступленія многовалентнаго кислотнаго радикала. Такимъ образомъ объясняется ранће высказанное Жераромъ утвержденіе, что только двухосновныя кислоты способны производить аминокислоты.
Благодаря этимъ и другимь подобнымъ опытамъ, и въ особенности, благодаря остроумнымъ объясненіямъ, къ которымъ Вильямсонь пришелъ на основаніи своихъ изслћдованій, Жерару удалось установить полную классификацію органическихъ соединеній, согласно новому принципу60). Эта классификація была изложена имъ въ четвертомъ томћ его превосходнаго руководства. {202}
Существеннымъ моментомъ въ системћ Жерара является то, что онъ соединяетъ противоположныя ея части промежуточными членами.
Напримћръ, такія вещества, какъ ћдкое кали и сћрную кислоту, онъ не считаетъ, какъ дуалисты, абсолютно противоположными другъ другу, а связываетъ ихъ переходными членами. Онъ получаетъ такимъ образомъ ряды, по которымъ и классифицируетъ тћла. При установленіи такихъ рядовъ Жераръ исходитъ изъ двухъ точекъ зрћнія, изъ которыхъ одна, правда, намћчена не имъ. Еще въ 1842 г. Шиль обратилъ вниманіе61) на то, что радикалы спиртовъ образуютъ рядъ, отдћльные члены котораго разнятся другъ отъ друга на п. СН2 и что точки кипћнія соотвћтствующихъ спиртовъ разнятся между собою на 18° на 1. СН2, что еще раньше было доказано Коппомъ для этиловыхъ и метиловыхъ соединеній62). Въ 1843 г. Дюма указалъ63), что и жирныя кислоты, отличаются такимъ же различіемъ въ составћ. Жераръ воспользовался этой столь замћчательной закономћрностью, встрћчающейся, какъ извћстно, въ очень многихъ органическихъ соединеніяхъ, и назвалъ гомологичными тћ тћла, которыя разнятся одно отъ другого на п. СН2. Оказалось, что эти тћла химически весьма сходны, и что ихъ физическія свойства измћняются медленно и непрерывно; это особенно ясно обнаружилось изъ подробныхъ и превосходныхъ изслћдованій Коппа64). Жераръ далће устанавливаетъ понятіе объ изологичныхъ соединеніяхъ. Эти соединенія также химически сходны, но различіе въ ихъ составћ не выражается, однако, черезъ п. CH2. Извћстными примћрами такого рода веществъ являются уксусная и бензойная кислоты.
Гомологичные и изологичные ряды составляютъ одинъ методъ классификаціи Жерара; другое же направленіе ея опредћляется гетерологичными рядами. Къ послћднимъ причисляются всћ тћла, которыя могутъ образоваться одно изъ другого при помощи простыхъ реакцій двойного обмћна и которыя по способу своего образованія находятся въ родственныхъ отношеніяхъ, но химически различны. Жераръ очень удачно сравниваетъ такое распредћленіе соединеній съ колодой картъ, въ которой карты расположены какъ по {203} мастямъ, такъ и по значенію. Подобно тому какъ при такомъ расположеніи картъ значеніе и масть каждой недостающей карты опредћляется ея свободнымъ мћстомъ, такъ и въ химической классификаціи для недостающихъ членовъ ея могутъ быть напередъ опредћлены главныя свойства и способы образованія и разложенія.
Жераръ сравниваетъ члены одного и того же гетерологическаго ряда, а, слћдовательно, также и представителей различныхъ гомологичныхъ и изологичныхъ рядовъ съ четырьмя очень хорошо изученными неорганическими веществами, — четырьмя основными типами: съ водой, соляной кислотой, водородомъ и амміакомъ, т.-е. съ водородными соединеніями. Тћло, принадлежащее къ одному изъ этихъ типовъ, должно разсматриваться, какъ образовавшееся изъ этого типа путемъ замћщенія атомовъ водорода радикаломъ. Такъ, къ типу воды Жераръ причисляетъ: спирты, эфиры, кислоты, ангидриды, соли, альдегиды, ацетоны и др.; послћдніе, собственно говоря, соотвћтствуютъ типу сћроводорода, который, однако, является лишь подгруппой типа воды. Хлориды, бромиды, іодиды и ціаниды относятся къ типу соляной кислоты. Амміакъ является представителемъ аминовъ, амидовъ, имидовъ, нитриловъ, а также соотвћтствующихъ фосфорныхъ соединеній. Наконецъ, къ типу водорода Н2относятся углеводороды, спиртовые и металлъ содержащіе радикалы.
Такимъ образомъ былъ совершенъ великій шагъ: въ механическіе типы Реньо и Дюма были введены радикалы. Если мы теперь бросимъ взглядъ назадъ и спросимъ себя, кому главнымъ образомъ мы обязаны этимъ столь замћчательнымъ развитіемъ прежней теоріи типовъ, то окажется, что на первый планъ слћдуетъ поставить имена Лорана и Вюрца. Первый еще въ 1846 г. причислилъ алкоголь и эфиръ къ типу воды. Три года спустя, Вюрцъ открылъ этиламинъ, который онъ считалъ замћщеннымъ амміакомъ. Такой взглядъ былъ тћмъ легче признанъ всћми, что сходство между обоими этими тћлами65) бросается въ глаза. Я долженъ здћсь упомянуть, еще разъ что въ понятіе „радикалъ” вкладывали теперь то содержаніе, которое Жераръ опредћлилъ еще въ 1839 г. Радикалами считали остатки {204} соединеній, группы атомовъ, которыя при нћкоторыхъ реакціяхъ могутъ быть перенесены неразложенными изъ одного вещества въ другое, но которыя отнюдь не должны поэтому непремћнно существовать самостоятельно; „они должны выражать лишь отношенія, въ которыхъ элементы или же группы атомовъ замћщаютъ другъ друга66).
Полученные такимъ образомъ символы не представляютъ расположенія атомовъ въ соединеніяхъ. Это лишь формулы превращеній, напоминающія о рядћ существующихъ аналогій. Понятно поэтому, какъ Жераръ для одного и того же вещества могъ допускать возможность существованія нћсколькихъ радикаловъ и нћсколькихъ раціональныхъ формулъ. Онъ считалъ неразрћшимой задачей выясненіе дћйствительнаго строенія тћлъ, такъ какъ къ разрћшенію этого вопроса могутъ привести лишь методы разложенія и образованія ихъ, а разнообразіе этихъ способовъ не даетъ возможности сдћлать какой-нибудь выводъ о расположеніи атомовъ. Такъ, напримћръ, сћрнокислый барій образуется изъ сћрной кислоты и окиси барія, а также изъ сћрнистой кислоты и перекиси барія, и, кромћ того, онъ образуется еще изъ сћрнистаго барія и кислорода. Поэтому строеніе этой соли возможно было бы символически выразить тремя формулами:
Ва2O + SO3, Ва2O2 +SO2, Ba2S + O467)
(O = 16, 5 = 32, Ва = 68,5).
По Жерару уже одинъ этотъ примћръ ясно доказывалъ, что всћ попытки выражать символами расположеніе атомовъ ведутъ лишь къ заблужденіямъ.
Для Жерара реакція это — двойное обмћнное разложеніе; именно въ этомъ обнаруживается контрастъ между его системой и дуалистической, такъ какъ согласно послћдней всћ соединенія образуются путемъ присоединенія (аддитивно). Жераръ заходитъ такъ далеко, что видитъ двойное обмћнное разложеніе или, какъ онъ выражается, типичную реакцію (une reaction type) даже въ тћхъ случаяхъ, когда двћ молекулы соединяюгся въ одну. Такъ, хлористый этиленъ образуется, по его мнћнію, изъ маслороднаго газа вслћдствіе замћщающаго дћйствія хлора. Сперва образуется C2H3Сl, а {205} этотъ продуктъ остается соединеннымъ съ одновременно образующейся соляной кислотой68).
Общій планъ и наглядность системы Жерара не оставляютъ желать ничего лучшаго. Хотя съ того времени взгляды значительно измћнились и сдћлались гораздо болће ясными, и хотя съ нынћшней точки зрћнія теорія типовъ должна считаться недостаточной, все же никогда нельзя будетъ отрицать заслугъ Жерара въ химіи. Къ сожалћнію, ему не довелось порадоваться успћху, который имћло его замћчательное руководство. Онъ умеръ въ 1856 г., очень скоро послћ выхода въ свћтъ четвертой и послћдней части его труда.
| {206} |
Смћшанные типы. — Связь между идеями Кольбе и теоріей Берцеліуса о сочетанныхъ соединеніяхъ. — Содержащіе металлъ радикалы. — Сочетанные радикалы. — Кольбе и Франкландъ сторонники теоріи типовъ. — Идея многоосновности, какъ доводъ въ пользу правильности „новыхъ атомныхъ вћсовъ”. — Открытіе многоатомныхъ спиртовъ и амміачныхъ соединеній.
Вы мнћ разрћшите вновь обратить ваше вниманіе на теорію типовъ въ томъ видћ, какъ она была установлена Жераромъ. Онъ раздћлилъ органическія соединенія, такъ сказать, на естественныя семейства; представителями ихъ были четыре типичныя соединенія: вода, соляная кислота, амміакъ и водородъ, которыя Жераръ назвалъ также типами двойного разложенія. При этомъ надо замћтить, что Жераръ допускаетъ существованіе сочетанныхъ радикаловъ, чтобы имћть возможность помћстить между типами также и продукты замћщенія и чтобы „связать одну съ другой нћсколько системъ двойного разложенія одного тћла”1). Для этого онъ воспользовался, по крайней мћрћ отчасти, воззрћніями Кольбе, которыя я еще долженъ вамъ изложить. Необходимо при этомъ отмћтить, что сочетанныя соединенія уже не имћютъ того смысла, который имъ раньше давалъ Жераръ. He только названіе „corps copules” замћнено другимъ („corps conjuges”), но измћнено и самое значеніе. Законъ основности, о которомъ мы подробно говорили {207} раньше, теперь уже не находитъ никакого примћненія2). По новымъ представленіямъ и одноосновныя кислоты могутъ съ нейтральными тћлами давать сочетанныя соединенія; къ послћднимъ причисляются, именно, всћ тћла, происходящія посредствомъ замћщенія (главнымъ образомъ, кислоты), т.-е. вещества, образовавшіяся отъ дћйствія на органическія вещества хлора, брома, іода, азотной и сћрной ,кислотъ и другихъ. Слћдовательно, сочетанные радикалы представляли собой, какъ мы это сказали бы теперь, замћщенные радикалы; они, кромћ того, обнимали группы атомовъ, содержащія металлы, напримћръ, какодилъ и др.
Въ то время какъ Жераръ причислялъ къ этому классу тћлъ хлоруксусную
C2Сl3O |
} |
H |
пикриновую
C6H2(NO2)3 |
} |
O |
H |
сульфобензойную кислоту
C7H4(SO2)O |
} |
O2 |
H2 |
и т.д., другіе химики, какъ Мендіусъ3), называютъ сочетанными тћла послћдней категоріи. Были также химики, какъ Лимприхтъ и Усларъ4), которые хотћли причислить къ этой категоріи почти всћ органическія соединенія. Такимъ образомъ относительно этого вопроса возникъ споръ, и въ результатћ были введены смћшанные типы, а отъ сочетанныхъ соединеній пришлось отказаться.
Уже Жераръ въ 1853 г. относилъ аминокислоты, которыя онъ въ своемъ руководствћ причисляетъ къ „acides conjuges”, къ типу амміакъ + вода5). Въ 1857 г. Кекуле, возвращаясь къ этой идећ, но въ то же время существенно расширяя ее, указалъ, что если допустить смћшанные типы, то разграниченіе между сочетанными и другими соединеніями сдћлается совершенно излишнимъ6). Возможность этой гипотезы основывалась на понятіи многоосновныхъ радикаловъ, введенномъ въ 1851 г. Вильямсономъ; благодаря ему, становилось понятнымъ, какъ двћ ранће отдћльныя молекулы могутъ соединяться въ одну. Вильямсонъ объяснялъ природой радикала SO2 соединеніе двухъ молекулъ воды, благодаря чему возникли уплотненные (kondensierte) типы. Кекуле пользуется этой мыслью для установленія смћшанныхъ типовъ. При этомъ онъ выражается слћдующимъ образомъ: „Соединеніе нћсколькихъ молекулъ можетъ произойти лишь въ томъ случаћ, когда многоатомный радикалъ {208} замћщаетъ два или три атома водорода, благодаря чему молекулы могутъ держаться вмћстћ”. Такъ какъ этимъ способомъ можетъ соединиться неограниченное число гетерогенныхъ молекулъ, то даже самыя сложныя соединенія могутъ быть отнесены къ типамъ, и этимъ устраняется необходимость прибћгать къ помощи сочетанныхъ радикаловъ. На это обстоятельство и указываетъ Кекуле: „Такъ называемые сочетанные радикалы образуются не иначе, чћмъ остальныя химическія соединенія; они такимъ же образомъ могутъ быть сведены къ типамъ, въ которыхъ водородъ замћщенъ радикаломъ; что касается ихъ образованія и насыщающей способности, то они подчиняются тћмъ же законамъ, что и всћ химическія соединенія”.
Чтобы вы могли лучше выяснить себћ идеи Кекуле, я приведу здћсь нћкоторыя предложенныя имь формулы:
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сульфобензойная кислота. |
Сульфобензидъ. |
Дымящая сћрная кислота. |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
Изэтіоновая |
Карбилъ-сульфатъ. |
Сульфобензойная кислота. |
Интересно, что Кекуле пользуется реакціей съ хлористымъ фосфоромъ, чтобы отличить другъ отъ друга Кекуле указываетъ, какъ при помощи этого реактива кислородъ воды замћняется двумя атомами хлора, вслћдствіе чего молекулы, соотвћтствующія этому типу, распадаются, тогда какъ молекулы, производныя отъ типа водорода сохраняются: {209}
этилсћрная кисл. |
|
образуетъ |
|
а сульфобензольная кисл. |
|
даетъ |
|
Только благодаря теоріи смћшанныхъ типовъ, этому наиболће крайнему выводу изъ всего ученія, система Жерара могла получить ту цћльную форму, въ которой она въ продолженіе ряда лћтъ господствовала въ органической химіи. Но когда была познана идея типовъ7), эти послћдніе стали уже ненужными. Теорія типовъ была лишь формальнымъ построеніемъ, потерявшимъ значеніе, лишь только было понято ея содержаніе. Эта теорія была, однако, необходима для послћдующаго развитія ученія объ атомности. Въ этомъ направленіи наиболће дћятельное участіе приняли Вильямсонъ, Вюрцъ, Одлингъ и особенно Кекуле, т.-е. изслћдователи, принимавшіе существенное участіе въ установленіи теоріи типовъ. Впрочемъ, одновременно съ ними, но совершенно съ другой стороны, а именно противниками Жерара и послћдователями Берцеліуса, было сдћлано для развитія вышеуказанныхъ взглядовъ много существеннаго въ смыслћ теоретической и экспериментальной разработки вопроса. Поэтому раньше чћмъ обратиться къ теоріи атомности и къ вытекающимъ изъ нея взглядамъ на взаимоотношенія между атомами, мы должны ближе разсмотрћть труды этой школы, возникшей на развалинахъ теорій Берцеліуса.
Но прежде позвольте мнћ вернуться къ далекому прошлому и указать на факты, которые, какъ мнћ кажется, привели отъ сочетанныхъ соединеній Берцеліуса къ важнымъ взглядамъ Кольбе.
Въ началћ 30хъ годовъ Маршанъ доказалъ8), что соли сћрновинной кислоты, высушенныя въ безвоздушномъ пространствћ надъ сћрной кислотой, соотвћтствуютъ старой формулћ Серулласа9) C4H8 + 2SO3 + МО + H2O, (C =12, S = 32, O = 16). Либихъ подтвердилъ это10) и такимъ путемъ пришелъ къ тому, чтобы признать этилсћрную кислоту изомерной съ изэтіоновой11). Ho онъ обнаружилъ {210} существенныя отличія въ отношеніи обћихъ кислотъ къ ћдкому кали. Въ то время какъ первая кислота уже при кипяченіи съ ћдкимъ кали превращалась въ алкоголь и сћрнокислый калій, разложеніе второй происходило лишь при плавленіи съ ћдкимъ кали, при чемъ получались соли сћрной и сћрнистой кислотъ. Эта реакція побудила Либиха предположить въ изэтіоновой кислотћ присутствіе сћрноватой (дитіоновой) кислоты. БерцелІусъ, присоединившись къ этому взгляду, воспользовался имъ, чтобы раздћлить на два класса вещества, образующіяся при дћйствіи сћрной кислоты на органическія вещества12).
Въ 1844 г. Кольбе пытался согласовать со взглядами Берцеліуса остроумную мысль Митчерлиха13), считавшаго, что сульфодериваты аналогичны обыкновеннымъ кислотамъ: первые онъ разсматривалъ, какъ соединенія сћрной кислоты, а послћднія, какъ углекислыя соединенія14). Въ то время Кольбе былъ занятъ изслћдованіемъ открытаго Берцеліусомъ и Марсе15) вещества, образующагося при дћйствіи хлора на сћрнистый углеродъ. Кольбе установилъ для него формулу CC12SO2 (C = 6, O = 8, S =16) и назвалъ его сћрнисто-кислымъ хлоридомъ углерода (schwefligsaures Kohlenchlorid). Обрабатывая это тћло ћдкимъ кали, онъ превратилъ его въ трихлорметил-сульфоновую кислоту, которая, въ свою очередь, посредствомъ реакціи Мельсана16), т.-е. при дћйствіи водорода in statu nascendi, можетъ быть превращена въ дихлормуравьино-сћрноватую, хлормуравьиносћрноватую и муравьино-сћрноватую кислоты. Кольбе разсматриваетъ эти соединенія, какъ сћрноватую (дитіоновую) кислоту, сочетанную съ трихлорформиломъ, дихлорформиломъ, хлорформиломъ и формиломъ. Онъ пишетъ:
C2Сl3 + S2O5 + HO |
хлористо-углеродно-сћрноватая кислота, |
C2HСl2 + S2O5 + HO |
дихлорформилъ-сћрноватая кислота, |
C2H2Cl + S2O5 + HO |
хлорформилъ-сћрноватая кислота, |
C2H3 + S2O5 + HO |
формилъ-сћрноватая кислота. |
Подобнымъ же способомъ Кольбе удалось произвести синтезъ трихлоруксусной кислоты: именно обработкой тетрахлорэтилена (Еіnfachchlorkohlenstoff = C2C4) хлоромъ при солнечномъ свћтћ въ присутствіи {211} воды. Такимъ образомъ онъ открылъ тћ данныя, которыя послужили основой для предположенія Берцеліуса о присутствіи хлористаго углерода въ трихлоруксусной кислотћ, что послужило существенной поддержкой для всей этой точки зрћнія. Вмћстћ съ тћмъ выяснилась аналогія между открытымъ Дюма тћломъ и сћросодержащими соединеніями, полученными Кольбе: трихлоруксусная кислота по теоріи Берцеліуса имћла формулу C2Сl3 + C2O3 + HO. Это было не что иное, какъ сочетанная щавелевая кислота, а всћ другія были сочетанными сћрноватыми кислотами.
Кольбе, какъ раньше Берцеліусъ, допускаетъ теперь возможность замћщенія водорода хлоромъ въ сочетанныхъ соединеніяхъ. Что подобное замћщеніе возможно безъ существеннаго измћненія свойствъ тћлъ, Кольбе объясняетъ тћмъ, что природа сочетаннаго соединенія оказываетъ лишь второстепенное вліяніе на характеръ соединенія. Кольбе, конечно, понялъ, то чего никогда не допускалъ Берцеліусъ, — что такимъ образомъ онъ принимаетъ существенный пунктъ теоріи замћщенія.
Мнћ кажется необходимымъ подчеркнуть то обстоятельство, что Кольбе, а также и Франкландъ, взгляды котораго въ то время вполнћ гармонировали со взглядами Кольбе, понимали еще радикалъ въ его прежнемъ значеніи. Они вћрили въ предсуществованіе извћстныхъ атомныхъ группъ въ соединеніяхъ и потому сильно расходились съ предположеніемъ Жерара, что можно допускать существованіе въ одномъ тћлћ различныхъ радикаловъ. Какъ Кольбе, такъ и Франкландъ задаются цћлью опредћлить строеніе соединеній, и въ этомъ отношеніи они существенно отличаются отъ послћдователей теоріи типовъ, которые, за исключеніемъ Бильямсона17), писали лишь формулы реакцій или превращеній.
Съ предположеніемъ о существованіи въ сложныхъ веществахъ обособленныхъ группъ была также связана идея о возможности изолировать послћднія, и поэтому уже въ 1848 г. Кольбе и Франкландъ производили опыты съ цћлью отдћлить радикалы18); особенно желательнымъ Кольбе считалъ разложеніе уксусной кислоты на ея сочетанныя части, на метиловую и щавелевую кислоты. Съ помощью электрическаго тока ему удалось изолировать, по крайней {212} мћрћ, одинъ радикалъ19). Подъ вліяніемъ электрическаго тока уксусная кислота разлагается на метилъ и углекислоту. По мнћнію Кольбе, реакція протекаетъ такимъ образомъ, что сперва отдћляются другъ отъ друга сочетанныя части, а затћмъ щавелевая кислота превращается въ углекислоту на счетъ кислорода воды, что гюдтверждалось, повидимому, одновременнымъ выдћленіемъ водорода.
Въ пользу мнћнія Кольбе и Франкланда говорилъ способъ полученія ціанметила, найденный незадолго передъ тћмъ Дюма и состоявшій въ нагрћваніи уксуснокислаго амміака съ безводной фосфорной кислотой20), а также превращеніе нитриловъ въ соотвћтствующія кислоты, произведенное Франкландомъ и Кольбе21).
Франкланду казалось, что, изолировавъ этилъ изъ іодистаго этила съ помощью цинка22), онъ устранилъ всякое сомнћніе въ правильности взглядовъ своихъ и Кольбе. Теорія этила въ той формћ, въ которой ее въ 1835 г. установилъ Либихъ, должна была теперь вновь занять свое прежнее мћсто. „Изолированіе сложныхъ радикаловъ служило по Франкланду, полнымъ и удовлетворительнымъ до казательствомъ правильности этой теоріи”23).
Этотъ рядъ изслћдованій, произведенныхъ въ промежутокъ времени отъ 1844 до 1850 г., реабилитировалъ теорію сочетанныхъ соединеній. Хотя она, какъ казалось, оправдывалась пока реакціями лишь для одного класса тћлъ, но зато это были именно тћ наиболће важныя соединенія, которыя побудили Берцеліуса установить свою теорію. Опытъ показалъ, что предположеніе о существованіи метила въ уксусной кислотћ, хлористаго углерода въ трихлоруксусной, этила въ алкоголћ и т. д. имћло свои основанія, и вскорћ стало очевиднымъ, что путь, на который вступили Кольбе и Франкландъ, долженъ былъ привести еще ко многимъ блестящимъ открытіямъ.
Франкландъ, занимаясь изолированіемъ этила изъ іодистаго этила, открылъ цинкъ-этилъ24), вещество, заслуживавшее весьма большого вниманія какъ по своимъ физическимъ, такъ и химическимъ свойствамъ. Послћ открытія этого соединенія усилія многихъ химиковъ были направлены на то, чтобы использовать его для {213} различныхъ синтезовъ25), и если это соединеніе и не оправдало всћхъ надеждъ, возлагавшихся на него, то все же можно сказать, что въ органической химіи мало есть веществъ, которыми пользовались бы въ то время такъ много для изслћдованій. За открытіемъ цинкъ-этила послћдовало полученіе другихъ металло-органичесхихъ радикаловъ. Такъ, мы обязаны Вёлеру открытіемъ теллуръ-этила26), соединенія сурьмы были найдены Лёвигомъ и Швейцеромъ27); органическія соединенія олова были открыты Франкландомъ28) и одновременно Лёвигомъ29); этилатъ-ртути былъ полученъ Франкландомъ30), этилатъ-алюминія — Кагуромъ31), но изученъ впервые лишь Буктономь и Одлингомъ32). Очень важнымъ оказалось затћмъ открытіе этилатовъ калія и натрія, сдћланное Ванклиномъ33); Фридель и Крафтъ34) получили кремній-этилъ и т. д.
Я намћренно упомянулъ здћсь объ этихъ соединеніяхъ, такъ какъ они безусловно оказали вліяніе на дальнћйшее развитіе теоріи сочетанныхъ радикаловъ. Кольбе первый далъ правильное объясненіе какодила, онъ называетъ его метиломъ, находящимся въ сочетаніи съ мышьякомъ  СН3
СН3
Подобное же воззрћніе Кольбе кладетъ въ основу теоріи всћхъ органическихъ соединеній; они всћ содержатъ сочетанные радикалы, а именно радикалы, сочетанные большею частью съ углеродомъ. Такъ, напримћръ, радикаломъ уксусной кислоты и родственныхъ ей соединеній Кольбе считаетъ радикалъ  C2Н3
C2Н3
(C2H3) |
альдегидъ, |
||||
(C2H3) |
уксусная кислота, |
||||
(C2H3) |
хлористый ацетилъ Реньо37 |
||||
(C2H3) |
{ |
|
ацетамидъ (C = 6, O = 8) |
||
Хотя формула уксусной кислоты Кольбе и не отличается существенно отъ формулы Берцеліуса, тћмъ не менће точка зрћнія, лежащая въ основаніи этихъ символовъ, содержала много новаго и цћннаго. Кольбе, напримћръ, обратилъ теперь вниманіе на то, что четыре углеродныхъ эквивалента уксусной кислоты (эквивалентъ въ смыслћ Гмелина) неравноцћнны; два изъ нихъ входятъ въ ея составъ въ видћ метила, тогда какъ другіе два эквивалента служатъ точкой приложенія для силы сродства кислорода.
Изъ формулы уксусной кислоты посредствомъ замћны метила этиломъ, пропиломъ, амиломъ и т. д., получаются формулы другихъ жирныхъ кислотъ. Въ бензойной кислотћ радикалъ фенилъ заступаетъ мћсто метила уксусной кислоты. Вообще, Кольбе, подобно Жерару, пользуется такъ называемыми гомологичными и изологичными радикалами, считая ихъ равноцћнными группами.
Въ алкоголћ, для котораго Кольбе даетъ такую же формулу, какъ и Либихъ, а именно (C4Н5) O, НО, но съ другими атомными вћсами, предполагается существованіе радикала этила; при окисленіи этотъ радикалъ расщепляется на C2Н3 и C2H2; послћдній же превращается дальше въ C2O2. По сравненію съ интерпретаціей Вильямсона, это объясненіе кажется сложнымъ, но впослћдствіи оно привело къ важнымъ выводамъ (ср. 12-ую лекцію).
Кольбе приписывалъ монохлоруксусной кислотћ Леблана38) и трихлоруксусной кислотћ Дюма слћдующія формулы:
HO |
( |
C2 |
{ |
|
} |
) |
|
C2, O3 и HO(C2Cl3) |
Значительно сложнће оказываются символы для соединеній, образующихся при дћйствіи сћрной кислоты на органическія кислоты. Способъ обозначенія ихъ приближается къ формуламъ, введеннымъ Дюма {215} и Пиріа для „acides conjuges”39). Такъ, напримћръ, формула сульфоуксусной кислоты слћдующая:
2HO |
{ |
C2 |
{ |
|
} |
|
C2, O3 |
} |
Въ то время Кольбе еще не рћшилъ, долженъ ли онъ допустить возможность существованія двухосновныхъ кислотъ, и потому онъ пока удержалъ старыя формулы; такимъ образомъ,
щавелевая кислота имћла формулу |
HO, C2O3, |
|
а янтарная кислота |
HO, (C2H2) C2O3 |
Слћдуетъ упомянуть то обстоятельство, что Кольбе допускаетъ существованіе кислородныхъ радикаловъ въ анисовой и салициловой кислотахъ, и, слћдовательно, въ этомъ пунктћ онъ тогда расходился съ Берцеліусомъ.
Наряду съ сочетанными металлическими и углеродными радикалами Кольбе признаетъ еще радикалы, содержащіе сћру; вслћдствіе этого сохраняется уже раньше указанная аналогія между обыкновенными кислотами и сульфокислотами. Такъ, напримћръ,
HO (C2Cl3) |
HO (C2Cl3) |
|
хлоруглеродсћрноватая кислота |
хлоруглеродщавелевая кислота |
Разсмотрћнное здћсь изслћдованіе Кольбе служитъ вполнћ законченнымъ основаніемъ химической системы, которую я здћсь могъ привести лишь въ существенныхъ чертахъ. Онъ старался удержать теорію радикаловъ, но представленіе о нихъ подверглось уже существеннымъ измћненіямъ. Теперь, напримћръ, оказалось необходимымъ допустить въ нихъ способность къ замћщеніямъ, вслћдствіе чего они вышли изъ того исключительнаго положенія, которое они занимали до сихъ поръ. Кромћ того, пришлось еще присоединить сочетанные радикалы, которые, конечно, не получили точнаго опредћленія.
Кольбе старался спасти электрохимическую теорію, но онъ долженъ былъ сдћлать весьма существенныя уступки противникамъ Берцеліуса. Составныя части соединенія должны быть электрически противоположны, но остается нерћшеннымъ вопросъ, какая изъ составныхъ частей будетъ положительной, и какая отрицательной, {216} такъ какъ Кольбе предполагаетъ, что одинъ и тотъ же элементъ можетъ обладать различными электрохимическими свойствами. Такое предположеніе находитъ себћ оправданіе въ фактћ существованія аллотропическихъ видоизмћненій элементовъ. Но именно тотъ пунктъ, въ которомъ Кольбе сдћлалъ уступку, былъ какъ разъ центромъ спора, и поэтому вновь сдћлалось очевиднымъ, что теорія Берцеліуса въ ея прежней формћ не можетъ болће удержаться.
За исключеніемъ Франкланда, у Кольбе было не много извћстныхъ сторонниковъ, и когда первый въ 1852 г. ввелъ существенныя измћненія въ понятіе о парныхъ соединеніяхъ, то и Кольбе, считаясь съ фактами, былъ вынужденъ видоизмћнить свои воззрћнія. Новыя гипотезы, имъ предложенныя, значительно болће приближаются къ теоріи типовъ, несмотря на то, что способъ его выраженія и обозначенія сохранили свойственныя ему особенности. Въ отношеніи основныхъ принциповъ система Кольбе уступаетъ системћ, предложенной Жераромъ, главнымъ образомъ потому, что въ ней нћтъ различія между понятіями молекула, атомъ и эквивалентъ; но она имћетъ и преимущества передъ системой Жерара, которыя, по моему мнћнію, главнымъ образомъ, заключаются въ томъ, что формуламъ отнынћ стали придавать бóльшее значеніе, а также и въ томъ, что углеродистые радикалы были подраздћлены на болће простыя группы.
Я выше (стр. 211) замћтилъ, что по мнћнію Кольбе радикалъ, входящій въ составъ парнаго соединенія, долженъ оказывать лишь второстепенное вліяніе на природу соединенія. Въ 1852 г. Франкландъ подвергнулъ это положеніе критикћ40), и ему удалось убћдить Кольбе въ его несостоятельности.
Франкландъ доказываетъ справедливость своихъ взглядовъ въ особенности ссылкой на содержащіе металлъ радикалы. Въ сочетанномъ соединеніи мышьяка съ метиломъ первый, по его мнћнію, измћняетъ свою емкость насыщенія. Тогда какъ въ свободномъ состояніи мышьякъ обладаетъ способностью соединяться съ 5 атомами кислорода, какодилъ въ своей наиболће высокой степени окисленія содержитъ лишь 3 атома кислорода. To же самое можно сказать объ остальныхъ органическихъ соединеніяхъ металловъ, и {217} это приводитъ Франкланда къ слћдующимъ важнымъ замћчаніямъ41): „Если разсматривать формулы неорганическихъ химическихъ соединеній, то даже поверхностный наблюдатель ясно замћтитъ господствующую во всћхъ этихъ формулахъ симметрію. Въ особенности соединенія азота, фосфора, мышьяка и сурьмы указываютъ на склонность этихъ элементовъ образовывать соединенія, содержащія 3 или 5 эквивалентовъ другихъ элементовъ, и именно въ этихъ отношеніяхъ происходитъ наиболће полное удовлетвореніе сродствъ этихъ элементовъ. Такъ, въ соединеніяхъ NO3, NH3, NS3, PO3, PH3, PCl3, SbO3, SbCl3, AsH3, AsO3, AsCl3, и др. отношеніе эквивалентовъ равно 1:3, а въ соединеніяхъ HO5, NH4O, NH4J, PO5, PH4J и др. отношеніе эквивалентовъ равно 1:5.
„He желая предлагать никакихъ гипотезъ относительно причины этого совпаденія въ группировкћ атомовъ, мы, однако, ясно видимъ изъ только-что приведенныхъ примћровъ, что въ нихъ господствуетъ такая тенденція или закономћрность и что сродство вступающаго въ соединеніе атома названныхъ элементовъ нacыщается всегда однимъ и тћмъ же числомъ присоединяющихся атомовъ, независимо отъ ихъ химическаго характера. Дћйствіе этой закономћрности, замћченное въ болће сложныхъ органическихъ группахъ, и побудило, вћроятно, Лорана и Дюма установить теорію типовъ. Если бы эти замћчательные химики не распространили своихъ воззрћній за предћлы, въ которыхъ извћстные тогда факты могли оказать имъ поддержку, если бы они не сдћлали предположенія, что свойства органическаго соединенія зависятъ лишь отъ положенія и никоимъ образомъ отъ природы отдћльныхъ атомовъ, то ихъ теорія несомнћнно способствовала бы еще въ большей степени развитію нашей науки. Подобное предположеніе могло возникнуть лишь въ эпоху, когда факты, на которые оно опиралось, были немногочисленны и не вполнћ изучены; но когда изслћдованіе явленій замћщенія подвинулось впередъ, сдћланное предположеніе оказалось неосновательнымъ, и вновь выступили основныя положенія электрохимической теоріи. Образованіе и изслћдованіе органическихъ соединеній, содержащихъ металлы, обћщало способствовать примиренію этихъ двухъ теорій, которыя столь долгое время разъединяли химиковъ и которыя слишкомъ поспћшно были признаны несовмћстимыми. Дћйствительно, если, съ одной стороны, {218} намъ ясно, что существуютъ извћстные типы рядовъ соединеній, то, съ другой стороны, не менће очевидно, что природа тћла, происходящаго отъ основного типа, существенно зависитъ отъ электрохимическаго характера содержащихся въ немъ отдћльныхъ атомовъ, а не исключительно отъ относительнаго положенія этихъ атомовъ”. Въ заключеніе авторъ указываетъ, что42) „стибэтинъ (сурьмянистое соединеніе ацетилена, или этина) служитъ замћчательнымъ примћромъ упомянутой уже закономћрности образованія соединеній по симметричнымъ формуламъ, и что онъ доказываетъ возможность образованія пятиатомной группы изъ группы, содержащей три атома, такъ какъ онъ въ состояніи соединяться съ двумя атомами химически сходнаго или противоположнаго характера”.
Такимъ образомъ Франкландъ отказался отъ идеи о сочетанныхъ соединеніяхъ. Какодилъ онъ разсматриваетъ теперь, какъ сћрнистый мышьякъ, въ которомъ оба атома сћры замћщены 2 метиловыми группами. Франкландъ признаетъ теорію типовъ, но въ нћсколько измћненной формћ. Хотя онъ думаетъ, что существенно расходится съ наиболће послћдовательными сторонниками этой теоріи, такъ какъ не признаетъ подобно имъ, „что свойства соединенія зависятъ отъ расположенія, а отнюдь не отъ природы отдћльныхъ атомовъ”, тћмъ не менће я въ этомъ не могу вполнћ съ нимъ согласиться. Co времени изслћдованій Гофманна43) о замћщенныхъ основаніяхъ, даже самъ Лоранъ не усматривалъ болће въ понятіи замћщенія того абсолютнаго значенія, которое онъ ему нћкогда придавалъ44). Хлорированные эфиры45), еще раныие полученные Малагути, никоимъ образомъ не могли быть вполнћ согласованы съ представленіемъ о полнћйшей неизмћняемости типа, и если Вильямсонъ относитъ къ типу воды эфиръ, алкоголь и уксусную кислоту, то было вћдь очевидно, что слово типъ онъ употреблялъ скорће въ смыслћ механическаго типа, чћмъ химическаго.
Эта статья Франкланда явилась первымъ шагомъ къ сближенію обћихъ, до той поры разъединенныхъ, школъ, и открыла путь къ взаимному пониманію. Сдћланный шагъ долженъ былъ привести къ сліянію различныхъ взглядовъ, изъ которыхъ впослћдствіи {219} развилась теорія валентности. Для послћдователей теоріи типовъ переходъ на ихъ сторону Франкланда былъ большимъ пріобрћтеніемъ, такъ какъ онъ принесъ имъ новыя воззрћнія, которыя могли быть превосходно утилизированы. Я не буду утверждать, что послћдователи теоріи типовъ не могли бы и самостоятельно сдћлать послћдній великій шагъ, а именно, различать атомы по ихъ валентности. Но судя по тому, какъ идеи въ дћйствительности развивались, едва ли можно отрицать вліяніе Кольбе, и въ особенности Франкланда, на представителей школы Жерара Вильямсона (Вюрцъ, Кекуле и Одлингъ). Обћ теоріи были необходимы, чтобы придать формуламъ то значеніе, которые онћ впослћдствіи пріобрћли, тћмъ болће, что Вильямсонъ, единственный въ то время химикъ, не желавшій довольствоваться писаніемъ формулъ превращеній, пересталъ принимать участіе въ дальнћйшемъ развитіи химіи.
Цћлесообразно было бы изложить вамъ теперь 'же подготовленный Франкландомъ переходъ отъ теоріи сочетанныхъ соединеній къ теоріи типовъ; когда же я перейду къ атомистическимъ воззрћніямъ и къ структурнымъ формуламъ, мнћ останется только коснуться взглядовъ Кольбе, и тогда я лучше смогу выяснить вамъ его вліяніе.
He легко было Кольбе слћдовать за Франкландомъ въ новћйшихъ стадіяхъ развитія его идей. Предположить, что сродство элементовъ всегда насыщается однимъ и тћмъ же числомъ атомовъ, независимо отъ ихъ химическаго характера, для Кольбе было равносильно совершенному отказу отъ электрохимической теоріи и признанію, что электрохимическая природа элементовъ не имћетъ никакого вліянія на образованіе соединеній. На это Кольбе не могъ рћшиться сразу46). Въ своемъ руководствћ онъ пытается, соглашаясь съ предпосылками аргументаціи Франкланда, связать ихъ съ помощью новыхъ гипотезъ съ основными электрохимическими положеніями47), и лишь въ 1857 г. онъ вполнћ присоединяется къ {220} воззрћніямъ Франкланда48), которыя онъ далће развиваетъ и примћняетъ особенно къ органической химіи. Но подробное изложеніе выработанныхъ такимъ путемъ воззрћній онъ даетъ лишь въ 1859 г., въ статьћ, весьма богатой новыми идеями („Ober den Zusammenhang der organischen und anorganischen Verbindungen”49).
Франкландъ сравнивалъ радикалы, содержащіе металлы, съ соотвћтствующими окисями. Кольбе же теперь выражается слћдующимъ образомъ: „Органическія вещества являются вообще производными неорганическихъ соединеній и частью образуются изъ нихъ посредствомъ простыхъ замћщеній”. Развивая мысль, вскользь высказанную нћкогда Либихомъ50), онъ выводитъ углеродистыя соединенія отъ угольной кислоты, сћрнистыя же соединенія отъ сћрной кислоты. Экспериментальныя основанія для этихъ воззрћній принадлежатъ частью Митчерлиху51), частью ему самому (ср. стр. 210), частью же Ванклину52), которому удалось получить пропіоновую кислоту изъ натрій-этила и угольной кислоты.
Уже въ то время Кольбе пользовался такъ же, какъ и долгое время спустя, атомными или эквивалентными вћсами Гмелина, одновременно принимая для большинства соединеній молекулярныя величины согласно опредћленіямъ Жерара, Лорана и Вильямсона. {221} Поэтому формулу угольной кислоты онъ писалъ C2O4 и, повидимому, отъ этого ангидрида производитъ органическія соединенія, какъ кислоты, альдегиды, ацетоны, спирты и т. д. Я говорю „повидимому”, такъ какъ впослћдствіи покажу, что въ дћйствительности это не было такъ; но сперва я изложу систему Кольбе въ той формћ, которой онъ пользовался самъ.
Въ угольной кислотћ различаются интра и экстрарадикальные кислородные атомы. Формулу ея поэтому писали (C2O2)O2 считая окись углерода радикаломъ угольной кислоты. Если одинъ экстра-радикальный атомъ ея кислорода замћнить водородомъ или радикаломъ алкоголя, то получается рядъ жирныхъ кислотъ:
HO, H |
(C2O2)O |
муравьиная кислота, |
||
HO, C2H3 |
(C2O2)O |
уксусная кислота и т. д. |
Если же и второй атомъ кислорода будетъ замћщенъ радикаломъ спирта, то образуется кетонъ, а если онъ замћщенъ водородомъ, то получается альдегидъ:
|
} |
C2O2 альдегидъ |
|
} |
C2O2 ацетонъ. |
При замћщеніи трехъ атомовъ кислорода тремя атомами водорода или же двумя атомами водорода и однимъ радикаломъ получаются спирты
HO, |
H3, |
C2, |
O |
. . | метиловый спиртъ |
|||
HO, |
|
C2, |
O |
. . | этиловый спиртъ и т. д. |
Если мы ближе разсмотримъ, какъ выводятся эти формулы, то увидимъ, что пріемъ Кольбе не вполнћ правиленъ. При замћщеніи водородомъ одного атома кислорода угольной кислоты образуется HC2O3, а не муравьиная кислота. Кольбе то прибавляетъ, то отбрасываетъ НО, слћдуя въ этомъ неправильномъ пріемћ дуалистамъ. Онъ обосновываетъ, правда, свой пріемъ предположеніемъ, что основность соединенія (а, слћдовательно, и число группъ НО) опредћляется числомъ экстрарадикальныхъ атомовъ кислорода; такъ, азотная кислота одноосновна, такъ какъ формула ея (NO4)O; сћрная кислота — двухосновна, такъ какъ она содержитъ два экстрарадикальныхъ атома кислорода (S2O4)O; фосфорная же кислота трехосновна (PO2)O3. {222}
Такъ какъ по такой интерпретаціи каждый атомъ кислорода внћ радикала соединенъ съ НО, то въ случаяхъ, когда Кольбе говоритъ о замћщеніи такого атома, въ дћйствительности замћщается всегда О + ОН = O2Н, и при такомъ пониманіи разсужденіе оказывается строго логичнымъ. Но тогда надо исходить отъ гипотетическаго гидрата угольной кислоты 2НO, (C2O2)O2.
При замћщеніи
O2H |
черезъ |
H |
получается |
HO, H(C2O2)O муравьин. кислота, |
||||||
O2H |
„ |
C2H3 |
„ |
HO, H(C2H3)(C2O2)O уксусн. кислота, |
||||||
2O2H |
„ |
H2 |
„ |
|
метилъ-альдегидъ, |
|||||
2O2H |
„ |
(C2H3)2 |
„ |
|
ацетонъ, |
|||||
O2H |
H и O2 |
черезъ H2 |
„ |
HO, H3C2, O метиловый спиртъ. |
||||||
O2H |
C2H3 и O2 |
черезъ H2 |
„ |
HO, |
|
C2, O, этилов. спиртъ. |
||||
При переходћ спиртовъ въ соотвћтствующія кислоты оба водорода опять замћщаются эквивалентами кислорода. Взглядъ Кольбе теперь оказывается болће опредћленнымъ, чћмъ Вильямсона. Въ то время какъ послћдній предполагаетъ, что радикалъ C2H5 (C = 12) переходитъ въ C2H3O, по мнћнію Кольбе
изъ |
C2 |
{ |
|
образуется C2 |
|
Это различіе существенно, и оно даетъ возможность Кольбе предсказать новый классъ спиртовъ, о чемъ онъ объявляетъ въ слћдующихъ словахъ53) „Если разсматривать тћ формулы, которыми я выразилъ раціональный составъ уксусной кислоты и соотвћтствующихъ ей альдегида и спирта, а именно:
HO |
(C2H3) |
(C2O2) |
O |
уксусная кислота, |
|||
|
C2O |
альдегидъ, |
|||||
HO |
|
C2O |
спиртъ |
то съ перваго взгляда становитсяпонятным, какимъ образомъ изъ пяти атомовъ водорода въ окиси этила алкоголя при окисленіи {223} послћдняго замћщаются лишь два атома водорода, а въ альдегидћ замћщается лишь одинъ атомъ водорода. Именно тћ атомы водорода, которые занимаютъ въ спиртћ и альдегидћ самостоятельное положеніе, подвергаются окисляющимъ вліяніямъ и значительно болће доступны дћйствію кислорода, чћмъ остальные атомы водорода, болће прочно связанные въ метиловомъ радикалћ.
Вышеприведенное представленіе о химической конституціи спиртовъ открываетъ намъ перспективу полученія новаго класса веществъ, которыя, будучи очень близки спиртамъ по своему составу, должны, по всей вћроятности, имћть также нћкоторыя общія съ ними свойства, но въ нћкоторыхъ другихъ существенныхъ пунктахъ должны отъ нихъ отличаться”.
Эти новыя вещества тоже могутъ получаться изъ угольной кислоты или изъ жирныхъ кислотъ посредствомъ замћщенія. Такъ, напримћръ,
2HO |
(C2O2), |
O2 |
угольная кислота, |
||||
HO |
C2H3, |
(C2O2) |
O |
уксусная кислота, |
|||
HO |
|
C2, O |
спиртъ, одинъ разъ метилированный, |
||||
HO |
(C2H3)3 |
C2, O |
спиртъ, дважды метилированный. |
||||
Кольбе предсказываетъ даже химическія свойства этихъ гипотетическихъ веществъ, а именно, по его мнћнію, спиртъ, одинъ разъ метилированный, долженъ дать при окисленіи ацетонъ посредствомъ реакціи, которая аналогична переходу нормальныхъ спиртовъ въ альдегиды:
HO |
|
C2, O |
даетъ |
|
C2O2 альдегидъ, |
|||||||
HO |
|
C2, O |
даетъ |
|
C2O2 ацетонъ |
Эти предположенія подтвердились блестящимъ образомъ и оказали вслћдствіе этого рћшающее вліяніе на развитіе ученія о конституціи. Поэтому я въ слћдующей лекціи вернусь къ нимъ опять.
Кольбе теперь допускаетъ возможность существованія многоосновныхъ кислотъ; по его мнћнію, онћ образуются изъ двухъ „атомовъ” угольной кислоты посредствомъ замћщенія двухъ экстра-радикальныхъ атомовъ кислорода (слћдовательно, двухъ группъ O2Н) {224} двухатомными радикалами, какъ этиленъ, фениленъ и др.54). Примћрами такихъ кислотъ служатъ:
янтарная кислота 2HO(C4H4) |
|
O2 |
|||
фталевая кислота 2HO(C12H4) |
|
O. |
Такимъ же образомъ трехосновныя кислоты производятся отъ трехъ атомовъ угольной кислоты замћщеніемъ трехъ атомовъ кислорода трехатомными радикалами.
Изъ остальныхъ въ высшей степени интересныхъ разсужденій, содержащихся въ статьћ Кольбе, я упомяну еще о его взглядћ на сульфокислоты. Въ этихъ соединеніяхъ теперь вновь выступаетъ выдвигавшаяся еще ранће аналогія съ карбоновыми кислотами. Подобно тому какъ послћднія образуются изъ углекислоты, первыя являются производными сћрной кислоты. Такимъ образомъ:
2HO(S2O4)O2 . . |
сћрная кислота, |
HO(C2H3)(S2O4)O . . |
метилъ-сћрная кислота, |
HO(C12H5)(S2O4)O . . |
сульфобензоловая кислота. |
Двухосновныя сульфокислоты образуются изъ двухъ атомовъ сћрной кислоты:
2HO(C2H2) |
|
O2 |
дисульфометоловая кислота, |
||||
2HO(H12H4) |
|
O2 |
дисульфобензоловая кислота. |
Кромћ того, Кольбе извћстны еще промежуточныя кислоты, производныя одного атома угольной кислоты и одного атома сћрной; сюда относятся уксусносћрная и бензойносћрная кислоты:
2HO(C2H2) |
|
O2 |
уксусносћрная кислота, |
||||
2HO(C12H4) |
|
O2 |
бензойносћрная кислота. |
Эта интерпретація даетъ простое объясненіе наблюдавшемуся Буктономъ и Гофманномъ превращенію уксусносћрной кислоты {225} (собственно ацетонитрила) въ дисульфометоловую кислоту при обработкћ сћрной кислотой55). При этомъ C2O2 замћняется черезъ S2O4.
Я не могу здћсь входить въ разсмотрћніе другихъ пунктовъ этой столь важной статьи, но я совћтую вамъ изучить ее, такъ какъ она полна геніальныхъ идей. Правда, этотъ трудъ содержитъ также мнћнія, съ которыми я не могу согласиться. Такъ, напримћръ, понятіе многоатомности Кольбе употреблялъ не въ томъ смыслћ, въ какомъ его установилъ Вильямсонъ, иначе онъ не сталъ бы спрашивать, почему не существуетъ также аминокислотъ съ одноосновнымъ радикаломъ, если отнести ихъ, какъ это дћлали Жераръ и Кекуле, къ типу NH3 + Н2O56). Поэтому не можетъ быть никакихъ споровъ о томъ, кому принадлежитъ пріоритетъ въ открытіи четырехатомности углерода: Кольбе или Кекуле. Если за Кольбе числятся неоспоримыя заслуги въ установленіи формулъ строенія или, какъ ихъ называютъ по Бутлерову, структурныхъ формулъ, то все же его участіе въ развитіи понятія атомности (валентности или значности) элементовъ и радикаловъ было незначительно; по моему мнћнію, оно было такимъ потому, что онъ не дћлалъ различія между молекулой, атомомъ и эквивалентомъ и, какъ это слћдуетъ изъ всего вышесказаннаго, не усвоилъ еще тогда представленія о связи посредствомъ многоатомныхъ радикаловъ.
Ученіе о значности могло и должно было возникнуть тогда, когда стали отличать атомъ отъ эквивалента. Разъ атомы не равно цћнны, то неизбћжно долженъ возникнуть вопросъ о значности одного по отношенію къ другому. Поэтому первый шагъ въ области атомныхъ воззрћній сдћлали тћ ученые, которые впервые разграничили вышеупомянутыя понятія, и заслуги въ этомъ отношеніи принадлежатъ Дюма, Либиху и Лорану. Тогда какъ благодаря явленіямъ замћщенія было понято, что элементы имћютъ различную цћнность, теорія многоосновныхъ кислотъ привела къ понятію многоатомныхъ радикаловъ. Оба воззрћнія существовали совмћстно продолжительное время, не оказывая существеннаго вліянія другъ на друга до тћхъ поръ, пока, благодаря Кекуле, не наступило ихъ сліяніе, т.-е. значность радикаловъ была объяснена посредствомъ значности элементовъ. {226}
Мы видћли уже въ послћдней лекціи57), какимъ путемъ Вильямсонъ пришелъ къ установленію понятія многоатомныхъ радикаловъ. Онъ воспользовался этимъ понятіемъ, чтобы объяснить образованіе химическихъ соединеній, такъ какъ, по его мнћнію, многоосновные радикалы обладаютъ способностью связывать нћсколько атомныхъ группъ. Въ то время лишь немногіе понимали все значеніе словъ Вильямсона и лишь немногіе распознали, какое широкое толкованіе можно было имъ придавать. Къ числу этихъ немногихъ принадлежалъ Кекуле, который своимъ проницательнымъ умомъ тотчасъ же постигъ все значеніе идей Вильямсона и воспользовался ими для объясненія открытой имъ въ 1853 г. тіоуксусной кио лоты58).
Кекуле сравниваетъ реакціи пятихлористаго и сћрнистаго фосфора съ уксусной кислотой, выражая ихъ слћдующими уравненіями:
5 |
|
+ P2S5 = 5 |
|
S + |
P2O5 |
||||||
5 |
|
+ 2PCl5 = |
|
+ P2O5 |
|||||||
(C = 12, O = 16, S = 32 и т. д.).
Въ связи съ этимъ онъ замћчаетъ: „Схема показываетъ соотношенія между реакціями, вызванными хлористымъ и сћрнистымъ соединеніями фосфора. Дћйствительно, мы видимъ, что разложеніе въ существенныхъ чертахъ протекаетъ совершенно одинаково, съ одной только разницей: когда примћняются хлориды фосфора, то продуктъ распадается на хлоротилъ (C2H3OCl) и соляную кислоту, а когда примћняются сћрнистыя соединенія фосфора, обћ группы остаются соединенными, такъ какъ количество сћры, эквивалентное двумъ атомамъ хлора, недћлимо”.
Эти взгляды побудили Кекуле выступить въ защиту правильности „новыхъ атомныхъ вћсовъ” (эквивалентовъ Жерара). По Кекуле, „они выражаютъ фактъ лучше, чћмъ способъ обозначенія, употреблявшійся раньше. Даже если мы, принявъ новыя формулы, сохранимъ старые эквиваленты, то все же остается непонятнымъ, почему сћрнистый фосфоръ даетъ при дћйствіи на алкоголь меркаптанъ, {227} тогда какъ пятихлористый фосфоръ образуетъ хлористый этилъ и соляную кислоту (C4H5Cl и НСl); почему послћднія два тћла не остаются соединенными, подобно группамъ C4H5S и HS и т. д. Одинъ атомъ воды содержитъ два атома водорода и только одинъ атомъ кислорода; количество хлора, эквивалентное одному недћлимому атому кислорода, дћлится на два, тогда какъ сћра, подобно кислороду, двухосновна, такъ что одинъ атомъ ея эквивалентенъ двумъ атомамъ хлора, — все это реальные факты, а не только различіе въ способћ обозначенія59)”.
Существенное вліяніе на развитіе теоріи многоатомныхъ радикаловъ оказали изслћдованія металлъ содержащихъ радикаловъ, произведенныя Франкландомъ, и его взгляды на емкость насыщенія (ср. стр. 216), а также интересная статья Одлинга о соляхъ, важныя работы Бертело о глицеринћ и Вюрца о гликоляхъ. Мы разсмотримъ ихъ подробнће.
Успћхъ, достигнутый Одлингомъ60), обусловленъ былъ тћмъ, что онъ примћнилъ идею многоосновности также и къ металламъ, и вновь ввелъ молекулярныя формулы для всћхъ солей, а также для полутораокисныхъ соединеній, которыя Жераръ обозначалъ эквивалентными формулами. Онъ не только относитъ къ конденсированнымъ типамъ многоатомныя кислоты, какъ это раньше дћлалъ Вильямсонъ, но онъ знаетъ также многоатомныя основанія, которыя можно разсматривать точно такимъ же образомъ. Напримћръ, онъ пишетъ:
Окись висмута
|
3O, |
азотнокислая соль окиси висмута
|
3O61). |
Тћ металлы, которые, по Жерару, имћютъ различные эквивалентные вћса, по представленію Одлинга, обладаютъ нћсколькими атомностями. Одлингу извћстно, напримћръ, одно атомное и трехатомное желћзо, одноатомное и двухатомное олово, и на основаніи этого онъ выводитъ слћдующія формулы:
окись желћза |
|
O3 |
соотвћтственно |
лимонной кисл. |
|
O3 |
||||||
окись желћза |
|
O |
„ |
азотной кислотћ |
|
O. |
| {228} |
Интересенъ также взглядъ на фосфорныя кислоты. Одлингъ пишетъ:
Обыкновенная фосфорная кислота |
|
O3 |
|||
Пирофосфорная кислота . . . |
|
O5 |
|||
Метафосфорная кислота |
|
O2 |
|||
Фосфористая кислота . |
|
O5 |
|||
Фосфорноватистая кислота . |
|
O2 |
Такимъ образомъ, по Одлингу, фосфористая кислота относится къ пирофосфорной, какъ фосфорноватистая къ метафосфорной кислотћ. Подобное же отношеніе существуетъ, съ одной стороны, между сћрноватистой кислотой и сћрной кислотой, а съ другой — между щавелевой кислотой и угольной.
|
O2 |
|
O2 |
|
O2 |
|
O2 |
|||||||||||||||
Угольная |
Щавелевая |
Сћрная |
Сћрноватистая |
|||||||||||||||||||
Приблизительно въ то же время Кэй, одинъ изъ учениковъ Вильямсона62), опубликовалъ интересную работу, сдћланную очевидно подъ вліяніемъ учителя. Дћйствуя этилатомъ натрія на хлороформъ, онъ получилъ эфиръ, названный имъ трехосновнымъ муравьинокислымъ эфиромъ; реакція полученія слћдующая:
|
+ 3 |
|
= |
|
O3 + 3NaCl. |
При этомъ Вильямсонъ обращаетъ особое вниманіе на то, что въ новомъ веществћ остатки трехъ молекулъ алкоголя связываются трехзначнымъ радикаломъ СН. Это былъ первый примћръ многоатомнаго углеводороднаго радикала. Вскорћ выяснилось, какое плодотворное значеніе имћлъ этотъ взглядъ. Бертело, въ то время занятый изслћдованіемъ глицерина, законченнымъ въ существенныхъ чертахъ въ 1854 г.63), пришелъ къ очень важному результату, a именно, что глицеринъ можетъ соединяться съ кислотами въ трехъ {229} различныхъ отношеніяхъ. Такъ,
Моностеаринъ |
= |
1 молек. глицер. |
+ 1 м. стеарин. кисл. |
—2 м. воды |
= |
C6Н8O6 |
+ C36H36O4 |
—2НО |
|
(C = 6, O = 8) |
||||
Дистеаринъ |
= |
1 молек. глицер. |
+ 2 м. стеарин. кисл. |
—4 м. воды |
= |
C6Н8O6 |
+ C36H36O4 |
—4НО |
|
(въ статьћ стоитъ 2НО) |
||||
Тристеаринъ |
= |
1 молек. глицер. |
+ 3 м. стеарин. кисл. |
—6 м. воды |
= |
C6Н8O6 |
+ 3C36H36O4 |
—6НО |
|
Монохлоргидр. |
= |
1 молек. глицер. |
+ 1 м. соляной кисл. |
—2 м. воды |
= |
C6Н8O6 |
+ HCl |
—2НО |
|
Дихлоргидринъ |
= |
1 молек. глицер. |
+ 2 м. соляной кисл. |
—4 м. воды |
= |
C6Н8O6 |
+ 2HCl |
—4НО |
Эти факты Бертело интерпретируетъ слћдующимъ образомъ: „Мои опыты доказываютъ, что глицеринъ относится къ алкоголю, какъ фосфорная кислота къ азотной кислотћ. Тогда какъ послћдняя образуетъ лишь одинъ единственный рядъ нейтральныхъ солей, фосфорная кислота образуетъ три различныхъ ряда ихъ: соли нормальной фосфорной кислоты, пирофосфорной и метафосфорной кислотъ. Если соли всћхъ этихъ трехъ рядовъ разложить въ присутствіи воды сильной кислотой, то образуется та же фосфорная кислота. Точно такъ же и алкоголь образуетъ лишь одинъ рядъ нейтральныхъ эфировъ, тогда какъ глицеринъ образуетъ три отличныхъ другъ отъ друга ряда нейтральныхъ соединеній. Эти три ряда соединеній, разлагаясь въ присутствіи воды, даютъ обратно глицеринъ”.
Это сравненіе глицерина съ фосфорной кислотой, съ одной стороны, и алкоголя съ азотной кислотой — съ другой, имћетъ громадное значеніе, хотя, къ сожалћнію, оно нћсколько подрывается тћмъ, что захватываетъ также пирофосфорную и метафосфорную кислоты. Ортофосфорная кислота Одлинга64) отличается отъ названныхъ кислотъ и по составу, и по своей основности, тогда какъ въ эфирахъ, полученныхъ Бертело, содержится всегда тотъ же самый глицеринъ. Лучше удалось объяснить эти замћчательные факты Вюрцу: онъ разсматриваетъ глицеринъ, какъ трехатомный {230} спиртъ и приписываетъ ему формулу:
|
O665). |
По мнћнію Вюрца, соединенія, изслћдованныя Бертело, образуются изъ этого спирта замћщеніемъ 1, 2 и 3 атомовъ водорода радикалами кислотъ. При этомъ онъ указываетъ, что одноатомная группа C6H7, теряя Н2, переходитъ въ трехзначный остатокъ C6H5 (C = 6, О = 8).
Отъ такого геніальнаго изслћдователя, какъ Вюрцъ, не могло ускользнуть то обстоятельство, что для существованія одноатомныхъ и трехатомныхъ спиртовъ требуется также существованіе двухатомныхъ, и онъ тотчасъ же приступилъ къ опытамъ съ цћлью получить такія соединенія. Co своей точки зрћнія, онъ долженъ былъ предположить въ гипотетическомъ алкоголћ присутствіе двухатомнаго радикала. Однозначная группа C6H7 и трехзначная C6H5 давали одноатомные и трехатомные спирты; двухатомнымъ спиртамъ должны были соотвћтствовать гомологи углеводорода C6H666). Правильность этого взгляда отчасти подтверждали уже давно извћстные хлориды и бромиды; если бы только удалось превратить послћдніе въ соотвћтствующіе гидраты окисей, то цћль была бы достигнута. Дћйствіе основныхъ гидратовъ окисей не оправдало надеждъ Вюрца; но теперь на помощь ему пришли его прежнія изслћдованія. Четыре года передъ тћмъ онъ открылъ реакцію, позволявшую произвести подобное же превращеніе67). Съ тћхъ поръ эта реакція уже во многихъ случаяхъ примћнялась имъ съ успћхомъ68), и теперь должно было обнаружиться, что эта реакція достойна названія общаго метода. Дћйствительно, при нагрћваніи іодистаго этилена съ уксуснокислымъ серебромъ Вюрцъ получилъ уксусный эфиръ, который, при разложеніи посредствомъ ћдкаго кали, давалъ желаемый алкоголь:
C4H4J2 + 2 |
|
O2 = |
|
O4 + 2AgJ |
|
O4 + 2KHO = |
|
O4 + 2 |
|
O2. |
Такимъ образомь, Вюрцу удалось получить первый двухатомный алкоголь, именно гликоль69). Онъ былъ щедро вознагражденъ {231} за всћ трудности этого изслћдованія, такъ какъ рћдко случается, чтобы открытіе одного единственнаго вещества оказывало такое сильное вліяніе на все развитіе химіи; рћдко одно единственное соединеніе вызывало такой рядъ прекрасныхъ и полезныхъ изслћдованій, какія возникли послћ открытія гликоля. Позвольте мнћ въ доказательство моего утвержденія сообщить кое-что о соединеніяхъ, находящихся въ ближайшемъ родствћ съ гликолемъ.
Посредствомъ окисленія гликоля Вюрцъ получилъ гликолевую и щавелевую кислоты70). Первая кислота была идентична съ соединеніемъ, которое было получено за десять лћтъ передъ тћмъ Горсфордомъ изъ гликоля71) и природа котораго была изучена Штреккеромъ72). Такимъ же точно образомъ изъ пропилгликоля получается молочная кислота73), формула которой
|
O4 |
была установлена Вюрцемъ, считавшимъ эту кислоту, какъ и гликолевуюі двухосновной74). — Далће, громадное значеніе имћло открытіе окиси этилена и полиэтиленовыхъ спиртовъ. Обрабатывая растворомъ ћдкаго кали гликольхлоргидринъ
|
O2 |
образующійся изъ гликоля дћйствіемъ соляной кислоты75), Вюрцъ получилъ эфиръ двухатомнаго алкоголя, относящійся къ этому послћднему, какъ ангидридъ сћрной кислоты относится къ ея гидрату:
C4H4O2 |
S2O4 . O2 |
|||||||||||
Окись этилена |
Ангидридъ сћрной кислоты |
|||||||||||
|
|
|||||||||||
Гликоль |
Гидратъ сћрной кислоты |
Нагрћвая окись этилена съ гликолемъ, Вюрцъ получилъ затћмъ полиэтиленовые спирты76), незадолго передъ тћмъ полученные Лауренсо изъ бромистаго этилена и гликоля77). Эти вещества пріобрћли еще болће важное значеніе благодаря тому, что изъ нихъ окисленіемъ были получены кислоты78); они служили превосходными {232} примћрами образованія веществъ, отвћчающихъ конденсированнымъ типамъ, и впослћдствіи Вюрцъ очень хорошо сумћлъ ими воспользоваться для объясненія природы силикатовъ79). Наконецъ, съ помощью амміака и его аналоговъ Вюрцъ изъ окиси этилена получилъ основанія, содержащія кислородъ80); эти соединенія пріобрћли весьма большой интересъ, благодаря синтезу нейрина изъ гликольхлоргидрина и триметиламина81).
Такое пониманіе этилена, какъ двухатомнаго радикала, дало Гофманну возможность правильно объяснить природу основаній, полученныхъ Клоэцомъ въ 1853 г. Оказалось, что ихъ можно считать производными двухъ молекулъ амміака и, слћдовательно, они являются для гликоля тћмъ же, что этиламинъ для алкоголя. При дальнћйшемъ изученіи этихъ веществъ84) Гофманну удалось добыть новыя доказательства правильности теоріи многоатомныхъ радикаловъ и ілроложить путь для правильнаго пониманія запутанныхъ металло-амміачныхъ соединеній.
Было бы несправедливо закончить этотъ обзоръ, не упомянувъ о правћ Буффа на пріоритетъ въ признаніи двухатомности этилена. За нћсколько мћсяцевъ до того, какъ Вюрцъ опубликовалъ свое первое изслћдованіе о гликолћ, Буффъ въ предварительномъ сообщеніи, а за мћсяцъ до этого въ докладћ, представленномъ Royal Society пытался доказать двухатомность углеводородовъ типа СnHn (C = 6)85). При обработкћ хлористаго этилена роданистымъ каліемъ онъ получилъ вещество, которое имћетъ формулу C4H4Сy2S4 и при окисленіи азотной кислотой превращается въ соединеніе, идентичное дисульфэтоловой кислотћ Буктона и Гофманна86). Буффъ предложилъ назвать это соединеніе этиленъсћрнистой кислотой и приписалъ ему формулу
H |
} |
S2O6 |
|
C4 |
H4 |
. |
|
H |
S2O6 |
Образованіе роданистаго этилена можетъ быть выражено слћдующимъ уравненіемъ:
C4H4Cl2 + 2 |
|
S2 = C4 |
|
+ 2KCl. |
| {233} |
Изъ всего доклада Буффа видно, что онъ распозналъ двухатомность этилена и что въ этомъ отношеніи онъ можетъ оспаривать у Вюрца пріоритетъ. Что же касается экспериментальнаго доказательства, то ихъ работы едва ли можно сравнивать. Изслћдованіе гликолей Вюрца принадлежитъ къ самымъ блестящимъ научнымъ трудамъ того времени. Благодаря этой работћ, гипотеза различной валентности радикаловъ получила основаніе, надежнће котораго нельзя было и требовать. Опыты Буффа соотвћтствовали тћмъ же теоретическимъ представленіямъ, но они никогда не могли бы привести къ выводамъ, сдћланнымъ изъ работъ Вюрца.
| {234} |
Идея типовъ. — Объясненіе природы радикалоьъ валентностью элементовъ. — Четырехатомность углерода. — Удћльные объемы. — Формулы строенія. — Разграниченіе понятій атомности и основности. — Изомерія спиртовъ и кислотъ. — Физическая изомерія. — Вещества съ меньшимъ содержаніемъ водорода.
Въ послћдней лекціи я выяснилъ вамъ, какъ, благодаря работамъ Вильямсона, Франкланда, Кекуле, Одлинга, Бертело, Буффа и Вюрца, пріобрћла большое значеніе теорія различной атомности радикаловъ и элементовъ. Теперь же я начну лекцію съ того, что покажу, какъ идея типовъ можетъ быть объяснена въ свћтћ этой теоріи1).
Въ то вреімя Кольбе оспаривалъ взгляды Жерара, считая ихъ произвольными2). Вюрцъ же стремился доказать, что это не такъ, что четыре типа Жерара, которые, по его мнћнію, могутъ быть сведены къ тремъ, представляютъ различныя состоянія (уплотненія) матеріи. Кромћ типа водорода H2, Вюрцъ допускаетъ еще типы H2H2 и H3H3. Первому изъ двухъ послћднихъ типовъ соотвћтствуетъ вода H2O, образующаяся замћщеніемъ Н2 черезъ O, тогда какъ амміакъ представляетъ трижды конденсированный водородъ, половина котораго замћщена трехосновнымъ азотомъ. Такъ какъ всћ эти молекулы въ газообразномъ состояніи заполняютъ одинъ и тотъ же объемъ, то взглядъ Вюрца можно считать вполнћ правильнымъ: одинъ атомъ водорода занимаетъ 1, 1/2 или 1/3 объема, смотря по тому, {235} находится ли онъ въ веществахъ, принадлежащихъ къ типу H2, или къ типу H4, или же къ типу H6. Вюрцъ считаетъ возможнымъ существованіе матеріи въ еще болће уплотненныхъ состояніяхъ, но соотвћтствующихъ такимъ состояніямъ типовъ онъ не устанавливаетъ.
Лишь въ 1857 г., по вопросу о строеніи гремучей ртути, Кекуле сообщаетъ3), что строеніе какъ этого, такъ и другихъ соединеній метиловаго ряда, къ которымъ, согласно произведеннымъ имъ опытамъ, должна быть причислена и гремучая ртуть, можетъ быть отнесено къ типу метилъводорода C2H44). Онъ пишетъ:
C2H4 |
C2H3Cl |
C2HCl3 |
C2(NO4)Cl3 |
|||
Метилъ- |
Хлористый |
Хлороформъ |
Хлоръ-пикринъ |
C2(NO4)2Cl2 |
C2H3(C2N) |
C2(C2N)(NO4)Hg2 |
||||
Масло Мариньяка5) |
Ацетонитрилъ |
Гремучая ртуть. |
Этимъ было положено начало, но типъ С2Н4 былъ пока еще мало полезенъ. До тћхъ поръ, пока его нельзя было распространить на всћ углеродистыя соединенія, не могло быть и рћчи о томъ, чтобы положить его въ основаніе цћлой системы органической химіи, какъ это было сдћлано позже. Недоставало еще идеи, съ помощью которой это возможно было бы осуществить; можетъ быть, въ то время Кекуле уже постигнулъ ее и не рћшался лишь ее опубликовать, но возможно также, что гипотеза о сцћпленіи атомовъ углерода еще не пришла ему въ голову. Во всякомъ случаћ, его воззрћнія, относящіяся къ тому времени, должны были быть уже весьма близки къ тћмъ воззрћніямъ относительно природы углерода, которыя онъ высказалъ въ 1858 г. Къ концу 1857 г., когда {236} представленіе о типахъ привело Кекуле къ многоатомности элементовъ6), онъ прямо говоритъ о четырехатомности углерода. Но онъ объ этомъ какъ бы упоминаетъ лишь мимоходомъ и не дћлаетъ дальнћйшихъ выводовъ.
Наконецъ, весною 1858 г. появилась статья, получившая въ нашей наукћ фундаментальное значеніе7). Кекуле начинаетъ съ того, что указываетъ на необходимость изученія природы элементовъ: по его мнћнію, лишь это можетъ привести къ выясненію основности радикаловъ. Въ органической химіи первую роль при подобной точкћ зрћнія играетъ углеродъ, и поэтому Кекуле подвергаетъ свойства этого элемента очень подробному изслћдованію. „Если разсматривать простћйшія соединенія этого элемента: CH4, CH3Cl, CCl4, CHCl3, COCl2, CO2, CS2 и CHN, то бросается въ глаза, что количество углерода, которое химики считаютъ наименьшимъ и признаютъ за атомъ, постоянно связываетъ четыре атома одноатомнаго элемента, или два атома двухатомнаго элемента, такъ что, вообще, сумма химическихъ единицъ элементовъ, соединенныхъ съ однимъ атомомъ углерода, равна четыремъ. Это побуждаетъ насъ разсматривать углеродъ, какъ четырехатомный элементъ”. Теперь появляется также и гипотеза о взаимной связи углеродныхъ атомовъ и подвергается самому подробному обсужденію: „Слћдуетъ предполагать, что въ веществахъ, содержащихъ нћсколько атомовъ углерода, по меньшей мћрћ часть атомовъ удерживается сродствомъ углерода, и что атомы углерода сами связываются другъ съ другомъ, при чемъ, естественно, часть сродства одного атома связывается съ такой же точно частью сродства другого”.
„Простћйшій и поэтому наиболће вћроятный случай подобнаго расположенія двухъ атомовъ углерода это — когда единицa сродства одного атома связана съ единицей же сродства другого. Такимъ образомъ, изъ 2.4 единицъ сродства двухъ атомовъ углерода двћ идутъ на то, чтобы связывать оба атома. Слћдовательно, остаются шесть единицъ, которыя могутъ быть связаны атомами другихъ элементовъ”.
При сдћланномъ здћсь допущеніи число, выражающее валентность другихъ элементовъ, когорые могутъ быть присоединены къ n связаннымъ между собой атомамъ углерода, можетъ быть выражено уравненіемъ:
4n - 2n + 2 = 2n + 2. {237}
Конечно, Кекуле считаетъ возможнымъ не только одинъ этотъ спо собъ взаимнаго соединенія углеродныхъ частицъ. Онъ указываетъ, что въ бензолћ и его гомологахъ можно допустить болће тћсную, „наиболће простую, послћ первой, группировку”.
Для характеристики основной точки зрћнія, принятой въ то время Кекуле, я упомяну еще, что въ вопросћ о значеніи формулъ онъ примыкаетъ къ послћдователямъ Жерара; Кекуле не считаетъ, что онћ выражаютъ расположенія атомовъ, а понимаетъ ихъ лишь, какъ формулы превращеній. Поэтому-то онъ и сохраняетъ способъ обозначенія Жерара и, подобно ему, признаетъ, что для одного вещества возможны нћсколько раціональныхъ формулъ. Кекуле очень хорошо понимаетъ, что, благодаря гипотезћ о четырехатомности углерода, эти формулы могутъ получить новый видъ, но онъ избћгаетъ входить въ подробное разсмотрћніе этого вопроса. Это становится понятнымъ, если принять во вниманіе, что Кекуле признаетъ за символами лишь указанное ограниченное значеніе, полагая, что лишь физическія свойства веществъ могутъ привести къ установленію гипотезъ о расположеніи атомовъ. Эти взгляды имћютъ тћмъ большій интересъ, что уже раньше съ весьма авторитетной стороны утверждалось, что одному веществу нельзя приписывать двћ формулы и нельзя его относить къ двумъ различнымъ типамъ: Коппъ, сопоставляя результаты своего превосходнаго изслћдованія8) объ удћльныхъ объемахъ жидкостей, доказалъ, что эти объемы могутъ быть вычислены изъ ихъ состава, если для каждаго элемента принять извћстный удћльный объемъ, который не во всћхъ случаяхъ будетъ одинъ и тотъ же, но зависитъ отъ роли, которую данный элементъ играетъ въ соединеніи. Такъ, напримћръ, по мнћнію Коппа, кислородъ имћетъ два совершенно различныхъ удћльныхъ объема, смотря по тому, находится ли онъ въ радикалћ или же внћ его. Поэтому для вычисленія удћльнаго объема альдегидовъ и акетоновъ отнюдь не было безразлично, относить ли ихъ къ типу водорода или же къ типу воды, тогда какъ Жераръ считалъ возможнымъ и то и другое9); съ правиломъ же Коппа согласовалось только первое. Коппъ отмћчаетъ это и указываетъ, что какъ разъ этимъ пропиловый альдегидъ отличается отъ изомернаго аллиловаго спирта: {238}
|
|
||||||||
Альдегидъ пропіоновой |
Аллиловый спиртъ. |
Можно считать очень важнымъ симптомомъ то обстоятельство, что теперь физическія основанія принудили химиковъ школы Жерара придавать своимъ формуламъ и умозрћніямъ бóльшее значеніе, чћмъ они считали возможнымъ раньше. Для этого, понятно, не было необходимости въ какомъ-нибудь особомъ побужденіи. Такъ, напримћръ, уже Куперъ повидимому хотћлъ символизировать соединенія дћйствительными формулами строенія. Независимо отъ Кекуле, Куперъ, нользуясь четырехатомностью углерода, показалъ, какъ этимъ свойствомъ можетъ быть объяснено существованіе очень многихъ органическихъ соединеній. Я хотћлъ бы сравнить эту статью Купера10) съ незадолго передъ тћмъ появившейся работой Кекуле, и показать вамъ, какъ оба изслћдователя, исходя изъ совершенно различныхъ точекъ зрћнія, пришли къ весьма сходнымъ результатамъ. Кекуле, постигнувъ и объяснивъ содержаніе идеи типовъ, пришелъ къ представленію о четырехатомности углерода и взаимной связи его атомовъ.
Куперъ же, напротивъ, отвергаетъ типы, такъ какъ ему казалось, что въ философскомъ отношеніи они не удовлетворяютъ условіямъ, предъявляемымъ ко всякой теоріи. По его мнћнію, система Жерара покоится на общихъ положеніяхъ, изъ которыхъ выводятся отдћльные случаи, тогда какъ, на его взглядъ, правиленъ лишь обратный путь. Куперъ считаетъ необходимымъ изучать сперва свойства элементовъ, а именно
1) избирательное сродство, или просто сродство;
2) сродство по степенямъ.
Послћднее свойство регулируетъ границы способности вступать въ соединенія и почти совпадаетъ съ тћмъ, что мы теперь называемъ значностью, валентностью или атомностью. Въ своихъ дальнћйшихъ взглядахъ Куперъ ограничивается опредћленіемъ степени сродства углерода и полагаетъ, что посредствомъ такого опредћленія возможно объяснить органическія соединенія. Въ сущности, лишь два свойства этого элемента оказываются для него характерными, а именно слћдующія: 1) углеродъ соединяется лишь съ четнымъ числомъ {239} атомовъ водорода и 2) онъ соединяется съ самимъ собою. Послћднее утвержденіе оправдывается указаніемъ на вещества, содержащія углеродъ: водородъ, кислородъ и т. д. могутъ быть отняты отъ этихъ веществъ и замћщены хлоромъ безъ нарушенія цћльности соединенія; поэтому причина связи должна лежать не въ замћщаемыхъ атомахъ. Maximum числа атомовъ, находящихся въ соединеніи съ атомомъ углерода, — четыре, и поэтому Куперъ схемой органическихъ соединеній считаетъ
nМ4 или nМ4 — mN2,
гдћ n — число атомовъ углерода и m < n. (Очевидно, m есть число паръ углеродныхъ атомовъ, связанныхъ между собой).
Сказаннаго достаточно, чтобы понять формулы Купера; нћкоторыя изъ нихъ приведемъ для примћра (С = 12, O = 8)11):
|
|
|
||||||||||||||||||||||||
алкоголь |
уксусная кислота |
эфиръ |
||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||
гликоль |
щавелевая кислота |
синильная |
ціановая кислота |
Здћсь мы впервые встрћчаемся съ формулами строенія въ современномъ смыслћ этого слова, т.-е. съ символами, возникшими благодаря познанію атомности элементовъ. При этомъ необходимо замћтить, что выражаемыя этими формулами воззрћнія на алкоголь и уксусную кислоту совпадаютъ съ таковыми же взглядами Кольбе12), и отличіе заключается лишь въ способћ обозначенія.
Обћ эти работы Кекуле и Купера служатъ основой нашихъ воззрћній на строеніе соединеній. Благодаря имъ, развитіе органической {240} химіи пошло по новому направленію; онћ составляютъ наиболће важное изъ всего того, что въ новћйшую эпоху было сдћлано для нашей науки въ области умозрћнія. Съ этого времени всћ стремленія были направлены главнымъ образомъ на то, чтобы, пользуясь принципомъ четырехатомности углерода, выработать представленія о взаимныхъ отношеніяхъ соединяющихся атомовъ. Этимъ отдћломъ въ исторіи развитія нашей науки мы и займемся теперь.
Эти вопросы относительно строенія нуждались, кромћ гипотезы о природћ углерода, еще въ цћломъ рядћ экспериментальныхъ данныхъ; но такъ какъ послћднія были неполны, то часто требовались многолћтнія усилія, чтобы изложенные принципы примћнить къ нћкоторымъ классамъ соединеній для опредћленія ихъ раціональныхъ формулъ. Эту задачу не удалось разрћшить вполнћ даже до настоящаго времени. Существуютъ еще многія соединенія, которыхъ никакъ нельзя включитъ въ систему. Однако, самое существенное уже достигнуто: всћ убћдились въ томъ, что теорія атомности можетъ служить фундаментомъ зданія, и въ этомъ отношеніи нашей глубокой благодарности заслуживаетъ Кекуле, доказавшій эту возможность своимъ превосходнымъ учебникомъ. Нћкоторые иногда упрекаютъ его въ томъ, что на практикћ онъ не всегда оставался вћренъ установленнымъ принципамъ; хотя этотъ упрекъ имћлъ правда, нћкоторыя основанія, но лишь въ тћхъ случаяхъ, въ которыхъ факты еще не были достаточны для окончательнаго рћшенія, такъ что врядъ ли даже и возможно было оставаться вполнћ послћдовательнымъ. Впрочемъ, даже въ то время Бутлеровъ13) и Эрленмейеръ14) весьма энергично стояли за послћдовательное примћненіе теоріи валентности, несмотря на то, что пользованіе структурными формулами было тогда сопряжено съ большими трудностями и часто давало поводы къ недоразумћніямъ.
Историческій обзоръ не можетъ ставить себћ задачей подробное изложеніе общихъ теоретическихъ воззрћній. Онъ долженъ ограничиться исторіей возникновенія и исчезновенія руководящихъ идей; перечисленіе же фактовъ и группировка ихъ съ одной общей точки зрћнія составляетъ содержаніе самой науки, и потому дается въ учебникахъ. Здћсь же я ограничусь лишь изложеніемъ тћхъ фактовъ и обстоятельствъ, которые существенно способствовали {241} упроченію системы или приводило къ новымъ понятіямъ и воззрћніямъ; кромћ того, мы разсмотримъ также, какіе факты не совмћщаются, повидимому, съ принципами и позволяютъ намъ предсказать расширеніе или измћненіе нынћшнихъ теорій.
Прежде всего я остановлюсь на полемикћ о строеніи молочной кислоты; этотъ научный споръ тянулся отъ 1858 до 1860 г. и повлекъ за собой раздћленіе понятій объ атомности и основности кислотъ. Многіе химики по примћру Жерара, считавшаго молочную кислоту двухосновной15), удваивали ея формулу и писали ее въ видћ С12H12O12 (С = 6, O = 8); но синтезъ аланина и превращеніе его въ молочную кислоту (Штреккеръ16) дћлали болће вћроятной неудвоенную формулу. Рћшительное доказательство въ пользу послћдней дано было Вюрцемъ, благодаря произведенному имъ окисленію пропилгликоля17). Этимъ была, повидимому, подтверждена также двухосновная природа молочной кислоты, такъ что Вюрцъ писалъ:
|
|
|||||||||
гликоль |
гликолевая кислота (С = 6, O = 8) |
|||||||||
|
|
|||||||||
пропилгликоль |
молочная кислота. |
Новымъ аргументомъ въ пользу этого взгляда явилась реакція съ пятихлористымъ фосфоромъ, которая даетъ хлоридъ С6Н4O2Сl2, переходящій при дћйствіи алкоголя въ хлормолочнокислый эфиръ
С6H4O2 |
} |
O2 |
С4H5 | ||
Cl |
соотвћтственно гликольхлоргидрину: плотность пара послћдняго вещества подтверждала предположенную величину молекулы18).
Кольбе считалъ молочную кислоту одноосновной; онъ называлъ ее оксипропіоновой кислотой и предполагалъ, что между нею и пропіоновой кислотой существуетъ такое же соотношеніе, какъ между оксибензойной и бензойной кислотами19). Какъ показалъ Герляндъ, амидобензойная кислота можетъ быть посредствомъ азотистой кислоты превращена въ оксибензойную20); точно такъ же {242} молочную кислоту можно получить изъ аланина. Послћднее соединеніе и гликоль должны быть разсматриваемы, какъ амидокислоты; этотъ взглядъ получилъ новое подтвержденіе, благодаря превращенію бромуксусной кислоты въ гликоль, произведенному Перкиномъ и Дюппа21), въ виду чего Кольбе могъ писать:
HO, (С4H5) C2O2, O; |
HO, |
( |
C4 |
{ |
H4 |
) |
C2O2, O; |
HO, |
( |
C4 |
{ |
H4 |
) |
C2O2, O |
NH2 |
O2H |
|||||||||||||
пропіоновая кислота |
аланинъ |
молочная кислота. |
||||||||||||
Чтобы согласовать со своими воззрћніями вещества, полученныя Вюрцемъ, Кольбе разсматривалъ хлористый лактилъ, какъ хлоридъ хлорпропіоновой кислоты, который при дћйствіи спирта превращается въ эфиръ хлорпропіоновой кислоты; дћйствительно, Ульрихъ получилъ изъ этого послћдняго соединенія, дћйствуя водородомъ in statu nascendi, эфиръ пропіоновой кислоты22). Какъ доказательство въ пользу своихъ идей, Кольбе могъ привести также полученіе гликолевой кислоты изъ монохлоруксусной кислоты, достигнутое Кекуле23), тогда какъ послћдній видћлъ въ этомъ превращеніи переходъ одноатомной кислоты24) въ двухатомную.
Вюрцъ указываетъ теперь въ подтвержденіе своего взгляда25) на существованіе двухосновныхъ молочнокислыхъ солей, описанныхъ Энгельгардомъ и Мадреллемъ26), а также Брюнингомъ27). Далће, Вюрцу удалось получить двухосновный молочнокислый эфиръ посредствомъ обработки эфира хлорпропіоновой кислоты этилатомъ натрія, затћмъ лактометанъ и эфиръ масляномолочной кислоты. Съ другой стороны, возстановленіе молочной кислоты въ пропіоновую посредствомъ іодистаго водорода — реакція, открытая Лаутеманномъ28),— a также превращеніе эфира хлорпропіоновой кислоты въ аланинъ29) дали Кольбе новую точку опоры для предположенія, что молочная кислота есть одноосновная оксикислота, каковую онъ опредћлилъ, какъ одноосновную кислоту, въ которой одинъ интрарадикальный водородный атомъ замћщенъ черезъ H2O2, т. е. перекисью водорода30). Многократно упомянутой уже аналогіей между карбоновыми и {243} сульфоновыми кислотами онъ пользуется для подтвержденія защищаемыхъ имъ идей, сравнивая молочную кислоту съ изэтіоновой:
HO(С4H5)C2O2, O |
|
|||||||||
пропіоновая кислота |
молочная кислота |
|||||||||
HO(С4H5)S2O4, O |
|
|||||||||
этилъ-сульфоновая кислота |
изэтіоновая кислота. |
Въ изложенной нами полемикћ до начала 1859 года воззрћнія Кольбе согласовались съ фактическимъ матеріаломъ лучше, чћмъ воззрћнія Вюрца: съ точки зрћнія Кольбе прекрасно объяснялись отношенія между жирными кислотами и молочными, а также явленія изомеріи, открытыя въ слћдующемъ году Вюрцемъ у эфировъ тюслћднихъ кислотъ31). Единственное, что не было оцћнено Кольбе, это — отмћченныя Вюрцемъ отношенія между гликолями и разсматриваемыми кислотами32); даже въ 1860 г., возвращаясь къ строенію молочной кислоты, Кольбе все еще оставался при прежней точкћ зрћнія33). Онъ отмћчаетъ различіе двухъ замћщаемыхъ радикалами водородныхъ атомовъ въ молочной и гликолевой кислотахъ, но не соглашается съ тћмъ, что содержащіяся въ нихъ группы перекиси водорода могутъ также находиться въ гликоляхъ.
Вюрцъ между тћмъ сдћлалъ шагъ впередъ. Онъ разграничиваетъ понятія объ атомности и основности кислотъ34). Тогда какъ первая опредћляется валентностью радикала, вторая обусловливается числомъ атомовъ водорода, замћщенныхъ металлами. По мнћнію Вюрца, степень легкости, съ которой кислота обмћниваетъ водородъ на металлъ, зависитъ не только отъ количества эквивалентовъ водорода, находящихся внћ радикала, т.-е. отъ типическихъ атомовъ водорода, но также и отъ природы самого радикала. Съ увеличеніемъ количества кислорода въ радикалћ послћдній становится болће электроотрицательнымъ, типическій же водородъ становится болће основнымъ (болће электроположительнымъ). {244}
„Имћемъ:
С2H4 |
} |
O2 |
С2H2O |
} |
O2 |
С2O2 |
} |
O2 |
С3H5 |
} |
O3 |
С3H3O |
} |
O3 |
||||
H2 |
H2 |
H2 |
H3 |
H3 |
||||||||||||||
гликоль |
гликолевая кисл. |
щавелев. кисл. |
глицеринъ |
глицериновая |
||||||||||||||
Глицериновая кислота трехатомна, но одноосновна, фосфористая и ціануровая кислоты трехатомны и двухосновны”. Впрочемъ, Вюрцъ считаетъ молочную кислоту двухосновной и по строенію отличной отъ гликолевой кислоты. Принять это онъ былъ вынужденъ фактомъ существованія описанныхъ Брюнингомъ и другими молочнокислыхъ солей.
Въ тотъ же годъ появился первый выпускъ учебника Кекуле, и тогда обнаружилось, какъ легко объясняется природа молочныхъ кислотъ, если восходить до самихъ элементовъ, что и дћлалъ Кекуле. Онъ пользуется типическимъ способомъ обозначенія, но поясняетъ его такъ называемыми графическими формулами, которыя выражаютъ отношенія атомовъ. Эти символы представляли собой новый способъ для выраженія строенія соединеній, который держался нћкоторое время, но впослћдствіи былъ вновь замћненъ раціональными формулами, близкими къ тћмъ, которыя ввелъ Куперъ. Здћсь я буду пользоваться послћдними формулами; содержаніе же конечно, отъ этого не измћнится:
СH3 |
СH3 |
CH2OH |
COOH |
|||
| |
| |
| |
| |
|||
CH2OH |
COOH |
CH2OH |
COOH |
|||
алкоголь |
уксусная кислота |
гликоль |
щавелевая кислота. |
Для Кекуле взаимоотношенія атомовъ въ гликолевой кислотћ опредћляются на основаніи открытаго имъ способа полученія ея изъ хлоруксусной кислоты; эти отношенія могутъ быть представлены формулой
CH2OH |
| |
COOH. |
Послћдняя, подобно формулћ молочной кислоты, содержитъ два типическихъ атома водорода, т. е., какъ это теперь объясняетъ Кекуле35), два различающіеся по своимъ свойствамъ атома водорода, связанные съ углеродомъ при посредствћ {245} кислорода: одинъ изъ нихъ имћетъ тћ же свойства, что и типическій водородъ уксусной кислоты и находится подъ вліяніемъ двухъ атомовъ кислорода, тогда какъ другой играегъ ту же роль, что и типическій водородъ спирта. Теперь было найдено, наконецъ, рћшеніе загадки, потому что такое представленіе объясняло сторонникамъ теоріи атомности всћ химическія реакціи гликолевой кислоты, а также ея отношеніе какъ къ гликолю, такъ и къ уксусной кислотћ. Спустя нћсколько лћтъ Кекуле доказалъ, что эти кислоты при дћйствіи бромистымъ водородомъ36), подобно спиртамъ, легко переходятъ въ соотвћтствующіе бромиды; этимъ были вновь подтверждены высказанные раньше взгляды относительно „алкогольнаго водо рода” въ этихъ соединеніяхъ. Еще раньше Перкинъ37) пытался доказать алкогольную природу гликолевой и молочной кислотъ на основаніи того факта, что натрій дћйствуетъ на эфиръ молочной кислоты, выдћляя водородъ, и что при дћйствіи на эти кислоты хлорацетила и хлорсукцинила образуются эфирообразныя соединенія, при чемъ выдћляется соляная кислота. Указанныя изслћдованія гликолевой и молочной кислотъ имћютъ важное значеніе еще и потому, что благодаря имъ было доказано, что одно и то же вещество можетъ отправлять двойную функцію, при чемъ свойства его просто суммируются; это обстоятельство, конечно, заслуживаетъ большого вниманія.
Кекуле былъ также въ состояніи объяснить, почему угольная кислота, гомологичная гликолевой, образуетъ соли съ двумя атомами металла, т. е. является двухосновной. Формула гипотетическаго гидрата ОН получила видъ
OH |
CO |
OH; |
оба атома водорода находятся подъ равномћрнымъ вліяніемъ кислорода, вслћдствіе чего для различія между ними нћтъ никакого основанія38).
Здћсь слћдуетъ отмћтить, что формула гликолевой кислоты Кольбе оказывается весьма сходной съ только-что приведенной нами формулой Кекуле, если только принять во вниманіе ея содержаніе, а не форму; лишь благодаря своему нћсколько сложному способу обозначенія, Кольбе не вывелъ всћхъ слћдствій, которыя вытекали изъ формулы. Вообще, преимущества теоретическихъ {246} воззрћній Кольбе должны были обнаруживаться чћмъ дальше, тћмъ больше: въ 1862 году Фридель, присоединивъ водородъ къ ацетону, получилъ пропиловый спиртъ39), идентичный съ тћмъ, который Бертело получилъ изъ пропилена40).
Кольбе41) тотчасъ же призналъ его первымъ представителемъ предсказанной имъ группы изомерныхъ спиртовъ42) и приписалъ ему формулу
С2H3 |
} |
С2O, HO. |
С2H3 | ||
H |
Кольбе утверждалъ далће, что можно установить отличіе этого спирта отъ пропиловаго спирта броженія Шанселя43), главнымъ образомъ, съ помощью окисленія, такъ какъ новый спиртъ долженъ при этомъ вновь превратиться въ ацетонъ, что дћйствительно и доказалъ Фридель44).
Два года спустя Кольбе вновь возвращается къ этимъ спиртамъ45). Сравнивая амміачныя основанія со спиртами, онъ пришелъ къ заключенію, что среди тћхъ и другихъ должны наблюдаться совершенно одинаковые случаи изомеріи:
|
|
|
|
|||||||||||||||||||||||
метиламинъ |
метилированный мети- |
этиламинъ |
этилированный мети- |
|||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||
диметиламинъ |
дважды метилиро- |
триметил- |
трижды метилирован- |
Теперь Кольбе уже распространяетъ свои воззрћнія также на кислоты и полагаетъ, что и въ этомъ классћ соединеній можно предвидћть явленія изомеріи. Нћсколько раньше Франкландъ получилъ лейциновую кислоту, обрабатывая эфиръ щавелевой кислоты46 {247} этилатомъ цинка. Благодаря этому интересному синтезу у Кольбе возникли новыя идеи. Подобно самому Франкланду, Кольбе считаетъ его кислоту диэтилъоксиуксусной кислотой и изображаетъ ее формулой:
C2 |
{ |
С4H5 |
} |
C2O2, O, HO. |
С4H5 |
||||
HO2 |
Этому соединенію соотвћтствуетъ диэтилуксусная кислота. Точно такъ же Кольбе извћстна диметилуксусная кислота, называемая имъ изомасляной, такъ какъ, по его мнћнію, она должна отличаться отъ обыкновенной масляной кислоты:
C6H7(C2O2)O, HO |
( |
C2 |
{ |
С2H3 |
) |
C2O2, O, HO |
|
С2H3 |
|||||||
HO2 |
|||||||
масляная кислота |
изомасляная кислота. |
||||||
Формулћ валерьяновой кислоты, по мнћнію Кольбе, соотвћтствуютъ три изомера: трижды метилированная уксусная кислота, метилэтилуксусная кислота и пропилуксусная кислота. Отъ этихъ соединеній выводятся изомерные дериваты, напримћръ, оксикислоты, къ которымъ Кольбе причисляетъ ацетоновую кислоту Штедлера47).
Эти взгляды вполнћ подтвердились, чтб было большимъ тріумфомъ для геніальной проницательности Кольбе. Правильность ихъ обнаружилась прежде всего на ацетонъалкоголћ Фриделя, имћющемъ поэтому большое значеніе. Такъ какъ строеніе ацетона было установлено синтезомъ Фрейнда, то едва ли могли быть какія-либо сомнћнія относительно формулы новаго пропиловаго алкоголя. Эрленмейеръ48) воспользовался ею для объясненія строенія трехатомнаго спирта, именно послћ того, какъ онъ убћдился въ тождественности этого спирта съ тћмъ, который былъ полученъ изъ глицерина49).
Непосредственно за открытіемъ изопропиловаго спирта Вюрцъ открылъ „гидраты”50). Онъ получилъ ихъ, дћйствуя на углеводороды этиленоваго ряда іодистымъ водородомъ и окисью серебра, a свойства ихъ онъ изучилъ на амиленгидратћ, отличіе котораго отъ амиловаго алкоголя онъ могъ доказать. Вначалћ знаменитый {248} французскій ученый разсматривалъ амиленгидратъ, какъ соединеніе углеводорода и воды, и выражалъ его формулой С5Н10, Н2O) это мнћніе, повидимому, подтверждалось легкимъ распадомъ даннаго соединенія на эти составныя части. Впослћдствіи Вюрцъ считалъ возможнымъ объяснить отличіе этого спирта отъ нормальныхъ спиртовъ тћмъ, что въ гидратахъ связь одного изъ атомовъ водорода иная (менће тћсная), чћмъ въ изомерныхъ съ ними веществахъ51).
Кольбе считаетъ, что эти вещества принадлежатъ52) къ предсказанной имъ группћ вторичныхъ спиртовъ, и старается доказать это мнћніе опытомъ окисленія, не давшимъ ему, однако, никакихъ опредћленныхъ результатовъ. Вюрцъ53), въ свою очередь, произведшій этотъ опытъ, получилъ, наряду съ уксусной кислотой, ацетонъ. Такимъ образомъ, вопросъ остался нерћшеннымъ54), пока, наконецъ, много позже, а именно въ 1878 году, Вышнеградскому не удалось доказать, что амиленгидратъ принадлежитъ къ третичнымъ спиртамъ55). Впрочемъ, эти послћдніе были открыты значительно раньше, въ 1863 году, Бутлеровымъ56), съ помощью въ высшей степени замћчательной реакціи. Потребовалось большое число изслћдованій Бутлерова и его учениковъ, чтобы окончательно разъяснить природу этихъ соединеній и ихъ отношенія къ другимъ спиртамъ.
Относительно изомеріи въ ряду жирныхъ кислотъ извћстно слћдующее. Эрленмейеръ въ 1864 году получилъ эфиръ изомасляной кислоты по способу, предложенному Кольбе57), но онъ не могъ найти никакого существеннаго различія между этимъ эфиромъ и обыкновеннымъ эфиромъ масляной кислоты; впослћдствіи Марковниковъ путемъ тщательнаго изученія солей нашелъ искомое различіе58) и, кромћ того, доказалъ, что ацетоновая кислота тождественна съ оксиизомасляной59). Существенное значеніе въ этомъ вопросћ имћли прекрасные синтезы Франкланда и Дюппа. Этимъ изслћдователямъ удалось отъ щавелевой кислоты перейти къ соединеніямъ ряда молочной кислоты, превращавшимся далће въ соотвћтственные члены ряда акриловой кислоты60). Кромћ того, имъ удалось при помощи {249} открытаго Гейтеромъ61) ацетоуксуснаго эфира ввести алкогольные радикалы въ уксусную кислоту и такимь образэмъ получить ея гомологи62). Впослћдствіи Вислиценусь разъяснилъ эту реакцію и изслћдовалъ ее болће точно. Имъ и его учениками были произведены по этому методу многочисленные синтезы, и черезъ это они существенно способствовали выясненію строенія кислотъ съ высшимъ содержаніемъ углерода.
Но рћшающее значеніе для всћхъ этихъ вопросовъ о строеніи имћлъ тотъ фактъ, что была установлена идентичность диметила съ водородистымъ этиломъ (Шорлеммеръ)63) (cp. стр. 190), и подтвердилась раньше возбуждавшая сомнћнія64) идентичность эфировъ угольной кислоты съ двумя различными спиртовыми радикалами65). Лишь послћ того, какъ удалось установить эти факты, можно было признать равнозначность четырехъ валентностей углерода; это было первымъ необходимымъ условіемъ для того, чтобы внушить довћріе къ „структурнымъ формуламъ”, столь употребительнымъ въ настоящее время.
Уже изъ приведенныхъ работъ вы могли видћть, что существенная задача научной химіи заключается въ разъясненіи явленій изомеріи. Эти послћднія встрћчаются такъ часто, что даже лучшіе умы не въ состояніи были бы охватить всћхъ фактовъ, если бы они нанизывались механически безъ всякой теоретической связи. Оказалось, однако, что графическія или структурныя формулы очень пригодны какъ для объясненія извћстныхъ намъ уже случаевъ изомеріи, такъ и для предугадыванія новыхъ; понятно поэтому, что усилія химиковъ все болће и болће обращаются къ установленію подобныхъ раціональныхъ формулъ. Само собою разумћется, я не могу здћсь остановить ваше вниманіе на всћхъ этихъ попыткахъ, направленныхъ къ разъясненію случаевъ изомеріи; я долженъ, главнымъ образомъ, стремиться къ разъясненію того принципа, которымъ пользуются, чтобы на основаніи реакцій сдћлать выводъ о строеніи. Согласно этому принципу, при превращеніяхъ взаимныя отношенія атомовъ остаются неизмћнными, за исключеніемъ лишь тћхъ, которыя разрываются, но вновь вступающіе атомы или группы возстановляютъ эти отношенія. {250} Я думаю, что не ошибусь, если буду считать это положеніе лишь новымъ видоизмћненіемъ закона замћщенія Лорана66). Указанное положеніе есть лишь обобщеніе послћдняго закона, который въ то же время получилъ иной смыслъ благодаря тому, что мы уже не стремимся опредћлять расположеніе атомовъ въ пространствћ, но только ихъ взаимныя отношенія, т. е. стараемся выяснить характеръ ихъ связи другъ съ другомъ. Къ сожалћнію, не было дано общаго доказательства въ пользу этого принципа и даже не было сдћлана никакихъ попытокъ въ этомъ направленіи. Этотъ принципъ, отнюдь не стоящій выше всякаго сомнћнія, признается лишь потому, что слћдствія, выведенныя изъ него, неоднократно давали согласные между собою результаты, т. е. для одного и того же вещества этотъ принципъ даетъ идентичныя формулы, независимо отъ способа образованія.
Конечно, такое согласованіе не всегда имћетъ мћсто. Извћстны многіе случаи, когда строеніе, выведенное изъ одного способа образованія, не совпадало съ формулой, которую можно было вывести или изъ другого способа образованія, или исходя изъ полученныхъ продуктовъ разложенія67). Въ такихъ случаяхъ мы должны предположить, что при одной изъ реакцій произошло превращеніе вешества въ его изомеръ; другими словами, мы должны допустить, что вышеустановленное основное положеніе здћсь не приложимо, что при превращеніи оставшіеся въ молекулћ атомы измћнили свои взаимныя отношенія. Подобные случаи заслуживаютъ вниманія. Они способны поколебать нашу вћру въ правильность вышеупомятутаго положенія, хотя дћлались также попытки разсматривать ихъ, въ соотвћтствіи съ тћмъ же принципомъ реакціи, какъ двойныя превращенія. Особаго интереса заслуживаютъ изслћдованія, опредћляющія условія, при которыхъ въ молекулћ происходятъ подобныя изомерныя превращенія — такъ называемыя перегруппировки или перемћщенія атомовъ. Изъ такихъ изслћдованій мы должны упомянуть работу Гофманна о превращеніи метилированнаго анилина въ гомологи анилина68) и изслћдованіе Демоле относительно самопроизвольнаго окисленія производныхъ этилена69). {251}
Ббльшее значеніе имћютъ, впрочемъ, тћ явленія изомеріи, которыя не могутъ вовсе быть выражены или наглядно представлены общеупотребительными формулами. Примћры этого рода уже давно извћстны; нћкоторые изъ нихъ были уже раньше изучены, и недавно, послћ того какъ признали ихъ значеніе, были сдћланы попытки дать имъ особое объясненіе, которое исходитъ изъ теоріи валентности, но развиваетъ ее дальше и расширяетъ. Объ этомъ мы должны поговорить подробнће.
Уже въ седьмой лекціи (см. стр. 110) я упомянулъ объ открытіи виноградной кислоты, изомерной съ винной кислотой. Опредћленіе взаимнаго отношенія обћихъ этихъ кислотъ составляетъ содержаніе одного изъ изслћдованій Пастера, которое было произведено между 1848 и 1860 г. и имћетъ основное значеніе для разсматриваемаго здћсь вопроса70). Пастеръ доказалъ, что существуютъ четыре изомерныя винныя кислоты: виноградная кислота, недћятельная винная кислота, правая и лћвая винныя кислоты; обћ послћднія кристаллизуются въ равныхъ, но противоположно построенныхъ (энантіоморфныхъ) формахъ, и обћ онћ отклоняютъ поляризованный лучъ свћта на одинаковый уголъ, но въ противоположныхъ направленіяхъ; если смћшать равныя количества обћихъ кислотъ въ концентрированный растворъ, то получается оптически недћятельная виноградная кислота. Далће Пастеру удалось разложить виноградную кислоту обратно на обћ оптически дћятельныя винныя кислоты, для чего онъ пользовался тремя методами: 1) полученіемъ и кристаллизаціей аммонійнонатріевой соли винной кислоты, при чемъ получались двћ энантіоморфныя формы, которыя по отдћленіи и разложеніи давали обћ винныя кислоты; 2) образованіемъ солей винной кислоты съ цинхонициномъ и хинициномъ, при чемъ въ первомъ случаћ сперва выкристаллизовывается лћвая виннокислая соль, a во второмъ — правая виннокислая соль; 3) обработкой раствора кислой амміачной соли виноградной кислоты спорами Репісіlium glaucum; no мћрћ развитія грибка, въ растворћ остается почти исключительно лћвая винная кислота. Недћятельную винную кислоту Пастеръ получалъ нагрћваніемъ виннокислаго цинхонина; Дессеню же удалось доказать, что гри нггрћваніи до 200° эта кислота вновь превращается частью въ виноградную71). {252}
Подобнаго рода явленія наблюдались еще и у различныхъ другихъ веществъ, напримћръ, у глюкозъ, терпеновъ, многихъ алкалоидовъ, у амиловаго спирта, яблочной, молочной, аспарагиновой и миндальной кислотъ72).
Во всћхъ этихъ случаяхъ изомеріи соотвћтствующія вещества различаются лишь физическими свойствами, и поэтому Каріусъ73) ввелъ для такихъ явленій изомеріи названіе „физическая изомерія”.
Въ новћйшее время Вантъ-Гоффъ74) и нћсколько позже Лебель75) попытались объяснить и эти факты съ точки зрћнія теоріи атомности; они прежде всего высказали положеніе, что вещества бываютъ оптически дћятельными лишь тогда, когда ихъ молекула содержитъ асимметричный атомъ углерода, т. е. если въ нихъ содержится атомъ углерода, четыре валентности котораго связаны съ четырьмя различными группами атомовъ. Это положеніе вполнћ оправдывалось фактами въ томъ смыслћ, что всћ до тћхъ поръ извћстныя оптически дћятельныя вещества содержали асимметричные атомы углерода. Но при этомъ надо замћтить, что обратное положеніе невћрно, т. е. отнюдь не всћ вещества, содержащія асимметричные атомы углерода, обладаютъ вращательной способностью. Вантъ-Гоффъ пытался пояснить свою гипотезу съ помощью геометрическаго представленія о положеніи атомовъ въ пространствћ. Но объ этомъ рћчь будетъ впереди.
Задолго передъ тћмъ Рохледеръ76) обратилъ вниманіе на одинъ классъ веществъ, очень легко претерпћвающихъ изомерныя превращенія; онъ назвалъ ихъ ненасыщенными соединеніями, такъ какъ они образуются при выпаденіи атомовъ изъ насыщенныхъ соединеній. Послћднія теперь часто носятъ также названіе „веществъ бћдныхъ водородомъ”; мы подвергнемъ ихъ подробному разсмотрћнію, такъ какъ изученіе ихъ предсгавляетъ большой интересъ.
Куперъ въ своей статьћ о теоріи органическихъ соединеній77) приписываетъ углероду способность проявлять то двћ, то четыре {253} единицы сродства; ему поэтому было нетрудно объяснить существованіе такихъ соединеній, какъ окись углерода, этиленъ и др. Изъ другихъ химиковъ съ нимъ согласились Вюрцъ78) и Кольбе79). Послћдній производитъ углеводороды, бћдные водородомъ, отъ окиси углерода, какъ отъ типа, при чемъ онъ во всћхъ этихъ веществахъ принимаетъ наличность одного или нћсколькихъ атомовъ углерода, которые дћйствуютъ двумя единицами сродства. Онъ пишетъ:
С2O2 окись углерода, |
|
этиленъ, |
|
пропиленъ, или С2.С2H2 ацетиленъ. |
Вначалћ Кекуле пытался объяснить строеніе веществъ, менће богатыхъ водородомъ, болће тћснымъ расположеніемъ атомовъ углерода80), впослћдствіи же въ своихъ прекрасныхъ изслћдованіяхъ объ органическихъ кислотахъ81) онъ, повидимому, пришелъ ко взгляду, что въ этихъ веществахъ сродства углерода не вполнћ насыщены, и остаются свободныя единицы сродства или также пробћлы. Это предположеніе было въ нћкоторой степени подтверждено опытами самаго Кекуле и Каріуса82), изъ которыхъ выяснилось, что эти вещества могутъ соединяться съ водородомъ, хлоромъ, хлорноватистой кислотой и др. Такимъ образомъ, способность къ реакціямъ прямого присоединенія сдћлалась критеріемъ для этой группы соединеній. Этотъ критерій, правда, не можетъ быть еще рћшающимъ, такъ какъ и вещества, причисляемыя нами къ насыщеннымъ, обладаютъ этой же способностью. Къ послћднимъ соединеніямъ принадлежатъ, главнымъ образомъ, альдегиды, кетоны и др. вещества, содержащія кислородъ, вполнћ связанный
Для объясненія этихъ фактовъ допускали, что въ моментъ присоединенія группа (С = О)" переходитъ въ (C — О)"", т.-е. двухатомный радикалъ переходигъ въ четырехатомный. Позднћйшія весьма подробныя изслћдованія Фиттига надъ „ненасыщенными”, т. е. бћдными водородомъ кислотами, казалось, подтверждали вышеупомянутое воззрћніе83); другими словами, Фиттигъ полагалъ, что указанные факты лучше всего объясняются, если допустить, по крайней мћрћ въ {254} нћкоторыхъ соединеніяхъ, существованіе пробћловъ, т. е. наличность двувалентныхъ атомовъ углерода. Окись углерода и группа изонитриловъ или карбиламиновъ, почти одновременно открытая Гофманномъ84) и Готье85), доказываютъ, что совершенно обойти подобное допущеніе невозможно. Эти интересныя соединенія образуются какъ при обработкћ аминовъ хлороформомъ, такъ и при дћйствіи іодистыхъ алкиловъ на ціанистое серебро. Они изомерны нитриламъ, и ихъ строеніе можетъ быть выражено лишь формулой
N |
{ |
R |
C, |
предложенной впервые Готье86); здћсь R означаетъ одноатомный спиртовый радикалъ. Если считать азотъ трехзначнымъ, какъ это всегда ранће и дћлалось (гипотезу пятивалентнаго азота мы разсмотримъ въ одной изъ слћдующихъ лекцій), то углеродъ окажется либо двухатомнымъ, либо ненасыщеннымъ.
Впрочемъ, существуетъ классъ ненасыщенныхъ соединеній, въ которыхъ по Кекуле предполагается болће тћсная связь атомовъ углерода. Я имћю въ виду ароматическія соединенія. Подъ ними въ лрежнее время подразумћвался цћлый рядъ веществъ, стоящихъ въ близкомъ химическомъ отношеніи къ нћкогорымъ сильно пахучимъ масламъ.
Кекуле сперва показалъ, что всћ эти вещества могутъ быть разсматриваемы, какъ производныя бензола, и что ихъ химическая природа зависитъ отъ строенія этого углеводорода87). Въ пользу такого взгляда говорилъ цћлый рядъ прежнихъ наблюденій, но существенными оказались синтетическія изслћдованія, произведенныя незадолго передъ тћмъ Фиттигомъ въ сотрудничествћ съ Толленсомъ88) и др.89). Въ своихъ изслћдованіяхъ они воспользовались методомъ, принадлежащимъ Вюрцу90), т.-е. они дћйствовали натріемъ на смћсь, состоящую изъ бромозамћщенныхъ ароматическихъ углеводородовъ и изъ іодистыхъ алкиловъ, благодаря чему имъ удалось получить гомологи исходныхъ веществъ. Такимъ образомъ, имъ удалось доказать, что метилбензолъ, полученный изъ {255} бромбензола и іодистаго метила, идентиченъ съ толуоломъ, но этил-бензолъ отличается отъ ксилола, въ свою очередь весьма приближающагося по своимъ свойствамъ къ метилтолуолу или диметилбензолу. Мнћ нћтъ надобности здћсь подробнће разсматривать дальнћйшіе результаты этихъ интересныхъ работъ, такъ какъ они были получены лишь послћ появленія статьи Кекуле и отчасти даже были оредусмотрћны ею. Фундаментальное значеніе для теоретическихъ лзслћдованій, здћсь обсуждаемыхъ, имћли нћкоторые результаты работъ Бейльштейна. Такъ, онъ совмћстно съ Рейхенбахомъ91), доказалъ, что такъ называемая салиловая кислота, считавшаяся бензол-карбоновой кислотой, изомерной съ бензойной92), есть лишь нечистая бензойная кислота, и что всћ полученныя до того времени хлор-бензойныя кислоты могутъ быть сведены къ тремъ кислотамъ93).
Благодаря Кекуле, бензолъ въ качествћ ядра ароматическихъ веществъ получилъ совершенно исключительное значеніе, и потому Кекуле посвятилъ вопросу о его строеніи подробное изслћдованіе. Этимъ мы займемся въ слћдующей лекціи.
| {256} |
Теорія ароматическихъ соединеній. — Опредћленіе мћста въ ядрћ. — Хиноны. — Техника красильнаго дћла. — Циклическія связи. — Строеніе алкалоидовъ. — Синтезы. — Явленія уплотненія.
Кекуле, исходя изъ четырехатомности углерода, указываетъ, что въ соединеніяхъ жирнаго ряда атомы углерода связаны другъ съ другомъ одной валентностью1). Для бензола была принята слћдующая простая гипотеза: атомы углерода, направляя другъ къ другу поперемћнно одну и двћ валентности, образуютъ замкнутую цћпь, или кольцо. Изъ 24 единицъ сродства 6ти атомовъ углерода 18 идутъ на связываніе атомовъ углерода, такъ какъ
|
6 2 |
· 4 + |
6 2 | · 4 = 18. |
Остаются шесть свободныхъ единицъ сродства, которыя насыщаются шестью водородными атомами. Поэтому, по мнћнію Кекуле, бензолъ можно разсматривать, какъ правильный шестиугольникъ, стороны котораго являются поочередно то простыми, то двойными. У вершинъ находятся группы СН.
Эта схема должна прежде всего наглядно объяснить относительно бóльшую устойчивость бензола сравнительно съ углеводородами жирнаго ряда, которые представляютъ собою открытую углеродную цћпь, большею частью съ простой связью атомовъ углерода. Изъ этого представленія вытекаетъ далће въ высшей степени {257} важное для ароматическихъ соединеній положеніе, именно, что 6 водородныхъ атомовъ бензола расположены въ молекулћ симметрично, т.-е. что они равноцћнны.
При замћщеніи въ бензолћ этихъ атомовъ водорода образуются ароматическія соединенія. Но изъ равноцћнности атомовъ водорода слћдуетъ, что если только одинъ изъ этихъ атомовъ замћщается, то совершенно безразлично, какой именно подвергается замћщенію; другими словами, всћ однозамћщенные продукты бензола существуютъ лишь въ одной единственной формћ. Подобный взглядъ сталъ возможнымъ лишь послћ того, какъ была доказана идентичность метилбензола съ толуоломъ и бензойной кислоты съ салиловой кислотой (ср. стр. 225).
Когда происходитъ замћщеніе двухъ или болће атомовъ водорода, то гипотеза Кекуле предсказываетъ многочисленные изомеры, соотвћтственно различному относительному расположенію входящихъ группъ. Число изомеровъ можетъ быть опредћлено. Такъ, напримћръ, при замћщеніи двухъ атомовъ водорода бензола другими атомами или радикалами образуются три изомера, при чемъ вполнћ безразлично, будутъ ли вошедшія группы атомовъ идентичны или различны. Для трехзамћщенныхъ продуктовъ бензола при одинаковыхъ замћстителяхъ возможны три изомерныя формы; когда же двћ изъ вошедшихъ атомныхъ группъ не сходны съ третьей, то возможны шесть изомеровъ. Далће, эта гипотеза предвидитъ три изомера для четырехзамћщенныхъ продуктовъ бензола, если замћстители одинаковы, а пятизамћщенныхъ и шестизамћщенныхъ могутъ существовать лишь no oдной формћ, при условіи, что замћстителями являются одинаковые атомы или радикалы. Такимъ образомъ, при замћщеніи водородовъ бензола однимъ опредћленнымъ элементомъ могутъ образоваться всего 12 продуктовъ, что и было дћйствительно доказано въ одномъ случаћ: послћ того, какъ была доказана ошибочность утвержденія, что существуютъ два изомерныхъ пентахлорбензола2), Бейльштейну удалось показать, что существуютъ какъ разъ 12 хлорозамћщенныхъ3) продуктовъ бензола.
Изъ строенія бензола слћдуетъ, что этилбензолъ долженъ отличаться отъ трехъ возможныхъ диметилбензоловъ и, далће, что при {258} дћйствіи хлора или брома изъ толуола должны образовагься продукты замћщенія, относящіеся къ двумъ различнымъ классамъ и характеризующіеся тћмъ, что въ одномъ галоидъ замћщаетъ одинъ атомъ водорода бензола (ядра), а въ другомъ — одинъ атомъ водорода метила (боковой цћпи). Подобныя разіичія были дћйствительно обнаружены4). Бейльштейну5) удалось доказать, что смотря по тому, дћйствуетъ ли хлоръ на холоду или при температурћ кипћнія, образуются соединенія того или другого класса. Хлористыя соединенія первой группы, которыя въ качествћ двухзамћщенныхъ продуктовъ существуютъ въ числћ трехъ изомеровъ, не допускаютъ никакого обмћна хлора на іодъ, ціанъ, гидроксилъ или другія кислородныя группы. Соединенія же второй группы, которыя, какъ однозамћщенный продуктъ, представлены лишь однимъ веществомъ, обладаютъ свойствами хлорида спиртоваго радикала и поэтому, подобно ему, легко могутъ быть превращены въ спирты, эфиры и т. д. Слћдующія двв формулы:
C6H4Cl(CH3) |
C6H5CH2Cl |
|
хлоръ-толуолы |
хлористый бензилъ |
выражаютъ эти различія, которыя, по мнћнію Кекуле, обусловливаются тћмъ, что атомъ хлора въ хлоръ-толуолахъ очень тћсно соединенъ съ углеродомъ, почти окруженъ послћднимъ, тогда какъ въ хлористомъ бензилћ онъ связанъ подобно галоиду хлористыхъ алкиловъ. Такъ же точно объясняются существенно различныя свойава феноловъ и ароматическихъ спиртовъ. Тогда какъ у первыхъ гидроксильная группа замћщаетъ одинъ водородь бензола, въ бензиловомъ спиртћ она входитъ въ метиловую группу:
C6H4(OH)CH3 |
C6H5CH2OH |
|
крезолы |
бензиловый спиртъ. |
Лишь послћднее соединеніе имћетъ свойства первичнаго спирта; при окисленіи оно даетъ альдегидъ и кислоту, тогда какъ эфиры первыхъ переходятъ этимъ путемъ въ алкилоксибензойныя кислоты C6H4(OR)CO2H6).
Очень важное значеніе имћютъ взгляды Кекуле на окисленіе ароматическихъ углеводородовъ въ кислоты. „Спиртовые радикалы, {259} примыкающіе къ ядру C6 въ видћ боковыхъ цћпей, при достаточно энергичномъ окисленіи превращаются въ группу CO2H. Такимь образомъ, продукты окисленія всегда содержатъ такое же число бо ковыхъ цћпей, какъ и вещества, изъ которыхъ они произошли. При болће умћренномъ окисленіи въ тћхъ производныхъ бензола, которыя содержатъ два или болће спиртовыхь радикала, удается пріостановить процессъ окисленія въ моментъ образованія промежуточныхъ продуктовъ: сперва, окисляется лишь одинъ спиртовый радикалъ, другой же остается неизмћннымъ. Такъ, диметилбензолъ даетъ сперва толуиловую кислоту, а затћмъ терефталевую”:
|
|
|
|||||||||||
ксилолъ |
толуиловая кислота |
терефталевая кислота |
Наконецъ, слћдуетъ отмћтить, что Кекуле, при дальнћйшей разработкћ своихъ воззрћній, выяснилъ строеніе открытыхъ Митчерлихомъ азосоединеній7), въ особенности же діазосоединеній8), открытыхъ и подробно изслћдованныхъ Гриссомъ, а также взаимное отношеніе этихъ веществъ9).
Указанныя изслћдованія ароматическихъ соединеній оказали сильное вліяніе на химію. Эти вещества, находившіяся до того времени какъ бы въ пренебреженіи, сдћлались въ послћдующее десятилћтіе почти исключительнымъ предметомъ изслћдованія многихъ химиковъ. Безчисленные случаи изомеріи дћлали раньше эту область весьма мало доступной, такъ какъ лишь немногіе были способны оріентироваться во всћхъ фактахъ; теперь же, когда для послћднихъ выработалось простое объясненіе, это царство изомеріи сдћлалось, напротивъ, особенно привлекательнымъ для изслћдователей. Что важнће всего, благодаря этимъ изслћдованіямъ взгляды Кекуле подтвердились въ самомъ широкомъ объемћ; они ни въ какомъ существенномъ пунктћ не претерпћли измћненія, а отдћльныя противорћчившія имъ данныя вскорћ же были опровергнуты, какъ неправильныя. Но въ то же время вслћдствіе открытія новыхъ многочисленныхъ фактовъ указанныя гипотезы были существенно расширены и дополнены. {260}
Въ первую очередь здћсь слћдуетъ упомянуть задачу опредћленія химическаго мћста. Эта задача, лишь намћченная Кекуле10), была впослћдствіи вполнћ разрћшена.
Опредћлить мћсто въ ароматическомъ ряду значитъ установить взаимныя отношенія входящихъ въ бензолъ замћстителей. Само собой разумћется, что эта задача можетъ имћть значеніе лишь для двузамћщенныхъ продуктовъ. Возможные здћсь по Кекуле три изомера получили названія: орто, мета- и пара-соединеній; вопросъ здћсь, прежде всего, состоитъ въ томъ, какъ нужно себћ представлять ихъ строеніе. Первый шагъ въ этомъ направленіи былъ сдћланъ Байеромъ11). Послћ того, какъ Фиттигъ12) доказалъ, что мезителенъ есть триметилбензолъ, Байеръ заключилъ изъ способа образованія этого углеводорода, что онъ состоитъ изъ бензольнаго ядра, въ которомъ симметрично расположены три метиловыя группы, т.-е. что мезитиленъ и изофталевая кислота представляютъ собою метасоединенія. Эта гипотеза была доказана впослћдствіи13), послћ точнаго изслћдованія продуктовъ замћщенія мезитилена. Гребе послћ тщательныхъ изслћдованій и опытовъ относительно природы нафталина14) удалось доказать, что послћдній, а, слћдовательно, и фталевая кислота должны быть разсматриваеімы, какь орто-соединенія. Наконецъ, Ладенбургъ, принявъ во вниманіе изслћдованія Гюбнера и Петерманна15), указалъ16), что кислоты терефталевая и параоксибензойная принадлежатъ къ ряду парасоединеній. Очень красивая и оригинальная мысль, ириведшая кърћшенію этой задачи, принадлежитъ Кернеру17); онъ показалъ, что изъ двузамћщенныхъ продуктовъ съ одинаковыми замћстителями при дальнћйшемъ введеніи одной атомной группы возможно получить три изомера, если начальное соединеніе принадлежало къ метаряду, два изомера, если оно было орто соединеніемъ, и, наконецъ, изъ парасоединенія возможно получить только одинъ единственный трехзамћщенный продуктъ. По этому продукту Кёрнеръ самъ опредћлилъ строеніе дибромбензоловъ, a Гриссъ18) — строеніе фенилендіаминовъ.
Послћ того, какъ было выяснено строеніе нћкоторыхъ соединеній, возникъ еще вопросъ о томъ, чтобы при помощи реакцій, {261} протекающихъ до конца, привести въ связь эти соединенія съ остальными и такимъ образомъ рћшить задачу о всћхъ двузамћщенныхъ пролуктахъ бензола. Это оказалось вполнћ возможнымъ; мало того, было опредћлено также положеніе замћстителей въ замћщенныхъ соединеніяхъ высшаго порядка. Во всћхъ этихъ изслћдованіяхъ, нерћдко весьма обширныхъ и осуществленныхъ соединенными силами многихъ изслћдователей, очень значительныя услуги оказали реакціи Грисса (см. выше).
Для теоріи ароматическихъ соединеній существенное значеніе имћло также то обстоятельство, что химикамъ, на основаніи четырехатомности углерода и цћлаго ряда точно установленныхъ фактовъ, удалось доказать для строенія бензола два основныхъ положенія, а именно: 1) равноцћнность атомовъ водорода въ бензолћ и 2) симметричное положеніе двухъ паръ водородныхъ атомовъ относительно третьей пары19).
Вопросъ относительно формулы бензола, т.-е. о взаимной связи содержащихся въ немъ атомовъ углерода, вызвалъ продолжительный споръ послћ того, какъ было указано, что формула Кекуле не вполнћ удовлетворяетъ требованіямъ, заключающимся въ двухъ вышеупомянутыхъ положеніяхъ20). Изъ этого слћдовало, что лишь такъ называемая призматическая формула въ состояніи ясно представить картину изомерныхъ отношеній въ ароматическомъ ряду; кромћ того, эта формула правильно выражала21) термическіе эффекты (по Томсену) и молекулярные объемы бензола и его производныхъ (no P. Шиффу). Тћмъ не менће шестиугольная формула Кекуле является общепринятой, такъ какъ во многихъ отношеніяхъ, особенно же въ тћхъ случаяхъ, когда рћчь идетъ о продуктахъ присоединенія водорода22), она имћетъ преимущества передъ всћми остальными формулами.
Изъ всћхъ значительныхъ работъ, вызванныхъ изслћдованіями Кекуле, я ближе разсмотрю здћсь лишь одну, которую надо {262} считать наиболће важной изъ числа всћхъ Я имћю въ виду работу Гребе о хинонахъ.
Кекуле высказалъ23) оригинальную мысль о хинонћ24), открытомъ Воскресенскимъ. Это соединеніе содержитъ, по Кекуле, открытую цћпь изъ шести атомовъ углерода, которые, какъ и въ бензолћ, связаны между собой поперемћнно простой и двойной связью. Гребе25) противопоставилъ этому взтляду другой; no era мнћнію, хинонъ есть лишь производное бензола, въ которомъ 2 атома водорода замћщены 2 атомами кислорода, связанными другъ съ другомъ. Это мнћніе Гребе основываетъ, главнымъ образомъ, на отношеніи хинона къ гидрохинону и превращеніи хлоранила съ помощью хлористаго фосфора въ гексахлорбензолъ. Эти доводы были настолько убћдительны, что мнћніе Гребе стало всћми раздћляться, хотя вскорћ и оказалось, что хинонъ принадлежитъ не къ ортосоединеніямъ, какъ думалъ Гребе, а къ парасоединеніямъ26). Впослћдствіи Гребе изучалъ также и другіе хиноны и такимъ образомъ пришелъ къ изслћдованію ализарина, желая доказать его хинонную природу. Гребе въ сотрудничествћ съ Либерманомъ показалъ, пользуясь однимъ изъ открытыхъ Байеромъ27) методовъ, вопервыхъ, что ализаринъ является производнымъ не нафталина, какъ тогда думали, а антрацена28), что онъ представляетъ собою хинонъ, а именно діоксиантрахинонъ. Далће, въ 1869 году имъ удалось также синтезировать это цћнное красящее вещество29), а вскорћ оно было приготовлено технически по методу, выработанному Гребе, Либерманомъ и Каро30). Это создало одну изъ важнћйшихъ отраслей современной промышленности.
Вообще, теорія ароматическихъ соединеній оказала болыіюе вліяніе на техническія производства и особенно на технику красильнаго дћла. Надо, впрочемъ, замћтить, что техническое производство анилиновыхъ красокъ возникло совершенно независима отъ упомянутыхъ изслћдованій, и, главнымъ образомъ, благодаря обширнымъ изслћдованіямъ Гофмана объ анилинћ и гомологичныхъ съ нимъ основаніяхъ. Первыя анилиновыя краски были открыты и утилизированы задолго до знаменитаго труда Кекуле. {263}
Еще въ 1856 году Перкинъ31) открылъ мовеинъ, а въ 1859 году Вергюэнъ открылъ фуксинъ32), и еще раньше образованіе его наблюдали Натансонъ33), Гофманъ34) и др.; несмотря, однако, на всесказанное, дальнћйшее развитіе техники красильнаго производства находится въ тћсной зависимости отъ болће правильнаго взгляда на строеніе ароматическихъ соединеній. По этому поводу напомнимъ, напримћръ, объ открытіи ортотолуидина Розенштилемъ35) и о выясненіи химической природы розанилина. Путь для этого былъ проложенъ Гофманомъ36), а окончатеіьное выясненіе удалось Э. и О. Фишерамъ37)
Производство другихъ классовь красящихъ веществъ, хотя и возникло независимо отъ какихъ-либо теорій, своимь развитіемъ, однако, много обязано теоріи. Примћромъ могутъ служить феноловыя краски, первымъ представителемъ которыхъ является розоловая кислотз, открытая Кольбе, Шмитомъ38) и одновременно Ж. Персоцемъ39). Производство этихъ красокъ, благодаря открытымъ и изученнымъ Байеройъ40) фталеинамъ, приняло обширные размћры, какъ и производство азокрасокъ, которыя, почти безъ исключенія, находятся въ связи съ важными работами Грисса.
Но интерпретація ароматическихъ соединеній Кекуле оказала значительно болће непосредственное вліяніе на воззрћнія относительно болће сложныхъ углеводородовъ.
Въ одной интересной статьћ объ ароматическихъ кислотахъ, содержащей критику воззрћній Кекуле, Эрленмейеръ41) приписываетъ нафталину C10H8 слћдующую формулу:
H |
H |
H |
H |
|||||||||
¬ |
C |
= |
C |
— |
C |
= |
C |
— |
C |
= |
C |
® |
| |
| |
|||||||||||
HC |
CH |
|||||||||||
|| |
|| |
|||||||||||
HC |
CH |
|||||||||||
Согласно этой формулћ нафталинъ можно представлять себћ состоящимъ изъ двухъ бензольныхъ шестиугольниковъ съ двумя общими {264} углеродными атомами. Это предположеніе сдћлалось очень вћроятнымъ послћ экспериментальныхъ и теоретическихъ изслћдованій Гребе42). Въ пользу этого же представленія говоритъ синтезъ нафталина изъ фенилбутилена, произведенный Аронгеймомъ43), и особенно синтезъ онафтола44), произведенный Фиттигомь и основанный на шестиугольной формулћ бензола. Этотъ взглядъ на строеніе нафталина приводитъ къ допущенію двухъ изомерныхъ однозамћщенныхъ продуктовъ; дћйствительно, уже Фарадэй получилъ двћ нафталинъ-моно-сульфокислоты45), и съ того времени подобные случаи наблюдались уже неоднократно. Больше того, получилась даже возможность опредћлять съ болыиой степенью вћроятности мћста замћстителей въ кольцћ; тщательное изученіе производныхъ нафталина здћсь также обнаружило полное совпаденіе фактовъ съ теоріей46).
Антраценъ, основное вещество столькихъ интересныхъ соединеній и цћнныхъ красящихъ веществъ, былъ уже давно признанъ соединеніемъ, содержащимъ замкнутое углеродистое кольцо, т.-е. „производнымъ отъ бензола ядромъ”. Въ своемь первомъ сообщеніи о соотношеніи между ализариномъ и антраценомъ47) Гребе и Либерманъ усгановили для антрацена формулу, изъ которой видно, что послћдній есть трибензолъ, т.-е. состоитъ изъ трехъ молекулъ бензола, у которыхъ четыре атома углерода общіе. Впослћдствіи они въ своей большой статьћ предложили на ряду съ этой формулой для антрацена другую, сходную съ этой, но казавшуюся имъ менће вћроятной. Послћ открытія изомернаго съ антраценомъ фенантрена и тщательнаго изученія послћдняго, чћмъ мы обязаны почти одновременнымъ изслћдованіямъ Гребе и Глазера48), а также Фиттига и Остермейера49), было признано, что первая формула антрацена относится къ фенантрену, а для антрацена была удержана вторая, позднћйшая формула. Послћдняя вполнћ удовлетворяетъ всћмъ требованіямъ, что весьма удивигельно, если принять во вниманіе многочисленность изомеровъ въ антраценовой группћ. Эта формула можеть также дать наглядное представленіе объ остроумныхъ синтезахъ антрахинона, ализарина, {265} хинизарина и пурпурина, произведенныхъ Кекуле и Франшимономъ50), Байеромъ и Каро51), а также Пикаромъ52), при чемъ она очень ясно выражаетъ соотношенія между фталевымъ ангидридомъ и антрахинономъ.
Далће было найдено строеніе флуорена, флуорантена, хризена, пицена, ретена и пирена, и черезъ то выяснено ихъ отношеніе къ бензолу. Флуоренъ СігН1053), открытый Бертело, былъ полученъ Фиттигомъ54) при перегонкћ дифениленкетона надъ цинковой, пылью и такимъ образомъ было установлено, что онъ представляетъ собой дифениленметанъ:
|
СH2. |
Флуорантенъ (идрилъ) С15H10, изолированный Гольдшмидтомъ55) изъ ртутной руды въ камерахъ для конденсаціи ртути и встрћчающійся также въ каменноугольной смолћ56), есть, вћроятно, дифениленпропиленъ:
C6 |
H4 |
— |
CH |
| |
| |
||
| |
CH |
||
| |
|| |
||
C6 |
H4 |
— |
CH |
Хризенъ С18Н12 на основаніи одного изъ синтезовъ Гребе57) считается нафтиленфенантреномъ:
C6 |
H4 |
— |
CH |
| |
|| |
||
C10 |
H6 |
— |
CH, |
т.-е. фенантреномъ, въ которомъ одна фениленовая группа замћщена нафтиленовой, тогда какъ пиценъ С22Н14 можетъ быть разсматриваемъ, какъ фенантренъ, въ которомъ обћ фениленовыя группы замћщены двумя нафтиленовыми58):
C10 |
H6 |
— |
CH |
| |
|| |
||
C10 |
H6 |
— |
CH. |
| {266} |
Ретенъ C18H18 по изслћдованіямъ Бамбергера и Гукера59) есть метилпропилфенантренъ:
C |
H |
— |
C6H4 |
|
|| |
| |
|
||
C |
H |
— |
C6H2 |
Наконецъ, пиренъ C6H12 есть нафталинъ60), конденсированный съ двумя бензольными ядрами.
Другія изслћдованія выяснили зависимость между азотъ содержащими соединеніями, особенно между алкалоидами и бензоломъ. Эта область, развившаяся лишь въ теченіе послћднихъ десятилћтій, дала уже столь замћчательные результаты, что я не могу обойти ее молчаніемъ.
Аналогія между формулами бензола C6H6 и нафталина C10H8, съ одной стороны, и формулами пиридина C5H5N и хинолина C9H7N, съ другой, вызвали предположеніе, что послћднія соединенія могутъ образоваться изъ первыхъ посредствомъ замћщенія группы CH азотомъ; такимъ образомъ для пиридина и хинолина были установлены двћ слћдующія формулы:
 |
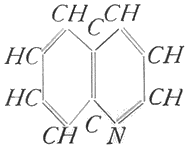 |
пиридинъ |
хинолинъ. |
| {267} |
Объ этой гипотезћ стало извћстно изъ частныхь сообщеній Кёрнера, по имени котораго она потому и называется. Впервые же ее опубликоваль Дьюаръ61).
Въ подтвержденіе ея можно привести въ настоящее время большое число фактовъ; главнћйшіе изъ нихъ я сейчасъ укажу.
Уже Андерсонь, открывшій пиридинъ, нашелъ въ костяномь маслћ, кромћ пиридина, еще цћлый рядъ гомологичныхъ основаній62). Послћдующее изслћдованіе костной смолы дало до послћдняго времени липіь метилпиридины63), подобно тому какъ въ каменноугольной смолћ содержатся лишь метилбензолы. Но извћстны также пиридины, замћщенные этиломъ и пропиломъ64). Эти основанія къ окисленію относятся точно такъ же, какъ и алкилъ-замћщенные бензолы, т.-е. каждая боковая цћпь при достаточномъ окисленіи даетъ группу СО2Н, такъ что и здћсь по основности образовавшейся кислоты можно заключать о количествћ боковыхъ цћпей въ окисленномъ основаніи63)64).
Явленія изомеріи въ пиридинћ значительно сложнће, чћмъ въ бензолв, такъ какъ атомы водорода въ первомъ не равноцћнны; пиридинъ, какъ на это впервые указалъ, кажется, Вейдель, долженъ давать три различныхъ однозамћщенныхь продукта65). Этотъ выводъ также подтверждается опытомъ, такъ какъ намъ извћстны три монокарбоновыя кислоты66), три метилъ-67) и три этилъ-пиридина68). Скраупъ довольно вћрно опредћлилъ мћста замћстителей въ пиридиновыхъ соединеніяхъ69).
Синтезъ пиридина, произведенный Рамзаемъ70) по примћру знамениіаго синтеза бензола изъ ацетилена Бертело71), а также {268} и синтезъ производныхъ72) пиридина могутъ служить подтвержденіемъ пиридиновсй формулы. Наконецъ, въ этомь отношеніи очень важно было также превращеніе производныхъ пиридина въ производныя. бензола73).
Формула хинолина была вначалћ обоснована многочисленными синтезами; изъ нихъ первымъ является синтезъ Кёнигса74), затћмъ Байера75) и, наконецъ, синтезъ Скраупа76), столь важный для всей группы. Этотъ синтезъ Скраупа основанъ на осуществленіи идеи, намћченной Гребе77.
Хинолинъ также служилъ исходнымъ матеріаломъ для большого числа соединеній, которыя образуются изъ него и превращаются въ него подобно тому, какъ бензолъ переходитъ въ ароматическія соединенія и получается изъ этихъ гюслћднихъ.
Слћдуетъ еще отмћтить отношенія между пиридиномъ и хинолиномъ. Подобно тому, какъ послћдній при окисленіи превращается въ бензолортодикарбоновую кислоту (фталевую кислоту)78), хинолинъ при окисленіи переходитъ, по Гугеверфу и ВанъДорпу79), въ орто-(αβ-)пиридиндикарбоновую кислоту. Оба эти изслћдователя изолировали также изъ каменноугольной смолы80) изохинолинъ, строеніе котораго они тотчасъ вћрно распознали; впослћдствіи оно было подтверждено цћлымъ рядомъ синтезовъ81). Существованіе и формула этого основанія даютъ намъ дальнћйшее подтвержденіе нашего взгляда на отношенія между пиридиномъ и хинолиномъ.
Но наибольшее значеніе имћетъ то обстоятельство, что самые важные алкалоиды оказываются производными пиридина и хинолина (или ихъ гидропродуктовъ) подобно тому, какъ ароматическія масла являются производными бензола. Первый относящійся сюда фактъ былъ найденъ въ 1842 году Жераромъ, открывшимъ, что хинолинъ есть продуктъ расщепленія хинина, цинхонина и стрихнина82). Въ 1867 году посредствомъ окисленія никотина Губеръ получилъ {269} кислоту C6H5NO283), признанную имъ тремя годами позже пиридинкарбоновой кислотой84), что сначала подвергалось сомнћнію, но затћмъ было подтверждено85). Вертгеймомъ и Рохледеромъ путемъ расщепленія пиперина былъ открыть пиперидинъ86); правильная формула его была установлена Кагуромъ87) и Андерсономъ88); Гофманъ считалъ его продуктомъ присоединенія водорода къ пиридину89), и это мнћніе было подтверждено Кёнигсомъ и др.90)
Эти и нћкоторые другіе факты, давшіе возможность установить съ несомнћнностью опредћленныя отношенія многихъ естественныхъ основаній къ пиридину91), привели Вышнеградскаго къ указанному выше взгляду на строеніе алкалоидовъ92); годъ спустя его мнћніе было подробнће обсуждено и обосновано Кёнигсомъ93). Съ того времечи такое воззрћніе упрочилось, главнымъ образомъ, вслћдствіе того, что былъ открытъ цћлый рядъ подтверждающихъ его фактовъ. Такъ, при окисленіи берберина Вейдель получилъ пиридин-трикарбоновую кислоту94), Герихтенъ выдћлилъ изъ наркотина95) пиридин-дикарбоновую кислоту, Ладенбургъ изъ атропина дибромпиридинъ96), a Гофманнъ превратилъ коніинъ въ пропилпиридинъ97). Впрочемъ, въ послћднее время, когда оказалось, что нћко торые алкалоиды являются также производмыми пиролла, изохинолина, морфолина и др., для нихъ могла быть предложена значительно болће общая точка зрћнія, согласно которой алкалоиды являются „основными соединеніями, встрћчающимися въ природћ и содержащими по меньшей мћрћ одинъ атомъ N въ циклической системћ”98).
Общепризнанный успћхъ вышеупомянутыхъ формулъ пиридина и хинолина далъ основаніе примћнить подобную же точку зрћнія и ко многимъ другимъ веществамъ. Раньше всего мы должны здћсь упомянуть о формулћ, установленной въ 1869 году Байеромъ {270} и Эммерлингомъ99) для индола100), родоначальника большинства производныхъ индиго:
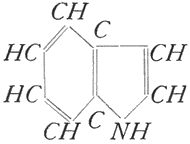 |
индолъ. |
Согласно этой формулћ индолъ является двойнымъ ядромь, подобно нафталину и хинолину. Этотъ взглядъ пріобрћлъ большее значеніе послћ того, какъ Байеръ и Эммерлингъ101) нћсколько позже стали и пирроллъ разсматривать, какъ „кольцо”. Теперь между тшрролломъ и индоломъ установилось то же соотношеніе, какъ между пиридиномъ и хинолиномъ или между бензоломъ и нафталиномъ:
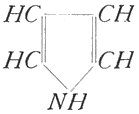 |
пирроллъ. |
Имћемъ:
C6H6 |
C10H8 |
|
бензолъ |
нафталинъ |
|
C5H5N |
C9H7N |
|
пиридинъ |
хинолинъ |
|
C4H5N |
C8H7N |
|
пирроллъ |
индолъ. |
Въ то же время открытый Лимприхтомъ тетрафенолъ102) (фурфуранъ или, лучше, фуранъ) С4H4O получилъ формулу, аналогичную формулћ пирролла: NH-группу послћдняго представляютъ себћ замћщенной черезъ О. Къ этому соединенію примыкаетъ открытый В. Мейеромъ тіофенъ, С4H4S103), который можно разсматривать какъ фуранъ, содержащій сћру; онъ успћлъ уже пріобрћсти большое значеніе благодаря очень большому числу своихъ производныхъ. Характерной чертой тіофена является сходство его и его производныхъ съ бензоломъ и производными послћдняго. {271}
Напомнимъ еще обь открытомъ Фритче карбазолћ104). Гребе105) разсматривалъ это соединеніе какь флуоренъ, въ которомъ группа СH2 замћщена черезъ NH:
|
NH. |
Далће, Гребе и Каро открыли въ неочищенномъ антраценћ акридинъ106), который разсматривается, какъ азотированный антраценъ107) или фенантренъ108). Сюда же относятся еще пиразолъ109), производнымъ котораго является антипиринъ и мирфолинъ, стоящій, no мнћнію Кнорра110), очень близко къ морфину, и пиперазинъ111), предложенный въ качествћ растворителя мочевой кислоты; впрочемъ, въ этомъ отношеніи его превзошелъ лизидинъ112), который, подобно гліоксалинамъ, является производнымъ имидазола. Въ заключеніе упомянемъ еще о пуринћ113), имћющемъ большое значеніе, какъ скелетъ мочевой кислоты и кафеина. Пуринъ можно разсматривать, какъ спайное соединеніе пиридина съ гліоксалиномъ:
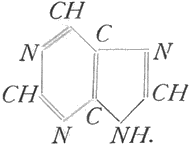 |
пуринъ. |
Съ другой стороны, пуринъ является также индоломъ, въ которомъ три группы СН замћщены тремя атомами N.
Еще раньше я указалъ (см. стр. 109), что поводомъ ко всћмъ этимъ изслћдованіямъ относительно строенія органическихъ веществъ послужили многочисленныя явленія изомеріи, съ которыми химикъ встрћчается на каждомъ шагу, и которыя вызываютъ въ немъ потребность создать себћ представленіе объ ихъ причинћ. Нельзя {272} отрицать заслугъ теоріи валентности, или значности, элементовъ, которая въ высокой мћрћ удовлетворяла этой потребности; въ этомъ и заключается все ея громадное значеніе. Но, съ другой стороны, нельзя отрицать, что основанія этого ученія совсћмъ не были разработаны точно и ясно; обь этомъ я скажу подробнће въ слћдующей лекціи. Пока же замћтимъ, что объясненіе изомеріи стало возможнымъ не только благодаря успћхамъ нашихъ теоретическихъ знаній, но, главнымъ образомъ, вслћдствіе того, что количество экспериментальнаго матеріала чрезвычайно возросло. Этимъ послћднимъ мы обязаны бóльшею частью методу, который давно уже былъ признанъ возможнымъ, но выдающагося значенія достигъ лишь въ послћднее время. Я имћю въ виду синтезъ. Впрочемъ, послћдній во многихъ случаяхъ служитъ не только средствомъ, но и самой цћлью нашихъ стремленій.
Въ одной изъ предыдущихъ лекцій (седьмой) я уже упомянулъ о первомъ синтезћ органическаго вещества, именно мочевины, произведенномъ Вёлеромъ, и о томъ важномъ значеніи, какое имћлъ этотъ опытъ для всего естествознанія. Только значительно позже подобные же результаты были достигнуты и для другихъ веществъ. Благодаря обширному труду Бертело114), значеніе этого метода получило правильное освћщеніе. Бертело получилъ синтетическимъ путемъ нћкоторыя особенно важныя вещества, а именио: болотный газъ, этиленъ, спиртъ, муравьиную кислоту и др.
Во многихъ случаяхъ выяснилось, что для установленія химической природы соединенія старый аналитическій методъ не всегда бываетъ достаточнымъ, и тогда необходимымъ дополненіемъ служитъ синтетическій методъ. Почти всегда анализъ предшествуетъ синтезу, но, за немногими исключеніями, исторію вещества завершаетъ синтезъ, и этимъ послћднимъ большею частью исчерпывается интересъ, который это вещество представляло собою для научнаго изслћдованія.
Съ этой точки зрћнія синтезы особенно важныхъ веществъ заслуживаютъ того, чтобы здћсь о нихъ упомянуть (ср. стр. 108). Такъ, въ 1850 году Штреккеръ получилъ аланинъ изъ альдегидъамміака, синильной и соляной кислотъ115); пять лћтъ спустя Зиминъ получилъ горчичное масло изъ іодистаго аллила и роданистаго {273} калія116); связь же этого масла съ чесночнымъ масломъ была установлена Вертгеймомъ еще значительно раньше117). Гликоль былъ синтетически полученъ Перкиномъ и Дюппа118) изъ бромъуксусной кислоты и амміака; этимъ же самымъ методомъ Гюфнеръ впослћдствіи гюлучилъ лейцинъ119). Синтетическая виноградная кислота получена Перкиномъ и Дюппа120) изъ дибромъянтарной кислоты, a яблочная кислота получена Кекуле121) изъ монобромъянтарной кислоты. Синтезомъ таурина мы обязаны Кольбе122), получившему его изъ изэтіоновой кислоты. Антраценъ впервые былъ искусственно полученъ Лимприхтомъ при кипяченіи бензилъхлорида съ водой123); гуанидинъ былъ полученъ Гофманномъ124) изъ хлоръпикрина и Эрленмейеромъ125) изъ ціанъамида и амміака. Фольгардъ126) добылъ синтетически креатинъ изъ хлоръуксусной кислоты, которую онъ съ помощью метилъамина превратилъ въ саркозинъ, a послћдній былъ имъ превращенъ въ креатинъ дћйствіемъ ціанъамида. Пиколинъ и коллидинъ были получены синтечески Байеромъ127) изъ альдегидъ-амміаковъ; кротоновую кислоту Кекуле получилъ изъ альдегида128), а Фридель и Сильва получили глицеринъ, исходя изъ ацетона129). Вюрцъ130) превратилъ гликольхлоргидринъ посредствомъ триметилъамина въ холинъ (нейринъ), а Реймеръ и Тиманъ получили ванилинъ изъ гваякола131). Гримо синтезировалъ аллантоинъ132), аллоксантинъ133) и лимонную кислоту134), Эрленмейеръ — тирозинъ135), Ладенбургъ — пиперидинъ136) и коніинъ137), а Горбачевскій — мочевую кислоту138). Слћдуетъ отмћтить синтезъ синяго индиго, произведенный Байеромъ139), такъ какъ этотъ синтезъ интересенъ не только въ томъ отношеніи, что онъ способствовалъ установленію и выясненію строенія важнаго красящаго вещества, но еще и потому, что онъ былъ произведенъ съ помощью новыхъ и своеобразныхъ реакцій. {274}
Совершенно особаго вниманія заслуживаютъ общіе методы, сдћлавшіе возможными синтезы цћлыхъ группъ веществъ; поэтому о важнћйшихъ изъ нихъ мы здћсь упомянемъ.
Полученіе углеводородовъ изъ веществъ менће сложнаго состава впервые удалось Франкланду140); изъ іодистаго метила и цинка онъ получилъ диметилъ (этанъ), а изъ іодистаго этила и цинка — діэтилъ (бутанъ). Этой реакціи Вюрцъ далъ болће широкое примћненіе: онъ дћйствовалъ натріемъ141) на смћсь алкилъіодюровъ; этотъ методъ Фиттихъ и Толленсъ использовали для синтеза ароматическихъ углеводородовъ142). Послћдніе еще до этого времени приготовлялись по реакціи, открытой Бертело путемъ перегонки смћси солей бензойной и жирныхъ кислотъ143). Цинке выработалъ синтетическій методъ, сдћлавшій возможнымъ полученіе углеводородовъ съ двумя фенильными группами; этотъ методъ основанъ на дћйствіи бензилъхлорида на ароматическіе углеводороды въ присутствіи цинковой пыли144). Тћ же соединенія, по мнћнію Байера, могутъ быть получены изъ альдегидовъ и ароматическихъ углеводородовъ при помощи водоотнимающихъ веществъ145). Весьма общее примћненіе нашелъ методъ, открытый Фриделемъ и Крафтомъ146), дающій возможность съ помощью хлористаго алюминія вводить въ ароматическое соединеніе самыя разнообразныя группы съ отщепленіемъ соляной кислоты или воды. Такимъ образомъ удается синтезировать углеводороды, кетоны, кислоты и др. соединенія.
Изслћдованія Пелуза147),148), Пиріа149), Вюрца150) дали возможность переходить въ ряду первичныхъ алкоголей отъ низшаго къ ближайшему высшему члену: алкоголь превращаютъ въ нитрилъ, затћмъ въ кислоту, альдегидъ и въ алкоголь по слћдующимъ уравненіямъ:
СNK + С2H5SO4K |
= С2H5CN + SO4K2 |
С2H5CN + KOH + H2O |
= С2H5CO2K + NH3 |
С2H5CO2K + CHO2K |
= С2H5COH + CO3K2 |
С2H5COH + H2 |
= С2H5CH2OH. |
| {275} |
Либенъ и Росси доказали всеобщность этихъ методовъ151). Существуетъ еще другой путь для полученія изъ какого-либо спирта слћдующаго за нимъ гомологичнаго члена: нитрилъ превращается водородомъ in statu nascendi въ аминъ (Мендіусъ152), а этотъ послћдній разлагается при помощи азотистой кислоты (Гёнтъ153). О синтезћ же вторичныхъ и третичныхъ спиртовъ мы говорили уже раньше (стр. 246 и 248). Полученіе феноловъ изъ углеводородовъ удается по способу, указанному оцновременно Дюссаромъ, Кекуле и Вюрцемъ154).
Для синтеза кислотъ, какъ уже упоминалось (стр. 249), пріобрћлъ большое значеніе ацетоуксусный эфиръ. Въ новћйшее время аналогичное примћненіе получили малоновый155) и бензоилуксусный156) эфиры; съ другой стороны, съ помощью малоноваго и ацетоуксуснаго эфировъ явилась возможность синтетически получать интересныя азотистыя соединенія157).
Такъ называемая реакція Перкина158), связанная съ наблюденіями Бертанини159) и основанная на дћйствіи альдегидовъ на соли органическихъ кислотъ въ присутствіи отнимающихъ воду веществъ, дала возможность получать большое число кислотъ; вначалћ она примћнялась въ нћсколько сложной формћ для синтеза кумарина160). Вышеупомянутый переходъ нитриловъ въ кислоты былъ также использованъ для полученія многоосновныхъ кислотъ, при чемъ для образованія ихъ можно исходить либо, по Симпсону161), изъ ціанистыхъ соединеній многоатомныхъ радикаловъ, либо же, по методу Кольбе162) и Миллера163), изъ ціанъзамћщенныхъ кислотъ. Нужно, впрочемъ, замћтить, что первое превращеніе ннтрила въ кислоту было произведено уже Пелузомъ164); въ 1831 году онъ превратилъ синильную кислоту въ муравьиную, а амміачную соль послћдней превратилъ кипяченіемъ обратно въ синильную кислоту. Нћсколько лћтъ спустя Винклеръ165) превратилъ горькоминдальное {276} масло, содержащее синильную кислоту, въ миндальную кислоту; эту реакцію правильно объяснилъ Либихъ166). Далће, многоосновыя кислоты могутъ быть получены по способу Вислиценуса167); для синтеза же феноловыхъ кислотъ имћетъ большое значеніе реакція Кольбе; она состоитъ въ томъ, что фенолаты обрабатываются угольной кислотой168). Къ этой реакціи примыкаетъ синтезъ фенолоальдегидовъ, произведеннный Реймеромъ изъ фенола и хлороформа169).
Наконецъ, мы должны еще упомянуть170) объ образованіи алкогольныхъ основаній по методу Гофманна, существенно измћненному и улучшенному имъ въ послћднее время171), а также о способћ гидротаціи Ладенбурга172), который примћнилъ его для полученія пиперидиновыхъ основаній изъ пиридиновъ, равно какъ для полученія діаминовъ изъ динитриловъ; съ того времени этотъ методъ нашелъ многостороннее примћненіе.
Во многихъ изъ этихъ изслћдованій была использована одна мысль, которая успћла уже принести обильные плоды, а въ будущемъ обћщаетъ еще больше. Это такъ называемые процессы конденсаціи, или уплотненія, т.-е. образованіе сложныхъ веществъ изъ простыхъ, которое такъ часто наблюдается и въ природћ, и при искусственныхъ реакціяхъ, когда нћсколько одинаковыхъ или однородныхъ молекулъ соединяются въ одну новую, болыиею частью съ выдћленіемъ водорода, воды, амміака и пр. Уже Жераръ, формулируя свою теорію остатковъ (ср. стр. 168), указалъ на подобныя реакціи, но лишь въ недавнее время, именно около 20ти лћтъ тому назадъ, этимъ явленіямъ было удћлено должное вниманіе. Бертело первый подробнће изучилъ подобныя реакціи и достигъ значительныхъ результатовъ. Къ реакціямъ такого рода относятся его синтезы: бензола С6H6 изъ ацетилена, дифенила—изъ бензола, антрацена — изъ толуола173) и др. При этихъ опытахъ онъ, между прочимъ, установилъ фактъ, съ тћхъ поръ неоднократно констатировавшійся, что при болће высокихъ температурахъ нћсколько молекулъ одного {277} углеводорода соединяются въ одну новую молекулу, выдћляя водородъ.
Нћсколько позже этимъ вопросомъ началъ заниматься Байеръ. Прежде всего онъ установилъ, что различіе между уплотненіемъ и полимеріей заключается въ томъ, что въ первомъ случаћ, при соединеніи молекулъ, связыо служитъ углеродъ, а при полимеріи онћ
связываются атомами кислорода или азота174). Ему уже ясно, что, собственно говоря, для синтезовъ имћетъ значеніе лишь уплотненіе, и онъ указываетъ далће на два очень важныхъ уплотненія, которыя были уже произведены, именно на образованіе по Кане175) мезитилена изъ ацетона и на произведенный Кіоцца синтезъ коричнаго альдегида изъ масла горькаго миндаля и альдегида дћйствіемъ соляной кислоты176). Вскорћ послћ этого Байеръ использовалъ высказанныя тогда теоретическія положенія для синтеза пиколина и коллидина. Они были получены путемъ уплотненія акролеинъамміака и альдегидъамміака177).
|
2С3H4ONH3 = С6H7N + 2H2O + NH3 |
|
2С2H4ONH3 = С8H11N + 4H2O + 3NH3. |
Нћсколько лћтъ спустя Кекуле получилъ кротоновый альдегидъ путемъ уплотненія двухъ молекулъ уксуснаго альдегида178) и такимъ образомъ выяснилъ химическую природу изслћдованнаго уже Либеномъ179) такъ называемаго акриловаго альдегида. Эта реакція позже была очень тщательно изучена Вюрцемъ180), который показалъ, что двћ молекулы уксуснаго альдегида сперва соединяются безъ выдћленія воды въ альдоль, альдегидъ β-оксимасляной кислоты, и лишь изъ послћдняго при выдћленіи воды образуется кротоновый альдегидъ. Впослћдствіи различными учеными, въ особенности изслћдованіями Клайзена181) было установлено, что эта интересная реакція имћетъ общее примћненіе.
Въ послћднее время понятіе уплотненія получило широкое примћненіе, такъ какъ каждую реакцію, при которой происходитъ соединеніе взаимодћйствующихъ молекулъ посредствомъ атома углерода, стали называть уплотненіемъ. Вслћдствіе этого уплотненіе сдћлалось синонимомъ синтеза и потеряло всякое самостоятельное значеніе, {278} соотвћтствующее его этимологическому смыслу. Такъ, уплотненіемъ была названа Байеровская реакція образованія углеводородовъ изъ альдегидовъ и бензола или его производныхъ, а также Перкиновскій методъ образованія ненасыщенныхъ кислотъ изъ альдегидовъ и солей жирныхъ кислотъ.
Понятіе уплотненія подверглось измћненію еще и въ другомъ направленіи: вышеупомянутымъ процессомъ внћшняго уплотненія стали противоставлять внутреннее уплотненіе. Подъ послћднимъ подразумћваются такія реакціи, при которыхъ однa молекула какого-либо вещества превращается въ другую черезъ отщепленіе атомовъ, соединяющихся въ одну молекулу, напримћръ, въ H2, HCl, H2O, NH3 и т. д., т.-е. реакціи, которыя протекаютъ внутри молекулы, и для которыхъ слово уплотненіе сохраняетъ свой смыслъ постольку, поскольку атомы связываются тћснће, т.-е. при помощи нћсколькихъ валентностей. Къ этой категоріи принадлежатъ давно извћстныя явленія, какъ образованіе этилена изъ алкоголя, образованіе С2Cl4 изъ С2Cl6, образованіе альдегидовъ и кетоновъ изъ алкоголей, окиси этилена изъ гликоля, ангидридовъ изъ многоосновныхъ кислотъ и т. д. Но внутреннимъ уплотненіемъ слћдуетъ считать также и образованіе ангидридовъ одно основныхъ охсикислотъ, лактоновъ и лактоновыхъ кислотъ, — реакціи, лишь недавно подробно изученныя Фиттихомъ. Къ реакціямъ этого же рода относятся еще слћдующія: образованіе кумарина, оксикумарина (умбеллиферонъ, дафнетинъ и т. д.), изатина, индола, розанилина, розоловой кислоты, фталеиновъ, альдегидина, хинолина, иафталина, антрацена и т. д. Указанные процессы играли поэтому большую роль при новћйшихъ изслћдованіяхъ, и мы здћсь остановимся на нихъ нћсколько дольше.
Гобрекеръ нашелъ, что при возстановленіи нитроацетоксилида и нитроацеттолуида182) образуются — этенилъ-ксиленъ-діаминъ и этенилъ-толуиленъ-діаминъ. Эта реакція привлекла прежде всего вниманіе Гюбнера, который получилъ большое число аналогичныхъ соединеній и показалъ, что такой анормальный ходъ возстановленія наступалъ лишь при орто-производныхъ бензола, а не при мета- и пара-соединеніяхъ183). Это было вполнћ подтверждено изслћдованіями Ладенбурга184), который обнаружилъ цћлый рядъ реакцій, {279} протекающихъ въ соединеніяхъ ряда орто совершенно иначе, чћмъ въ изомерныхъ рядахъ, и показалъ, что въ діаминахъ именно по этимъ реакціямъ можно отличить орто-соединенія отъ ихъ изомеровъ; онъ же впервые указалъ, что образованіе названныхъ выше соединеній основано на этомъ „орто-уплотненіи”. Этимъ же вопросомъ затћмъ занялся Байеръ, и прекрасными плодами его работъ являются упомянутые уже синтезы хинолина и оксиндола.
Къ этому же внутреннему уплотненію примыкаетъ и внутреннее окисленіе. Такъ называются реакціи, при которыхъ находящіеся въ молекулћ атомы кислорода, большею частью изъ группы NO2, разрывая свои связи, окисляютъ другія группы, принадлежащія къ той же самой молекулћ. Первая подобная реакція наблюдалась Вахендорфомъ185), но объяснена лишь Грейффомъ186). Тогда разсматривался вопросъ о дћйствіи брома на ортонитротолуолъ, которое Грейффъ выразилъ слћдующимъ уравненіемъ:
С6H4 |
NO2 |
+ Br4 = С6H2Br2 |
NH2 |
+ 2HBr. |
CH3 |
CO2H |
Эта реакція даетъ намъ возможность понять открытый Байеромъ187) весьма важный способъ образованія изатина при кипяченіи ортонитрофенилпропіоловой кислоты со щелочами:
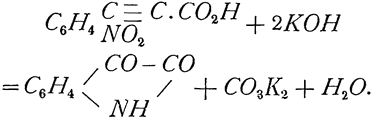
Ha подобныхъ же превращеніяхъ основано также образованіе синяго индиго изъ ортонитрофенилпропіоловой кислоты.
| {280} |
Основныя понятія химіи. — Явленія диссоціаціи. — Аномальныя плотности пара. — Постоянная или перемћнная валентность. — Ученіе о валентности въ неорганическОй химіи. — Періодическій законъ. — Новћйшее развитіе ученія о сродствћ. — Спектральный анализъ. — Синтезы минераловъ. — Непрерывность жидкаго и газообразнаго аггрегатнаго состоянія. — Сжиженіе „постоянныхъ” газовъ. — Термохимія. — Электрохимія. — Фотохимія. — Молекулярная физика. — Морфотропія.
Мы прослћдили развитіе органической химіи до конца послћдняго столћтія и познакомились такимъ образомъ со значительными успћхами, достигнутыми наиіей наукой благодаря вліянію теорію валентности. Теперь мы должны поставить и обсудить вопросъ, можетъ ли эта теорія служить основаніемъ также и для минеральной химіи, и указать на важнћйшіе результаты изслћдованій въ области общей химіи.
Прежде чћмъ перейти къ этой части нашей задачи, мы должны подвергнуть разсмотрћнію и испытанію самую теоріи валентности. При изложеніи исторіи возникновенія относящихся сюда ученій мы не всегда могли останавливаться на болће точномъ значеніи основныхъ понятій. Мы займемся этимъ теперь; но, понятно, здћсь я могу лишь отмћтить самое главное, все же остальное читатель найдетъ въ учебникахъ и руководствахъ по теоретической и физической химіи.
Наши воззрћнія основываются, главнымъ образомъ, на точномъ опредћленіи и разграниченіи понятій атома, молекулы и эквивалента.
Атомомъ мы называемъ мельчайшее недћлимое количество элемента, какое только можетъ существовать, но большею частью {281} встрћчается только въ соединеніи съ другими матеріальными частицами.
Молекулу мы опредћляемъ, какъ мельчайшее количество химическаго вещества (безразлично, простого или сложнаго), встрћчающееся въ свободномъ состояніи. Нужно замћтить, что опредћленіе величины молекулы основано, главнымъ образомъ, на сліяніи понятій о физической и химической молекулахъ, т.-е. мы называемъ молекулой какъ наименьшее количество вещества, встрћчающееся въ свободномъ, газообразномъ сосгояніи, такъ и количество, которое вступаетъ въ реакцію.
Что же касается опредћленія атомныхъ вћсовъ, то мы здћсь должны замћтить, что числа Жерара1) подверглись существеннымъ измћненіямъ; именно, они были удвоены для металловъ, за исключеніемъ одноатомныхъ, т.-е. щелочныхъ металловъ и серебра. Уже въ 1840 году, когда химики пользовались еще атомными вћсами Берцеліуса, Реньо предложилъ уменьшить вдвое атомный вћсъ серебра и сообразно съ этимъ принять, что въ его окиси на 1 атомъ кислорода приходятся 2 атома металла2). Впослћдствіи то же самое было предложено имъ для калія, натрія и литія3). Его классическія изслћдованія относительно теплоемкости доказали, что лишь при такомъ предположеніи законъ Дюлонга и Пти можетъ быть примћненъ ко всћмъ металламъ. Если бы предложеніе Реньо было тогда принято, то получились бы за немногими исключеніями наши нынћшніе атомные вћса. Но такъ какъ химики, слћдуя Жерару, уменыиили вдвое атомные вћса всћхъ металловъ, то впослћдствіи, когда Розе4) и Канниццаро новыми данными доказали справедливость предложенія Реньо, пришлось удвоить атомные вћса всћхъ металловъ, за исключеніемъ вышеупомянутыхъ. Канниццаро указалъ въ своемъ знаменитомъ трудћ5), что для опредћленія атомныхъ вћсовъ рћшающее значеніе долженъ имћть законъ Дюлонга и Пти, a для установленія молекулярныхъ величинъ — гипотеза Авогадро. Проведеніе подобныхъ принциповъ въ то время встрћчало еще болыиія затрудненія. Правда, тогда же было доказано Девиллемъ и Тростомъ6), {282} что плотность пара сћры при температурћ около 1000° составляетъ лишь треть числа, найденнаго ранће при болће низкой температурћ (Дюма и Мичерлихъ, ср. стр. 97); такимъ образомъ, для сћры также можно было теперь принять формулу S2, a ртуть, фосфоръ и мышьякъ продолжали оставаться при своихъ прежде найденныхъ аномаліяхъ. Но это не остановило Канниццаро. Для торжества принципа химическія отношенія должны были отступить на задній планъ. Канниццаро предположилъ, что въ двухъ объемахъ фосфорнаго и мышьяковистаго водорода содержится лишь 1/4 молекулы фосфора и 1/4 молекулы мышьяка, тогда какъ два объема амміака содержатъ 1/2 молекулы азота, а въ двухъ объемахъ хлористой ртути находится 1 молекула этого металла. Такимъ образомъ, по мнћнію Канниццаро, даже въ химически аналогичныхъ веществахъ наблюдается различная дћлимость молекулы на атомы. Если это утвержденіе и казалось рискованнымъ, то все же противъ него нельзя было выставить никакихъ серьезныхъ доводовъ.
Это на первый взглядъ странное предположеніе о различномъ строеніи элементарныхъ молекулъ со временемъ оказалось вполнћ вћрнымъ. Дћйствительно, почему бы у элементовъ не могло имћть мћсто то же, что и въ химически сложныхъ веществахъ, молекулы которыхъ, какъ извћстно, представляютъ весьма большое разнообразіе въ отношеніи числа атомовъ? Канниццаро очень удачно сравниваетъ элементы съ углеводородами, т.-е. сравниваетъ водородъ, кислородъ и т. д. съ такъ называемыми алкогольными радикалами: метиломъ, этиломъ и т. д., а молекулы ртути, кадмія и цинка — съ ненасыщенными углеводородами; это сравненіе можетъ быть распространено и на соотвћтствћнные дериваты7):
H2, O2, N2 |
соотвћтствуютъ |
(CH3)2, (C2H5)2 |
Hg, Zn |
„ |
C2H4, C3H6 |
K2O, H2O |
„ |
(CH3)2O, (C2H5)2O |
CaO, ZnO |
„ |
C2H4O, C3H6O |
Bi2O3, Sb2O3 |
„ |
(C3H5)2OH3 |
SnO2, SiO2 |
„ |
CO2 |
KOH |
соотвћтствуетъ |
CH3OH, C2H5OH |
Ca(OH)2 |
„ |
C2H4(OH)2, C3H6(OH)2 |
Bi(OH)3 |
„ |
C3H5(OH)3 |
Sn(OH)4 |
„ |
C4H6(OH)4 |
| {283} |
Для выясненія природы ртутной молекулы рћшающее значеніе имћютъ опыты Кундта и Варбурга8), которые могутъ разсматриваться, какъ прямое доказательство теоріи Канниццаро. Эти изслћдователи, опредћляя скорость распространенія звука въ парахъ ртути, усгановили, что отношеніе теплоёмкостей при постоянномъ давленіи и при постоянномъ объемћ равно 1,67; по механической теоріи теплоты это число получается при условіи, что вся энергія газа заключается въ поступательномъ движеніи его молекулъ. Далће, В. Мейеръ доказывалъ, что плотность паровъ іода непостоянна9) и, какъ показали наблюденія Крафта10), эта плотность при достаточно высокой температурћ понижается до половины своей начальной величины и затћмъ остается постоянной; — это можетъ быть объяснено лишь тћмъ, что при высокой температурћ молекула іода состоитъ изъ одного только атома.
Значительно болће упорную борьбу вызвалъ вопросъ объ установленіи молекулярной величины тћхъ соединеній, для которыхъ число, полученное изъ опредћленія плотности пара, не сходилось съ числами, выведенными изъ химическихъ отношеній. Еще Бино при опредћленіи удћльнаго вћса паровъ получилъ весьма замћчательныя числа, и причиной этихъ своеобразныхъ объемныхъ отношеній онъ считалъ расщепленіе11). Такъ, онъ нашелъ, что плотность карбамино-кислаго аммонія (или, какъ онъ выражался, безводнаго углекислаго амміака) соотвћтствовала 6 объемамъ, вслћдствіе чего онъ предполагалъ, что происходило разложеніе на 4 объема амміака и 2 объема углекислоты. Подобное же предположеніе было сдћлано Мичерлихомъ для пятихлористой сурьмы12) и Гладстономъ13) для пятибромистаго фосфора. Въ обоихъ этихъ случаяхъ предполагалось, что на ряду съ галоидами образуется и трихлоридъ или трибромидъ соотвћтствующаго элемента. To же предложеніе было высказано въ 1847 г. и Кагуромъ14) для объяо ненія низкой плотности пара пятихлористаго фосфора.
Въ томъ же году Грове15) сдћлалъ замћчательное наблюденіе: вода при соприкосновеніи съ сильно раскаленной платиной разлагается на свои составныя части. Онъ пытался объяснить это явленіе {284} дћйствіемъ высокой температуры, но его объясненіе не встрћтило признанія, такъ какъ ему противопоставляли тотъ фактъ, что платина можетъ расплавляться отъ пламени гремучаго газа. Поэтому опытъ Грове считали слћдствіемъ дћйствія сродства и объясняли такъ же, какъ наблюдавшееся Реньо разложеніе воды подъ вліяніемъ расплавленнаго серебра, при чемъ должны образоваться окись серебра и водородъ16).
Мнћніе Грове было окончательно доказано лишь Сенъ-Клеръ-Девиллемъ, подвергнувшимъ явленіе весьма тщательному изслћдованію, которое легло въ основаніе теоріи диссоціаціи.
Прежде чћмъ выяснить ближе эти столь важныя для химіи явленія, я долженъ здћсь указать, что пониманіе ихъ существенно связано съ успћхами, которые были достигнуты ученіемъ о теплотћ. Этими успћхами мы обязаны закону сохраненія энергіи, который, какъ извћстно, впервые былъ ясно формулированъ17) Робертомъ Майеромъ, и особенно выразились въ механической теоріи тепла и кинетической теоріи газовъ. Эти теоріи были развиты, главнымъ образомъ, трудами Клаузіуса, Джауля, Ранкина, Томсона, Гельмгольца, Максвелла, О. Е. Мейера и др.
Девилль указалъ, что въ опытћ Реньо сродство серебра къ кислороду не можетъ имћть значенія, такъ какъ окись серебра распадается на свои составныя части при значительно болће низкихъ температурахъ, и что подобное же явленіе должно происходить, во всякомъ случаћ, и въ присутствіи водорода; далће, онъ показалъ, что разложеніе воды наблюдается и при сильномъ нагрћваніи окиси свинца (до 1200°—1300°); при помощи остроумно придуманныхъ приборовъ ему удалось даже получить такое разложеніе безъ дћйствія посторонняго тћла, и такимъ образомъ онъ блестяще доказалъ правильность своего взгляда, что разложеніе есть лишь слћдствіе высокой температуры18).
Затрудненія при этихъ опытахъ состоятъ въ томъ, что про дукты разложенія соединяются обратно при среднихъ температурахъ, вслћдствіе чего при обыкновенныхъ условіяхъ нельзя доказать, что произошло разложеніе. Какъ обнаружилъ Девилль, разложеніе можетъ быть доказано разбавленіемъ продуктовъ разложенія сильной {285} струей какоголибо индифферентнаго газа; этимъ способомъ удается воспрепятствовать полному обратному соединенію. Можно также воспользоваться диффузіей, которая измћняетъ составъ газовой смћси, или, наконецъ, разложеніе можетъ быть доказано такъ называемымъ „tube chaud et froid”, т.-е. внезапнымъ охлажденіемъ продуктовъ разложенія.
Девиллю удалось съ помощыо приборовъ, построенныхъ на этихъ принципахъ, доказать не только разложеніе воды, но и распаденіе угольной кислоты на окись углерода и кислородъ, затћмъ разложеніе окиси углерода на углеродъ и угольную кислоту, соляной кислоты на хлоръ и водородъ сћрнистой кислоты — на сћрную кислоту и сћру и т. д.
Основываясь на этихъ опытахъ, Девилль сравниваетъ диссоціацію соединеній съ парообразованіемъ. По его мнћнію, оба явленія начинаются при опредћленныхъ температурахъ и оба развиваются постепенно. При сгущеніи паровъ освобождается извћстное количество теплоты, и часто то же самое въ еще большихъ размћрахъ происходитъ при соединеніи двухъ веществъ. Но подобно тому какъ образованіе паровъ начинается уже при температурћ ниже точки сгущенія, такъ и разложеніе нћкоторыхъ веществъ наблюдается ниже дћйствительной температуры соединенія. Подобно тому какъ каждому градусу термометрической шкалы соотвћтствуетъ опредћленная упругусть пара, точно такъ же и упругость продуктовъ разложенія опредћляется температурой, по крайней мћрћ, въ опредћленныхъ случахъ. Девилль устанавливаетъ различіе между разложеніемъ, вызваннымъ теплотой, и разложеніемъ посредствомъ химическихъ дћйствій. Лишь первое Девилль называетъ диссоціаціей19). Она характеризуется тћмъ, что можно наблюдать ея различныя фазы, что она начинается при одной опредћленной температурћ, а оканчивается при другой, и между этими двумя границами упругость непрерывно увеличивается, такъ что каждой температурћ внутри этого интервала соотвћтствуетъ опредћленная упругость, цорожденная газообразными продуктами разложенія.
Позднћйшія весьма тщательныя изслћдованія въ этой области подтвердили взгляды Девилля, по крайней мћрћ, въ общихъ чертахъ. Въ настоящее время диссоціаціей называются лишь такія разложенія, которыя идутъ въ направленіи, противоположномъ дћйствію {286} химическихъ силъ и сопровождаются поглощеніемъ теплоты20). Вышеуказанное сравненіе диссоціаціи съ парообразованіемъ остается въ силћ, но не для всћхъ случаевъ, а, главнымъ образомъ, для разложенія твердыхъ веществъ на газообразныя составныя части, какъ было доказано Дебрэ для углекислой извести21), Науманномъ для карбаминокислаго аммонія22), Изамберомъ — для сульфгидрата аммонія, и др. Особенное значеніе имћютъ изслћдованія относительно соединеній амміака съ хлористомъ серебромъ24) и соединеній съ кристаллизаціонной водой, такъ какъ въ нихъ путемъ внезапнаго измћненія упругости можно обнаружить различныя амміачныя соединенія и различныя степени гидротаціи солей25).
Пфаундлеръ26) пытался объяснить странный на первый взглядъ фактъ частичнаго разложенія, постепенно увеличивающагося вмћстћ съ температурой, т.-е. различныя свойства одинаковыхъ молекулъ при однихъ и тћхъ же условіяхъ. Науманнъ27) развилъ эти взгляды, но опредћленнће они были формулированы Горстманомъ28), который воспользовался максвелловой теоріей вћроятности29), распредћленіемъ скоростей30). Въ различныхъ случаяхъ было доказано почти полное согласіе этой теоріи съ наблюденіями.
Горстманнъ первый пытался дать общую теорію диссоціаціи31), исходя изъ принциповъ механической теоріи теплоты, главнымъ образомъ, изъ такъ называемаго второго начала. Въ одномъ случаћ32) обнаружилось, что теорія вполнћ подтверждается опытомъ. Еще большее значеніе имћли весьма плодотворныя изслћдованія Гиббса33) и Гельмгольца34), основанныя на тћхъ же принципахъ.
Эти изслћдованія, относящіяся уже отчасти къ области физики, получили весьма важное значеніе для разсматриваемаго здћсь вопроса. Уже вскорћ послћ первыхъ работъ Девилля три различныхъ {287} изслћдователя: Канниццаро35), Коппъ36) и Кекуле37) высказали мысль, что такъ называемыя аномальныя плотности пара могутъ быть объяснены распаденіемъ соотвћтственныхъ веществъ на двћ (или болће) составныя части. Послћднія, по ихъ мнћнію, при охлажденіи вновь соединяются, такъ что при перегонкћ не обнаруживается никакого разложенія.
Лишь нћсколько лћтъ спустя Пебаль38) преодолћлъ затрудненія, которыя въ силу указанныхъ причинъ препятствовали непосредственному наблюденію разложенія; при этомъ онъ основывался на положеніи, высказанномъ впервые Бунзеномъ39), что смћсь газовъ можно отличить отъ однородныхъ газовъ лишь при помощи физическихъ способовъ (диффузіи или абсорбціи). Пебаль заставлялъ диффундировать пары нашатыря черезъ азбестовую пробку, и по окраскћ лакмуса онъ показалъ, что въ одной части прибора газъ имћетъ щелочную реакцію, а въ другой — кислую.
Подобнымъ же образомъ, т.-е. пользуясь диффузіей, Ванклинъ и Робинзонъ40) пытались доказать распаденіе гидрата сћрной кислоты на ангидридъ и воду и пятихлористаго фосфора — на треххлористый фосфоръ и хлоръ.
Девилль41) подвергъ критикћ выводы, которые названные химики сдћлали изъ своихъ опытовъ. По его мнћнію, для разъединенія съ помощью диффузіи составныхъ частей нћтъ надобности въ полномъ разложеніи; для этого достаточно весьма небольшой упругости диссоціаціи. Въ то время, какъ удаляютъ продукты разложенія, образуются новые, такъ что при достаточной продолжительности опыта можно достигнуть полнћйшаго разъединенія компонентовъ при температурћ, которой соотвћтствуетъ лишь минимальное разложеніе. Девилль доказалъ, что плотность паровъ воды при 1000° остается еще нормальной42), хотя диссоціацію уже возможно обнаружить посредствомъ диффузіи; поэтому онъ думалъ, что неразложеннымъ парамъ нашатыря необходимо приписать аномальную плотность. Положительное доказательство этого взгляда онъ находитъ въ фактћ значительнаго повышенія температуры, которое, по его мнћнію, можно констатировать, когда амміакъ и соляная кислота {288} встрћчаются въ сосудћ, предварительно нагрћтомъ до 350°43). Впослћдствіи, когда Робинзонъ и Ванклинъ выставили возраженіе, что до соединенія газы могли быть недостаточно нагрћты44),
Девилль повторилъ опытъ и произвелъ его такъ, что устранилъ всякую возможность возраженія; онъ снова нашелъ повышеніе температуры, но величины его не указалъ45). Дальнћйшій доводъ въ свою пользу Девилль нашелъ въ фактћ, что амміакъ, нагрћтый до 1100°, распадается на азотъ и водородъ. По его мнћнію, нашатырь, нагрћтый до такой температуры, долженъ былъ бы послћ охлажденія дать оба эти газа, и такимъ образомъ было бы доказано образованіе амміака; однако, присутствіе азота и водорода въ дћйствительности не наблюдается. Танъ, наоборотъ, находитъ, что значительно труднће разложить газовую смћсь, чћмъ чистый газъ46); это совпадаетъ со взглядами Девилля на диссоціацію47). Съ пониженіемъ парціальнаго давленія повышается температура, при которой начинается диссоціація48), или же, если температура остается неизмћнной, упругость разложенія уменьшается. Смћшивая при 360° соляную кислоту съ амміакомъ, Танъ не нашелъ повышенія температуры. Хотя при своемъ опытћ онъ допускалъ сравнительно бóльшія погрћшности, и хотя онъ не могъ измћрять очень малыхъ разностей температуръ, но все же изъ его данныхъ несомнћнно вытекаетъ, что амміакъ и соляная кислота, смћшиваясь при 360°, выдћляютъ лишь незначительное количество теплоты. Это заключеніе подтверждалось опытомъ Мариньяка49), который доказалъ, что при образованіи нашатыря изъ амміака и соляной кислоты выдћляется такое же количество теплоты, которое поглощается при превращеніи этой соли въ паръ. Такимъ образомъ, можно считать вполнћ доказаннымъ, что нашатырь въ газообразномъ состояніи не существуетъ, но при улетучиваніи разлагается на свои составныя части.
Подобные же же факты, хотя и не всегда столь убћдительные, были найдены и для многихъ другихъ соединеній, молекула которыхъ въ газообразномъ состояніи соотвћтствуетъ четыремъ объемамъ. Мы видимъ это, напримћръ, у пятихлористаго фосфора50), сћрнистаго аммонія51), карбаминокислаго аммонія52) и др. {289} Относительно природы паровъ хлоралъгидрата возникъ продолжительный споръ между Вюрцомъ53), съ одной стороны, и Тростомъ54), Девиллемъ55) и Бертело56) — съ другой. Этотъ споръ окончился въ пользу перваго, т.-е. было доказано, что пары хлоралъгидрата при испареніи разлагаются.
Обратимся, однако, къ опредћленію основныхъ понятій (ср. стр. 281). Эквивалентомъ, или вћрнће эквивалентнымъ вћсомъ, мы называемъ то количество элемента, или радикала, которое способно замћщать одинъ атомъ водорода или же съ нимъ соединяться. Это понятіе въ настоящее время уже не имћетъ существеннаго значенія; взамћнъ его введено другое, находящееся съ нимъ въ тћсной связи, именно, неоднократно упоминавшееся нами понятіе валентносги, или значности; подъ этимъ разумћютъ частное отъ дћленія эквивалента на атомный вћсъ. Чрезвычайно важное значеніе имћетъ вопросъ, есть ли валентность опредћленнаго элемента величина постоянная или перемћнная. Пока мы опредћляемъ и употребляемъ понятіе валентности лишь въ указанномъ выше смыслћ, мы можемъ для большинства случаевъ считать валентность постоянной. Но если сравнивать валентности многозначныхъ элементовъ, чтб неизбћжно, то уже нельзя и настаивать на абсолютной неизмћнности валентности. Даже углеродъ, для котораго предположеніе о постоянной четырехвалентности встрћчаетъ сравнительно мало противорћчій, даетъ соединеніе — окись углерода, къ которому это предположеніе не примћнимо. Подобные же случаи, но только сильнће выраженные, мы встрћчаемъ и у другихъ элементовъ, и поэтому каждый разъ приходится допускать исключенія. Были предложены два различныхъ способа, чтобы по возможности согласовать эти исключенія съ системой, но оба они все-таки не устраняютъ вполнћ затрудненія.
Нћкоторые во главћ съ Кекуле57) придерживаются вышеупомянутаго опредћленія валентности, но они все же допускаютъ, что существуетъ большой классъ соединеній, къ которымъ это опредћленіе не можетъ быть примћнено, а именно, молекулярныя соединенія, мельчайшія частицы которыхъ представляютъ {290} комплексъ молекулъ, связакныхъ между собой молекулярными силами.
Сюда относятся соединенія съ кристаллизаціонной водой (съ кристаллизаціоннымъ алкоголемъ, бензоломъ и т. д.), большинство двойныхъ солей, амміачныя соли, пятихлористый фосфоръ, треххлористый іодъ и др. Точнаго опредћленія этихъ соединеній не существуетъ; они лишь характеризуются тћмъ общимъ свойствомъ, что не могутъ переходить въ парообразное состояніе безъ разложенія (за исключеніемъ, какъ нашелъ Торпъ58), пятифтористаго фосфора), легко образуются изъ своихъ молекулярныхъ компонентовъ и такъ же легко обратно на нихъ распадаются.
Сторонники постоянной валентности должны, кромћ того, считать ненасыщенныя соединенія исключеніемъ. Если этихъ соединеній извћстно не особенно много, то все же ихъ существованіе является серіознымъ возраженіемъ нротивъ этого ученія, возраженіемъ, котораго нельзя ослабить доводомъ, что такія вещества стремятся къ насыщёнію59).
Противники этихъ теорій во главћ съ Франкландомъ и Куперомъ60) опредћляли валентность, какъ максимальную способность насыщенія или максимумъ химической значности; при такомъ огтредћленіи ненасыщенныя соединенія теряютъ свое исключительное положеніе. Далће, такъ какъ для многихъ элементовъ они считаютъ величину валентности значительно большей, чћмъ предполагалось раньше, напримћръ, азотъ и фосфоръ считаютъ пятивалентными, сћру — шестивалентной, іодъ — пяти или семивалентнымъ и т. д., то имъ удалось включить въ систему большое число молекулярныхъ соединеній. Но на приверженцевъ этой теоріи падаетъ задача объяснить измћненіе способности насыщенія, или же, по крайней мћрћ, установить условія, вызывающія это измћненіе въ свойствахъ элементовъ, такъ какъ, въ противномъ случаћ, ихъ гипотеза не заслуживала бы названія теоріи. Но именно въ этомъ направленіи было сдћлано еще слишкомъ мало, и даже это немногое едва ли можетъ быть формулировано въ общихъ чертахъ61). Съ другой стороны, сталъ извћстнымъ цћлый рядъ фактовъ, которые только съ трудомъ {291} можно объяснить допущеніемъ постоянной валентности. Къ числу такихъ фактовъ относится, напримћръ, идентичность нафтилфенилсульфона и толилфенилсульфона, которые получаются совершенно различными способами62), и изомерія двухъ окисей трифенилфосфиновъ, изъ которыхъ одна должна соотв ћтствовать пятихлористому фосфору P(C6H5)3O, а другая — хлорокиси фосфора:
Уже изъ этихъ немногихъ замћчаній явствуеть, что понятіе о валентности, совершенно независимо отъ какого-либо математически-механическаго обоснованія, которое въ настоящее время еще совершенно отсутствуетъ64), еще очень шатко и неустойчиво, и что не существуетъ еще теоріи, которая могла бы обнять всю область химіи.
Если, не смотря на все вышесказанное, понятіе валентности все еіле прочно держится и считается важнћйшимъ основаніемъ науки, то это объясняется удивительными успћхами, достигнутыми съ его помощью въ органической химіи въ теченіе послћднихъ десятилћтій. Въ неорганической же химіи дћло обстоитъ иначе.
Впрочемъ, и здћсь мы должны констатировать плодотворное вліяніе этой теоріи: благодаря ей систематика сдћлалась болће ясной, какъ мы сейчасъ покажемъ на нћсколькихъ отдћльныхъ случаяхъ. Уже возможность классифицировать самые элементы по ихъ валентности является шагомъ впередъ: благодаря этому стали очевидными такія аналогіи между элементами, которыя въ прежнее время были замћчены лишь частично. Сходство углерода съ кремніемъ замћчено было уже раньше, но къ этимъ элементамъ присоединяли еще и боръ. Теперь же было доказано, что сходство двухъ первыхь элементовъ гораздо сильнће, тогда какъ боръ пришлось отнести къ совершенно другой группћ; зато къ двумъ первымъ были присоединены титанъ, цирконій и олово. Точно такъ же къ группћ азота и фосфора были присоединены мышьякъ, сурьма, висмутъ, а впослћдствіи, послћ прекраснаго изслћдованія Роско, и ванадій65). Наконецъ, въ эту же группу включили ніобій и танталъ, именно, послћ того какъ стали извћстны результаты работы Мариньяка66). To же {292} признано и для металловъ, которые до того времени соединялись въ группы или по величинћ удћльнаго вћса, или же по аналитическимъ свойствамъ.— Теорія валентности оказала рћшающее вліяніе также и на пониманіе нћкоторыхъ классовъ соединеній, въ особенности силикатовъ. Вюрцъ показалъ, что результаты, найденные имъ о конденсаціяхъ гликоля, могутъ быть отнесены и къ производнымъ кремневой кислоты67), и такимъ образомъ ему удалось нћсколько освћтить эту до сихъ поръ темную область. Дальнћйшіе успћхи въ этой области были достигнуты благодаря важному изслћдованію Чермака68) относительно полевыхъ шпатовъ, согласно которому полевые шпаты должны разсматриваться, какъ изоморфныя смћси ортоклаза, альбита и анортита. Теперь нашли себћ мћсто въ системћ также и многочисленныя металлоамміачныя и металлоаммонійныя соединенія; они разсматриваются какъ амміакъ или хлористый аммоній, въ которыхъ водородъ замћщенъ металломъ или же его окисью. Эта классификація сперва была испробована Гофманномъ69), который при этомъ использовалъ результаты своихъ работъ надъ органическими основаніями. To же воззрћніе было развито далће Вельтциномъ70), Шиффомъ71), Клеве72) и многими другими.
Несмотря на все это, нельзя утверждать, что теорія валентности оказалась очень плодотворной для неорганической химіи. Вопервыхъ, число вызванныхъ ею работъ было не очень значительно, и, кромћ того, основанная на ней систематика оказалась неспособной дать что-либо цћльное и послћдовательное. Значительно болће глубокое и дћйствительное вліяніе оказала другая гипотеза, которая уже теперь, спустя лишь сорокъ лћтъ послћ ея возникновенія, обнаруживаетъ неожиданные и блестящіе успћхи. Я имћю въ виду соотношенія между свойствами элементовъ и ихъ атомными вћсами.
Новћйшія изслћдованія въ этой области примыкаютъ къ гипотезћ Проута, о которой у насъ уже раныие73) была рћчь; она никогда не встрћчала всеобщаго сочувствія, но не переставала подстрекать мысль къ подобнымъ же умозрительнымъ попыткамъ. Я здћсь назову только Деберейнера, который въ 1829 г. впервые обратилъ {293} вниманіе на тріады74), т.-е. на группы изъ трехъ аналогичныхъ элементовъ, атомные вћса которыхъ отличаются тћмъ свойствомъ, что одинъ изъ нихъ можно считать среднимъ ариќметическимъ двухъ другихъ. Гмелинъ75). Петтенкоферъ76), Дюма77) и Ленсенъ78), развивали дальше эти идеи, но они не достигли сколько-нибудь существенныхъ результатовъ.
Замћчательный результатъ былъ достигнутъ благодаря доказательству, что свойства элементовъ являются періодической функціей ихъ атомнаго вћса. Этимъ мы обязаны изслћдованіямъ Ньюлэндса79), Лотара Мейера80) и Менделћева81). Главная заслуга въ этомъ отношеніи принадлежитъ несомнћнно послћднему. Менделћевъ первый обратилъ вниманіе на широкій обобщающій характеръ этихъ взаимоотношеній и, что важнће всего, выяснилъ пользу подобныхъ воззрћній. Его трудъ поэтому сразу и обратилъ на себя очень большое вниманіе, тогда какъ работа Ньюлэндса осталась совершенно незамћченной82).
Въ таблицћ Менделћева элементы расположены въ ряды по величинћ атомнаго вћса, но ряды раздћлены на отдћлы такимь образомъ, что аналогичные элементы составляютъ вертикальные ряды, образуя группы, при чемъ каждые семь или десять элементовъ одного горизонтальнаго ряда, слћдующіе другъ за другомъ въ порядкћ ихъ агомныхъ вћсовъ, образуютъ малый періодъ, внутри котораго свойства (какъ физическія, такъ и химическія) измћняются непрерывно. Два горизонтальныхъ ряда, непосредственно слћдующихъ другъ за другомъ, образуютъ большой періодъ. При этомъ надо замћтить, что въ группахъ аналогія между элементами въ томъ случаћ, когда они принадлежатъ къ четнымъ, или точно такъ же къ нечетнымъ (горизонтальнымъ) рядамъ, больше, чћмъ между элементами, принадлежащими частью къ четнымъ, частью къ нечетнымъ рядамъ.
Выдающееся значеніе пріобрћли слћдующія два примћненія „періодическаго закона”. Съ его помощью возможно, вопервыхъ, опредћлять или исправлять атомные вћса недостаточно извћстныхъ {294} элементовь и, вовторыхъ, предсказывать свойства неизвћстныхь еще элементовъ.
Относительно перваго примћненія можно сказать слћдующее: Менделћевъ, по предложенію Авдћева83), принялъ въ качествћ атомнаго вћса бериллія число 9, и помћстилъ его въ одной группћ съ магніемъ, тогда какъ до того времени бериллій обыкновенно считался сходнымъ съ аммоніемъ, и ему приписывали атомный вћсъ 13,5. Вызванный этимъ продолжительный споръ окончился полной побћдой Менделћева84). Атомный вћсъ индія былъ увеличенъ въ 11/2 раза, т.-е. было предложено число 113; въ скоромъ времени это число было подтверждено опредћленіемъ теплоёмкости этого металла, произведеннымъ Бунзеномъ85) и Менделћевымъ86). Атомный вћсъ урана былъ удвоенъ; послћ прекраснаго и подробнаго изслћдованія Циммермана87) это число было признано вполнћ вћрнымъ. Для атомнаго вћса теллура Менделћевъ принялъ число 125, что противорћчило прежнимъ опредћленіямъ, на основаніи которыхъ установлено было число 128. Браунеръ сначала полагалъ, что его изслћдованія88) подтверждаютъ предположеніе Менделћева, но впослћдствіи89) принужденъ былъ остаться при прежнемъ атомномъ вћсћ. Послћ этого Кётнеръ вновь опрсдћлилъ атомный вћсъ теллура и нашелъ, что онъ равенъ 127,6 (O = 16)90).— Съ другой стороны, Ладенбургъ91) провћрилъ атомный вћсъ іода и нашелъ значительно ббльшее число, чћмъ опредћлилъ Стасъ, именно 126,96 вмћсто 126,85; это было подтверждено и другими изслћдователями92). Послћдній случай имћетъ особенное значеніе, такъ какъ здћсь впервые было доказано, что атомные вћса Стаса93), до сихъ поръ не подвергавшіеся сомнћнію, въ дћйствительности не точны; впослћдствіи это же самое пришлось констатировать и въ другихъ случаяхъ.
Ho, конечно, всћми этими изслћдованіями не удалось устранить аномаліи въ таблицћ Менделћева. {295}
Тћмъ не менће предсказанія Менделћева относительно новыхъ элементовъ дали поразительные результаты. Для того, чтобы распредћлить элементы по группамъ и рядамъ и сохранить при этомъ приблизительно одинаковую разность атомныхъ вћсовъ для смежныхъ членовъ, Менделћевъ принужденъ былъ оставить въ таблицћ пробћлы. Послћдніе, по его мнћнію, должны быть заполнены элементами, до сихъ поръ неизвћстными, но все-таки существующими; атомные вћса и нћкоторыя другія свойства этихъ элементовъ онъ могъ опредћлить по ихъ положенію въ системћ, именно на основаніи общихъ свойствъ группъ и рядовъ, которыми можно было пользоваться, какъ координатной системой. Такъ, напримћръ, въ первыхъ пяти рядахъ оказались три пробћла. Менделћевъ замћстилъ ихъ тремя предполагаемыми элементами: экаборомъ (атомный вћсъ 44), экаалюминіемъ (атомный вћсъ 68) и экасилиціемъ (атомный вћсъ 72). Эти три элемента были дћйствительно найдены, и свойства ихъ оказались почти такими, какъ предсказывалъ Менделћевъ. Дћйствительно, Нильсонъ94) открылъ элементъ скандій съ атомнымъ вћсомъ 44, Лекокъ де Буабодранъ95) — элементъ галлій съ атомнымъ вћсомъ 69,8 и Винклеръ96) — германій съ атомнымъ вћсомъ 72,32.
Но эта теорія имћетъ огромное значеніе не только благодаря этимъ успћхамъ. Она настолько глубоко проникла въ химію, что изслћдованія элементовъ и ихъ соединеній пріобрћли новое значеніе. Благодаря установленной ею связи между отдћльными элементами, она сообщаетъ каждому такому спеціальному изслћдованію ту привлекательность, какой отличается работа, имћющая общій интересъ.
Такое же большое значеніе имћютъ и изслћдованія относительно сродства, давшія ему математическую форму и примыкающія къ ученію о сродствћ Бертолле97). Эти изслћдованія, можетъ быть, и не сбнаруживаютъ столь поразительныхъ успћховъ, какъ тћ, о которыхъ мы говорили раньше, но они были испытаны въ столькихъ направленіяхъ и настолько глубоко проникли во всћ области теоретической химіи, что заслуживаютъ подробнаго разсмотрћнія.
Путь для новыхъ успћховъ былъ проложенъ изслћдованіемъ Гульдберга и Вааге98). Вмћсто понятія Бертолле о химической {296} массћ они ввели іюнятіе объ активной массћ; такъ они называютъ число молекулъ вешества въ единицћ объема; скорость взаимодћйствія двухъ веществъ равна произведенію ихъ активныхъ массъ, умноженному на коэффиціентъ сродства. Послћдній есть величина, зависящая отъ химической природы вещества и отъ температуры”).
Такъ, если активныя массы взаимодћйствующихъ тћлъ А1, B1 и т. д. обозначимъ черезъ а1, b1 и т. д., активныя массы образующихся при этомъ веществъ А2, B2,... обозначимъ черезъ а2, b2 .., коэффиціенты сродства этихъ реакцій обозначимъ черезъ k1 и k2, скорость, съ которой вещества А1, B1... превращаются въ А2, B2,... назовемъ v1 и скорость противоположной реакціи обозначимъ черезъ v2, то
|
v1 = k1a1b1..., |
|
v2 = k2a2b2.... |
Равновћсіе наступаетъ, когда обћ скорости равны между собой, т.-е. когда
k1a1b1... = k2a2b2...,
или
|
a1b1... a2b2... |
= |
k2 k1. |
= K, |
гдћ К есть константа.
Это уравненіе выражаетъ основной законъ химической статики. Впрочемъ, оно примћнимо лишь къ тћмъ случаямъ, когда различныя вещества дћйствуютъ другъ на друга въ количествћ только одной молекулы (мономолекулярная реакція). Если m1, m2... молекулъ веществъ А1, B1... вступаютъ въ реакцію, и образуются n1, n2... молекулъ веществъ А2, B2..., то уравненіе принимаетъ слћдующій видъ:
|
a1m1b1m2... a2n1b2n2... |
= C. |
Это — наиболће общая форма закона.
Этотъ „законъ химическаго дћйствія массъ” былъ провћренъ безчисленное множество разъ, и почти всегда оказывалось, что онъ согласуется съ дћйствительностью.
Въ качествћ предшественниковъ Гульдберга и Вааге мы должны назвать Вильгельми, Бертело, Пеанъ де Сенъ-Жиля, Гаркурта и {297} Эссона. Первый уже въ 1850 г. ввелъ понятіе о скорости реакціи; въ своей въ высшей степени интересной и важной работћ100) объ инверсіи тростниковаго сахара онъ показалъ, что количество сахара, инвентируемаго въ единицу времени, пропорціонально концентраціи взятаго сахара. Къ такимъ же результатамъ пришли Гаркуртъ и Эссонъ въ своихъ изслћдованіяхъ относительно возстановленія марганцовокислаго калія большимъ избыткомъ щавелевой кислоты101), а также въ своихъ позднћйшихъ работахъ относительно дћйствія перекиси водорода на іодистоводородную кислоту102).
Работы Бертело и Пеанъ де С. Жиля103) относительно этерификаціи предшествовали только что упомянутымъ изслћдованіямъ. Онћ посвящены изученію предћла этерификаціи и скорости реакцій. Полученныя числовыя величины достаточно близко согласуются съ величинами, полученными теоретическимъ путемъ. Эти изслћдованія были продолжены и расширены Меншуткинымъ104), который изучилъ въ указанномъ направленіи образованіе эфировъ изъ самыхъ разнообразныхъ спиртовъ и кислотъ, и такимъ образомъ въ значительной степени способствовалъ уясненію вопроса о различіи свойствъ соединеній въ зависимости отъ ихъ структуры. Далће сюда же относятся подробныя и интересныя работы по термохиміи Томсена105) и объемнохимическія изслћдованія Оствальда106), не только подтвердившія теорію, но и расширившія ее. Послћднія работы касаются, главнымъ образомъ, сродства между кислотами и основаніями; при этомъ было введено понятіе жадности, которое соотвћтствуетъ приблизительно ранће употреблявшемуся, но недостаточно точному термину „сила кислотъ или основаній”. Жадностью называется отношеніе, въ которомъ два тћла раздћляютъ между собой третье, количество котораго недостаточно для ихъ полнаго насыщенія. Доказано, что жадность равна квадратному корню изъ отношенія коэффиціентовъ сродства.
Важное значеніе имћютъ изслћдованія Горстмана107) относительно неполнаго сгоранія окиси углерода и водорода, изслћдованіе {298} относительно частичнаго разложенія водой солей окиси желћза, произведенное Видеманномъ108) съ помощыо магнитнаго метода, и, далће, изслћдованія относительно распредћленія различныхъ кислотъ между двумя алкалоидами; Джелеттъ109) нашелъ соотвћтственное соотношеніе путемъ опредћленія оптической вращательной способности. Но я не могу здћсь подробнће разсматривать эти работы, какъ и много другихъ110).
Особнякомъ отъ этихъ — преимущественно теоретическихъ — изслћдованій стоитъ открытіе одного метода, который можно считать наиболће блестящимъ изъ всего того, что достигнуто въ новћйшее время съ помощью экспериментальнаго изслћдованія, а именно, спектральнаго анализа. Онъ даетъ намъ возможность дћлать заключенія о химическомъ составћ отдаленныхъ міровыхъ свћтилъ, матеріальныя свойства которыхъ раньше были намъ совершенно неизвћстны; при помощи этого метода число элементовъ было увеличено на шесть.
Изложеніе работъ, предшествовавшихъ классическимъ изслћдованіямъ Кирхгоффа и Бунзена111), завело бы насъ слишкомъ далеко. Я поэтому ограничусь здћсь лишь нћкоторыми указаніями и сошлюсь на историческое изложеніе этого предмета, сдћланное Муссономъ112), затћмъ на нћкоторыя замћтки Тиндалля113) и въ особенности на относящійся къ этому предмету трудъ Кирхгоффа114).
Въ 1802 г. Волластонъ первый замћтилъ темныя полосы въ солнечномъ спектрћ115); въ 1814 г. онћ были ближе изслћдованы и опредћлены Фраунгоферомъ116), которому были неизвћстны наблюденія Волластона; въ 1822 г. Гершель наблюдалъ117) яркія полосы, которыя появляются при разложеніи свћта, происходящаго отъ пламени, окрашеннаго солями мегалловъ. Это явленіе было далће изучено Тальботомъ118) и Брюстеромъ119). Сванъ указалъ на высокую чувствительность этой реакціи, особенно для поваренной соли120). {299}
Уже Фраунгоферъ обратилъ вниманіе на совпаденіе D-линіи съ желтой линіей натрія. Брюстеръ нашелъ, что полосы калія совпадаютъ съ другими Фраунгоферовыми линіями; подобныя же наблюденія сдћлалъ и Фуко121).
Въ спектральномъ анализћ фундаментальное значеніе имћютъ два пункта, выясненіемъ которыхъ мы обязаны изслћдованіямъ Кирхгоффа и Бунзена: во-первыхъ, каждый элементъ въ раскаленномъ парообразномъ состояніи характеризуется опредћленнымъ прерывистымъ спектромъ; объ этомъ фактћ даже Сванъ еще не рћшался говорить съ увћренностью; вовторыхъ, основное значеніе имћетъ законъ избирательнаго поглощенія, къ которому близко подошли уже Ангстрёмь122) и БальфуръСтюартъ123), не сумћвшіе, однако, понять его ясно и полностью. Этотъ законъ извћстенъ теперь подъ именемъ закона Кирхгоффа, который доказалъ его математически124); экспериментально же его доказали Кирхгоффъ и Бунзенъ посредствомъ знаменитаго опыта съ обращеніемъ линій. Этотъ законъ гласитъ: При тепловомъ излученіи отношеніе испускательной способности къ поглощательной у всћхъ тћлъ при одной и той же температурћ остается одинаковымъ для лучей одинаковой длины волны. Отсюда слћдуетъ, что всћ тћла становятся накаленными, т.-е. испускаютъ одинаковой длины свћтовыя волны, при одной и той же температурћ, и что раскаленныя тћла поглощаютъ лишь тћ лучи, которые они испускаютъ. Такъ какъ раскаленные газы обладаютъ максимумомъ и минимумомъ силы свћта въ опредћленныхъ частяхъ спектра, а твердыя и жидкія тћла при достаточномъ нагрћваніи испускаютъ свћтовые лучи всћхъ родовъ, то газы должны поэтому обладать избирательною способностью поглощенія, которая вообще не встрћчается въ твердыхъ и жидкихъ тћлахъ. Такимъ образомъ Фраунгоферовы линіи являются результатомъ поглощеній, производимыхъ раскаленными парами. Благодаря этимъ линіямъ оказалось возможнымъ объяснить физическую природу солнца, а опредћленіе расположенія (длины волнъ) этихъ линій и сравненіе со спектрами излученія элементовъ, находящихся въ газообразномъ состояніи, дало возможность опредћлить химическій составъ солнца. Такимъ образомъ Кирхгоффъ является основателемъ новой науки, астрохиміи. Хотя со времени основанія этой науки {300} прошло лишь 45 лћтъ, она сдћлала уже большіе успћхи. Астрономія, благодаря ей, получила новыя задачи и новые методы изслћдованія, которые чрезвычайно расширили ея поле дћятельности; но ближе касаться этого предмета мы здћсь, конечно, не можемъ.
Творцы новаго метода показали сами, какое значеніе имћетъ для химіи спектральный анализъ, примћнивъ его къ аналитической химіи и открывъ съ его помощью два новыхъ элемента — рубидій и цезій. Благодаря этому же методу Круксомъ125) былъ открытъ таллій, Рейхомъ и Рихтеромъ — индій126), и ему же мы обязаны открытіемъ галлія и скандія, о когорыхъ выше уже была рћчь127).
Изъ новћйшихъ изслћдованій въ этой области мы должны упомянуть о работћ Митчерлиха, который указалъ, что не только каждый элементъ, но и каждое соединеніе въ газообразномъ состояніи имћетъ собственный спектръ128); далће, объ изслћдованіи Плюкера и Гитторфа, показавшихъ, что каждому элементу соотвћтствуютъ два спектра: кромћ линейнаго спектра, имћется еще и спектръ перваго порядка или полосовой (Bandenspektrum)129). Далће, мы должны указать на изслћдованія, относящіяся къ количественному спектральному анализу, главнымъ образомъ, Фирордта130) и Глана131), и, наконецъ, на многочисленныя работы, которыми имћлось въ виду доказать соотношенія между атомными вћсами и спектрами испусканія элементовъ, напримћръ, работы Лекокъ де Буабодрана132) и Чіамичіана133), или же отношенія между спектрами поглощенія и составомъ соединеній, какъ работы Эбнея, Фестинга134), Крюсса135) и др. Мы должны здћсь упомянуть также о работћ Банера, который далъ способъ вычислить при помощи простой формулы всћ линіи такъ называемаго перваго спектра водорода съ точностью до десятимилліонной части миллиметра136), и о рядћ важныхъ изслћдованій137) Кайзера и Рунге, очень точно установившихъ {301} спектры металловъ и показавшихъ, что эти спектры могутъ быть разложены на ряды простыхъ и парныхъ линій, у которыхъ разность колебанія приблизительно одинакова. Новћйшія изслћдо ванія сулятъ этимъ теоріямъ блестящую будущность.
Этому аналитическому методу можно противопоставить синтетическій, хотя послћднему въ смыслћ примћнимости нельзя придавать такого широкаго значенія, какъ первому. Я имћю въ виду синтезъ минераловъ. Поводомъ къ опытамъ этого рода послужили наблюденія Коха (1809)138), а особенно Гаусмана и Митчерлиха, которые нашли среди шлаковъ, образующихся при металлургическихъ процессахъ, продукты, идентичные съ извћстными минералами. Впервые такого рода удачный опытъ былъ произведенъ Джемсомъ Голлемъ. Онъ получилъ при помощи нагрћванія и большого давленія кристаллическую углекислую известь (мраморъ)139). Бертье и Митчерлихъ получили искусственную слюду, пироксенъ и другіе подобные минералы, сплавляя кремневую кислоту съ известью, магнезіей и окисью желћза140). Годенъ получилъ мелкіе рубины, сплавляя въ струћ гремучаго газа амміачные квасцы съ нћкоторымъ количествомъ окиси хрома141). Гэ-Люссакъ получилъ кристаллическій желћзный блескъ142), дћйствуя на хлорное желћзо парами воды. Эбельмену удалось получить цћлый рядъ кристаллическихъ тугоплавкихъ или вовсе не плавящихся минераловъ, при чемъ онъ для кристаллизаціи пользовался бурой или борной кислотой143). Беккерель получилъ въ кристаллическомъ состояніи нерастворимыя въ водћ вещества, какъ хлористое и сћрнистое серебро, закись мћди и основную углекислую мћдь; для этой цћли онъ пользовался медленно протекающими химическими реакціями144).
He имћя возможности входить здћсь въ подробности, я сообщу только, что Сенармонъ поставилъ себћ задачей, которую отчасти уже и разрћшилъ, опредћлить и осуществить условія, при которыхъ образуются встрћчающіеся въ природћ минералы, выдћлившіеся въ видћ кристалловъ въ рудныхъ жилахъ. Для достиженія этой цћли онъ пользовался главнымъ образомъ водой, которую заставлялъ дћйствовать подъ давленіемъ и при температурћ {302} приблизительно въ 350°145). Далће я упомяну, что СенъКлеръДевиль146) и его ученики изучили и использовали свойство фторисгаго водорода и другихъ фтористыхъ соединеній способствовать кристаллизаціи, и, наконецъ, что Готфейль147) первый получилъ искусственно каліевый и натріевый полевой шпатъ.
Въ изученіи взаимоотношеній между различными аггрегатными состояніями матеріи весьма плодотворнымъ оказалось понятіе о критической температурћ, или точкћ абсолютнаго кипћнія.
Уже въ 1822 г. Каньяръ де Латуръ замћтилъ148), что при нагрћваніи жидкости въ запаянной трубкћ, большая часть которой заполнена ею, можно достигнуть такой температуры, когда менискь исчезаетъ, и все содержимое кажется совершенно однороднымъ. Отсюда онъ сдћлалъ заключеніе, что при такой температурћ жидкость превращается въ газъ, независимо отъ давленія. Хотя эти опыты заслуживали большого вниманія, они, однако, остались почти совершенно незамћченными, и лишь 33 года спустя Вольфъ149) и Дріонь150) пытались найти для нћкоторыхъ жидкостей температуры, при которыхъ онћ переходятъ въ состояніе, замћченное Каньяръ деЛатуромъ. Въ 1861 г. Менделћевъ ввелъ для этой температуры весьма подходящее названіе „точки абсолютнаго кипћнія”. Онъ опредћлилъ ее какъ температуру, при которой какъ сцћпленіе жидкости, такъ и теплота ея парообразованія равны нулю, и жидкость, независимо отъ давленія и объема, превращается въ паръ151).
Восемь лћтъ спустя появилась знаменитая работа Эндрыоса152), который самымъ точнымъ образомъ изслћдовалъ взаимоотношеніе между давленіемъ, объемомъ и температурой у двуокиси углерода, и доказалъ, что она не можетъ быть превращена въ жидкость при температурћ выше 30,92° Ц. Онъ назвалъ эту температуру критической, а давленіе, подъ которымъ при температурћ чуть ниже критической можетъ наступить сжиженіе, онъ назвалъ критическимъ давленіемъ. Наблюденія Эндрьюса дали возможность построить для угольной кислоты изотермы, соотвћтствующія различнымъ температурамъ и представляющія соотношенія между {303} давленіемъ и объемомъ. При этомъ оказывается, что кривыя при температурћ ниже 30,92° Ц. не непрерывны и состоятъ изъ разнородныхъ частей, чего при температурћ выше указанной уже не бываетъ. Если при температурахъ немного выше, чћмъ 30,92° Ц., еще встрћчаются незначительныя измћненія въ кривизнћ, то уже при 48° это не имћетъ мћста, и кривая на всемъ своемъ протяженіи слћдуетъ уравненію газовъ:
рv = С,
т.-е. она представляетъ собою прямоугольную гиперболу. Вотъ почему прежнія обычныя опредћленія пара и постояннаго газа были оставлены, и въ настоящее время газомъ называютъ всякую упругую жидкость, нагрћтую выше свойственной ей критической температуры153). Непрерывность жидкаго и газообразнаго состояній обнаруживается съ особенной ясностью, когда какую-нибудь жидкость нагрћваютъ при давленіи выше критическаго. Въ этомъ случаћ никогда не наблюдается раздћленія на жидкость и газъ, но жидкость превращается въ газъ такъ, что при этомъ нельзя замћтить какой-либо разнородности154).
Эти работы оказали рћшающее вліяніе на опыты со сгущеніемъ газовъ. Всћмъ извћстно, что Фарадэй первый занялся этой задачей съ большимъ успћхомъ, и что цћлый рядъ газовъ былъ имъ превращенъ въ жидкое состояніе155) посредствомъ чрезвычайно простого и остроумнаго способа. Но онъ производилъ свои работы въ небольшомъ масштабћ; въ большомъ же количествћ угольную кислоту впервые сгустилъ Тилорье156). Воспользовавшись его опытами, Фарадэй продолжилъ свои изслћдованія157); однако, въ опытахъ съ водородомъ, кислородомъ, азотомъ, окисями углерода и азота онъ не получилъ удовлетворительнаго результата. Даже Наттереръ не могъ еще превратить водородъ въ жидкость, хотя онъ подвергнулъ его давленію въ 2790 атмосферъ158).
Лишь въ 1877 году Пикте159) и Кальете160) почти одновременно удалось превратить въ жидкое состояніе многіе изъ такъ {304} называемыхъ постоянныхъ газовъ, но ихъ методы и аппараты не давали имъ еще возможности получить эти вещества въ устойчивомъ жидкомъ состояніи и установить ихъ физическія константы (точку кипћнія, критическую температуру, плотность и т. д.). Впервые это удалось лишь Вроблевскому161), работу котораго надо считать образцовой по совершенству техники.
Внутренняя связь между физикой и химіей, обнаружившаяся уже при разсмотрћніи послћдняго вопроса, выступитъ передъ нами еще отчетливће, когда мы перейдемъ къ термохиміи. Этотъ отдћлъ науки имћетъ одинаковое значеніе для обћихъ дисциплинъ, и онъ почти въ равной степени разработанъ физиками и химиками. Основателями термохиміи слћдуетъ считать Лавуазье и Лапласа не только въ виду ихъ экспериментальныхъ работъ, относящихся къ теплотћ удћльной и скрытой, а также и къ теплотћ сгоранія, но и потому, что они дали опредћленія понятій162) и, что особенно важно, они установили, хотя и не вполнћ строго формулировали, основной законъ, который они вывели изъ механическаго закона сохраненія живыхъ силъ.
Теплота, освобождающаяся при образованіи соединеній или при измћненіи состоянія вещества, вновь поглощается при разложеніи соединеній или при возвращеніи вещества въ первоначальное состояніе, и обратно163).
Въ 1840 году Гессъ далъ этому закону другую форму, совершенно точную и весьма важную для практической термохиміи. Выдћленіе теплоты, соотвћтствующее какому-нибудь химическому процессу, остается неизмћннымъ, независимо отъ того, совершается ли этотъ процессъ сразу или протекаетъ отдћльными стадіями164).
Гессъ установилъ это положеніе эмпирически и пользовался имъ для опредћленія количества теплоты во многихъ такихъ случаяхъ, когда непосредственное измћреніе невозможно, т.-е. онъ поступалъ точно такъ же, какъ практикуется еще и понынћ.
Большое значеніе имћютъ обширныя работы Фавра и Зильбермана165), которыя отчасти состоятъ въ весьма точномъ измћреніи количествъ теплоты, именно теплотъ сгоранія. Сорокъ лћтъ {305} тому назадъ эти измћренія составляли эмпирическое основаніе термохиміи, въ новћйшее же время они уступили свое мћсто превосходнымъ изслћдованіямъ Томсена и Бертело, охватывающимъ почти всю область химіи.
Томсенъ166) призналъ, что законъ Гесса есть слћдствіе перваго начала механической теоріи тепла, которую онъ и положилъ въ основаніе своей теоріи. Онъ установилъ, далће, второй принципъ чисто химическій: каждое простое или сложное дћйствіе чисто химической природы сопровождается выдћленіемъ теплоты. Это положеніе онъ пытался обосновать какъ теоретически, такъ и эмпирически. Указанный принципъ часто согласуется съ опытомъ, но извћстны также и исключенія. Горстманнъ предполагаетъ, что химическія силы сами по себћ всегда стремятся вызвать экзотермическія реакціи167), реакціи же эндотермическія могутъ считаться результатомъ дћйствія теплоты.
Недавно Томсенъ пытался изъ чиселъ, найденныхъ эмпирическимъ путемъ, вычислить величины сродства углерода въ калоріяхъ и затћмъ вывести изъ этихъ величинъ теплоту образованія многихъ органическихъ соединеній. И здћсь также въ большинствћ случаевъ обнаружилось близкое согласіе съ опытомъ; однако, встрћчаются также и исключенія. Мы имћли уже случай указать, что подобнаго рода изслћдованія могутъ быть использованы въ цћляхъ провћрки структуры органическихъ соединеній168).
Бертело169) установилъ три принципа. Вопервыхъ, выдћленіе тепла при химическихъ процессахъ служитъ мћрой произведенной при этомъ химической и физической работы; это есть, слћдовательно, приложеніе перваго основного начала механической теоріи тепла. Согласно второму принципу выдћленіе тепла при химической реакціи, не сопровождающейся внћшней работой, зависитъ лишь отъ начальнаго и конечнаго состояній системы; это правило является лишь болће точнымъ выраженіемъ закона Лавуазье и {306} Лапласа (ср. стр. 305). Наконецъ, третій принципъ гласитъ, что всякое химическое превращеніе, совершающееся безъ помощи посторонней энергіи, стремится къ образованію тћла или системы тћлъ, которой соотвћтствуетъ наибольшее выдћленіе теплоты.
Этотъ „принципъ максимальной работы” вызвалъ много возраженій. Оспаривали не только его самостоятельность (въ немъ хотћли видћть лишь видоизмћненіе закона Томсена170), но отрицали и его правильность. Бертело выступилъ противъ этихъ двоякихъ нападокъ; однако, ему не удалось доказать справедливость принципа для всћхъ случаевъ171).
Мимоходомъ замћтимъ здћсь, что весьма употребительные нынћ термины „термическій эффектъ” (Wärmetönung)172) и „экзотермическія и эндотермическія реакціи” были введены первый Томсеномъ, а послћдніе — Бертело173).
Co времени Дэви и Берцеліуса задача о связи между электрическими и химическими силами занимала самыхъ геніальныхъ изслћдователей, но эта важная область до сихъ поръ оставалась не вполнћ освћщенной174). Электролитическій законъ Фарадэя есть законъ эмпирическій, и въ настоящее время его слћдуетъ считать одной изъ самыхъ могущественныхъ опоръ теоріи валентности175). Прекрасныя изслћдованія Даніелля и Миллера176), Гитторфа177) и Кольрауша178) много содћйствовали выясненію явленій электролиза. Въ послћднее время былъ разрћшенъ одинъ основной вопросъ, именно о возможности примћненія закона сохраненія силы къ электролитическимъ процессамъ, т.-е. было установлено взаимоотношеніе между химической энергіей и электродвижущей силой. Выясненіемъ этихъ отношеній мы обязаны важнымъ изслћдованіямъ Брауна179) и Гельмгольца180). Первый показалъ, что существуютъ такія цћпи, {307} электродвижущая сила которыхъ меньше величины, соотвћтствующей измћненію химической энергіи, и существуютъ цћпи съ электродвижущей силой, превышающей эту величину. Гельмгольцъ установилъ правило, что энергія тока лишь тогда равна химической энергіи, когда электродвижущая сила элемента не зависитъ отъ температуры. Если же электродвижущая сила увеличивается съ повышеніемъ температуры, то для порожденія тока расходуется, кромћ химической энергіи, еще и теплота, въ обратномъ же случаћ часть химической энергіи освобождается въ видћ теплоты.
Правильность этого положенія экспериментально доказали, кромћ самого Гельмгольца, еще многіе другіе изслћдователи181), въ особенности Янъ182).
Мы можемъ здћсь лишь слегка коснуться тћхъ отношеній между оптическими и химическими свойствами, которыя одинаково важны какъ для теоріи, такъ и для практики, потому что лишь немногіе изъ достигнутыхъ результатовъ имћютъ общее значеніе. Химическія дћйствія свћта были подробно изучены, главнымъ образомъ, лишь въ трехъ случаяхъ: 1) на серебряныхъ соляхъ183), 2) въ ассимиляціи зелеными частями растеній184) и 3) на взрывчатой смћси изъ хлора и водорода185).
Уже Дрэперъ пытался доказать, что яркость свћта пропорціональна произведенному дћйствію; эти доказательства были до полнены Бунзеномъ и Роско. Уже Шееле нашелъ, что не всћ лучи проявляютъ одинаковое свћтовое дћйствіе. Многіе позднћйшіе изслћдователи подтвердили это, а Бунзенъ и Роско установили точнће. Такъ какъ при различныхъ обстоятельствахъ было найдено, что наибольшее дћйствіе оказываютъ фіолетовые лучи, то возникла идея о химическихъ лучахъ; но въ настоящее время она совершенно оставлена. Можно считать доказаннымъ, что лучи любой длины волны могутъ производить химическія реакціи186), хотя и не съ одинаковой {308} интенсивностью и различнымъ образомъ, въ зависимости отъ химическихъ свойствъ свћточувствительнаго вещества. Существенно, что максимумъ дћйствія для различныхъ химическихъ процессовъ найденъ въ различныхъ частяхъ спектра. Замћчательно, что многочисленные опыты, произведенные съ дћлью установить максимумъ дћйствія спектра въ процессћ ассимиляціи растеніями, не привели къ одинаковымъ результатамъ. Одни нашли этотъ максимумъ въ желтой части, другіе — въ красной. Этотъ вопросъ имћетъ большое значеніе.
Ингенгусъ установилъ, что разложеніе угольной кислоты происходитъ въ зеленыхъ частяхъ растеній; это открытіе привело вскорћ къ предположенію, что существуетъ связь между красящимъ веществомъ хлорофилла и химическимъ процессомъ ассимиляціи. Уже въ 1824 г. Дюма высказалъ предположеніе, что фіолетовые лучи, преимущественно поглощаемые хлорофилломъ, должны играть наиболће дћятельную роль въ ассимиляціи187). Ломмель же, напротивъ, защищалъ взглядъ188), что главную роль въ ассимиляціи должны играть лучи, лежащіе между фраунгоферовыми линіями В и C, такъ какъ они обладаютъ наибольшей интенсивностью и соотвћтствуютъ также максимуму поглощательной способности хлорофилла.
Такъ какъ фактическія данныя не подтверждали ни того, ни другого предположенія, то Прингсгеймъ предложилъ и старался доказать слћдующую гипотезу, къ которой онъ пришелъ на основаніи своихъ изслћдованій относительно дћйствія свћта на окислительные процессы въ растеніяхъ: красящее вещество хлорофилла не есть химически дћйствующее тћло, а служитъ лишь ширмой, чтобы ослабить дыханіе растеній, которое безъ нея было бы слишкомъ сильнымъ189). Пфефферъ190) же считаетъ, что эта гипотеза противорћчитъ кривой поглощенія, установленной Энгельманномъ191), при чемъ нужно, однако, указать, что эта кривая основана на бактеріальномъ методћ192).
Уже Дрэперъ пытался доказать, что дћйствіе свћта должно сопровождаться его поглощеніемъ (l. с). Для выясненія этого вопроса Бунзенъ и Роско произвели измћрительные опыты, и оказалось, что во {309} взрывчатой смћси изъ хлора и водорода около 1/3 поглощаемыхъ лучей идетъ на химическую работу. Но необходимо при этомъ различать двоякаго рода случаи: вопервыхъ, когда свћтъ долженъ доставлять энергію, необходимую для химическаго процесса (протекающаго при поглощеніи теплоты), какъ, напримћръ, при ассимиляціи въ зеленыхъ частяхъ растенія, и, вовторыхъ, случаи, когда химическій процессъ происходитъ съ выдћленіемъ тепла, какъ, напримћръ, въ смћси хлора съ водородомъ. Но свћтъ производитъ работу, повидимому, въ обоихъ случаяхъ. Во второмъ случаћ, правла, это лишь подготовительная работа, при помощи которой устраняются препятствія къ соединенію. Для этого требуется также извћстный промежутокъ времени, названный по предложенію Бунзена и Роско фотохимической индукціей.
Намъ остается еще разсмотрћть обширную область молекулярной физики. Она занимается опредћленіемъ физическихъ константъ химическихъ веществъ и изслћдуетъ отношенія между этими константами, химическимъ составомъ и строеніемъ. Основателемъ этой отрасли является Германнъ Коппъ. Онъ съ 1842 года занимался опредћленіемъ точекъ кипћнія и удћльныЯъ, или молекулярныхъ, объемовъ жидкостей193). Для того, чтобы полученныя числа можно было сравнивать, ихъ надо опредћлять при сравнимыхъ условіяхъ, т.-е. точки кипћнія слћдуетъ опредћлять при одинаковыхъ давленіяхъ, а объемы — при точкћ кипћнія, такъ чтобы соотвћтствующіе пары обладали одинаковой упругостью. Руководящая мысль при этихъ сравненіяхъ заключалась прежде всего въ томъ, что одинаковымъ различіямъ въ сосхавћ должно соотвћтствовать и одинаковое измћненіе изучаемыхъ свойствъ, или что свойства какого-нибудь соединенія составляютъ сумму свойствъ его элементарныхъ составныхъ частей. Эмпирически вычислялась величина, соотвћтствующая атому элемента въ отношеніи разсматриваемаго свойства; зная составъ соединенія, съ помощью полученныхъ чиселъ устанавливали для соединенія теоретическую величину, соотвћтствующую данному свойству, и эту величину сравнивали съ величиной наблюдаемой. Такого рода изслћдованія были произведены относительно молекулярныхъ объемовъ, и при этомъ неоднократно получались {310} хорошо согласующіеся результаты. Но впослћдствіи были обнаружены и отклоненія, и поэтому оказалось необходимымъ принимать въ соображеніе также и строеніе соединеній; такъ, напримћръ, значеніе атомнаго объема, соотвћтствующее одному атому, должно быть измћнено въ зависимости отъ формы соединенія. Благодаря этому въ нћкоторыхъ случаяхъ получилась возможность провћрять структуру соединеній, которая сперва была найдена лишь химическимъ путемъ (ср. стр. 238).
По этому пути, съ болынимъ успћхомъ и искусствомъ проло женному Коппомъ, пошли многіе изслћдователи. Изслћдованія относительно молекулярныхъ объемовъ продолжаются до самаго послћдняго времени, и полученные результаты разрабатываются и примћняются такимъ же образомъ, какъ это дћлалъ Коппъ194). Другія свойства веществъ также были изслћдованы, и аналогичнымъ способомъ было установлено соотношеніе этихъ свойствъ съ составомъ и строеніемъ соединеній.
Это относится въ особенности къ преломленію свћта въ жидкостяхъ и газахъ. Такъ какъ показатель преломленія вещества зависитъ какъ отъ длины волнъ, такъ и отъ температуры, то самимъ показателемъ нельзя пользоваться для сравненія. Вначалћ, правда, пытались устранить вліяніе дисперсіи, беря показатель преломленія для волны опредћленной длины. Такъ, Ландольтъ въ своихъ изслћдованіяхъ пользовался показателемъ преломленія для линіи C раскаленнаго водорода. Брюль, напротивъ, примћнивъ формулу Коши и опредћливъ показатель преломленія для волнъ различной длины, вычислилъ совершенно независящій отъ нихъ коэффиціентъ195) (для безконечно длинныхъ волнъ).
Вначалћ пытались достигнуть независимости отъ температуры, примћняя найденное Лапласомъ выраженіе для преломляющей силы:
|
n2—1 d |
(n — показатель преломленія, d — плотность)196). Но вскорћ {311} оказалось, что это выраженіе не удовлетворяетъ требуемому условію (независимости отъ температуры); кромћ того эта формула потеряла всякое физическое значеніе послћ того, какъ была оставлена эмиссіонная теорія свћта. Гладстонъ и Дэль197) впослћдствіи доказали эмпирически, что выраженіе
|
n – 1 d |
удовлетворяетъ этому требованію, по крайней мћрћ, для многихъ случаевъ. Произведеніе этой величины на молекулярный вћсъ, такъ называемый эквивалентъ преломленія, Ландольтъ положилъ въ основаніе своихъ обширныхъ изслћдованій198); онъ нашелъ, что это произведеніе зависитъ, главнымъ образомъ, отъ химическаго состава (вліяніе строенія было лишь констатировано, но не изучено); такимъ образомъ Ландольту удалось вычислить эквиваленты преломленія атомовъ элементовъ С, Н и О, а изъ нихъ обратно вывести величины для отдћльныхъ соединеній; найденныя величины во многихъ случаяхъ совпадали со значеніями, полученными опытнымъ путемъ. Въ своихъ наблюденіяхъ онъ, впро чемъ, ограничился органическими соединеніями жирнаго ряда. Эти наблюденія были значительно расширены Гагеномъ199), а затћмъ Гладстономъ200), которые опредћлили свћтопреломленіе многихъ органическихъ соединеній и нашли эквиваленты преломленія почти всћхъ элементовъ.
Между тћмъ Г. А. Лоренцъ201) и Л. Лоренцъ202), совершенно независимо другъ отъ друга, вывели теоретически формулу
|
n2 – 1 (n2+2)d |
для вычисленія константы преломленія. Этой формулой воспользовался Ландольтъ203) и его ученикъ Брюль. Произведеніе этой величины на молекулярный вћсъ они называютъ молекулярнымъ преломленіемъ, и это послћднее было изслћдовано Брюлемъ для веществъ, сильно разсћивающихъ свћтъ, именно для ароматическихъ соединеній204). Онъ пришелъ къ заключенію, что атомное преломленіе многовалентныхъ элементовъ есть величина перемћнная; что, напримћръ, атомная рефракція углерода значительно увеличивается, если въ соединеніи имћются двойныя или тройныя углеродныя связи, или, какъ онъ полагаетъ, ненасыщенныя углеродныя валентности. Брюль опредћлялъ это увеличеніе для каждой этиленовой и ацетиленовой {312} связи и затћмъ вычислялъ молекулярное преломленіе; такимъ образомъ онъ неоднократно получалъ результаты, согласные съ наблюденіемъ. Позднћйшія изслћдованія Назини и Бернгеймера205), a также Канонникова206) только отчасти подтвердили выводы Брюля, но послћдній все же надћялся, что ему удастся устранить исключенія207). Однако, Томсенъ показалъ, что многія изъ найденныхъ Брюлемъ чиселъ могутъ быть вычислены безъ допущенія двойной и тройной углеродной связи208). Эти изслћдованія получаютъ особое значеніе еще и потому, что согласно взглядамъ Экснера209) молекулярныя рефракціи представляютъ собой также „истинные молекулярные объемы”.
Я не могу здћсь входить въ подробное разсмотрћніе другихъ подобныхъ изслћдованій, произведенныхъ съ цћлью выяснить соотношеніе между физическими и химическими свойствами, и ограничусь лишь ссылкою на нћкоторыя работы. Я укажу, напримћръ, на изслћдованія, установившія связь между пониженіемъ точки замерзанія растворовъ и молекулярнымъ вћсомъ находящагося въ растворћ вещества (Коппе210) и Рауль211), см. ниже). Эти изслћдованія примыкаютъ къ аналогичнымъ работамъ, произведеннымъ раньше212).
Затћмъ, я укажу на работу Г. Видеманна относительно молекулярнаго магнитизма213), на изслћдованія Грэма214) относительно транспираціи газовъ, на изслћдованія О. Ф. Мейера215), Максвелла216) и на изслћдованіе Лотара Мейера217) о транспираціи паровъ. Отдћльно нужно еще упомянуть о фундаментальныхъ изслћдованіяхъ Біо отно сительно вращенія плоскости поляризаціи218) и о примыкающихъ къ нимъ работахъ Ландольта219) и др.; наконецъ, упомяну еще опыты Перкина220) относительно электромагнитнаго вращенія плоскости поляризаціи. {313}
Въ заключеніе я долженъ сказать нћсколько словъ о соотношеніяхъ, которыя были установлены между кристаллической формой и химическимъ составомъ и привели къ существенному расширенію понятія объ изоморфизмћ. Это соотношеніе было открыто Гротомъ221). Благодаря многочисленнымъ работамъ этого изслћдователя и его учениковъ, его теорія была подтверждена въ очень значительномъ объемћ. Гротъ прослћдилъ тћ измћненія въ отношеніяхъ кристаллографическихъ осей, которыя вызываются вступленіемъ въ молекулу замћщающихъ группъ, и вывелъ такимъ путемъ рядъ закономћрностей. Указанныя явленія были названы имъ морфотропіей. Онъ далъ толчокъ къ цћлому ряду изслћдованій относительно морфотропическаго вліянія опредћленныхъ замћстителей. При этомъ выяснилось, напримћръ, что морфотропическое дћйствіе Cl, Br и J аналогично дћйствію водорода, вслћдствіе чего эти элементы и были названы изоморфотропными222). Гинтце затћмъ установилъ223), что изоморфизмъ надо считать частнымъ случаемъ морфотропіи. На это, впрочемъ, еще раньше указалъ Гротъ.
| {314} |
Законъ дћйствія массъ. — Теорія фазъ. — Теорія корреспондирующихъ сОстояній. — Теорія растворовъ. — Электрохимія. Жидкій воздухъ. — Новые элементы въ воздухћ. — Химія азота. — Температура превращенія. — Стереохимія. — Тавтомерія. — Новыя открытія въ органической химіи.
При обзорћ развитія химіи въ послћднія 20 — 30 лћтъ можно замћтить, что этотъ періодъ характеризуется все возрастающимъ вліяніемъ физической химіи или, какъ нћкоторые ее называютъ, общей химіи, которая развилась въ обиіирную науку. Ея развитію способствовали главнымъ образомъ выдающіеся естествоиспытатели, какъ Горстманнъ, Гиббсъ, Ванъ-деръ-Ваальсъ и особенно Вантъ-Гоффъ, посвятившіе свои труды исключительно этой области и своими идеями и открытіями поднявшіе эту науку чрезвычайно высоко. Съ другой стороны, нельзя отрицать, что расцвћтъ общей химіи не случайно совпалъ съ появленіемъ большого руководства по общей химіи Оствальда. Этотъ трудъ, въ которомъ впервые была дана полная картина всего достигнутаго въ физической химіи, оказалъ огромное и весьма плодотворное вліяніе. Развитію физической химіи весьма сильно способствовалъ также основанный Оствальдомъ и Вантъ-Гоффомъ журналъ „Zeitschrift fur physikalische Chemie”, сотрудниками котораго были всћ выдающіеся изслћдователи въ этой области, такъ что этотъ журналъ безусловно можетъ быть поставленъ на ряду съ лучшими періодическими изданіями нашей науки.
Прежде чћмъ перейти къ дальнћйшему изложенію, я долженъ предварительно сдћлать нћкоторыя добавленія относительно закона дћйствія массъ, о которомъ уже была рћчь въ пятнадцатой лекціи (см. стр. 296). {315}
Упомянемъ о нћкоторыхъ изъ тћхъ безчисленныхъ приложеній, которыя нашелъ этотъ законъ.
Большой интересъ возбудили изслћдованія относительно образованія іодистаго водорода изъ составныхъ частей, произведенныя сначала Готфейлемъ1) и дополненныя позже Лемуаномъ2). Послћдній полагалъ, что ему удалось констатировать вліяніе давленія на степень разложенія іодистаго водорода, что противорћчило бы теоріи. По иниціативћ В. Мейера — Боденштейнъ3) подвергнулъ этотъ вопросъ опытному изслћдованію; онъ сперва нашелъ еще болће сильное отклоненіе отъ теоріи въ отношеніи независимости равновћсія отъ давленія, и лишь позже4) ему удалось обнаружить полное согласіе опыта съ теоріей, послћ того какъ онъ открылъ и устранилъ источникъ погрћшности въ прежнемъ изслћдованіи.
Явленіе диссоціаціи газовъ часто представляло случай для примћненія теоріи; таковы, напримћръ, случаи расщепленія N2O45), разложенія солянокислаго метиловаго эќира6), распаденія двуокиси углерода на кислородъ и окись углерода7) и т. д.
Законъ дћйствія массъ нашелъ многочисленныя примћненія также и въ изслћдованіяхъ по электролитической диссоціаціи, но объ этомъ я сейчасъ не буду говорить, такъ какъ объ электролитической диссоціаціи будетъ рћчь впереди. Здћсь же мы займемся подробнће работами, касающимися химическаго равновћсія.
Толчокъ къ этимъ изслћдованіямъ дала теорія фазъ, которой мы обязаны В. Гиббсу8). Разработанное имъ правило фазъ, доказанное имъ же и позже Ванъ-деръ-Ваальсомъ9), гласитъ: полное равновћсіе наступаетъ только тогда, когда число „фазъ” на единицу превышаетъ число „независимыхъ составныхъ частей”.
„Фазы” это — однородныя (гомогенныя) составныя части неоднороднаго (гетерогеннаго) комплекса. Всякое аггрегатное состояніе образуетъ, слћдовательно, по крайней мћрћ одну фазу; въ жидкомъ и твердомъ состояніи могутъ существовать рядомъ двћ и {316} болће фазъ, тогда какъ газъ, какъ бы сложенъ онъ ни былъ, образуетъ всегда лишь одну фазу.
„Независимыми составными частями” называются всћ тћ элементы или соединенія, масса которыхъ можетъ быть выбрана произвольно10). Напримћръ, хлористый аммоній содержитъ только одну такую независимую, составную часть: ею можетъ быть либо N, либо Н, либо Сl. Если прибавить избытокъ амміака или соляной кислоты, то получатся двћ независимыя составныя части. Углекислый кальцій выше своей температуры диссоціаціи состоитъ изъ двухъ независимыхъ составныхъ частей, напримћръ, изъ Са и C, такъ какъ составъ двухъ твердыхъ фазъ, каковыми являются СаСО3 и СаО, не можетъ быть опредћленъ однимъ Са. Вотъ почему полное гетерогенное равновћсіе въ хлористомъ аммоніи имћетъ мћсто при двухъ фазахъ, а въ кальцитћ — при трехъ.
Полное равновћсіе это — такое состояніе, при которомъ еще имћется одна степень свободы; напримћръ, при такомъ состояніи можно, не нарушая равновћсія, измћнять температуру.
Если имћются n+2 фазъ и n независимыхъ составныхъ частей, то равновћсіе имћетъ мћсто только въ особенныхъ точкахъ, т.-е. при опредћленной температурћ (кратныя точки, температуры перехода, температуры превращенія). Если число фазъ равно числу составныхъ частей, то равновћсіе такой системы будетъ неполнымь, т.-е. каждой температурћ соотвћтствуетъ рядъ давленій.
Какъ показалъ главнымъ образомъ Рузебумъ11), это правило фазъ находитъ весьма многочисленныя примћненія. Онъ изслћдовалъ зависимость между аггрегатными состояніями, равновћсіе между водой и двуокисью сћры, гидраты хлорнаго желћза и др. Далће, правило фазъ можетъ быть примћнено къ явленіямъ диссоціаціи, къ взаимному превращенію аллотропическихъ модификацій и т. д.12).
Весьма возможно, что правило фазъ, значеніе котораго нћкоторыми преувеличивается, по своей плодотворности уступаетъ теоріи корреспондирующихъ состояній Ванъ-деръ-Ваальса13) и теоріи {317} растворовъ Вантъ-Гоффа14). Ванъ-деръ-Ваальсъ существеннымъ образомъ подвинулъ изслћдованіе тћмъ, что „уравненію состоянія” газовъ, которое по законамъ Бойля-Маріота и Генри-Гэ-Люссака выражается формулой
pv = RT,
онъ придалъ слћдующій видъ:
( |
p + |
a v2 |
) |
(v – b) = RT, |
гдћ а и b суть константы, соотвћтствующія объему молекулы, котораго нельзя не принимать вовсе въ расчетъ (b есть учетверенный объемъ), и сцћпленію газовъ.
Это уравненіе Ванъ-деръ-Ваальса не только значительно лучше предыдущаго соотвћтствуетъ свойствамъ газовъ, въ особенности въ сжатомъ состояніи, но оно безъ измћненія можетъ быть также примћнено и къ жидкостямъ. Такъ какъ константы а и b могутъ быть опредћлены сравнительно просто по критическимъ даннымъ (объемъ, давленіе и температура) и по свойствамъ газа при высокихъ давленіяхъ, то уравненіе Ванъ-деръ-Ваальса даетъ способъ опредћлять свойства всћхъ однородныхъ жидкихъ и газообразныхъ веществъ при измћненіяхъ температуры, давленія и объема. Оно имћетъ поэтому фундаментальное значеніе. Провћркой его мы обязаны главнымъ образомъ Юнгу15).
Теорія растворовъ основывается на представленіяхъ, создавшихся благодаря извћстнымъ опытамъ Пфеффера16), которые въ свою очередь стали возможными послћ того, какъ Траубе17) открылъ полупроницаемыя перепонки.
ВантъГоффъ, объясняя осмотическое давленіе ударами растворенныхъ молекулъ о стћнки, пришелъ къ мысли объ аналогіи между растворами и газами. Законы Бойля-Маріотта, Генри-Гэ-Люссака, а также основная гипотеза Авогадро могутъ быть непосредственно ириложены и къ растворамъ. Такимъ образомъ эта область, до сихъ поръ одна изъ самыхъ темныхъ во всей химіи, стала сразу совершенно доступной изслћдованію. Этимъ былъ достигнутъ громадный успћхъ, отразившійся на всей химіи. {318}
Только теперь могли быть теоретически объяснены упомянутыя выше весьма важныя соотношенія между пониженіемъ точки плавленія и давленія пара или повышеніемъ точки кипћнія, съ одной стороны, и молекулярнымъ вћсомъ раствореннаго вещества — съ другой, ікоторыя были экспериментально установлены и формулированы главнымъ образомъ Раулемъ (ср. стр. 312)18). Уже благодаря этому, а также вслћдствіе различныхъ усовершенствованій19) и упрощеній способа Рауля для опредћленія молекулярнаго вћса, этотъ методъ очень скоро вошелъ въ употребленіе; результаты, полученные изъ опредћленія пониженія точки замерзанія, оказываются не менће вћрными, чћмъ тћ, которые получаются изъ опредћленія плотности пара.
Впрочемъ, уже Рауль указалъ, что водные растворы солей и кислотъ не подчиняются его правиламъ: въ этихъ случаяхъ получается слишкомъ низкій молекулярный вћсъ, половина или треть той величины, которую слћдуетъ считать нормальной. Это явленіе сначала не находило объясненія и поэтому возникъ вопросъ о томъ, въ какихъ предћлахъ имћетъ силу теорія Вантъ-Гоффа. Соотвћтственное затрудненіе было преодолћно здћсь такимъ же образомъ, какъ въ вопросћ объ аномальныхъ плотностяхъ паровъ, который разрћшили Канниццаро, Кекуле и Коппъ. Совершенно такимъ же путемъ пошелъ и Арреніусъ (Ср. стр. 287).
Гипотеза20), установленная имъ въ 1887 г., предполагаетъ реально существующимъ то состояніе, которое необходимо для достиженія согласованія теоріи Вантъ-Гоффа съ числами, получающимися по правиламъ Рауля. Арреніусъ указываетъ, что числа, не согласующіяся съ теоріей, получаются именно для тћхъ растворовъ, которые представляютъ собой электролиты, т.-е. отъ дћйствія электрическаго тока распадаются на свои іоны. Арреніусъ предположилъ, что образованіе іоновъ вызывается не токомъ, но уже самымъ процессомъ растворенія; этотъ послћдній, такимъ образомъ, сопровождается {319} болће или менће полной электролитической диссоціаціей, степень которой зависитъ, главнымъ образомъ, отъ степени разбавленія. Очень скоро самимъ Арреніусомъ21), а также Планкомъ22), Оствальдомъ23) и др. были выработаны различные способы для опредћленія степени диссоціаціи; весьма важно то, что эти способы дали согласные результаты.
Гипотеза Арреніуса, какъ и слћдовало ожидать, встрћтила очень многихъ противниковъ. Предположеніе, что водный растворъ поваренной соли содержитъ свободные іоны натрія и хлора, которые вћдь представляютъ собой не что иное, какъ электрически заряженные атомы и обладаютъ свойствами свободныхъ молекулъ, должно было встрћтить сопротивленіе со стороны. химиковъ, такъ какъ эта гипотеза прежде всего противорћчила непосредствќнному наблюденію и вслћдствіе этого содержала нћчто метафизическое. Кромћ того, она дћлала весьма труднымъ пониманіе нћкоторыхъ реакцій, ранће казавшихся простыми, напримћръ, разложеніе воды щелочными металлами24), такъ какъ здћсь вћдь нельзя было предполагать соединеніе съ кислородомъ, а съ другой стороны также врядъ ли здћсь можно было допускать вытћсненіе H-іоновъ іонами Na. Ho какое значеніе имћютъ подобныя возраженія въ сравненіи съ тћми огромными преимуществами, которыя представляетъ теорія электролитической диссоціаціи? Она удовлетворительно объясняла цћлый рядъ фактовъ, которые раньше были непонятны. Такъ называемый законъ термонейтральности Гесса25), отчасти уже подтвержденный знаменитыми изслћдованіями Томсена26) и Бертело27), находится въ полномъ соотвћтствіи съ іонной теоріей такъ же, какъ и исключенія изъ этого закона, которыя должны имћть мћсто при неполной диссоціаціи. Безъ этой теоріи указанныя явленія представляли бы неразрћшимую загадку28).
Теорія электролитической диссоціаціи объясняетъ также явленіе идентичности теплотъ нейтрализаціи одного и того же основанія различными кислотами и обратно. Она согласуется, далће, съ правиломъ Оудеманса29)-Ландольта30), по которому соли оптически дћятельнаго {320} алкалоида такъ же, какъ и оптически дћятельныхъ кислотъ, обнаруживаютъ одинаковое вращеніе при эквивалентной концентраціи; далће, она согласуется съ магнитною вращательною способностью соединеній31) и съ явленіями атомнаго магнитизма32). Этой теоріей вполнћ объясняется, почему спектры разбавленныхъ растворовъ различныхъ солей, содержащихъ одинаково окрашенный іонъ, идентичны33), а также почему молекулярная преломляющая способность солей, находящихся въ водномъ растворћ, является свойствомъ аддитивнымъ. Но важнћйшими фактами этого рода нужно считать, во-первыхъ, пропорціональность между электропроводностью кислотъ и ихъ коэффиціентомъ сродства, и, во-вторыхъ, доказательство, что степень диссоціаціи, вычисленная какъ изъ электропроводности, такъ и изъ пониженія точки замерзанія приводитъ къ почти одинаковымъ результатамъ, какъ показапъ Арреніусъ36). Въ виду всего этого не можетъ быть сомнћнія, что гипотеза Арреніуса имћетъ полное право на существованіе.
Эта теорія іонизаціи, какъ ее часто теперь называютъ, непосредственно приводитъ насъ къ электрохиміи, достигшей необыкновеннаго расцвћта и представляющей въ настоящее время самостоятельную и весьма плодотворную отрасль науки. Для насъ теперь вполнћ понятенъ тотъ энтузіазмъ, съ которымъ было встрћчено открытіе гальваническаго тока и Вольтова столба (ср. стр. 62). Послћ великихъ открытій Риттера, Дэви, Берцеліуса и Фарадэя послћдовалъ, правда, продолжительный періодъ. застоя; однако, мнћніе тћхъ изслћдователей, которые полагали, что эта новая область таитъ еще сокровища, которыя когда-либо будутъ открыты, подтвердилось самымъ блестящимъ образомъ.
Новћйшая электрохимія примкнула непосредственно къ этимъ старымъ открытіямъ и къ изслћдованіямъ Гитторфа и Кольрауша, которыя теперь только нашли пониманіе, и постепенно привела къ цћлому ряду новыхъ открытій.
Прежде всего упомянемъ объ аккумуляторахъ, безъ которыхъ врядъ ли была бы возможна дћйствительная утилизація электрической {321} энергіи и которые нашли самое широкое примћненіе. Ихъ устройство основывается на явленіи поляризаціи, открытомъ Риттеромъ37) и на весьма обстоятельныхъ работахъ Плантё, начатыхъ имъ еще въ 1859 г.38) Плантё уже конструировалъ довольно сильныя такъ называемыя вторичныя цћпи, позже значительно усовершенствованныя Форомъ39).
Слћдуетъ также упомянуть о капиллярномъ электрометрћ Липпманна40), основанномъ на вызываемомъ поляризаціей измћненіи поверхностнаго натяженія ртути.
Большое значеніе имћетъ теорія Вольтова столба, которой мы обязаны Нернсту41). Она основывается на теоріи диффузіи, установленной этимъ изслћдователемъ, и на понятіи о напряженіи раствора, выведенномъ изъ теоріи растворовъ Вантъ-Гоффа (см. выше). Нернстъ развилъ также теорію концентраціонныхь цћпей, при чемъ онъ пришелъ къ тћмъ же выводамъ, къ какимъ Гелымгольтцъ42) пришелъ термодинамическимъ путемъ.
О всћхъ этихъ работахъ мы здћсь можемъ лишь упомянуть мимоходомъ, такъ онћ относятся собственно къ области физики.
Вернемся къ предметамъ, касающимся насъ ближе. Прежде всего нужно упомянуть объ успћхахъ, достигнутыхъ аналитической химіей благодаря примћненію электролиза. Этотъ методъ очень старъ, и его примћнимость предвидћлъ уже въ 1801 году43) Крюикшэнкъ (Cruikshank). Вначалћ электролизъ примћнялся только въ качественномъ анализћ44), но позже Магнусъ указалъ, что онъ примћнимъ также и въ количественномъ анализћ, т.-е. для электролитическаго выдћленія металловъ45). Подобнаго рода опыты были произведены также Дж. Гиббсомъ46) и Луковымъ47). Позже Классенъ48), Миллеръ {322} и Килліани49), Смитъ50), Вортманъ51) и др. показали многообразныя примћненія электролиза въ количественномъ анализћ, a Классенъ указалъ, въ какомъ видћ лучше всего производится опытъ. Но только Килліани52) выяснилъ впервые, какое огромное значеніе имћетъ электродвижущая сила при электролитическомъ отдћленіи веществъ.
Быть можетъ, еще болће важное значеніе имћетъ примћненіе электролиза въ металлургіи. Послћ давнишнихъ работъ Дэви (см. стр. 65) существенному успћху въ этомъ направленіи способствовали главнымъ образомъ изслћдованія Бунзена53), произведенныя отчасти имъ самимъ, отчасти вмћстћ съ Маттизеномъ. Техническое примћненіе электролизъ нашелъ впервые въ гальванопластикћ, которая была открыта Якоби и Спенсеромъ въ 1839 году и основывается на одномъ наблюденіи Деларива, сдћланномъ въ 1836 году.
Техническое полученіе металловъ стало возможнымъ лишь послћ изобрћтенія динамомашины (1872 г.). Ее сейчасъ же примћнили для выдћленія мћди изъ растворовъ (на гамбургскомъ заводћ). Позже были получены электролитическимъ способомъ также и другіе металлы, a именно цинкъ, магній, серебро, золото и др. Выдающееся значеніе получило электролитическое добываніе алюминія, которое удалось впервые Бунзену54). Техническій методъ Геру (Heroult)55) отличается отъ способа Бунзена главнымъ образомъ тћмъ, что электролизу подвергаются не расплавленные двойные хлориды металла, но растворъ окиси алюминія въ расплавленномь кріолитћ.
Здћсь умћстно указать на огромное научное и практическое значеніе опытовъ Муассана съ изобрћтенной имъ электрической печью56). Заслуживаетъ вниманія изготовленіе искусственныхъ алмазовъ, полученіе карбида кальція, который, впрочемъ, былъ открытъ задолго передъ тћмъ Вёлеромъ57), и другихъ карбидовъ; Муассанъ кромћ того получилъ въ чистомъ видћ хромъ и другіе тугоплавкіе металлы. Карборундъ, полученіе котораго часто {323} приписывается Муассану, въ дћйствительности былъ открытъ американцемъ Ачесономъ58). Здћсь нужно замћтить, что при этихъ опытахъ электрическая энергія въ нћкоторыхъ случаяхъ служитъ лишь для полученія высокихъ температуръ (отъ 3000° до 4000°), и поэтому тћхъ же результатовъ можно было бы достигнуть и другимъ способомъ; недавно, напримћръ, такія высокія температуры были получены посредствомъ химическихъ реакцій. Возникла совершенно новая область, термоиндустрія, отъ которой металлургія получила уже очень много и можетъ ожидать еще большаго. Къ болће раннему времени относится примћненіе паяльника съ гремучимъ газомъ для плавленія и обработки платины59), сжиганіе въ воздухћ или кислородћ при высокой температурћ углерода и другихъ элементовъ, какъ кремній, сћра и фосфоръ, для полученія еще болће высокихъ температуръ — въ доменныхъ печахъ или при столь остроумномъ методћ Бессемера. Новымъ является усовершенствованіе этихъ методовъ для полученія не содержащихъ угля металловъ, какъ хромъ, марганецъ, желћзо, никкель, и очень многихъ сплавовъ (Гольдшмидтъ60). Методъ Гольдшмидта основанъ на необыкновенно высокой теплотћ сгоранія алюминія.
Здћсь слћдуетъ напомнить объ интересныхъ результатахъ, полученныхъ В. Мейеромъ61) съ одной стороны, а Крафтомъ62) съ другой, посредствомъ выработаннаго В. Мейеромъ метода для опредћленія плотчости пара63). Въ этомъ отношеніи достойно вниманія доказательство, что молекула іода J2 при высокой температурћ расщепляется на два отдћльныхъ атома64) и что начало подобной же диссоціаціи замћчается и у брома65); далће, что молекула мышьяка As4 распадается на двћ части, тогда какъ іодистый калій даже при очень высокихъ температурахъ сохраняетъ формулу KJ, а полухлористая мћдь Cu2Cl2 не можетъ быть расщеплена, и т. д.
Если достиженіе высокихъ температуръ оказалось столь полезнымъ для всей нашей науки и техники, то, съ другой стороны, стремленія достигнуть низкихъ температуръ также привели къ {324} весьма важнымъ и неожиданнымъ резулыатамъ. Соотношеніе между аггрегатнымъ состояніемъ и критической температурой найдено было уже давно; объ этомъ мы уже говорили выше (стр. 302); тамъ же мы упоминали о результатахъ, полученныхъ Пиктэ, Кайетэ и Вроблевскимъ относительно сгущенія такъ называемыхъ постоянныхъ газовъ. Особенно важными оказались тщательныя изслћдованія Вроблевскаго и Ольшевскаго, которые впервые приготовили кислородъ и азотъ въ устойчиво-жидкомъ состояніи и подробнће описали многія ихъ свойства66). Ими же былъ выработанъ и методъ опредћленія температуры посредствомъ измћренія напряженія термоэлектрическихъ токовъ. Этотъ способъ въ настоящее время нашелъ широкое примћненіе67). При опытахъ, произведенныхъ въ новћйшее время для сгущенія воздуха и другихъ газовъ, примћняли не методъ Пиктэ, но другой способъ, напоминающій болће способъ Кайетэ. Этотъ послћдній методъ, однако, претерпћлъ превращеніе въ процессъ динамическій или непрерывный: расширеніемъ и необходимой для этого внутренней работой сильно сжатыхъ газовъ пользуются, чтобы вызвать пониженіе температуры. Такъ, Дьюоръ68) получилъ жидкій воздухъ, подвергая внезапному расширенію воздухъ, охлажденный посредствомъ твердой углекислоты и сжатый подъ давленіемъ 100 атмосферъ. По болће новому методу охлажденіе воздуха достигается исключительно его расширеніемъ; это расширеніе сжатаго воздуха весьма остроумно осуществляется въ аппаратћ, основанномъ на принципћ противотока. Пользуясь этимъ методомъ, Линде69) въ Германіи и Гампсонъ70) въ Англіи почти одновременно конструировали технически годные аппараты для полученія жидкаго воздуха.
Впрочемъ, въ техникћ жидкій воздухъ не нашелъ еще сколько-нибудь значительнаго примћненія*). Изъ жидкаго воздуха получаютъ очень дешево почти чистый кислородъ, который пытались утилизировать для взрывовъ или для полученія высокихъ температуръ; {325} но пока еще объ этомъ ничего нельзя сказать окончательно. Гораздо болыиее значеніе жидкій воздухъ имћетъ въ чисто научномъ отношеніи.
Вопервыхъ, Дьюору удалось съ помощью жидкаго воздуха привести въ жидкое состояніе водородъ71) и получить въ твердомъ видћ воздухъ, кислородъ и водородъ72), т.-е. въ этомъ отношеніи достигнуто почти все. Дьюоръ полагалъ, что ему удалось также превратить въ жидкость и гелій73), но позже онъ призналъ, что ошибся74); Ольшевскій75) показалъ, что гелій остается газообразнымъ даже при –271°*).
Весьма важное значеніе имћетъ также то обстоятельство, что озонъ, полученный уже Готфейлемъ и Шаппюи въ 1882 г. въ жидкомъ состояніи съ помощью жидкаго этилена, можетъ быть легко полученъ почти въ чистомъ видћ съ помощью жидкаго воздуха76); благодаря этому Троосту удалось опредћлить его точку кипћнія77), а Ладенбургу78) — плотность. Послћднее опредћленіе имћетъ особенное значеніе, такъ какъ выведенный отсюда молекулярный вћсъ, соотвћтствующій формулћ O3, оказался самымъ убћдительнымъ доводомъ въ пользу всей молекулярной теоріи. До тћхъ поръ эта величина, которая была опредћлена только на основаніи опыта Cope79), не могла считаться окончательно установленной. Открытый Гольдштейномъ новый способъ для полученія чистаго озона80) также основанъ на примћненіи жидкаго воздуха.
Но особенно поразительны успћхи, достигнутые съ помощыо жидкаго воздуха при открытіи новыхъ элементовъ.
Когда лордъ Рэлей сравнилъ удћльный вћсъ азота, полученнаго изъ воздуха, съ вћсомъ того же газа, полученнаго изъ амміака или другцхъ азотъсодержащихъ соединеній, то онъ обнаружилъ разницу (въ третьемъ десятичномъ знакћ), которую нельзя было объяснить погрћшностью опыта81). Онъ рћшилъ тогда произвести тщательное изслћдованіе, чтобы установить, какое вещество примћшано къ атмосферному азоту. Это изслћдованіе, произведенное имъ {326} совмћстно съ В. Рамзаемъ, привело къ открытію элемента аргона, неспособнаго, повидимому, входить ни въ какія соединенія82). Молекулярный вћсъ его, опредћленный по плотности, оказался равнымъ 39,3183); такъ какъ изслћдованіе по методу Кундта (ср. стр. 283) дало основаніе считать этотъ газъ одноатомнымъ, то его атомный вћсъ имћетъ такую же величину, какъ и молекулярный. Но вслћдствіе этого возникъ чрезвычайно трудный вопросъ относительно положенія этого элемента въ періодической системћ, такъ какъ онъ долженъ находиться рядомъ съ каліемъ, а именно непосредственно передъ нимъ.
Къ возникшей проблемћ Рамзай приступилъ съ весьма общей точки зрћнія. Ему казалось очень вћроятнымъ, что аргонъ является членомъ цћлой группы элементовъ, и онъ надћялся, что ему удастся открыть въ азотћ еще и другіе члены этой группы. При этомъ онъ пришелъ между прочимъ къ изслћдованію газа, кото рый выдћляется изъ клевеита при его нагрћваніи съ сћрной кислотой и который Гиллебрандтъ считалъ азотомъ84). Этотъ опытъ привелъ Рамзая къ открытію гелія, самую яркую линію котораго D3 (D1 и D2-линіи Na) Локіеръ уже задолго передъ тћмъ нашелъ въ солнечной хромосферћ85). Гелій, атомный вћсъ котораго (4) былъ опредћленъ по его плотности и по скорости распространенія звука въ немъ, оказался во всћхъ отношеніяхъ аналогичнымъ аргону, вслћдствіе чего для Рамзая стало ясно, что долженъ существовать еще одинъ элементъ съ атомнымъ вћсомъ, равнымъ приблизительно 20, который долженъ находиться передъ натріемъ, подобно тому какъ гелій находится передъ литіемъ и аргонъ передъ каліемъ, хотя атомный вћсъ аргона оказался ббльшимъ, чћмъ у калія86) (подобно этому у теллура атомный вћсъ, по новћйшимъ опредћленіямъ, оказывается ббльшимъ87), чћмъ у іода88).
Рамзай излагаетъ дальнћйшій ходъ своей работы въ такомъ видћ89), будто его систематическое изслћдованіе, произведенное съ чрезвычайной энергіей и настойчивостью, осталось безрезультатнымъ и только случай привелъ его къ дальнћйшимъ открытіямъ. {327} Въ дћйствительности же тутъ случая не было, такъ какъ и изслћдованіе остатковъ отъ испаренія жидкаго воздуха тоже вћдь составляетъ лишь звено, неразрывно связанное со всћмъ ходомъ его мыслей, хотя, можетъ быть, и безсознательно для него самого. Такимъ образомъ былъ открытъ криптонъ; предварительное опредћленіе его молекулярнаго вћса дало 45, а позже было установлено, что онъ равенъ 8290). Оказалось далће, что отношеніе теплоемкостей криптона равно 1,66; онъ является, слћдовательно, одноатомнымъ элементомъ; положеніе его въ періодической системћ еще не опредћлено.
Путемъ систематическаго фракціонированія аргона91), сгущеннаго съ помощью жидкаго воздуха, Рамзай далће открылъ два новыхъ элемента: неонъ съ атомнымъ вћсомъ 19,9, ксенонъ, для котораго сначала была найдена плотность 6591), позже исправленчая на 12890). Неонъ, очевидно, долженъ былъ помћщенъ между геліемъ и аргономъ и передъ натріемъ. Такъ называемый метаргонъ при ближайшемъ изслћдованіи оказался окисью углерода.
Хотя устранены еще не всћ сомнћнія относительно однородности и элементарной природы этихъ газовъ,92) однако, эти изслћдованія несомнћнно принадлежатъ къ числу наиболће плодотворныхъ изъ всћхъ сдћланныхъ въ теченіе послћднихъ 20 лћтъ. Жидкій воздухъ при этомъ игралъ не только роль исходнаго матеріала: Рамзай остроумнымъ образомъ утилизировалъ его или, вћрнће, жидкій кислородъ, изъ него полученный, для отдћленія различныхъ новыхъ элементовъ.
Вопросъ относительно положенія этихъ „элементовъ” въ періодической системћ усердно обсуждался, но пока еще не разрћшенъ окончательно. Вћроятнће всего, что этимъ элементамъ нужно приписать валентность 0 и помћстить ихъ передъ группой щелочныхъ металловъ. Но и теперь уже можно сказать, что, если даже вновь найденные факты и должны измћнить наши взгляды на зависимость между свойствами элементовъ и ихъ атомными вћсами, но періодическій законъ, во всякомъ случаћ, оказался наилучшей руководящей идеей въ этой темной области.
Какъ ни неожиданны были эти открытія, они не могугъ, однако, оказать замћтнаго вліянія на всю область химіи, такъ какъ всћ открытые {328} элементы повидимому сходны съ аргономъ, т.-е. даютъ лишь очень мало соединеній или даже вовсе не вступаютъ въ соединенія. Поэтому можно сказать, что эти интересныя изслћдованія въ смыслћ слћдствій не окажутся особенно значительными. Въ этомъ отношеніи они уступаютъ другимъ работамъ, менће замћтнымъ для широкихъ круговъ.
Сюда относится прежде всего полученіе фтора въ чистомъ видћ (Муассанъ, 188693), далће открытіе соедниенія никкеля съ окисью углерода и другихъ подобныхъ соединеній (Мондъ94). Нћсколько дольше я долженъ остановиться на изслћдованіяхъ по химіи азота, такъ какъ въ послћднее десятилћтіе эта отрасль стала сильно развиваться.
Сюда относится открытіе гидроксиламина (Лоссенъ), которое было сдћлано, правда, уже въ 1865, но лишь постепенно оцћнено во всемъ его значеніи, чему главнымъ образомъ способствовали работы В. Мейера объ оксимахъ96) и ихъ стереоизомеріи97).
Далће слћдуетъ упомянуть о фенилгидразинћ, полученномъ Фишеромъ98). Значеніе этого соединенія чрезвычайно велико, такъ какъ оно даетъ ключъ къ группћ углеводовъ99). Сюда примыкаютъ далће прекрасныя изслћдованія Курціуса, который въ 1889 г. открылъ гидразинъ100), а въ 1890 г. азотисто-водородную кислоту101). Эти соединенія дали толчокъ къ многимъ изслћдованіямъ, и нужно ожидать еще дальнћйшихъ. Далће слћдуетъ открытіе діазометана CH2N2 (Пехманнъ101a); это соединеніе заслуживаетъ интереса уже по своему составу. Слћдуетъ упомянуть объ изслћдованіяхъ Тиле102), который открылъ, между прочимъ, удобный и технически выполнимый методъ приготовленія гидразина, и объ {329} изслћдованіи Рашига103), который выяснилъ строеніе сульфазотистыхъ кислотъ и при этомъ нашелъ нынћ примћняемый методъ полученія гидроксиламина.
Здћсь не мћсто входить далће въ разсмотрћніе этого предмета, такъ какъ въ историческомъ обзорћ на первый планъ должны выдвигаться только тћ вопросы, которые имћютъ общее значеніе.
Я долженъ, однако, упомянуть объ одномъ открытіи Гелльригеля104), составившемъ эпоху въ химіи и агрономіи. Гелльригель доказалъ, что бобовыя растенія, особенно лупины, подъ вліяніемъ низшихъ организмовъ получаютъ способность ассимилировать атмосферный азотъ; нужно, однако, прибавить, что уже раньше Бертело отстаивалъ возможность ассимиляціи свободнаго азота105). Далће, сюда относятся весьма важные въ техническомъ отношеніи опыты непосредственнаго превращенія атмосфернаго воздуха въ амміакъ или азотную кислоту. Обћ эти задачи сейчасъ, повидимому, весьма близки къ рћшенію. Первая задача рћшается опытами Каро и Франка106), примыкающими къ старымъ работамъ Маргерита и Сурдеваля107); методъ основанъ на томъ, чтобы свободный азотъ связывать карбидами. Изъ карбида кальція получается такимъ образомъ ціанъамидъ кальція, оказавшійся весьма цћннымъ удобреніемъ. Рћшеніе второй задачи основано на методћ Кэвендиша, дающемъ возможность прямо соединять азотъ и кислородъ въ азотную кислоту (ср. стр. 23). Повидимому Биркеландъ и Эйде108) преодолћли затрудненія, препятствовавшія техническому примћненію этого метода.
Здћсь нужно также упомянуть объ изслћдованіи Бухнера, доказавшаго, что броженіе можетъ быть вызвано безъ посредства живыхъ организмовъ съ помощью отжатаго сока пивныхъ дрожжей (зимаза)109). Бухнеръ сначала доказалъ это только для алкогольнаго броженія, а въ послћднее время распространилъ и на молочнокислое и уксуснокислое броженіе110). Для этой цћли онъ пользовался {330} такъ называемыми долговћчными препаратами (Dauerpraparate), свободными отъ живыхъ организмовъ.
Особаго вниманія заслуживаетъ работа Вантъ-Гоффа, въ которой выясняются понятіе и значеніе температуры превращенія111). Вантъ-Гоффъ пришелъ къ этому, сравнивая химическія реакціи со взаимными переходами аггрегатныхъ состояній. Но къ такому же воззрћнію можно придти и черезъ теорію фазъ (конденсированныя системы).
Уже со времени СенъКлеръ Девилля явленія диссоціаціи разсматривались и объяснялись аналогично явленіямъ испаренія. Теперь же Вантъ-Гоффъ доказалъ, что существуютъ также реакціи, которыя можно сравнить съ процессомъ плавленія и у которыхъ опредћленная температура служитъ границей между двумя химически различными состояніями. Эта постоянная температура называется температурой превращенія. Вантъ-Гоффъ доказалъ свою теорію сначала на примћрахъ образованія двойныхъ солей (астраханитъ), на образованіи аллотропическихъ модификацій (сћра) и на расщепленіи рацемическихъ веществъ (амміачно-натріевая соль виноградной кислоты).
Тотъ же вопросъ позже онъ развилъ гораздо подробнће въ извћстной монографіи112): „Uber Bildung und Spaltung von Doppelsalzen”, гдћ онъ излагаетъ теорію вопроса и методы экспериментальнаго опредћленія температуръ превращенія.
Эти изслћдованія нашли очень цћнное примћненіе при объясненіи проиессовъ отложенія солей въ океанахъ113) и пастёровскихъ методовъ расщепленія рацемическихъ соединеній.
Это вводитъ насъ непосредственно въ область стереохиміи, о возникновеніи которой мы, впрочемъ, уже говорили въ 13-ой лекціи (см. стр. 252). Но въ послћднее время стереохимія пріобрћла такое значеніе, что я долженъ ея коснуться здћсь еще разъ.
Я уже раньше указалъ, что не всћ соединенія съ асиметрическимъ атомомъ углерода оптически активны. Удалось, однако, показать, что подобные факты представляютъ лишь кажущіяся исключенія, такъ какъ для очень многихъ случаевъ было доказано, что подобныя соединенія либо „рацемичны”, т.-е. подобно виноградной кислотћ могутъ быть расщеплены на энантіоморфныя составныя части, {331} либо же представляютъ собой смћсь такихъ частей, относящихся одна къ другой, какъ предметъ къ своему зеркальному изображенію, либо, наконецъ, являются мезосоединеніями, т.-е. обладаютъ свойствами мезовинной кислоты; послћднее, впрочемъ, возможно только у соединеній съ симметричной формулой строенія.
Теорія асиметрическаго атома углерода была провћрена сперва только на отдћльныхъ случаяхъ, между прочимъ черезъ расщепленіе спиртовъ грибками (Лебель114) и черезъ расщепленіе синтетическаго коніина115); послћднее замћчательно тћмъ, что здћсь впервые было получено активное основаніе. Систематической же провћркой теоріи въ большомъ масштабћ явились произведенные Фишеромъ знаменитые синтезы группы углеводовъ116).
Теорія преодолћла этотъ experimentum cruris, и Фишеръ установилъ даже конфигураціи отдћльныхъ гексозъ117), не натолкнувшись на противорћчія. Это прямо поразительно, особенно если принять во вниманіе новыя изслћдованія Вальдена118), изъ которыхъ видно, что съ помощью простыхъ химическихъ реакцій можно при обыкновенной температурћ переходить отъ активнаго вещества къ его антиподу.
Примћненіе теоріи асиметрическаго углероднаго атома къ молекуламъ съ двойной углеродной связью, которое показалъ уже Вантъ-Гоффъ, встрћтило въ свое время мало вниманія, но затћмъ было энергично выдвинуто Вислиценусомъ119), который своими прежними обширными изслћдованіями относительно молочной кислоты120) далъ сильный толчокъ къ развитію стереохимическихъ воззрћній.
Работы Вислиценуса и его учениковъ121) доставили, во всякомъ случаћ, весьма цћнныя данныя для объясненія этихъ замћчательныхъ случаевъ изомеріи, надъ которыми со времени открытія {332} фумаровой122) и малеиновой123) кислотъ тщетно трудились очень многіе химики и даже самъ Кекуле124). Все-таки въ этой области остается много необъяснимыхъ противорћчій, на что, именно, и указывали Михаэль125) и Аншютцъ126). Но, съ другой стороны, надо сказать, что благодаря теоріи Вантъ-Гоффа оказалось возможнымъ весьма удовлетворительно объяснить продукты, получаемые при окисленіи фумаровой и малеиновой кислотъ127).
Весьма цћнны и интересны примћненія ученія объ асиметрическомъ атомћ углерода къ циклическимъ соединеніямъ; основа для этихъ приложеній также была развита Вантъ-Гоффомъ128), но значеніе ихъ было окончательно признано лишь послћ того, какъ Байеръ опубликовалъ свои обширныя изслћдованія относительно гидроароматическихъ соединеній, именно гидрофталевыхъ кислотъ129).
Хотя Байеромъ при этихъ работахъ руководило желаніе найти слабыя мћста теоріи и даже измћнить ее, однако, результаты его работъ привели лишь къ укрћпленію теоріи. Байеръ, кромћ того, установилъ при этомъ такъ называемую теорію напряженія130), которая успћла уже оказаться полезной во многихъ случаяхъ.
Нужно, вообще, замћтить, что грандіозные успћхи теоріи асиметрическаго углероднаго атома выззали стремленіе все шире и шире использовать стереохимическія воззрћнія. Сюда относятся многочисленныя работы, посвященныя изслћдованію замедленія нћкоторыхъ реакцій и объясняющія его пространственнымъ располо женіемъ элементовъ или группъ131); наиболће извћстны изслћдованія В. Мейера132) объ этерификаціи. Далће, сюда же относится ученіе объ асиметрическомъ атомћ азота.
Въ этомъ направленіи фундаментальное значеніе имћли работы Ганча и Вернера133), которымъ удалось объяснить случаи изомеріи {333} оксимовъ, тогда уже извћстные. Впослћдствіи Ганчъ развилъ эти воззрћнія и съ ихъ помощью объяснилъ изомерію гидразоновъ134) и діазосоединеній135). Этими изслћдованіями была доказана только геометрическая изомерія азотъсодержащихъ органическихъ соединеній. Что асиметрическій азотъ также можетъ породить оптическую дћятельность или вліять на нее, пытались доказать Лебель136) и Ладенбургъ137). Хотя ихъ изслћдованія подвергались нападкамь138), тћмъ не менће оба они доказали правильность полученныхъ ими результатовъ139). Позже Попъ получилъ оптически дћятельныя соединенія сћры140) и олова141).
Явленіе рацемичности возбуждало весьма много споровъ. Пониманіе ея стало возможнымъ лишь благодаря введенію понятія о температурћ превращенія (см. выше) и выясненію аналогіи между рацемическими веществами и двойными солями. Важнћйшій методъ расщепленія рацематовъ, а именно съ помощью оптически дћятельныхъ веществъ, все-таки оставался загадкой до тћхъ поръ, пока отрицали возможность существованія частично рацемическихъ соединеній142). Ho всћ затрудненія были устранены, послћ того какъ Ладенбургъ показалъ, что такія соединенія несомнћнно существуютъ143), и послћ того какъ для этихъ соединеній было доказано существованіе температуры превращенія144).
Можно считать рћшеннымъ также и другой вопросъ, возбуждавшій много споровъ, а именно, какъ отличить настоящее рацемическое вещество (химическое соединеніе) отъ смћси активныхъ компонентовъ145). {334}
Несомнћнно, что важнћйшее изъ всего сдћланнаго въ органической химіи за послћднія два десятилћтія, это — установленіе и разработка стереохиміи (это названіе было введено В. Мейеромъ146). Стереохимія имћла въ этотъ періодъ времени такое же значеніе, какъ разработка теоріи ароматическихъ соединеній въ предыдущее двадцатилћтіе. Но кромћ этого слћдуетъ отмћтить также и другія цћнныя изслћдованія въ области органической химіи.
Весьма общее значеніе имћетъ новое понятіе тавтомеріи или десмотропіи. Это понятіе было установлено Лааромъ147) въ 1885 г. на основаніи нћкоторыхъ наблюденій и замћчаній Цинке148). По Лаару тавтомернымъ называется такое соединеніе, для котораго можно принять двћ или нћсколько структурныхъ формулъ, смотря по его превращеніямъ. Весьма извћстнымъ примћромъ такихъ соединеній можетъ служить ацетоуксусный эфиръ, который даетъ реакціи to no кетонной формулћ СН3СОСН2СООС2Н5, то по энольной СН3С(ОН): СНСООС2Н5. Относительно подобныхъ соединеній, извћстныхъ въ весьма большомъ числћ, имћются многочисленныя изслћдованія. Изъ нихъ наиболће извћстны работы В. Вислиценуса149), Клайзена149a) и Кнорра149b). Въ настоящее время существуетъ еще большое разногласіе во мнћніяхъ относительно слћдующихъ вопросовъ: слћдуетъ ли считать десмотропныя соединенія смћсью двухъ (или нћсколькихъ) веществъ (Лааръ), или же изомерныя формы непрерывно переходятъ одна въ другую (посредствомъ колебательныхъ движеній по Кекуле, или посредствомъ перемћщеиія связей по Кнорру149c), и наконецъ, не является ли устойчивой при опредћленныхъ условіяхъ одна форма, а при другихъ другая?
О почти законченномъ систематическомъ и теоретическомъ изслћдованіи группы углеводовъ мы уже упоминали (см. стр. 331). Группа мочевой кислоты, которая такъ долго не поддавалась выясненію и синтезу, въ настоящее время совершенно выяснена150), главнымъ образомъ, благодаря синтетическимъ изслћдованіямъ Э. Фишера151). {335}
О гидроароматическихъ соединеніяхъ также была уже рћчь выше (стр. 332), но о терпенахъ мы еще не упоминали. Прежде они составляли одну изъ наиболће запутанныхъ областей органической химіи. Теперь же ихъ систематика установлена, благодаря обширнымъ и тщательнымъ работамъ Валлаха152). Повидимому, удалось также выяснить и строеніе этихъ соединеній, благодаря работамъ Валлаха153), Байера154), Вагнера155), Тимана и Землера156).
Совсћмъ недавно произведены нћкоторые синтезы соединеній этого рода, главнымъ образомъ, Перкиномъ младшимъ157), Землеромъ158) и Валлахомъ159). Наконецъ, Галлеру160) и Компа161) удалось синтезировать камфору, послћ того именно, какъ Бредтъ162) выяснилъ ея строеніе.
Важное значеніе имћетъ также открытіе іодосоединеній, іодозосоединеній и іодоніевыхъ соединеній, которымъ мы обязаны Вилыеродту163) и В. Мейеру164). Это открытіе пролило новый свћтъ на природу іода. Для медицины имћло большое значеніе открытіе антипирина (Кнорръ165); одновременно благодаря этому была выяснена также и группа пиразола166). Въ настоящее время среди лекарственныхъ средствъ большую роль играетъ также пирамидонъ (диметиламидоантипиринъ167).
Въ техническомъ отношеніи важное значеніе имћетъ полученіе такъ называемыхъ субстантивныхъ азокрасокъ168). Еще ббльшее значеніе имћетъ амміачная (сольвейевская) сода и синтетическое индиго, получаемое по способу, выработанному Гейманомъ169).Этотъ методъ представляетъ, быть можетъ, наиболће поразительный примћръ того, {336} какую выдающуюся пользу можетъ оказать тћсное единеніе науки и техники. Подробная исторія этого вопроса, которая сдћлалась доступной для насъ благодаря изложенію Брунка170), представляетъ много интереснаго и поучительнаго. При этомъ нужно замћтить особенно, что полученіе синтетическаго индиго повлекло за собой новый способъ полученія сћрной кислоты171), который, можетъ быть, вытћснитъ испытанный старый методъ. Благодаря тому, что при полученіи необходимой для индиго антраниловой кислоты и при соединеніи сћрнистаго ангидрида съ кислородомъ приходится прибћгать къ помощи каталитическихъ процессовъ, вниманіе химиковъ вновь обратилось къ этому вопросу, который уже и раньше составлялъ предметъ многихъ изслћдованій172) (ср. стр. 193 и ниже, въ 17-ой лекціи).
Громадные успћхи достигнуты также въ дћлћ приготовленія искусственныхъ ароматическихъ продуктовъ: ванилинъ синтетически полученъ уже давно; кромћ того полученъ пиперональ173) (геліотропинъ), особенно же интересенъ синтезъ іонона (Тиманнъ и Крюгеръ174).
Я не могу закончить этого обзора послћдней стадіи развитія нашей науки въ минувшемъ столћтіи безъ того, чтобы не указать на весьма цћнныя, хотя и незаконченныя раооты, предпринятыя подъ руководствомъ Фриделя для установленія новой номенклатуры въ органической химіи175). Хотя пока еще не удалось распространить систему на циклическія соединенія, однако выработанные принципы содержатъ очень много хорошаго и весьма цћннаго.
| {337} |
Изслћдованіе радія. — Новое понятіе о валентности. — Вычисленіе химическихъ равновћсій на основаніи термическихъ измћреній. — Твердые растворы. — Аллотропія. — Методы расщепленія рацемическихъ соединеній. — Асиметрическій азотъ. — Синтезы и синтетическіе методы. — Недокиси и перекиси. — Изслћдованіе бћлковъ. — Катализъ. — Химія коллоидовъ.
Сегодня я попытаюсь изложить вамъ важнћйшіе успћхи, достигнутые химіей въ настоящемъ столћтіи, причемъ я, разумћется, долженъ буду ограничиться лишь самымъ существеннымъ.
Безъ сомнћнія изученіе радія составляетъ важнћйшее, что намъ принесли послћдніе годы; относящіяся сюда открытія приковали къ себћ вниманіе самыхъ широкихъ круговъ, и, по мнћнію нћкоторыхъ изслћдователей, они должны расшатать основы нашей науки.
Даже самая исторія открытія радія представляетъ большой интересъ. Беккерель1), заинтересовавшись рентгеновскими лучами и ихъ поразительными свойствами, нашелъ, что урановыя соли дћйствуютъ на защищенную отъ свћта фотографическую пластинку. Дальнћйшія изслћдованія опровергли предполагавшуюся вначалћ зависимость этихъ дћйствій отъ предварительнаго освћщенія урановыхъ соединеній. Напротивъ, дћйствія ихъ оказались совершенно постоянными, даже когда соли находились въ темнотћ въ продолженіе нћсколькихъ лћтъ. Далће обнаружилось, что эти урановые или беккерелевскіе лучи обладаютъ свойствами электризовать, т.-е. іонизировать, воздухъ, и на этомъ свойствћ былъ основанъ методъ измћренія интенсивности лучей2). {338}
Послћ этого г-жа Склодовская-Кюри съ помощью особаго аппарата начала изслћдовать различныя вещества въ отношеніи ихъ „радіоактивности”3); такъ она назвала лучеиспускательную способность урановыхъ соединеній. При этомъ обнаружилось, что кромћ урана и почти всћхъ его соединеній этимъ же свойствомъ обладаютъ еще только вещества, содержащія торій4). Далће г-жа Кюри нашла, что смоляная руда приблизительно въ 4 раза активнће металлическаго урана. Отсюда она сдћлала выводъ, что причиной активности должна быть какая-то примћсь5), каковую она и рћшила отдћлить. Это удалось ей послћ переработки многихъ тоннъ руды и при участіи П. Кюри и Бемона6). Найденное вещество Кюри отнесла къ числу элементовъ и назвала радіемъ. Передъ этимъ она совмћстно съ П. Кюри изолировала полоній7), обладающій радіоактивными свойствами подобно актинію8), полученному изъ смоляной руды Дебьерномъ9).
Въ пользу элементарной природы радія говоритъ, главнымъ образомъ, большое сходство его галоидныхъ соединеній и сульфата съ соотвћтствующими соединеніями барія, а также постоянство его спектральныхъ линій. Исходя отсюда, гжа Кюри опредћлила атомный вћсъ радія изъ его бромистой соли и получила число 225, считая молекулу бромистаго радія аналогичной BaBr210). Самъ же гипотетическій элементъ, вслћдствіе недостатка матеріала, не могъ еще быть изолированъ*).
Самымъ замћчательнымъ и наиболће важнымъ свойствомъ солей радія является постоянное и самостоятельное выдћленіе теплоты, которое было впервые измћрено Рётгерфордомъ и МакъКлонгомъ11). Позднћйшими измћреніями Кюри и Лабарда12) было установлено, что 1 граммъ Ra въ теченіе часа выдћляетъ около 100 {339} граммъ-калорій; радій оказывается, такимъ образомъ, носителемъ колоссальнаго количества энергіи. Весьма замћчательно, что радій излучаетъ совершенно различнаго рода лучи, такъ называемые α, β и γ-лучи13); два первые рода лучей были открыты Рётгерфордомъ14), а γ-лучи — Вилльяромъ15). Лучи α, на долю которыхъ приходится наибольшая часть всей излучаемой энергіи, имћютъ свойства каналовыхъ лучей, т.-е. представляютъ собою положительно заряженныя частицы; они отклоняются магнитомъ, іонизуютъ воздухъ, обладаютъ лишь незначительною проницательной способностью и т. д.; β-лучи обнаруживаютъ свойства катодныхъ лучей, т.-е. отрицательно заряженныхъ частицъ; они также отклоняются магнитомъ, но въ противоположномъ направленіи, обладаютъ сильной проницательной способностью и сильнымъ фотохимическимъ дћйствіемъ и т. д. Что касается γ-лучей, то они имћютъ свойства рентгеновскихъ лучей и, слћдовательно, не отклоняются магнитомъ.
Новую эпоху въ изслћдованіи радія составило открытіе эманацій, выдћляемыхъ радіоактивными тћлами. Онћ дали ключъ къ пониманію наблюдавшихся супругами П. и С. Кюри явленій такъ называемой наведенной радіоактивности16). Этого рода радіоактивность, по объясненію Рётгерфорда, вызывается эманаціей17). Гизель нашелъ, что эманація есть газъ18). Это было подтверждено Рётгерфордомъ и Содди, сгустившими эманацію съ помощью жидкаго воздуха, и Рамзаемъ и Содди, доказавшими, что она подчиняется законамъ газовъ20). Рамзай и Содди показали также, что эманація спустя нћкоторое время исчезаетъ, и тогда становится видимымъ спектръ гелія21). Еще раньше, впрочемъ, Рётгерфордъ и Содди высказывали мнћніе, что при распадћ эманаціи радія долженъ образоваться гелій19). {340}
Съ радіемъ аналогичны по своимъ свойствамъ уранъ и торій, элементы съ наибольшимъ атомнымъ вћсомъ. Относительно радіоактивности торія и его эманаціи произведено большое число изслћдованій22).
Рётгерфордъ и Содди23) предположили, что всћ радіоактивные „элементы” суть вещества, находящіяся въ процессћ превращенія, такъ какъ возникающая сперва эманація постепенно, а иногда очень быстро, теряетъ свою активность и превращается въ эманаціи другого рода, также способныя къ превращенію, пока, наконець, не образуется вещество, которое уже не радіоактивно и не способно къ превращенію, напримћръ, гелій. Атомъ, претерпћвающій подобныя превращенія, они назвали метаболомъ (metabolon). Они опредћлили скорость превращенія, что весьма важно, и установили для нея формулу24):
|
Jt J0 |
= e–λt |
здћсь Jt и J0 обозначаютъ напряженность излученія для опредћленнаго времени t и для начальнаго состоянія, а λ есть константа радіо активности, имћющая для опредћленнаго радіоактивнаго вещества весьма постоянное значеніе; для всякаго другого радіоактивнаго вещества она имћетъ другое постоянное значеніе, которое можетъ быть опредћлено съ необыкновенной точностыо, и для одного и того же вещества всегда оказывается неизмћннымъ. 1/λ это — такъ называемая средняя долговћчность жизни соотвћтствующаго вещества. Опредћливъ эту величину, можно и радіоактивное вещество опредћлить съ несравненно большей увћренностью, чћмъ при помощи спектральнаго анализа.
На основћ этихъ воззрћній и фактовъ Рётгерфордъ и Содди построили свою теорію распада, согласно которой атомы элементовъ суть метаболы; этимъ и объясняется, почему они выдћляютъ тепло25). Хотя эту гипотезу они вначалћ установили только дпя радіоактивныхъ веществъ, но, повидимому, они полагаютъ, что {341} она должна быть распространена и на всћ элементы, такъ какъ, въ противномъ случаћ, они не могли бы говорить объ „эволюціи матеріи, обнаруженной благодаря явленіямъ радіоакти вности”26).
Строгая объективность обязываетъ историка при изложеніи такихъ фактовъ и взглядовъ воздерживаться отъ своего собственнаго сужденія.
Впрочемъ, изученіе радія привлекло сравнительно мало изслћдователей, несмотря на прекрасные и поразительные опыты и на то универсальное значеніе, которое они пріобрћли какъ въ теоретическомъ, такъ и въ практическомъ отношеніи. Практическая сторона привлекла особенное вниманіе, послћ того какъ Эльстеръ и Гейтель27), а также другіе28) доказали, что радій весьма распространенъ въ природћ, и послћ того какъ выяснилось его весьма сильнсе дћйствіе на кожу29), благодаря чему радій очень скоро нашелъ терапевтическое примЬненіе.
Большинство же химиковъ неуклонно продолжаетъ разрабатывать существующую систему. Прежде всего упомянемъ о попыткахь расширить или измћнить понятіе о валентности, главнымъ образомъ съ цћлью создать для молекулярныхъ соединеній устойчивое положеніе въ системћ (см. стр. 289). Сомнительно,однако, чтобы пути, по которымъ шли до сихъ поръ, способны были привести къ окончательному рћшенію. Вернеръ30) отличаетъ главныя и дополнительныя сродства. „Главныя сродства соединяютъ между собой простые или сложные радикалы, которые могутъ играть роль самостоятельныхъ іоновъ или у которыхъ химическая связывающая способность эквивалентна той же способности іонизированныхъ радикаловь. Дополнительные сродства представляютъ собою силы, {342} связывающія между собой радикалы, которые могутъ дћйствовать, какъ самостоятельные одновалентные іоны, и съ послћдними не эквивалентны”31). Предполагается, что дополнительныя сродства въ состояніи связывать H2O, NH3, KCl и др.
Согласно этому можетъ показаться, что Вернеръ подъ главнымъ сродствомъ понимаетъ приблизительно то же, что до сихь поръ обозначалось словомъ валентность. Однако это не совсћмъ такъ, такъ какъ онъ прямо оспариваетъ положеніе, что сродство представляетъ отдћльную направленную силу32). Но это колеблетъ современную теоретическую основу всей стереохиміи, согласно которой атомъ углерода обладаетъ четырьмя силами, направленными къ вершинамъ тетраэдра33), въ центрћ котораго находится углеродный атомъ. Новыя молекулы прикрћпляются съ помощью дополнительныхъ сродствъ къ молекулћ, образованной силами главныхъ сродствъ. Такъ, напримћръ, въ нашатырћ соляная кислота связана съ трехвалентнымъ азотомъ съ помощью дополнительныхъ сродствъ азота и водорода. Вернеръ пишетъ34):
H3N.....HCl
и подробнымъ образомъ старается противопоставить это воззрћніе прежнимъ взглядамъ, хотя трудно не замћтить большой аналогіи между ними.
Сумма главныхъ и дополнительныхъ сродствъ, по Вернеру, вообще выражается числомъ 6, т. е. для большинства центральныхъ атомовъ она имћетъ одну и ту же величину, и почти не зависитъ отъ природы связанныхъ съ ними радикаловъ. Это число называется координаціоннымъ числомъ и выражаетъ количество атомовъ или группъ, связанныхъ въ первой сферћ съ однимъ центральнымъ атомомъ. Эти атомы и группы неспособны къ іонизаціи, въ противоположность атомамъ или радикаламъ, находящимся во второй сферћ35) Въ пользу этого взгляда приводятся различные примћры:
[PtCl6]K2, [SiFl6]K2, [Fe(CN)6]K4
[Fe(CN)6]K3, [AlFl6]Na3, Fe |
[ |
|
] |
Na2 |
[Cr(SCN)6]R3, |
[ |
Cr |
|
] |
R2 и т. д. |
| {343} |
Съ этой точки зрћнія легко объясняются комплексныя соли. Особенныя услуги она оказываетъ для выяснешя комплексныхъ амміачнокобальтовыхъ и амміачноплатиновыхъ соединеній и ихъ молекулярной электропроводности. Примћромъ можетъ служить слћдующая діаграмма:
 |
Числа показываютъ молекулярную электропроводность. |
іонизируемые радикалы находятся не въ скобкахъ, а только внћ ихъ. Отсюда становится понятнымъ, что въ лутеохлоридћ, или хлористомъ гексамміакатћ кобальта, способны къ замћщенію три атома хлора, въ пурпуреохлоридћ, или хлоропентамміакатћ кобальта, 2 атома хлора, въ празеохлоридћ, или хлористомъ дихлоротетрамміакатћ кобальта, 1 атомъ хлора, а въ соляхъ триамміакатовъ ко бальта вовсе невозможно произвести двойное замћщеніе. Конечно, при такой точкћ зрћнія предполагается, что Сl (или NO2) и NH3 могутъ эквивалентно замћщать другъ друга36).
Совершенно иначе разсматриваетъ явленіе Абель37), примыкающій довольно близко къ взглядамъ Берцеліуса38) и Броди39). Онъ находитъ, что при соединеніи двухъ атомовъ всегда происходитъ выравниваніе противоположныхъ электрическихъ силъ. Чтобы объяснить это, онъ предполагаетъ, что въ каждомъ атомћ имћются положительныя и отрицательныя валентности, сумма которыхъ всегда равна 8, т.-е. равна числу группъ въ системћ Менделћева. Абель различаетъ нормальныя валентности и контръвалентности. Число тћхъ {344} и другихъ обусловливается положеніемъ въ періодической системћ и выясняется изъ слћдующей схемы:
Группы |
|||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Нормальныя валентности |
+1 |
+2 |
+3 |
4 |
–3 |
–2 |
–1 |
Контръ-валентности . . |
(–7) |
(–6) |
(–5) |
+5 |
+6 |
+7 |
|
He требуется непремћнно насыщенія максимальной валентности, a контръвалентности рћдко бываютъ вполнћ насыщенными. Отрицательное электросродство40), соотвћтственно свойствамъ отрицательнаго электрона, значительно слабће положительнаго. Это имћетъ особенное значеніе для контръвалентностей.
Изложенная гипотеза должна, по мићнію ея приверженцевъ, объяснить существованіе молекулярныхъ соединеній; они стараются доказать, что съ одинаковыми или различными молекулами соединяются лишь тћ вещества, считающіяся, вообще, насыщенными соединеніями, которыя обладаютъ еще и контръвалентностями для дальнћйшихъ связей.
Сомнительно, чтобы такое воззрћніе можно было распространить на всю область химіи, не встрћчая при этомъ неодолимыхъ препятствій. Такъ, напримћръ, трудно понять, почему водородъ и галоиды образуютъ только двухатомныя молекулы. Далће, такія соединенія, какъ СuСl2 и AuCl3 представляются чрезвычайно странными, такъ какъ Cu и Au принадлежатъ къ первой группћ и обладаютъ только одной положительной нормальной валентностью. Дуалистическое пониманіе кислотъ и солей, разсматриваемыхъ, какъ соединенія ангидридовъ съ водой или съ окисью металла, повидимому, менће соотвћтствуетъ фактамъ, чћмъ обычное представленіе, что кислоты содержатъ гидроксильныя группы, водородъ которыхъ способенъ замћщаться
Далће встрћчаются затрудненія при пониманіи соединеній, образуемыхъ элементами одной и той же группы, напримћръ, сћрой и кислородомъ, такъ какъ въ этомъ случаћ нормальныя валентности одного изъ элементовъ должны {345} оставаться несвязанными, коль скоро онћ не насыщаютъ контръвалентностей другого элемента.
Обћ теоріи имћютъ еще и тотъ недостатокъ, что ихъ еще не пробовали примћнить къ органическимъ соединеніямъ. Поэтому сомнительно, удастся ли съ помощью такихъ системъ построить единообразное ученіе о структурћ, которое соотвћтствовало бы фактамъ въ неменьшей степени, чћмъ современное ученіе о валентности.
Что касается теоріи парціальныхъ валентностей Тиле41), неоднократно упоминавшейся съ хорошей стороны, то здћсь мы должны ограничиться лишь простымъ учазаніемъ на нее.
Въ области химической термодинамики большой шагъ впередъ представляетъ работа Нернста, имћющая цћлью вычислить химическія равновћсія посредствомъ термическихъ измћреній42). Рћшеніе этой задачи становится возможнымъ при предположеніи, что свободная и полная энергія химическихъ реакцій между твердыми и жидкими тћлами при абсолютномъ нулћ и вблизи его равны между собой. Нернсту удалось найти различныя приложенія для своихъ теоретическихъ выводовъ и доказать ихъ близкое согласіе съ наблюденіемъ. Методъ, которому слћдовалъ Нернстъ, въ будущемъ можетъ пріобрћсти большое значеніе.
Существенное значеніе имћетъ, далће, новое понятіе о твердыхъ растворахъ, которымъ мы обязаны Вантъ-Гоффу43). Подъ твердыми растворами онъ понимаетъ однородныя твердыя смћси, составъ которыхъ можетъ непрерывно измћняться въ опредћленныхъ границахъ. Такое пониманіе должно объяснять намъ нћкоторыя аномаліи, обнаруженныя при кріоскопическихъ изслћдованіяхъ. Оказалось, что такъ называемый законъ Рауля (см. стр. 312 и 318) совершенно непримћнимъ также и въ тћхъ случаяхъ, когда вещество — не электролитъ. Вантъ-Гоффъ предполагаетъ, что въ такихъ случаяхъ выдћляется не чистый растворитель, а смћсь его съ веществомъ, находящимся въ растворћ, т.-е. выдћляется „твердый растворъ”. Такого рода аномаліи, по Вантъ-Гоффу, происходятъ въ особенности тогда, когда растворъ и растворитель обладаютъ въ извћстной степени аналогичнымъ строеніемъ; подобныя вещества впослћдствіи получили названіе „изоморфогенныхъ”44). {346}
Твердые растворы подраздћляются на аморфные и кристаллическіе. Примћромъ первыхъ могутъ служить окрашенныя стекла, а изоморфныя смћси являются представителями второй группы растворовъ.
Теорія Вантъ-Гоффа провћрена не только качественно, но и количественно: изъ пониженія точки плавленія вычислили количество раствореннаго вещества, выдћлившагося въ твердомъ растворћ, вычисленное количество сравнили съ имћющимся въ дћйствительности, при чемъ получилось довольно полное согласіе45).
Эта теорія твердыхъ растворовъ получила цћлый рядъ интересныхъ приложеній, изъ которыхъ я хочу указать лишь на одно важнћйшее, именно, на частичное объясненіе продуктовъ, выдћляющихся при техкическомъ полученіи желћза.
Прежде всего изъ обстоятельнаго изслћдованія, которымъ мы обязаны, главнымъ образомъ, Юптнеру, Роозебоому и Лешателье46), выяснилось, что существуютъ по крайней мћрћ 3 или 4 аллотропическихъ видоизмћненія желћза. Изъ нихъ α-желћзо устойчиво при температурћ ниже 760° и можетъ поглощать лишь весьма малое количество углерода, β-желћзо способно къ существованію въ предћлахъ между 760° и 900° и можетъ поглощать лишь 0,15% углерода; γ-желћзо устойчиво въ предћлахъ отъ 900° до точки плавленія (1550°) и поглощаетъ въ этомъ состояніи до 2% углерода. Расплавленное желћзо можетъ содержать 4% углерода и больше.
Цементитъ представляетъ собою углеродистое соединеніе желћза съ 6,6% углерода. Его формула Fe3C. Чугунъ слћдуетъ разсматривать, какъ твердый растворъ феррита (α- или β-желћза) съ цементитомъ. Мартензитъ также, вћроятно, представляетъ соединеніе карбиднаго желћза съ 0,9% углерода и, быть можетъ, твердый растворъ желћза въ цемектитћ (Рузебумъ называетъ его однородными смћшанными кристаллами). Онъ образуетъ главную составную часть стали, которая, однако, большею частью содержитъ еще растворекный углеродъ. При закалкћ стали углеродъ остается въ растворћ и {347} образуется мартензитъ, т.-е. твердая сталь, тогда какъ при медленномъ охлажденіи происходитъ частичное выдћленіе углерода.
Такія же явленія, какъ у желћза, наблюдаются и у другихъ элементовъ, но въ нихъ все это происходитъ гораздо проще, такъ какъ у нихъ наблюдаются только явленія аллотропіи, а не твердыхъ растворовъ.
Такъ, напримћръ, изслћдованіями Когена47) доказано, что олово существуетъ въ видћ трехъ аллотропическихъ формъ: ниже 20% устойчиво сћрое олово, отъ 20° до 170° — тетрагональное олово и отъ 170° до 232° (точка плавленія олова) — ромбическое. Благодаря работћ Когена найдено было, наконецъ, объясненіе болћзни олова, о которой зналъ, какъ говорятъ, уже Аристотель: именно, при низкой температурћ бћлое (тетрагональное) олово переходитъ въ сћрое.
Марку удалось доказать, что такъ называемый кристаллическій или металлическій селенъ встрћчается въ двухъ аллотропическихъ измћненіяхъ48), изъ которыхъ одно оказывается совершеннымъ непроводникомъ, а другое есть очень хорошій проводникъ съ отрицательнымъ температурнымъ коэффиціентомъ. Послћдняя модификація отличается свћточувствительностью. Также и жидкая сћра должна существовать въ двухъ формахъ, изъ которыхъ одна, легкоплавкая, устойчива до 160°, другая же форма очень вязкая49).
Слћдуетъ упомянуть о работћ Шенка50), который пытается рћшить вопросъ: слћдуетъ ли считать отношеніе бћлаго фосфора къ красному полимеріей или же полиморфизмомъ? Этотъ вопросъ, по его мнћнію, рћшается черезъ опредћленіе скорости реакціи, т. е. нужно установить, является ли данное превращеніе реакціей мономолекулярной или бимолекулярной; въ качествћ растворителя для бћлаго фосфора Шенкъ употребляетъ трехбромистый фосфоръ и считаетъ сначала реакцію бимолекулярной, но при точномъ изслћдованіи находитъ, что она мономолекулярна51). Тћмъ не менће онъ разсматриваетъ полученный продуктъ, а именно яркокрасный фосфоръ, какъ полимеръ бћлаго фосфора, и доказываетъ, что первый идентиченъ съ обыкновенной красной модификаціей, но является сильно {348} измельченнымь и содержитъ абсорбированный бромистый фосфоръ. Яркокрасное видоизмћненіе фосфора, освобожденное отъ бромистаго фосфора, кажется болће пригоднымъ для техническихъ цћлей, чћмъ обыкновенный красный фосфоръ.
Отъ аллотропіи мы перейдемъ теперь къ изомеріи, а именно къ стереомеріи и стереохиміи.
Уже раньше (стр. 251 и 330) было сказано, что съ того времени, какъ Пастеръ открылъ три способа расщепленія рацемическихъ соединеній, не найдено было новаго способа, хотя къ этой цћли были направлены усилія многихъ химиковъ. Теперь, однако, можно указать на нћкоторые успћхи, достигнутые въ этомъ отношеніи.
Прежде всего отмћтимъ идею Э. Фишера, теперь извћстную подъ именемъ асиметрическаго синтеза. Она можетъ быть изложена слћдующимъ образомъ52): если къ одной оптически дћятельной молекулћ, содержащей одинъ или нћсколько асимметрическихъ атомовъ углерода, присоединигь одну неактивную группу, но такимъ образомъ, чтобы образовался новый асимметрическій атомъ углерода, то можно предвидћть, что изъ возможныхъ конфигурацій условія будутъ особенно благопріятны для одной; если теперь обратно отщепить введенную группу, то получится активная молекула. Неоднократно пытались примћнить эту мысль къ полученію оптически дћятельныхъ соединеній53), но, несмотря на всћ усилія какъ самого Э. Фишера, такъ и другихъ54), до сихъ поръ не удалось получить удачнаго результата, если не считать таковымъ активной валеріановой кислоты, полученной Марквальдомъ изъ метилэтилмалоновой кислоты съ помощыо бруцина55). Повидимому, однако, правильнће принять, что это послћднее расщепленіе происходитъ согласно второму методу Пастера56).
Зато Марквальду удалось57) осуществить другую идею, а именно, использовать различіе въ скоростяхъ этерификаціи двухъ энантіоморфныхъ кислотъ по отношенію къ одному оптически дћятельному спирту. Такимъ образомъ ему удалось, нагрћвая ментолъ съ правой миндальной кислотой, получить изъ не этерифицированной части лћвую миндальную кислоту. {349}
Предложенный Эрленмейеромъ младшимъ58), а также Нейбергомъ59) методъ расщепленія альдегидовъ и кетоновъ на оптическіе изомеры съ помощью оптически дћятельныхъ основаній или гидразиновъ такъ же, какъ и обратный методъ, по существу не могутъ считаться новыми, но являются лишь обобщеніемъ второго метода Пастера. На это указываютъ, впрочемъ, и сами авторы.
Къ этимъ изслћдованіямъ примыкаютъ новыя наблюденія относительно стереоизомеріи азотистыхъ соедикеній. Благодаря опытамъ Ладенбурга60) было твердо установлено существованіе трехатомнаго асимметрическаго азота, въ чемъ раньше сомнћвались. Кромћ того, Попъ и Пичей61), Джонсъ62) и Ведекиндъ63) получили новыя активныя соединенія съ пятиатомнымъ азотомъ.
Ладенбургъ доказалъ, что стильбазолинъ C5H10NCH2.СН2C6Н5 — продуктъ возстановленія стильбазола, открытаго Бауратомъ64), дћйствіемъ винной кислоты расщепляется на два энантіоморфныхъ, оптически активныхъ вещества, и что легче изолируемый лћвовращающій продуктъ расщепленія при нагрћваніи можетъ перейти въ соединеніе, слабће вращающее влћво; самостоятельное существованіе этого второго продукта не подлежитъ сомнћнію, и такъ какъ онъ содержитъ лишь одинъ асимметрическій атомъ углерода, то указанную изомерію возможно объяснить только асимметрическимъ азотомъ. Далће было доказано, что при расщепленіи синтетически полученнаго недћятельнаго коніина, образуется основаніе, которое обладаетъ значительно большею вращательною способностью, чћмъ самый чистый естественкый коніинъ и переходитъ въ него лишь при нагрћваніи до 300°. Послћдній опытъ настолько доказателенъ, что врядъ ли возможно еще какое-либо возраженіе. Откосительно опытовъ Ведекинда63) можно упомянуть лишь слћдующее. Онъ думалъ, что ему удалось получить два стереоизомерныя дћятельныя амміачныя соединенія, а именно, два бензилфенилаллилметилъ-аммоній-іодида, но Джонсъ нашелъ65), что это предположеніе ошибочно, и доказалъ, что такъ наываемое β-соединеніе имћетъ совершенно другой {350} составъ, а именно представляетъ собой бензилфенилдиметиламмоній-іодидъ. Попу и Пичею удалось съ помощью камфосульфановой кислоты расщепить полученный Ведекиндомъ метилфенилбензилаллилъ-аммоній-іодидъ на два оптическихъ изомера61), что могли подтвердить самъ Ведекиндъ63) и Джонсъ64). Замћчательно, однако, что нћкоторыя изъ этихъ соединеній быстро теряютъ свою вращательную способность и подвергаются авторацемизаціи, другія же соединенія этого не обнаруживаютъ66). Авторацемизація совершенно несвойственна оптически дћятельнымъ соединеніямъ, содержащимъ трехвалентный асимметрическій азотъ, но слћдуетъ отмћтить, что неизвћстно ни одного примћра, чтобы асимметрическій трехатомный азотъ обусловливалъ активность соединенія. Онъ вліяетъ только на активность, вызываемую асиметрическимъ углеродомъ67).
Здћсь я долженъ указать еще другіе успћхи органической химіи. Въ добавленіе къ сказанному на стр. 273, отмћчу еще новыя общія реакціи, имћющія весьма большое значеніе. На первомъ планћ стоитъ методъ Гриньяра, имћвшій безпримћрный успћхъ.
Барбье первый примћнилъ для перехода къ высшему гомологу магній и іодистый метилъ вмћсто обычнаго цинка, и такимъ способомъ превратилъ метилгептенолъ въ диметилгептенолъ68). Гриньяръ всесторонне изучилъ эту реакцію и доказалъ69), что магній можно примћнить вообще, чтобы ввести въ соединенія алкилы или другія группы. Прежде всего ему удалось доказать, что магній, въ особенности въ присутствіи эфира, непосредственно образуетъ соединенія, содержащія большею частью еще эфиръ*). Послћднія соединяются со многими тћлами, напримћръ съ альдегидами и кетонами, а изъ полученныхъ продуктовъ реакціи путемъ гидролитическаго расщепленія образуются вторичные или третичные спирты. Но этимъ же методомъ, вызвавшимъ уже значительное число изслћдованій, можно лолучить также углеводороды, первичные спирты, гликоли, кетоноспирты, эфиры, кетоны, альдегиды, кислоты, фенолы и многія другія соединенія. {351}
Здћсь нужно упомянуть о реакціи, которая была открыта нћсколько раньше, но имћетъ значеніе еще и въ настоящее время,— о разложеніи пиперидина и подобныхъ ему основаній посредствомъ исчерпывающаго метилированія, что впервые удалось А. Гофману70). При помощи его метода можно изъ содержащаго азотъ кольца удалить азотъ дћйствіемъ іодистаго метила: азотъ удаляется окончательно въ видћ триметиламина, а углеродный скелетъ кольца получается въ видћ углевода. Этотъ методъ часто примћняется для изслћдованій строенія алкалоидовъ71).
Впрочемъ, Брауну недавно удалось найти гораздо болће короткій способъ для достиженія той же цћли72): онъ примћняетъ пятибромистый фосфоръ и пользуется старыми опытами Валлаха73).
Слћдуетъ упомянуть также о способћ полученія первичныхъ аминовъ, выработанномъ Габріэлемъ74) и неоднократно примћнявшемся имъ самимъ75), его учениками и другими химиками. Этотъ способъ состоитъ въ дћйствіи галоидныхъ производкыхъ на калійфталимидъ и расщепленіи полученныхъ фталевыхъ соединеній кислотами. Такимъ способомъ удалось получить цћлый рядъ аминовъ (и аминокислотъ, ср. стр. 354), которые другимъ способомъ не могли быть получены.
Здћсь нужно также сказать о новомъ методћ гидрогенизаціи, именко, о примћненіи въ качествћ катализатора весьма измельченныхъ металловъ, главнымъ образомъ, никкеля. Эта реакція была открыта Сабатье и Сендеренсомъ и примћнялась уже много разъ съ большимъ успћхомъ76). Съ ея помощью удалось превратить кенасыщенные углеводороды въ насыщенные (главнымъ образомъ ацетиленовыя соединенія въ этановыя), и множество ароматическихъ углеводородовъ въ циклогексанъ и его гомологи. Она дала также возможность получать изъ альдегидовъ и кетоновъ спирты, изъ нитриловъ — амины77) и т. д.
Въ связи съ этимъ способомъ гидрогенизаціи скажемъ также нћсколько словъ относительно полученія водородныхъ соединеній {352} металловъ. Изъ нихъ раньше извћстна была лишь водородистая мћдь (ср. стр. 186). Въ 1891 году Гюнтцъ78) получилъ соединеніе литія съ водородомъ, а Муассань79) открылъ цћлый рядъ подобныхъ гидрюровъ, главнымъ образомъ, водородныя соединекія щелочныхъ и щелочноземельныхъ металловъ, напримћръ КН и СаН2. Мутманнъ и Крафтъ80) вслћдъ за этимъ получили водородистый лантанъ и водородистый церій LаН3 и СеН3. Изъ соединеній этого рода особенкой способностью къ реакціямъ отличаются гидрюры щелочныхъ металловъ. При дћйствіи углекислаго газа они образуютъ соль муравьиной кислоты, а при дћйствіи двуокиси сћры — соль гидросћрнистой кислоты. Водородистый калій, далће, былъ предложенъ для техническаго полученія водорода.
Упомянемъ также о недавко произведенныхъ синтезахъ особенко важныхъ соединеній, а именно, о полкомъ синтезћ никотина, произведенномъ въ 1904 г. Пикте и Крепье81), и Пикте и Рочи82). Этого удалось достигнуть благодаря тому, что Пиннеръ83), еще за 11 лћтъ передъ тћмъ, установилъ правильную структурную формулу никотина. Согласно этой формулћ, никотинъ есть метиловое производное пиридикъпирролидина C5H4N— C4H8N, которое держится углеродными связями, какъ дифенилъ.
Двумя годами раньше удалось произвести полный синтезъ атро пина, благодаря изслћдованіямъ, съ одной стороны, Ладенбурга84), а съ другой — Вилыптедтера85). Формула строенія, которая по ихъ изслћдованіямъ соотвћтствуетъ этому основанію, весьма замћчательна тћмъ, что она представляетъ производное пиперидинъпирролидиноваго ядра, въ которомъ, однако, два общіе атома углерода находятся въ метаположеніи. Аналогичная точка зрћкія принимается, впрочемъ, также и для строенія камфоры86). Изслћдованіе болће сложныхъ алкалоидовъ не пошло еще такъ далеко, но все-таки и тутъ можно отмћтить весьма большіе успћхи. Я считаю возможнымъ утверждать, что мы уже весьма близки къ выясненію {353} строенія хинина87) и морфина88). Совсћмъ недавно удалось, повидимому, выяснить строеніе адреналина или супраренина, соединенія, извлекаемаго изъ надпочечныхъ железъ и имћющаго весьма важныя терапевтическія свойства. Удалось, кромћ того, получить синтетически основаніе, несомнћнно весьма близко стоящее къ этому соединенію89).
Интересно также открытое Дильсомъ и Вольфомъ90) новое соединеніе углерода съ кислородомъ — недокись углерода С3O2. Они получили это соединеніе, дћйствуя при очень низкой температурћ фосфорнымъ ангидридомъ на малоновый эфиръ. Полученное соединеніе имћетъ свойства ангидрида малоновой кислоты, которая изъ него и получается при дћйствіи воды; по своему составу С(СО)2 оно напоминаетъ карбонилъ никкеля91)92).
Въ связи съ этимъ скажемъ объ изслћдованіяхъ надъ перекисями и надкислотами. Нћкоторыя изъ этихъ соединеній извћстны были, конечно, уже давно, но они пріобрћли большое значеніе лишь въ послћднее время.
Изъ надкислотъ ранће всћхъ была извћстна марганцевая кислота; она была получена еще въ 16мъ вћкћ, но ея составъ былъ установленъ Митчерлихомъ только въ 1832 г.94). Въ 1815 г. Стадіонъ открылъ хлорную кислоту, которую подробнће изслћдовали онъ самъ95), Серулласъ96) и особенно Роско97). Ангидридъ надсћрной кислоты впервые получилъ Бертело, дћйствуя тихимъ электрическимъ разрядомъ на смћсь сћрнистаго ангидрида и кислорода98); онъ же имћлъ въ рукахъ также и надсћрную кислоту, хотя и не въ чистомъ видћ. Но въ чистомъ видћ соли ея впервые были получены Маршалемъ99). Броди мы обязаны открытіемъ такого рода {354} надкислотъ99a), которыя теперь можно считать смћсями ангидридовъ кислотъ съ надкислотами. Полученіе кислоты Каро100), образующейся при дћйствіи концентрированной сћрной кислоты на персульфатъ и обладающей весьма энергичнымъ окислительнымъ дћйствіемъ, дало Байеру поводъ ближе заняться изученіемъ надкислотъ101). Ему мы обязаны новой номенклатурой этихъ соединеній; онъ выяснилъ, что всћ онћ могутъ считаться производными перекиси водорода; онъ же приготовилъ нћсколько органическихъ надкислотъ: надбензойную кислоту С6H5СOO2H, мононадфталевую кислоту
С6H4 |
CO2H |
COO2H |
и надоксифталевую кислоту
( |
С6H4 |
CO |
) |
O2 |
CO2H |
смћшанный ангидридъ фталевой и надфталевой кислотъ. Слћдуетъ указать также на перекись ацетона, открытую Вольфенштейномъ, перекись альдегида и перекись діэтила, гидроперекись этила, открытыя Байеромъ и Филлигеромъ101), а также на открытую Меликовымъ и Писаржевскимъ перекись аммонія101a).
Но важнћйшее изъ всего того, что сдћлано за послћднее время въ области органической химіи, это — весьма обширныя и точныя работы Эмиля Фишера о полипептидахъ и ихъ синтезћ103). Можно надћяться, что эти изслћдованія приведутъ, наконецъ, къ синтезу пептоновъ, и, можетъ быть, даже къ синтезу бћлковыхъ веществъ (протеиновъ).
Фишеръ исходитъ изъ почти общепринятаго мнения104), что пептоны состоятъ, существеннымъ образомъ, изъ полипептидовъ, т. е. представляютъ повторное амидообразное сцћпленіе моно- и діаминокислотъ. Простћйшій членъ этой группы, это — дипептидъ глицилъ-глицинъ
NH2CH2СONH.CH2COOH
Фишеръ основывается при этомъ на томъ фактћ, что при расщепленіи протеиновъ обнаружены были только аминокислоты и ихъ производныя. {355}
При своихъ синтетическихъ изслћдованіяхъ онъ исходитъ, согласно этому, отъ этихъ кислотъ, изъ числа которыхъ имъ были получены многія, до тћхъ поръ неизвћстныя. Моноаминокислоты онъ получаетъ по двумъ методамъ, испытаннымъ Штрекеромъ105), Перкинсомъ и Дюппа106), діаминокислоты по способу Габріэля107), при помощи каліяфталимида, или же изъ ненасыщенныхъ кислотъ съ помощью амміака; оксиаминокислоты онъ получаетъ путемъ присоединенія синильной кислоты къ оксиальдегидамъ, напримћръ къ альдолю. Онъ достигъ расщепленія на оптическіе компоненты, дћйствуя по второму методу Пастера108), т. е. вводя радикалъ кислоты, напримћръ, бензоилъ или нитробензоилъ.
Изъ производныхъ этихъ кислотъ интересъ представляютъ эфиры и хлориды. Первые получаются по методу, указанному Курціусомъ109), за которымъ въ этой области вообще числятся большія заслуги109).
Для развитія цћпи въ аминокислотахъ примћняются, главнымъ образомъ, слћдующіе три метода:
1) Расщепленіе дикетопиперазиновъ110) съ помощью кислотъ или, лучше, щелочей. 2) Обработка эфировъ ацетъхлоридами, или хлорированными ацетхлоридами, омыленіе эфировъ и обработка амміакомъ. 3) Дћйствіе хлорида аминокислоты на эфиры и омыленіе послћднихъ. Фишеру и его многочисленнымъ сотрудникамъ удалось путемъ сочетанія этихъ трехъ методовъ приготовить очень большое число полипептидовъ и получить цћпи изъ 12 аминокислотъ.
Если теперь сравнить свойства этихъ полипептидовъ съ пептонами, то нельзя не признать ихъ сходства, и потому вполнћ оправдывается предположеніе, что такимъ путемъ удается достигнуть синтеза пептоновъ.
Въ послћднее время пріобрћла большое значеніе одна реакція, которую вовремена Берцеліуса и Митчерлиха относили къособому классу111); она играетъ важную роль въ техникћ и весьма широко {356} распространена, въ чемъ изслћдователи убћждаются все болће и болће. Рћчь идетъ о катализћ. Къ катализу цћлесообразно относить тћ реакціи, скорость которыхъ увеличиваетсн (или уменьшается) отъ прибавленія такъ называемаго катализатора. Этотъ послћдній, однако, не принимаетъ участія въ реакціи, и количество его можетъ быть сравнительно весьма мало, т. е. совершенно не соотвћтствовать его сильному дћйствію; послћ окончанія реакціи это количество оказывается неизмћнившимся112). Къ числу каталитическихъ реакцій принадлежитъ прежде всего цћлый рядъ очень важныхъ техническихъ процессовъ, напримћръ, броженіе, біологическій характеръ113) котораго въ настоящее время совершенно отрицается. Далће сюда же отнсь сится новый контактный способъ полученія сћрной кислоты114) и окисленія нафталина въ фталевую кислоту посредствомъ сћрной кио лоты въ присутствіи ртути115). Этотъ процессъ составляетъ существенную стадію въ производствћ индиго изъ нафталина. Кромћ того, извћстенъ еще цћлый рядъ катапитическихъ реакцій, изъ которыхъ мы здћсь упомянемъ лишь нћкоторыя, имћющія теоретическое значеніе. — Укажу, между прочимъ, на разложеніе Н2O2116) на сгораніе гремучаго газа (Дэви117) и Деберейнеръ118), на многочисленныя
реакціи, протекающія, повидимому, только въ присутствіи воды119); далће, на образованіе металлоорганическихъ соединеній, происходящее при содћйствіи уксуснаго эфира120), на дћйстіе хлористаго алюминія и другихъ хлоридовъ при синтезћ ароматическихъ углеводородовъ по методу Фриделя и Крафта121); сюда же относится вліяніе тонко измельченныхъ металловъ, главнымъ образомъ никкеля на присоединеніе водорода122) и т. д. Наконецъ, уже давно извћстно {357} вліяніе кислотъ на инверсію тростниковаго сахара123) и на разложеніе эфировъ124).
Что касается результатовъ общаго характера, добытыхъ благодаря изученію катализа, то особенно многаго констатировать здћсь не придется. Оствальдъ125) нашелъ при инверсіи сахара правило, что ускореніе процесса, вызванное кислотами, пропорціонально силћ сродства этихъ кислотъ, т.-е. пропорціонально концентраціи ихъ водородныхъ іоновъ. Подобнаго же рода закономћрности констатировали также Бредигъ и Френкель126), затћмъ Кёлихенъ127). Очень важно, далће, то обстоятельство, что катализаторомъ можетъ быть измћнена скорость реакціи, но не моментъ наступленія равновћсія. Это было доказано во многихъ случаяхъ, напримћръ, при конденсаціи ацетона въ діацетонъалкоголь128) и при образованіи ангидрида сћрной кислоты изъ сћрнистаго ангидрида и кислорода129). Нужно, впрочемъ, сказать, что эти такъ называемыя закономћрности только приблизительно точны. Наконецъ, слћдуетъ упомянуть о поразительномъ сходствћ между органическими и неорганическими катализаторами. Напримћръ, весьма сходны дћйствія энзимовъ и губчатой платины или коллоидальной платины, что было доказано, главнымъ образомъ, Бредигомъ130).
Неоднократно уже дћлались попытки объяснить каталитическія реакціи. Большою извћстностью пользуется гипотеза, согласно которой дћйствіе тонко измельченныхъ металловъ при реакціяхъ газовъ основывается на сгущеніи газовъ въ этихъ металлахъ. Изслћдованіе Боденштейна131) относительно сгоранія гремучей смћси въ присутствіи губчатой платины, повидимому, подтверждаетъ такое предположеніе. Но мы не можемъ еще удовлетворительно объяснить всћ случаи катализа, и трудно на это надћяться, такъ какъ понятіе катализа распространяютъ на слишкомъ большое число разнородныхъ явленій.
Въ заключеніе я позволю себћ дать лишь краткій обзоръ нћкоторыхъ наиболће общихъ результатовъ, добытыхъ химіей коллоидовъ. Эта отрасль имћетъ столь большое значеніе, что ее нельзя {358} обойти молчаніемъ. Явленія, къ ней относящіяся, играютъ весьма большую роль въ біологіи и техникћ, но научное изслћдованіе этой области мало еще подвинулось впередъ. Мы даже не знаемъ еще, приложимы ли къ коллоидамъ стехіометрическіе законы!
Первымъ, кто отдћлилъ коллоиды отъ кристаллоидовъ, былъ Грэмъ. Въ своихъ знаменитыхъ изслћдованіяхъ диффузіи132) онъ обнаружилъ большую разницу въ скорости диффузіи: основанія, кислоты, соли, вообще, кристаллизующіяся вещества диффундируютъ очень быстро сравнительно съ аморфными тћлами, какъ клей, бћлокъ, кремневая кислота и т. п. Грэмъ далће показалъ, что только вещества перваго рода способны проходить черезъ животный пузырь или пергаментную бумагу, тогоа какъ коллоиды почти совершенно задерживаются этими перепонками.
Коллоиды можно подраздћлить на коллоидальные растворы, которые называются также гидрозолями, и на аморфныя вещества, которыя иногда выдћляются изъ первыхъ и вслћдствіе своего сходства съ желатиномъ называются гидрогелями133).
Коллоидальные растворы существенно отличаются отъ настоящихъ растворовъ тћмъ, что они вызываютъ только минимальное пониженіе точки замерзанія сравнительно съ чистымъ растворителемъ, что объясняется, можетъ быть, весьма высокимъ молекулярнымъ вћсомъ коллоида. Отличіе, далће, состоитъ въ томъ, что изъ коллоидальныхъ растворовъ коллоиды большею частью могутъ быть выдћлены въ видћ аморфнаго осадка посредствомъ прибавленія небольшого количества какого-либо электролита. Наконецъ, они обнаруживаютъ явленіе Тиндаля, т.-е. сильно разсћиваютъ и поляризуютъ свћтъ, и въ ультрамикроскопћ134) они почти всегда имћютъ видъ суспензій.
Изъ нижеслћдующихъ фактовъ, открытыхъ Г. Квинке135) и другими слћдуетъ, повидимому, что при свертываніи гидрозолей, дћйствительно, играютъ роль электрическіе процессы. Если суспендированныя частицы подъ вліяніемъ электрическаго тока направляются къ аноду, то онћ осаждаются катіонами, аніонами же онћ выдћляются въ томъ случаћ, когда онћ подъ вліяніемъ тока движутся къ катоду. Далће было найдено, что коллоиды, передвигающіеся {359} въ одинаковомъ направленіи, другъ на друга не дћйствуютъ, но они взаимно осаждаются, если имћютъ неодинаковое направленіе движенія. Кромћ того, замћчательно, что многовалентные катіоны обладаютъ всегда болће значительной и болће интенсивной осаждающей способностью, чћмъ одновалентные. Однако, эти правила не всегда имћютъ силу. Гарди136) показалъ, что бћлокъ различно передвигается по отношенію къ полюсамъ электрической батареи, смотря по тому, имћетъ ли онъ кислую или щелочную реакцію. Если жидкость электрически нейтральна, то бћлокъ коагулируетъ весьма легко, и, какъ нашли Гофмейстеръ137) и Паули138), коагуляція отъ дћйствія солей щелочныхъ металловъ оказывается процессомъ обратимымъ, т. е. при избыткћ этихъ солей коагулирующіе коллоиды вновь растворяются; напротивъ, при дћйствіи солей тяжелыхъ металловъ коллоиды остаются въ осадкћ.
Интересны свойства алкоголя при очень низкихъ температурахъ (въ жидкомъ воздухћ)139). Сначала онъ превращается въ аморфное вещество, которое становится кристаллическимъ только при болће высокой температурћ. Нћчто подобное наблюдается и у многихъ металловъ, которые изъ расплавленнаго состоянія выдћляются въ кристаллической формћ, тогда какъ при обыкновенной температурћ они легко могутъ быть получены въ коллоидальной формћ. Впервые коллоидальный металлъ былъ полученъ Фарадэемъ140). Послћдній дћйствовалъ фосфоромъ на растворы солей золота и получилъ такимъ образомъ великолћпно окрашенные растворы золота. Затћмъ слћдуютъ многочисленныя работы Кари Ли141), относящіяся, главнымъ образомъ, къ аллотропическимъ видоизмћненіямъ серебра. Позже еще многіе другіе142) занимались подобными изслћдованіями; особеннаго упоминанія заслуживаетъ Бредигъ143), распылявшій металлы съ помощью электрической дуги. Подобнаго рода гидрозоли металловъ, главнымъ образомъ серебра144) (колларголь) и ртути (гирголь), нашли разнообразныя примћненія въ терапіи. To же самое относится и къ такъ называемымъ препаратамъ {360} Пааля145). Коллоидальные металлы пріобрћли техническое значеніе также и въ другомъ направленіи. Такь, напримћръ, въ настоящее время приготовляютъ металлическія нити для электрическихъ лампъ146), осаждая металлы изъ ихъ коллоидныхъ растворовъ и прессуя полученный осадокъ. Вообще, изслћцованія коллоидовъ оказали много услугъ техчикћ. Я напомню только о такъ называемомъ осмосћ или, лучше, діализћ въ производствћ сахара и о такъ называемомъ гнилостномъ броженіи фарфора, которое теперь объясняется совершенно иначе, чћмъ раньше147).
О гидрогеляхъ извћстно сравнительно мало, и важнћйшими свћдћніями въ этой области мы обязаны, несомнћнно, ванъ-Беммелену148). Онъ показалъ, что вода, содержащаяся въ гидрогеляхъ, не связана химически, но удерживается адсорбціей или, какъ онъ говоритъ, абсорбціей. Поэтому изъ многочисленныхъ гидратовъ желћза онъ лишь немногіе считаетъ химическими соединеніями. Къ подобнымъ же результатамъ пришелъ также и В. Фишеръ149) въ противоположность Руффу150).
| {361} |
П. ВАЛЬДЕНЪ
ОЧЕРКЪ ИСТОРІИ ХИМІИ
ВЪ РОССІИ.
Начало химіи связано съ началомъ культуры; исторія химіи — только глава изъ исторіи человћческой культуры. Отражая подобно зеркалу въ различные періоды времени всћ колебанія матеріальной и духовной культуры отдћльныхъ странъ и народовъ, исторія химіи является и экономическимъ, и интеллектуальнымъ, а равно и политическимъ барометромъ.
Два источника снабжаютъ, главнымъ образомъ, древо химіи живою водою: потребности практической жизни и духовное стремленіе къ познаванію міра; съ одной стороны, притокъ реальныхъ свћдћній, съ другой стороны, притокъ идей или философскихъ представленій. Въ различныя эпохи культуры и въ зависимости отъ духовныхъ особенностей различныхъ народовъ, въ развитіи химіи преобладаютъ то оба направленіи, то лишь одно изъ нихъ. Такъ, напримћръ, на востокћ въ старину развивается по преимуществу практическая сторона химіи: въ древней Греціи процвћтаетъ философія химіи или физическихъ наукъ вообще; у арабовъмагометанъ обћ стороны химіи встрћчаютъ пониманіе и развитіе,— арабы не только прилежные практики и искусные наблюдатели, но и носители и распространители идей греческихъ философовъ; вспомнимъ, напримћръ, знаменитаго Гебера (VIII вћкъ).
Средневћковый періодъ химіи долженъ уже считаться съ новыми народами и съ новой культурой: паденіе власти арабовъ въ Испаніи (въ XIII стол.) и развитіе власти римской церкви во всей западной Европћ выдвигаютъ и для химіи новыхъ покровителей и работниковъ. Главными представителями и защитниками химіи въ это время являются члены римской церкви или духовныхъ орденовъ. Химія подъ этимъ новымъ покровительствомъ отчасти {362} перемћшивается съ идеями католической религіи; она процвћтаетъ какъ алхимія1), т.-е. сочетаніе философіи Аристотеля съ мистицизмомъ и реальнымъ міромъ. Альбертъ Великій, доминиканецъ и епископъ (XIII в.); его знаменитый ученикъ, доминиканецъ Ќома Аквинатъ (XIII в.); далће францисканецъ Рожеръ Бэконъ (ум. 1294), Арнольдъ изъ Вилланова (ум. 1314); миссіонеръ Раймундъ Люллій (ум. 1315); миќическій бенедиктинецъ Василій Валентинъ (якобы въ XV в.); не забудемъ также францисканца Бертольда Шварца (XIV в.), знаменитаго изобрћтателя чернаго пороха — вотъ списокъ славнћйшихъ представителей алхиміи, а равно католической церкви.
Наступаетъ XVI вћкъ, вћкъ реформаціи, наукъ и искусствъ. Новая церковь и новые служители ея не являются болће покровителями и учителями алхиміи, и для химіи наступаетъ новая эра. Медицина нынћ беретъ химію подъ свое покровительство: знаменитый врачъ Парацельзъ (1493—1541) провозглашаетъ для химіи новыя цћли. He превращеніе благородныхъ металловъ въ неблагородные, не фабрикація серебра и золота, а приготовленіе лекарственныхъ препаратовъ составляетъ задачу химіи,— химія на западћ (съ 1525) превращается, слћдовательно, въ помощницу медицины, въ медицинскую химію или іатрохимію. Но еще другой переворотъ совершается въ химіи: рядомъ съ медицинской химіею въ XVI вћкћ на западћ зарождается и техническая химія. Взамћнъ схоластической химіи металловъ возникаетъ практическая металлургія, основателемъ которой можно считать Г. Агриколу (1494—1555), который въ качествћ минералога изучалъ минералы и, какъ химикъ (De re metallica, 1530), положилъ основаніе нћмецкому раціональному горнозаводскому дћлу. Во Франціи онъ имћлъ соперника въ лицћ славнаго Бернарда де Палисси (около 1499 по 1590 г.), труды котораго относятся къ керамикћ, минералогіи и агрикультурной химіи. Парацельзъ, Агрикола и Палисси могутъ считаться основателями индуктивнаго метода въ химіи и виднћйшими представителями экспериментальной химіи новой эпохи.
Великія волны, исходившія отъ духовныхъ переворотовъ XVI вћка на западћ, дошли также до границъ Московскаго государства; Московская Русь воспринимаетъ эти волны и оказывается {363} резонаторомъ западной науки и техники, въ частности медицины и химіи, а равно и химической промышленности.
Востокъ Европы — древняя Русь — не принималъ никакого участія въ изложенномъ нами послћдовательномъ развитіи химіи ни съ теоретической, ни съ практической стороны. Представители русской церкви не могли быть ни покровителями, ни распространитќлями физикохимическихъ наукъ: съ одной стороны, причиной является недостатокъ училищъ вообще (Кіевская духовная Академія существуетъ съ 1589 г.1), съ другой стороны — презрћніе къ западнымъ наукамъ. На знанія смотрћли, какъ на ересь, какъ на нћчто, несовмћстимое съ православіемъ: „братіе, не высокоумствуйте”, учили въ тћ времена, „но въ смиреніи пребывайте, по сему и прочая разумћвайте. Аще кто ти речетъ: вћси ли всю философію? И ты ему рцы: еллинскихъ борзостей не текохъ, ни риторскихъ астрономъ не читахъ, ни съ мудрыми философы не бывахъ — учуся книгамъ благодатнаго закона”2).
Высшія свћтскія школы (университеты), которыя на западћ являлись центромъ знаній вообще, и въ частности медицины и естественныхъ наукъ, отсутствовали въ Россіи. Но постепенно развиваются, съ одной стороны, внћшнія торговыя сношенія, а съ другой стороны — внутреннія потребности въ различныхъ металлахъ и металлическихъ издћліяхъ. Благодаря этимъ двумъ факторамъ на Руси пробуждается интересъ къ природнымъ богатствамъ, мало помалу вызывающій попытки къ ихъ использованію и создающій промышленность. Торговля3) съ западомъ способствуетъ возникновенію производства мћховъ, составляющихъ главный товаръ; въ огромномъ количествћ вывозился также въ западную Европу воскъ; другими предметами торговли были: ленъ, конопля, толстый холстъ и пакля, сало, кожи, медъ. Кромћ того, уже съ XIII и XIV вћка добывались и шли заграницу въ значительномъ количествћ поташъ3) и смола, главнымъ образомъ, черезъ Новгородъ. {364} Поташъ составлялъ цћнный продуктъ для голландцевъ и фламандцевъ, примћнявшихъ его для мыловаренія, очистки шерсти и т. д., а смола покупалась иностранцами для корабельныхъ надобностей. Привозные химическіе продукты другихъ странъ были киноварь, сулема, квасцы, купоросъ, бура, ярь и бћлила, бывшія тогда въ большомъ употребленіи у русскихъ женщинъ. Рядомъ съ химическимъ производствомъ поташа и смолы для вывоза въ древней Руси существовало еще производство соли1) для внутренней торговли. О мћсто рожденіи соли около устьевъ Днћпра сообщаетъ уже отецъ исторіи Геродотъ (V столћтіе до Р. Хр.). Крымъ и вообще побережье Чернаго моря богаты самосадочными лиманами и озерами. Галицкая земля издавна славилась своими обильными мћсторожденіями соли; гор. Галичъ, а равно Галицкое княжество получили свое имя, по всей вћроятности, отъ кельтовъ, которые первые стали разрабатывать соль: Галичъ = Halicz, a слово Hal, hall, столь распространенное въ Гёрманіи и Австріи при названіи мћстностей и городовъ, въ которыхъ добывалась или еще добывается соль, связывается съ кельтами2), въ старину обитавшими въ этихъ областяхъ и отличавшимися своимъ искусствомъ въ горнозаводскомъ дћлћ. Но солевареніе развивалось и на сћверћ Россіи, въ Двинской области: извћстіе объ этомъ двинскомъ солевареніи на Руси относится уже къ XII вћку. Соль добывалась издавна и въ Новгородской землћ, a именно въ Старой Русћ; а въ XII вћкћ былъ основанъ новый го родъ, Галичъ Костромской — вслћдствіе найденнаго тамъ запаса соли. Съ XIV вћка начинается, по всей вћроятности, вслћдствіе возникновенія артиллеріи и потребности въ порохћ, — селитровареніе; уже въ XVI столћтіи приготовленіе селитры (sal nitrae), или ямчуги, было на Руси дћломъ обычнымъ.
Металлы1). Въ древней Руси издавна были извћстны и находились въ обращеніи металлы: золото, серебро, мћдь и желћзо; въ XII вћкћ появляется еще олово, въ XIII вћкћ свинецъ; ртуть и сурьма тоже были извћстны. Однако, до XVI вћка включительно всћ эти металлы привозились въ Россію, главнымъ образомъ, черезъ Новгородъ и Ригу отъ Ганзы, частью по Волгћ. Особаго вниманія заслуживаетъ тотъ фактъ, что русскія названія3) нћкоторыхъ {365} металловъ, напримћръ, мћди, ртути, свинца, а равно названіе сурьмы не совпадаютъ съ названіями культурныхъ языковъ запада; древняя Русь, слћдовательно, ознакомилась съ этими металлами черезъ посредство другихъ1) восточныхъ народовъ (тюркскаго, чудскаго, татарскаго?) и еще до соприкосновенія съ народами западной Европы.
Лишь поздно въ XV столћтіи, начинаются поиски металловъ, главнымъ образомъ, золота, серебра и мћди, въ предћлахъ Руси, а равно попытки насажденія горнаго дћла въ Россіи. Заслуга эта принадлежитъ Великому Князю Ивану III, который обратился (въ 1488 г.) къ венгерскому королю Матвћю I Корвину съ просьбою, „чтобы онъ намъ дружбу учинилъ, прислалъ бы къ намъ мастеровъ... которой руду знаетъ, золотую и серебряную, да которой бы руду умћлъ и раздћлити съ землею, занеже въ моей землћ руда золотая и серебряная есть, да не умћютъ ее раздћлити съ землею”. Въ 1489 году то же порученіе о „рудникћ, который руду знаетъ золотую и серебряную”, передается посламъ, ћхавшимъ къ римскому императору. Въ 1491 г. имъ были посланы рудоискатели на Печору; къ этому году относится первое открытіе печорскихъ серебряныхъ и мћдныхъ мћсторожденій на рћкћ Цыльмћ. Царь Иванъ Васильевичъ Грозный въ 1547 г. поручилъ саксонцу Шлитту нанять въ Европћ 2 рудокоповъ, 1 пробирщика, 1 плавилыцика и 1 плющильщика. Онъ многократно обращается къ шведскому королю Іоанну II Ваза за присылкой въ Россію „добрыхъ мастеровъ, искусныхъ въ добываніи руды и ея обдћлываніи”. Въ 1557 посланный царемъ въ Лондонъ дворянинъ Осипъ Непея привезъ оттуда дћйствительно нћсколькихъ рудокоповъ2). Наконецъ въ грамотћ знаменитымъ Строгановымъ 1574 разрћшено было „мћдяну руду или оловяную, свинчатую и сћры горючія гдћ найдутъ, и тћ руды на испытъ дћлати”. Съ рћки Чусовой предпріимчивые Строгановы, начавшіе свою дћятельность съ солеваренія въ зырянской сторонћ въ Соли Вычегодской, расширили свои промыслы за Каменный Поясъ на Уралћ и открыли Сибирь еще до появленія Ермака. {366}
При великомъ князћ Василіи найдены были желћзныя руды около Каширы, а при царћ Ќедорћ I близъ Устюга Великаго и Ту л ы.
Царствованіе Ивана Грознаго ознаменовалось еще другимъ событіемъ, важнымъ для дальнћйшаго культурнаго развитія Московскаго Государства и знаменательнымъ въ исторіи химіи въ Россіи. Съ 1553 г. между Англіею и Москвою завязываются правильныя торговыя сношенія черезъ Архангельскъ и вмћстћ съ тћмъ сношенія правительствъ обоихъ государствъ. Результатомъ таковыхъ является, между прочимъ, слћдующее: въ 1581 г. англійская королева Елизавета посылаетъ — по просьбћ Ивана Грознаго — своего придворнаго врача Р. Якоби вмћстћ съ аптекаремъ Френчэмомъ (James Frencham) въ Москву. Одновременно Френчэмъ привозитъ съ собою запасъ химическихъ медикаментовъ. Этотъ годъ (1581) составляетъ начало возникновенія химіи въ Россіи; Френчэмъ, какъ аптекарьхимикъ, является родоначальникомъ химіи въ Россіи; открытая имъ (1581) первая аптека составляетъ первое вообще мћсто, гдћ производились химическіе процессы по правиламъ науки запада, а цћль этой химіи — приготовленіе лекарствъ. Одновременно1) въ Москвћ возникаетъ аптекарская палата или аптекарскій приказъ, т.-е. центральное медицинское учрежденіе, а само названіе характеризуетъ то громадное значеніе, которое придавалось аптекарскому и вмћстћ съ тћмъ химическому искусству при созиданіи медицинской помощи въ Россіи.
Эта первая въ Россіи аптека почти сто лћтъ оставалась единственной; въ 1672 г. была открыта вторая, а въ 1682 г. третья царская аптека въ Москвћ. Лишь Петръ Великій въ 1701 г. приказалъ „для всякихъ надобныхъ и потребныхъ лекарствъ быть въ Москвћ вновь осьми аптекамъ”2).
Какъ была организована аптекарская дћятельность въ древней Руси? Какіе вообще спеціалисты были подчинены аптекарскому приказу? Вотъ длинный перечень, иллюстрирующій культуру этой эпохи: 1) доктора, лекари, окулисты, чепучинные и чечуйные лекари, цырульники, гортанные мастера, костоправы, 2) аптекари, алхимисты, водочники (дистилляторы), аптекарскихъ и алхимическихъ {367} дћлъ ученики, травники и помясьг, 3) переписчики и переводчики, часовыхъ дћлъ мастера, знаменщики и брюкмейстеры12).
Что насъ особенно поражаетъ, это — сословіе алхимистовъ (алхимиковъ) и алхимическихъ дћлъ учениковъ! Неужели въ Россіи, гдћ не было алхиміи, все-таки существовали алхимики, которые занимали даже оффиціальныя должности при царскомъ дворћ? При словћ „алхимія” мы невольно вспоминаемъ о той эпохћ въ химіи, когда вћрующіе адепты, хитрые обманщики и аферисты неутомимо предлагали свои услуги по превращенію неблагородныхъ металловъ въ благородные; передъ нами воскресаютъ таинственныя лабораторіи алхимиковъ, въ которыхъ адепты герметической науки трудятся надъ приготовленіемъ философскаго камня. Мы вспоминаемъ, что, напримћръ, при вћнскомъ императорскомъ дворћ и при дворћ въ Дрезденћ не только состояли придворные алхимики, но даже коронованныя особы лично занимались алхиміей!
Таковы ли были придворные алхимисты Московскаго Государства? Нћтъ, ихъ роль была совершенно другая: кромћ громкаго имени они не имћли ничего общаго съ этими алхимиками запада.
Въ чемъ заключались функціи этихъ древнихъ русскихъ алхимистовъ, кто они были, какое они занимали служебное положеніе?
В. Рихтеръ, извћстный авторъ „Исторіи медицины въ Россіи” (3 тома, 1814—1820), поясняетъ, что въ эпоху московскихъ царей названіе „алхимистъ” было почетнымъ титуломъ2). Рихтеръ подводитъ подъ это названіе и нћкоторыхъ аптекарей, напримћръ Ягана (Іоанна) Зеттегаста и Петра Пиля.
Но такой взглядъ несомнћнно неправиленъ. Въ царскихъ указахъ и грамотахъ этого періода явно различаются аптекари отъ алхимистовъ, и мы сейчасъ увидимъ, что между ними существуетъ переходъ, а именно, отъ алхимиста къ аптекарю. „Алхимистъ” не представляетъ почетнаго титула аптекарей, а относится къ особому классу сотрудниковъ аптекарей.
„Лекарственную мудрость” дћлили въ это время „на три статьи дохтуромъ и обтекаремъ и лекаремъ, потому что дохтуръ совћтъ свой даетъ и приказываетъ, а самъ тому неискусенъ; а лекарь прикладываетъ и лекарствомъ лечитъ и самъ не наученъ; а обтекарь у нихъ у обоихъ поваръ...”1). Въ этомъ спискћ не хватаетъ еще одного—алхимика; функціи алхимика или алхимиста нигдћ не {368} опредћлены. Но ихъ было сравнительно много. Такъ напримћръ, при Михаилћ Ќеодоровичћ (1613—1645) врачебный персоналъ состоялъ изъ 7 докторовъ, 13 лекарей, 4 аптекарей и 3 алхимистовъ2). Приведемъ имена этихъ алхимистовъ: Вилимъ Смитъ, Христофоръ Пухнеръ и Томасъ Винсъ. У Алексћя Михайловича (1645—1676) и Ќеодора Алексћевича мы встрћчаемъ слћдующихъ оффиціальныхъ алхимистовъ: 1) Марко Юрьевъ, 2) Петръ Пиль (Пель), 3) Беніусъ Гансланцъ (Ганслантъ или Ганцъ Сланцъ), 4) Яганъ Зеттингастъ (Зеттигастъ), кромћ того 5) Францъ Шляторъ (Шлахторъ, Слаторъ, Сляторъ); у Петра Великаго, въ началћ его царствованія: Петръ Пель (Пиль), Яганъ Зеттегастъ, Яганъ Григори, кромћ того три алхимиста и аптекарскаго дћла ученика.
Принимая во вниманіе иностранныя фамиліи этихъ алхимистовъ, можно заключить, что они, какъ и доктора и аптекари, были иноземнаго происхожденія и переселились изъ заграницы въ Москву.
Прослуживъ нћкоторое время, они даже отпускаіись на свою родину и увольнялись отъ службы; напримћръ, алхимистъ Зеттегастъ „изъ Прусской земли, прослуживъ съ 1672 г., былъ уволенъ (1683) съ царской грамотой и ућхалъ изъ Россіи”3).
Однимъ изъ первыхъ по времени алхимистовъ является Вилимъ Смитъ; въ 1631 году онъ, однако, еще упоминается какъ англійскій купецъ, впослћдствіи мы уже встрћчаемъ его, какъ алхимиста, а при его смерти (1645 г.) онъ именуется алхимистомъ и водочникомъ4). Служебное положеніе алхимистовъ слћдуетъ считать высокимъ; они слћдовали за докторами и аптекарями. Между прочимъ, ихъ вознагражденіе опредћлилось слћдующими числами: въ 1662 г. доктора получали по 250 p., аптекари по 60 и 50 p., алхимисты по 60 и 50 p., а лекари no 55 и 20 p. въ годъ5). За выслугу лћтъ слћдовали прибавки; такъ, напримћръ, алхимистъ Пиль въ 1664 году получилъ за годъ всего 110 p., a въ 1682 году 150 р.
Въ чемъ заключались функціи алхимистовъ? Они совмћстно съ аптекарями готовятъ лекарства. Въ частности, мнћ кажется, {369} можно раздћлить дћятельность обћихъ профессій такъ: аптекарю была поручена какъ продажа и контроль лекарствъ, такъ и рецептура и „надкушиваніе”, т. е. приготовленіе сложныхъ медикаментовъ по рецептамъ, составленнымъ докторами, и ихъ физіологическое испытаніе, а алхимистъ скорће всего являлся лaборантомъ, занимающимся экстрагированіемъ, перегонкою, кальцинаціею, очисткою, кристаллизаціею и т. д., т. е. приготовленіемъ отдћльныхъ химическихъ препаратовъ въ аптекарской лабораторіи.
Если научная подготовка аптекарей была нормирована сложившейся на западћ традиціею аптекарскаго сословія, то алхимисты, вћроятно, были заграничные самоучки или аптекари-недоучки, обладавшіе нћкоторой практической подготовкой по химіи и химическимъ операціямъ.
Алхимисты, однако, совмћстно съ аптекарями, принимали также участіе въ анализћ и экспертизћ новыхъ лекарственныхъ продуктовъ. Напримћръ, въ 1679 г. аптекарь Эглеръ и алхимистъ Пиль, a равно „алхимискаго” дћла ученикъ Тихонъ Ананьинъ и русскіе лекари произвели анализъ мази, ртутной съ купоросомъ, кото рой Гришка Донской лечиль князя Ќедора Щербатаго1). Алхимисты состояли при особћ царя; они же посылались за границу „для приглашенія въ Московское Государство” докторовъ и техниковъ, для покупки всякихъ аптекарскихъ запасовъ и т. д.; напримћръ, въ 1675 г. алхимистъ Б. Гансъ Слантъ былъ командированъ въ Римскую Имперію, Венгрію, Курляндію и Саксонію2).
Къ алхимистамъ отдавались также въ практическое ученіе молодые люди въ „алхимискаго дћла ученики”; такъ, напримћръ, въ 1678 г. къ алхимисту Петру Пилю аптекарскимъ приказомъ былъ назначенъ ученикъ „алхимискаго дћла Тихонъ Ананьинъ”. Но эти ученики алхимискаго дћла также обучались первоначально у аптекарей; послћ практическаго обученія они опредћлялись въ школу въ новонћмецкой слободћ для обученія „латинскому и цесарскому языку”3).
Выше мы упоминали о профессіи водочника или дистиллятора. Винокуреніе извћстно на Руси съ древнћйшихъ временъ. Съ введеніемъ аптекарскаго дћла приготовленіе водки и всякихъ спиртовъ было прикрћплено къ Аптекарской Палатћ, а казна {370} получала отъ „сидћнья всякія спирты и водки — коричную, гвоздичную, анисную, поморанцевую, цытрановую...” значительные доходы или, какъ говорится въ источникахъ, „а збиралось съ тћхъ водокъ въ казну прибыль не малая”. Нћсколько числовыхъ данныхъ покажутъ намъ эти водочные доходы: съ 1го апрћля по 1е октября 1673 г., т.-е. за 6 мћсяцевъ, чистая выручка достигла 5194 руб. 10 ден. по старому счету; по смћтћ 1673 года для нуждъ аптекарскаго приказа требовалось 15214 ведеръ вина, изъ нихъ на одни „перепуски” — 7607 ведеръ.
Первымъ дистилляторомъ является русскій водочный перепусчикъ Вас. Шиловъ, 1678. Въ обязанности водочника или дистиллятора входило, кромћ водочнаго сидћнья, еще „варенье всякихъ сироповъ, пластырей и мазей и протчихъ лекарствъ, которые въ запасъ дћлаются”; имъ предписывалось, „такъ бы чинить, чтобъ всякая водка и составъ совершенную силу по предписанному дћйствію въ рецептахъ дохтурскихъ имћла”1).
Но не всћ алхимисты оставались при своей профессіи. По нашему предположенію алхимисты не обладали формально законченнымъ образованіемъ; отчего имъ было не закончить такового и сдать за границею экзаменъ на званіе аптекаря? И дћйствительно, мы видимъ, какъ, напримћръ, алхимистъ аптекарскаго приказа Яганъ Готфридъ Григорій, по его челобитной въ 1693 году былъ отпущенъ по царскому указу „за море въ цесарскую землю за время” „...для свиданія съ родственниками и для совершеннћйшаго ученія аптекарской науки”2). Пребываніе Григорія за границею, во всякомъ случаћ, увћнчалось успћхомъ, такъ какъ въ 1701 году онъ уже, какъ аптекарь, снабженный царскими полномочіями, доставляетъ изъ Архангельска въ Москву на 32 подводахъ купленные имъ „заморскіе питеи”3).
Равнымъ образомъ уже до Григорія, алхимистъ Францъ Шляторъ (Слаторъ), состоявшій еще въ 1662 и 1666 гг. алхимистомъ4), въ 1676 г. является уже аптекаремъ5) и впослћдствіи даже лекаремъ5). Подобно ему и алхимистъ Марко Юрьевъ (1662) впослћдствіи значится, какъ лекарь6). Если „алхимистъ” — почетный титулъ аптекаря, то непонятно было бы, почему послћ новаго {371} обученія на западћ вдругъ не присваивается болће этотъ почетный титулъ. Прибавимъ, что такія служебныя передвиженія, вћроятно на основаніи пріобрћтеннаго за границею дополнительнаго образованія, мы видимъ и въ другихъ случаяхъ: напримћръ, аптекарь Бріотъ (1631—1644) былъ потомъ лекаремъ1), а Яганъ Гутменшъ, состоя еще въ 1672 г. аптекаремъ, былъ въ 1682 г. даже докторомъ2), и, какъ таковой, былъ убитъ3), послћ смерти царя Ќедора Михайловича, во время стрћлецкаго бунта.
Изъ приведенныхъ данныхъ мы видимъ, что „алхимисты” Моо ковскаго Государства были скромные труженикихимики, честолюбіе которыхъ вообще не касалось философскаго камня и его тайнъ. Но нельзя не упомянуть, что въ эту эпоху и настоящая алхимія встрћчала нћкоторую поддержку и старалась проникнуть въ Москву. Укажемъ на то обстоятельство, что были переведены на „плохой церковнославянскій языкъ съ полонизмами” и сохранились въ рукописяхъ4):
Michael Scotus (современникъ Альберта Великаго) о естествознаніи, о тайнахъ естественныхъ; латинское изданіе „de secretis naturae”, Frankfurt a. M. 16145).
Albertus Magnus, o таинствахъ женскихъ и т. д.
Raymundus Lullus (XIV стол.), число трудовъ котораго алхимиками опредћляется въ пятьсотъ6): „великая наука” и „краткая наука” (ars magna et ars parva).
Укажемъ на тотъ фактъ, что мнимые адепты, обладатели философскаго камня, неоднократно предлагали свои услуги Московскимъ Государямъ. Такъ, напримћръ, въ 1626 г. нћкій голландецъ G. von der Heyden представилъ царю Михаилу Ќеодоровичу рукопись подъ заглавіемъ: „Изъясненіе о Алхимической мудрости или о философскомъ камнћ, врачующемъ всћ болћзни”. Московское Государство не воспользовалось этой „мудростью”, хотя назначило разспросъ, какъ „изъ свинцу и олова, желћза и изъ мћди и ртути серебро и золото „дћлать” и что къ тому дћлу пристойно”, а именно: „И къ тому дћлу надобно свинецъ, олово, желћзо, мћдь, ртуть, и изъ того возьмешь, что ему надобно. Будетъ захотћть изъ этого здћлать {372} серебро, ино взять серебра и здћлать изъ того серебра сћмя; а похотћть, чтобы тћ преждепомянутыя скудћли поворотились въ золото, ино взять золота, сколько пригоже, и взять изъ него сћмя...”. Дћйствительно просто, „ино взять сћмя”!
Въ заключеніе приведемъ еще нћсколько данныхъ о состояніи промышленности (химической) въ концћ этого періода. Съ развитіемъ аптекарскаго и медицинскаго дћла на Руси расширилась потребность въ стеклянныхъ и глиняныхъ сосудахъ и приборахъ. Первоначально для царской аптеки была привезена необходимая аптекарская посуда изъза границы; упоминается о „скляницахъ золоченыхъ”; равнымъ образомъ и другіе аптекарскіе запасы (химическіе препараты) привозились изъ за границы: изъ Гамбурга и изъ Англіи черезъ Архангельскъ. Подобный порядокъ практиковался еще въ 1672 г.1). Но рядомъ сталоразвиваться и внутреннее производство стеклянныхъ и глиняныхъ издћлій. Производство стекла началось при царћ Михаилћ Ќеодоровичћ и развилось при царћ Алексћћ Михайловичћ: въ это время существовали уже два завода, измаиловскій и духанинскій. Въ 1663 г. изъ Москвы былъ посланъ для пріисканія глины въ Гжельской волости „аптекарскихъ и алхимискихъ глиненыхъ судовъ мастеръ Пашко Птицкой”; дћйствительно, уже въ слћдующемъ году было приказано доставить изъ Гжельской волости 20 возовъ глины. Глина эта доставлялась на скляничные заводы. Другой извћстный мастеръ „Оптекарской палаты скляничный мастеръ” — Петръ Костъ (Коэтъ, Котъ), работавшій въ измаиловскомъ заводћ весьма успћшно, по заграничнымъ образцамъ, а равно по рисункамъ „бумажнымъ образцамъ”, „съ разными узорами”. Такъ, напримћръ, Петръ Костъ доставилъ въ Приказъ въ 1679 г. разныхъ сосудовъ 1674, а въ 1680 г. — 2316 мћстъ. О родћ этой посуды можно судить па заявленію вдовы другого скляничнаго дћла заводчика, Антона Коста, писавшей въ 1667 г., что покойный ея мужъ дћлалъ для Аптекарской Палаты „реторты и колвы, и реускіопы, и сепраторіи, и алеорчики, и ќіолы, и сулеи, и скляницы четвертныя, и фунтовые, и полуфунтовые, и иные всякіе скляничные суды”1).
Какъ видно, названія большею частью еще нынћ употребительныя, и среди этихъ изготовленныхъ на русскомъ заводћ сосудовъ встрћчаются уже и измћрительные приборы! {373}
Въ половинћ XVII вћка въ Россіи были основаны также заводы мыльные, куда находилъ сбытъ русскій поташъ. „Мыло — масштабъ благосостоянія и культуры государствъ”, говоритъ знаменитый Либихъ. Если этотъ критерій вћренъ, тогда лишь съ половины XVII вћка въ болће широкихъ слояхъ Московскаго Государства просыпается чувство красиваго, чувство довольства, уюта, связаннаго съ чистотою!
Около того же времени иностраниами были основаны въ подмосковныхъ мћстностяхъ нћсколько писчебумажныхъ фабрикъ.
Что касается горнaгo дћла и добыванія металловъ, то въ XVII вћкћ, вслћдствіе усилившейся потребности въ металлахъ вообще, а равно вслћдствіе поощренія со стороны царей, въ видћ привиллегій и льготъ, на Руси возникаетъ рудоманія: какъ въ западной Европћ, нћсколько столћтій раньше, появилась манія искусственнаго приготовленія благородныхъ металловъ, манія, существовавшая еще въ XVII вћкћ и создавшая столь многихъ адептовъ и алхимиковъ, такъ на Руси развелись охотники „сыскивать всякія руды”. Какъ въ одномъ, такъ и въ другомъ случаћ мы имћемъ дћло съ людьми, главнымъ орудіемъ которыхъ являлись не знанія, не спеціальная подготовка, а корыстолюбіе и вћра въ собственное счастье. Хотя эти „сыски” руды производились весьма ревностно, но лишь въ немногихъ случаяхъ они дали практическій результатъ.
Благородные металлы, а равно мћдь, свинецъ, олово, на Руси XVII вћка еще не добывались, а получались изъза границы; относительно мћди, напримћръ, еще въ 1677 г. цослћдовалъ именной указъ, въ которомъ ограничивается количество продаваемой персидскимъ купцамъ мћди, „потому что въ Московскомъ государствћ то не родится, приходитъ изъ нћмецкихъ странъ”. Зато желћзное производство1) началось на Руси уже въ XVI вћкћ, напримћръ, въ Тулћ2). Широкое развитіе это производство получило, когда голландецъ Андрей Виніусъ въ 1632 г. построилъ близъ Тулы четыре завода, названные Городищенскими, для обработки желћзной руды въ доменныхъ печахъ, впервые введенныхъ тогда въ {374} Россіи. Вскорћ, въ 1644 г., два другихъ „голландскихъ гостя”, Петръ Марселисъ и Филимонъ Акема, получили отъ Царя Михаила Ќеодоровича грамоту на постройку новыхъ желћзныхъ заводовъ въ отдаленіи отъ Тулы, на рћкахъ Вагћ, Костромћ, Шекснћ. Въ 1657 г., кромћ Тульскихъ и Каширскихъ заводовъ, существовали еще Угоцкій, въ 90 верстахъ отъ Москвы, и Поротовскій заводы, устроенные или арендованные Марселисомъ и Акемою. Въ 1674 г. правительство устроило (или перестроило) Павловскій желћзный заводъ въ 52 верстахъ отъ Москвы, на рћкћ Истрћ. Какъ въ Тулћ, такъ и въ Олонецкомъ краћ, давно уже существовало домашнее желћзное производство, — жители этого края съ давнихъ временъ занимались приготовленіемъ желћза прямо изъ руды въ сыродутныхъ горнахъ. Въ царствованіе Алексћя Михайловича олонецкіе желћзные рудники были отданы на откупъ датчанину Бурнанту фонъ Розенбушу, сначала вмћстћ съ Марселисомъ, построившему въ 1674 г. два завода, Устьрћцкій и Кедрозерскій, для выплавки чугуна и стали. Наконецъ, Андреемъ Андреевичемъ Виніусомъ, сыномъ упомянутаго Андр. Виніуса, думнымъ дьякомъ и начальникомъ Сибирскаго Приказа, были открыты желћзныя магнитныя руды въ Сибири, близъ Верхотурья и Тобольска, — фактъ, вызвавшій указъ Петра Великаго отъ 1697 г. о построеніи въ тћхъ мћстахъ большихъ желћзныхъ заводовъ. Въ томъ же 1697 г. послћдовало повелћніе Петра Великаго объ устройствћ ббльшаго желћзнаго завода на У р а л ћ, гдћ были найдены магнитный желћзнякъ на рћкћ Тагилћ и бурьій желћзнякъ у рћкъ Нейвы и Зыряновки. Черезъ нћсколько лћтъ (1701) здћсь начали работать Невьянскій и Каменскій желћзные заводы.
Къ этому же періоду, около 1700 г., относится также открытіе мћдной руды Лаврентіемъ Нейдгартомъ по рћкћ Бымъ, между Осинской слободой и Кунгуромъ, гдћ впослћдствіи работалъ Бымовскій мћдноплавильный заводъ; одновременно грекъ Александръ Левандіанъ открылъ въ Нерчинскомъ краћ серебряныя руды и построилъ Нерчинскій заводъ; выплавка серебра изъ серебро-свинцовыхъ рудъ началась уже въ слћдующемъ столћтіи и дала потомъ одного серебра болће чћмъ на 70 мил. рублей, хотя первоначально опасались затратить на основаніе этихъ заводовъ болће одной тысячи рублей.
На этомъ кончается нашъ бћглый обзоръ Московскаго леріода химіи въ Россіи, т.-е. состоянія химіи въ {375} до-Петровской Руси. Наступаетъ новая эпоха въ жизни русскаго государства, наступаетъ XVIII вћкъ, устраняющій многіе остатки прежней культуры и вмћстћ съ ними своеобразныхъ русскихъ „алхимистовъ”. Послћдніе къ началу XVIII вћка постепенно вымираютъ, а пріћздъ новыхъ „алхимистовъ” изъза границы прекращается.
Петръ Великій и въ этомъ дћлћ является реорганизаторомъ, создающимъ новыя основанія для дальнћйшаго развитія химіи въ Россіи. Онъ являлся убћжденнымъ противникомъ „алхимистовъ” вообще: онъ принималъ всћ ему представляемые проекты, „кромћ проектовъ алхимическихъ, поелику онъ увћренъ былъ, что тотъ, кто выдаетъ себя дћлателемъ золота, долженъ быть или обманщикъ, или невћжа въ химіи”1).
Московская Русь, по сравненію съ западной Европой, значительно отстала въ своей культурћ. Петръ Великій, лично ознакомившійся съ культурными странами запада, обладалъ геніемъ, смћлостью и энергіею, чтобы іприступить къ реформамъ, имћвшимъ своею цћлью превращеніе Руси — въ культурномъ отношеніи — въ часть Европы. He считаясь съ законами послћдовательнаго и непрерывнаго развитія, пренебрегая преемственностью, онъ задумалъ перенести въ Россію западную культуру. Къ числу мћропріятій этого великаго реформатора Россіи, имћвшихъ цћлью насажденіе наукъ западнаго міра, относится учрежденіе Академіи Наукъ въ 1724 году, хотя въ Россіи только лишь начали учреждаться нћкоторыя училища. Академія Наукъ дћйствительно была открыта въ ноябрћ 1725 года; расходы по ея содержанію покрывались изъ суммъ, собираемыхъ „въ Дерпта, Нарвы, Пернова и Аренсбурга таможенныхъ и лицентныхъ”. Если, съ одной стороны, первыя матеріальныя средства Академіи получались отъ этой западной провинціи Россіи, то, съ другой стороны, и первыя интеллектуальныя силы доставлялись западомъ же: первые академики были выписаны {376} изъ-за границы. Циклъ наукъ, представляемыхъ Академіею, обнималъ также химію, рядомъ съ физикою, механикою и т. д.
Назначеніе первыхъ академиковъ производилось при содћйствіи знаменитаго философа, физика и математика Христіана Вольфа. Но и на западћ семья химиковъ была въ это время малочисленна; химики начала XVIII вћка были по своей профессіи медики или фармацевты, по преимуществу самоучкитеоретики или практики. Поэтому Вольфу1) стоило много трудовъ и заботъ найти для Академіи перваго химикаакадемика. Сперва предполагалось поручить каќедру химіи пастору I. Г. Лейтману, съ 1726 по 1736 г. состоявшему профессоромъ механики и оптики при Академіи Наукъ; потомъ Вольфъ предложилъ въ качествћ химика извћстнаго металлурга, дра медицины Генкеля изъ Фрейберга, впослћдствіи учителя М. В. Ломоносова. Однако, еще до выясненія вопроса объ этой кандидатурћ, президентъ Академіи Блюментростъ пригласилъ на эту каќедру уроженца Курляндіи, д-ра медицины Мих. Бюргера, съ которымъ онъ вмћстћ слушалъ лекціи въ Лейденскомъ университетћ у знаменитаго медика и химика Боергава. Историкъ Академіи Наукъ Миллеръ кратко замћчаетъ относительно Бюргера: „онъ пріћхалъ въ Петербургъ, повидимому, лишь для того, чтобы тамъ быть похороненнымъ”. Бюргеръ, прибывъ въ Петербургъ въ мартћ 1726, скончался скоропостижно въ іюлћ того же года, не оставивъ по себћ никакихъ слћдовъ въ исторіи химіи.
Какъ смотрћли на химію въ это время, видно изъ письма Блюментроста къ Бюргеру: „Если васъ нћсколько затруднитъ химія, то можно ее откинуть, такъ какъ вы... будете въ особенности прилежать къ практической медицинћ”,— про себя онъ писалъ до своего пріћзда, что „вслћдствіе слабаго тћлосложенія, онъ не въ состояніи завћдывать химической лабораторіей”.
Найти Бюргеру преемника оказалось труднымъ дћломъ. Невольно спрашивается, что случилось бы, еслибы вмћсто Бюргера, этого химика безъ химіи, былъ назначенъ Генкель, этотъ опытный и прилежный практикъ и аналитикъ? Какое направленіе получило бы развитіе отраслей химіи и химической промышленности въ Россіи при его умћломъ содћйствіи? Чего достигъ бы Ломоносовъ, если бы судьба назначила ему въ учителя Генкеля еще въ Россіи? {377}
Въ числћ кандидатовъ на должность профессора химіи значится нћкій Г. Г. Шульце, профессоръ въ Альторфћ; о немъ мы скажемъ нћсколько словъ въ другомъ мћстћ.
Въ 1727 г. числится въ спискахъ, какъ профессоръ химіи, молодой Шталь (сынъ знаменитаго Шталя1).
Однако, новый профессоръ не пріћзжаетъ, а вмћсто него безъ приглашенія прибываетъ въ Россію (лћтомъ 1727 г.) Іоаннъ-Георгъ Гмелинъ (1709—1755) изъ знаменитой семьи ученыхъ. Прослуживъ вольноопредћляющимся при Академіи, оказавъ услуги по натуральной исторіи, составивъ каталогъ минералогическаго музея Академіи (которымъ впослћдствіи воспользовался Ломоносовъ), Гмелинъ былъ лишь въ 1731 г. объявленъ „профессоромъ химіи и натуральной исторіи”. Но работать по химіи ему не приходилось ни до, ни послћ своего назначенія, — не было лабораторіи, „а къ учрежденію ея не было никакой надежды”. Какъ химикъ, онъ оставилъ лишь нћсколько теоретическихъ обзоровъ, но какъ натуралистъ, онъ пріобрћлъ славу своими путешествіями по Сибири (1733-1743) и своей „Flora sibirica”.
Дабы химія въ это промежуточное время не вполнћ исчезла въ Академіи, въ 1736 г. былъ назначенъ адъюнктомъ химіи учитель академической гимназіи Хр.-Э. Геллертъ изъ Саксоніи (1711—1795), выбывшій, однако, въ 1744 г. Геллертъ прославился какъ металлургъ своими трудами Anfangsgrunde der metallurgischen Chemie (Leipzig, 1750) „Anfangsgrunde der Probircunst” (ib. 1755), и изслћдованіями no капиллярности и плотности сплавленныхъ металловъ (Comm. Acad. Petrop. XII, XIII; 1736 и 1737); имъ былъ впервые введенъ способъ холоднаго амальгамированія золота и серебра (извлеченіе таковыхъ изъ горной породы, 1750, 1790); онъ также составилъ таблицы химическаго сродства (1750).
Въ 1745 г. Гмелинъ передаетъ свою профессуру Мих. Вас. Ломоносову (1711—1765), который является первымъ „профессоромъ химіи”, отдћлившейся отъ медицины или натуральной исторіи. Жизнь этого необыкновеннаго человћка была недавно описана умћлою рукою {378} Б. Н. Меншуткина (Мих. Вас. Ломоносовъ. Спб. 1911). Нынћ, когда узкая спеціализація каждаго ученаго является результатомъ его борьбы за существованіе и работоуспћшности, мы лишь съ трудомъ можемъ понять ту универсальность и притомъ оригинальность, которыми характеризуется Ломоносовъ, этотъ гигантъ мысли и труда. Если въ древней Греціи семь городовъ спорили между собою, кому принадлежитъ слава слыть роднымъ городомъ Гомера, то нынћ въ Россіи болће семи наукъ спорятъ между собою о правћ и чести считать Ломоносова своимъ основателемъ или первымъ представителемъ. Его жизнь полна глубокаго трагизма, несмотря на внћшній успћхъ. Онъ былъ созданъ для того, чтобы сдћлаться реорганизаторомъ химіи вообще; онъ уже положилъ свою мощную руку на руль физическихъ наукъ и могъ бы дать имъ новое направленіе, — могъ бы создать новую эпоху въ химіи. Вмћсто этого, въ Россіи его экспериментальные химическіе труды, изслћдованія, задуманныя и начатыя имъ, не встрћтили пониманія и были забыты, и въ той мћрћ, какъ въ Россіи возрастала его слава, какъ „отца русской литературы”, уменьшалось его значеніе, какъ самостоятельнаго химикамыслителя, а въ исторіи химіи, въ химическомъ мірћ XIX вћка, имя химикa Ломоносова почти исчезло! Ломоносовъ это — синтезъ рћдкаго типа натуралиста, представляющаго собой поэта, философа, физикохимика и экспериментаторапрактика. Безпредћльностью своихъ интересовъ и универсальностью своихъ знаній онъ представляетъ собою воплощеніе русскаго народнаго генія со всћми его великими преимуществами, но и со всћми его недостатками. Онъ одинъ изъ первыхъ провозглашалъ, а въ химіи также и примћнялъ, принципъ, что все построено и происходитъ по мћрћ, вћсу и числу; но по отношенію къ самому себћ, къ своимъ научнымъ планамъ и начинаніямъ, онъ не соблюдалъ этой мћры, не соблюдалъ мудраго совћта древняго греческаго философа: знай мћру! Недаромъ древніе греки говорили, что послћдній и высшій даръ боговъ человћку — чувство мћры. Онъ одинъ изъ первыхъ, съ 1745 г., позналъ и старался приложить къ химіи и физикћ законъ сохраненія вћса (вещества), а равно законъ превращаемости силъ и сохраненія ихъ количества; по отношенію же къ самому себћ онъ, къ сожалћнію, не соблюдалъ этого закона, не соблюдалъ экономіи; расходуя свои силы, свою физическую и психическую энергію, чрезмћрно обильно и скоро, онъ не только истощилъ преждевременно огромный запасъ своей энергіи, но, прервавъ въ 1757 г. свои научныя химическія изслћдованія и оставивъ {379} ихъ въ незаконченномъ видћ, онъ тћмъ самымъ уменьшилъ „полезный коэффиціентъ”, т. е. значеніе и вліяніе своихъ экспериментальныхъ изслћдованій и плановъ по физической химіи... Въ противоположность духу того времени, онъ подчеркивалъ мысль, что польза химіи можетъ касаться не только практической жизни, реальныхъ потребностей государства и его населенія, но также идеальныхъ благъ человћка, способствуя „философскому познаванію тайнъ природы”. Химія, слћдовательно, должна быть наукою, а какъ наука, она имћетъ цћлью изученіе строенія вещества вообще и законовъ дћйствія тћлъ другъ на друга.
Съ такой возвышенной точки зрћнія Ломоносовъ предпринимаетъ преобразованіе химіи; въ 1741 г. онъ составляетъ свои „элементы математической химіи”, намћреваясь приложить законы механики къ химіи и превратить химію въ часть механики. Завершить эту реформу удалось лишь въ XIX вћкћ, благодаря классическимъ трудамъ Бертолле (1803) и Бертело (1879)! Затћмъ Ломоносовъ вырабатываетъ свою корпускулярную гипотезу матеріи, во многихъ точкахъ соприкасающуюся съ современной теоріею молекулъ и атомовъ. Для всесторонняго экспериментальнаго изученія матеріи и отдћльныхъ тћлъ необходима была химическая лабораторія, и, благодаря его трудамъ, въ 1748 г. открывается, наконецъ, при Академіи Наукъ первая въ Россіи химическая лабораторія. Въ 1752 г. онъ приступаетъ къ экспериментальному осуществленію своихъ завћтныхъ плановъ и производитъ закладку дћйствительно новаго зданія химіи, а именно физико-химіи. Мы сознательно называемъ его „отцомъ физической химіи”, такъ какъ имъ впервые выдвигается идея математической и физической химіи, какъ самостоятельной науки. Онъ опредћлилъ цћль и рамки этой новой науки, составилъ систематическій курсъ; онъ первый сталъ читать публичныя лекціи (экспериментальныя) по этому предмету; онъ же первый предпринялъ опытное изученіе фундаментальныхъ вопросовъ физико-химіи, останавливаясь по преимуществу на изученіи растворовъ. Ломоносовъ поставилъ себћ задачей „испытать все, что толькоможно измћрять, взвћшивать и опредћлять вычисленіемъ”; въ его опытахъ показаны „мћра, вћсъ и пропорціи”. Предвосхитивъ своими планами относительно физической химіи дћйствительное ея возникновеніе (около 1887 г.) на цћлое столћтіе, онъ опередилъ также основателя количественнаго періода химіи, знаменитаго Лавуазье, на десятилћтіе, не только примћненіемъ въ {380} своихъ опытахъ количественнаго метода и вћсовъ, но и своими, къ сожалћнію, незаконченными опытами надъ причинами окисленія металловъ (1756). Какъ химикъ, онъ интересовался практическими вопросами, изучилъ приготовленіе окрашенныхъ стеколъ и мозаичныхъ картинъ и написалъ „первыя основанія металлургіи” (1742, 1761—1763 г.). Какъ физикохимикъ, онъ занимался и физикою; въ 1744 г. онъ закончилъ переводъ экспериментальной физики
своего знаменитаго учителя Хр. Вольфа, чћмъ пріобрћлъ славу популяризатора физики и творца русскихъ физическихъ терминовъ. Въ 1745 г. онъ пишетъ свое „размышленіе о причинћ теплоты и холода”, въ которомъ, отрицая теплотворную матерію, создаетъ механическую теорію теплоты; въ 1748 г. онъ печатаетъ свою „гтопытку теоріи упругой силы воздуха”, въ которой излагаетъ основанія кинетической (механической) теоріи газовъ; онъ пишетъ свое „слово о происхожденіи свћта” (1756), „слово о явленіяхъ возлушныхъ, отъ электрической силы происходящихъ” (1753), „о рожденіи металловъ” (1757), „о твердости и жидкости тћлъ” (1760) и т. д.1)
Этотъ химикъромантикъ былъ созданъ для того, чтобы насадить въ Россіи науку; своимъ устнымъ словомъ онъ могъ бы воодушевить множество учениковъ, обильнымъ потокомъ своихъ идей онъ могъ бы создать центръ научной школы русскихъ изслћдователей... Лишь XX вћкъ сталъ отдавать должное генію Ломоносова, какъ физико-химика. О немъ заговорили въ западной {381} Европћ историки химіи, физики и естествознанія: Г. Кальбаумъ, П. Диргартъ, М. Шпетеръ, С. Гюнтеръ, В. Оствальдъ, Э. Когенъ, Даннеманнъ1).
Еще въ прошломъ году Э. Когенъ, амстердамскій физикохимикъ, писалъ, что нынћ мы всћ смотримъ съ удивленіемъ на научные труды Ломоносова, „такъ какъ они не только даютъ то, что Лавуазье далъ черезъ полстолћтія, но несомнћнно оказали бы свое вліяніе на ходъ развитія физической химіи и въ другихъ направленіяхъ, если бы они... не оставались совершенно неизвћстными”. А недавно А. Смитъ2), извћстный американскій химикъ, авторъ образцовыхъ учебниковъ химіи, заканчиваетъ свою оцћнкуЛомоносова — an early physical chemist, слћдующими словами: „Въ общей сложности открытіе Ломоносова сразу прибавило химика первой величины и личность удивительной силы къ ограниченной галлерећ величайшихъ людей міра” (Taking him all, the rediscovery of Lomonossoff has added at once a chemist of the first magnitude and a personality of marvellous force and range to the limited gallery of the World's very greatest men). Физико-химическіе труды Ломоносова появились въ 1910 на нћмецкомъ языкћ въ извћстной библіотекћ „Ostwald's Klassiker der exakten Naturwissenschaften” (№ 178).
Въ 1757 г. Ломоносовъ передалъ завћдываніе химической лабораторіею Ульриху-Христіану Сальхову, назначенному въ декабрћ 1755 г. профессоромъ химіи и его преемникомъ, — но уже въ 1760 г. Сальховъ выбылъ изъ состава Академіи Наукъ, что несомнћнно составляетъ наибольшую заслугу этого скромнаго труженика-врача. Трудно представить себћ бóльшій контрастъ: Ломоносовъ, съ одной стороны, и его преемникъ Сальховъ — съ другой. Причиною приглашенія Сальхова изъза границы въ Академію послужила работа, представленная имъ въ отвћтъ на задачу, объявленную Академіею Наукъ и касавшуюся отдћленія золота отъ серебра посредствомъ крћпкой водки; эта работа, напечатанная въ 1756 г., была удостоена {382} преміи лишь потому, что изъ присланныхъ вообще диссертацій „не найдено такой, въ которой бы оная задача совершенно была рћшена”1).
ПреемникомъЛомоносова и Сальхова является бывшій прусскійбергратъ, геологъ и дръ мед. ІоганнъГотлибъ Леманъ (род. въ 1700 г.2), назначенный уже въ 1761 г. профессоромъ химіи. Леманъ пользовался извћстностью, какъ плодотворный писатель и разносторонній химикъ, еще до своего назначенія членомъ Академіи Наукъ. Къ сожалћнію, его интенсивная научная дћятельность продолжалась лишь недолго: онъ погибъ въ январћ 1767 г. жертвою своихъ химическихъ опытовъ, вслћдствіе отравленія мышьякомъ отъ лопнувшей при нагрћваніи реторты съ мышьякомъ. Имъ были напечатаны многочисленные труды на нћмецкомъ, латинскомъ и французскомъ языкахъ, частью въ видћ монографій, частью въ мемуарахъ Берлинской Академіи, частью, съ 1764 г., въ Nov. Comm. Acad. Petrop. Ha русскомъ языкћ появились: Опытъ генеральной орографіи (1762), Пробирное искусство (нћм. изд. 1761, переводъ Гладкаго 1772 г.), Минералогія (нћм. изд. 1768, переводъ Нартова 1772 г.), Кобальтословіе (нћм. 1761—1762, пер. Хемнитцера 1778 г.), Разсужденіе о фосфорахъ (нћм. изд. 1750, переводъ Бабашина 1780 г.). Имъ впервые, въ видћ письма на имя Бюффона (1766), была описана сибирская красная свинцовая руда (PbCrO4); онъ изучалъ еще другіе минералы и природные продукты, напримћръ нефритъ (1766), синюю землю, найденную около Москвы и въ Лифляндской губ. (1767), и др.; онъ далъ минералогическое описаніе Старой Руссы и Ильменскаго озера (1768), составилъ трактаты объ изготовленіи кирпичей, о торфћ и нефтяныхъ угляхъ, о добываніи квасцовъ, объ испытаніи и очисткћ русской поваренной соли и т. д.
Въ 1765 г. Ломоносовъ скончался, и единственнымъ химикомъ при Академіи оказался Леманъ; попытки Академіи пригласить еще второго достойнаго химика въ лицћ извћстнаго въ свое время профессора Абоскаго университета П. Гадда (Peter Gadd, 1727—1797) не увћнчались успћхомъ. Но когда въ 1767 г. умеръ и Леманъ, каќедра химіи совершенно опустћла. Лишь черезъ три года, въ {383} 1770 г., былъ назначенъ временно исправляющимъ должность профессора химіи Эрикъ (Кирилъ Густавовичъ) Лаксманъ1) (1738—1796), по спеціальности — профессоръ экономіи: обћ должности онъ оставилъ въ 1781 г., вслћдствіе перећзда въ гор. Нерчинскъ на практическую службу. Этотъ первый финнъ, удостоившійся званія ординарнаго члена Академіи, является однимъ изъ наилучшихъ и интереснћйшихъ представителей типа академиковъпутешественниковъ и энциклопедистовь. По профессіи пасторъ, онъ въ 1762 г. перећхалъ изъ Финляндіи въ С.-Петербургъ, гдћ получилъ мћсто въ новооткрытомъ (1762) училищћ при нћмецкой церкви Св. Петра и Павла.
Состоя съ 1762—1764 г. учителемъ. онъ сблизился съ другимъ учителемъ Петропавловскаго училища, I. Бекманомъ, впослћдствіи профессоромъ Гёттингенскаго университета и знаменитымъ основателемъ технологической науки, сошелся также съ учеными академиками и пріобрћлъ извћстность въ качествћ ботаника. Въ 1764 г. онъ былъ избранъ корреспондентомъ Академіи и назначенъ нћмецкимъ пасторомъ въ гор. Барнаулъ. Въ этомъ мћстћ знаменитый Демидовъ построилъ въ 1739 г. заводъ; слћды древнихъ чудскихъ копей въ Колыванскихъ горахъ побудили его перевести туда съ Урала часть своихъ рабочихъ. Около І746 г. казна, выкупивши Демидовскіе рудники, перевела въ Барнаулъ мћстное управленіе, горную канцелярію и главный заводъ.
Плавильный заводъ около 1760 г. доставлялъ ежегодно болће 400 пуд. чистаго серебра и отъ 11 до 15 пуд. золота; прибавимъ, что въ 1887 г. въ барнаульской золотосплавочной лабораторіи было добыто чистаго золота около 379 пудовъ, стоимостью въ 51/2 мил. рублей. Наряду со своей пастырской службой Лаксманъ занимался также изученіемъ природы и горнаго дћла. Нћкоторымъ образомъ инструкціею для его научной дћятельности является письмо знаменитаго Линнея, который писалъ изъ Упсалы Лаксману въ Барнаулъ (1764): „... Провидћнье и судьба заставили Васъ отправиться въ такія мћста, куда еще почти никто не попадалъ съ открытыми глазами. Да ниспошлетъ Всевышній на Васъ благодать Свою, чтобы Вы могли видћть чудеса Его и открывать ихъ міру...”. Въ Барнаулћ онъ встрћтился съ {384} замћчательнымъ изобрћтателемъ Ив. Ползуновымъ (см. ниже): подъ руководствомъ этого опытнаго горнаго механика Лаксманъ пріобрћлъ первыя основанія заводской и горной науки; здћсь онъ впервые ознакомился съ приготовленіемъ стекла на городскомъ стеклянномъ заводћ, построенномъ горнымъ совћтникомъ Христіани, пріћхавшимъ около 1735 г. изъ Саксоніи; здћсь въ 1764 и 1766 г. Лаксманъ производилъ въ большомъ масштабћ свои опыты примћненія Глауберовой соли взамћнъ поташа при плавкћ стекла. Это открытіе, вызвавшее переворотъ въ производствћ стекла вообще, Лаксманомъ было использовано въ 1784 г. для устройства собственнаго стекляннаго завода у Талцынска, въ 40 верстахъ выше Иркутска.
Въ 1770 г. барнаульскій пасторъ былъ назначенъ на каќедру химіи, былъ, такъ сказать, „секуляризованъ”; въ томъ же году онъ принялъ на себя завћдываніе прежней ломоносовской лабораторіей.
На немъ лежала также обязанность быть наставникомъ химіи въ соединенной съ Академіею гимназіи.
Какъ высоко понималъ Лаксманъ свою задачу, видно, напримћръ, изъ его письменнаго отзыва (1774 г.), даннаго по поводу проекта о командировкћ одного изъ его учениковъ (Ќед. Моисеенкова, род. 1754 г., съ 1779 адъюнктъ, ум. 1781) въ заграничные университеты для обученія горному дћлу: „Вслћдствіе познаній по химіи, которыя Моисеенковъ пріобрћлъ у меня, онъ теперь въ состояніи безъ того руководства, насколько оно обыкновенно сообщается при заграничныхъ университетахъ, заниматься самостоятельно. Также не послужило бы къ особенной чести моей, еслибъ нашимъ студентамъ, для изученія химіи, нужно было еще ћхать заграницу...”. Невольно напрашиваются сравненія между академическими пріемами этого давняго времени и современными.
Интересно еще то обстоятельство, что Лаксманъ давалъ уроки также въ сухопутномъ кадетскомъ корпусћ, а именно по естественной исторіи и химіи. Равнымъ образомъ онъ участвовалъ въ устроенныхъ по иниціативћ С. Г. Домашнева (съ 1776—1782 г. состоявшаго директоромъ Академіи Наукъ) популярныхъ публичныхъ лекціяхъ. Въ продолженіе нћсколькихъ лћтъ (1776—1779) Лаксманъ, а также и другіе академики, въ мартћ и апрћлћ читали эти лекціи, которыя охотно посћщались аристократіею; въ частности {385} Лаксманъ читалъ два раза въ недћлю, по химіи и минералогіи, сопровождая свои лекціи многочисленными опытами. Это, кажется, первый вообще въ Россіи опытъ публичныхъ систематическихъ курсовъ экспериментальной металлургической химіи. Прибавимъ, что Лаксманъ читалъ понћмецки.
Какъ химикъ, Лаксманъ былъ практикъсамоучка. Интересно и поучительно для исторіи открытій прослћдить, какими путями этотъ совершенно неопытный практикъ уже въ началћ своихъ занятій химіею (въ 1764—66 г.) натолкнулся на открытіе новаго метода добыванія стекла. Онъ самъ пишетъ: „Искуснћйшіе химики, и въ особенности химики парижской академіи, принимаютъ за математическую истину, что всћ соли, содержащія купоросную кислоту, будто негодны для производства стекла”.
Поташъ, употреблявшійся до этого времени въ стеклянномъ производствћ, добывался изъ дровъ и, слћдовательно, являлся косвеннымъ продуктомъ сжиганія и истребленія лћсовъ. Съ цћлью сбереженія послћднихъ Лаксманъ, имћя въ виду обширныя залежи природной соли сибирскихъ озеръ, прибћгаетъ къ содћйствію флогистона, горючаго начала по теоріи Шталя. При сжиганіи дерева, т.-е. при дћйствіи горючаго вещества, изъ дерева получается поташъ, пригодный для стеклодћлія; не получится ли при дћйствіи зажженнаго горючаго вещества, т.-е. угля, на озерную (Глауберову) соль также пригодное для стеклодћлія основное вещество? И дћйствительно, „вћруя во флогистонъ” въ юности своей, Лаксманъ открылъ этотъ методъ, а въ 1795 году, пишетъ онъ, „въ болће спокойномъ возрастћ могу хладнокровно согласиться съ противниками флогистона въ томъ, что купоросная кислота, заключавшаяся въ горькой соли, при участіи теплоты соединяетъ свой жизненный газъ (т. е. кислородъ) съ угольнымъ порошкомъ и такимъ образомъ отдћляется отъ своего основного вещества”. Лаксманъ своей неспокойной и многострадальной жизнью, столь богатой научными открытіями и успћхами въ области естествознанія, напоминаетъ другого пастора, своего современника и знаменитаго химика-естествоиспытателя Пристли (1733—1804), который, также вћря въ флогистонъ, напрасно осмћиваемый многими, сдћлалъ свои безсмертныя открытія въ химіи. Укажемъ еще на другого русскаго химика, славнаго Ловица, сдћлавшаго при помощи ученія о флогистонћ свое открытіе адсорбціонной способности углерода. По этому {386} поводу прибавимъ, что ученіе о флогистонћ само по себћ, даже въ глазахъ одного изъ величайшихъ умовъ, И. Канта, считалось однимъ изъ выдающихся открытій въ области естествознаній вообще; давши въ рукахъ многихъ талантливыхъ химиковъ множество крупныхъ открытій, оно въ нћкоторомъ родћ подготовило почву для ученія объ энергіи и отжило свой вћкъ, когда природу флогистона стали изслћдовать не посредствомъ философіи, а вћсами.
Лаксману, долго жившему въ Сибири и основательно изучившему этотъ край отъ Урала до Охотскаго моря, удалось, наконецъ, осуществить свою мечту1): въ 1795 г. онъ предпринялъ путешествіе изъ Петрограда въ Японію съ ученою и торговою цћлью. Однако, въ 118 верстахъ отъ Тобольска онъ внезапно скончался въ пути (5 января 1796). Число напечатанныхъ трудовъ Лаксмана по химіи незначительно: О квасцахъ и содћ изъ Оренбурга (1769), О маслћ изъ Amygdalus nana (1771), Серебряная роговая руда съ Алтая (1774), О нерчинскихъ рудникахъ (1781), О съћдобной землћ (1793), О селитрћ (1795), Новый способъ плавки стекла (1795). Бóльшая часть его трудовъ относится къ естественной исторіи и техническимъ вопросамъ. Георги называетъ его лћнивымъ писателемъ; но этотъ упрекъ скорће есть похвала; дћйствительно, Лаксманъ, противъ тогдашняго обычая2), не опубликовалъ ни толстыхъ компиляцій, ни подробныхъ описаній своихъ путешествій, но зато у него хватило времени наблюдать, собирать и3) открывать столь много новаго, что его имя пережило столћтія. Въ честь его названы въ ботаникћ разные виды растеній „Laxmannia”, въ энтомологіи — „Grylus Laxmanni”, въ минералогіи — минералъ „Laxmannit”, {387} въ географіи — мћстность около Байкала „Лаксмана” и „Лаксмановъ проливъ”.
Послћ ухода Лаксмана изъ Академіи, на должность академика химіи былъ назначенъ въ 1783 г. бывшій фармацевтъ, съ 1776 г. адъюнктъ Академіи, Іог. Готл. Георги1) (род. 1729 г. въ Помераніи, ум. 1802 г. въ Петрогр.). Какъ химикъ, онъ не отличался ни плодотворностью, ни оригинальностью; главнћйшіе его труды касаются анализа и описанія русскихъ природныхъ продуктовъ: натра (1777), соли (1781), мрамора (1782), Невской воды (1784), „туфяного камня” изъ Лифляндіи (1791), „возгарающей земли” изъ Эстляндіи (1791). Но Георги прославился, какъ химикъ-путешественникъ; онъ съ искусствомъ и любовью срисовывалъ всякіе виды, наряды и т. д. и, объћхавъ всћ отдаленныя восточныя провинціи Россійской Имперіи, частью съ экспедиціей Палласа и Фалька, съ 1770 до 1774 г., онъ сдћлалъ на своемъ 40000верстномъ пути весьма цћнныя наблюденія; со всћхъ этихъ отдаленныхъ мћстъ онъ снялъ хорошія карты и изготовилъ рисунки нарядовъ и типовъ видћнныхъ имъ восточныхъ народовъ. Въ 1775 г., вернувшись въ Петроградъ, онъ началъ было издавать описаніе своихъ путешествій подъ заглавіемъ „Открываемая Россія”. Онъ оставилъ эту идею и приступилъ къ составленію „Описанія всћхъ въ Россійскомъ Государствћ обитающихъ народовъ” (1776; второе изданіе русскаго перевода вышло въ 1799 г.), въ которомъ онъ использовалъ результаты своихъ путешествій, а равно всћхъ своихъ предшественниковъ. Въ 1797—1802 г. онъ издаетъ свой послћдній капитальный трудъ: „Geographische, physikalische und naturhistorische Beschreibung des Russischen Reiches (3 тома, съ дополненіями). Кромћ того, имъ были переведены: Исторія о желћзћ Ринмана, Минералогія Брюниха и др.
Одновременно съ Георги академикомъ по химіи состоялъ (съ 1787 г.) Никита Соколовъ (1748—1795). {388}
Питомецъ Академіи Наукъ, онъ по окончаніи курса былъ отправленъ съ Палласомъ въ путешествіе; по возвращеніи онъ былъ командированъ (1774) для окончанія наукъ въ Лейденъ и Страсбургъ, гдћ и получилъ степень доктора медицины. Въ 1783 г. онъ былъ назначенъ въ адъюнкты химіи; представленная имъ диссертація на это званіе называется: De tractatione metallorum cum sulphure; въ томъ же году имъ была представлена еще другая химическая работа: De natura arsenici, а въ 1784 r.: Optima methodus parandi amalgama cupri; всћ онћ напечатаны въ Act. Acad. Sc. Imp. Petrop. I, 193 и 209, 247 (1786). O значеніи этихъ работъ съ современной точки зрћнія не можетъ быть двухъ мнћній: авторъ этихъ экспериментальныхъ работъ какъ бы принадлежитъ къ періоду Бехера, а не къ концу XVIII вћка; онъ разсматриваетъ мышьякъ какъ принципъ или духъ простой сћры; онъ предполагаетъ, что въ природћ существуетъ не только твердый, но и жидкій мышьякъ, что мышьякъ есть не что иное, какъ сћра или соляная кислота, загрязненная горючей металлической землею, и т. д.;какъвидимъ, дћло идетъ о защитћ или о возобновленіи принциповъ ятрохимиковъ XVI и XVII вћка. Кромћ того Соколовъ1) напечаталъ статью „О пользћ и употребленіяхъ можжевельника” съ медицинской точки зрћнія, 1784 и „О дћлћ молочнаго сахара и пользћ онаго” 1784; въ этой послћдней, весьма дћльной статьћ авторъ обращаетъ вниманіе на обиліе скота и коровьяго молока въ Россіи и на неразумное употребленіе послћдняго: сыворотку „у насъ или отдаютъ телятамъ и коровамъ для пойла, или иногда безъ всякаго употребленія выливаютъ на землю”; взамћнъ такого способа Соколовъ рекомендуетъ по примћру Швейцаріи добывать изъ сыворотки молочный сахаръ. Имъ была еще напечатана „Рћчь о пользћ химіи” (1786), статья „О дћланіи аглинскаго фосфора” (1787), „Описаніе пріисковъ земляного угля въ калужскомъ намћстничествћ” (1794). Послћдняя работа появилась уже послћ выхода Соколова въ отставку (въ 1792) „по причинћ разстроившагося по званію своему отъ химическихъ трудовъ здоровья”, причемъ завћдываніе лабораторіей было передано адъюнкту Захарову. Бблынее значеніе имћютъ труды Соколова по популяризаціи химіи; по порученію Директора Академіи княгини Дашковой онъ закончилъ (1788) переводъ сочиненія Erxleben'a „Anfangsgründe der Chymie”. Этотъ переводъ сдћланъ {389} хорошо и имћетъ цћнное значеніе благодаря многимъ, весьма умћло составленнымъ русскимъ химическимъ названіямъ. Соколовъ участвовалъ также върусскомъ переводћ „естественной исторіи” знаменитаго Бюффона (1794), a no порученію княгини Дашковой читалъ публичныя лекціи по химіи, которыя онъ сопровождалъ многочисленными опытами, пользуясь руководствомъ своего страсбургскаго учителя, извћстнаго химика и медика lac. Reinh. Spielmann'a (1722—1783).
Преемниками Соколова были Як. Д. Захаровъ (1775—1836) и Товій Ловицъ (1757 — 1804).
Первый изъ нихъ, Захаровъ1) ,учился въ академической гимназіи, былъ командированъ въ 1785 г. (одновременно съ Севергинымъ) въ Геттингенскій университетъ для дальнћйшаго усовершенствованія, въ 1790 г. по представленіи диссертаціи „Specimen chemicum de defferentia et affinitate acidi nitrosi...”, назначенъ адъюнктомъ, a въ 1798 г. произведенъ въ академики по части общей химіи. Онъ написалъ слћдующія статьи: „О приготовленіи чистћйшей и наикрћпчайшей азотной кислоты” (1797), „О законахъ теплоемкости тћлъ” (1804, 1808), „О происхожденіи свћта отъ тренія различныхъ тћлъ” (1805), „Описаніе весьма чувствительной магнитной стрћлки” (1806), Раппортъ въ Имп. Акад. Наукъ о послћдствіи воздушнаго путешествія 1804 г. (1806), Разсужденіе о Россійскомъ химическомь словозначеніи (1810), О разложеніи воды посредствомъ раскаленнаго желћза (1811), О полюстровской минеральной водћ (1816), Разложеніе Екатеринбургскаго наждака (1817), Новые опыты разложенія алмаза (1815), и, кромћ того, еще другіе мелкіе рефераты по технологіи и лћсоводству. Имъ была издана на русскомъ языкћ „антифлогистическая химія” Гиртаннера (1801), что — вмћстћ съ его трудами по выработкћ русской химической номенклатуры — составляетъ его главную заслугу и способствовало водворенію новой теоріи Лавуазье въ Россіи. Захаровъ участвовалъ также въ чтеніи публичныхъ курсовъ химіи, устроенныхъ по иниціативћ княгини Дашковой; хотя онъ читалъ химію по системћ Лавуазье, но, повидимому, онъ самъ еще не успћлъ усвоить основаній новой химіи, такъ какъ княгиня Дашкова „предложила ему избрать другую отрасль естествознанія, наиболће ему сподручную”2). {390}
Если научная творческая сила Захарова не отличалась ни особой интенсивностью, ни оригинальностью, то, въ противопоюжность ему, Ловицъ долженъ быть отнесенъ къ числу великихъ химиковъ.
Товій Егоровичъ Ловицъ (род.въ 1757 г. въ Геттингенћ) пріћхалъ десятилћтнимъ мальчикомъ въ Россію со своимъ отцомъ, извћстнымъ математикомъ Г. М. Ловицемъ, назначеннымъ въ 1767 г. профессоромъ астрономіи при Академіи Наукъ. Когда Г. Ловицъ въ 1769 г. предпринялъ астрономическую экспедицію къ Каспійскому морю, съ нимъ поћхалъ нашъ будущій химикъ; но члены экспедиціи были взяты въ плћнъ шайками Пугачева, приказавшаго казнить Ловица (1774). Молодой Ловицъ и другіе члены экспедиціи случайно спаслись бћгствомъ и вернулись въ Петербургъ (1775). Товій Ловицъ воспитывался въ академической гимназіи; изучивъ практику аптекарскаго дћла въ придворной аптекћ, онъ былъ отправленъ въ Геттингенскій университетъ. По возвращеніи въ Россію (1784), онъ получилъ мћсто въ лабораторіи Императорской Главной Аптеки. Въ 1787 г. онъ былъ избранъ членомъкорреспондентомъ, въ 1790 г. адъюнктомъ по химіи, а въ 1793 г. ординарнымъ академикомъ химіи, въ каковой должности онъ умеръ въ Петроградћ (26го ноября 1804 г.). По оригинальности своихъ научныхъ работъ, по образцовому экспериментальному выполненію ихъ и по научному значенію добытыхъ имъ новыхъ данныхъ Т. Ловицъ долженъ быть признанъ наилучшимъ химикомъ-экспериментаторомъ XVIII вћка въ Россіи. Его работы касаются въ равной мћрћ аналитической химіи, физической и органической химіи. Слћдуя духу того времени и традиціямъ Академіи Наукъ, онъ занимался и вопросами технической химіи; но въ противоположность другимъ химикамъ, его предшественникамъ при Академіи, онъ не участвовалъ ни въ путешествіяхъ, ни въ переводахъ химическихъ иностранныхъ учебниковъ; онъ прославился не множествомъ своихъ печатныхъ трудовъ и не популяризаторской дћятельностью, но оригинальностью своихъ дћйствительно важныхъ открытій, ке потерявшихъ еще значенія даже въ двадцатомъ вћкћ. Уже первое его открытіе гарантируетъ ему прочную славу въ исторіи химіи: въ 1785 г. онъ открылъ способность угля адсорбировать растворенныя вещества (Crell's Chem. Annal. 1786 I, 293). Всћмъ химикамъ {391} извћстно, какое практическое значеніе эти явленія адсорбціи при помощи угля пріобрћли въ лабораторной и фармацевтической практикћ, а равно въ крупной химической промышленности, для очистки спирта, сахара, солей и т. д.. Но и съ теоретической точки зрћнія открытая Ловицемъ область явленій адсорбціи имћетъ важное значеніе. Какія силы удерживаютъ вещества въ углћ? Химическія ли или механическія? Твердые ли это растворы? Вотъ рядъ вопросовъ, еще не рћшенныхъ въ XX вћкћ.
Въ физико-химическихъ наукахъ мы довольно часто замћчаемъ любопытное явленіе: открываются новыя и важныя истины на основаніи „невћрныхъ” предположеній и измћреній. Такой фактъ, интересный для біологіи генія изобрћтателей, мы наблюдаемъ и въ жизни Ловица, а именно, открытіе адсорбціонной способности угля. Когда Ловицъ состоялъ аптекаремъ придворной аптеки, онъ занимался приготовленіемъ большихъ количествъ винной кислоты; сгущая ея растворы, онъ замћтилъ, что, даже при слабомъ огнћ, эти растворы бурћютъ и даютъ окрашенные кристаллы. Отчего это происходитъ? Какъ можно устранить подобное явленіе? Виновникомъ оказывается флогистонъ... „Такъ какъ бурый цвћтъ нашей жидкости зависитъ отъ горючаго (флогистона), освободившагося вслћдствіе легкаго разложенія этой (винной) кислоты...” и такъ какъ уголь обладаетъ способностью „не отпускать своего горючаго принципа (флогистона) въ замкнутомъ сосудћ (заключенномъ отъ доступа свободнаго воздуха) даже при наивысшихъ градусахъ огня, можно было предполагать, что онъ (уголь) будетъ способенъ притягивать къ себћ горючаго принципа, если онъ встрћчаетъ таковой гдћ-нибудь”, — вслћдствіе этого прибавленный къ раствору уголь долженъ соединяться съ освободившимся отъ кислоты горючимъ (флогистономъ) и дать при кристаллизаціи безцвћтные кристаллы.
Геній и при помощи неудовлетворительныхъ теорій открываетъ новые источники познаній! (См. также о Лаксманћ).
Другая великая область, открытая Ловицемъ, также касается физической химіи: это — явленія кристаллизаціи. Исходной точкой при этомъ явилась открытая имъ (1789) кристаллическая уксусная кислота (acidum aceticum glaciale no Ловицу). Изучая явленія кристаллизаціи этого новаго тћла, онъ открываетъ явленія пересыщенія и переохлажденія, прививки и выращиванія кристалловъ; онъ открываетъ далће дигидратъ поварекной соли NaCl+2Н2O (1792), кристаллическіе {392} ћдкій натръ (1792) и ћдкое кали КОH + 2Н2O (1792) Фундаментальныя открытія Ловица въ области кристаллизаціи впослћдствіи приписывались Ле-Блану (1802), Гэ-Люссаку (1813), Клеману и Дезорму (1814) и т. д., изучавшимъ эти явленія послћ Ловица. Въ связи съ этой областью Ловицъ впервые примћняетъ микроскопическій анализъ для распознанія кристалловъ (1798).
Явленія переохлажденія наводятъ Ловица на изученіе явленій искусственнаго холода (1792-3): примћняя впервые кристаллическое ћдкое кали или хлористый кальцій СаСl2.6Н2O со снћгомъ, онъ открываетъ охладительныя смћси, дающія наинизшую температуру —50°С. Въ органической химіи Ловицъ прославился, кромћ открытія кристалловъ уксусной кислоты съ точкою плавленія +16°С, открытіемъ абсолютнаго спирта (1796) при помощи прокаленнаго поташа, а также чистаго безводнаго эфира (1796) съ помощью прокаленнаго хлористаго кальція. Для опредћленія чистоты обоихъ тћлъ онъ примћняетъ удћльный вћсъ.
Въ 1792 Ловицъ открылъ кристаллизацію винограднаго сахара и вмћстћ съ тћмъ существованіе другого, трудно кристаллизующагося сахара (левулезы). Онъ впервые предпринимаетъ хлорированіе уксусной кислоты (1793), открывъ при этомъ одну жидкую (т.-е. монохлоруксусную кислоту Леблана 1844 г.) и одну твердую кислоту (т.-е. трихлоруксусную, открытую Дюма въ 1830 г.); а въ 1797 онъ дћлаетъ смћлую попытку синтеза сахара (возстановленіемъ уксусной кислоты при помощи фосфора), — попытку, увћнчавшуюся успћхомъ лишь черезъ 100 лћтъ въ рукахъ Эмиля Фишера.
Какъ химикъ-аналитикъ, Ловицъ далъ (1795) способъ отдћленія барія отъ стронція и кальція, основанный на растворимости солей SrCl2 и СаСl2 въ абсолютномъ спиртћ и нерастворимости въ немъ хлористаго барія; онъ первый указалъ на окрашиваніе пламени въ красный цвћтъ солями кальція; онъ же открылъ способъ растворенія природныхъ силикатовъ мокрымъ путемъ (1799), а именно, при помощи нагрћванія съ ћдкой щелочью. Попутно имъ были произведены анализы различныхъ русскихъ минераловъ и природныхъ продуктовъ.
По технической химіи имъ былъ напечатанъ рядъ статей въ Трудахъ Вольн. Экон. Общ. (съ 1789 г.), Новыхъ Ежемћсячныхъ {393} Сочин. (съ 1788 г.), Учен. Извћст. (съ 1802 г.), а равно въ монографіяхъ: Опыты очищенія грубой селитры угольями (1792), Показаніе новаго способа изготовлять уксусную кислоту (1802), Апzeige eines neuen Mittels Wasser... trinkbar zu machen (1790), Bemerkungen uber die Reinigung des Kornbrantweins durch Kohlen (1794).
Его научные труды появились въ Nov. Act. Petropol. и въ Crell's Ann. d. Ch.1)
Еслибы Россіи ХVІІІ вћка суждено было имћть нћсколькихъ Ломоносовыхъ и Ловицовъ, или лишь еще одного химика, который соединилъ бы дальновидные планы Ломоносовафилософа съ терпћливою изобрћтательностью Ловица-экспериментатора, то химическая наука въ Россіи сразу поднялась бы на одинаковый уровень съ западноевропейской наукой.
Какова была отличительная черта и каковы были главные результаты химическихъ изслћдованій этого періода?
Дћятельность химиковъ Академіи опредћлялась условіями русской культуры, или вообще духомъ времени. Естествознанію въ самомъ широкомъ смыслћ оказывалось покровительство какъ по теоретическимъ, такъ и по практическимъ и патріотически-государственнымъ соображеніямъ, — ради процвћтанія государства. Вопросы чистой науки не стояли на первомъ мћстћ: не матерія по себћ, а матерія, встрћчаемая въ Россіи, составляла главную задачу изслћдованія. Химики-академики не должны были заниматься рћшеніемъ научныхъ вопросовъ химіи: ихъ занятія имћли въ виду практическую пользу Русскаго Государства. Какъ химики-путешественники, они должны были изучать европейскую и въ особенности азіатскую Россію и всћ три царства природы въ ней; въ качествћ естествоиспытателей они открывали и изслћдовали природныя и минеральныя богатства Россіи, способствуя эксплуатаціи таковыхъ насажденіемъ или усовершенствованіемъ химической промышленности. Такъ, напримћръ, въ 1757 г. Канцелярія Академіи пишетъ преемнику Ломоносова, Зальхову, чтобы онъ „свои ученыя розысканія по химіи употреблялъ больше на такія вещи, кои натурою производятся въ предћлахъ Россійской Имперіи”. {394}
Результатомъ трудовъ этихъ химиковъпрактиковъ было открытіе новыхъ мћсторожденій уже извћстныхъ минераловъ и металловъ; такъ, напримћръ, въ 1728 г. былъ открытъ въ Сибири азбестъ; интересно еще то обстоятельство, что онъ попалъ въ Петербургъ въ видћ тканой матеріи, т.-е. „достаточно большого куска полотна, приблизительно въ 1 аршинъ длины и ширины, сдћланнаго изъ азбеста”1). Были открыты также и новые минералы, напримћръ, красная свинцовая руда (1766), алтаитъ, хромистый желћзнякъ, плюмбостибъ и т. д., и произведены анализы минераловъ, напримћръ, Леманомъ, Биндгеймомъ, Моделемъ, Лепехинымъ, Георги, Германомъ, Ловицемъ. Наряду съ академиками-химиками, минеральныя богатства Россіи подробно изслћдовали также академикиминералоги, напримћръ Германъ, Ферберъ, Севергинъ. Были открыты и описаны минеральныя (цћлебныя) воды. Въ 1714 г. „молотовой работникъ” Иванъ Ребоевъ2) открываетъ цћлебныя воды (желћзныя) въ Олонецкой губерніи, — на челобитной Ребоева рукою Великаго Петра написано: „за объявленіе сего, что первый знакъ лћченія на немъ (т.-е. на Ребоевћ, страдавшемъ до этого сердечною болћзнію) означился, свобождается онъ и домъ его отъ всћхъ работъ и податей на мћдныхъ заводахъ”.
Петроградскій полевой медикъ Г. Ремусъ далъ въ 1720 г. первое научное описаніе этихъ водъ. Г. Шоберъ публикуетъ въ 1760 г. описаніе теплицъ при рћкћ Терки (Астраханской губ.) и сћрнаго ключа у Сергіевска (недалеко отъ Самары). Открываются цћлебные источники въ Барбернћ и Балдонћ около Митавы (1761), анализъ которыхъ производится Шиманомъ (Митава, 1799). Уже раньше Модель (въ 1763 г.) сообщилъ о первомъ „разысканіи воды рћки Невы”, за нимъ Георги3) (1784) опубликовалъ новое „химическое изслћдованіе Невской воды”. Наконецъ, Георги издалъ систематическій указатель всћхъ извћстныхъ въ Россіи и Азіи минеральныхъ, горькихъ, соляныхъ, сћрныхъ и др. источниковъ (1798—1799)4).
Зарождается большой запасъ новыхъ данныхъ и свћдћній, зарождается и русская химическая литература, какъ самостоятельная, такъ и переводная. Однимъ изъ первыхъ является Ив. Шлаттеръ1) (род. въ 1708 г. въ Берлинћ, пріћхалъ въ 1719 г. въ {395} Россію, умеръ 1768 г.). Занявъ должность президента Бергъ-Коллегіи и Монетнаго Двора, онъ открылъ искусство изготовлять желтую мћдь, завелъ особую лабораторію въ 1745 г., когда въ Сибирскихъ Алтайскихъ горахъ были открыты серебряные рудники, и издалъ много цћнныхъ учебниковъ по металлургіи и монетному дћлу: Ариќметическая табель о всћхъ пробахъ золота и серебра... Спб. 1739; Описаніе при монетномъ дћлћ потребнаго искусства... Спб. 1739; Задачи, касающіяся до монетнаго искусства. Спб. 1754—1758; Обстоятельное наставленіе рудному дћлу. Спб. 1760; Обстоятельное описаніе руднаго плавильнаго дћла. Спб. 1765—1767 и др. Кромћ того имъ оставленъ въ рукописи переводъ: „Начальное основаніе пробирной науки” Крамера, а „Минералогія” Валерія, имъ переведенная, вышла въ Петроградћ, въ 1763. Въ своемъ „Обстоятельномъ описаніи” онъ посвящаетъ особую главу „каменнымъ углямъ ио добываніи оныхъ”. Въ 1698 г. былъ открытъ каменный уголь на берегахъ Донца. Въ 1768 г. Штелинъ (труды ВольноЭконом. Общ. VIII, 221) публикуетъ изслћдованіе „О пріисканіи каменнаго угля въ Россійской Имперіи, а особливо въ Новгородской губерніи”, a Рычковъ (ib. IX, 83) — О каменномъ углћ (въ Оренбургской губ).
Металлургіи посвященъ и другой оригинальный трудъ, a именно „Первыя основанія металлургіи” Ломоносова (1761—1763 г.), а пробирному дћлу — переводъ труда Лемана „Пробирное искусство” (1772). Въ чистой химіи еще не пришло время для созданія русскихъ оригинальныхъ учебниковъ и руководствъ: къ сожалћнію, математическая и физическая химія Ломоносова остались незаконченными! Поэтому всћ учебники по чистой химіи были переводными, и вмћстћ съ тћмъ изученіе химіи въ Россіи въ XVIII вћкћ было основано на переводной литературћ. Назовемъ: Макера „Начальныя основанія умозрительной химіи” (1774/5 и 1791), его же „Химическій словарь” (1788), Бургаве „Элементы химіи” (1788), Эркслебена „Начальныя основанія химіи” (1788), Жакена „Химія” (1795), „Химическая философія” (1799), Гиртаннера „Начальныя основанія антифлогистической химіи” (1801). И въ этомъ дћлћ главная заслуга принадлежитъ Академіи Наукъ: по ея иниціативћ были сдћланы почти всћ упомянутые переводы, и она же ихъ издала. Частная предпріимчивость почти отсутствовала въ то время.
Характерно еще одно обстоятельство. Эпоха конца XVIII и начала XIX вћка, это — годы борьбы стараго ученія о флогистонћ {396} съ новымъ ученіемъ Лавуазье. Виднћйшіе представители химіи въ Россіи, напримћръ Лаксманъ, Соколовъ, Ловицъ, а равно Германъ — явные приверженцы ученія о флогистонћ. Вслћдствіе этого мы наблюдаемъ слћдующее: классическій учебникъ Лавуазье Traite elementaire de Chimie (1789) не находитъ переводчика въ Россіи, a самъ Лавуазье не встрћчается въ числћ членовъ-корреспондентовъ или почетныхъ членовъ Императорской Академіи Наукъ!
Болће всћхъ отличается своей литературной дћятельностью по прикладной химіи академикъ-минералогъ Вас. Мих. Севергинъ1) (1765—1826). По своей феноменальной продуктивности и по удивительной разносторонности разработанныхъ имъ вопросовъ, относящихся къ чистой и аналитической, по преимуществу технической химіи, его можно отнести къ числу полезнћйшихъ русскихъ химиковъ: своими трудами Севергинъ положилъ основаніе русской химической технологіи, какъ науки. Какъ сынъ „вольнаго человћка”, придворнаго музыканта, онъ воспитывался въ академической гимназіи и академическомъ университетћ. Двадцати лћтъ онъ уже былъ командированъ (въ 1785 г.) за границу, въ Гёттингенскій университетъ; онъ успћшно занимался тамъ 31/2 года у знаменитыхъ профессоровъ Кестнера, Гмелина и Лихтенберга. По возвращеніи въ Россію (въ 1789 г.) былъ подвергнутъ испытанію въ комиссіи, состоявшей изъ академиковъ-натуралистовъ Палласа и Лепехина, a no химіи и минералогіи у Георги и Крафта. Испытаніе увћнчалось полнымъ успћхомъ; экзаменъ производился два дня (27 и 28 марта 1789 г.). Затћмъ Севергинъ представилъ 14 мая еще разсужденіе „Specimen mineralogicum de natura et origine basaltis” — по минералогіи, a другое (8 іюня 1789 г.) подъ заглавіемъ „Specimen chemicum de natura et differentia salium alcalinorum” — по химіи. Обћ работы удостоились большой похвалы. Практическій результатъ этого испытанія и этихъ работъ сказался уже 18 іюня 1789 г., когда Севергинъ, по предложенію директора Академіи Дашковой, единогласно былъ избранъ адъюнктомъ по каќедрћ минералогіи. Въ 1793 г. онъ былъ возведенъ въ званіе академика минералогіи. Дополнимъ эту бытовую картину еще нћкоторыми данными, чтобы дать возможность сопоставить современныя испытанія на ученыя степени, напримћръ, магистра, съ {397} требованіями, предъявлявшимися въ концћ XVIII вћка въ Академіи Наукъ. Въ чемъ заключался, напримћръ, экзаменъ по химіи, минералогіи и физикћ? Задано было всего 11 вопросовъ по этимъ наукамъ. Чтобы характеризовать ихъ, я приведу нћсколько примћровъ.
Вопросъ 1. Обосновано ли раздћленіе металлическихъ субстанцій на semimetalla, metalla imperfecta et perfecta? или оно не нужно? и почему?
Вопросъ 2. Въ сколькихъ состояніяхъ встрћчаются мегаллы въ горахъ? какъ руды и т. д.
Вопросъ 3. Resinae minerales, bitumina, succinum etc. минеральнаго или растительнаго происхожденія? Почему одно или другое?
Вопросъ 5. Какія основныя земли принимаетъ современная химія?
Вопросъ 6. Постоянны ли основныя земли (Grunderden, terrae primitivae)? или могутъ ли онћ быть превращаемы одна въ другую? Какое изъ обоихъ мнћній подтверждается природою?
Вопросъ 9. Какъ добывается чистая минеральная щелочь изъ Глауберовой соли?
Вопросъ 11. Какія химическія причины для теплыхъ источниковъ?
Комментарій къ этимъ — съ современной точки зрћнія — элементарнымъ вопросамъ излишенъ.
Научная дћятельность Севергина характеризуется идеальнымъ стремленіемъ оказать пользу отечеству; онъ стремится самъ познавать и другихъ научать познавать „россійскіе минералы, россійскіе способы ихъ добыванія, приготовленія и обрабатыванія, кои всћ во многомъ разнятся отъ иностранныхъ”... „пространное государство россійское столь изобилуетъ различными природы произведеніями, что требуетъ токмо поощренія и рукъ трудолюбивыхъ для доставленія ихъ въ достаточномъ количествћ въ замћну иностраннымъ”. Онъ выработалъ для себя такую программу жизни: изученіе родины, объединеніе минералогіи и химіи, приложеніе обћихъ къ вопросамъ жизни и созданіе химической технологіи. Для достиженія этой цћли онъ самъ составляетъ руководства по минералогіи (1798), пробирному искусству (1801), испытанію минеральныхъ водъ (1800), испытанію химическихъ лћкарственныхъ произведеній (1800), пишетъ наставленія о добываніи минеральной щелочной соли въ Россіи (1796) и о лучшихъ способахъ добывать селитру въ Россіи (1812) и т. д. Онъ проявляетъ и очень интенсивную {398} дћятельность, какъ переводчикъ; имъ переведены: Наставленіе о плавленіи рудъ — Жансана (1806), О ископаемыхъ тћлахъ — Кирвана (1791), Начальныя основанія физики — Кузена (1800), Химическія основанія ремеслъ и заводовъ — Гмелина (1803), Словарь химическій — Луи Кадета (1810); подъ его руководствомъ издается переводъ: Начальныя основанія всеобщей и врачебной химіи — Жакина (1800). Обогащая русскую научную литературу столь многими трудами, онъ способствуетъ также развитію русской научной терминологіи; въ своихъ химическихъ трудахъ онъ придерживается теоріи Лавуазье и способствуетъ поэтому введенію ея въ Россіи. Онъ былъ также плодотворнымъ и талантливымъ популяризаторомъ химическихь, минералогическихъ и техническихъ знаній; ему принадлежитъ „Краткое начертаніе минералогіи для губернскихъ гимназій” (1804), „Руководство къ удобнћйшему разумћнію химическихъ книгъ иностранныхъ” (1815). Когда въ 1804 (по 1815 г.) сталъ издаваться Академіей Наукъ „Технологическій журналъ”, первымъ главнымъ редакторомъ былъ Севергинъ; въ 1806 г. къ журналу были даны „Прибавленія”, а съ 1816 г,— 1826 г. „Продолженіе технологическаго журнала” (подъ названіемъ „Ученыя извћстія при Спб. Вћдомостяхъ”). Въ технологическомъ журналћ и его „Продолженіяхъ”, начиная съ перваго, 1804 г., до 1826 года, послћдняго года жизни журнала и Севергина, было напечатано около 200 отдћльныхъ статейрефератовъ Севергина по техническимъ и практическимъ вопросамъ, о новыхъ открытіяхъ и т. д.
Закончимъ нашъ краткій очеркъ дћятельности этого замћчательнаго ученаго и патріота указаніемъ на то, что онъ читалъ въ 1792 и 1796—1802 годахъ публичныя лекціи по минералогіи.
Итакъ, XVIII вћкъ, въ особенности вторая его половина, ознаменовалась началомъ планомћрной популяризаціи химическихъ, а равно техническихъ и естественныхъ наукъ въ Россіи,— какъ при помощи печатнаго слова, такъ и устными лекціями. Иниціатива въ этомъ культурномъ дћлћ принадлежитъ Академіи Наукъ. Объ устроенныхъ впервые, во время директорства Домашнева, публичныхъ лекціяхъ по химіи нами говорилось уже выше (см. о Лаксманћ); заслуга дальнћйшаго развитія этихъ лекцій принадлежитъ другому директору Академіи, Екатеринћ Ром. Дашковой1) (1743—1810). {399} Эта замћчательная женщина, членъ Стокгольмской, Берлинской и Эрлангенской Академій и ученыхъ обществъ Стараго и Новаго Свћта, сподвижница великой Екатерины II, была въ 1783 г. назначена Директоромъ Спб. Академіи Наукъ и состояла въ этой должности до 1796 г. Въ своей программной рћчи, обращенной къ академикамъ, княгиня Дашкова выразила надежду, что свћтъ наукъ, пустившихъ глубокіе корни, распространится изъ Академіи по всему отечеству: „науки не будутъ уже водворяться въ семъ единомъ обиталищћ, но, присвоены будучи всему отечеству и вкоренившись, процвћтать будутъ”. Однимъ изъ самыхъ важныхъ средствъ для достиженія просвћтительной цћли Дашкова считала устройство публичныхъ курсовъ. Эта ьысокая и симпатичная цћль была ею дћйствительно осуществлена: она пригласила русскихъ академиковъ и адъюнктовъ избрать предметы для лекцій. Ежегодно въ теченіе четырехъ лћтнихъ мћсяцевъ читались нарусскомъ языкћ публичные курсы по химіи Соколовымъ и Захаровымъ, по минералогіи Севергинымъ, по физикћ Кононовымъ и Гурьевымъ, по естественной исторіи Озерецкимъ. Этотъ первый народный русскій университетъ по естественнымъ наукамъ, эти первые академическіе курсы для всћхъ были встрћчены любознательною публикою съ большимъ интересомъ, и залъ не могъ вмћстить всћхъ желавшихъ посћщать эти лекціи. Новый Директоръ Академіи вообще интересовался тћми научными изслћдованіями, которыя имћли ближайшее отношеніе къ Россіи и къ русской жизни; въ примћръ прочимъ академикамъ было поставлено, напримћръ, статистическое изслћдованіе академика-физика Лог. Юрьев. Крафта (1743—1814) о движеніи народонаселенія въ Петербургћ 1764—1780 г.; по этимъ даннымъ въ Петербургћ изъ 1000 чел. умираетъ ежегодно около 28, а въ другихъ большихъ городахъ — 42. Столь благопріятныя для Петербурга условія Крафтъ объясняетъ „крћпкимъ тћлосложеніемъ петербурскихъ жителей, здоровымъ воздухомъ сћверной столицы и хорошимъ качествомъ невской воды.1)”
О, доброе старое время, когда невская вода и петроградскій климатъ еще славились своими преимуществами!
Какъ бы въ связи съ этимъ теплымъ климатомъ Madame la Directeur не отпускала достаточно дровъ для отопленія конференцъ-зала {400} Академіи, несмотря на зимніе морозы. Чрезмћрная бережливость новаго Директора сказалась еще въ дћлћ упомянутыхъ сейчасъ публичныхъ курсовъ; такъ, напримћръ, въ 1794 г. Лаксманъ (см. выше) пишетъ: „Вмћсто того, чтобы дћлать опыты, профессоръ химіи на публичныхъ лекціяхъ рисуетъ vasa chemica мћломъ на черной доскћ, потому что ни копейки не даютъ на опыты, такъ что ихъ вовсе и не дћлаютъ”...
Но личность мудрой княгини Дашковой еще въ другомъ отношеніи характерна для этого періода: она является примћромъ того значительнаго интереса къ естественнымъ наукамъ, который пустилъ глубокіе корни въ высшихъ слояхъ общества. Этотъ интересъ имћлъ не только платоническій характеръ и сказался не только въ покровительствованіи опытныхъ и практическихъ знаній. Онъ представляетъ отголосокъ той культурной борьбы, въ которой участво вали выдающіеся умы Франціи, Германіи и т. д. и принимаетъ въ нћкоторыхъ отдћльныхъ личностяхъ вполнћ конкретную форму.
Къ этому періоду относится основаніе общества, знаменитаго какъ по своимъ высокогуманнымъ и просвћтительнымъ цћлямъ, такъ и вслћдствіе принесенной Россіи положительной пользы. Въ 1765 г. въ Петроградћ было основано Императорское Вольное Экономическое Общество1) по частной иниціативћ 15 лицъ; въ томъ числћ были знатнћйшіе представители аристократіи (напримћръ гр. Орловъ, гр. Воронцовъ, гр. Чернышевъ), химики — Леманъ (проф. химіи) и Модель (членъ медиц. Коллегіи), А. А. Нартовъ (членъ монетнаго двора), а душой всего дћла былъ придворный библіотекарь И. И. Таубертъ. Уже своимъ первымъ дћйствіемъ оно вызвало всеобщее вниманіе, и во Франціи это изумленіе выразилось въ словахъ: „L'on est done ami de Thumanite sur les bords de la Neva”. Съ 1765 г. Общество стало издавать свой журналъ „Труды”; въ 1767 г. къ нему присоединились „Abhandlungen der freien Oekonomischen Gesellschaft in St.-Petersburg”, съ 1790—1793 г. „Auswahl oekonomischer Abhandlungen...”, въ 1793 r. „Preisschriften und Abhandlungen der freien Oekon. Gessellschaft”. Между первыми дћятелями Общества занимали весьма видное мћсто члены С.-Петербургской Академіи Наукъ: Палласъ, Эйлеры, химики Леманъ, Ловицъ, Севергинъ и др. Въ „Трудахъ” Общества печатались химическія и технологическія работы Лемана, Моделя, Георги, Биндгейма, Ловица, Севергина и др. {401}
Этотъ пробуждавшійся интересъ къ наукћ далъ еще другіе результаты. Среди отдћльныхъ выдающихся представителей великосвћтскаго общества мы встрћчаемъ извћстныхъ химиковъ-любителей и минералоговълюбителей, по своимъ трудамъ не уступавшихъ химикамъ и минералогамъ-спеціалистамъ. Такъ, напримћръ, фельдмаршалъ графъ Алекс. Бестужевъ-Рюминъ1) (1692—1766) впервые наблюдалъ свћточувствительность солей желћза (1725) и прославился изобрћтеніемъ особой желћзной тинктуры „tinctura tonicenervina Bestoucheffi”*). Графъ Аполлосъ Мусинъ-Пушкинъ2) (род. 1760, ум. 1805), вице-президентъ Бергъ-Коллегіи и реорганизаторъ (въ 1804 г.) горнаго кадетскаго корпуса (впослћдствіи Горнаго Института) и съ 1796 г. почетный членъ Императорской Академіи Наукъ, сдћлался извћстнымъ своими химическими изслћдованіями: напримћръ, онъ впервые получилъ безцвћтный прозрачный фосфоръ, при помощи котораго онъ возстановилъ растворы угольной кислоты въ углеродь; онъ изучалъ платину, открылъ новый способъ ковки и новыя соли платины (платинохлористо водородныя), подробно изслћдовалъ хромъ, открылъ фіолето вые (хромовые) квасцы (1800) и новыя окиси хрома; онъ первый далъ способъ приготовленія вольфрамовокислаго натра и т. д. Укажемъ еще на князя Дмитрія Голицына3) (ум. 1803 г.), чрезвычайнаго посланника въ Гаагћ и почетнаго члена Академій въ Петроградћ, Берлинћ, Стокгольмћ и т. д. Онъ работалъ надъ гремучимъ газомъ (изобрћлъ особую пушку), изучалъ вліяніе газовъ на сћмена, открылъ свойство фіолетоваго сибирскаго хлорофана (CaF2) принимать при нагрћваніи зеленый цвћтъ, который при охлажденіи переходитъ обратно въ фіолетовый и сочинилъ курсъ минералогіи, считавшійся въ свое время образцовымъ (cm. Crell's Ann. 1796 II, 19 L до 1801 II, 451). Наконецъ, назовемъ натуралиста и геолога графа {402} Григорія Разумовскаго1) (1758—1837 г.), изучившаго синтетическое приготовленіе колчедана, анализировавшаго разныя воды, открывшаго минералъ, носящій и до сихъ поръ его имя, т.-е. Rasumoffskin (см. Zirkel, Mineralogie, 730, 1885) и основавшаго въ Лозаннћ (1784) Физическое Общество: этотъ замћчательный для своего времени русскій ученый жилъ и умеръ на чужбинћ.
Итакъ мы видимъ, что и для развитія химіи въ Россіи XVIII вћкъ былъ вћкомъ просвћщенія; уже народились отдћльные химики, мыслители и экспериментаторы, подготовлялась почва для будуіцей русской химической науки, интересъ къ ней и технологіи пробудился не только въ ученыхъ и правительственныхъ сферахъ, но и въ широкихъ слояхъ общества1), не только среди интеллигенціи, но и у людей практики.
Стала уже сказываться самостоятельность и изобрћтательность русскаго народнаго генія; такъ, напримћръ, Андрей Род. Баташевъ2) (1750) усовершенствовалъ металлургическую печь (опрокидываемую) Реомюра и вмћстћ съ тћмъ чугуннолитейное дћло; въ 1763 г. на Алтаћ шихтмейстеръ Ив. Ив. Ползуновъ3) (ум. 1766) изобрћлъ паровую машину для вдуванія воздуха при металлургическихъ процессахъ,— про Ползунова уже Ледебуръ (Reise durch das Altaigebirge, I, 370, 1829) пишетъ, что „онъ построилъ новую паровую машину въ Россіи”, у Ползунова пріобрћлъ свои первыя познанія по заводской и горной наукћ академикъ Лаксманъ (см. выше).
Параллельно съ пробужденіемъ собственныхъ творческихъ силъ шло развитіе здравой критики и способности отличать реальное отъ мнимаго. Это сказывается особенно ярко въ отношеніи русскихъ къ алхиміи.
Въ то время, когда еще на западћ, напримћръ при императорскомъ дворћ въ Вћнћ, при королевскихъ дворахъ въ Копенгагенћ, въ Дрезденћ, даже при дворћ Фридриха Великаго — друга Вольтера — алхимики со своими мнимыми трансмутаціями встрћчаютъ пріютъ, покровительство и часто щедрую поддержку, въ Россіи соблазнительныя предложенія отвергаются всћ безъ исключенія. Приведемъ лишь нћсколько примћровъ4): въ 1740 г. нћкій {403} голландецъ Іоаннъ де Вильде предлагаетъ Императрицћ Аннћ Іоанновнћ за 1000 червонныхъ способъ дћлать ежемћсячно по 100 червонцевъ золота и 50 марокъ серебра; въ 1741 нћкій баронъ де Шевремонтъ предлагаетъ свое всецћлительное лекарство, poudre de projection, превращающее также свинецъ въ золото. Условія, безъ исполненія которыхъ сей баронъ не желалъ открывать своей тайны, были, однако, менће скромны, чћмъ у его предшественника, а именно: 1) Императрица Анна должна произвести его въ графы и кавалеры ордена Святаго Андрея, 2) онъ долженъ быть назначенъ россійскимъ посланникомъ при французскомъ королћ или въ Гаагћ, 3) и его братъ долженъ быть произведенъ въ графы и кавалеры Св. Андрея, 4) дабы онъ съ почетомъ могъ пріћхать въ Россію, онъ долженъ быть снабженъ паспортомъ, въ которомъ онъ значится Россійско-Импер. дћйствительнымъ камергеромъ и дћйств. статскимъ совћтникомъ.
Въ 1745 г. нћкій Д. Гофмейстеръ изъ Цюриха предложилъ вицеканцлеру графу Бестужеву-Рюмину рецептъ всеобщаго лекарства, которое, по его мнћнію, особенно полезно въ Россіи, вслћдствіе ея заразительнаго воздуха, и при плаваніи по азіатскимъ морямъ. Закончимъ рядъ этихъ . благодћтелей Россіи еще другимъ швейцарскимъ гражданиномъ Цолликоферомъ фонъ Алтенъ-Клингеймъ, предложившимъ Императрицћ Елисаветћ въ 1760 г. одновременно услуги французскаго мыльнаго мастера и нћкоего извћстнаго ему врача, который посредствомъ алхиміи можетъ излћчить всћ болћзни, но кромћ того готовъ открыть секретъ, съ помощью котораго можно увеличить ежегодные доходы Ея Величества на 10 милліоновъ рублей, безъ отягощенія подданныхъ. — Удивительно, какъ много было въ эту эпоху незванныхъ благодћтелей Россіи!
Описываемый періодъ, въ частности вторая половина XVIII вћка, ознаменовался еще другими важными событіями, имћющими значеніе какъ для культуры Россіи, такъ и для развитія русской химіи. Важнћйшимъ изъ нихъ является открытіе Московскаго Университета (1755), состоявшееся благодаря просвћщенному содћйствію М. В. Ломоносова. Такимъ образомъ зарождается новый разсадникъ наукъ, высшее учебное заведеніе, за которымъ черезъ нћкоторое время послћдовали другія; увеличивается число ядеръ, около которыхъ начинается независимая кристаллизація научныхъ силъ. Появляются новые профессора химіи, новыя химическія лабораторіи. Хотя процессъ кристаллизаціи первоначально {404} протекалъ довольно медленно, не давая сразу крупныхь кристалловъ и новыхъ ядеръ, иначе говоря, не давая сразу ни крупныхъ химическихъ единицъ, ни выдающихся химическихъ работъ, ни значительнаго числа учениковъ, — все-таки было положено начало многообћщающему будущему, положено начало столь необходимому развитію химіи въ Россіи.
Ни первый изъ профессоровъ химіи Московскаго Университета Керстенсъ (съ 1758 по 1770 г.), ни его преемники Веніаминовъ (1770 — 1775) и „профессоръ анатоміи, практической медицины и химіи” Зыбелинъ (1775 — 1802) не оставили слћдовъ въ химической наукћ1). Химія находилась, кромћ того, въ услуженіи у медицины. Такъ, напримћръ, первый изъ этихъ химиковъ преподавалъ не только химію, но и металлургію, теоретическую и экспериментальную физику, медицинскую химію и естественную исторію простыхъ фармацевтическихъ препаратовъ; онъ нћсколько лћтъ былъ даже единственнымъ профессоромъ на медицинскомъ факультетћ, a въ 1768 г. весь факультетъ состоялъ лишь изъ одного студента... Зато „Императорскаго московскаго университета публичный демонстраторъ химическихъ и фармацевтическихъ наукъ” (1795—1804), аптекарь Іог. Як. Биндгеймъ2) (1750—1825) оказался весьма прилежнымъ химикомъ, напечатавшимъ много работъ по собственнымъ наблюденіямъ изъ аналитической, фармацевтической и технической химіи (съ 1783—1799 г.). Такъ, напримћръ, онъ изолировалъ изъ бћлой свеклы чистћйшій сахаръ (1799).
Другимъ центромъ кристаллизаціи для химическихъ силъ и работъ являются медицинскія школы; первая изъ нихъ открывается въ Москвћ (1706) при первомъ госпиталћ, а въ этой медицинской школћ химія преподается въ видћ фармаціи аптекаремъ Хр. Эйхлеромъ. Вторая госпитальная школа открывается въ 1733 г. въ Петроградћ (Кронштадтћ), а преподавателемъ химіи и фармаціи въ ней назначается въ 1737 г. аптекарь Іог. Георг. Модель3) (съ 1745—1775 г. аптекарь при Главной Пгрской аптекћ); химическіе труды послћдняго были оцћнены, между прочимъ, и Академіею Наукъ, избравшей его почетнымъ членомъ (въ 1756 г.). Модель далъ подробное описаніе приготовленія, очистки и состава {405} буры (1747 и 1762), сдћлалъ первый анализъ невской воды (1763 и 1773) и охтенской (1762), далъ новый анализъ олонецкаго желћзнаго источника (1762), открылъ новые фармацевтическіе препараты и усовершенствовалъ способы очистки старыхъ (напримћръ камфоры, животнаго масла Диппеля, поваренной соли) и т. д. Вообще Модель далъ множество полезныхъ указаній и точныхъ наблюденій по практической химіи; его главнћйшіе труды были собраны имъ и изданы подъ названіемъ: Kleine Schriften (Спб. 1773), Chyxnische Nebenstunden (Спб. 1762) и Fortsetzung derselben (Спб. 1768),— значеніе этихъ трехъ сочиненій Моделя видно изъ того, что они были переведены на французскій языкъ Parmentier'oivrb и изданы въ Парижћ (1774). Историкъ химіи Гмелинъ называетъ Моделя „славнымъ с.петербургскимъ химикомъ” (Scheidekunstler). Объ участіи Моделя въ основаніи и въ „Трудахъ” Вольнаго Экономическаго Общества мы уже говорили въ своемъ мћстћ. Онъ родился въ Ротенбургћ въ 1711 г., его неутомимая дћятельность была прервана смертью въ 1775 г.
Медицинскія школы1) получили въ 1754 г. новые учебные планы, въ которыхъ химіи было отведено болће широкое мћсто, — она преподавалась по знаменитому учебнику Н. Boerhave: Elementa chemiae (1732). Дальнћйшія десятилћтія приносятъ преобразованіе обћихъ школъ въ медико-хирургическія, при которыхъ въ 1786 г. учреждаются профессуры; „профессору химіи и ботаники” поручается чтеніе химіи 4 раза въ недћлю съ демонстраціями, опытами и изложеніемъ причинъ химическихъ явленій.
Первымъ профессоромъ химіи былъ извћстный намъ Товій Егор. Ловицъ; его преемникомъ (съ 1796 г.) былъ Вас. Мих. Севергинъ (см. выше); химія читалась по учебнику Жакена — Elementa chemiae, переведенному на русскій языкъ Севергинымъ (въ 1800 г.). Наконецъ, въ 1799 г. произошло преобразованіе этихъ школъ въ медико-хирургическія Академіи (Петроградскую и Московскую), чтеніе лекцій въ этихъ высшихъ учебныхъ заведеніяхъ началось съ 1800 г.; въ Петроградской Академіи профессорами были: химіи Севергинъ, a физики — извћстный Вас. Влад. Петровъ (членъ Академіи Наукъ, самоучка-физикъ, авторъ замћчательныхъ трудовъ по электрохиміи); съ 1804 г. профессоромъ химіи состоялъ А. Шереръ (1771—1824), впослћдствіи (съ 1815 г.) орд. членъ Академіи Наукъ. {406}
Первый центръ — Московскій Университетъ — далъ русской наукћ въ XIX вћкћ видныхъ представителей чистой химіи; второй центръ — Медико-хирургическая или (съ 1881) Военно-медицинская Академія, — дала въ частности представителей медицинской химіи. Къ первымъ двумъ впослћдствіи присоединился еще третій центръ, ставшій разсадникомъ химіи горнозаводской и металлургической.
Начало горнозаводскому образованію1) было положено В. И. де-Генниномъ въ 1713 г. въ районћ Олонецкихъ заводовъ, a Bac. Никит. Татищевымъ въ 1721 г. на Уралћ (около Екатеринбурга), устроившими школы. Школа, учрежденная въ Екатеринбургћ, подверглась дальнћйшему развитію; такъ, напримћръ, въ 1746 г. президентъ Бергъ-Коллегіи Томиловъ ввелъ новые предметы: металлургію, механику, маркшейдерское искусство, химію и т. д., но, къ сожалћнію, вслћдствіе недостатка учителей, большая часть этихъ предметовъ не преподавалась. Наконецъ, въ царствованіе Екатерины II, въ 1773, было учреждено Горное училище въ Петроградћ; профессорами были приглашены частью академики, частью иностранные ученые; химію и металлургію читалъ Карамышевъ, а маркшейдерское искусство, минералогію и горное искусство Ив. Мих. Ренофанцъ2). Особенно много пользы принесъ Горному училищу этотъ послћдній, уроженецъ Саксоніи, окончившій Фрейбергскую Академію (род. 1744 въ Дрезденћ, умеръ 1798 въ Петроградћ въ должности главноначальствующаго надъ Императорскимъ Горнымъ Кабинетомъ); онъ напечаталъ рядъ статей по минералогіи и географіи Алтая, о байкалитћ, объ антрацитћ Екатеринославской губ. (1793) и др.
Упомянемъ еще другого просвћщеннаго дћятеля этой эпохи, способствовавшаго развитію горныхъ наукъ въ Россіи, Андрея Андреевича Нартова3). Нартовъ (род. 1737 въ Петроградћ, воспитывался въ Академической гимназіи) быль однимъ изъ основателей Вольнаго Экономическаго Общества, временно управлялъ Горнымъ училищемъ, поступивъ въ Бергъ-Коллегію (1766), и въ 1796 г. былъ назначенъ президентомъ послћдней; скончался въ 1813 г. Онъ занимался поэзіею и литературою, ему принадлежитъ рядъ {407} переводовъ съ французскаго и нћмецкаго языковъ, въ томъ числћ переводъ металлургіи Скополи и минералогіи Лемана; кромћ того онъ опубликовалъ нћсколько научныхъ трудовъ, напримћръ о финляндскомъ розовомъ кварцћ (1797), о новомъ родћ гранита съ Бћлаго моря (1797).
Въ 1804 г. состоялось преобразованіе Петроградскаго горнаго училища въ Горный Корпусъ, т.-е. въ высшее учебное заведеніе; основныя мысли новаго устава были даны графомъ Апол. Апол. Мусинъ-Пушкинымъ, а первымъ профессоромъ химіи былъ профессоръ медико-хирургической академіи Шереръ.
Закончимъ нашъ обзоръ подведеніемъ итоговъ развитія технической химіи или химической промышленности и горнаго дћла. Благодаря заботамъ и мћропріятіямъ Петра Великаго въ Россіи зародилась не только химическая наука, но и горнозаводская промышленность; онъ обладалъ даромъ находить достойныхъ сотрудниковъ, — мы уже упоминали объ Андрећ Андреевичћ Виніусћ, необходимо назвать еще Татищева и Геннина (см. выше). В. И. де Геннинъ (родомъ изъ Голландіи) былъ назначенъ въ 1713 году олонецкимъ комендантомъ: онъ привелъ въ порядокъ олонецкіе литейные заводы. Въ 1721 и 1722 г. были отправлены на Уралъ и въ Сибирь Татищевъ и Геннинъ; Геннинъ, назначенный главнымъ директоромъ сибирскихъ заводовъ, построилъ въ г. Екатеринбургћ мћдный и желћзный заводы. Въ 1724 г. Татищевъ (род. 1686, ум. 1750, извћстенъ какъ авторъ „Исторіи Россійской”) былъ посланъ Петромъ въ Швецію для осмотра рудниковъ и заводовъ. Въ 1725 г. онъ по приказу Петра пристроилъ на шведскихъ заводахъ и рудникахъ 22 прибывшихъ въ Швецію русскихъ молодыхъ людей для обученія плавкћ и обжиганію рудъ, машинному дћлу, пробирному искусству и проч. Въ 1734 г. (послћ недоразумћній политическаго характера и освобожденія отъ суда) снова назначенъ на Уралъ „для размноженія заводовъ” ; при немъ число послћднихъ возросло до 40 и были открыты новые рудники, между ними знаменитая гора Благодать, громаднћйшее въ мірћ мћсторожденіе магнитнаго желћзняка*), открытое въ 1735 г. вогуломъ Чумнинымъ и получившее свое названіе отъ Татищева. Уже въ 1719 г. Императоромъ Петромъ была учреждена бергъ-коллегія и мануфактуръ-коллегія, — спеціальные {408} правительственные органы для охраненія интересовъ горнаго дћла и промышленности: каждое полезное промышленное дћло встрћчаетъ покровительство, а предпринимателямъ даруется цћлый рядъ разнообразныхъ привилегій и льготъ. Появляются и русскіе предприниматели, среди нихъ знаменитый Никита Демидовъ (1656—1725), получившій въ 1701 г. казенный Невьянскій желћзный заводъ и построившій (съ 1716 и 1725 г.) четыре завода на Уралћ и одинъ на рћкћ Окћ. Демидовъ былъ однимъ изъ главныхъ помощниковъ Петра Великаго при основаніи Петрограда и жертвовалъ на это деньгами, желћзомъ и др. Сыновья Ник. Демидова были достойными его преемниками. Ник. Демидовымъ и его потомками было построено 30 заводовъ на Уралћ. Одновременно развивались заводы другого знаменитаго рода, а именно Строгановыхъ, но уже безъ всякихъ пособій отъ казны, на огромной области Строгановскихъ имћній въ Пермскомъ краћ.
Въ 1797 г. былъ основанъ Луганскій заводъ въ Екатеринославской губ.
Для иллюстраціи практическихъ результатовъ этой работы насажденія горной промышленности въ Россіи приведемъ нћсколько цифровыхъ данныхъ.
Послћ кончины Петра Великаго въ Россіи было уже 195 казенныхъ и частныхъ заводовъ, кромћ горныхъ и мелкихъ кожевенныхъ; въ томъ числћ 1 сахарный (рафинадный, основанный въ Петроградћ, въ 1719 г.), 1 красочный, 2 стеклянныхъ, 5 кожевенныхъ. Добываніе важнћйшихъ металловъ уже достигло значительныхъ размћровъ; напримћръ, въ 1718 г. было выплавлено
на |
казенныхъ |
заводахъ: |
мћди |
28 400 |
пуд. |
и |
чугуна |
869 000 |
пуд. |
„ |
частныхъ |
„ |
„ |
169 000 |
„ |
и |
„ |
5 772 000 |
„ |
|
|
|||||||||
Итого |
мћди |
197 400 |
пуд. |
и |
чугуна |
6 641 000 |
пуд. |
||
Въ 1749 г. было вывезено (преимущественно въ Англію) русскаго чугуна 579 000 пудовъ, а въ 1761 г. изъ Петроградскаго порта было вывезено (также въ Англію) 3 милліона пудовъ желћза. Въ 1761 г. производительность всћхъ русскихъ фабрикъ выражалась суммою въ 4,2 мил. рублей. Въ 1765 г. всћхъ фабрикъ было уже 262 съ производительностью въ 5 мил. рублей (общая добыча чугуна уральскихъ заводовъ въ 1766 г. выражалась цифрою {409} въ 3 457 800 пудовъ, а добыча мћди на уральскихъ заводахъ въ 1766 г. составляла 209 900 пудовъ). Въ 1801 г. число фабрикъ было 2423, а производительность составляла 25 мил. рублей.
Обозрћвая объективно итоги развитія химіи въ Россіи за XVIII вћкъ, необходимо согласиться, что сильная воля Самодержца Петра Великаго въ началћ этого періода, дћйствительно, положила основу гигантскому культурному переустройству Россіи; начатый имъ смћлый эксперименть продолжала императрица Екатерина II. Сћмена, посћянныя Петромъ, нашли плодородную почву, давшую въ концћ этого вћка обильную жатву: тамъ, гдћ раньше не было ни наукъ, ни ученыхъ, ни промышленности, по истеченіи одного столћтія были пробуждены къ жизни какъ духовныя силы, такъ и скрытыя богатства нћдръ земли, — тамъ возникла и развилась наука и техника! Новый вћкъ больше не требовалъ повелителя и дальновиднаго иниціатора, новый XIX вћкъ нуждался лишь въ щедромъ покровителћ уже существующаго, и таковымъ оказался Александръ I, завершившій великую культурную миссію Петра.
Естественнымъ образомъ и въ XIX вћкћ научное развитіе химіи концентрируется около высшихъ ученыхъ и учебныхъ учрежденій. Если въ предыдущемъ столћтіи Академія Наукъ являлась фактически единственнымъ родникомъ, снабжавшимъ Россію живою водою западной науки, то въ новомъ столћтіи къ этому центральному роднику прибавилось все больше и больше новыхъ научныхъ источниковъ: наука стала бить ключемъ изъ Московскаго Университета; интенсивно началъ дћйствовать Горный Корпусъ, въ 1833 г. преобразованный въ Горный Институтъ, Медико-Хирургическая Академія, въ 1881 г. переименованная въ Военно-Медицинскую Академію; но, что еще важнће, были открыты новые разсадники чистой науки, университеты: въ Дерптћ (1802), Харьковћ (1803), Вильнћ (1803) и Казани (1805), а въ {410} 1819 г. въ Петроградћ. Прибавимъ, что за ними послћдовали университеты: въ Варшавћ (1816—1832, 1857 г.), въ Одессћ (съ 1817 г. лицей, съ 1865 г. университетъ), въ Кіевћ (1834), въ Томскћ (1888), въ Саратовћ (1909). Въ 1809 г. присоединился къ этому числу и университетъ въ Гельсингфорсћ, — въ 1640 г. основанъ въ Або, въ 1827 г. переведенъ въ Гельсингфорсъ.
Но возникаютъ еще новые типы высшихъ учебныхъ заведеній, впослћдствіи участвовавшихъ въ развитіи какъ прикладной, такъ и чистойхиміи: Птр. Технологическій Институтъ (1828), Императорское Московское Техническое училище (1832), Петровская Сельско-Хозяйственная Академія (1845), еще въ 1803 г. въ Петроградћ былъ основанъ Лћсной Институтъ; Технологическій Институтъ въ Харьковћ (1885), въ Томскћ (1896, откр. 1900). Что касается политехникумовъ, то первымъ учрежденіемъ этого типа былъ Рижскій Политехникумъ (откр. въ 1862), потомъ былъ открытъ политехникумъ въ Кіевћ (1898) и Варшавћ (1898), въ Петроградћ (1902) и Новочеркасскћ (1907).
Существенно измћнившіяся внћшнія условія не могли не отразиться на характерћ и ростћ русской химической науки. Малопомалу передвигаются главныя цћли химіи; химическія изслћдованія производятся уже не только ради государственной пользы,— утилитарный характеръ XVIII вћка постепенно замћняется чисто нayчнымъ характеромъ химическихъ трудовъ, зарождаются новыя области химической науки и новыя проблемы для экспериментальнаго изслћдованія. Перемћна происходитъ также и въ другомъ отношеніи: восемнадцатый вћкъ, главнымъ образомъ, прибћгалъ къ заграничнымъ ученымъ, — въ XIX вћкћ русская земля рождаетъ самостоятельныхъ химиковъ-ученыхъ, участвующихъ на равныхъ правахъ съ великими химиками западной Европы въ созиданіи новой химіи.
Въ XVIII вћкћ главный научный интересъ ученыхъ химиковъ западной Европы сосредоточивался на теоріи флогистона, тогда какъ въ ту же эпоху большинство химиковъ въ Россіи было поглощено практическими вопросами и какъ бы сознательно устраняло себя отъ этой духовной борьбы между химическими теоріями. Поэтому мы видимъ, что преобразованіе флогистической химіи въ антифлогистическую и процессъ проникновенія взглядовъ Лавуазье во всћ области химіи, — этотъ замћчательный переворотъ и прогрессъ въ химіи, — не встрћчаетъ въ Россіи ни активныхъ борцовъ, ни видимаго сопротивленія. Новая теорія распространяется {411} въ Россіи сравнительно постепенно и медленно; законы диффузіи дћйствуютъ также въ мірћ идей, и эта диффузія совершается автоматически даже черезъ перегородки. Если считать отношеніе Академіи Наукъ оффиціальнымъ барометрическимъ показателемъ какъ всћхъ крупныхъ колебаній въ наукћ вообще, такъ и вліянія этихъ колебаній на русскую химическую науку, то можно заключить, что великія колебанія на западћ, обусловленныя трудами Кэвендиша и Шееле (химія газовъ), Лавуазье (количественная химія съ 1775 г.), Дальтона (атомистическое ученіе 1805 г. и законъ кратныхъ чиселъ), Волластона (1808 г.), Авогадро (молекулярная теорія, 1811 г.), а равно Бертолле (ученіе о химическомъ сродствћ, statique chimique, 1803 г.) не произвели въ Россіи никакого видимаго эффекта, — имена этихъ великихъ реформаторовъ не попали въ списокъ членовъ нашей Академіи.
Главными русскими представителями новой химіи въ началћ XIX вћка являются: Захаровъ, который перевелъ учебникъ Жиртаннера „Антифлогистическая химія” (1801) и первый въ Россіи читалъ химію по этой системћ; Севергинъ, который уже въ своемъ „Пробирномъ искусствћ” (1801) впервые примћнилъ систему Лавуазье; наконецъ, А. И. Шереръ, который велъ энергичную пропаганду этой системы. Шереръ (род. въ Пгр. въ 1771 г., воспитывался въ Ригћ и въ Іенскомъ университетћ, въ 1803 г. назначенъ профессоромъ химіи Дерптскаго университета, въ 1804 г. профессоромъ химіи въ МедикоХирургической Академіи въ Петроградћ; съ 1805 г. адъюнктъ, съ 1807 г. экстр. академикъ, а съ 1815 г. ординарный академикъ химіи, ум. 1824) напечаталъ: Beitrage zur Berichtigung der antiphlog. Chemie (1795), Grundzuge der neueren chem. Theorie (1795), Uebersicht der Zeichen fur die neuere chem. Theorie (1796), Руководство къ преподаванію химіи (Спб. 1808). Шереръ отличался не своими экспериментальными изслћдованіями, а даромъ обобщенія и систематизированія. Имъ было напечатано довольно много отдћльныхъ небольшихъ замћтокъ. Кромћ упомянутыхъ сочиненій имъ были изданы еще монографіи: „Ueber das Leuchten des Phosphors in Stickstoff (1795, дополненія 1797), Kurze Darstellung der chem. Untersuchung der Gasarten (1799), Versuch einer system. Uebersicht der Heilquellen des Russischen Reiches (Спб. 1820), біографическій очеркъ T. Ловица (1822), характеристика Т. Парацельза (1822) и др.
| {412} |
Новая антифлогистическая химія требовала новой русской химической номенклатуры. Въ разработкћ таковой участвовали: Н. Соколовъ переводомъ химіи Эркслебена (1788), Севергинъ своими переводами и собственными учебниками, Шереръ, представившій въ Академію Наукъ „Опытъ методическаго опредћленія химическихъ наименованій для Россійскаго языка” (Спб. 1808), Захаровъ, сочинившій „Разсужденіе о россійскомъ химическомъ словозначеніи” (1810) и Ф. Ф. Рейссъ, напечатавшій въ Трудахъ Московскаго физико-медицинскаго Общества (Commentat. Societ. Phys.-Medicae, t. I, 1808) свое „Разсужденіе о пользћ новћйшаго химическаго именословія (nomenclatura) съ опытомъ перевода химическихъ терминовъ на Русскій языкъ” (1806).
Наибольшія заслуги въ этомъ важномъ дћлћ принадлежатъ Г. И. Гессу и его образцовому учебнику „Основанія чистой химіи” (1831/3 г.). Въ этомъ трудћ Гессъ — по соглашенію съ своими товарищами Нечаевымъ (проф. Медико Хирургической Академіи и Горнаго Института), Соловьевымъ1) (проф. Пгр. Университета и Горнаго Института) и Соболевскимъ2) выработалъ номенклатуру, существующую въ главныхъ частяхъ еще въ настоящее время, послћ того какъ Д. И. Менделћевъ внесъ въ нее нћкоторыя дополненія, обусловленныя дальнћйшимъ развитіемъ химической науки. По отношенію къ органической химіи Менделћевъ сдћлалъ соотвћтственныя измћненія въ своемъ учебникћ „Органическая химія” (1861), а для неорганической химіи — въ „Основахъ химіи” (съ 1868 г.).
На первый взглядъ вопросъ о химической номенклатурћ покажется, можетъ быть, не очень существеннымъ. Однако, въ дћйствительности это не такъ. Уже Лавуазье занялся этимъ вопросомъ и внесъ въ Парижскую Академію Наукъ (1787 г.) предложеніе о преобразованіи и усовершенствованіи химической номенклатуры. Въ 1787 г. вышелъ въ Парижћ трудъ гг. Де Морво, Лавуазье, Бертолле и Де Фуркруа: Methode de Nomenclature chimique. Въ своемъ образцовомъ учебникћ „Traite elementaire de chimie” Лавуазье снова {413} останавливается на этомъ вопросћ; исходя изъ мысли философа Кондильяка, что „мы размышляемъ при помощи словъ”, онъ доказываетъ невозможность отдћленія номенклатуры отъ науки и науки отъ номенклатуры и говоритъ, что каждая физическая наука непремћнно состоитъ изъ трехъ вещей: изъ ряда фактовъ, которые образуютъ науку; изъ идей, которыя воспроизводятъ (rареіlent) таковые, и изъ словъ, которыя передаютъ ихъ. Слово должно рождать идею, идея должна изображать (peindre) фактъ (1. с, р. VI, 1793).
Упомянутый выше трудъ французскихъ свћтилъ послужилъ, въ большей или меньшей мћрћ, образцомъ для трудовъ всћхъ русскихъ авторовъ начала XIX вћка.
Каковы были названія химическихъ тћлъ сто лћтъ назадъ? Вотъ нћсколько образчиковъ.
Въ 1801 г. вышелъ трудъ В. Севергина „Пробирное искусство” (Спб. 1801 г.); приведемъ изъ этого труда нћсколько названій, отличающихся отъ современныхъ.
Кислотворное вещество ( = кислородъ), водородное, удушливое (азотъ) и угольное вещество; известная земля (известь), тальковая (MgO), глинистая (Аl2О3) и кремнистая (SiO2) земля; металлы имћютъ современное названіе, кромћ двухъ: „королекъ молибдены” и „королекъ волчеца” (металлы молибденъ и вольфрамъ).
„Сложнћйшія тћла” (т.-е. составныя, сложныя тћла).
Соли: „купоросныя среднія соли” (= нейтральныя сћрно кислыя).
„Селитряныя среднія соли” (= нейтральныя азотнокислыя).
„Соляныя среднія соли” (= хлористоводородныя соли).
„Буровыя „ „ (=соли борной кислоты).
„Мышьячныя „ „ (= соли мышьяковой кислоты).
„Волчецовая кислота” (= вольфрамовая кислота).
„Кислоты произрастеній (= растительныя кислоты).
„Составы металловъ” (= сплавы).
Въ 1807 г. Алекс. Шереръ представляетъ въ Академію Наукъ свой „Опытъ методическаго опредћленія и т. д.”.
„Гасъ” (=газъ); газообразные элементы: „кислотворъ”, „водотворъ”, „селитротворъ” (N), а равно — „углетворъ” (углеродъ). „Окисленіе, разкисленіе, окиселъ”.
Изъ 37 указанныхъ металловъ лишь одинъ никкель имћетъ отличное отъ современной химіи названіе, а именно „никколанъ”. {414}
Соли получаютъ названія, согласныя съ французской номенклатурой, напримћръ, carbonates = угляки, (т. е. Me2CO3), sulfate d'alumine = сћрнякъ глинистый (Al2(SO4)3), sulfite = сћрникъ (Ме2SO3), benzoates = бензоевяки (С6Н5СООМе), nitrates = селитряки (MeNO3) и т. д.
Въ 1813 г. появляется „Всеобщая химія” Ф. Гизе (Харьковъ, 1813); приведемъ нћсколько примћровъ изъ этой книги.
„Кислотворъ”, „водотворъ”, „угольное начало” и т. д.
„Офосфоренный (осћренный, омышьяченный, обугленный) водотворъ”, т.-е. PH3, SH2, AsH3, СН4.
„Окисленное (осћренное, офосфоренное) серебро”.
„Окиси”, „закиси” („желћзная”, „серебряная”...).
„Идраты” (напримћръ „мћдный идратъ” = гидратъ мћди, гидрокись мћди).
Въ 1830 г. вышли „Начальныя основанія химіи” проф. Н. П. Щеглова.
Названія элементовъ (53) тождественны съ современными, кромћ слћдующихъ 10:
Кремнеземій (Si), глиноземій (Аl), известковій (Са), горькоземій (Мg), глициній (Be), поташій (К), содій (Na), селеній (Se), волчецъ (W), молибдена (Мо).
„Окислы” (напримћръ, окиселъ серебра) въ случаћ существованія нћсколькихъ окисловъ одного и того же элемента получаютъ слћдующія названія, начиная съ окисла съ наименьшимъ паемъ кислорода: „закись”, „недокись”, „окись”, „перекись” (эти названія были выработаны Соловьевымъ).
Для кислотъ различныхъ степеней окисленія вводятся окончанія: „истая”, „оватая”, „истоватая”, „овая” или „ная”, напримћръ „сћрнистая, сћрноватая, сћрнистоватая и сћрная” кислоты.
Далће: „первосћрнистое”, „второсћрнистое” желћзо (FeS, FeS2), „первохлорнокислая”, „второхлорнокислая” ртуть (HgCl, HgCl2).
Въ 1831/4 гг. былъ изданъ учебникъ Г. И. Гесса „Основанія чистой химіи” (съ дополненіями въ 1834 г.). Пользуясь работами своихъ предшественниковъ, Гессъ видоизмћнилъ и усовершенствовалъ номенклатуру неорганическихъ тћлъ весьма существеннымъ образомъ. Такъ, напримћръ, изъ 54 элементовъ уже 50 (противъ 43 у Щеглова) имћютъ названія, еще нынћ употребляемыя; маленькія отступленія встрћчаются лишь у слћдующихъ элементовъ: селеній и {415} хромій (вмћсто „селенъ” и „хромъ”), циркона (вмћсто „цирконъ”) и потассій (вмћсто современнаго слова „калій”). Вмћсто четырехъ формъ окисловъ Соловьева, Гессъ дћлитъ „окислы”, вообще, на „недокислы”, „окислы”, „перекислы”, которые далће дифференцируютъ окончаніемъ „ный” или „истый”, напримћръ, желћзистый, желћзный (окислъ, недокислъ) и т. д. Номенклатуру Щеглова, напримћръ, для кислотъ сћры, онъ измћняетъ такъ, что, оставляя его окончанія, онъ перемћщаетъ соединенія: SO3 — сћрная, S2O5 — сћрноватая, SO2 — сћрнистая, S2O2 — сћрноватистая, примћняя эти же окончанія и для другихъ кислотъ, дающихъ различныя степени окисленія. Прежнія названія „водородосћрный”, „водородохлорный” и т. п. онъ сокращаетъ въ водосћрный, водохлорный; онъ предлагаетъ термины: „сћрнистое”, „хлористое” и т. п. серебро. Если соединеніе происходитъ въ нћсколькихь пропорціяхъ, то говорится: „полу-”, „одно-”, „дву-”, „тре-” сћрнистый, хлористый и т. д.; при болће сложныхъ соединеніяхъ употребляются два числа, напримћръ Fe2Cl6 = двушестихлористое желћзо. Двойныя соединенія обозначаются, напримћръ, такъ: борнофтористый потассій KF.BF3 = KBF4, т. е. названіе галоида ставится между названіями калія (потассія) и бора. Очевидно, что номенклатура Гесса уже представляетъ высокую стадію внутренняго развитія; осталось лишь докончить и время отъ времени исправлять эту постройку.
Русская химическая номенклатура впослћдствіи тоже привлекала къ себћ вниманіе нашихъ химиковъ. Останавливаясь подробнће на этомъ вопросћ, можно легко убћдиться, что здћсь дћло идетъ объ очень сложномъ явленіи. Какъ, напримћръ, въ южныхъ государствахъ находятся въ обращеніи одновременно монеты старой и новой чеканки и разныхъ государствъ, такъ и въ нашей номенклатурћ встрћчаются рядомъ эмпирическіе и устарћвшіе термины, какъ рудименты прежней культуры страны и прежнихъ фазъ развитія химіи, получившіе, однако, право гражданства; попадаются также названія, заимствованныя изъ иностранной литературы и иностранныхъ языковъ, такъ называемая оффиціальная номенклатура, приспособленная къ Женевской (1892 г.) международной химической номенклатурћ. Изъ національныхъ соображеній создаютъ не такіе термины, какъ изъ соображеній общенаучныхъ; чистота и духъ русскаго языка иногда не мирятся съ тћми химическими названіями, которыя подсказываются практическими соображеніями. Краткость названія и ясность его въ химическомъ смыслћ, т. е. передача характера и строенія {416} вещества, при соблюденіи наиболыией умственной экономіи, конечно, составляютъ идеалъ, но такой идеалъ химической номенклатуры не всегда согласуется съ идеаломъ филолога. Слћдовательно, номенклатура эта подлежитъ постоянной эволюціи не только съ измћненіемъ и ростомъ химіи, какъ науки, которая непрерывно развивается и даетъ начало все новымъ и новымъ отраслямъ, но и съ измћненіемъ культурнаго уровня и національнаго самосознанія химиковъ. Она создается не сразу и не тћмъ или другимъ отдћльнымъ химикомъ; время отъ времени она требуетъ урегулированія, даже регламентаціи, посредствомъ совмћстной работы многихъ химиковъ, вполнћ знакомыхъ съ современнымъ положеніемъ науки. Въ послћднее время, къ сожалћнію, у насъ не было обращено должнаго вниманія на эту сторону нашей науки.
Въ 1869 г. В. В. Марковниковъ (Ж. 1, 239; 3, 65) предложилъ ІІму съћзду русскихъ естествоиспытателей въ Москвћ заняться изысканіемъ путей, которыми можно было бы достигнуть единства въ русской химической номенклатурћ, въ виду того, что именно на съћздћ было бы всего удобнће заняться этимъ вопро сомъ. По этому поводу Н. Э. Лясковскій представилъ химической секціи свои соображенія, содержавшія рядъ цћнныхъ основныхъ принциповъ, которыми слћдовало бы руководствоваться, и пояснилъ примћнимость послћднихъ на нћсколькихъ примћрахъ. Такъ, напримћръ, онъ предлагаетъ слћдующіе термины:
Сћрнокисень — взамћнъ „сульфата” или сћрнокислой соли.
Киснота — взамћнъ „кислота” (хлорнота = НСl).
Сновни, кисни — кислородныя соли (напримћръ, углекисни = Ме2СO3, ціанокисни = MeCNO).
Захлоръ, напримћръ, захлоръ мћди СuСl.
Охлоръ, напримћръ, охлоръ мћди СuСl2; сћрнокисная ожелћзь = сћрнокислая окись желћза и т. д.
Въ протоколћ этого засћданія говорится кратко: „A. M. Бутлеровъ предложилъ, по поводу вопроса о преобразованіи русской химической номенклатуры, образовать во всћхъ университетскихъ городахъ Россіи комиссіи изъ наличныхъ химиковъ для разработки этого вопроса. Комиссіи эти представятъ результаты своихъ соображеній въ русское химическое общество въ Петербургћ, которое составитъ сводъ всћмъ этимъ соображеніямъ и представитъ его къ слћдующему съћзду”. (Ж. 1, 241, 1869). {417}
Вопросъ благополучно былъ переданъ въ комиссію,— слћдовательно, осужденъ на обычный въ канцеляріяхъ родъ смерти? Нћтъ, не сразу. По порученію комиссіи Ќ. Савченковъ составилъ записку „Историческіе матеріалы по русской химической но менклатурћ” (Ж. 2, 187, 205. 1870); при обсужденіи въ комиссіяхъ была подана „мысль о возможности принять для химическихъ названій сочетанія въ родћ русскихъ отчествъ и фамилій”, напримћръ, вмћсто хлористаго калія — „калій хлоровичъ” или „калій хлоровъ”; вмћсто хлорноватисто-кислаго калія — „калій хлоровичъ кисловъ” и т. д. и т. д. Получилась бы дћйствительно химія, весьма своеобразная: фторъ іодовичъ, хлоръ водородовичъ, водородъ кислородоцовъ (какъ вульгарно звучитъ прежнее названіе: вода!), сурьма свинвичъ и т. д.! Комиссія представила Химическому Обществу въ ноябрћ 1870 г. докладъ, въ которомъ она полагаетъ, „что въ настоящее время не представляется существенной надобности въ радикальномъ измћненіи химической номенклатуры” и проч. и проч. Послћ продолжительныхъ преній Общество постановило „имћть въ виду докладъ комиссіи и отложить окончательное рћшеніе вопроса до января”. (Ж. 2, 292. 1870). Къ сожалћнію, годъ не былъ показанъ, и, слћдовательно, мы такъ и до сихъ поръ не знаемъ, когда, т.-е. въ январћ какого года будетъ разбираться этотъ вопросъ.
Просматривая нашь Журналъ Р. Ф.Х. О. за старые годы, мы легко замћчаемъ, что, напримћръ, въ номенклатурћ по органической химіи, существуетъ нћкоторая нерћшительность; такъ, напримћръ, А. Зайцевъ — вплоть до 1874 г. — пишетъ: „эфилъ”, „мефилъ”, „іодистый эфилъ”, „диэфилъ-карбинолъ”, „муравьиный эфильный эфиръ” и т. д. Вдругъ, въ томъ же томћ (Ж. 6, 308, см. также 122. 1876) появляется новая форма: іодистый „метилъ” и „этилъ”, „цинкэтилъ”, „муравейный этильный эфиръ” и т. д.
Выработкћ и распространенію современной номенклатуры по органической химіи много способствовали П. П. Алексћевъ и Н. А. Меншуткинъ; учебникъ перваго „Органическая химія”, а въ особенности „Лекціи органической химіи” послћдняго ученаго, долголћтняго редактора Журнала Р. Ф.-Х. Общ. (Н. А. состоялъ редакторомъ Ж. съ 1869 до 1900 г.) оказали въ этомъ отношеніи сильное вліяніе.
Нынћ же снова поднимается вопросъ о русской номенклатурћ; на этотъ разъ импульсъ данъ извнћ, со стороны „Международной ассоціаціи химическихъ обществъ”, въ составъ которой вошло {418} также Р. Ф.-Х. Общество. Одной изъ задачъ этой „Ассоціаціи” является также урегулированіе и объединеніе химической номенклатуры вообще, а въ зависимости отъ послћдней, конечно, и русской въ частности.
Если въ предыдущіе періоды учебная литература, въ частности учебники чистой химіи, почти безъ исключенія были заимствованы у выдающихся химиковъ запада, представляя собой русскіе переводы, главнымъ образомъ, нћмецкихъ и французскихъ учебниковъ, то начало XIX вћка характеризуется возникновеніемъ самостоятельной учебной литературы.
Профессора новооткрытыхъ высшихъ учебныхъ заведеній являются иниціаторами этого важнаго дћла; частью на нћмецкомъ, частью на русскомъ языкћ появляются первые учебники, составленные профессорами русскихъ университетовъ и высшихъ учебныхъ заведеній для своихъ слушателей. Такъ, напримћръ, А. Шереръ уже въ 1808 г. издаетъ свое „Руководство къ преподаванію химіи”; Давидъ Гриндель въ бытность свою профессоромъ химіи и фармаціи въ Дерптскомъ университетћ издаетъ учебники: Grundriss der Pharmacie zu Vorlesungen (Riga, 1806), — Handbuch der theoretischen Chemie zu academischen Vorlesungen (Dorpat, 1808), — Taschenbuch fur priifende Aerzte und Apotheker (Riga, 1808). Ив. Гизе, въ бытность свою профессоромъ Харьковскаго университета, издаетъ „Lehrbuch der Pharmacie (два тома, Рига, 1806—1811), а равно, въ переводћ Комлишинскаго, свой трудъ „Всеобщая химія для учащихъ и учащихся” (Харьковъ, 1813—1817; въ 5 томахъ). Г. Озаннъ, въ то время проф. Дерптскаго университета, издаетъ свой „Handbuch der theoretischen Chemie” (Jena, 1827) и „Messkunst der chemischen Elements” (Дерптъ, 1825). H. П. ІДегловъ, экстраординарный профессоръ физики Птг. университета, пишетъ свой курсъ „Начальныя основанія химіи” (Пгр. 1830). Наконецъ, появляется классическій учебникъ Г. Ив. Гесса „Основанія чистой химіи” (Птг. 183133), господствовавшій до шестидесятыхъ годовъ и выдержавшій семь изданій (1849 г.). Онъ былъ вытћсненъ учебниками Д. И. Менделћева: {419} „Органическая химія” (1е изд. 1861 г., 2е изд. 1863 г.) и „Основы химіи” (1е изданіе вышло въ 1868 — 1870 г., 8е и послћднее — 1905-6 г.).
„Органическая химія” Менделћева обратила на себя вниманіе даже химиковъ западной Европы; противъ обычая, Zeitschr. f. Ch. (1862, 271—276) дала объ этомъ русскомъ учебникћ весьма подробную рецензію, въ которой подчеркивается оригинальное и основательное изложеніе, а равно классификація соединеній не по радикаламъ или гипотетическимъ принципамъ, a no химическимъ ихъ функціямъ. Въ заключеніе рецензентъ даже склоненъ рекомендовать нћмецкимъ химикамъ предпринять переводъ этого замћчательнаго труда. Имя рецензента — Ќ. Бейльштейнъ, приватъдоцентъ Гёттингенскаго Университета.
Объ „органической химіи” Менделћева писалъ въ свое время A. M. Бутлеровъ, что „это единственный и превосходный оригинальный русскій трудъ по органической химіи, лишь потому неизвћстный въ западной Европћ, что ему еще не нашелся переводчикъ”. Такъ писалъ Бутлеровъ, этотъ органикъ par excellence и авторъ классическаго учебника „Введеніе къ полному изученію органической химіи” (Казань, 1864-66); оригинальность и удивительная свћжесть этого „Введенія” плћняютъ читателя еще въ XX вћкћ, а въ свое время онћ вызвали переводъ этого труда на нћмецкій языкъ (A. Butlerow, Lehrbuch der organischen Chemie, Leipzig, 1868). Этоть фактъ имћетъ историческое значеніе, представляя одинъ изъ первыхъ примћровъ перевода русскаго учебника химіи на иностранный языкъ — обратное явленіе въ Россіи считалось какъ бы нормальнымъ, и, къ сожалћнію, практикуется еще въ настоящее время въ слишкомъ широкихъ размћрахъ.
Этимъ событіемъ открывается рядъ другихъ образцовыхъ учебниковъ химіи, также переведенныхъ на иностранные языки и просуществовавшихъ до нашихъ дней. Укажемъ на „Учебникъ неорганической химіи” В. Рихтера1) (1е изд. 1874 г., а 13-ое русское изданіе, переработанное Л. Явейномъ, вышло въ 1910 г.), замћчательный {420} еще потому, что онъ представляетъ собою первый учебникъ, въ которомъ была примћнена періодическая система Менделћева: благодаря тому обстоятельству, что этотъ учебникъ уже въ 1875 г. вышелъ въ нћмецкомъ изданіи, въ 1883 г. на англійскомъ, а въ 1884 г. на итальянскомъ языкћ, идеи Менделћева нашли широкое распространеніе среди молодыхъ химиковъ западной Европы. Рихтеръ выпустилъ также русскій учебникъ органической химіи (1874), который скоро вышелъ на нћмецкомъ языкћ: „Kurzes Lehrbuch der organischen Chemie” (1876; итальянскій переводъ появился въ 1883 г., англійскій въ 1885 г.). Оба учебника Рихтера пережили автора и существуютъ въ переработанномъ видћ еще въ настоящее время (неорганическая химія въ XII нћмецк. изданіи вышла въ 1910 г., а органическая часть въ XI нћм. изд. въ 1909 г.). Этими учебниками, отличающимися ясностью изложенія и систематичностью группировки и считающимися со всякимъ прогрессомъ химіи, В. Ю. Рихтеръ пріобрћлъ заслуженную извћстность во всемъ химическомъ мірћ.
Укажемъ далће на „Аналитическую химію” Н. Меншуткина, вышедшую первымъ изданіемъ въ 1871 г.; десятое и посімертное изданіе было выпущено Б. Н. Меншуткинымъ въ 1908 г. Этотъ образцовый учебникъ аналитической химіи нашелъ много почитателей и заграницей и былъ переведенъ на нћсколько иностранныхъ языковъ; напримћръ, въ 1877 г. вышло первое нћмецкое изданіе подъ редакціею Баха, въ 1893 г. появилось англійское изданіе. Н. Меншуткинъ составилъ также обширный курсъ органической химіи „Лекціи органической химіи” (I изд. 1884, четвертое и послћднее — 1901 г.); къ сожалћнію, „Лекціи” не нашли переводчика, {421} ихъ особенность заключается въ примћненіи данныхь физической химіи при изложеніи свойствъ и строенія органическихъ тћлъ.
Весьма широкое распространеніе на западћ получилъ еще и другой русскій учебникъ по аналитической химіи: „Руководство къ качественному химическому анализу” Ќ. Ќ. Бейльштейна (Спб. 1867 г.), появившійся въ 1867 г. также и на нћмецкомъ языкћ подъ заглавіемъ „Anleitung zur qualitativen chemischen Analyse” (Лейпцигъ 1867). Маленькое „руководство” Бейльштейна и „Введеніе” Бутлерова — два русскихъ учебника химіи, открывающихъ новую эпоху въ исторіи развитія русской учебной химической литературы. Съ момента перевода этихъ учебниковъ на иностранные языки начинается обратное теченіе химической педагогической литературы съ востока на западъ; Россія, столь продолжительное время снабжавшаяся переводной литературою съ запада, нынћ сама начинаетъ не только производить собственную химическую литературу, но выступаетъ даже въ качествћ соперницы на западномъ литературномъ рынкћ, изобилующемъ богатой и превосходной химической литературой. Явленіе, дћйствительно, знаменательное. Руководство Бейльштейна скоро переводится на голландскій (1868), англійскій (переводчикомъ оказывается нынћ знаменитый Вильямъ Рамзай, 1873) и французскій языки (1883). Съ того времени прошло почти полвћка, а это „Anleitung zur qualitativen chemischen Analyse” все еще служитъ руководствомъ для новыхъ поколћній химиковъ (9ое изданіе вышло въ 1909 г.).
Но Бейльштейнъ создалъ еще другой трудъ, значеніе и слава котораго переживутъ многія поколћнія химиковъ, трудъ, сдћлавшійся прототипомъ для другихъ отдћловъ химической науки и прочнымъ памятникомъ энергіи, знаній и трудолюбія своего автора. Это „Handbuch der organischen Chemie”, вышедшій впервые въ двухъ томахъ въ 1881—1883 г. въ Лейпцигћ; третье изданіе его появилось уже въ четырехъ томахъ (1893—1899 г.); прощаясь въ 1899 г. съ почти сорокалћтней работою, Бейльштейнъ передаетъ дальнћйшее изданіе Handbuch'a Химическому Обществу въ Берлинћ, которое съ своей стороны уже выпустило 5 дополнительныхъ томовъ (съ 1901—1906 г.). Нынћ „Beilstein”, какъ называется его трудъ на западћ, является standard work'омъ каждой лабораторіи какъ чистой, такъ и технической органической химіи. Болтонъ, американскій химикъ, охарактеризовалъ этотъ трудъ въ слћдующихъ краткихъ словахъ: „A stupendous monument of industrious, {422} intelligent compilation”. Оцћнка практическаго значенія подобнаго труда вылилась у другого поклонника-американца въ предложеніи Бейльштейну: „make an inorganic chemistry!”.
Если въ настоящее время „Бейльштейнъ” завоевалъ весь ученый міръ химиковъ органиковъ, если его „Руководство”, а равно „Аналитическая химія” Меншуткина распространены среди студентовъ-практикантовъ въ химическихъ лабораторіяхъ запада, если учебники неорганической и органической химіи Рихтера не перестаютъ употребляться молодыми химиками запада, то это еще не единственные успћхи генія русскихъ химиковъ-педагоговъ. Капитальный трудъ Д. И. Менделћева „Основы химіи”, хотя и поздно проникнувъ, все-таки широко распространенъ въ западномъ мірћ. Въ 1891 г. вышелъ англійскій переводъ, сдћланный Г. Каменскимъ, „The Principies of Chemistry”, London, въ 1892 г. былъ изданъ нћмецкій переводъ Л. Явейна и А. Тилло: „Grundlagen der Chemie”, Спб., а въ 1896—1899 гг. появился французскій переводъ „Principes de Chimie”, Paris.
Къ числу классическихъ руководствь по химіи, составленныхъ русскими учеными, принадлежитъ также образцовое руководство В. Оствальда, написанное имъ въ г. Ригћ: „Lehrbuch der allgemeinen Chemie. I Band: Stochiometrie (1885), II Band: Verwandschaftslehre (1887)”. Этотъ учебникъ имћетъ историческое значеніе; въ немъ впервые былъ данъ полный обзоръ физической (общей) химіи. Примћняя историко-критическій методъ, Оствальдъ представляетъ намъ привлекательную картину этой области химіи, открывая новые горизонты химическому изслћдованію. И дћйствительно, начало новой физической химіи, какъ самостоятельной науки, считается съ 1885 г., „потому что, вопервыхъ, въ этомъ году появилась знаменитая работа Вантъ-Гоффа о растворенныхъ веществахъ... и, вовторыхъ, въ томъ же году Оствальдъ1) издалъ первый {423} томъ своего капитальнаго руководства физической химіи” (В. Нернстъ).
Но не только по чистой химіи, напримћръ, органической, неорганической и физической, русскими химиками былъ созданъ рядъ классическихъ руководствъ и учебниковъ, пріобрћтшихъ нынћ право гражданства во всемъ химическомъ мірћ, — по технической химіи русская научная литература обладаетъ не менће выдающимися по своему содержанію и изложенію, вполнћ самостоятельными трудами, заслуживающими перевода на иностранные языки. Укажемъ лишь на трудъ профессора Технологическаго Института Н. И. Витта „Промышленная химія”, въ 2 томахъ (Птг. 1847-8 г.) съ собраніемъ чертежей, на „Курсъ Химической Технологіи” (1851) П. А. Ильенкова (1821—1877; съ 1850 г. проф. хим. технологіи въ Птг. Унив., впослћдствіи съ 1865 до 1875 г. проф. въ Петровско-Разумовской Академіи), далће на „Химическую технологію”, въ 2 томахъ, Птг., 1888-9 г. Н. И. Тавилдарова (род. 1846 г. въ Тифлисћ, 1880—1893 г. проф. хим. технол. въ Птг. Технол. Инстит., съ 1900 г. Управл. Отд. Пром. Учил. М. Н. Пр., нынћ Управл. Экспед. Загот. Госуд. Бумагъ). Изъ трудовъ новћйшаго времени особаго вниманія достойны: „Курсъ Химической Технологіи” въ 4 выпускахъ (1900), составленный Ник. Ник. Бунге (род. 1842 г., съ 1871 г. состоитъ орд. проф. техн. химіи въ Кіевскомъ Университетћ), а равно и „Техническая химія” въ 5 томахъ (V томъ 1910 г.) Ник. Ник. Любавина (род. 1845 г., съ 1890 г. проф. технической химіи въ Московскомъ Университетћ).
Какъ видно изъ этихъ данныхъ, главными творцами научной литературы по технической химіи или химической технологіи являются и профессора какъ спеціальныхъ высшихъ учебныхъ заведеній, такъ и университетовъ. Вћдь при нашихъ университетахъ, напримћръ при Московскомъ, Казанскомъ, Кіевскомъ, Петроградскомъ, {424} существуютъ особыя каќедры технической химіи. Приведемъ нћсколько интересныхъ данныхъ изъ многострадальной судьбы этой каќедры технической химіи въ Казанскомъ Университетћ. Первымъ профессоромъ „технологіи и наукъ, относящихся къ торговлћ и фабрикамъ” былъ саксонецъ Іог.-Фр. Хр. Вуттигъ (1808—1812); его пренодаваніе не дало особыхъ результатовъ, но Вуттигу слћдуетъ поставить въ заслугу, что онъ старался при содћйствіи своихъ русскихъ коллегъ передавать нћмецкіе техническіе термины на русскій языкъ. Вуттигъ зналъ практически фабрикацію купороснаго масла и издалъ по этому вопросу особую монографію. Онъ написалъ также „Основанія математическаго метода химіи”.
Преемникомъ его былъ Фил. Леонтьев. фонъ Брейтенбахъ (съ 1812 до 1819 г.). Онъ же преподавалъ сельское домоводство и написалъ много работъ; изъ числа его трудовъ были переведены на русскій языкъ руководства по винокуренію (1804), хмћлеводству (1812), добыванію торфа и каменнаго угля и т. д. Въ 1819 г. попечитель Магницкій уволилъ Брейтенбаха, такъ какъ онъ преподаетъ лекціи „сихъ тщетныхъ наукъ” весьма недостаточно и безполезно! Тотъ же Магницкій упразднилъ въ 1822 г. положенную по штату каќедру другого практическаго предмета, агрономіи или „сельскаго хозяйства”, и учредилъ на мћсто ея каќедру французской литературы! Мотивы его не менће курьезны: „Весь вредъ, замћченный въ нашихъ университетахъ, произошелъ отъ образованія, книгъ и людей, заимствованныхъ отъ германскихъ университетовъ. Тамъ зараза невћрія и началъ возмутительныхъ, возникшая въ Англіи, усиленная въ прежней Франціи, сдћлалась полною системою и, такъ сказать, классическою. Наука и литература сћверной Германіи такъ заражены этою язвою, что могутъ быгь употреблены только съ величайшею осторожностью” и т. д.
Кромћ вышеупомянутыхъ крупныхъ произведеній химической педагогической литературы, принадлежащихъ международному рынку, слћдуетъ еще обрдтить вниманіе на богатую литературу, имћющую значеніе для внутренняго рынка. Приведемъ нћсколько примћровъ, показывающихъ оригинальный характеръ русскихъ учебниковъ.
| {425} |
Ф. М. Флавицкій. Общая или неорганическая химія (II изд., Казань, 1898).
А. Л. Потылицынъ. Начальный курсъ химіи (8ое изд., Спб., 1904).
A. И. Горбовъ. Химическіе элементы. Металлоиды (Спб., 1908).
B. В. Куриловъ. Учебникъ химіи (Екатеринославъ, 1909).
И. П. Осиповъ. Лекціи неорганической химіи (Харьковъ, 1911), 2-е изд. 1913.
И. А. Каблуковъ. Основныя начала неорганической химіи (5-е изд., Москва, 1912).
Г. В. Коршунъ и Е. Хотинскій. Курсъ общей химіи (I часть, Харьковъ, 1912).
В. Н. Ипатьевъ и А. Сапожниковъ. Курсъ неорганической химіи (5ое изд., Спб., 1912).
A. M. Зайцевъ. Курсъ органической химіи (Казань, 1890—92).
П. П Алексћевъ. Органическая химіи (3-ье изд., Кіевъ, 1884).
Его же. О методахъ превращенія органическихъ соединеній (Кіевъ, 1889). Переведено на французскій языкъ.
С. Н. Реформатскій. Начальный курсъ органической химіи (11-ое изд., Кіевъ, 1913).
И. П. Осиповъ. Введеніе къ изученію органической химіи (2ое изд., Харьковъ, 1910).
B. Н. Ипатьевъ. Курсъ органической химіи (3-е изд., Спб., 1911). А. С. Гинзбергъ. Курсъ органической химіи (I часть, Спб., 1913).
Г. Г. Густавсонъ. Двадцать лекцій агрономической химіи (Москва, 1889).
Г. Коршунъ. Нћкоторые химическіе процессы въ лабораторіяхъ и растительныхъ организмахъ (Харьковъ, 1910).
Л. А. Чугаевъ. О химическомь строеніи комплексныхъ соединеній (Спб., 1910).
C. A. Bischoff и P. Walden. Handbuch der Stereochemie (Frankf., 1893-4). {426}
С. A. Bischoff. Materialien der Stereochemie. Два тома. (Braunschew., 1904).
Ш. Безрћдко и Н. Зелинскій. Опытъ исторіи развитія стереохимическихъ представленій (Одесса, 1892).
Вл. Ипатьевъ. Руководство для практическихъ занятій по химіи, Птр.
Э. Фрелихъ. Практическое введеніе въ органическую химію (Рига, 1912).
Н. Н. Любавинъ. Физическая химія (Спб., 18767).
W. Ostwald. Lehrbuch der allgemeinen Chemie, I Bd. Leipzig, 1885; II Bd., Leipzig, 1887. Второе (незаконченное) изданіе съ 1891 до 1902 г.
W. Ostwald. Grundriss der allgemeinen Chemie, I изд. 1891, послћднее (IVe) — въ 1908 г. Первый русскій переводъ подъ редакціей И. Каблукова: Москва, 1891 г., послћдній, подъ редакціей П. фонъ-Веймарна, Спб., 1911.
W. Ostwald. Wissenschafliche Grundlagen der analytischen Chemie, I изд. 1894, послћднее 1910 года. Первый русскій переводъ подъ редакціей П. Вальдена, Рига, 1894; второй — А. Комаровскаго, съ предисловіемъ Вальдена. (Спб., 1911).
П. Хрущовъ. Введеніе къ изученію теоріи химическихъ равновћсій (Харьковъ, 1894).
И. А. Каблуковъ. Основныя начала физической химіи (Въ 3-хъ частяхъ, I ч., второе изд., 1912; II часть, 1902; III ч. 1910. М.).
В. А. Плотниковъ. Введеніе въ изученіе физической химіи (Кіевъ, 1910).
Joh. Plotnikow. Photochemie (Stalle a. S., 1910).
П. П. Веймарнъ. Къ ученію о состояніи іиатеріи (Спб., 1910).
P. P. von Weimarn. Grundzuge der Dispersoidchemie (Dresden, 1911).
H. M. Витторфъ. Теорія сплавовъ (Спб., 1909).
Укажемъ также на слћдующіе классическіе труды, въ виду широкаго мћста, отведеннаго въ нихъ физической химіи и электрохиміи:
О. Д. Хвольсонъ. Курсъ физики (въ 4-хъ томахъ), III изд. (Спб., съ 1908 г). {427}
В. И. Вернадскій. Основы кристаллографіи. Москва, 1903 (см. также его трудъ: Опытъ описательной минералогіи. Спб., 1908).
Н. А. Меншуткинъ. Очеркъ развитія химическихъ воззрћній. (Спб., 1888).
W. Ostwald. Elektrochemie. Ihre Geschichte und Lehre. (Leipzig, 1896).
B. Оствальдъ. Эволюція основныхъ проблемъ химіи. Переводъ подъ ред. Шпитальскаго (Москва, 1909).
W. Ostwald. Entwicklung der Elektrochemie (Leipzig, 1910). И. A. Каблуковъ. Очерки изъ исторіи электрохиміи за XIX вћкъ (Москва, 1901).
P. Walden. Die Lostingstheorien in ihrer geschichtlichen Aufeinanderfolge (Stuttgart, 1910).
Кромћ того необходимо указать на подробные біографическіе труды Б. Н. Меншуткина (М. В. Ломоносовъ, 1904 и 1911 г.; Н. А. Меншуткинъ, Спб. 1908), П. И. Вальдена (W. Ostwald, 1904; Д. И. Менцелћевъ, 1909).
Цћнныя данныя по исторіи химическихъ лабораторій въ Россіи даетъ Ломоносовскій сборникъ, вышедшій подъ редакціею Вл. В. Марковникова (Москва, 1901 г.).
Въ 1803 г. учреждается въ г. Ригћ Фармацевтическо-химическое Общество; однимъ изъ основателей его былъ аптекарь Дав. Гриндель (род. въ Ригћ въ 1776 г., гдћ и умеръ въ 1836 г.), занимавшій съ 1804 до 1814 г. каќедру химіи и фармаціи въ Дерптскомъ (Юрьевскомъ) университетћ1). {428}
Въ 1804 г. при Московскомъ Университетћ, по мысли попечителя университета М. Н. Муравьева, было основано Физико-медицинское Общество, которое съ 1808 г. стало издавать свои труды подъ названіемъ „Commentat. societ. physico-medicae”.
Въ 1805 г. при Московскомъ Университетћ, по мысли Г. И. Фишера фонъ-Вальдгейма, было основано Императорское Московское Общество испытателей природы, которое съ 1806 г. стало издавать свои труды подъ заглавіемъ „Mem. Soc. der Natur (Memoires, 1806—1823; Nouv. memoires, съ 1829 r. Bulletin, съ 1829 r.).
Въ 1816 г. было основано Императорское Минералогическое Общество въ Пгр., издававшее „Труды”, а съ 1842 г. „Записки”.
Кромћ основанныхъ еще въ XVIII вћкћ и сейчасъ упомянутыхъ журналовъ и мемуаровъ, печатающихъ также изслћдованія по химіи, къ началу XIX вћка возникла еще новая періодическая литература.
Съ 1803—1808 г. Гриндель (см. выше) издаетъ въ г. Ригћ первый фармацевтическій журналъ въ Россіи „Russisches Jahrbuch der Pharmacie”.
Продолженіемъ послћдняго является съ 1809—1810 г. ежегодникъ „Russisches Jahrbuch fur Chemie und Pharmacie” (г. Рига), издаваемый Ив. Гизе (см. выше) и Гринделемъ. {429}
Новая попытка изданія самостоятельнаго химическаго журнала въ Россіи, также на нћмецкомъ языкћ, была сдћлана Шереромъ (см. выше); но и эта попытка оказалась преждевременной. Его „Nordische Blatter fur Chemie (Halle, 1817), скоро переименованные въ „Allgemeine Nordische Annalen der Chemie” (Спб. 1819—1822), должны были прекратиться, хотя они обратились за содћйствіемъ ко всћмъ „друзьямъ естествознанія и медицинскихъ наукъ, въ особенности фармаціи, физіологіи, физики, минералогіи и технологіи въ Русскомъ Государствћ”.
Въ 1825 г. горный департаментъ сталъ издавать „Горный журналъ”, въ кругъ котораго входитъ также химія.
Кромћ того проф. Н. П. Щегловъ основалъ особый журналъ „Указатель открытій по физикћ, химіи, естественной исторіи и технологіи”, просуществовавшій съ 1824 по 1831 г., благодаря трудамъ редактора, заполнявшаго его почти исключительно своими переводами.
Послћ долгаго перерыва два химика оптимиста Н. Соколовъ и А. Энгельгардтъ1) приступили къ изданію перваго русскаго химическаго журнала. Въ 1859 г. вышла первая книжка „Химическаго журнала” обоихъ ученыхъ. Во вступительномъ словћ редакціи мы читаемъ слћдующее: „Полагая, что въ нашемъ обществћ есть уже много людей, настолько развитыхъ, чтобы сознательно принять на себя всегда не легкій трудъ основательнаго изученія химіи, надо желать, чтобы существовали необходимыя для этого средства. Эти средства главнымъ образомъ состоятъ: 1) въ учебникахъ, излагающихъ науку въ настоящемъ ея состояніи; 2) въ публичной лабораторіи, потому что только съ помощью практическихъ занятій совершенно ясно усваивается узнанное изъ книгъ...; наконецъ 3) въ спеціальномъ химическомъ журналћ, который, безпрестанно сообщая всћ новћйшія открытія въ наукћ, постоянно поддерживалъ бы на высотћ современности тћхъ членовъ общества, которые спеціально занимаются химіею”.
Для исполненія этой программы оба химика въ 1857 г. устроили публичную химическую лабораторію, дозволяя „каждому заниматься совершенно свободно, чћмъ угодно и какъ угодно, лишь бы это дћлалось безъ стћсненія другихъ”. Новый {430} журналъ долженъ былъ сообщать оригинальныя изслћдованія русскихъ химиковъ, переводы, извлеченія, разборы, различныя извћстія и т. д. Сколько оказалось въ это время русскихъ химиковъ, труды которыхъ вошли въ первые два тома журнала за 1859 г.? Вотъ недлинный списокъ: Бейльштейнъ, Бекетовъ, Бородинъ, Бутлеровъ, Гарницъ-Гарницкій, Головкинскій, Ивановъ, Лавровъ и Короваевъ (и Яцуковичъ), Менделћевъ, Соколовъ1), Энгельгардтъ2). Въ первомъ томћ новаго журнала, съ первой же страницы, Н. Соколовъ помћщаетъ классическій обзоръ „О современномъ направленіи химіи”, гдћ онъ даетъ изящное и точное изложеніе теоріи типовъ своего учителя Жерара. Въ слћдующемъ (1860) году вышли еще два тома этого журнала, послћ чего и кончилось смћлое начинаніе двухъ химиковъ-идеалистовъ, журналъ прекратилъ свое существованіе, а лабораторія ими была пожертвована Пгр. Университету (въ которомъ до этого фактически не было лабораторіи для занятій студентовъ).
Крупнымъ событіемъ въ научной жизни Россіи явился I съћздъ русскихъ естествоиспытателей, собравшійся въ Петроградћ (съ 28го декабря 1867 г. по 4 янв. 1868 г.) и принесшій богатую научную жатву, и, что можетъ быть еще важнће, давшій русскимъ ученымъ, въ частности семьћ химиковъ, увћренность {431} въ достаточности наличныхъ силъ для организаціи Xимическаго Общества. И дћйствительно, съ необычайною для столь важнаго предпріятія скоростью, благодаря энергіи Д. И. Менделћева и Н. А. Меншуткина, уже 6-го ноября 1868 г. возникаетъ Русское Химическое Общество при Петроградскомъ Университетћ, „съ цћлью содћйствовать успћхамъ всћхъ частей химіи и распространять химическія знанія”. Несмотря на роковое число 13 (число статей несложнаго устава новаго общества), новый разсадникъ химіи начинаетъ свою дћятельность при 47 членахъ, а первымъ президентомъ является Н. Н. Зининъ.
Роль Р. Хим. Общества (впослћдствіи Р. Физ.-Хим. Общ.) въ дћлћ сплоченія и объединенія русскихъ химиковъ, а равно въ воспитаніи и поддержкћ молодыхъ химическихъ силъ безспорно велика. Засћданія общества представляли мћсто соприкосновенія химиковъ различныхъ направленій и возрастовъ, доклады сопровождались преніями и треніями, но являлись при этомъ школою для старыхъ и молодыхъ. Издаваемый съ 1869 г. журналъ Р. X. О. представляетъ важный памятникъ русской химіи; уже въ первомъ году своего существованія ему суждено было помћстить на своихъ страницахъ трудъ, имћющій историческое значеніе и прославившій русскій научный геній на всћ времена, а именно трудъ Д. И. Менделћева (6го марта 1869 г.): „Соотношеніе свойствъ съ атомнымъ вћсомъ элементовъ”1). Въ западной Европћ стали обращать серьезное вниманіе на дћятельность Р. X. О. и на труды, печатаемые въ журналћ, благодаря Викт. Юльев. Рихтеру, который далъ первыя извћстія о Р. X. Общ. и составлялъ рефераты о засћданіяхъ, регулярно печатавшіеся въ Berichte der D. Chem. Ges. (начиная съ II тома, стр. 508, 1869).
Перелистывая нынћ 45 томовъ Журнала Р. Ф.Х. О.2), мы видимъ, какъ въ немъ мало-помалу уплотняются, сгущаются разсћянныя до этого времени творческія единицы и какъ пробуждаются къ жизни все новыя и новыя; въ настоящее время сумма всћхъ этихъ единицъ представляетъ уже внушительное количество интеллектуальной энергіи химіи XX вћка.
Чтобы иллюстрировать упомянутый ростъ Р. Ф.-Х. Общ., приведемъ маленькую таблицу, показывающую число членовъ Химич. {432} отдћленія и число напечатанныхъ научныхъ химическихъ трудовъ, a равно число занимаемыхъ этими трудами страницъ Журнала:
Годъ |
Томъ Ж. |
Число член. |
Число напеч. |
Число стран. |
1869 |
I |
47 |
38 |
264 |
1879 |
XI |
119 |
49 |
414 |
1889 |
XXI |
233 |
57 |
563 |
1899 |
XXXI |
293 |
83 |
1061 |
1911 |
XLIII |
387 |
135 |
1831 (+ 288 стр.) |
1912 |
XLIV |
411 |
156 |
2000 (+ 238 „) |
1913 |
XLV |
514 |
153 |
2078 |
Химическая продуктивность русскихъ ученыхъ, какъ видимъ, развивается съ замћчательной скоростью.
Если журналъ Р. Ф.-Х. О. имћетъ значеніе, какъ русскій органъ русскихъ химиковъ всћхъ направленій, то другой журналъ, основанный въ Россіи (въ гор. Ригћ) русскимъ химикомъ, пріобрћлъ значеніе международнаго органа физико-химиковъ: — „Zeitschrift fur physikalische Chemie, Stöchiometrie und Verwandtschaftslehre”, задуманный В. Оствальдомъ въ 1886 г. и вышедшій впервые въ 1887 г. (въ Лейпцигћ). Издателями-редакторами этого журнала, проложившаго путь къ развитію физической химіи вообще, состояли В. Оствальдъ и Вантъ-Гоффъ; въ числћ сотрудниковъ-основателей мы находимъ имена величайшихъ химиковъ всћхъ странъ, въ томъ числћ и Россіи (Д. И. Meнделеевъ и Н.А. Меншуткинъ). Лишь смерть стерла ихъ имена съ заглавной страницы журнала (съ 57-го тома, 1907), а нынћ (начиная съ 62-го тома, 1908) русскіе химики представлены здћсь П. Вальденомъ.
Роль этого журнала въ исторіи современной химіи чрезвычайно велика; ростъ физической химіи за истекшее 25-лћтіе (1887—1912) иллюстрируется появившимися за этотъ періодъ 79 томами этого журнала, являющимися standard work'омъ въ равной степени для химиковъ, физиковъ и минералоговъ. Къ началу 1914 г. вышло уже 86 томовъ!
| {433} |
Если въ XVII и, главнымъ образомъ, въ XVIII вћкћ химиками въ Россіи были по преимуществу иностранцы, а ихъ труды преслћдовали по преимуществу національныя цћли, т.-е. культурное благо Россіи, то XIX вћкъ даетъ намъ все возрастающее число національныхъ русскихъ химиковъ, а ихъ научные труды должны быть разсматриваемы и оцћниваемы не столько съ русской, сколько съ международной, общенаучной точки зрћнія, въ смыслћ вліянія ихъ на ходъ, развитіе и ростъ химическихъ знаній вообще. Лишь при такомъ ограниченіи открывается возможность оріентироваться въ этомъ громадномъ количествћ изслћдованій, которыя за этотъ столћтній періодъ были произведены сотнями русскихъ химиковъ.
Предметы этихъ изслћдованій, конечно, столь же разнородны, сколь разнородны вообще вопросы химіи. Частью они обусловливаются химическою модою, т.-е. проблемами и направленіями, господствовавшими въ свое время въ химіи; частью они вызываются открывавшимися физикой новыми формами энергіи; частью русскій геній самъ открываетъ новыя научныя области и обогащаетъ международную химію новыми законами; частью, наконецъ, условія русской жизни и природныя богатства Россіи даютъ поводъ и предметы для новыхъ химическихъ изслћдованій и открытій.
Но первыя десятилћтія новаго періода, приблизительно до 40-хъ годовъ ХІХ-го столћтія, довольно рћзко отличаются отъ послћдующихъ десятилћтій. Производительность русскихъ химиковъ очевидно не соотвћтствовала еще возложеннымъ на нихъ ожиданіямъ: общему числу представителей химіи не соотвћтствуетъ ни число, ни качество произведенныхъ ими самостоятельныхъ экспериментальныхъ работъ, такъ какъ они трудились преимущественно, какъ педагоги, организаторы и литераторы. Кромћ того, отсутствовали необходимыя для собственныхъ изслћдованій лабораторіи*), а равно и матеріальныя средства. Вслћдствіе этого ни въ одномъ изъ открывшихся центровъ высшаго образованія не возникла химическая школа; ни одинъ изъ тогдашнихъ представителей химіи не собралъ около себя талантливыхъ молодыхъ химиковъ, не воспиталъ будущихъ представителей научной химіи въ Россіи. {434}
Другія обстоятельства тоже не благопріятствовали осуществленію этого идеала.
Для характеристики взглядовъ на науку какъ у представителей ея, такъ и у покровителей просвћщенія въ этотъ далекій періодъ времени, приведемъ нћсколько фактовъ. Въ 1821 г. Ив. Ив. Дунаевъ, адъюнктъ по химіи и металлургіи въ Казанскомъ университетћ, произнесъ на годичномъ актћ рћчь: „О пользћ и злоупотребленіяхъ наукъ естественныхъ и о необходимости ихъ основывать на христіанскомъ благочестіи”. Попечитель Казанскаго учебнаго округа Магницкій призналъ эту рћчь „первой въ своемъ родћ, изъ произносимыхъ на сей предметъ въ университетахъ”, и вслћдствіе этого Дунаевъ въ 1821 г. былъ произведенъ въ экстраординарные профессоры. Тотъ же Магницкій въ 1823 г. назначилъ доктора медицины Франца Пелатье, французскаго уроженца, адъюнктомъ по химіи, который долженъ былъ читать еще „малую хирургію и десмургію”; Пелатье читалъ химію по руководствамъ Тенара и Томсона и др. на французскомъ языкћ (1823—1825)!
Какія требованія предъявлялись къ тћмъ, кто желалъ получить ученую степень? Возьмемъ, какъ классическій примћръ, магистерскій экзаменъ Н. Н. Зинина въ Казанскомъ университетћ (1835 г.). Экзаменъ для полученія степени магистра физико-математическихъ наукъ обнималъ чистую математику, прикладную математику и астрономію и, наконецъ, химію; — экзаменъ по всћмъ этимъ научнымъ дисциплинамъ, устный и письменный, производился впродолженіе одного мћсяца; при этомъ экзаменующемуся было задано на устномъ экзаменћ всего 50 вопросовъ, на письменномъ — для отвћта подъ наблюденіемъ одного изъ членовъ факультета — всего 8 вопросовъ; написанные отвћты занимали 371/2 листовъ! Заданные по химіи два вопроса для письменнаго отвћта гласили: 1) о селитротворћ (азотћ) и химическихъ соединеніяхъ его съ кислотворомъ (кислородомъ), 2) объ углетворћ (углеродћ) и соединеніяхъ его съ кислотворомъ; отвћтъ былъ написанъ на 12 листахъ. Какъ видно, вопросы относятся къ неорганическимъ простымъ соединеніямъ. По окончаніи экзамена факультетъ предложилъ Зинину тему для диссертаціи: „О явленіяхъ химическаго сродства и о превосходствћ теоріи Берцеліуса о постоякныхъ химическихъ пропорціяхъ предъ химическою статикою Бертолетта”, — тема относится къ фундаментальнымъ вопросамъ, т.-е. къ теоретической физической химіи. {435}
Диссертація была написана и представлена черезъ годъ. Результаты этой диссертаціи и вмћстћ съ тћмъ отвћты на заданную тему явствуютъ изъ 10 положеній магистранта; изъ нихъ приведемъ нижеслћдующія:
1. Различныя состоянія тћлъ суть различные случаи равновћсія системы частичекъ (Изомерія?).
4. Заключеніе Митчерлиха объ одинаковой форменности кали и натра неосновательно (Изоморфизмъ невћренъ?).
5. Теорія Гротгуса и Ларива химическаго дћйствія электрическаго потока неудовлетворительна.
6. Теорія электрохимическая (Берцеліуса?) неудовлетворительна.
7. Правило химическихъ массъ ложно.
10. Мнћніе Бертолетта о строеніи растворовъ ложно.
Какъ видимъ, магистрантъ оказался очень строгимъ критикомъ и дальновиднымъ отрицателемъ.
Другой классическій примћръ, относящійся къ болће позднему періоду и соотвћтствующій измћнившемуся состоянію химической науки, магистерскій экзаменъ A. M. Бутлерова въ томъ же Казанскомъ университетћ, въ 1850 г. Экзаменъ производился по всћмъ отдћламъ химіи, минералогіи и физики и продолжался около мћсяца; письменное испытаніе по химіи содержало слћдующіе три вопроса: 1) дћйствіе галоидовъ на простыя и сложныя тћла, на металлы, на неметаллическія тћла, на сћрнистыя соединенія, на окиси; 2) о радикалћ эфилћ (этилћ); 3) характерныя содержанія металловъ первой группы, ихъ реагенты, отдћленіе ихъ изъ общей смћси. Первый вопросъ относится къ неорганической, второй — къ органической, a третій — къ аналитической химіи. При сравненіи съ предыдущимъ экзаменомъ (1835 г.) сказывается, какъ дифференціація, такъ и увеличеніе химическихъ научныхъ познаній. Экзаменъ былъ законченъ въ концћ октября, а уже въ началћ будушаго (1851) года магистрантъ представилъ диссертацію подъ заглавіемъ: „Объ окисленіи органическихъ соединеній”. По отзыву Клауса, диссертація оказалась превосходной и представляла собою полный систематическій обзоръ всћхъ извћстныхъ фактовъ, разбросанныхъ въ разныхъ сочиненіяхъ.
Распространенный у насъ modus vivendi молодого ученаго въ періодъ его формированія съ сарказмомъ бичуетъ А. И. Энгельгардтъ (въ письмћ Л. Н. Шишкову отъ 1857 г.): „Но вотъ еще новость: Ск. ћдетъ за границу на 6 мћсяцевъ и намћренъ, какъ онъ мнћ {436} говорилъ, работать одинъ мћсяцъ у Бунзена, одинъ мћсяцъ у Вюрца, быть четыре дня въ Мюнхенћ и т. д. Ну, не скажите пожалуйста? Пріћдетъ назадъ, будетъ держать на доктора и прочтутъ въ біографіи: былъ заграницей, работалъ у Бунзена, у Вюрца .... Представьте себћ: я до сихъ поръ еще такъ молодъ, что это меня бћситъ”. (Ж. 42, 1343).
Бутлеровъ передаетъ разговоръ, который онъ имћлъ съ Либихомъ по поводу работоспособности русскихъ молодыхъ химиковъ, занимавшихся въ его Гиссенской лабораторіи:
„Мнћ не разъ приходилось встрћчать молодыхъ русскихъ химиковъ, дћлавшихъ въ нашихъ лабораторіяхъ весьма интересныя изслћдованія и подававшихъ надежды сдћлаться талантливыми учеными, но по возвращеніи въ Россію они обыкновенно переставали работать. Какая тому причина?” И какъ правъ былъ Либихъ! вћдь стоитъ намъ привести лишь одинъ примћръ, чтобы сразу и наглядно иллюстрировать всю тяжесть этого явленія: вспомнимъ судьбу Воскресенскаго! (см. о немъ).
Новооткрытая сила природы — вольтово-гальваническое электричество — сразу встрћтила въ Россіи живой откликъ и нашла цћлый рядъ выдающихся изслћдователей. Скажемъ больше: электрохимія обязана своимъ развитіемъ замћчательнымъ трудамъ химиковъ въ Россіи. Однимъ изъ первыхъ въ этой новой области является Вас. Влад. Петровъ (1762—1834), самоучка и искусный физикъ-экспериментаторъ. Въ 1799 г. Вольта сдћлалъ свое великое открытіе новаго источника электричества, — уже въ 1803 г. Петровъ печатаетъ свой трудъ „Извћстіе о гальвани-вольтовскихъ опытахъ посредствомъ огромной батареи, состоявшей иногда изъ 4200 мћдныхъ и цинковыхъ кружковъ” (Спб., 1803). Изъ числа этихъ замћчательныхъ, къ сожалћнію недостаточно оцћненныхъ, опытовъ упомянемъ лишь объ электролизћ окисловъ ртути, свинца, олова, а равно органическихъ тћлъ (маселъ, спирта, эфировъ) и воды, о полученіи вольтовой ауги между двумя кусками древеснаго угля: „является между ними весьма яркій бћлаго цвћта свћтъ или пламя, отъ котораго темный покой довольно ясно освћщенъ {437} быть можетъ!”, онъ изучаетъ электропроводность и при низкихъ температурахъ (ледъ — непроводникъ) и т. д. Вообще Петровъ является однимъ изъ предшественниковъ знаменитыхъ Дэви и Фарадэя.
Хронологически за нимъ слћдуетъ другой самоучка, уроженецъ Курляндской губерніи баронъ Ќеодоръ Гротгусъ (Theodor von Grotthuss). Онъ родился въ 1785 г., воспитывался въ деревнћ, послћ кратковременныхъ путешествій занимался (съ 1808 г.) сельскимъ хозяйствомъ въ имћніи, гдћ и произведены были его разнородные оптическіе, электрическіе и химическіе опыты; умеръ въ 1822 г. Въ 1805 г. въ Римћ, двадцати лћтъ отъ роду, онъ опубликовалъ свой трудъ „Мёmоіrе sur la decomposition de l'еаu et des corps qu'elle tient en dissolution a Taide de l'electricite galvanique” (cp. также: Ann. de chimie et de phys. 58, 54, 1806), нћмецкій переводъ въ Митавћ, 1806), гдћ излагается его теорія механизма электролиза, оказавшая величайшее вліяніе на электрохимію1) и дополненная черезъ полъвћка (1854) Клаузіусомъ; уже въ этой первой работћ Гротгусъ высказываетъ мысль, что химическіе процессы по существу являются электрическими. Въ 1819 г. онъ2) развиваетъ взглядъ, что внутри раствора происходитъ самопроизвольно, безъ электрическаго тока, постоянный обмћнъ между атомами, т.-е. взглядъ, высказанный лишь черезъ полвћка Вилліамсономъ и Клаузіусомъ и усовершенствованный Арреніусомъ (1884)3).
Ко времени возникновенія электрохиміи относится и открытіе Рейсса, сдћланное въ Москвћ.
Фердин. Фридр. Рейссъ (род. 1778 въ Тюбингенћ, скончался 1852 г. въ Штутгартћ) состоялъ съ 1804 до 1832 г., профессоромъ химіи Московскаго университета, а съ 1817 до 1839 г. профессоромъ химіи въ Московскомъ Отдћленіи Императорской МедикоХирургической Академіи. Въ это время вћянія новой химіи еще не коснулись Московскаго университета; лишь въ 1803 г. благодаря заботамъ попечителя университета Муравьева, по рисункамъ Ловица была заведена маленькая химическая лабораторія и пріобрћтены сочиненія Лавуазье и Фуркруа. Рейссъ оказался весьма плодовитымъ и полезнымъ химикомъ, но отсталымъ въ вопросахъ теоріи; свои {438} университетскія лекціи онъ читаль на латинскомъ языкћ цицероновскимъ слогомъ, по учебнику Гермбштедта (съ 1791 г.), составленному въ духћ флогистической эпохи; свои публичныя лекціи (читавшіяся съ 1803 г. по естествознанію московскими знаменитостями) Рейссъ1) читалъ по-французски. Его изслћдованія касаются вопросовъ медицинской химіи: уже первое его изслћдованіе, произведенное имъ совмћстно съ Эммертомъ,— первое вообще химическое изслћдованіе лимфы — обратило на себя вниманіе наилучшихъ химиковъ этого времени. Онъ же изслћдовалъ составъ Кавказскихъ минеральныхъ водъ (1812 г.) и положилъ въ Москвћ начало приготовленію искусственныхъ минеральныхъ водъ (съ 1823 г.). Въ 1830 г. онъ напечаталъ разсужденіе „объ угютребленіи хлора для предохраненія отъ холеры”. Его имя навсегда сохранилось въ физикћ и электрохиміи, благодаря его изслћдованіямъ о дћйствіи гальваническаго электричества на воду2): въ 1807 г. имъ были открыты, вопервыхъ, явленіе, нынћ называемое „электрическимъ эндосмозомъ”, т.-е. передвиженіе жидкостей черезъ пористыя перегородки въ замкнутой цћпи, и, вовторыхъ, движеніе взвћшенныхъ частицъ въ жидкости, включенной въ цћпь. Эти явленія электроосмоза или электроэндосмоза и катафореза занимали впослћдствіи множество великихъ физиковъ; они были вторично открыты Порре (1816) и подробно изучались Беккерелемъ (1835), Видеманномъ (1852), Квинке (1861), Гельмгольтцемъ (1879) вплоть до послћдняго времени (Перренъ, 1903, Крузе, 1905, Смолуховскій, 1905); они имћютъ не только теоретическое значеніе для физики3), но и важное значеніе для химіи коллоидовъ4) и для технической5) химіи. Въ новћйшее время Г. Елисафовъ (1912) подвергъ изслћдованію роль электролитовъ въ электроэндосмозћ.
Борисъ Семеновичъ Якоби6) (род. 1801 въ Потсдамћ, съ 1835 г. профессоръ гражданской архитектуры при Дерптскомъ {439} университетћ, съ 1837 г. въ Петроградћ, съ 1839 адъюнктъ, съ 1847 г. академикъ по технологіи и прикладной химіи; умеръ 1874 г. въ Птр.), сдћлалъ первое случайное наблюденіе, относящееся къ его знаменитому открытію гальванопластики, еще въ февралћ 1837 г., въ Дерптћ (Юрьевћ); онъ доложилъ о немъ 5го октября 1838 г. въ засћданіи Академіи Наукъ и при этомъ представилъ удачный гальванопластическій снимокъ. Когда возникли споры о пріоритетћ (Spencer), Якоби въ 1840 г. писалъ: „Гальванопластика исключительно принадлежитъ Россіи; здћсь она получила свое начало и образованіе”. (М. Г. Якоби, Гальванопластика или способъ по даннымъ образцамъ производить мћдныя издћлія изъ мћдныхъ растворовъ, помощью гальванизма. Спб., 1840, 66 стр.). Уже весною 1837 г. К. Клаусу былъ показанъ первый гальванопластическій отпечатокъ, снятый Якоби съ двухкопеечной монеты.
Къ электрометаллургіи относятся важныя работы Максимиліана Герцога Лейхтенбергскаго (1817—1852), впервые обратившаго вниманіе (1847) на электролитическій способъ добыванія и очистки (раффинація) мћди и отдћленія отъ нея золота, серебра (платины); способъ этотъ лишь впослћдствіи привился въ С. Америкћ (Elkington, 1865). Герцогъ Лейхтенбергскій построилъ въ Петроградћ первый гальванопластическій заводъ, на которомъ изготовлялись большія статуи и группы, напр., горельефы для Исаакіевскаго Собора, а равно были приготовлены первые въ Россіи паровозы. Имъ былъ напечатанъ рядъ статей по гальванопластикћ, гальваническому серебренію и золоченію и др. (См. некрологь, читанный Б. Якоби.) (Compt. rend., St. Petersb. 1853, стр. 69).
Другого рода примћненіе гальванопластики впервые было сдћлано русскимъ лейтенантомъ Э. Г. Ќедоровскимъ, демонстрировавшимъ уже въ 1867 г. на Парижской всемірной выставкћ полученныя имъ какъ прямыя, такъ и сложныя гнутыя съ отростками мћдныя трубы; впослћдствіи появился патентъ Elmore на изготовленіе мћдныхъ трубъ съ помощью гальванопластики.
Кромћ гальванопластики мћди въ Россіи была открыта и гальванопластика желћза: изобрћтатель этого метода — Клейнъ (1869, въ экспедиціи заготовленія государственныхъ бумагъ, см. P. Ленцъ, Ж. II, 57). {440}
Къ этому времени относятся также опыты электролиза солей органическихъ соединеній.
Въ 1849 г. Г. Кольбе далъ схему электролитическаго разложенія солей жирныхъ кислотъ на углеводороды. А. Бутлеровъ (1869) повторилъ электролизъ валеріановокислой соли и получилъ изобутиленъ. Съ 1870 г. начинаются систематическія изслћдованія Н. Н. Бунге, относящіяся къ электролизу водныхъ растворовъ тіосоединеній, щавелевой и муравьиной кислотъ (1870—1876), муравьиной и меллитовой кислотъ (1880), жирныхъ кислотъ (1889), хлорозамћщенныхъ органическихъ кислотъ (1892). Въ области электроанализа Н. Клобуковъ (1888) вводитъ новый принципъ: вращеніе электродовъ (перемћшиваніе жидкости) во время электролиза; имъ предложены были новые приборы для электрохимическихъ изслћдованій (1886—1889). Изученіемъ продуктовъ электролиза занимались впослћдствіи: Н. Зелинскій (щелочныя соли нитросоединеній жирнаго ряда, 1894), Л. Писаржевскій (β-метилглицидная и β-метилглицериновая кислоты, 1897), А. Сперанскій (соли серебра въ пиридинћ, 19001, В. Плотниковъ (комплексы АlBr3 съ С6Н6 и друг., 1908 и слћд.).
Вернемся теперь къ изслћдованіямъ по чистой электрохиміи. Робертъ Змил. Ленцъ (сынъ академика Э. X. Ленца, род. 1833, ум. 1903, профессоръ физики въ Птр. Технологическомъ Институтћ и Университетћ, съ 1889 г. управл. экспедиц. заготовленія госуд. бумагъ) первый ввелъ въ науку понятіе объ эквивалентной электропроводности (1877); онъ сравнивалъ электропроводность эквивалентныхъ (молекулярныхъ) растворовъ и изучалъ электропроводность неводныхъ растворовъ и смћсей растворителей, a равно водныхъ растворовъ при большихъ разбавленіяхъ и переносъ іоновъ (1882), принимая, аналогично Гитторфу, въ растворахъ полимерныя молекулы, распадающіяся при разбавленіи на простыя. Изслћдованія Ленца сильно разбавленныхъ водныхъ и неводныхъ растворовъ являются исходною точкою изслћдованій электропроводности Св. Арреніуса, давшихъ (1884) первые матеріалы для его теоріи электролитической диссоціаціи и пропорціональности между скоростью химическихъ реакцій и электропроводностью кислотъ и основаній.
Эту пропорціональность поцтвердилъ В. Оствальдъ (въ Ригћ), занимавшійся независимо (еще съ 1877 г.) опредћленіемъ сродства кислотъ и основаній, а съ 1884 г. подробно изучавшій {441} электропроводность водныхъ растворовъ. Послћ совмћстной работы Оствальда и Арреніуса въ химической лабораторіи Рижскаго Политехникума (въ 1886 г.) и послћ того, какъ Арреніусъ (въ 1887 г.) окончательно формулировалъ свою теорію электролитической диссоціаціи, Оствальдъ болће, чћмъ кто-либо другой, способствовалъ интенсивному примћненію, дальнћйшей разработкћ и быстро му распространенію этой теоріи, частью своими собственными классическими электрохимическими изслћдованіями (напримћръ, „законъ разбавленія” или „константы сродства” Оствальда, 1888), частью работами своихъ учениковъ въ лейпцигской университетской лабораторіи (Вл. А. Кистяковскаго, И. А. Каблукова и друг.). Ф. Крангальсъ произвелъ измћренія электропроводности водныхъ растворовъ солей при 18° и также при 100° Ц. (1890). Въ это же время П. Д. Хрущевъ произвелъ обширные опыты надъ электропроводностью водныхъ растворовъ солей (1889—1890), для рћшенія вопроса о распредћленіи кислотъ и основаній. Двойныя (галоидооловянныя) соли изслћдовалъ В. Ковалевскій (1900), a A. Войташевскій (1913) изслћдовалъ смћси двухъ электролитовъ съ цћлью рћшенія вопроса объ образованіи комплексныхъ іоновъ.
Электропроводность смћсей азотной и сћрной кислотъ изслћдовалъ А. Сапожниковъ (1904).
Н. Андреевъ и А. Сапожниковъ дали методъ опредћленія степеней диссоціаціи электролитовъ въ смћсяхъ (1912).
Для аналитическихъ цћлей Г. Хлопинъ и П. Васильева (1913) примћнили электропроводность, какъ способъ для отличія натуральныхъ красокъ отъ искусственныхъ каменноугольныхъ: въ водныхъ и спиртныхъ растворахъ послћднія обладаютъ въ нћсколько разъ большей электропроводностью, нежели первыя.
Недавно А. Дорошевскій и С. Дворжанчукъ (1913) произвели подробное изслћдованіе „о примћненіи электропроводности при изслћдованіи естественныхъ водъ”.
В. Кистяковскій является однимъ изъ первыхъ убћжденныхъ защитниковъ теоріи Арреніуса въ Россіи; своими собственными трудами по электрохиміи водныхъ растворовъ онъ способствовалъ распространенію въ Россіи и развитію электрохиміи; начиная съ 1890 г. онъ изучаетъ двойныя (комплексныя) соли, числа переноса іоновъ, электродные потенціалы и методъ опредћленія ихъ (1907), электрохимическія реакціи металловъ, причины періодическаго явленія при раствореніи хрома (1908), ему же принадлежитъ открытіе активированія {442} и пассивированія магнія (1907) и теорія пассивности металловъ (1910). (См. его цћнную докторскую диссертацію: Электрохимическія реакціи и электродные потенціалы нћкоторыхъ металловъ. Птр. 1910).
Въ связи съ электромоторной силою „простого” гальваническаго элемента укажемъ на оригинальные методы В. Тюрина (1890), предложенные имъ для опредћленія молекулярнаго вћса металловъ.
Надъ опредћленіемъ концентраціонныхъ цћпей съ хлористымъ кадміемъ трудился также Е. В. Биронъ (1907/9).
По вопросу о вліяніи давленія на электродвижущую силу гальваническихъ цћпей произвелъ примћрное экспериментальное изслћдованіе Г. Тимоќеевъ (1911—1913), примћнившій давленія отъ 1 до 1500 атмосферъ и изучившій количественно всћ обстоятельства.
Съ особеннымъ успћхомъ русскіе физико-химики разработали область неводныхъ электролитическихъ растворовъ. На западћ водные растворы приковали къ себћ научный интересъ химиковъ; на водныхъ растворахъ электролитовъ, начиная съ 1887 г., состоялась провћрка и блестящее подтвержденіе теоріи Арреніуса объ электролитической диссоціаціи, а равно и осмотической теоріи Вантъ-Гоффа. Не-водные растворы не представляли интереса, такъ какъ неводные растворители считались не іонизующими или мало іонизующими для электролитовъ. Благодаря трудамъ русскихъ изслћдователей это отношеніе измћнилось существеннымъ образомъ; неводные растворы были призваны дать, на ряду съ подтвержденіемъ обћихъ теорій, и очевидныя отступленія отъ нихъ. Открылся рядъ новыхъ вопросовъ, и почти съ увћренностью можно сказать, что неводные растворы въ будущемъ дадутъ рћшеніе вопроса о вћрности или о необходимости измћненія нынћ существующихъ теорій растворовъ.
Электрохиміи не-водныхъ растворовъ посвящены изслћдованія Вальдена, Каблукова, Писаржевскаго, Плотникова, А. Саханова и С. Сћркова. Главными вопросами нынћ являются слћдующіе: приложима ли вообще теорія Арреніуса, созданная для разбавленныхъ водныхъ растворовъ, къ неводнымъ растворамъ? Отъ какихъ свойствъ растворителя зависитъ величина электропроводности и степень диссоціаціи раствореннаго электролита? Какое взаимодћйствіе существуетъ между растворителемъ и раствореннымъ тћломъ при образованіи электролитараствора? Какія отношенія обнаруживаются при изслћдованіи концентрированныхъ растворовъ? {443}
Мало іонизующіе растворители изучались И. А. Каблуковымъ (1889), установившимъ первые характерные примћры отступленія отъ теоріи: напримћръ, хлористый водородъ въ этиловомъ эфирћ и амиловомъ спиртћ показываетъ съ разбавленіемъ не увеличеніе, a уменьшеніе молекулярной электропроводности и т. д. Новые растворители съ новыми аномаліями составляютъ предметъ измћреній В. А. Плотникова, начиная съ 1904 г.; въ частности имъ были изучены растворы въ эфирћ (системы эфиръ + бромъ, эфиръ + Н3PO4), въ хлороформћ и С2Н5Br (эфиръ + Br2), въ жидкомъ бромћ и т. д.; въ большинствћ случаевъ вопросъ касается здћсь „ненормальныхъ” электролитовъ какъ по составу, такъ и по измћненію электропроводности съ разбавленіемъ; (см. Изслћдованія по электрохиміи неводныхъ растворовъ. Кіевъ, 1908). Плотниковъ измћрилъ также числа переноса іоновъ для нћкоторыхъ изъ этихъ особыхъ электролитовъ. Для объясненія электропроводности вообще Плотниковъ предлагаетъ гипотезу объ „электрохимическомъ резонансћ” (1913). С. Сћрковъ (1908—1910) изучалъ электропроводность электролитовъ (бинарныхъ солей) въ метиловомъ и этиловомъ спиртахъ, въ ацетонћ и въ бинарныхъ смћсяхъ этихъ растворителей. Онъ пришелъ къ интереснымъ результатамъ при изслћдованіи солей литія въ ацетонћ и смћси воды съ ацетономъ, въ которыхъ и были опредћлены числа переноса іоновъ: въ ацетонћ соли литія оказались сложными, т.-е. дающими сложные (комплексные, полимерные) іоны, распадающіеся отъ увеличенія количества воды или спирта. Въ послћднее время (1910—1913) А. Сахановъ приступилъ къ экспериментальному изученію электропроводности солей въ слабыхъ іонизаторахъ, напр., въ сложныхъ эфирахъ, анилинћ, хинолинћ, пиридинћ, уксусной кислотћ и т. д.; онъ устанавливаетъ въ иихъ ненормальный ходъ молекулярной электропроводности съ разбавленіемъ (максимумы и минимумы); исходя изъ предположенія о существованіи комплексовъ-проводниковъ, онъ выводитъ новыя уравненія, предусматривающія появленіе максимума молекулярной электропроводности. (См. Сахановъ, Изслћдованія по электропроводности неводныхъ растворовъ. Москва, 1913).
Самыя обширныя и систематичныя изслћдованія въ области неводныхъ растворовъ произвелъ П. Вальденъ. Начавъ въ 1887 г. съ измћренія электропроводности водныхъ растворовъ простыхъ и двойныхъ солей и примћненія таковой для опредћленія молекулярнаі о вћса, атомности кислотъ и основаній (правило Оствальдъ-Вальдена), {444} и изучивъ (1890—1896) электропроводность около 200 кислотъ, съ цћлью опредЬленія „константы сродства” Оствальда1) и установленія связи между ней и строеніемъ этихъ кислотъ, Вальденъ изслћдовалъ (съ 1899 г. по настоящее время) неводные растворы, руководствуясь теоріей электролитической диссоціаціи Арреніуса. Имъ впервые введены новые неорганическіе растворители (напр., SO2, SOCl2, SO2Cl2, РОСl3, H2SO4), а равно рядъ органическихъ, напр., HCONH2, C2H4(CN)2, CH3NO2, SO2(OCH3)2, CH2CNCOOR, альдегиды, ангидриды кислотъ; имъ впервые изучено болће 50 неводныхъ растворителей на ихъ іонизующую способность, примћмћняя одинъ и тотъ же электролитъ N(C2H5)4J, и установлена, согласно правилу Томсона и Нернста, параллельность между ней и діэлектрической константою этихъ растворителей. Онъ открылъ связь между молекулярной электропроводностью λ∞ при безконечномъ разбавленіи и внутреннимъ треніемъ η∞ растворителя: λ∞· η∞ = const (1906, 1911, 1913); это правило впослћдствіи было выведено теоретически (Гертли, Томасъ, Аппельбергъ, 1908; Герцогъ 1910). Онъ же нашелъ своеобразный фактъ, что одинъ и тотъ же электролитъ имћетъ въ различныхъ іонизаторахъ при точкћ насыщенія одну и ту же степень диссоціаціи (1906; 1913), — эта закономћрность была теоретически обоснована ванъ Лааромъ (1907) и Ф. Крюгеромъ (1911)2). Въ послћднее время (1913) имъ же были изучены концентрированные растворы бинарной соли (N(C5H11)4J) въ самыхъ слабыхъ іонизаторахъ: углеводородахъ, аминахъ, эфирахъ и т. д. и показано, что, несмотря на явныя аномаліи, и въ этихъ растворителяхъ въ общемъ наблюдаются закономћрности, господствующія въ хорошихъ и лучшихъ іонизаторахъ. Извћстный американскій физико-химикъ Джонсъ пишетъ по поводу этихъ работъ, что „... изслћдованія Вальдена и его сотрудниковъ (напримћръ, Центнершвера) по вопросу о диссоціирующей способности неорганическихъ и органическихъ растворителей, вообще, дали, можетъ быть, больше, чћмъ {445} всћ извћстныя до сихъ поръ работы, посвященныя этой задачћ”1). „Paul Walden has been, and is one of the most industrious workers among the younger generation of physical chemists; and his contributions to the development of the science are among the most important”2).
Изслћдованіемъ электропроводности въ смћшанныхъ рacтворителяхъ усиленно занимался И. Каблуковъ (1891), который изучалъ въ водноспиртовыхъ растворахъ хлористый водородъ, сћрную кислоту, монохлоруксусную и трихлоруксусную кислоты (см. Современныя теоріи растворовъ въ связи съ ученіемъ о химическомъ равновћсіи. Москіза, 1891); изъ полученныхъ имъ своеобразныхъ результатовъ укажемъ на фактъ скораго достиженія съ разбавленіемъ максимума молекулярной электропроводности и дальнћйшаго уменьшенія послћдней при увеличеніи разбавленія. За нимъ Н. Д. Зелинскій и С. Крапивинъ (1896) приступили къ экспериментальному измћренію молекулярной электропроводности разнородныхъ солей и кислотъ какъ въ чистомъ метиловомъ спиртћ, такъ и въ смћсяхъ его съ водою; они впервые наблюдали фактъ, что въ растворителћ изъ 50% метиловаго спирта + 50% воды электропроводность солей не повинуется аддитивной схемћ, т.-е. она даже ниже электропроводности въ метиловомъ спиртћ. Эти явленія были впослћдствія снова изучены Г. Джонсомъ въ Америкћ. Съ цћлью изслћдованія „свободной энергіи” химическихъ реакцій Л. Писаржевскій изучалъ электропроводность (и внутреннее треніе) солей въ водныхъ растворахъ, а равно въ метиловомъ и этиловомъ спиртахъ и въ глицеринћ; параллельно были опредћлены электропроводности въ смћсяхъ метиловаго (этиловаго) спирта съ глицериномъ. (См. Л. Писаржевскій, Свободная энергія химической реакціи и растворитель. Москва, 1912). — Упомянемъ еще, что А. Думанскій измћрялъ электропроводность солей въ смћшанномъ растворћ: вода + желатина, и что А. Дорошевскій и М. Рождественскій (1908) изслћдовали электропроводность смћси вода—спиртъ отъ 0 до 100%? при этомъ въ кривой электропроводности не оказалось ни минимумовъ, ни максимумовъ (въ противоположность Пфейфферу, 1885).
Особаго рода изслћдованія были произведены Д. П. Коноваловымъ (1891—1893); онъ исходитъ изъ того мнћнія, что въ противоположность теоріямъ Вантъ-Гоффа и Арреніуса анормальныя {446} величины осмотическаго давленія и депрессій, а равно электро проводность растворовъ обусловливаются не электрической диссоціаціею, а проявленіемъ существующихъ въ растворћ подвижныхъ химическихъ ассоціацій между тћлами, образующими растворъ. Въ подтвержденіе такого взгляда онъ произвелъ рядъ измћреній электропроводности и замерзанія растворовъ аминовъ (анилина, метил- и диметиланилина, толуидина) и кислотъ уксусной, пропіоновой и масляной, давшихъ въ зависимости отъ природы и количества прибавленнаго амина максимумы электропроводности и т. д.; кривая электропроводности растворовъ анилина и уксусной кислоты обнаруживаетъ рядъ „выдающихся точекъ”, отвћчающихъ растворамъ, составъ которыхъ удовлетворяетъ простой кратной пропорціи. Общій выводъ тотъ, что „электролитическая электропроводность жидкости при обыкновенной температурћ обусловливается явленіями химическаго соединенія между раствореннымъ электролитомъ и избыткомъ растворителя”. (1893). — Прибавимъ, однако, что, напримћръ, Паттенъ (1902) при повтореніи и расширеніи опытовъ Коновалова не нашелъ подтвержденія высказанныхъ имъ взглядовъ. Съ другой стороны, слћдуетъ подчеркнуть, что въ отдћльныхъ случаяхъ электропроводность безспорно является результатомъ предшествовавшаго процесса соединенія растворителя съ раствореннымъ тћломъ [сольватація и сольваты (Вальденъ), комплексы (Плотниковъ; Сахановъ)].— Въ послћднее время (1913) А. Басковъ произвелъ обстоятельное изслћдованіе, находящееся въ связи съ работами Коновалова,— онъ изучалъ электропроводность и діаграммы плавкости расплавленныхъ системъ, образуемыхъ бензойной кислотою съ анилиномъ и толуидинами. Изъ кривыхъ плавкости оказалось, что въ этихъ системахъ существуютъ химическія соединенія (1 молекула бензойной кислоты на 1 молекулу основанія), а этимъ химическимъ соединеніямъ (нормальнымъ солямъ) соотвћтствуетъ максимумъ электропроводности; температурный коэффиціентъ электропроводности — отрицательный, вслћдствіе частичной диссоціаціи (сольволиза) проводящаго токъ соединенія — соли.
Электрохимія расплавленныхъ солей лишь недавно получила научную обработку, напримћръ, въ цћнномъ трудћ А. Богородскаго: „Матеріалы по электрохиміи неорганическихъ соединеній въ огненно-жидкомъ состояніи” (Казань, 1905). Электропроводность, частью и потенціалы, металлическихъ системъ сплавовъ вошла также въ кругъ изслћдованій сплавовъ Н. С. Курнакова (съ {447} 1906 г.), С. Жемчужнаго, Н. Пушина, Н. Степанова, Г. Уразова (1911), Дишлера (1912) и др. Особенно цћннымъ является изслћдованіе Н. Степанова (1912), въ которомъ дается какъ способъ выработки препаратовъ сплавовъ, пригодныхъ непосредственно для измћренія электропроводности, такъ и измћренія послћдней и температурныхъ коэффиціентовъ для разнородныхъ системъ. Какъ въ результатахъ другихъ названныхъ изслћдователей, такъ и здћсь выводы о химической природћ сплавовъ совпадаютъ съ результатами относительно опредћленныхъ соединеній (металлидовъ) другихъ металлографическихъ методовъ. Степановъ предпринялъ также попытку дальнћйшаго развитія теоріи электропроводности сплавовъ, стоя на почвћ электронной теоріи.
Электропроводность азотистыхъ металливъ была опредћлена И. Жуковымъ (1910).
Возникшему въ наши дни и технически столь важному вопросу объ электрическомъ сжиганіи воздуха съ цћлью фабрикаціи азотной кислоты посвящены также изслћдованія русскихъ ученыхъ. Въ этомъ направленіи работали съ успћхомъ I. Мосцицкій, А. Горбовъ и В. Миткевичъ (1909), предложившіе собственные методы сжиганія и другія отдћльныя усовершенствованія, a равно А. Сапожниковъ (ср. его работу: Азотная кислота и селитра въ воздухћ. 1911. Ж. 43, II, 27 — 79 и 45, 1076); въ новћйшее время Горбовъ и Миткевичъ дали цћнные опытные матеріалы „о горћніи воздуха въ вольтовой дугћ” (Ж. 45, 1109—1136, 1693—1697. 1913).
Въ заключеніе укажемъ еще на приложеніе электрическихъ волнъ въ химіи; опредћленіе показателя преломленія электрическихъ волнъ само по себћ цћнно для характеристики соединеній, кромћ того діэлектрическая постоянная К = n2 пріобрћла значеніе въ электрохиміи, вслћдствіе высказаннаго Дж. Дж. Томсономъ и В. Нернстомъ (1893) положенія, что іонизующая сила растворителей тћмъ больше, чћмъ больше діэлектрическая константа К растворителей. Если примемъ во вниманіе ту значительную роль, которую играетъ въ современной электрохиміи теорія электролитической диссоціаціи Арреніуса, то вопросъ о причинахъ этой диссоціаціи и.іи іонизирующей силы растворителей, вообще, является однимъ изъ крайне важныхъ для электрохиміи. Русскіе физики участвовали въ этомъ вопросћ, давши методы опредћленія этихъ константъ; напримћръ, Шиллеръ (1874), Зиловъ (1875/6), Томашевскій (1888), {448} Терешинъ (1889), Щегляевъ (1891), Гервагенъ (диссертація, Юрьевъ, 1892), Лебедевъ (1891 /5), Соколовъ (1892), Станкевичъ (1894), Косоноговъ (диссертація, Кіевъ, 1901) и др. Далће возникъ вопросъ о связи діэлектрической константы съ другими физическими свойствами, a равно съ химической природой растворителя; первыя попытки въ этой сложной области были сдћланы Гезехусомъ (поверхностное натяженіе 1899), Терешинымъ (роль гомологіи, 1889), Томашевскимъ (роль молекулярнаго вћса, 1888). Систематическое изслћдованіе какъ этихъ константъ, такъ и связи ихъ съ физическимъ и химическимъ характеромъ жидкостей растворителей принадлежитъ П. Вальдену (съ 1903 по настоящее время); имъ были опредћлены (по методу Друде и Нернста) константы для разнородныхъ новыхъ растворителей, органическихъ и неорганическихъ (1904, 1905, 1909); онъ первый удачно приступилъ къ опредћленію діэлектрическихъ константъ и другого компонента раствора, т.-е. растворенной соли (1911), доказавъ и для солей большое разнообразіе въ этихъ константахъ; онъ установилъ въ широкомъ размћрћ, для хорошо іонизующихъ растворителей, прямую пропорціональность между діэлектрической константой растворителя и іонизующей солью послћдняго (1905), химической актнвностью (1907), растворяющей силою (1908), строеніемъ, скрытой теплотою, внутреннимъ давленіемъ и др. (1909). Съ другой стороны Дм. Добросердовъ (съ 1908 г.) внесъ въ науку многочисленныя новыя экспериментальныя данныя для однородныхъ тћлъ и смћсей и старался выяснить зависимость между строеніемъ тћлъ и величиною этой константы. Новый методъ изслћдованія открываютъ работы A. P. Колли (съ 1908 г.) надъ дисперсіею въ электрическомъ спектрћ жидкостей однородныхъ и смћсей.
Въ связи съ только что упомянутыми трудами русскихъ физиковъ въ области электричества хотћлось бы напомнить еще о многихъ другихъ научныхъ работахъ. Напомнимъ, что баронъ Шиллингъ фонъ-Каннштадтъ (род. 1786 въ гор. Ревелћ, ум. 1836) уже въ 1812 г. примћнялъ изобрћтенный имъ электрическій способъ зажиганія подводныхъ минъ на р. Невћ, а въ 1812 г. устроилъ первый электрическій телеграфъ (въ Петроградћ, между Зимнимъ Дворцомъ и зданіемъ министерства путей сообщенія), тогда какъ Гауссъ и Веберъ въ Геттингенћ устроили свой электриче. скій телеграфъ въ 1833 г. Упомянемъ еще слћдующія имена: Зеебекъ, открывшій термоэлектричество, былъ родомъ изъ г. Ревеля; онъ родился {449} въ 1770 г., въ купеческой семьћ, проживавшей тамъ въ продолженіе нћсколькихъ поколћній. Эмилій Хр. Ленцъ, знаменитый физикъ и съ 1834 г. преемникъ В. Петрова въ Академіи Наукъ, открылъ законъ о направленіи индуцированныхъ электрическихъ токовъ (доложено 29го ноября 1833 г. въ Акад. Наукъ; Pogg. Ann. 31), законъ Джоуль-Ленца (1844) и т. д. (Л. родился въ гор. Дерптћ 1804; умеръ въ 1865 г.). Якоби въ 1834 г. построилъ новый электромоторъ, приводившій въ движеніе на р. Невћ лодку съ 12 людьми. П. Яблочковъ (род. 1847 въ Саратовћ, ум. 1894) въ 1876 г. изобрћлъ свою электрическую свћчу, Мих. Доливо-Добровольскій (род. 1861 въ Петроградћ, съ 1878 до 1881 г. былъ студентомъ въ Рижскомъ Политехникумћ), построилъ въ 1891 г. первую станцію для передачи работы посредствомъ перемћнныхъ токовъ высокаго напряженія различныхъ фазъ («Drehstrommotor»). Алекс. Степ. Поповъ (1859—1905) изобрћлъ свой безпроволочный телеграфъ въ 1895 г., — открытіе Маркони было сдћлано въ 1896 г. П. Н. Лебедевъ (род. 1866 г. въ Москвћ, ум. 1912 г.) прославился первымъ экспериментальнымъ измћреніемъ давленія, производимаго свћтовыми волнами (1900).
Въ исторіи фотохиміи довольно важную роль играетъ желћзная тинктура, случайно открытая гр. Бестужевымъ-Рюминымъ въ 1725 г. и представляющая спирто-эфирный растворъ хлорнаго желћза. Бестужевъ-Рюминъ первый наблюдалъ свћточувствительность этихъ растворовъ солей желћза. Эта примћрная фотохимическая реакція1), вслћдствіе всеобщаго медицинскаго примћненія тинктуры Бестужева, нашла и всеобщее примћненіе въ аптекарской практикћ. Непосредственно къ этому свћточувствительному спиртовому раствору {450} хлорнаго желћза примыкаютъ изслћдованія геніальнаго Ќ. фонъ-Гротгуса въ 1819 г.: «О химическомъ дћйствіи свћта и электричества»1). На этомъ желтомъ растворћ, обезцвћчивающемся отъ солнечнаго дћйствія, а равно на полученномъ имъ (1818 г.) кровяно-красномъ растворћ роданистаго желћза Fe(CNS)3 и синемъ растворћ іодокрахмала Гротгусъ открылъ первые фундаментальные законы фотохиміи, законы, впослћдствіи открытые вновь выдающимися учеными западной Европы. Такъ, его фотохимическій законъ поглощенія (лишь та спектральная область можетъ быть фотохимически дћятельной, которая поглощается свћточувствительнымъ тћломъ) былъ снова открытъ въ 1843 г. Дрэперомъ и носитъ имя этого ученаго. Гротгусъ высказалъ мнћніе, „что цвћтной свћтъ старается разрушить въ тћлћ, подвергнутомъ его дћйствію, цвћтъ, ему противоположный”; въ 1895 г. этотъ законъ былъ снова открытъ О. Винеромъ. Гротгусъ открылъ также ускоряющее дћйствіе свћта на явленія окисленія при помощи свободнаго кислорода; это фотохимическое активированіе кислорода нынћ считается общимъ явленіемъ (см., напр., К. Engler и Weissberg, Ueber Autoxydation 1904).
Своеобразный фотохимическій эффектъ былъ открытъ академикомъ Юл. Ќедор. Фрицше; въ 1866 г. Онъ наблюдалъ, что растворы антрацена С14Н10 на солнечномъ свћтћ даютъ полимерный діантраценъ (Cl4Н10)2; равнымъ образомъ фозенъ давалъ парафозенъ. Еще недавно (1905) Р. Лутеръ и Вейгертъ подвергли подробному изслћдованію эту обратимую реакцію: 2 C14Hl0 C28H20.
C28H20.
Изученіе фотохимическихъ процессовъ въ растеніяхъ было предпринято знаменитымъ ботаникомъ-физіологомъ Андр. Фаминцынымъ (род. 1835 г. близъ Москвы; 1867 — 1889 г. проф. Птр. Унив., въ 1883 э.-о. академикъ, а съ 1891 г. орд. академикъ Имп. Акад. Наукъ). A. C. всесторонне изслћдовалъ вліяніе свћта на физіологическіе процессы въ водоросляхъ и другихъ близкихъ имъ организмахъ, начиная съ 1865 г.,— въ частности образованіе хлорофилла и разложеніе углекислоты растеніями въ зависимости отъ рода и интенсивности искусственнаго свћта (напр. 1873—1880). Въ томъ же направленіи протекаютъ научные труды еще другого выдающагося ботаника-физіолога — Климента Аркадьевича Тимирязева, который извћстенъ кромћ того, какъ замћчательный популяризаторъ естественныхъ {451} наукъ (родился 1843 г. въ Петроградћ; состоитъ съ 1877 г. профес. Моск. Ун.). Его первые научные труды „Спектральный анализъхлорофилла” (маг. диссерт. 1871 г.), „Объ усвоеніи свћта растепіемъ” (докт. диссерт. 1875 г.), продолженіемъ которыхъ являются труды: „Химическій и физіологическій эффекты свћта на хлорофиллъ” (1885), „Фотохимическое дћйствіе крайнихъ лучей видимаго спектра” (1893) и др. Цћль этихъ изслћдованій — выяснить разложеніе атмосферной углекислоты зелеными растеніями подъ вліяніемъ солнечной энергіи. Тимирязевъ параллельно изучалъ также спектры хлорофклла (твердаго и раствореннаго, 1869, 1872), а равно различные дериваты, напр., безцвћтный хлорофиллъ (1885), протофилинъ (1895). Въ 1881 г. третій знаменитый ботаникъ, орд. академикъ Ив. Парќен. Бородинъ, впервые наблюдалъ подъ микроскопомъзеленые кристаллы хлорофилла, изолированные и изслћдованные спектроскопически Монтеверде (1893), оспариваемые однако многими, но пріобрћтшіе въ послћднее время большое значеніе, послћ того какъ Вильштеттеръ въ Цюрихћ получилъ кристаллическій хлорофиллъ (1908). Еще въ 1901 г., затћмъ въ 1908 г. М. С. Цвћтъ (въ Казани) доказывалъ, что упомянутое вещество не представляетъ естественнаго пигмента, являясь лишь искусственнымъ продуктомъ превращенія, отъ дћйствія алкоголя, сћроуглерода и т. д., примћненныхъ для экстракціи его изъ листьевъ. Въ 1910 г. Цвћтъ снова изслћдовалъ этотъ кристаллическій хлорофиллъ и посредствомъадсорбціоннаго анализа локазалъ, что „кристаллическій хлорофиллъ” Вильштеттера долженъ разсматриваться, какъ изоморфная смћсь двухъ хлорофиллиновыхъ дериватовъ (α- и β-метахлорофиллиновъ). Хлорофиллу посвящены также цћнныя изслћдованія другихъ русскихъ ученыхъ. В. И. Палладинъ (съ 1891 г.) установилъ роль и концентрацію углеводовъ при позеленћніи. Ненцкій (1896) предполагаетъ образованіе хлорофилла. а равно и гемоглобина, при распадћ бћлковыхъ веществъ.
Въ 1862 г. А. Волковъ показалъ, что лишь свћтъ, проникающій въ зеленую клћтку, производитъ химическую работу, вызывая образованіе органическаго вещества, и что существуетъ пропорціональность между количествомъ кислорода и интенсивностью освћщенія. Изученію вліянія энергіи лучей на химическіе процессы въ растеніяхъ посвящены также работы Рихтера (1897 и послћд., 1912), показавшаго, что процессъ разложенія углекислоты прямо зависитъ отъ лучистой энергіи. Въ общемъ растенія приспособлены къ минимуму падающей лучистой энергіи (Любименко, 1905 и послћд.). {452} Упомянутый процессъ, однако, зависитъ также отъ количества хлорофилла (Любименко, Содержаніе хлорофилла въ хлорофилльномъ зернћ и энергія фотосинтеза. Птр. 1910). Что между количествомъ разложенной углекислоты и количествомъ образовавшагося сухого органическаго вещества существуетъ связь, напр., между накопленіемъ энергіи и накопленіемъ крахмала, показалъ Крашенинниковъ (Накопленіе солнечной энергіи въ растеніяхъ. Москва, 1901), а Сапожниковъ уже раньше (1894) установилъ параллелизмъ между накопленіемъ углеводовъ на свћту и количествомъ образовавшихся бћлковъ (Сапожниковъ: Бћлки и углеводы зеленыхъ листьевъ. Томскъ, 1894).
Xимики сравнительно поздно начали систематически заниматься фотохимическими изслћдованіями. Образцовыми можно назвать работы A. A. Яковкина (1899) объ условіяхъ равновћсія системы Сl2 + Н2O въ зависимости отъ свћта. Фотохимическое разложеніе перекиси водорода Н2O2 изслћдовалъ В. А. Кистяковскій (1900); начиная съ 1906 г., въ этомъ направленіи успћшно работалъ И. Плотниковъ (О фотохимическомъ окисленіи іодистаго водорода, іодоформа; о фотохимическихъ свойствахъ брома и т. д.), Имъ были изданы руководства: Photochemie (Halle, 1910), Photochemische Versuchstechnik (Leipzig, 1911) и др.1).
Фотохимическія реакціи имћютъ мћсто также при выцвћтаніи красокъ. Этотъ процессъ, одинаково важный для практики и теоріи, былъ изслћдованъ В. Н. Оглоблинымъ (1894). Значеніе era опытовъ по преимуществу практическое; изслћдованіе касалось выцвћтанія фиксированныхъ на хлопчато-бумажномъ волокнћ разнородныхъ — неорганическихъ и органическихъ, искусственныхъ и растительныхъ — пигментовъ, подвергнутыхъ продолжительному дћйствію солнечнаго свћта. Самыми стойкими оказываются минеральные пигменты, за ними идутъ антраценовые, черный анилинъ и растительные (Ж. 26,107).
Крупный шагъ впередъ сдћлалъ П. П. Лазаревъ (Ж. 39, физ. часть, 236, 1907; Zeitschr. phys. Ch. 78, 657, 661. 1912); онъ далъ при помощи изящной экспериментальной постановки первое доказательство точнаго закона выцвћтанія органическихъ пигментовъ: въ области полосъ поглощенія количество разложеннаго пигмента (и скорость выцвћтанія) пропорціонально {453} поглощенной свћтовой энергіи и не зависитъ отъ длины свћтовыхъ волнъ, только минимальная часть падающей на пигментъ свћтовой энергіи идетъ на фотохимическую реакцію,— главнћйшая ея часть служитъ для нагрћванія адсорбирующаго слоя. Недавно (1913) А. Васильева открыла и изслћдовала фотохимическія свойства коллоидальной вольфрамовой кислоты.
Изслћдованіе химическаго дћйствія ультрафіолетовыхъ лучей на синтезъ и разложеніе воды (скорость реакціи синтеза, вліяніе температуры) было произведено И. И. Андреевымъ (1911). Интереснымъ техническимъ примћненіем ь можетъ оказаться фотохимическій синтезъ полимеризаціи бромистаго винила въ β-каупренбромидъ, превращаемый въ искусственный кayчукъ, согласно открытію, сдћланному И. Остромысленскимъ (1911—12). Еще М. Львовъ (1878, 1880) наблюдалъ фотосинтетическую полимеризацію бромистаго винила („дћйствіемъ лучей наиболће преломленной части спектра”), а И. Кондаковъ въ 1892 г. открылъ фотохимическую полимеризацію діизопропенила въ гомологъ каучука.
Въ связи съ возникшей давно въ Россіи фотохиміей разсмотримъ также спектрохимію, появившуюся, однако, гораздо позже.
По вопросу о свћтопреломляющей способности представилъ весьма обширные экспериментальные матеріалы И. И. Канонниковъ: его изслћдованія отиосятся къ періоду возникновенія спектрохиміи, въ связи съ капитальными изслћдованіями Брюля1) (1879—80) о молекулярной рефракціи и роли строенія (двойной {454} связи) органическихъ соединеній; одновременно (1880) появляется новая формула
( |
M d |
· |
n2 – 1 n2 + 2 |
) |
обоихъ Лоренцовъ. Первое изслћдованіе Канонникова (маг. дис: „Матеріалы по вопросу о вліяніи строенія на свћтопреломляющую способность органическихъ соединеній”, 1880) относится къ однороднымъ тћламъ и подтверждаетъ выводы Брюля. Болће цћннымъ и самостоятельнымъ является второе крупное изслћдованіе Канонникова, посвященное изученію растворовъ (докт. дис. „О свћтопреломляющей способности химическихъ соединеній”, 1884) и представляющее продолженіе работъ Гладстона (1880) и Бедсона и Вилліамса (1881). Растворителями служили: вода, спиртъ, бензолъ и хлороформъ; при помощи органическихъ соединеній, и неорганическихъ солей изучается роль концентраціи и растворителей (безъ вліянія) и выводятся формулы строенія, между прочими тћлами, и для камфоры, борнеола, ментона и ментола, а равно нафтеновъ, у которыхъ доказывается отсутствіе двойной связи. Съ 1888 до 1891 г. Канонниковъ дћлаетъ интересную попытку установить соотношеніе между вращательной и свћтопреломляющей способностью. Въ 1898 г. онъ переходитъ къ изслћдованію свћто-поляризующей способности органическихъ тћлъ въ зависимости отъ строенія, полимеріи и т. д. Въ 1899 г. онъ вводитъ въ спектрохимію, новую величину, „истинную плотность”, и старается найти связь между этой величиною и валентностью атомовъ (составомъ и строеніемъ частицъ).— Изслћдованіемъ атомной рефракціи платины въ ея комплексныхъ соляхъ занимался Н. С. Курнаковъ (1893).
Новые методы опредћленія показателя преломленія предложилъ академикъ князь Бор. Бор. Голицынъ (1895); совмћстно съ И. Вилипомъ, 1899, онъ произвелъ опредћленіе свћтового преломленія этиловаго эфира въ предћлахъ критической температуры послћдняго, доказавъ приложимость квадратной формулы Лоренцовъ и въ критической области матеріи.
Вопросу о свћтопреломляющей способности и дисперсіи посвятилъ много изслћдованій П. Вальденъ, изучившій замћщенные этенилтрикарбоновые эфиры (1890), эфиры непредћльныхъ стереоизомерныхъ кислотъ и др. (1894—1896), эфиры нитрояблочной кислоты (1902), эфиры рицинолеиновой кислоты (1903); онъ изслћдовалъ роль концентраціи и растворителя (1907), и старался установить связи между рефракціею и капиллярными постоянными, скрытой теплотою испаренія и др. (1909). Свћтопреломляющую способность {455} нитропроизводныхъ изучалъ М. Коноваловъ (1895), опредћлившій рефракціонный инкрементъ группы NO2, а атомное преломленіе фосфора изслћдовалъ В. Ковалевскій (1897). Въ новћйшее время С. Лебедевъ (1913) измћрилъ на многочисленныхъ, имъ открытыхъ, производныхъ циклобутана экзальтацію (рефракціонный инкрементъ) четырехчленнаго кольца; она въ среднемъ равна +0.60.
Свћтопреломляемость смћсей — съ цћлью аналитическихъ опредћленій составныхъ частей — изучалъ Я. Завидскій (1900;, a A. Дорошевскій изслћдовалъ въ частности смћси этиловаго и метиловаго спиртовъ и воды.
Спектры поглощенія въ связи со строеніемъ производныхъ бензола впервые измћрилъ Н. Валяшко (1910, 1913); имъ были изучены альдегидо, мелетокси- и нитрофенолы въ нейтральныхъ и кислыхъ растворахъ: всћ эти соединенія оказались существующими въ двухъ изомерныхъ состояніяхъ; въ щелочныхъ растворахъ не происходитъ измћненія типа спектровъ поглощенія.
Спектры поглощенія въ ультрафіолетовой части нитросоединеній изслћдовали Н. Зелинскій и Розановъ (1911). Т. Кравецъ изучалъ съ физической точки зрћнія адсорбцію свћта въ 22 окрашенныхъ растворахъ; при этомъ варіировались концентраціи и растворители, и была разобрана связь между колебаніями электроновъ и цвћтомъ растворовъ (Кравецъ, Адсорбція свћта въ растворахъ окрашенныхъ веществъ. Москва, 1912). Спектры элементовъ составляютъ предметъ замћчательныхъ изслћдованій Д. С. Рождественскаго: аномальная дисперсія въ парахъ натрія. Спб. 1911; Простыя отношенія въ спектрахъ щелочныхъ металловъ. Петроградъ, 1915.
Научная термохимія была основана въ 1840 г. трудами русскаго академика Г. Г. Гесса. Напомнимъ, что еще въ XVIII столћтіи Ломоносовъ задумалъ и предпринялъ рядъ термохимическихъ изслћдованій (напр., о теплотћ растворенія), что одновременно П750) его товарищъ, академикъ по физикћ, Георгъ В. Рихманъ (род. 1711 г. въ гор. Перновћ, скончался 1753 г. отъ удара молніи во время {456} опытовъ) открылъ носящее его имя правило о температурћ при смћшеніи жидкостей, что въ 1834 г. Г. Р. Германъ (Зап. Импер. Моск. Общ. Испытат. Прир., 3, 1834) въ обширной статьћ: „О пропорціи, въ которой теплота соединяется съ химическими элементами” описалъ ледяной калориметръ, который въ 1847 г. былъ вновь предложенъ Гершелемъ, въ 1870 г. построенъ Бунзеномъ, а нынћ извћстенъ, какъ ледяной калориметръ Бунзена;
Упомянутый сейчасъ Герм. Генр. Гессъ долженъ быть признанъ однимъ изъ крупнћйшихъ русскихъ химиковъ; измћряя его научныя заслуги международнымъ масштабомъ, необходимо считать его великимъ химикомъ, имя котораго занимаетъ почетное мћсто въ исторіи химіи. Гессъ родился въ 1802 г. въ Женевћ и еще трехлћтнимъ ребенкомъ былъ привезенъ въ Россію, гдћ его отецъ посвятилъ себя педагогической дћятельности. Въ 1822 г. Г. Гессъ поступилъ въ Дерптскій Университетъ на медицинскій факультетъ, но, не вполнћ удовлетворенный медициной, сталъ заниматься одновременно еще химіей игеогнозіей,— его учителями по химіи были профессора Ив. Гизе (съ 1803—1814 г. проф. химіи въ Харьковскомъ, съ 1814 до 1821 г. проф. химіи Дерптск. Универ., ум. въ 1821 г.) и Готфр. Озаннъ (1823 по 1828 г. проф. Дерпт. Унив.). Его диссертація на степень доктора медицины имћла химическій характеръ: „Изученіе химическаго состава и цвлебнаго дћйствія минеральныхъ водъ Россіи” (1825). Свое химическое образованіе онъ продолжалъ въ 1826 г. въ Стокгольмћ у Берцеліуса. Назначенный врачемъ въ Иркутскъ, онъ рядомъ съ широкой врачебной практикой (по глазнымъ болћзнямъ) занимался также химическими изслћдованіями: анализомъ Туркинскихъ горячихъ минеральныхъ водъ, казенной соли (Surlesselscommuns du gouvernement d'Irkoutsk, 1830) и др. За эти работы онъ былъ удостоенъ званія адъюнкта (1828), экстраорд. академика (1830) и орд. академика Акад. Н. (1834). Послћ своего причисленія къ Акад. Н. и переселенія въ Петроградъ 1830), Гессъ окончательно посвятилъ себя наукћ и профессорской дћятельности. Въ 1830 году онъ участвовалъ въ выработкћ плана преподаванія практической и теоретической химіи въ Технологическомъ Институтћ, въ которомъ и занялъ каќедру химіи; въ 1832, при открытіи Главнаго Педагогическаго Института, былъ назначенъ профессоромъ химіи и технологіи (1832—1848), въ 1832 г. началъ читать химію въ Горномъ Институтћ, съ 1838—1849 г. читалъ химію въ Артиллерійскомъ училищћ. Несмотря на столь напряженную педагогическую дћятельность, онъ, однако, {457} проявляетъ и удивительно интенсивную дћятельность какъ изслћдователь. Гессъ извћстенъ, какъ выдающійся аналитикъ; онъ произвелъ, напр., анализъ Невской воды 1830, газа священныхъ бакинскихъ огней 1836. Гессъ имћетъ также заслуги въ геологіи и минералогіи; упомянемъ, напр., геогностическое описаніе странъ около озера Байкалъ 1829, описаніе и анализъ открытыхъ имъ минераловъ: уваровита 1832, гидроборацита 1833, вёртита. 1830, фольбортита. Имя Гесса упрочилось въ учебникахъ минералогіи. Гессъ изучалъ (1833) теллуристое серебро изъ Колыванскаго мћсторожденія и указалъ способь извлеченія теллура изъ этого минерала, который даже называется гесситомъ (Zirkel, Mineralogie, 333, 1885). Онъ открываетъ бромъ въ Старо-Русскомъ источникћ (1831) и новую окись кобальта Со3О4 (1832). Но Гессъ прославился также, какъ химикъ-органикъ, обогатившій органическую химію веществомъ, которое онъ назвалъ сахарною кислотою (cm. Berzelius, Jahresber. 1838—39, 277), онъ же предложилъ методъ элементарнаго анализа въ струћ кислорода (1838), изучилъ продукты пирогенизаціи (нефть, 1835) и т. д.
Полная научная самостоятельность Гесса сказывается въ термохиміи, основателемъ которой является онъ же. Первая его работа (съ 1839 г.) вращается еще около излюбленной въ то время проблемы и называется: „О выдћленіи тепла въ кратныхъ отношеніяхъ” (Bull., V, 302; Lieb. Ann. 31, 79, 1839). Въ ней выдћленіе теплоты примћняется впервые для діагностицированія опредћленныхъ гидратовъ1) (сћрной кислоты),— тема, разработанная также Грэмомъ съ 1843 г. до 1845 г. Самая фундаментальная часть термохимическихъ изслћдованій Гесса относится къ 1840 г. (Pogg. Ann. 50, 385, 1840). Прежде чћмъ существовала механическая теорія теплоты, за два года до появленія труда Р. Майера (1842), Гессъ уже высказалъ основное положеніе термохиміи, представляющее приложеніе перваго начала этой теоріи къ химическимъ явленіямъ. Количество тепла, развивающагося при какомъ-либо химическомъ процессћ, всегда остается тћмъ же, происходитъ ли данный химическій процессъ сразу или проходитъ черезъ какое-либо число стадій,— это „законъ постоянства суммъ тепла”, дающій возможность простымъ путемъ вычислить тепловые эффекты даже въ такихъ случаяхъ, когда непосредственное измћреніе неосуществимо. Законъ Гесса служитъ еще въ современной термохиміи, какъ средство {458} для опредћленія общей теплоты образованія сложнаго тћла изъ его элементовъ. Второй важный законъ былъ найденъ Гессомъ въ 1842 г. (Pogg. Ann. 52, 79, 1842); это — законъ термонейтральности, т.-е. законъ отсутствія теплового эффекта при обмћнныхъ реакціяхъ нейтральныхъ солей въ водныхъ растворахъ. Законъ термонейтральности нашелъ себћ объясненіе лишь послћ появленія теоріи электролитической диссоціаціи, основанной въ 1887 г. Св. Арреніусомъ1).
Гессъ и его законы2) представляютъ поучительный примћръ умственной инертности изслћдователей: въ то время, когда изслћдованія Гесса были опубликованы, химики и физики не были въ состояніи оцћнить все значеніе этихъ трудовъ; впослћдствіи, когда термохимическія изслћдованія вошли въ моду, вниманіе ученыхъ сосредоточилось на результатахъ Фавра и Зильберманна, Томсена, Бертело и др., т.-е. интересы дня были отведены въ совершенно другое русло, и въ концћ концовъ оказалось, что черезъ нћсколько десятилћтій вообще забыли объ этихъ законахъ. Одной изъ многихъ заслугъ В. Оствальда нужно признать то, что онъ „открылъ” Гесса (въ 1887 г.); Оствальдъ подчеркиваетъ то истинное удовольствіе, которое онъ испытывалъ при этомъ случаћ, отдавъ генію Гесса подобающее ему мћсто въ термохиміи3).
Но интересно еще то обстоятельство, что судьба, аналогичная судьбћ Гессатермохимика, постигла и другого великаго реорганизатора химіи I. В. Рихтера, основателя стехіометріи. И здћсь черезъ полвћка появился ученый, снова открывшій заслуги Рихтера и указавшій ему почетное мћсто въ наукћ, — этимъ ученымъ былъ нашъ Гессъ! Въ 1841 г. онъ4) снялъ” съ имени Рихтера покровъ несправедливаго забвенія, которое выпало на его долю вслћдствіе недоразумћнія Берцеліуса. Для исторіи возникновенія и развитія химическихъ идей важно еще слћдующее обстоятельство. Занимаясь основательно стехіометрическими работами Рихтера и понявъ его настоящее значеніе, Гессъ самъ невольно проникается принципомъ кратныхъ отношеній и умозаключеніями Рихтера; распространяя ихъ {459} по аналогіи на термохимическія явленія, онъ приходитъ къ результатамъ первой своей работы и къ закону термонейтральности1).
Термохимія, основанная въ Россіи геніемъ Гесса, не встрћтила, однако, непосредственно среди русскихъ химиковъ достойныхъ приверженцевъ: центръ дальнћйшаго ея развитія перемћстился во Францію. Изъ парижской школы М. Бертело, черезъ посредство работавшихъ тамъ русскихъ ученыхъ, термохимія впослћдствіи распространилась въ Россіи. Какъ по числу и разнообразію своихъ трудовъ, такъ и по мастерству и точности добытыхъ данныхъ, первое мћсто среди русскихъ термохимиковъ новћйшаго времени занимаетъ Владим. Ќеодор. Лугининъ2) (род. въ Москвћ 1834 г., ум. въ Парижћ 1911 г.), устроившій при Московскомъ университетћ въ 1891 г. термохимическую лабораторію (съ этого времени онъ стоялъ приватъдоцентомъ, а съ 1899 г. экстраорд. професромъ химіи Моск. университета). Въ своихъ первоначальныхъ ряботахъ, съ 1875 до 1879 г., Лугининъ совмћстно съ Бертело изучаетъ теплоты образованія и субституціи, съ 1880 до 1891 г. онъ поглощенъ опредћленіемъ теплотъ горћнія, (въ 1882 г. онъ даетъ описаніе своего собственнаго метода), а съ 1,896 до 1902 г. производитъ измћреніе скрытой теплоты испаренія3), усовершенствовавъ методъ опредћленія этой важной физической монстанты и удћльной теплоты твердыхъ и жидкихъ тћлъ. Въ 1902 г. онъ даетъ, совмћстно съ А. Щукаревымъ, термическое изслћдованіе сплавовъ, а въ 1907 г. онъ и И. Каблуковъ производятъ опредћленіе теплотъ присоединенія брома къ ненасыщеннымъ соединеніямъ. ногочисленныя данныя, впервые добытыя или исправленныя Луининымъ, вошли уже цћликомъ въ составъ термохимической науки. Дабы и вторая сторона его плодотворной дћятельности, т.-е. созданная имъ практика и выработанные имъ методы, оставалась живой и доступной, Лугининымъ были изданы слћдующіе труды:
Описаніе различныхъ методовъ опредћленія теплоты горћнія органическихъ тћлъ. Москва, 1894; нћмецкій переводъ вышелъ въ Берлинћ, 1897 г. Кромћ того {460}
Руководство къ калориметріи... Составили В. Ќ. Лугининъ и A. H. Щукаревъ. Москва, 1905 г.; французскій переводъ вышелъ въ Женевћ, 1908 г.
Къ числу извћстныхъ учениковъ Лугинина можно отнести Ив. Павл. Осипова, работавшаго первоначально (1887) въ частной термохимической лабораторіи Лугинина въ Парижћ, а потомъ у Бертело. Съ 1888 г. по 1893 г. Осиповъ произвелъ много опредћленій теплоты горћнія, въ томъ числћ гомологическихъ и стереоизомерныхъ кислотъ, съ цћлью изученія роли конституціи на теплоту горћнія (см. его докторскую диссертацію, Харьковъ, 1893).
Прямьіімъ ученикомъ Бертело является Евг. В. Вернеръ, который (1884/5) совмћстно съ своимъ великимъ учителемъ изучалъ также теплоты горћнія; кромћ того, съ 18859 гг., имъ были опредћлены теплоты нейтрализаціи оксикисіотъ и ароматическихъ веществъ.
Цћнными изслћдованіями являются опредћленія теплотъ горћнія П. Зубова (1898), произведенныя въ лабораторіи Лугинина и относящіяся къ предћльнымъ и непредћльнымъ углеводородамъ, изомернымъ спиртамъ, кетонамъ и нћкоторымъ сложнымъ эфирамъ; въ новћйшее время (1913) онъ далъ богатый матеріалъ и относительно циклическихъ соединеній.
Своеобразными и цћнными можно считать обширныя термохимическія изслћдованія В. Свћнтославскаго (1908—1913), давшаго термохимію азотъ-содержащихъ соединеній (азотистой кислоты, азо- и діазосоединеній, нитросоединеній и др.), изслћдованія относительно теплотъ горћнія и пересмотръ теплотъ образованія атомныхъ связей между углеродомъ, водородомъ и кислородомъ жирнаго ряда (1908); онъ же изслћдовалъ термохимически реакцію діазотированія въ водћ, вліяніе молекулярнаго вћса на теплоту діазотированія, переходъ діазоніевыхъ основаній въ діазоніевыя соли и діазоніевъ въ соли синдіазосоединеній (1909—1913).
Теплоту растворенія и нейтрализаціи въ водяномъ растворћ нћсколькихъ органическихъ кислотъ изслћдовалъ Л. Писаржевскій (1897). Надъ теплотой растворенія (въ водћ) работали также А. Богородскій (1911; гидраты LiCl), Я. Завидскій (1910, сплавы-смћси KNО3 и NaNO3, M. Левальтъ-Езерскій (1912, KNО3, при повышенныхъ температурахъ).
Замћчательныя термохимическія изслћдованія другого рода далъ академикъ Ник. Ник. Бекетовъ (1827—1911). Исходя изъ широкой идеи о связи между прочностью соединеній, т.-е. предћломъ вытћсненія {461} одного элемента другимъ, отношеніемъ атомныхъ вћсовъ (массъ) и количествомъ выдћляющагося тепла, Бекетовъ съ 1878 до 1903 г. изучаетъ теплоты окисленія въ группћ щелочныхъ металловъ Li, Na, K, Rb и Cs и теплоты гидратаціи этихъ окисловъ, подтвердившія общій его принципъ „стремленія элементовъ соединяться въ направленіи большихъ атомныхъ вћсовъ съ бóльшими и меньшихъ съ меньшими”; съ той же точки зрћнія произведены изслћдованія „о взаимномъ обмћнћ галоидныхъ солей въ расплавленномъ состояніи”, давшія тотъ результатъ, что „во всћхъ случаяхъ, гдћ элементы расположены согласно принципу приближенія къ возможному равенству соединенныхъ массъ, и теплота образованія больше”. (См., однако, Д. Менделћевъ, Основы химіи, 784, VIII изд., 1906). Ник. Ник. Бекетовъ родился въ Пензенской губ. въ 1827 г., обучался въ Петроградскомъ, а затћмъ въ Казанскомъ университетахъ, а свое химическое образованіе продолжалъ въ Петроградћ, у Зинина, въ лабораторіи Медико-Хирургической Академіи. Въ 1853 г. онъ представилъ свою магистерскую диссертацію „О нћкоторыхъ новыхъ случаяхъ химическаго сочетанія и общія замћчанія объ этихъ явленіяхъ”. Съ 1855 до 1886 г. состоялъ профессоромъ химіи въ Харьковскомъ университетћ, представивъ въ 1865 г. тамъ же свою оригинальную и замћчательную докторскую диссертацію: „Изслћдованія надъ явленіями вытћсненія однихъ металловъ другими” (Харьковъ, 1865). Съ 13 декабря 1886 состоялъ ординарнымъ академикомъ по химіи Академіи Наукъ. Въ 1890 г. Н. Н. прочелъ въ Московскомъ университетћ лекціи по „Основнымъ началамъ термохиміи”. Оригинальными являются также его рћчи, напр.: „Динамическая сторона химическихъ явленій” 1879 (прибавимъ, что на основаніи изложенныхъ здћсь взглядовъ и по предложенію Н. Н. возникла теорія К. А. Бишофа: „Динамическая изомерія”); „Избирательное химическое сродство” (1888); „Химическая энергія въ природћ” (1894). Всћ эти рћчи вышли подъ названіемъ: „Рћчи химика (1862—1903)”, Петербургъ, 1908. Біографическія данныя о Н. Н. имћются въ некрологахъ, написанныхъ П. Вальденомъ, Изв. Имп. Ак. Наукъ, 1912, 123—140, И. Осиповымъ, В. Тимофеевымъ, Н. Чернымъ и В. Куриловымъ, Ж. 45, 383—433 (1913).
Однимъ изъ виднћйшихъ русскихъ термохимиковъ является также А. Лавр. Потылицынъ. Его главная задача заключается въ выясненіи предћловъ приложимости такъ называемаго „правила наибольшей работы” Бертело. Согласно этому правилу, „всякое {462} химическое превращеніе, совершающееся безъ вмћшательства посторонней энергіи, стремится къ произведенію тћла или системы тћлъ, которыя выдћляютъ наиболће тепла”. Напомнимъ, что Н. Н. Бекетовъ, въ общемъ, при своихъ изслћдованіяхъ руководствовался этимъ принцигтомъ. Потылицынъ, однако, доказалъ его ложность, выбравъ длинный рядъ реакцій, которыя требуютъ поглощенія тепла, но протекаютъ сравнительно легко, напримћръ, вытћсненіе хлора изъ хлористыхъ металловъ бромомъ въ отсутствіи воды, при 250—450°, вытћсненіе кислородомъ галоидовъ изъ галоидныхъ металловъ, реакцію между газообразнымъ хлористымъ водородомъ и бромистыми металлами, дћйствіе сухого водорода на сухія галоидныя соли. Съ другой стороны, реакція вытћсненія брома изъ бромистыхъ солей хлоромъ €сть реакція экзотермическая и, слћдовательно, по правилу Бертело про текаетъ легко, въ дћйствительности же она въ безводной средћ идетъ весьма трудно. Потылицынъ доказалъ, что это правило представляетъ предћльный законъ, безусловно вћрный лишь при температурћ абсолютнаго нуля. Упомянутыя изслћдованія Потылицына, начатыя еще въ 1874 г., вошли въ составъ его магистерской и докторской диссертацій: „О способахъ измћренія химическаго сродства” Петербургъ, 1880, и „О значеніи теплоты образованія солей при реакціяхъ двойныхъ разложеній” Варшава, 1886.
Отъ изслћдованій Потылицына, произведенныхъ частью въ отсутствіи растворителя, частью въ присутствіи воды, перейдемъ теперь къ разсмотрћнію термохимическихъ работъ, относящихся къ не-воднымъ растворамъ и смћшаннымъ растворителямъ.
Съ цћлью провћрки теоріи Арреніуса, С. Танатаръ въ 1894 г. предпринялъ измћреніе теплоемкости водно-спиртныхъ растворовъ соляной кислоты, ћдкаго кали и теплотъ нейтрализаціи обоихъ растворовъ. Имъ также были даны теплоты растворенія нћкоторыхъ органическихъ кислотъ (1891/92), и, вмћстћ съ Писарткевскимъ, ислћдованы въ алкогольныхъ растворахъ теплоты нейтрализаціи и растворенія неорганическихъ и органическихъ тћлъ (1897).
Процессу солеобразованія въ алкогольномъ растворћ посвящены термохимическія изслћдованія С. Танатара и Б. Клименко (1898, 1900), опредћлившихъ для основаній (ћдкое кали и амміакъ) теплоты нейтрализаціи посредствомъ органическихъ кислотъ. Теплоты растворенія солей КСl, NaCl, KNO3, {463} NaNO3, K2SO4, KJ, NaJ, KBr и фенола, таннина, глицерина и сахарозы въ спиртоводныхъ растворахъ изслћдовалъ Н. Колосовскій (1912/13); во всћхъ случаяхъ въ спиртоводныхъ растворахъ наблюдалось — по сравненію съ теплотой растворенія въ водныхъ растворахъ — пониженіе теплового эффекта. Электролиты и и неэлектролиты относятся, слћдовательно, одинаково, или измћненіе степени диссоціаціи не есть главная причина наблюдаемыхъ дополнительныхъ поглощеній тепла при раствореніи въ присутствіи спирта. Послћднее авторъ относитъ на счетъ разложенія гидратовъ, существующихъ въ растворћ между раствореннымъ тћломъ (солью или неэлектролитомъ) и водою. Стоя на почвћ теоріи электролитической диссоціаціи, П. Вальденъ (1907) предпринялъ, съ одной стороны, опредћленіе теплотъ растворенія бинарныхъ солей въ не-водныхъ растворителяхъ, а, съ другой стороны, вычислилъ эти теплоты изъ термодинамически выведенной формулы Вантъ-Гоффа (при помощи измћненій растворимости и степени диссоціаціи): результаты совпадаютъ удовлетворительнымъ образомъ. Точно также П. Вальденъ (1907) вычислилъ по формулћ Арреніуса теплоты диссоціаціи бинарныхъ солей въ неводныхъ растворителяхъ (1911). Цћнный трудъ „О зависимости между температурой плавленія твердыхъ тћлъ и ихъ растворимостью” представилъ И. Ф. Шредеръ (1890).
Теплоты образованія не-водныхъ растворовъ (неэлектролитовъ) уже рано нашли экспериментальную обработку въ трудахъ Дм. Никол. Абашева (1829—1880), который еще въ 1857/8 гг. изучалъ взаимную растворимость органическихъ жидкостей въ зависимости отъ температуры и термохимически изслћдовалъ этотъ процессъ въ трудћ: „О тепловыхъ явленіяхъ, обнаруживающихся при соединеніи жидкостей” (Одесса, 1868). Тотъ же тепловой эффектъ при взаимномъ раствореніи жидкостей былъ обнаруженъ въ 1867 г. двумя французскими учеными Buignet и Bussy; впослћдствіи В. Алексћевъ (1879 — 1883) изслћдовалъ и теплоемкость растворовъ, и тепловой эффектъ при ихъ образованіи. Однако, самое полное и образцовое изслћдованіе, изобилующее новыми экспериментальными матеріалами и дающее всестороннее освћщеніе іакового, представилъ Вл. Ќ. Тимоќеевъ въ монографіи: „О теплотћ образованія неводныхъ растворовъ”. (Кіевъ, 1905).
Въ заключеніе упомянемъ еще, что по термодинамикћ вообще, а равно по термодинамикћ растворовъ работали Г. Тамманъ, Э. фонъ Штакельбергъ, А. Щукаревъ, Р. Холлманъ и др. {464}
Изъ новћйшихъ трудовъ по термодинамикћ укажемъ еще на слћдующіе:
О. Хвольсонъ, Основы положенія термодинамики („Новыя идеи въ физикћ”. Спб. VI, 1913).
А. Грузинцевъ, Термодинамика. Харьковъ, 1913; Термодинамическая теорія химическихъ реакцій. Харьковъ, 1913, Термодинамика и стехіометрія. Харьковъ, 1914.
Руководствуясь хронологическою послћдовательностью, мы до сихъ поръ касались тћхъ отдћловъ физической химіи, которые не только нашли прилежныхъ работниковъ среди русскихъ ученыхъ за весь XIX вћкъ, но которые уже давно были основаны въ Россіи или обогатились фундаментальными открытіями благодаря трудамъ русскихъ химиковъ. Изъ этого обзора мы можемъ усмотрћть, что физическая химія, задуманная первымъ русскимъ химикомъ Ломоносовымъ около 1750 г., какъ бы болће всего соотвћтствуетъ русской творческой силћ; нашедшая уже въ концћ XVIII вћка, въ лицћ Ловица, великаго представителя-экспериментатора, физическая химія дћйствительно развивается съ начала XIX вћка въ Россіи и даетъ богатую научную жатву. Неорганическая и аналитическая химія, имћвшая въ западной Европћ, въ началћ XIX вћка, выдающихся представителей, въ Россіи не встрћчаетъ видныхъ дћятелей или обрабатывается съ успћхомъ лишь не. многими химиками, и то лишь въ зависимости отъ внћшнихъ условій.
Съ сороковыхъ годовъ, однако, вслћдствіе появленія въ Германіи и Франціи выдающихся учителей и школъ органической химіи — лабораторія Либиха въ Гиссенћ1), лабораторіи Дюма и Вюртца въ Парижћ,— а равно въ связи съ замћчательной плодотворностью и удивительными успћхами этой новой химіи, и въ Россіи появляются химикиорганики, своими трудами прославившіе русское имя и создавшіе школу для этой отрасли химіи. Этотъ періодъ {465} замћчателенъ еще тћмъ, что въ 1837 г. Либихъ даже былъ приглашенъ занять каќедру въ Петроградћ; въ 1841 г. другой знаменитый химикъ, Р. Бунзенъ, получилъ такое же приглашеніе Дерптскаго (Юрьевскаго) Университета! Но Либихъ остался въ Гиссенћ, а Бунзенъ — въ Марбургћ, химія же въ Россіи должна была развиваться собственными силами. Въ частности органическая химія, дћйствительно, развивалась быстро, и органическое направленіе преобладало въ русской химіи многія десятилћтія.
Первые видные представители органической химіи въ Россіи появляются около 1840 г. и наука имъ уже обязана открытіемъ новыхъ типовъ соединеній и новыхъ реакцій; въ широкой же теоретической работћ созданія основаній органической химіи они не принимаютъ рћшающаго участія. Если не считать важныхъ работъ Ловица по органической химіи, огносящихся къ концу XVIII вћка, то необходимо назвать Александра Абрамовича Воскресенскаго (1809—1880) русскимъ „дћдушкой органической химіи”. Ученикъ Гесса въ Главномъ Педагогическомъ Институтћ, Воскресенскій продолжалъ свое образованіе у Либиха, гдћ и началъ свои научныя и оригинальныя изслћдованія. Возвратившись въ 1838 г. въ Петроградъ, Воскресенскій начинаетъ свою весьма интенсивную и обширную педагогическую дћятельность; онъ читалъ лекціи въ Университетћ, Главномъ Педагогическомъ Институтћ, Институтћ Путей Сообщенія, Инженерной Академіи, Пажескомъ корпусћ и Школћ гвардейскихъ подпрапорщиковъ. Изъ его многочип сленныхъ выдающихся учениковъ назовемъ лишь Д. И. Менделћева, Н. Н. Бекетова, Н. Н. Соколова, Н. А. Меншуткина, П. П. Алексћева. Имъ впервые былъ опредћленъ „элементарный составъ нафталина” изъ анализа плотности паровъ (1838); потомъ появилось его капитальное сочиненіе о составћ хинной1) кислоты и продуктћ ея перегонки или окисленія перекисью марганца и H2SO4 — хинонћ (1838), какъ {466} этотъ новый типъ вещества былъ названъ Берцеліусомъ. За этимь открытіемъ послћдовало другое: изолированіе изъ какао новаго алкалоида теобромина (1842). На этомъ и кончается столь блестяще начатая научная дћятельность Воскресенскаго,— къ сожалћнію, педагогическая дћятельность всецћло поглотила его творческую энергію.
Другой органикъ и современникъ Воскресенскаго, который, въ противоположность послћднему, не занимался учительской дћятельностью, вслћдствіе чего и проявилъ весьма плодотворную дћятельность ученаго-изслћдователя, былъ Юлій Ќеодоровичъ Фрицше1). Онъ родился въ 1808 г. въ Саксоніи, въ 1834 г. переселился въ Петроградъ, гдћ состоялъ съ 1838 г. адъюнктомъ Академіи Наукъ, экстраординарнымъ академикомъ съ 1844 и ординарнымъ академикомъ съ 1852 г.; умеръ въ Дрезденћ въ 1871 г. Изъ числа замћчательныхъ открытій Фрицше укажемъ на слћдующія: выясненіе строенія мурексида, какъ NH4-соли пурпурной кислоты (1839), открытіе антраниловой (о-амидобензойной) кислоты изъ индиго и распаденіе ея на углекислоту и анилинъ (1840; это названіе ввелъ Фрицше), изолированіе изъ степной руты двухъ алкалоидовъ гармалина и гармина (1847—1854), открытіе фотохимическаго перехода антрацена въ парантраценъ (1866) и фозена въ парафозенъ, открытіе новыхъ ароматическихъ углеводородовъ карбазола и ретена (1858) и хризогена (1866); при изученіи ароматическихъ углеводородовъ ему оказала услугу открытая имъ (1857) способность пикриновой кислоты давать молекулярныя соединенія съ первыми, напр., С10Н8. C6H2(NO2)OH; химическія равновћсія этихъ соединеній были изучены (1892/4) Р. Берендомъ.
Фрицше уже въ 1839 г. получилъ дћйствіемъ азотной кислоты на индиго летучее желтое тћло, признанное имъ впослћдствіи идентичнымъ съ открытымъ A. B. Гофманомъ (1850) нитрофеноломъ. При новомъ изученіи дћйствія разбавленной азотной кислоты — это обстоятельство заслуживаетъ вниманія — на фенолъ Фрицше (1857) получилъ снова летучій нитрофенолъ (ортосоединеніе), но, кромћ того, ему впервые удалось установить присутствіе второго изомера, нелетучаго нитрофенола (пapа-соединеніе, 1858), и изслћдовать соли и эфиры обоихъ нитрофеноловъ.
Онъ получилъ β-динитроантрахинонъ (1868), который служитъ {467} чувствительнћйшимъ реактивомъ на ароматическіе углеводороды и примћняется для отдћленія таковыхъ. Въ неорганической химіи имъ было сдћлано (1863) наблюденіе, важное для ученія о замерзаніи растворовъ, а именно, что изъ окрашенныхъ растворовъ при замораживаніи выдћляется безцвћтный ледъ. Имъ была открыта новая модификація олова (1868): этотъ переходъ олова былъ еще недавно (съ 1899 г.) подвергнутъ изслћдованію и выясненъ трудами Когена. (До этого также Энгельгардъ (1869), особенно же В. Марковниковъ (1881) опубликовали новыя данныя относительно образованія „ранъ” и „опухолей” олова).
Въ общемъ можно сказать, что Фрицше былъ чрезвычайно искусный экспериментаторъ и замћчательно точный наблюдатель; его многочисленныя оригинальныя изслћдованія не имћютъ внутренней связи между собою, не произведены изъ любви къ какой-либо гипотезћ или апріорчой идећ, — онћ скорће имћютъ характеръ неожидан наго, своеобразнаго и случайнаго, и потому являются вполнћ самосгоятельными и важными; многіе изъ открытыхъ имъ фактовъ еще нынћ ждутъ объясненія и дальнћйшаго изслћдованія.
Изъ Гиссенской школы Либиха вышелъ также третій знаменитый русскій органикъ, Николай Николаевичъ Зининъ1). Онъ родился въ 1812 г. на Кавказћ, обучался въ Казанскомъ университетћ, работалъ у Либиха, а въ 1840 г. вернулся въ Казань; съ 1841 до 1847 г. состоялъ профессоромъ по каќедрћ технологіи въ Казанскомъ университетћ, гдћ его ученикомъ былъ A. M. Бутлеровъ, a съ 1847 до 1864 г. состоялъ профессоромъ Медико-Хирургической Академіи; въ 1865 г. назначенъ ординарнымъ академикомъ Академіи Наукъ, гдћ совмћстно съ Фрицше устроилъ въ 1867 г. новую химическую лабораторію; умеръ въ Петроградћ въ 1880 г. Научныя изслћдованія Зинина характеризуются той особенностью, что всћ онћ какъ бы группируются около одного лишь тћла — бензойнаго альдегида; продуктомъ его превращенія, бензоиномъ, онъ начинаетъ свою первую статью, въ Анналахъ Либиха, въ 1839 г.; продуктамъ распаденія того же бензоина онъ посвящаетъ послћднюю свою статью, напечатанную въ Бюллетеняхъ Академіи Наукъ, въ 1879 г. Въ лабораторіи Либиха онъ выработалъ свой способъ приготовленія бензоина изъ бензойнаго альдегида (горько-миндальнаго масла), который употребляется еще нынћ. Случай пришелъ ему {468} навстрћчу и снабдилъ его (въ Петроградћ) большими количествами дорогого въ то время вещества, горько миндальнаго масла, которое въ рукахъ Зинина подвергалось столь интереснымъ превращеніямъ. Труды Зинина, вышедшіе изъ Казанской лабораторіи въ продолженіе немногихъ лћтъ (1842—1845), имћютъ для чистой химіи значеніе классическихъ работъ, пріобрћтшихъ, кромћ того, величайшее значеніе для промышленности органическихъ красокъ: они лучше всего иллюстрируютъ то обстоятельство, что открытія, сдћланныя лишь въ интересахъ чистой науки, рано или поздно являются и великими открытіями для техники и жизни. Въ 1842 г. Зининъ извћщаетъ ученый міръ о своей знаменитой реакціи превращенія ароматическихъ нитросоединеній, посредствомъ сћрнистаго аммонія, въ амидосоединенія: изъ нитробензола онъ получаетъ „бензидамъ”, который Фрицше тотчасъ призналъ за открытый имъ „анилинъ”, а изъ нитронафталина — „нафталидамъ”, т. е. α-нафтиламинъ. Значеніе этого открытія формулировалъ знаменитый A. B. Гофманъ такъ: „Если бы Зининъ не сдћлалъ ничего болће, кромћ превращенія нитробензола въ анилинъ, то и тогда имя его осталось бы записаннымъ золотыми буквами въ исторіи химіи” (Berl. Ber. XIII, 449).
Въ 1844 г. Зининъ открылъ, при помощи того же возстановнтеля, нафтилендіаминъ и m-фенилендіаминъ, а въ 1845 г. новую амидобензойную кислоту (m-; см. o-модификацію Фрицше). Въ 1845 г. имъ былъ открытъ азоксибензолъ (изъ нитробензола, посредствомъ новаго возстановителя — спиртовой щелочи) и бензидинъ (p-діамидодифенилъ, изъ гидразобензола посредствомъ кислотъ). Впослћдствіи Зининъ самъ изучалъ еще азосоединенія (1864 г. превращеніе кислотою въ бензидинъ), а равна П. Алексћевъ (см. диссертаціи 1864 и 1867)1), А. Вериго (диссертаціи 1866 и 1870;, Я. Барзировскій (диссертація 1878), В. Петріевъ (съ 1870 г., магист. диссертація 1872).
Къ петроградскому періоду дћятельности Зинина относятся и труды другого рода. Въ 1854 г. онъ сообщаетъ объ искусственномъ образованіи летучаго масла горчицы изъ іодистаго аллила и роданистаго калія, — синтезъ, замћчательный для того времени вслћдствіе малочисленности вообще искусственно приготовленныхъ продуктовъ органическаго міра; въ {469} 1855 г. появляется изслћдованіе о нћкоторыхъ тћлахъ аллиловаго (пропилениловаго) ряда; цћлью изслћдованія было показать аналогію „аллила” съ „этиломъ”. Въ 1861 г. Зининъ даетъ переходъ отъ горькоминдальнаго масла къ новому тћлу, гидробензоину, при помощи спиртовой кислоты и цинка и превращенія его въ бензоинъ; въ 1862 г. онъ получилъ изъ бензоина новое вещество дезоксибензоинъ; изъ дезоксибензоина онъ получилъ хлоридъ С14H11Сl, иревращающійся въ стильбенъ С14Н12 и толанъ C14H10. Уплотненіе и превращеніе бензойнаго альдегида C6H5CHO онъ ведетъ дальше. Въ 1866 г. Зининъ открываетъ лепиденъ (тетрафенилфуранъ) C28H20O, какъ продуктъ конденсаціи бензоина соляной кислотою, далће оксилепиденъ и (1871) двуоксилепиденъ, но кромћ одного оксилепидена получается еще изомерный, дающій изомерный лепиденъ (1876). Изъ дезоксибензоина и бензойнаго альдегида онъ получаетъ уплотненіемъ новый дикетонъ бензамаронъ С70Н56О4 или С35Н28O2, который онъ превращаетъ въ амаровую кислоту С23Н22О3 + Н2O и ея гомологи (1877). Если всћ эти реакціи и переходы нынћ представляются понятными и предсказываются теоріею, то совсћмъ иначе обстояло дћло 50 лћтъ тому назадъ; число аналогичныхъ реакцій было незначительно, структура тћлъ и способы изученія ея представляли громадныя затрудненія; Зинину, слћдовательно, пришлось дћйствовать вполнћ самостоятельно, прямо бороться съ этими новыми тћлами, которыя всћ являются типичными и требуютъ мастера-піонера. Къ числу открытыхъ имъ новыхъ реакцій принадлежитъ также способъ прямого отщепленія галоидовъ посредствомъ обработки галоидопроизводныхъ въ спиртовомъ растворћ цинкомъ. Выдающееся химическое чутье, которымъ столь отличался Зининъ какъ „органикъ”, тћмъ удивительнће, что онъ по своему образованію обћщалъ скорће сдћлаться математикомъ-физикомъ: вћдь онъ учился (1830—1833) на математическомъ отдћленіи философскаго факультета Казанскаго университета; на него скоро обратили вниманіе знаменитый математикъ Лобачевскій и астрономъ Симоновъ, и въ 1833 г. вмћстћ съ степенью кандидата онъ удостоился золотой медали за сочиненіе: „О пертурбаціяхъ эллиптическаго движенія планетъ”! А въ 1833 г. онъ былъ опредћленъ репетиторомъ при каќедрћ физики, и въ 1834 г. ему было поручено преподаваніе аналитической механики, гидростатики и гидравлики. {470}
Недостатокъ профессоровъ химіи и побудилъ, вћроятно, вліятельныхъ друзей Зинина предложить ему готовиться къ занятію именно каќедры химіи. Благодаря этому случаю, Зининъ, занимавшійся по окончаніи курса преимущественно чистой и прикладной математикою и астрономіею, превратился въ химика; благодаря другой случайности, онъ не сдћлался физико-химикомъ, хотя по своей подготовкћ и математическимъ способностямъ своимъ онъ могъ бы быть выдающимся физико-химикомъ. Попавъ въ 1839 г. къ великому Либиху, этому химикуромантику, онъ всецћло проникся духомъ этсго замћчательнаго ученаго и учителя. Вернувшись въ Россію, Зининъ самъ сталъ русскимъ Либихомъ, создавъ въ Россіи органическую химію и школу органическихъ химиковъ. Изъ большого числа славныхъ учениковъ Зинина назовемъ лишь A. M. Бутлерова и Н. Н. Бекетова; затћмъ А. П. Бородина, пріобрћтшаго, какъ композиторъ, всемірную извћстность, Ал. П. Діанина и A. A. Загуменнаго1).
Научное значеніе Зинина было охарактеризовано А. В. Гофманномъ, сообщившимъ Берлинскому Химическому Обществу вћсть о кончинћ Зинина, въ слћдующихъ словахъ: „Сегодня я долженъ сообщить Обществу, что славный великій мастеръ химической науки, почетный членъ нашего Общества, мужъ, оказавшій на развитіе органической химіи прочное вліяніе, выбылъ изъ ряда живыхъ” (Bed. Ber. XIII, 449, 1880). {471}
Резюмируя научные успћхи русскихъ химиковъ за первый періодъ существованія органической химіи (до 60-хъ годовъ XIX вћка), мы можемъ убћдиться, что число работниковъ было незначительно и главный интересъ ихъ былъ сосредоточенъ на изученіи ароматическихъ (циклическихъ) тћлъ, и что результаты были достигнуты блестящіе.
Приведемъ хронологическую таблицу выдающихся работъ по ароматической химіи.
1838. Воскресенскій установилъ формулу нафталина (Lieb. Ann., томъ 26, 66—69).
1838. Онъ же открываетъ хинонъ (ibid. 27, 257—270) и устанавливаетъ составъ хинной кислоты (ibid.).
1839. Фрицше открываетъ изъ индиго летучій нитрофенолъ (Bullet, de l'Acad., St.-Petersb., t. V, 159).
1839. Зининъ открываетъ бензоинъ (Lieb. Ann. 31, 329—332, 34, 186—192).
1840. Фрицше открываетъ антраниловую кислоту изъ индиго и изъ нея анилинъ (Bullet, de l'Acad., St.-Petersb., t. VII, 161).
1842. Воскресенскій изолируетъ изъ какао новое соединеніе теоброминъ (Lieb. Ann., 41, 125).
1842. Зининъ возстановляетъ посредствомъ сћрнистаго аммонія нитробензолъ въ бензидамъ-анилинъ, а изъ нитронафталина α-нафтиламинъ (Bull. Ac. des Sc, St.-Pet., X, 273—285; замћчанія Фрицше, ib. 352).
1844. Зининъ открываетъ нафтилендіаминъ и мета-фенилендіаминъ (ib. III, 129—138).
1845. Онъ же открываетъ метаамидобензойную кислоту изъ нитробензола и спиртовой щелочи азоксибензолъ и бензидинъ (ib. IV, 273 — 286).
1847—1854. Фрицше открываетъ два алкалоида, гармалинъ и гарминъ (ibid. VI, VII, VIII и XII).
1857. Фрицше открываетъ пикраты ароматическихъ углеводородовъ (ib. XVI, 150, XVII, 68; Mel. phys. et chim. III, 202 — 212).
1858. Онъ же открываетъ карбазолъ и ретенъ (ib. XVII, 68—76; Mel. HI, 429—439).
1858. Онъ же открываетъ нелетучій (пара) нитрофенолъ (ib. XVII, 145—167; Mel. III, 457—489).
1860. Зининъ даетъ новыя данныя о ретенћ (ib. III, 88—110; Mel. IV, 615—645). {472}
1860. Зининъ превращаетъ окисленіемъ HNO3 бензоинъ въ бензилъ (ib. III, 68—74).
1861. Зининъ открываетъ гидробензоинъ (ib. V, 21—25, 529—534, и Мёі. V, 175—180, 424—431).
1862. Зининъ открываетъ дезоксибензоинъ (ib. V, 21—25, 529—534, и Мќі. V, 175—180, 424—431).
1865. А. Вериго примћняетъ въ спиртовомъ растворћ амальгаму натрія для возстановленія нитробензола въ азобензолъ (Lieb. Ann. 135, 176; cm. также П. Алексћевъ, 1864, Bull. soc. chim. 1, 324).
1866. Фрицше открываетъ ароматическій углеводородъ хризогенъ (Bull, de l'Acad. St.-Pet., IX, 406—419; Mel. VI, 601—619).
1866. Онъ же открываетъ фотохимическое превращеніе антрацена въ діантраценъ (ib. XI, 385—397; Mel. VII, 358—375).
1867. П. Алексћевъ вводитъ для возстановленія нитробензола въ азобензолъ цинковую пыль въ слабощелочномъ спиртовомъ растворћ (диссертація, Кіевъ, 1867; Zeitschr. f. Ch., 1868, 497).
1868. Фрицше открываетъ β-динитроантрахинонъ какъ реактивъ на углеводороды, „реактивъ Фрицше” (Bull. Acad., St.-Pet., XIII, 143—168; Mel. VII, 785, VIII, 7).
1866—1871. Зининъ открываетъ лепиденъ, окси- и диоксилепиденъ (Bull. Acad., St.Pet., 11, 151 (1866), 15, 15).
Начиная съ 60-хъ годовъ, однако, совершается поворотъ: не только увеличивается число русскихъ химиковъ-органиковъ, но возрастаетъ также интенсивность научной работы вообще и разнообразіе изучаемыхъ вопросовъ; рядомъ съ химіей ароматическихъ тћлъ появляется длинный рядъ классическихъ работъ по алифатическому (жирному) ряду.
Краткій хронологическій перечень важнћйшихъ открытій за 25лћтіе (1854—1879) послужитъ иллюстраціей только что сказаннаго.
1854. Зининъ впервые синтезируетъ горчичное масло C3H5ONS (A. 95, 128). {473}
1855. Зининъ изучаетъ производныя радикала „аллила” C3H5 (Bull, de l'Acad., St.Pet., XIII, 360).
1857. Шишковъ изучаетъ соли гремучей кислоты и открываетъ тетранитрометанъ С(NO2)4, тринитрометанъ CH(NO2)3 или нитроформъ, тринитро- и динитроацетонитрилъ СCN(NO2)3, и CHCN(NO2)2, бромнитрометанъ СBr(NO2)3 (С. r. 44, 144; А. chim. phys. (3) 49, 310; A. 101, 215; 119, 247).
1858. Соколовъ впервые получаетъ глицериновую кислоту окисленіемъ глицерина азотной кислотою (А. 106, 95).
1859. Соколовъ опредћляетъ молочную кислоту, какъ двухатомно-одноосновную (Хим. Журн. I, 265).
1858. Бутлеровъ открываетъ іодистый метиленъ CH2J2 (Ann. chim. phys. (3) 53, 313; A. 107, 110).
1859. Бутлеровъ открываетъ полимерный формалдегидъ, тріоксиметиленъ С3Н6О3 (A. III, 242).
1861. Зининъ открываетъ способъ прямого введенія водорода (цинкъ, НСl и спиртъ) (А. 119, 179. Bull. Acad., St.-P., Ill, 529).
1861. Бутлеровъ открываетъ посредствомъ тріоксиметилена первый синтетическій сахаръ метиленитанъ C6Hl2O6 (A. 120, 295).
1861. Бейльштейнъ получаетъ β-іодпропіоновую кислоту изъ глицериновой и іодистаго фосфора (А. 120, 226).
1861. Бородинъ приготовляетъ α-броммасляную, wвалеріановую кислоты, дћйствуя бромомъ на серебряныя соли (А. 119, 121; Bull, soc. ch. 1860).
1861. Марковниковъ получаетъ аллиленъ СН3С·СН изъ пропиленбромида (Z. 1861, 466), а Савичъ изъ бромпропилена, a равно ацетиленъ СН·СН изъ брохмированнаго этилена, дћйствуя спиртовой щелочью (С. r. 52, 157, 399); одновременно Мясниковъ получаетъ изъ этиленбромюра и натрійизоамилата ацетиленъ (всћ эти работы произведены въ лабораторіи Бутлерова).
1862. Бейльштейнъ упрощаетъ способъ полученія цинкэтила (Zn-овыя опилки и немного Zn-Na-амальгамы) и производитъ синтезъ амилена и пропилена (С. r. 58, 171; А. 124, 242).
1863. Бейльштейнъ видоизмћняетъ способъ Personn'a (1861) для полученія іодистаго этила введеніемъ краснаго фосфора и даетъ точное уравненіе этой реакціи (А. 126, 250).
1864. Бутлеровъ получаетъ первый третичный, псевдо бутиловый спиртъ (СН3)2СОН (Z. 1864, 385). {474}
1866. Марковниковъ устанавливаетъ изомерію масляной и изомасляной кислотъ (различіе въ соляхъ) (А. 138, 361).
1867. Бутлеровъ показываетъ непосредственную замћщаемость гидроксила въ третичномъ спиртћ іодомъ (посредствомъ HJ), получаетъ въ подтвержденіе принципа химической структуры вторичный бутанъ и ассиметрическій диметилэтиленъ (изъ третичнаго іодистаго бутила) (А. 144, 10).
1869. Соколовъ получаетъ изъ β-іодпропюновой кислоты окисью серебра β-оксипропіоновую кислоту (А. 150, 167).
1869. В. фонъ-Шнейдеръ: синтезъ нормальной валерьяновой кислоты изъ β-іодпропіоновой кислоты, іодистаго этила и серебра (Z. 1869, 342).
1869. А. Зайцевъ (22го авг. 1869 г. на II съћздћ естествоиспытателей въ Москвћ) впервые докладываетъ о новомъ способћ полученія первичныхъ спиртовъ, а именно возстановленіемъ хлорангидридовъ кислотъ и самыхъ кислотъ амальгамой натрія; по этому способу былъ полученъ этиловый спиртъ и нормальный бутиловый спиртъ (Ж. I, 226; см. подробнће: Ж. 2, 292). Въ іюнћ 1869 г. Lieben и Rossi (Compt. rend. 68, 1561) дали способъ полученія нормальнаго бутиловаго спирта возстановленіемъ маслянаго алдегида, полученнаго сухой перегонкой кальціевыхъ солей масляной и муравьиной кислотъ.
1869. Марковниковъ: „Матеріалы къ вопросу о взаимномъ вліяніи атомовъ въ химическихъ соединеніяхъ” (докт. дис. Казань).
1870. А. Зайцевъ получаетъ нормальный бутиленъ изъ нормальнаго іодистаго бутила и спиртовой щелочи (Ж. 2, 254, 308).
1870. Марковниковъ: полученіе (хлорированіемъ въ присутствіи іода) α-хлоро- (и β-хлоро-) масляной кислоты и превращеніе ея, кипяченіемъ съ баритовой водою) въ чистую α-оксимасляную кислоту (описаніе солей) (А. 153, 242), параллельно и Марковниковъ: полученіе α-бромизомасляной кислоты (дћйствіемъ брома на изомасляную кислоту) и изъ нея — оксиизомасляной кислоты (описаніе солей); параллельно онъ добываетъ изъ пропиленхлоргидрина и HCN впервые β-оксимасляную кислоту (1868). Этими изслћдованіями Марковниковъ впервые установилъ фактъ, что при замћщеніи атома водорода галоидомъ таковое происходитъ въ α-положеніи (1868, 1870), что ацетоновая кислота Штеделера (изъ ацетона, HCN и соляной кислоты), бутилолактиновая кислота Вюрца (окисленіемъ изъ амиленгликоля), диметилщавелевая кислота Франкланда (изъ щавелеваго эфира и цинкметила идентичны) съ добытой имъ изъ {475} бромизомасляной кислоты α-оксимасляной кислотою (названіе это было дана Марковниковымъ), что обћ оксимасляныя кислоты изъ пропиленхлоргидрина (Марковниковъ) и изъ ацетоуксусной кислоты (по Вислиценусу) идентичны, т.-е. представляютъ β-оксимасляную кислоту, и, наконецъ, что оксикислоты, получаемыя изъ хлорбутирилхлорида и изъ броммасляной кислоты, между собою идентичны, и представляютъ собою нормальную α-оксимасляную кислоту СН3СН2СН(ОН)СООН (1870). Для теоріи строенія и изомеріи эти изслћдованія Марковнико ва имћли большое значеніе. Прибавимъ, что С. Пржибытекъ (1876,. Ж. 8, 335) осуществилъ синтезъ α-оксимасляной кислоты изъ пропіоноваго алдегида и HCN.
1871. Зининъ даетъ методъ замћщенія галоидовъ водородомъ посредствомъ цинка въ спиртовомъ растворћ (Ж. 3, 95); впослћдствіи А. Сабанћевъ (1877) снова предлагаетъ этотъ элегантный методъ (Ж. 8, 329; 9, 32).
1872. Бутлеровъ синтезируетъ новый изомеръ валерьяновой кислоты, триметилуксусную (Ж. 4, 206).
1872. Пономаревъ синтезируетъ парабановую кислоту (BulL soc. chim. 18, 97).
1872. Бейлыптейнъ: реакція на галоиды въ органическихъ соединеніяхъ (окрашиваніе пламени, CuО). Ж. 4, 358.
1873. Марковниковъ вводитъ для полученія сложныхъ эфировъ изъ кислотъ и спиртовъ H2SO4 какъ катализаторъ1).
1873. Гемиліанъ предлагаетъ для полученія алифатическихъ сульфокислотъ сћрнистокислый аммоній (съ іодистыми алкилами) (Ж. 5, 86).
1873. Бутлеровъ (съ Вл. Горяиновымъ) открываетъ „удобное и быстрое поглощеніе этилена концентрированной сћрной кислотою при температурћ около 160°”, „фактъ, обћщающій пріобрћсти со временемъ практическое значеніе; еслибы удалось открыть дешевый способъ приготовленія этилена, то онъ составилъ бы матеріалъ для добыванія спирта” (Ж. 5, 303).
1873. А. Эльтековъ получаетъ гликоли введеніемъ ОН — группы посредствомъ окиси свинца (Ж. 5, 81, 86).
1873/4. А. Зайцевъ: γ-оксимасляная кислота, ея ангидридъ—первый лактонъ (соли) (А. 171, 270; Ж. 5, 392). {476}
1874. Бутлеровъ открываетъ фактъ гидратаціи этиленныхъ углеводородовъ (напримћръ, изобутилена) водою, въ присутствіи малыхъ количествъ сћрной кислоты (каталитическое дћйствіе) (Ж. 8, 31).
1874. Гемиліанъ: α- и β-іодмасляная кислота (изъ α-кротоновой + H) (А. 174, 324), превращеніе (жидкой) изокротоновой въ твердую кротоновую кислоту.
1874. Густавсонъ получаетъ четырехіодистый углеродъ CJX (A. 172, 173; Ж. 6, 94, 109).
1878. Петріевъ: моно- и диброммалоновая кислота и ихъ превращеніе въ тартроновую и мезоксалевую кислоты (Ж. 10, 57, 94, 152).
1879. Вериго и Меликовъ впервые показываютъ, что оксикислоты (глицериновая) при нагрћваніи и насыщеніи растворомъ хлористаго водорода даютъ замћщеніе гидроксильной группы хлоромъ (В. Ber. 10, 1500).
Воскресенскій, Фрицше, Зининъ — вотъ яркое трехзвћздіе русской химіи первой половины XIX вћка, своими экспериментальными изслћдованіями создавшее въ Россіи органическую химію. Вполнћ равенъ имъ и даже превосходитъ ихъ, такъ какъ онъ былъ и экспериментаторъ, и теоретикъ-философъ, слћдующій химикъ-органикъ, Бутлеровъ. Александрь Михайловичъ Бутлеровъ родился въ 1828 г. въ Чистополћ, Казанской губерніи; по окончаніи I Казанской гимназіи, онъ поступилъ въ 1844 г. въ Казанскій университетъ, гдћ изучалъ химію подъ руководствомъ К. К. Клауса и Н. Н. Зинина. Клаусъ — приверженецъ электрохимическаго дуализма Берцеліуса, чистый типъ неорганика-экспериментатора, Зининъ — индифферентный къ ученію Жерара и Лорана, являлся послћдователемъ эквивалентнаго обозначенія Гмелина и представлялъ собой мастера органика-экспериментатора; любопытно, что Бутлеровъ, какъ ученикъ обоихъ, сдћлался виднћйшимъ теоретикомъ! Въ 1849 г. молодой A. M. окончилъ университетъ, представивъ свою кандидатскую диссертацію: „Дневныя бабочки Волго-Уральской фауны”; въ слћдующемъ году, по рекомендаціи Клауса, онъ былъ оставленъ при университетћ и одновременно ему было поручено преподаваніе физики и физической географіи съ климатологіею студентамъ медицинскаго факультета.
Въ 1851 г. онъ пріобрћлъ степень магистра (диссертація: „Объ окисленіи органическихъ соединеній”), былъ избранъ въ {477} адъюнкты и продолжалъ безвозмездное преподаваніе физики и т. д. медикамъ (до 1853 г.).
Въ 1854 г. былъ удостоень степени доктора въ Московскомъ университетћ, такъ какъ физикоматематическій факультетъ Казанскаго университета разошелся въ оцћнкћ представленной Бутлеровымъ докторской диссертаціи „Объ эфирныхъ маслахъ”; здћсь онъ впервые описываетъ новое камфорообразное соединеніе С10Н16О, полученное имъ изъ растенія Pulegium mi crauthum Claus (состоящее изъ пулегона: Semmler, Aetherische Oele, III, 660, 1906).
Въ томъ же году состоялось его избраніе экстраординарнымъ профессоромъ, а въ 1857 г. ординарнымъ профессоромъ химіи. Итакъ, съ внћшней стороны, Бутлеровъ очень быстро достигь высшихъ академическихь степеней и должностей, хотя съ научной точки зрћнія онъ не успћлъ еще проявить особой творческой силы. Замћчательная перемћна произошла лишь послћ его заграничной поћздки (1851—1858). Поћздка эта имћла удивительныя послћдствія: скрытая до того времени, неорганизованная психическая энергія Бутлерова сразу приняла опредћленную форму; личное знакомство съ выдающимися преподавателями западной науки, съ ихъ лабораторіями, методами преподаванія и научными пріемами экспериментальной работы,— все это оказало на научный обликъ Бутлерова вліяніе, которое можно сравнить съ вліяніемъ катализатора на систему, въ которой реакціи протекаютъ чрезвычайно медленно. Безспорно два химика, въ двухъ различныхъ направленіяхъ, произвели это каталитическое и ускоряющее дћйствіе на научный характеръ Бутлерова: Кекуле въ Гейдельбергћ и Вюрцъ въ Парижћ. Въ частности Кекуле способствовалъ установленію въ Бутлеровћ опредћленныхъ теоретическихъ взглядовъ. Къ нему Бутлеровъ заћзжалъ осенью 1857 г.; поработавъ у Вюрца, Бутлеровъ вторично былъ у Кекуле въ маћ 1858 г. Его же онъ посћтилъ снова во второй своей поћздкћ въ 1861 г., уже въ Гентћ. „Qui se ressemblent, s'assemblent”, и, дћйствительно, оба геніальныхъ ученыхъ имћли много сходнаго; Ладенбургъ (въ своихъ воспоминаніяхъ) разсказываетъ, какъ они другъ друга искали, какъ при ихъ встрћчћ сейчасъ же начинался обмћнъ взглядовъ, принимавшій столь оживленную и громкую форму, что остальные считали себя обязанными вмћшаться и успокоить обоихъ: „но мы не имћли тогда еще понятія объ исторіи химіи и личностяхъ, которыя встрћчались въ ней”, добавляетъ Ладенбургъ. Самъ А. М. Бутлеровъ писалъ (1858 г.) о Кекуле, что {478} лекціи его по органической и теоретической химіи его заинтересовали „по ясности и отчетливости изслћдованія, по оригинальности и новости нћкоторыхъ взглядовъ, введенныхъ этимъ ученымъ въ область теоретической части органической химіи”.
Это пребываніе Бутлерова за границею въ 1857—1858 г. довершило (со словъ самого A. M.) его „превращеніе изъ ученика въ ученаго”, добавимъ — вполнћ самостоятельнаго и сразу оказавшагося въ передовыхъ рядахъ новаго движенія органической химіи вообще. Пребываніе же Бутлерова въ лабораторіи Вюрца оказало глубокое вліяніе на экспериментальную сторону его развитія: здћсь появилось его изслћдованіе о іодистомъ метиленћ (1858 г.), т.-е. соединеніи, которое легло въ основаніе многолћтнихъ трудовъ Бутлерова: посредствомъ этого соединенія онъ не только обогатилъ химію новыми своеобразными тћлами (напримћръ, уксусный метиленгликоль (1859), „діоксиметиленъ” (1859), гексаметилентетраминъ (1860) и др.), но и проявилъ особую смћлость въ постановкћ научныхъ вопросовъ и мастерство въ экспериментальномъ ихъ рћшеніи (метиленитанъ — первый синтезъ сахара, 1861). Этотъ переворотъ въ научномъ характерћ Бутлерова сказался и въ другомъ отношеніи: неизвћстный до этого времени въ химическомъ мірћ западной Европы профессоръ какого-то полуазіатскаго университета вдругъ выступаетъ, какъ строгій критикъ существующихъ химическихъ воззрћній того же запада, ясно и увћренно высказывая при этомъ собственные взгляды!
Критико-теоретическіе труды A.M. начинаются еще въ 1859 г., когда онъ разбираетъ (А. 110, 51) статью Купера — „о новой химической теоріи” (Compt. rend. 46, 1157; A. 110, 46); Куперъ ввелъ одновременно съ Кекуле ясный принципъ четырехатомности углерода и взаимной связи атомовъ углерода въ сложныхъ органическихъ соединеніяхъ. Въ 1861 г. Бутлеровъ впервые предлагаетъ новое понятіе и новый терминъ — „химическая структура” (Chemische Struktur), химическое строеніе. „Я называю химическимъ строеніемъ распредћленіе дћйствія этой силы (сродства атомовъ), вслћдствіе котораго химическіе атомы, посредственно или непосредственно вліяя другъ на друга, соединяются въ химическую частицу”.
Впослћдствіи Бутлерову неоднократно приходилось защищать передъ химиками запада не столько правильность предложеннаго имъ принципа химической структуры, или разсмотрћнія и опредћленія {479} рода взаимной химической связи элементарныхъ атомовъ въ молекулћ, сколько отстаивать свой пріоритетъ противъ присвоенія этихъ взглядовъ другими химиками (напримћръ Friedel и Ladenburg, L. Buff, L. Meyer, Lieben). „Вообще я долженъ замћтить, пишетъ Бутлеровъ въ 1867 г. (А. 144, 9), что въ химической литературћ послћднихъ годовъ высказываются, какъ новые и оригинальные (безъ цитатъ), такіе взгляды, которые мною уже опубликованы были”. He умаляя великихъ заслугъ Кекуле, Бутлеровъ, однако, весьма энергично возставалъ противъ умаленія или даже умалчиванія произведенныхъ имъ лично теоретическихъ и экспериментальныхъ расширеній новаго ученія, приписывая себћ „не малую долю въ дальнћйшемъ развитіи, въ послћдовательномъ проведеніи и широкомъ примћненіи этого новаго принципа” (Бутлеровъ, А. 146, 260. Отвћтъ Lothar'y Meyer'y, 1868). He подлежитъ сомнћнію, что нћмецкій переводъ его учебника „Введеніе къ полному изученію органической химіи” (Leipzig, 1868) впервые далъ западнымъ химикамъ систематическое изложеніе и строгое примћненіе того же принципа химической структуры, принципа, который не всегда понимался самимъ Кекуле. Вотъ какъ выражается по этому поводу Вл. Марковниковъ (въ магистер. диссерт.: Объ изомеріи органическихъ соединеній. Казань, 1865, стр. 85): „Будучи ревностнымъ послћдователемъ теоріи типовъ, Кекуле является въ послћднее время приверженцемъ той же теоріи, которая подробно развита Бутлеровымъ, подъ именемъ химическаго строенія. Но, къ сожалћнію, мы не находимъ той послћдовательности въ проведеніи однажды принятой идеи, послћдовательности, которой вправћ были бы ожидать отъ Кекуле; даже самая идея, кажется, недостаточно еще ясно сознана”. (См. также Бутлерова: Z. VI, 500, 1863; А. 146, 262, 1868).
Замћчательно плодотворная научная дћятельность Бутлерова въ Казани, обнимающая десятилћтіе 1858—1868 г., проложившая новые пути органической химіи и представляющая апогей творческой его силы, была прервана его переходомъ въ Петроградскій университетъ, въ которомъ онъ состоялъ профессоромъ съ 1869 г. Въ Академіи Наукъ онъ занималъ должности адъюнкта (съ 1870 г.), экстраординарнаго академика (съ 1871 г.) и ординарнаго академика (съ 1874 г.), явившись преемникомъ Фрицше. Его смерть послћдовала 5-го августа 1886 г. {480}
Въ лицћ Бутлерова русская химическая наука видитъ одного изъ величайшихъ своихъ мастеровъ; представляя идеальное сочетаніе теоретика и экспериментатора, онъ, безспорно, является самымъ плодотворнымъ изъ всћхъ русскихъ представителей органической химіи, а его гипотезы въ значительной мћрћ повліяли на возникновеніе и послћдовательное развитіе ученія о строеніи; какъ искусный и неутомимый экспериментаторъ онъ далъ необходимые фактическіе матеріалы своему ученію о химической структурћ: своими синтезами и теоретическими трудами Бутлеровъ завоевалъ себћ прочное мћсто среди величайшихъ химиковъ міра.
Разнообразіе трудовъ Бутлерова можетъ быть иллюстрировано нижеслћдующимъ хронологическимъ обзоромъ, дающимъ лишь его главнћйшія химическія работы:
1858. Полученіе іодистаго метилена CH2J2 изъ іодоформа и алкоголята натрія (А. 107, 110), жидкаго вещества, характеризующагося своимъ удћльнымъ вћсомъ 3.285 — самая тяжелая органическая жидкость, употребляемая для механическаго раздћленія смћсей минераловъ.
1859. Полученіе уксуснаго метиленгликола (дћйствіемъ уксуснокислаго серебра на CH2J2); и попытки получить изъ него свободный метиленгликолъ; при этомъ Бутлеровъ открываетъ новый изомеръ формалдегида „діоксиметиленъ”, нынћ тріоксиметиленъ С3Н6О3; одновременно онъ производитъ (съ отрицательнымъ результатомъ) опыты надъ полученіемъ въ свободномъ видћ метилена СН2 и сообщаетъ первые результаты полученія хлористаго и бромистаго метилена СН2Сl2 и CH2Br2 (A. III, 242); нынћ хлористый метиленъ употребляется въ медицинћ для мћстнаго анестезированія.
1860. Полученіе новаго соединенія, гексаметилентетрамина C6H12N4, дћйствіемъ амміака на тріоксиметиленъ (А. 115, 322); гексаметилентетраминъ (CH2)6N4, нынћ подъ названіемъ формина, аминоформа или уротропина употребляется, какъ медицинскій препаратъ, благодаря его антисептическимъ свойствамъ и способности растворять мочевую кислоту
1861. Дћйствіемъ известковой воды на тріоксиметиленъ получается метиленитанъ (А. 120, 295), сахарообразное сладкое тћло, имћющее нћкоторое сходство съ маннитаномъ изъ маннита. Относительно значенія этого тћла Бутлеровъ имћлъ вполнћ опредћленное представленіе. Онъ закончилъ свою работу слћдующими {481} словами: „приготовленіе метиленитана..... есть первый синтезъ вещества съ сахарообразнымъ характеромъ, а именноизъ простћйшихъ соединеній органической химіи... и можно утвердить, что мы имћемъ дћло съ первымъ примћромъ синтеза сахарообразнаго тћла”. Синтезъ этотъ проложилъ новый путь въ сложную область углеводовъ; его значеніе было оцћнено лишь поздно: въ 1870 г. Бейеръ впервые принялъ его за основаніе своей гипќтезы объ образованіи сахара въ растеніяхъ, въ 1886 г. О. Левъ снова произвелъ конденсацію формалдегида посредствомъ известковой воды въ сладкій сиропъ (формозу); наконецъ, въ 1888 г. Эмиль Фишеръ, открывъ въ фенилгидразинћ реактивъ на сахары, приступаетъ къ изслћдованію этого перваго искусственнаго сахара, доказавъ его неоднородность (α-акроза, формоза и др.). Поэтому поводу Э. Фишеръ (Bed. Ber. 21, 988) пишетъ слћдующее: „Такимъ образомъ Бутлерову безспорно принадлежитъ честь синтетическаго полученія изъ параформалдегида посредствомъ известковаго молока перваготћла, принадлежащаго къ классу сахаровъ”. (Е. Fischer, Untersuchungen uber Kohlenhydrate. 1884—1908, стр. 161. Bedin, 1909).
Безъ преувеличенія можно сказать, что уже на основаніи этого одного открытія метиленитана имя Бутлерова навсегда сохранится въ исторіи химіи рядомъ съ великими химиками Вёлеромъ, Кольбе, Бертело, которые своими трудами основали за періодъ 1828—1861 г. органическій синтезъ соединеній животнаго и растительнаго царства.
Первый удачный синтезъ углеводовъ, т.-е. α-акрозы или (d+l)-фруктозы, произведенный Бутлеровымъ въ 1861 г., даетъ намъ поводъ вспомнить о первой вообще попыткћ синтеза сахара, принадлежащей Ловицу (въ 1797 г.). Далће, терминъ „углеводъ” (Kohlenhydrat), столь удобный и нынћ столь обычный, впервые былъ предложенъ русскимъ химикомъ Карломъ Шмидтомъ (А. 51, 30. 1844), изслћдовавшимъ растительную слизь и бассоринъ въ ихъ отношеніи и переходћ къ клћтчаткћ и глюкозћ.
Интересно отмћтить, что еще въ 1863 г. Менделћевъ (Органическая химія, 470, 1863) не знаетъ названія „углеводъ”, а употребляетъ переводное выраженіе „гидратъ углерода”; въ 1875 г. мы встрћчаемся еще, напримћръ, у К. Лисенко (Ж. 7, 55), съ нормальнымъ терминомъ „углегидратъ”, а лишь вскользь употребляется имъ оборотъ „углеводъ”. {482}
1861. Открытъ новый способъ полученія этилена С2H4 дћйствіемъ мћди и воды на CH2J2; вмћсто свободнаго радикала метилена СН2 получается продуктъ его полимеризаціи С2Н4 (А. 120, 356).
1861. На съћздћ нћмецкихъ натуралистовъ въ Шпейерћ Бутлеровъ дћлаетъ докладъ, въ которомъ впервые предлагаетъ терминъ „химическая структура”, выражающій порядокъ и родъ взаимной связи атомовъ въ сложной частицћ; въ такомъ случаћ „химическая природа сложной частицы опредћляется природою и количествомъ ея элементарныхъ составныхъ частей и ея химической структурою” (Zeitschr. f. Ch. 1861, 553, cm. также Z. f. Ch. 1863, 503).
1863. Въ статьћ подъ заглавіемъ „О различныхъ способахъ объясненія нћкоторыхъ случаевъ изомеріи” Бутлеровъ (Zeitschr. f. Ch. 1863, 500—534) подробно разбираетъ теоретическія основанія Кекуле и Кольбе и, между прочимъ, высказываетъ слћдующіе взгляды:
„Врядъ ли можно присоединяться къ мнћнію Кекуле, что положеніе атомовъ въ пространствћ нельзя изобразить въ плоскости бумаги; вћдь математическими формулами выражается положеніе точекъ въ пространствћ, и можно надћяться, что законы, управляющіе образованіемъ и существованіемъ химическихъ соединеній, найдутъ въ свое время математическое выраженіе. Но если атомы дћйствительно существуютъ, тогда я не понимаю, почему всћ попытки опредћленія ихъ группировки въ пространствћ — какъ это полагаетъ Кольбе — должны быть тщетными; почему будущее насъ не научитъ произвести такія опредћленія?” (1. с. 504). Эти строки показываютъ намъ, какъ Бутлеровъ, этотъ химикъ-философъ, своей интуиціею заглядывалъ впередъ, предугадывая и предвћщая новый фазисъ развитія химіи — стереохимію. Увћренность Бутлерова нашла подтвержденіе черезъ одиннадцать лћтъ: въ 1874 года Вантъ-Гофъ и Лебель дћйствительно основали эту химію въ пространствћ.
1863. Бутлеровъ выводитъ четырехатомность свинца изъ плотности паровъ метилсвинца Pb(CH3)4 (Z. 1863, 500).
Исходя изъ своихъ теоретическихъ воззрћній на химическую структуру, Бутлеровъпредпринимаетъ изслћдованіе взаимодћйствія простћйшихъ углеродистыхъ тћлъ (съ однимъ лишь атомомъ углерода), чтобы осуществить простћйшіе синтезы. Съ этой цћлью онъ {483} изучаетъ, напр., реакцію СОСl2 съ Zn(CH3)2, при которой получается кристаллическій продуктъ присоединенія, дающій съ водою уксусную кислоту (Z. 1863, 490).
1864. Образовавшееся при предыдущей реакціи кристаллическое тћло является поводомъ къ изслћдованію механизма этой реакціи; при замћнћ СОСl2 хлористымъ ацетиломъ СН3СОСl получается съ цинкметиломъ кристаллическое тћло, разлагающееся съ водою въ метанъ, ZnO, ZnCl2 и новый спиртъ: третичный бутиловый или триметилкарбинолъ (СН3)3СОН (Z. 1864, 385—402, 702), существованіе котораго было уже предсказано Кольбе1), Открытый новый классъ спиртовъ представлялъ подтвержденіе теоріи о химическомъ строеніи и не могъ не оказать вліянія на дальнћйшее развитіе послћдней.
1864. Бутлеровъ даетъ „систематическое примћненіе принципа атомности для предсказанія случаевъ изомеріи и метамеріи” (Z. 1864, 513—532).
1864-66. Бутлеровъ начинаетъ изданіе своего учебника „Введеніе къ полному изученію органической химіи” (I выпускъ, Казань 1864). Критическій разборъ этого классическаго труда былъ данъ Ќ. Бейльштейномъ (Z. 1865, 727), отмћтившимъ, что этотъ учебникъ „даетъ совершенную и ясную картину современной органической химіи”, а его переводъ былъ бы встрћченъ широкой публикою съ интересомъ и принесъ бы пользу. Это — первый учебникъ на русскомъ языкћ, въ которомъ, на основаніи новаго ученія о химической структурћ, была изложена вся органическая химія, но онъ же и первый учебникъ вообще, давшій въ сжатой формћ послћдовательное и полное примћненіе этого ученія. Большой трудъ самого Кекуле „Lehrbuch der organischen Chemie”, выходилъ съ 1861 до 1866 г., но остался незаконченнымъ, а Эрленмейеръ, извћстный дћятель въ области структурной химіи, издалъ первый томъ своего труда „Lehrbuch der organischen Chemie” въ 1867—1883 г.
1865. Открытіе трехъ новыхъ третичныхъ спиртовъ: метилдиэтил-, пропилдиметил- и пропилдиэтилкарбинола (Z. 1865, 614).
1865. А. Поповъ опровергаетъ мнћніе Кольбе объ изомеріи кетоновъ съ двумя различными радикалами, напр., метиламилкетона, полученнаго изъ цинкметила и капроилхлорида, и кетона изъ {484} цинкамила и ацетилхлорида; согласно взглядамъ Бутлерова, оба кетона при окисленіи двухромокислымъ каліемъ и сћрной кислотою даютъ одинаково только валеріановую и уксусную кислоту; кетоны, слћдовательно, имћютъ симметричное строеніе
R1 |
> |
CO |
R2 |
(Zeitschr. f. Ch. 1865, 577).
1867. Поповъ распространяетъ эти опыты также на метилэтилкетонъ 1) изъ хлористаго пропіонила и цинкметила и 2) изъ хлористаго ацетила и цинкэтила; при этомъ окисленіемъ обћ пробы были превращены въ уксусную кислоту (А. 145, 283).
1867. Поповъ добываетъ этилдиметилкарбинолъ (С2Н5)(СН3)2СОН изъ хлористаго пропіонила и цинкметила (А. 145, 292).
1867. Дальнћйшее изслћдованіе третичнаго бутиловаго спирта; болће выгодный способъ его полученія и физическія свойства, нахожденіе его въ продуктахъ броженія; легкое полученіе іодюра дћйствіемъ іодистаго водорода на карбинолъ, дћйствіемъ цинка и воды на іодюръ триметилкарбинола получается изомерный бутанъ (СH3)3CH, a дћйствіемъ спиртоваго раствора ћдкаго кали на тотъ же іодюръ выдћленъ изомерный (изо) бутиленъ (СH3)2С = СН2(А. 144, 1).
1868. Синтезъ вторичнаго бутиловаго и пропиловаго спиртовъ изъ іодгидрина, этиленгликола и цинкалкиловъ (вмћстћ съ М. Осокинымъ. А. 144, 42; 145, 257); по реакціи, однако, требовалось образованіе первичныхъ спиртовъ: примћръ перегруппировки и изомеризаціи во время реакціи этилена изъ конфигураціи СН2.СН2 въ СН3.СН.
1871. Изслћдованіе правильности окисленія третичныхъ спиртовъ: простћйшій изъ алкогольныхъ радикаловъ (или одинъ изъ простћйшихъ) остается въ соединеніи съ третичнымъ углеродомъ и даетъ кислоту СnН2nO2, а два остальныхъ радикала окисляются отдћльно въ кислоты (Ж. 3, 277).
1872. Синтезъ триметилуксусной кислоты (СH3)3С.СООН, изомера валерьяновой, изъ (CH3)3CJ и ціанистой ртути (Ж. 4, 239) или, съ лучшимъ выходомъ, изъ K2Hg(CN)4 (Ж. 5, 238).
1874. Синтезъ метил-бутилкетона изъ хлорангидрида триметилуксусной кислоты и цинкметила и установленіе идентичности его съ пинаколиномъ Фриделя (Ж. 6, 158).
1875. Синтезъ кристаллическаго третичнаго гептильнаго спирта пентаметилэтола (СH3)3С.С(ОН) (СН3)2 изъ хлорангидрида {485} (СН3)3С.СОСl и цинкметила, дающій также кристаллическій гидратъ; изъ іодюра этого спирта полученъ гептиленъ (Ж. 7, 37); гептиленъ, запаянный въ трубку съ водою, спиртомъ и азотной кислотой, превращается обратно въ кристаллическій гидратъ пентаметилэтола (Ж. 8, 30).
Одновременно Бутлеровъ изучаетъ вообще процессъ гидратаціи и полимеризаціи углеводородовъ этиленнаго ряда.
Еще въ 1873 г. онъ вмћстћ съ В. Горяиновымъ открылъ способъ легкаго превращенія этилена въ этильный спиртъ (Ж. 5, 302). Въ 1876 г. изслћдуются съ этой точки зрћнія гептиленъ (см. выше); изобутиленъ въ присутствіи спирта, воды и азотной кислоты даетъ триметилкарбиноль; но соединеніе жидкаго изобутилена съ водою вызывается уже нћсколькими каплями сћрной кислоты (т.-е. H2SO4 — или водородные іоны — являются здћсь катализаторомъ, вызывающимъ гидратацію); псевдобутиленъ и амилены обладаютъ той же способностью гидратаціи. (Ж. 8, 30).
1877. Обширное изслћдованіе о диизобутиленћ (Ж. 9, 38—76, А. 189, 44) или изомерномъ октиленћ C8H16.
Вопросъ о полимеризаціи (конденсаціи) и изомеризаціи, занимавшій Бутлерова почти всю его жизнь, генетически связанъ съ іодистымъ метиленомъ; эксперименты надъ этимъ соединеніемъ привели Бутлерова къ тріоксиметилену (1859) и гексаметилентетрамину (1860), къ бимеру метилена СН2.СН2 (этилену, 1861) и синтезу сахара „метиленитана” (1861). Въ 1868 г. Бутлеровъ установилъ изомеризацію (перегруппировку) этилена; въ 1873 г. онъ, совмћстно съ В. Горяиновымъ, предпринялъ опыты „полимеризаціи углеводо родовъ этиленнаго ряда” (Ж. 5, 302), а равно превращеніе этилена въ этиловый спиртъ. Разбирая уплотненіе амилена, изученное Шнейдеромъ (1869), Бутлеровъ приходитъ къ заключенію, что „нћкоторые атомы водорода мћняютъ свои мћста во время уплотненія амилена”. Что касается уплотненія этилена, то таковое не происходитъ ни въ присутствіи сћрной кислоты, ни фтористаго бора, но пропиленъ и изобутиленъ уплотняются легко,— послћдній углеводородъ переходитъ въ изотрибутиленъ С12Н24 (изодибутиленъ C8Hl6 былъ впервые полученъ нагрћваніемъ изобутилена со слабой сћрной кислотой. Ж. 7, 315, 1875).
Упомянутый диизобутиленъ (СН3)2С: СНС(СН3)3 присоединяетъ HJ и даетъ съ влажной окисью серебра новый октильный спиртъ (третичный). {486}
1878—1879. (Вмћстћ съ Вышнеградскимъ) изслћдованіе цинхонина и хинина, давшихъ отъ дћйствія ћдкаго кали хинолинъ или высшій его гомологъ, а равно этилпиридинъ или его гомологъ (Ж. 10, 244, 11, 321).
1879. Изслћдованіе изотрибутилена (продукта конденсаціи изобутилена съ крћпкой сћрной кислотою)
(СН3)2С: С |
< |
С(СН3)3 |
С(СН3)3 | (Ж. 11, 197). |
1884. Изслћдованіе строенія азарона или азаровой камфоры; вмћстћ съ Б. Рицца (Ж. 16, 561; 19,97) была установлена структурная формула азарона
С6Н2 |
< |
(OСН3)3 |
СH:СНCH3 |
Достойно вниманія то обстоятельство, что первая работа Бутлерова по органической химіи принадлежала къ области камфорообразныхъ тћлъ (пулегонъ, 1854), а послћдняя работа также посвящена камфорообразному тћлу (азаронъ, 1884).
Въ упомянутомъ изслћдованіи Бутлерова объ изодибутиленћ онъ развиваетъ свои теоретическіе взгляды на механизмъ образованія этого тћла изъ третичнаго спирта и сћрной кислоты. Эти соображенія имћютъ значеніе съ различныхъ точекъ зрћнія; поэтому я приседу изъ нихъ нћсколько мћстъ (А. 189, 76, 1877 и Ж. 9, 68, 1877); см. также его „Введеніе”, нћм. изд. (1868, 49, 721):
„Слћдуетъ думать, что въ смћси третичнаго спирта съ разведенной сћрной кислотою, уже и при обыкновенной температурћ, находится нћкоторое количество углеводорода, образовавшагося распаденіемъ..... При обыкновенной температурћ химическому равновћсію въ смћси соотвћтствуетъ малое количество углеводорода рядомъ съ большимъ количествомъ алкоголя.....; при возвышенной температурћ, наоборотъ, равновћсіе устанавливается при большомъ количествћ углеводорода и маломъ — алкоголя..... Мыслимо, что и безъ присутствія посредствующаго реагента, каковымъ является здћсь сћрная кислота, частицы нћкоторыхъ веществъ вслћдствіе иостояннаго распаденія и возсоединенія продуктовъ въ новомъ порядкћ постоянно изо меризуются, переходя отъ одного видоизмћненія въ другое — и обратно..... но, вћроятно, существуютъ также тћла, при которыхъ количество одного изомера не минимально, масса которыхъ постоянно заключаетъ въ замћтномъ количествћ изомерныя частицы различнаго химическаго строенія, — частицы, {487} постоянно „соприкасающіяся” между собою, перегруппировывающіяся взаимно изъ одного строенія въ другое. Ясно, что химическія метаморфозы такого тћла должны протекать то въ смыслћ одной, то въ смыслћ другой группировки, въ зависимости отъ природы реагента и условій опыта...... Подобной частицей дћйствительнаго строенія будутъ, напримћръ, повидимому, ціановая кислота, синильная кислота и т. п. Съ этой точки зрћнія представляются безполезными и невозможными старанія разрћшить вопросъ о томъ, гидратное или карбимидное строеніе свойственно ціановой кислотћ, нитрильное или карбиламинное строеніе имћетъ синильная кислота и т. п. Почти лишнее прибавлять, что сказанное представляетъ приложеніе къ представленію о химическомъ строеніи тћхъ динамическихъ понятій, начало которымъ положилъ Бертолле и которыя все болће и болће захватываютъ и освћщаютъ область химизма”.
По общему ея смыслу гипотеза Бутлерова для гомогенныхъ органическихъ тћлъ исходитъ изъ принципа диссоціаціи и ассоціаціи; въ частности, она смћло допускаетъ для отдћльныхъ органическихъ строеній, въ зависимости отъ ихъ структуры, самопроизвольную диссоціацію частицы въ замћтномъ количествћ, при обыкновенныхъ температурныхъ условіяхъ и въ жидкомъ состояніи; невольно вспоминается другой русскій ученый — Гротгусъ (1818 г.) который, съ точки зрћнія электрохимика, высказалъ впервые относительно растворенныхъ солей подобную гипотезу постояннаго растворенія частицы и возсоединенія этихъ молекулярныхъ обломковъ; невольно вспоминается намъ и Каяндеръ, пришедшій на основаніи химическаго сродства различныхъ кислотъ къ заключенію, что таковыя существуютъ въ видћ продуктовъ распаденія (1881 г.); однако, Каяндеръ считалъ такое смћлое умозаключеніе недопустимымъ (Ж. 13, 471, 474). Наконецъ, въ 1884—1887 г. Арреніусъ устанавливаетъ для электролитовъ вообще такое свободное распаде. ніе на іоны.
Но гипотеза Бутлерова, относящаяся къ неэлектролитамъ, т.е, къ органическимъ соединеніямъ, имћетъ свое значеніе еще въ другомъ направленіи: она уже въ 1877 г. опредћленно формулировала то, что лишь въ 1885 г. было введено въ химію, какъ вполнћ „новое” понятіе, Ларомъ (Berl. Ber. 18, 648, 19, 730). Это — извћотное нынћ явленіе таутомеріи или десмотропіи; таутомернымъ Ларъ называетъ соединеніе, которое по своимъ реакціямъ можетъ имћть нћсколько структурныхъ формулъ. Предлагая новый терминъ и {488} начиная обзоръ таутомерныхъ соединеній съ ціанистыхъ соединеній, Ларъ, къ сожалћнію, забываетъ назвать Бутлерова, который, по существу, далъ болће широкую интерпретацію механизма этихъ явленій, чћмъ Ларъ (лишь послћ рекламаціи Бутлерова Ларъ упомянулъ объ его работахъ, 1886, Bed. Ber. 19, 730).
Бутлеровъ имћетъ рядъ выдающихся учениковъ, изъ которыхъ назовемъ лишь A. M. Зайцева, Вл. В. Марковникова, A. H. Попова, М. Д. Львова. Въ частности первый изъ нихъ можетъ быть названъ — какъ по мћсту и времени, такъ и по духу — прямымъ преемникомъ Бутлерова, продолжавшимъ въ казанской лабораторіи съ такимъ же мастерствомъ экспериментально-научную обработку органической химіи вообще, и въ особенности изучавшимъ синтезъ спиртовъ.
Зайцевъ создалъ множество новыхъ методовъ и новыхъ органическихъ тћлъ; но и безъ этихъ трудовъ, доставившихъ ему прочное мћсто въ исторіи химіи вообще, онъ пріобрћлъ въ исторіи русской химіи широкую славу, какъ основатель цћлой школы выдающихся химиковъ въ Россіи. Къ его извћстнымъ ученикамъ принадлежатъ, напримћръ, Е. Е. Вагнеръ, И. И. Канонниковъ, С. Н. Реформатскій, А. А. Альбицкій, А. Арбузовъ, А. Богородскій, М. М. Зайцевъ, А. Н. Реформатскій, В. И. Сорокинъ и др.
Алекс. Мих. Зайцевъ родился въ 1841 г. въ Казани; ученикъ А. Бутлерова въ Казани, онъ заграницею учился у Кольбе въ Марбургћ и у Вюрца въ Парижћ; послћ ухода Бутлерова въ Петроградъ, состоялъ съ 1869 г. до своей смерти профессоромъ химіи Казанскаго университета; умеръ въ 1910 г.
Зайцевъ былъ химикъ-экспериментаторъ par excellence, который почти всћ свои работы посвятилъ органической химіи, а именно изслћдованію алифатическихъ соединеній. Изъ многочисленныхъ классическихъ работъ Зайцева приведемъ лишь слћдующія:
1863. Превращеніе анисовой кислоты въ параоксибензойную (нагрћваніемъ съ HJ. А. 127, 129).
1866. Открытіе новаго класса сћрнистыхъ соединеній — сульфокисей (изъ тіоэфировъ азотной кислотою, А. 139, 354, 144, 148, а равно магист. диссерт., Казань, 1867).
1870. Новый способъ синтеза первичныхъ спиртовъ: первичный бутиловый спиртъ полученъ возстановленіемъ хлорангидрида кислоты (докт. диссерт.: Новый способъ превращенія жирныхъ кислотъ въ соотвћтствующіе имъ алкоголи. Казань, 1870). {489}
1870. Полученъ бутиленъ изъ нормальнаго бутиловаго спирта, (Journ. pr. Ch. 2, 3, 88; Lieb. Ann. 179, 330).
1873. Открытіе перваго лактона, бутиролактона (возстановленіемъ хлорангидрида янтарной кислоты) (А. 171, 258)1).
1874. (Вмћстћ съ Е. Вагнеромъ) новый синтезъ предћльныхъ вторичныхъ спиртовъ, дћйствіемъ цинка и галоидоалкиловъ, напримћръ, C2H5J, на муравьиный этиловый эфиръ (Ж. 6, 122, 290).
1875. Новый синтезъ вторичныхъ спиртовъ изъ альдегидовъ и цинкоорганическихъ соединеній Е. Вагнера.
1875. Правило присоединенія HJ и отщепленія его (Вл. В. Марковниковъ).
1875-6. Вмћстћ съ И. Канонниковымъ и Мих. Зайцевымъ полученіе непредћльныхъ вторичныхъ спиртовъ изъ муравьинаго эфира, цинка и іодистаго аллила (Ж. 8, 341, 359).
1876. Совмћстно съ Мих. Зайцевымъ новый синтезъ третичныхъ непредћльныхъ спиртовъ (изъ кетоновъ, цинка и галоидоуглеводородовъ, напримћръ, іодистаго аллила) (Ж. 8, 363).
1877. Выясненіе механизма предыдущей реакціи и образованіе промежуточнаго продукта
Zn |
< |
С3H5 |
(Ж. 9, 17). |
J |
1877-8. Зайцевъ и Канонниковъ получаютъ уксусный альдегидъ дћйствіемъ хлористаго ацетила на ледяной уксусь (Ж. 9, 31).
1885. Новый синтезъ третичныхъ предћльныхъ спиртовъ изъ кетоновъ (Ж. 17, 178).
1885. Реакція окисленія олеиновой и элаидиновой кислотъ марганцовокислымъ каліемъ (діоксистеариновыя кислоты) (Ж. 17, 417).
1887. П. Меньшиковъ доказываетъ, что и предћльные іодюры дћйствуютъ подобно іодистому аллилу, т.-е. что вообще продуктъ первой фазы реакціи іодцинкалкилъ Alk — ZnJ (Ж. 19, 38).
1888. Новая твердая (изо-)олеиновая кислота (вмћстћ съ Мих. и Конст. Зайцевымъ. Ж. 20, 388).
Вообще A. M. Зайцевъ создалъ рядъ новыхъ синтезовъ {490} предћльныхъ и непредћльныхъ спиртовъ при посредствћ галоидоцинкорганическихъ соединеній, давъ дальнћйшее развитіе реакціи Бутлерова (1864) и обогативъ химію цћлымъ рядомъ новыхъ синтезовъ. Эти методы получили новое усовершенствованіе въ 1900 г., когда Гриньяръ замћнилъ цинкъ магніемъ и ввелъ растворитель. По справедливости эта „Гриньяровская реакція” должна быть названа реакціей Зайцева-Гриньяра, такъ какъ Зайцевъ первый создалъ всю совокупность этихъ реакцій и даже объясненіе механизма1).
Область спиртовъ была разработана въ особенности Е. Е. Barнеромъ (см. хронологическую таблицу), начавшимъ свои изслћдованія совмћстно съ А. Зайцевымъ въ 1873 г. Сводка этихъ работъ была дана въ магистерской диссертаціи Вагнера: „Синтезъ вторичныхъ спиртовъ и ихъ окисленіе” (1885). Непосредственно изъ казанской лабораторіи скоро появилась другая цћнная магистерская диссертація — С. Реформатскаго, посвященная многоатомнымъ спиртамъ, т.-е. добыванію таковыхъ изъ непредћльныхъ углеводородовъ и спиртовъ посредствомъ присоединенія хлорноватистой кислоты дћйствіемъ водной щелочи на хлоргидрины („Предћльные многоатомные алкоголи”. Казань, 1889).
Эта реакція присоединенія хлорноватистой кислоты къ непредћльнымъ углеводородамъ, открытая въ 1862 г. Каріусомъ, многократно примћнялась русскими химиками. Такъ, напримћръ, Эльтековъ съ ея помощью получилъ рядъ монохлоргидриновъ гликолей, отъ которыхъ перешелъ къ окисямъ, за нимъ С. Пржибытекъ примћнилъ ее для полученія многоатомныхъ спиртовъ, напримћръ, двуокиси діаллила, 1884. Съ ея помощью и И. Каблуковъ получилъ въ лабораторіи Марковникова новые трехатомные спирты (1884—1887), описанные въ магистерской диссертаціи: „Глицерины или трехатомные спирты и ихъ производныя” (Москва, 1887). Укажемъ еще, что помощью этой же реакціи Е. Любарскій синтезировалъ четырехатомный эритритъ (1900).
Когда Е. Е. Вагнеръ2) въ Варшавской лабораторіи выработалъ въ 1888 г. замћчательный методъ окисленія этиленныхъ {491} углеводородовъ и спиртовъ разбавленнымъ воднымъ растворомъ марганцовокаліевой соли, этимъ былъ созданъ изящный способъ полученія гликолей изъ углеводородовъ и глицериновъ изъ спиртовъ.
Этому вопросу Е. Вагнеръ посвятилъ свою классическую докторскую диссертацію: „Къ реакціи окисленія непредћльныхъ углеродистыхъ соединеній” (1888). Упомянемъ, что этимъ же методомъ Вагнеръ скоро воспользовался при объясненіи структуры терпеновъ (см. ниже). Въ казанской лабораторіи, начиная съ 1892 г., тотъ же методъ служилъ для полученія новыхь многоатомныхъ спиртовъ, глицериновъ и пятиатомныхъ (Н. Зайцевъ, Я. Боянусъ, И. Панфиловъ, 1892; А. Богородскій, А. Гнћдичъ, 1898; Д. Марко, 1901 и др.).
Изъ работъ казанской школы, относящихся къ спиртамъ, упомянемъ еще о слћдующихъ.
Амиленгидратъ, разсматривавшійся знаменитымъ Вюрцемъ, какъ гидратъ углеводорода С5Н10.Н2O, служилъ долгое время предметомъ споровъ. Его полученіе изъ цинкметила и хлорида пропіоновой кислоты удалось А. Попову (1868), а Ф. Флавицкій (объ изомеріи амиленовъ. Казань, 1875), и, въ окончательной формћ, А. Вышнеградскій (1877) доказали, что этотъ „гидратъ” есть третичный спиртъ.
А. Н. Поповъ (ученикъ А. Бутлерова; съ 1869 г. профессоръ Варшавскаго университета, ум. 1881 г.) внесъ въ область опредћленія структуры спиртовъ новый важный факторъ. Начавъ подъ руководствомъ Бутлерова свои изслћдованія объ окисленіи кетоновъ вообще (магист. диссерт.: „Объ окисленіи кетоновъ одноатомныхъ”. Казань, 1869), и выяснивъ послћдовательно ходъ этого окисленія, онъ въ 1872 г. вывелъ общее правило этой реакціи, дающее способъ для опредћленія строенія алкоголей и кислотъ: окисленіе кетоновъ (двухромокислымъ каліемъ и сћрной кислотою) происходитъ при карбонильной группћ, которая съ однимъ изъ радикаловъ даетъ одну кислоту, между тћмъ какъ другой радикалъ окисляется въ радикалъ соотвћтственнаго спирта. Е. Е. Вагнеръ (см. магист. диссерт.) подвергъ этотъ законъ Попова экспериментальной провћркћ, установивъ случаи отступленія въ зависимости отъ условій (1884-5). {492}
Продолженіемъ трудовъ казанской лабораторіи по синтезу спиртовъ являются и недавнія изслћдованія А. Реформатскаго, напечатавшаго трудъ: „Одноатомные непредћльные спирты жирнаго ряда. Синтезъ спиртовъ ряда СnН2n–5ОН” (Москва, 1908), представляющій цћнную по полнотћ монографію синтезовъ непредћльныхъ спиртовъ вообще, съ точнымъ разборомъ работъ русскихъ химиковъ. Кромћ того, Реформатскій сообщаетъ и собственныя экспериментальныя изслћдованія, давшія неизвћстные раньше спирты ряда СnН2n–5ОН.
Непредћльный (жирный) спиртъ ундециленовый и способность его изомеризоваться отъ дћйствія разбавленной сћрной кислоты въ γ-окись были изучены Н. Логгиновымъ (1913).
А. Фаворскій далъ способъ полученія кетоспиртовъ (1913); примћняя реакцію Фриделя — дћйствіе пятихлористаго фосфора на кетонный карбонилъ, — онъ уже раньше воспользовался полученными дихлоридами для полученія углеводородовъ СnН2n–2 (1888), нынћ же онъ выработалъ способъ приготовленія дибромидовъ, дћйствуя РBr5 на кетоны; при этомъ образуются по преимуществу несимметричные α-α-дибромкетоны, превращаемые, напримћръ, 10% растворомъ поташа въ кетоспирты. В. Семеновъ получилъ дибромкетоны (симметричные) прямымъ дћйствіемъ брома (въ эфирћ) на кетоны (1911).
Къ казанской школћ химическихъ изслћдованій относятся также оксикислоты. Въ частности для синтеза третичныхь β-оксикислотъ С. Реформатскій (1890) создалъ методъ, дћйствуя смћсью цинка и монохлоруксуснаго эфира на кетоны и альдегиды; варіируя эфиры (хлоро- и бромозамћщенные монокарбоновыхъ кислотъ) и кетоны, а равно альдегиды, С. Реформатскій вмћстћ со своими учениками подробно разработалъ этотъ интересный и плодотворный методъ, создалъ цћлый рядъ новыхъ β-оксикислотъ, изучилъ ихъ распаденіеит. д. (см. монографію: Сборникъ работъ лабораторіи органической химіи университета Св. Владиміра, Кіевъ, 1907). Б. Шишковскимъ была опредћлена электропроводность части этихъ кислотъ. Дћйствіемъ магнійгалоидметила на дибромизобутиронъ А. Умнова получила (1913) нормальную гексаметилъ-β-оксимасляную кислоту.
Къ классу изслћдованій спиртовъ принадлежатъ также труды В. Г. Тищенко (съ 1896 г.), приготовившаго новые алкоголяты алюминія и изучившаго ихъ свойства и реакціи съ водою, алкоголями, галоидопроизводными углеводородовъ и т. д., a {493} равно сухую перегонку (маг. диссерт.: „О дћйствіи амальгамированнаго алюминія на алкоголи. Спб. 1899). Продолженіемъ этихъ трудовъ является серія изслћдованій того же ученаго: О дћйствіи алкоголятовъ алюминія на альдегиды. Сложно-эфирная конденсація, какъ новый видъ уплотненія альдегидовъ. (Докторская диссертація, 1906, Спб.).
Области многоатомныхъ спиртовъ, т.-е. углеводовъ, касаются изслћдованія А.М.Настюкова; онъ произвель экспериментальное изслћдованіе оксицеллулозъ и далъ монографію (магистерская диссертація: Оксицеллюлоза. Тамбовъ, 1901); имъ была также изучена конденсація ароматическихъ углеводородовъ съ углеводами (1907). Целлулозћ посвящено еще цћнное изслћдованіе А. Сапожникова „О теоріи нитраціи клћтчатки” (1909).
Упомянемъ также, что въ каталитическихъ реакціяхъ гидрогенизаціи, въ присутствіи, напримћръ, желћза и окиси никкеля (1907), а равно окиси мћди и цинковой пыли (1911), В. Ипатьевъ открылъ способъ перехода отъ альдегидовъ и кетоновъ къ спиртамъ; кстати прибавимъ, что эти реакціи суть обратимыя; такъ, напримћръ, СН3СО.СН3 + Н2  (CH3)2СН(ОН).
(CH3)2СН(ОН).
Въ заключеніе укажемъ еще на классическія изслћдованія Н. А. Меншуткина о вліяніи изомеріи спиртовъ и кислотъ на скорость образованія сложныхъ эфировъ (1877—1906).
Остановимся еще на одномъ вопросћ: какъ была устроена эта казанская лабораторія, дававшая столь выдающихся химиковъ въ продолженіе почти цћлаго столћтія съ такой послћдовательностью, которая сама собою напоминаетъ уже закономћрность. Отличалась ли эта лабораторія особымъ богатствомъ средствъ или благоустройствомъ? Или въ ней дћйствовали особые „невћсомые” факторы, напримћръ, великія традиціи и свћтлыя воспоминанія, созданныя примћромъ великихъ представителей науки? Или обособленность этой лабораторіи давала ученымъ возможность сосредоточиться на работћ, а скромно обставленная лабораторія способствовала проявленію особой изобрћтательности и интенсивности въ работћ?
Казанская лабораторія была выстроена въ 1837 г. и состояла изъ семи комнатъ (въ нижнемъ этажћ особаго флигеля; въ верхнемъ помћщался физическій институтъ). „Въ этомъ числћ {494} заключаются: аудиторія, большая комната „химическій кабинетъ” для храненія цћнныхъ инструментовъ и посуды, вћсовая комната, кладовая, такъ что собственно рабочее помћщеніе состояло изъодной довольно большой комнаты сосводами и каменнымъ поломъ. Въ ней находилось 10 изразцовыхъ неподвижныхъ печей, дымовой колпакъ для подвижныхъ желћзныхъ печей и по серединћ три рабочихъ стола и нћсколько шкафовъ для необходимой посуды и реагентовъ”. (А. Альбицкій, см. Ломоносовскій Сборникъ, 1901). Бюджетъ этой лабораторіи, въ которой вскорћ начали работать два профессора — К. Клаусъ и Зининъ, составлялъ всего 444 р. 28 к. серебромъ; въ качествћ иллюстраціи отдћльныхъ статей этого бюджета приведемъ роспись на 1843 годъ:
Жалованье 2 служителямъ (92 р. 56 к.), | 164 р. 28 к. |
||
посуда для химическихъ опытовъ. . . | 30 р. |
||
матеріалы для нихъ . . . . . . . | 100 р. |
||
покупка аппаратовъ и инструментовъ . | 150 р. |
||
на собственно химическіе расходы итого . . | 280 р. . . . |
280 р. |
|
Итого . . |
444 р. 28 к. |
||
Дћйствительно замћчательная сумма: 280 рублей! А теперь, рядомъ съ этими жалкими матеріальными средствами, разсмотримъ добытыя тамъ же и въ тћ же годы научные результаты, т.-е. противъ расходовъ годовыхъ, около 280 p., поставимъ научные доходы.
|
Въ 1842 г. Зининъ открываетъ методъ возстановленія нитробензола въ анилинъ. Въ 1842 г. Зининъ получаетъ изъ нитронафталина α-нафтиламинъ. Въ 1844 г. Зининъ получаетъ тћмъ же способомъ нафтилен- и фенилендіаминъ. |
ü |
Продукты эти даютъ современной техникћ годные доходы въ милліоны рублей. |
Въ 1844 г. Клаусъ открываетъ элементъ рутеній. |
Комментаріи излишни.
Когда Зининъ въ январћ 1848 г. перешелъ въ Петроградъ, какова была тамъ его лабораторія?
„Работалъ Н. Н. въ самой скромной лабораторіи”, разсказываетъ Ќ. Ќ. Бейльштейнъ, „до устройства лабораторіи въ Академіи {495} Наукъ (т.-е. до 1867 г.), преимущественно даже въ узкой комнатћ, въ своей частной квартирћ, въ Шпалерной”.
Въ концћ 1851 академическаго года Клаусъ оставилъ казанскій университетъ, занявъ каќедру фармаціи въ дерптскомъ (юрьевскомъ) университетћ; химическую лабораторію онъ сдалъ A. M. Бутлерову.
Химическую лабораторію въ Казани Бутлеровъ „получилъ въ весьма примитивномъ состояніи”, говоритъ ученикъ Бутлерова (В. Марковниковъ, Ж. 19, 77). „Ея рабочее помћщеніе состояло изъ одной залы въ семь оконь. Въ ней было два изразцовыхъ стола, большая печь для приготовленія калія, горнъ, песчаная баня безъ тяги и двћ переносныя калильныя печи. Вотъ и все устройство для работъ. Тутъ велись научныя изслћдованія, здћсь же приготовлялись опыты для лекцій, мылась грязная посуда..... Студенты работали на окнахъ. Газу не было. Нагрћваніе производилось спиртовыми лампами или углемъ, а когда приходилось дћлать органическій анализъ, то примащивались кое-какъ на печкћ для калія. Но не красна изба углами — красна пирогами”. Въ этой-то лабораторіи Бутлеровъ произвелъ свои замћчательные синтезы, создалъ и разработалъ свою теорію строенія, оставилъ свою классическую химическую школу и написалъ свою „Органическую химію”. Въ 1868 г. Бутлеровъ переходитъ въ Петроградъ.
Завћдываніе казанской лабораторіей, по случаю перехода Бутлерова въ Петроградъ, въ 1868 г. было поручено доценту, а съ 1869 г. профессору Владиміру Васильевичу Марковникову, ученику Бутлерова. Въ этой же лабораторіи были произведены прекрасныя изслћдованія Марковникова объ аллиленћ (1861), объ изомеріи въ пропиловомъ ряду (1864), объ изомеріи органическихъ соединеній (1865), разработаны „матеріалы къ вопросу о взаимномъ вліяніи атомовъ въ химическихъ соединеніяхъ” (1869). Когда въ декабрћ 1871 г. Марковниковъ былъ уволенъ, на его мћсто былъ въ 1871 г. избранъ ординарнымъ профессоромъ и завћдывающимъ лабораторіею A. M. Зайцевъ, исполнявшій эти обязанности до 1910 г. и прибавившій много научныхъ открытій и покрывшій новой славой имя Казанской лабораторіи. Однако, эта лабораторія оставалась все же старой и убогой!
Послушаемъ, какъ рисуетъ эту лабораторію въ Зайцевскій періодъ одинъ изъ біографовъ Александра Михайловича Зайцева (А. Реформатскій, Ж. 43, 865 1911). {496}
„Казанская лабораторія была основана въ 1806 г. Правда, первые 30 лћтъ она почти не существовала въ современномъ смыслћ: она даже не имћла собственнаго помћщенія. Послћднее было выстроено лишь въ 1837 г. и почти въ полной неприкосновенности существуетъ и по сіе время. Если бы современные химики, привыкшіе видћть химическія лабораторіи въ видћ обширныхъ, нерћдко величественныхъ зданій, болће или менће изящныхъ снаружи и богато обставленныхъ внутри, съ такимъ масштабомъ пошли бы въ казанскій университетъ искать его химическую лабораторію, то здћсь пришлось бы потратить не мало времени, и все-таки подходящаго зданія не нашлось бы и, конечно, потому, что ничего подобнаго сказанному здћсь нћтъ. На нашъ запросъ, гдћ у Васъ химическая лабораторія, добродушный и флегматичный дворникъ-татаринъ указалъ бы на маленькую... дверь, ведущую въ подвалъ. Пойдемте туда, но только не спћша: дверь отворяется не легко; гулко звучитъ простой заржавћлый блокъ, на которомъ ходитъ самая обыкновенная веревка съ кирпичемъ, притворяющая эту дверь. Два-три скрипучихъ приступка спустятъ насъ въ подвалъ. Узкимъ, темнымъ..... корридорчикомъ приходится осторожно пробираться въ первую небольшую подвальную лабораторную комнату, за которой сейчасъ же слћдуетъ вторая и послћдняя подвальная комната. Это уже органическая лабораторія..... По темной узкой деревянной лћстницћ надо подняться кверху — этажемъ выше, здћсь.....входимъ въ комнату сравнительно большую — съ 18 рабочими мћстами для аналитиковъ, a.....рядомъ комната приблизительно втрое меньшая, которая и являлась долгіе годы собственно органической лабораторіей. Вотъ и вся лабораторія, которая находилась въ вћдћніи А. М, Зайцева, а до него Бутлерова..... бћдно здћсь: всего мало и всћ это знаютъ и всћ экономятъ...”.
А какова была лабораторія Бутлерова въ Петроградћ? Вотъ какъ характеризуетъ Г. Г. Густавсонъ таковую: „... то помћщеніе, которое, на первое время, пришлось занять Бутлерову, было весьма мало и не снабжено въ достаточной степени приспособленіями для работъ...; но это не остановило дћла и не помћшало работамъ самого Бутлерова. Онъ умћлъ обходиться наличными, хотя бы и малыми, средствами, потому что искусство изслћдователя было въ немъ развито до высокой степени”. (Ж. 19, 61). {497}
А самъ Г. Г. Густавсонъ работалъ въ Петроградћ „въ собственной квартирћ, въ которой устроилъ себћ домашнюю лабораторію. Въ этой чрезвычайно скромной обстановкћ домашней лабораторіи онъ одинъ, безъ всякаго помощника, произвелъ часть труднћйшихъ своихъ изслћдованій о каталитической роли галоидныхъ солей алюминія въ превращеніяхъ органическихъ соединеній. Сожженія, которыхъ онъ сдћлалъ много, производилъ онъ на бензиновыхъ лампахъ (!), ставя ихъ въ воду” (Н. Демьяновъ, Ж. 41, 550). Это относится къ ученому конца XIX и начала XX вћка!
А какова была лабораторія Бунзена, этого научнаго чародћя, творческая сила котораго сказывалась во всемъ, къ чему прикладывалъ онъ свои руки, и который можетъ считаться однимъ изъ величайшихъ экспериментаторовъ въ химіи? Въ 1859 г. къ нему отправился нашъ Д. И. Менделћевъ, — въ ту эпоху, когда Бунзенъ уже закончилъ свои классическія фотохимическія изслћдованія совмћстно съ Роско (1855—1857), и нашъ соотечественникъ Л. Н. Шишковъ произвелъ съ нимъ изслћдованіе о горћніи пороха (1857). Это было, слћдовательно, наканунћ открытія спектральнаго анализа (185960), благодаря которому мы можемъ при помощи свћтовыхъ волнъ — этихъ курьеровъ вселенной — сноситься съ самыми отдаленными небесными свћтилами. Вотъ какъ описываетъ Д. И. Менделћевъ (въ письмћ Л. Н. Шишкову, 1859 г., Ж. 42, 1341) свое пребываніе и свой уходъ изъ этой лабораторіи: „Бунзенъ былъ милъ, какъ и всегда, отыскалось и мћсто для меня въ его лабораторіи — да не могъ я тамъ работать. Извћстный Вамъ Каріусъ (онъ теперь завелъ свою отдћльную лабораторію) такъ вонялъ своими сћрнистыми про дуктами (Каріусъ готовилъ эфиры сћрнистой кислоты, тіоэфиры, сульфоны. П. В.), что у меня (а мнћ пришлось стоять около него) голова и грудь заболћли на другой же день. Потомъ увидћлъ, что ничего мнћ необходимаго нћтъ въ этой лабораторіи, даже вћсы, и тћ куда какъ плоховаты, а главное—нћтъ чистаго покойнаго уголка, гдћ можно было бы заниматься съ такими деликатными опытами, какъ капиллярные, съ такими точными инструментами, какъ катетометръ... Я и рћшилъ устроить все у себя дома.” Такова была обстановка у дћйствительно знаменитаго физико-химика Бунзена, а въ лабораторіяхъ менће знаменитыхъ?
Невольно хотћлось бы вывести нћчто въ родћ закона „объ обратной пропорціональности между качествомъ произведенныхъ научныхъ работъ и качествомъ лабораторіи, въ которой данный {498} ученый долженъ трудиться”! Въ томъ же смыслћ выразился нћкогда и В. Мейеръ, говоря, что лучшія работы произведены были въ наихудшихъ лабораторіяхъ.
Ученіе о непредћльныхъ углеводородахъ возникло лишь полвћка тому назадъ и въ развитіи опытнаго и теоретическаго познанія ихъ русскіе химики принимали выдающееся участіе. Въ наши дни всћ эти теоретическія изслћдованія пріобрвли чрезвычайно большое практическое значеніе вслћдствіе той связи, которая была установлена между ними, напр., между бромисгымъ вшшаомъ, алкилированными алленами, или пипериленомь, дииропиленомъ, бутадіенами, изопреномъ и продуктами полимеризаціи послћднихъ — каучукомъ. Вопросъ, слћдовательно, касаегся сингеза вообще и синтетической фабрикаціи каучука въ частности. А техническая роль каучука въ современной жизни должна быть признана очень значигельной: стоимость обрабатываемаго ежегодно сырого каучука составляетъ сумму около 500 милліоновъ рублей.
Въ 1795 г. Дейманъ (Deiman) и трое голландскихъ химиковъ открыли этиленъ С2Н4; въ 4825 г. Фарадэй изолировалъ первый полимерный углеводородъ бутиленъ С4H8, а равно бензолъ изъ продуктовъ сухой перегонки жирныхъ маселъ. Въ 1859 г. Бертело получилъ чистый углеводородъ С2Н2, названный имъ „ацетиленомъ”.
Въ Россіи Бутлеровъ первый предпринялъ систематическое изслвдованіе непредћіьныхъ углеводородовъ; въ казанской лабораторіи, начиная съ 1862 г., имъ же и его учениками (напр., Марковниковымъ, Савичемъ, Мясниковымь, А. Зайцевымь) были даны новые методы полученія и новыя реакціи изомеризаціи этихъ углеводородовъ. Вообще изученіе углеводородовь представляло {499} впродолженіе многихъ десятилћтій интересную и важную задачу для теоріи строенія; въ видћ piece de resistance непредћльные углеводороды появляются въ научныхъ трудахъ выдающихся русскихь химиковъ, вслћдствіе чего послћдними были созданы новые и богатые научные матеріалы въ этой области. Въ центрћ интереса долгое время находился амиленъ С5Н10 кромћ Бутлерова, надъ выясненіемъ строенія амиленовъ работали еще Ќ. Бейльштейнъ (1862), Н. Бунге (іірисоединеніе NOCl, 1871), Ф. Флавицкій (1872; диссер. Объ изомеріи амиленовь. Казань, 1875), А. Вышнеградскій (1875/7), А. Эльтековъ (съ 1877), Е. Вагнеръ и А. Зайцевъ (1875), В. Ф. Шнейдеръ (диамилень, 1871), въ особенности И. Кондаковъ (1885—1893). Циклическій амиленъ былъ изученъ Г. Густавсономъ и Н. Демьяновымъ (синтезъ пентаметилена, 1889) и В. Марковниковымъ (пентаметиленъизъкавказской нефти, 1897). Эльтековъ ноказалъ(1873), что дћйствіемь окиси свинца на галоидныя соединенія этилена и пропилена получаются гидроксилировамные продукты. Діаллилъ (С3H5)2 былъ обстоятельно изслћдованъ В. Н. Сорокинымь, получившимъ, между прочимъ, при окисленіи этого углеводорода марганцовокаліевой солью янтарную кислоту (магист. дис: Къ вопросу о строеніи нћкоторыхъ непредћльныхъ соединеній съ повторяющейся двойною связью. Окисленіе диаллила въ диаллилмегилкарбиноль. Казань, 1879).
Эльтековъ далъ въ 1884 г. сводку своихъ выдающихся изслћдованій въ магистерской диссертаціи: Матеріалы по вопросу омолекулярныхъ перемћщеніяхъ между углеводородами ряда этилена и между предћльными спиртами (Харьковъ, 1884). Спеціально разобрана изомеризація бутиленовъ и амиленовъ (бромистыхъ изобутила и изоамила въ бромистые третичные бутиль и амилъ), т.-е. подчеркнуто значеніе симметричяой гругшировки и изучена температура изомеризаціи.
Вл. Ипатьевъ, съ 1901 г. по настоящее время, подходитъ новыми путями къ полученію, изомеризаціи и конденсаціи непредћльныхъ углеводородовъ; а именно, онъ работаетъ при высокихъ температурахъ и давленіяхь при помощи катализаторовъ. Такимъ образомъ, быль открытъ техническій способъ полученія въ присутствіи глинозема (при 380° этилена изъ этиловаго спирта (1902), пропилена изъ пропиловаго и изопропиловаго, изобутилена и бутилена изъ нормальнаго бутиловаго, амилена, т.-е. изопропиэтилена и метилэтилэтилена, изомеризующихся частью въ триметилэтиленъ — изъ амиловаго спирта броженія; реакція, слћдовательно, протекаетъ {500} почти количественно по уравненію: СnН2n+1ОН = СnНn2 + Н2O. Что циклическіе алкоголи въ присутствіи катализатора глинозема подвергаются (330°—370°) тому же распаду на воду и углеводороды, было доказано Ипатьевымъ; такъ, напримћръ, гексагидрофенолъ разлагается на тетрагидробензолъ, борнеолъ на камфенъ, ментолъ на нћсколько изомерныхъ ментеновъ. — При этихъ реакціяхъ ка талитическаго отщепленія воды протекаетъ еще каталитическая изомеризація образовавшихся углеводородовъ, напримћръ, изопропилэтилена въ триметилэтиленъ и vice versa: (СH3)2СН.СН:СН2  (СH3)2 С: СН(СН3). Такому же каталитическому изомерному превращенію подлежатъи циклическіе углеводороды; напримћръ, гемдиметилтриметиленъ Густавсона (1898) переходитъ въ присутствіи глинозема при 340° въ триметилэтиленъ:
(СH3)2 С: СН(СН3). Такому же каталитическому изомерному превращенію подлежатъи циклическіе углеводороды; напримћръ, гемдиметилтриметиленъ Густавсона (1898) переходитъ въ присутствіи глинозема при 340° въ триметилэтиленъ:
(СH3)2 С |
|
СH2 |
→ (СH3)2 С : СH(СH3). |
||
| |
|||||
СH2 |
Эта реакція Ипатьева подтверждаетъ наблюденія Танатара (1896—1902) объ изомеризаціи триметилена (катализаторъ — платиновая чернь) въ пропиленъ.
Упомянемъ еще, что А. Фаворскій впервые (1907) доказалъ изомеризацію бромистаго изопропила въ первичный бромистый пропилъ. Въ новћйшее время А. Лћпинъ изслћдовалъ изомеризацію при нагрћваніи углеводорода (СH3)3 С.СHBrC6H5.
А. Сабанћевъ (1873) далъ подробное „изслћдованіе о соединеніяхъ ацетилена” (диссертація), за которымъ послћдовали: приготовленіе дибромистаго ацетилена, 1876; полимеризація бромистаго винила, 1883/85; діаллилъ, 1887/90. Хлористый и бромистый винилъ были изучены Г. Глинскимъ (1872) въ ихъ отношеніи къ хлорноватистой и бромноватистой кислотамъ.
Оригинальныя изслћдованія въ области непредћльныхъ углеводородовъ принадлежатъ Мих. Гр. Кучерову (ученикъ А. Энгельгардта и Н. Соколова въ Птр. земледћльческомъ институтћ, гдћ съ 1872 г. былъ ассистентомъ у проф. П. Лачинова, а съ 1891 г., за смертью Лачинова, доцентомъ и затћмъ проф. химіи; умеръ въ 1911 г.). {501} Кучеровъ изучалъ бромистый винилъ СН2.СНBr (1875, 1881) съ точки зрћнія замћщаемости брома гидроксиломъ, а затћмъ перешелъ къ изслћдованію углеводородовъ ацетиленоваго ряда; въ 1881 г. онъ открылъ способъ гидратаціи послћднихъ (ацетилена, аллена, валерилена) въ присутствіи солей окиси ртути и выяснилъ (1883 г.) это дћйствіе солей ртути; въ кисломъ растворћ послћднія образуютъ сложныя соединенія, напримћръ, съ аллиленомъ С3H4, которыя съ кислотой даютъ ацетонъ, а въ щелочномъ растворћ образуется прямой продуктъ замћщенія, напримћръ, (C2H3)2Hg. Впослћдствіи Кучеровъ подвергнулъ дћйствію ртутныхъ солей также диаллилъ и углеводороды (и спирты) этиленоваго ряда, и въ этомъ случаћ образовались сложныя ртутныя соединенія (1892); что углеводороды RR1C=CH2 способны давать двойныя соединенія съ хлористымъ цинкомъ, показалъ въ 1893 г. И. Кондаковъ.
Бромистый винилъ былъ изученъ также М. Д. Львовымъ (проф. Птр. Техн. Инст., ум. 1899 г.), который изслћдовалъ его полимеризацію въ зависимости отъ растворителей и катализаторовъ, доказавъ, что въ этомъ случаћ имћетъ мћсто фотосинтезъ (1878, 1888. Ж. 10, 236, 12, 260).
Къ этому періоду относятся также наблюденія Г. Лагермарка и А. Эльтекова о дћйствіи сћрной кислоты на ацетиленъ (1877/79); при этомъ получился кротоновый альдегидъ, давшій кротоновую кислоту съточкой плавленія 72° (синтезъ ея изъ элементовъ). Лагермаркъ (1879) изслћдовалъ также аллиленъ С3H4. Эфирный растворъ аллилена очень легко реагируетъ съ металлическимъ натріемъ, образуя C3H3Na, при дћйствіи угольнаго ангидрида на аллиленънатрій образуется тетроловая кислота СН3С:ССООН (первый синтезъ). Подобнымъ же образомъ Лагермаркъ и Эльтековь получили въ 1879 г. изъ изопропилацетилена натріевое соединеніе, давшее съ СО2 новую кислоту, изосорбиновую С5H7СООН; изслћдованіе послћдней и синтезъ ея изомера, пропилацетиленкарболовой кислоты, былъ произведенъ Фаворскимъ въ 1888 г.
Вообще, вопросъ объ изомеризаціи непредћльныхъ ацетиленовыхъ и алленовыхъ углеводородовь былъ подробно и образцово разобранъ А. Е. Фаворскимъ и его школою. Еще въ 1887 г. Фаворскій установилъ, что углеводороды съ ацетиленовой связью при нагрћваніи со спиртовымъ ћдкимъ каліемь изомеризуются въ алленовые, а эти послћдніе, подь вліяніемь нагрћванія въ запаянныхъ трубкахъ съ натріемъ, переходятъ обратно въ однозамћщенные {502} ацетиленовые углеводороды; Фаворскій далъ обіцій методъ для полученія двузамћщенныхъ ацетиленовыхъ углеводородовъ (изъ замћщенныхъ аиетоуксусныхъ эфировъ получаются кетоны, а эти дћйствіемъ РСl5 превращаются въ дихлородериваты,— изъ послћднихъ. дћйствіемъ спиртовой шелочи отіцепляется хлористый водородъ); Фаворскій открылъ также реакцію съ мегаллическимъ натріемъ (натрійацетиленаты), даюіцую, иосредствомъ угольной кислоты, возможность перехода къ ацетиленкарбоновымъ кислотамъ. Далће Фаворскій, частью совмћстно съ К. И. Дебу, изучалъ реакиіи, характерныя для различныхъ классовъ углеводородовъ ряда СnН2n–2; въ связи съ этимъ было изслћдовано дћйствіе хлорноватистой кислоты на двузамћщенные ацетилены, даюіціе несимметричные α-дихлоркетоны, и алленовые углеводороды (ср. докт. диссерт.: Изслћдованіе изомерныхъ превращеній въ рядахь карбонильныхъ соединеній... Спб., 1895) и дћйствіе на нихъ спиртовой щелочи; впослћдствіи Фаворскій, при содћйствіи Ж. Іоцича, изучилъ дћйствіе пыли цинка и т. д. (1899).
Изомеризація циклическихъ непредћльныхъ углеводородовъ была изучена также Фаворскнмъ и И. Воргманомъ (метилен-циклогексанъ, 1907) и В. ЕгоровоП (циклогексилацетплень, 1911).
Въ новћйшее время изомерныя превращенія алленовыхъ углеводородовъ были изслћдованы Л. А. Кучеровымъ (1911), а равно С. В. Лебедевымь (1911); изъ несимметричнаго димегилаллена при нагрћваніи до 100 150° Лебедеву удалось получить 1) двадимера и одинъ тримеръ, какъ продукты полимеризаціи, и 2) изопренъ, какъ продуктъ изомеризаціи диметнлаллена. Начиная отсюда, столь интересный съ научной точки зрћнія вопросъ становится одновременно вопросомъ чрезвычайно важнымь для техники и культуры человћчества, — онъ переходитъ въ вопросъ о синтезћ каучука.
Въ исторіи синтеза каучука изслћдованія И. Кондакова (1901) хронологически занимаютъ первое мћсто. Этотъ учеиый впервые наблюдалъ, что диизопропенилъ (диметилъ-2-3-бутадіенъ-1-3) въ разсћянпомь свћтћ самопроизвольно полгімеризуется въ бћлую коллоидальную массу, одна часть которой растворяется въ алкоголћ, a другая, болће полимеризованная, — иерастворима, — „эта масса по своимъ свойствамъ напоминаеть каучукъ” (Journ. prakt. Ch. 62, 175, 1900, 64, 109, 1901). Первый гомолoгъ каучука, слћдовательно, былъ синтезированъ Кондаковымъ до открытія Гаррісса (Harries) (начиная {503} съ 1904 г.) и техническаго способа завода Bayer C° (1909 и слћд.). Открытіе Кондакова и практическое его значеніе были признаны еще въ 1902 и 1903 г. Веберомъ (С. О. Weber, Gummi-Zeitung, 1902, 207; 1903, 374).
Напомнимъ также, что уже Маріуца въ 1889 г. наблюдалъ полимеризацію открытаго имь диизопропенила, ближайшаго гомолога изопрена, въ присугствіи разбавленныхъ кислотъ, а Долецкій въ 1903 г. установилъ образованіе димерной формы того же углеводорода; Беркенгеймъ въ 1895 г. наблюдалъ полимеризацію пиперилена (α-метилбутадіена), а Мокіевскій въ 1898 г., изучая строеніе изопрена (β-метилбутадіена) и продукты присоединенія НСlО, НBrО, Br2 замћтилъ появленіе нерастворимой полимерной формы изопрена.
Изопрену, какь продукту сухой перегонки каучука, посвящены изслћдованія В. П. Гадзяцкаго (1886/8); онъ старался опредћлить строеніе изоирена и приютовиль спиртъ изъ монохлоргидрата изопрена1). Строенію изопрена посвятилъ цћнныя изслЬдованія В. Ипатьевъ. Онъ работаль надъ приіотовленіемъ новыхъ алленовыхъ углеводородовъ, вообще, искалъ такую реакцію, которая могла бы служить для ихъ характеристики; бромистый водородъ оказался пригоднымъ для установленія ихъ строенія (см. диссертацію: О дћйствіи брома на третичные спирты и бромистаго водорода на ацетиленовые и алленовые углеводороды. Спб. 1895). ДальнћйшІя изслћдованія Ипатьева касались изопрена, и ему удалось въ 1897 г. установить строеніе этого столь важнаго углеводорода и осуществить его синтезъ изомеризаціей гемдиметилаллена, посредствомъ присоединенія и отщепленія двухъ частицъ НBr; рядомъ съ реакціею присоединенія бромистаго водорода въ уксуснокисломъ растворћ и различнаго (для ацетиленовыхъ и алленовыхъ углеводородовъ) отношенія полученныхъ бромюровъ къ раствору поташа изучалось и дћйствіе сииртовой щелочи на послћдніе, а равно хлористаго нитрозила: были получены кристаллическіе хлороиитрозаты (см. монографію: Алленовые углеводороды, реакціи хлористаго нитрозила и нитрозаты. Спб. 1898).
Изслћдованія С. В. Лебедева являются блестящим ь экспериментальнымъ продолженіемь работъ А. С. Фаворскаго и его лабораторіи; въ частности они касаются 1) явленій и механизма полимеризаціи {504} двуэтиленовыхъ углеводородовъ въ зависимости отъ ихъ строенія и внћшнихъ условій и 2) продуктовъ этой полимеризаціи, ихъ строенія и отношенія къ природному каучуку. Напомнимъ, что уже Фаворскій установилъ въ 1891 г. склонность углеводородовъ ряда диаллила С=С—С—С—С=С изомеризоваться въ присутствіи спиртовой щелочи въ производныя дивинила С—С=С—С=С—С. Онъ же въ 1897 г., а равно В.Ипатьевъ въ 1898 г. указали на присущую алленовымъ углеводородамъ способность уплотняться выше 160°С. Лебедевъ, частью при содћйствіи Н. Скавронской и Б. Мережковскаго, производилъ свои систематическія изслћдованія, начиная съ 1908 г.; первыя сообщенія о нихъ относятся къ 1910 году и нашли свое подтвержденіе по вопросу о полимерахъ изопрена въ работахъ Гарріеса (1911). Имъ была изучена полимеризація 1) дивинила, полученнаго по способу О. Г. Филиппова (1910) изъ этиловаго эфира въ присутствіи металлическаго Аl, давшаго при 150° димеръ и полимеръ, озонидъ котораго былъ изслћдованъ, 2) диизопропенила, перешедшаго въ димеръ и полимеръ, 3) изопрена (димеръ и полимеръ); полученные результаты показали, что полимеръ изопрена имћетъ то же строеніе, что и природный каучукъ (1910). Далће были подвергнуты полимеризаціи: пипериленъ, диизокротилъ (добытый по способу Пржибытека въ 1888 г. изъ бромистаго изокротила), мирценъ, фенил-1-бутадіен-1-3, циклопентадіенъ; затћмъ углеводороды ряда аллена, представляющіе новый типъ полимеризаціи, какъ по чрезвычайной легкости послћдней, такъ и по строенію полимерныхъ формъ (принадлежащихъ къ производнымъ циклобутана) и числу таковыхъ: аллены даютъ непрерывный рядъ формъ отъ димера до гексамера, напримћръ, алленъ, полученный по способу Густавсона въ 1888 г. изъ трибромгидрина, давшій отъ димера (С3H5)2 до гексамера C18H24, несимметричный диметилалленъ, симметричный диметилалленъ и триметилалленъ. Лебедевъ предложилъ также методъ опредћленія скоростей полимеризаціи и примћнилъ его къ углеводородамъ ряда дивинилаи ряда аллена (1913). Б. Мережковскій дополнилъ циклъ изслћдованій Лебедева, изучивъ въ 1913 г. тетраметилалленъ, его полимеризацію и изомеризацію, а равно диэтилалленъ; онъ нашелъ, что въ гомологическомъ ряду алленовыхъ углеводородовъ скорость полимеризаціи при соотвћтственныхъ температурахъ растетъ съ увеличеніемъ массы замћстителя.
Изъ лабораторіи А. Фаворскаго вышла также важная серія экспериментальныхъ изслћдованій объ изомерномъ превращеніи {505} диметилаллена въ изопренъ, принадлежащая Л. М. Кучерову (1911; 1913). Для изомеризаціи Кучеровъ примћняетъ катализаторъ, а именно, галоидоводородную соль хинолина, предложенную А. Фаворскимъ и И. И. Боргманомъ въ 1906 г. Синтезъ изопрена по Ипатьеву, слћдовательно, упрощается; приготовленный по Ипатьеву изъ бромистаго триметилэтилена несимметричный гемдиметилалленъ превращается въ присутствіи упомянутаго катализатора нагрћваніемъ на 130—135° въ изопренъ, а эта реакція изомеризаціи — необратимая. Механизмъ реакціи выражается поэтому слћдующей вћроятной схемой съ образованіемъ промежуточнаго продукта:
(CH)2.С=С=СН2 + С9H7N.HX →
(диметилалленъ).
(CH3)2.СХ.СН=СН + C9H7N →
СН2=C(СН3).СН=CH2 + C9H7N.HX.
(изопренъ).
Почти одновременно съ упомянутыми изслћдованіями о синтезћ изопрена и каучука И. И. Остромысленскій произвелъ рядъ важныхъ изслћдованій о строеніи полимеризованнаго бромистаго винила и каучука (1911—1912). Онъ открылъ три изомерныя модификаціи полимеризованнаго бромистаго винила, легко превращающіяся одна въ другую; эта полимеризація происходитъ отъ дћйствія солнечнаго свћта (на мономеръ или α-каупренбромидъ), а въ мономеръ — при дћйствіи ультрафіолетовыхъ лучей. Онћ оказались идентичными съ бромидомъ простћйшаго бутадіенъ-каучука Гарріеса и представляютъ собой простћйшіе гомологи бромида естественнаго каучука. Регенерація каучука изъ каупренбромида и упомянутыхъ сейчасъ бромидовъ происходитъ при дћйствіи цинковой пыли на эти бромиды. Эти реакціи открыли путь техническаго синтеза каучука и его гомологовъ (Остромысленскій получилъ на свои открытія патенты), такъ какъ бромистый винилъ легко получить изъ этиловаго спирта, дающаго по методу Ипатьева этиленъ, который превращается въ дибромистый этилень, переходящій черезъ отщепленіе НBr въ бромистый винилъ. Равнымъ образомъ Остромысленскій далъ реакцію полученія бутадіена или дивинила или эритрена СН2.СН.СНСН2 изъ этиловаго спирта, который постепенно превращается въ ацеталдегидъ, алдолъ, гликолъ, а послћдній, по методу Ипатьева, — черезъ отщепленіе воды въ присутствіи Аl2O3, — переходитъ въ бутадіенъ СH2СНСНСН2. {506}
Дальнћйшее усовершенствованіе заключается въ увеличеніи выхода дивинила (эритрена), благодаря видоизмћненію способа Филиппова: изъ монохлорэтиловаго эфира черезъ отщепленіе НСl и Н2O при 350°, въ присутствіи Аl2О3 и ВаСl2, образуется дивинилъ (1914).
Прибавимъ, что успћшное техническое проведеніе этого метода открыло бы новые обширные горизонты для примћненія спирта и имћло бы, слћдовательно, чрезвычайно важное экономическое и государственное значеніе. Другими естественными исходньши матеріалами могутъ служить скипидаръ и погоны нефти.
Механизмъ вулканизаціи каучука изучался Б. Бызовымъ въ 1910 г., который разсматривалъ вулканизацію,— на основаніи коллоидальной природы каучука,— какъ простое явленіе адсорбціи.
Укажемь еще на слћдующіе литературные источники по каучуку:
И. Л. Кондаковъ, Синтетическій каучукъ, его гомологи и аналоги. Монографія, Юрьевъ, 1912.
И. Остромысленскій, Каучукъ и его аналоги. Москва, 1913.
Francis I. Pond, A Review of the pioneer work on synthesis of rubber, Journ. of the Americ. Chem. Soc. 36, 165—199 (1914); въ этой критической и экспериментальной статьћ авторъ даетъ объективную оцћнку заслугъ всћхъ піонеровъ въ области синтетическаго каучука.
И. Бызовъ, Синтетическій каучукъ. Журн. Р. Физ.Хим. Общ. 45, II, 17 — 33 (1913).
С. В. Лебедевъ, Изслћдоваыіе въ области полимеризаціи. Тамъ же подробныя историческія данныя объ оікрытіи дипентена при сухой перегонкћ каучука, изопрена изъ динентена и т. д. Ж. 45, 1249—1390 (1913).
С. В. Лебедевъ, Изслћдованіе въ области полимеризаціи двуэтиленовыхь углеводородовъ. Монографія. Спб., 1913, 168 стр.
Реакція окисленія непредћльныхъ углеводородовъ играла большую роль въ развитіи знанія этого класса соединеній. Первое предположеніе о механизмћ прямого окисленія олифиновъ было высказано Эльтековымъ (см. выше), предполагавшимъ по мћсту двойной связи присоединеніе одного атома кислорода (окись, альдегидъ или кетонъ) или двухъ атомовъ его (распадъ по мћсту двойной связи).
Такого же взгляда держался и A. M. Зайцевъ относительно окисленія олеиновой и элаидиновой кислоты въ диоксистеариновыя. Въ {507} 1888 г. Е. Е. Вагнеръ, независимо отъ уиомянутыхъ сейчасъ наблюденій, на основаніи собственныхъ открытій, показалъ въ общей формћ, что „способность окисляться путемъ присоединенія есть общее свойство всћхъ непредћльныхъ соединеній съ этиленными связями какъ съ открытой, такъ и съ замкнутой группировкой углероднаго ядра, безразлично, будетъ ли такая связь находиться въ самомъ ядрћ или въ боковой цћпи”; далће онъ предполагаетъ, что въ сущности таковъ же и механизмъ окисленія и соедиыеній съ алленовыми и ацетиленовыми связями; было, однако, показано, что триметиленъ, не заключающій многократной связи, не измћняется марганцовой солью, слћдовательно послћдній — нынћ общеупотребительный — окислитель можетъ служить для рћшенія вопроса о томъ, находятся ли въ данномъ соединеніи 1) шюгократныя связи вообще и 2) сколько ихъ именно. Одновременно послћдній реактивъ на многократныя связи былъ предложенъ А. Бэйеромъ. Механизмъ процесса окисленія получилъ новое освћщеыіе благодаря гипотезћ М. Д. Львова (1889), предполагавшаго, что самъ окислитель непосредственно и цћликомъ присоединяется къ окисляющемуся непредћльному соединенію. Е. Е. Вагнеръ въ 1895 г. указалъ порядокъ присоединенія окислителей (азотной кислоты, хлорноватистой кислоты, марганцовой соли) безъ помощи гипотезы Львова о перекисномъ строеніи окислигелей; онъ оставилъ также свою собственную первую гипотезу о промежуточномъ окислителћ.
Н. Кижнеръ носвятилъ вопросу объ очисткћ предћльныхъ углеводородовъ въ присутствіи неиредћльныхъ съ помощью марганцовокислаго калія цћнныя изслћдованія (1912/13); онъ доказалъ, что примћсь непредћльнаго углеводорода вліяетъ на степень устойчивости предћльнаго, т.-е. что и послбдній подлежить дћйствію окислителя, и что случай окисленія смћси обоихъ типовъ принадлежитъ къ типу сопряженныхъ реакцій. Подобное совмћстное окисленіе смћси предћльныхъ и непредћльныхъ углеводородовъ наблюдалъ также С. Наметкинъ въ 1913 г.
α-Окиси1) по взглядамъ А. Фаворскаго играюіъ роль при многихъ случаяхъ изомеризаціи; предполагалось, что при этомъ образовались хлорозамћіценныя, хотя ни одна изъ этихъ предполагаемыхъ {508} α-окисей не была получена. Поэтому К. Красускій предпринялъ „изслћдованіе изомерныхъ превращеній, совершающихся при участіи органическихъ окисей” (магист. дис. 1902, Спб.); ему удалось, дћйствительно, показать появленіе этихъ предполагаемыхъ органическихъ α-окисей, какъ промежуточныхъ продуктовъ при изомерныхъ превращеніяхъ; изучивъ реакцію присоединенія хлорноватистой кислоты къ этиленовымъ углеводородамъ (полученіе α-хлороспиртовъ), онъ установилъ, что гидроксильная группа присоединяется преимущественно къ наименће гидрогенизованному атому углерода. Хлористый водородъ присоединяется къ этимъ α-окисямъ преимущественно съ образованіемъ гидроксильной группы при наименће гидрогенизованномъ углеродћ, а образующіеся α-хлороспирты распадаются въ щелочной средћ обратно на хлористый водородъ и α-окиси, которыя изомеризуются въ альдегиды и кетоны.
Упомянемъ, что послћ того какъ Вюрцъ открылъ окись этилена, какъ новый типъ органическихъ гликолей окиси въ 1859 г., А. Эльтековъ въ 1882 г. впервые приготовилъ семь новыхъ окисей и изслћдоваль ихъ отношеніе къ водћ (образованіе гликолей).
Энергичныя реакціи α-окисей и аналогіи порядка присоединенія къ нимъ хлористаго водорода съ отношеніемъ хлористоводородной кислоты къ этиленовымъ углеводородамъ побудили К. Красускаго изслћдовать также дћйствіе амміака на α-окиси (докт. дис: Изслћдованіе реакцій амміака и аминовъ съ органическими окисями. Кіевъ, 1911). Результаты показали, что амміаки и амины дћйствительно присоединяются къ α-окисямъ съ образованіемъ гидроксильной группы преимущественно при наименће гидрогенизованномъ атомћ углерода; были также изучены получающіеся аминоспирты и механизмъ реакціи въ зависимости отъ различныхъ факторовъ.
Въ связи съ послћдними производными азота остановимся вообще на разборћ нћкоторыхъ выдающихся изслћдованій въ области азотистыхъ соединеній. Хронологически первыми являются выдающіяся работы Шишкова.
| {509} |
Въ Россіи научнымъ изслћдованіемъ взрывчатыхъ тћлъ впервые занимался Леонъ Николаевичъ Шишковъ. Л. Н. родился въ 1830 г. въ Рязанской губ., окончилъ въ 1851 г. Михайловскую Артиллерійскую Академію, работалъ въ Гейдельбергћ у Бунзена и въ Парижћ у Дюма; съ 1860 до 1865 г. состоялъ профессоромъ въ Михайловской Артиллерійской Академіи; выйдя въ отставку, занялся сельскимъ хозяйствомъ; умеръ въ 1908 г. Къ сожалћнію, научная и оригинальная дћягельность Шишкова продолжалась лишь недолгое время. Совмћстно съ Бунзеномъ1) онъ произвелъ классическое изслћдованіе о горћніи чернаго пороха въ 1857 г. и далъ теорію этого горћнія. Работа эта вышла на иностранныхъ языкахъ отдћльной монографіею, напримћръ, на французскомъ языкћ „Theorie chimique de la combustion de la poudre, par R. Bunsen et L. Schischkoff”. Paris, 1859.
Начиная съ 1855 г. Шишковъ всецћло отдался выясненію вопроса о строеніи гремучей кислоты (гремучаго серебра и ртути). Его изслћдованія были представлены въ Парижской Академіи Наукъ: какъ его великій предшественникъ Либихъ работою на ту же тему и въ той же Академіи въ 1823 г., двадцати лћтъ отъ роду, сразу обратилъ на себя всеобщее вниманіе ученаго міра, такъ и Шишковъ, тоже еще молодой, сразу сдћлался извћстнымъ послћ этой работы о строеніи гремучей и фульминуровой кислотъ (1857); это — первая вообще русская химическая работа, доложенная во французской Академіи Наукъ. При изслћдованіи продуктовъ разложенія этихъ кислотъ Шишковъ2) открываетъ новыя нитро-соединенія: напримћръ нитроформъ CH(NO2)3 въ 1857 г. и тетранитрометанъ въ 1857 г. Формула строенія гремучей кислоты C4N4H4O4 или гремучей ртути {510} CN2Hg.C2Hg(NO2)2 какъ ціанистаго и нитросоединенія, защищалась имъ еще въ 1884 г. противъ Кекуле.
Но ни одна изъ нихъ не оказалась вћрною, такъ какъ нынћ, по новћйшимъ изслћдованіямъ, для гремучей кислоты приыята формула CNOH. Для натріевой соли Л. Вёлеръ въ 1905 г. доказалъ кріоскопическимъ способомъ и посредствомъ электропроводности, согласно правилу Оствальдъ-Вальдена, формулу CNONa.
Сорокъ лћтъ назадъ вопросъ о строеніи амидовь и имидовь кислотъ, въ частности моно- и диимидовъ (напримћръ парабановой, ди-аллуровой, мочевой кислоты), еще не былъ рћшенъ и представлялъ выдающійся научный интересъ какъ для органической, такъ и для физіологической химіи. Лишь позже Э. Фишеру (1895—1897) удался полный синтезъ мочевой кислоты. Въ связи съ этимь вопросомь находятся изслћдованія Якубовича, Пономарева и Н. Меншуткина. Н. К. Якубовичъ1) осуществилъ синтезъ гиппуровой кислоты изъ бензамида и хлоруксусной кислоты (1867) и изучилъ „амиды кислотъ гликолеваго порядка” (1867). Н. А. Меншуткинъ2) посвятилъ много {511} экспериментальныхъ работъ изученію амидокислоть, амидовъ и имидовъ кислотъ (напримћръ, янтарной), классификаціи уреидовъ (1869), парабоновой, оксалуровой, диаллуровой, диметилпарабановой, тартрон-аминовой и др. кислотъ, приготовилъ соли и эфиры послћднихь (1868—1876). Интересъ къ изслћдованію этой сложной группы азотистыхъ соединеній сказывается въ обћихъ пробныхъ лекціяхъ Н. А., прочитанныхъ имъ въ 1866 г., а именно: „Ціанистыя органическія соединенія”, и „О соединеыіяхъ мочевой кислоты”. Первую сводку своихъ собственныхъ изслћдованій Н. А. представилъ въ своей докторской диссертаціи: „Синтезъ и свойства уреидовъ. Спб. 1869”.
Къ числу вопросовъ, не рћшенныхъ Н. А., относится строеніе парабановой кислоты. Синтезъ послћдней былъ впервые произведенъ И. М. Пономаревымъ1) въ 1872 г., посредствомь щавелевой кислоты и мочевины въ присутствіи РСl3. И. М. и впослћдствіи занимался разработкою вопросовь, связанныхъ съ производными группы мочевой кислоты (1879), тіомочевины и псевдо- и пер-сульфоціана (1874-6), ціануровой кислоты и ея эфировъ (1887), уроксановой кислоты и алантоина (1895).
Отношеніе алкиленовъ къ окисямь азота (напр. N2O3, NO2) и образующіеся нитрозиты составили предметь изслћдованій Семенова (1864), В. Ипатьева (1898—1901), Н. Демьянова (1899), К. Сидоренко (1899, 1913). И. Егоровъ изслћдовалъ дћйствіе этихъ окисловъ на непредћльныя кислоты, a M. Коноваловъ создалъ мегодъ нитрованія предћльныхъ кислотъ слабой азотной кислотой.
Семеновъ въ 1864 г. впервые получилъ при этомъ воздћйствіи окисловъ N2O3 и NO2 на этиленъ рядомъ съ жидкимъ и кристаллическій продуктъ. Демьяновъ позднве изучалъту же реакцію по отношенію къ этилену, бутилеиу, псевдобутилену, тетраметилэтилену, а Сидоренко къ изобутчлену (Н. Я. Демьяновъ: О дћйствіи азотнаго ангидрида и азотноватой окиси на этиленовые углеводороды и т. д. Москва, 1899). Демьяновъ впервые получиль кристаллическій нитрозитъ С5H8N2O3 винилтриметилена (1908), а Сидоренко снова удалось (1913) получить кристаллическій этиленнитрозитъ C2H4N2O3 Семенова. Ипатьевъ подробно изучилъ взаимодћйствіе окисловъ азота съ гексиленами и другими непредћльными соедиыеніями и выдћлилъ цћлый рядъ нигрозитовь и ихъ производныхъ (см. выше). {512}
Н. Я. Демьяновъ также санимался изслћдованіемъ дћйствій азотистой кислоты на три-, тетра- и пента-метилендіаминъ; дћйствіемъ азотистой кислоты, напримћръ, на триметилендіаминъ получены амиловый спиртъ и β-пропиленгликоль1) (магист. дис., Москва, 1895).
Впослћдствіи И. В. Егоровъ распространяетъ эту реакцію съ азотноватой окисью на вещества, имћющія въ частицћ еще карбоксильную группу, т.-е. на непредћльныя кислоты, напримћръ, акриловую, кротоновую и ея стереомеръ; метакриловую, олеиновую и стереоизомерную элаидиновую2), аллилуксусную. Изъ кислотъ ряда СnH2n–2O2, дћйствіемъ азотноватой окиси, первымъ продуктомъ является СnH2n–2O2(ONO)(NO2), a порядокъ присоединенія группъ ONO и NO2 оказался одинаковымъ съ присоединеніемъ іодистаго водорода (іодъ — NO2, а на мћсто водорода — ONO) (см. магист. диссерт.: О дћйствіи азотноватой окиси на непредћльныя кислоты ряда СН2n–2O2. Москва, 1903).
Дальнћйшая разработка (начиная съ 1904 г.) этихъ продуктовъ привела Егорова къ открытію новаго метода опредћленія мћста двойной связи въ непредћльныхъ соединеніяхъ: при дћйствіи крћпкой соляной кислоты упомянутые продукты присоединенія азотноватой окиси распадаются по мћсту двойной связи въ исходной непредћльной кислотћ; при этомъ распаденіе даетъ нитро-углеводороды и жирную кислоту (И. В. Егоровъ: О методахъ окисленія въ примћненіи къ опредћленію строенія непредћльныхъ соединеній, Кіевъ, 1911).
И. Бевадь занимался добываніемъ и изслћдованіемъ вторичныхъ и третичныхъ нитросоединеній3) жирнаго ряда и осуществилъ {513} переходъ отъ первичныхъ нитросоединеній черезъ ихъ моногалоидо-производныя къ вторичнымъ, посредствомъ цинкорганическихъ соединеній; беря галоидопроизводное вторичнаго нитросоединенія или двугалоидопроизводное первичнаго, Бевадъ превратилъ ихъ въ третичное нитротћло (1889—1891-2).
И. Бевадъ разъяснилъ также реакціи взаимодћйствія азотистыхъ эфировъ и нитропараффиновъ съ цинкалкилами (диссерт. Варш., 1899); при реакціи первичныхъ и вторичныхъ нитропараффиновъ съ цинкалкилами образуются β-двузамћщенные гидроксиламины, при этомъ NO2-группа изомеризуется въ изонитрогруппу NOOH, и есть возможность уловить нћкоторыя промежуточныя фазы этой сложной реакціи.
Въ области нитросоединеній высокое значеніе имћютъ работы М. Коновалова.
Мих. Ив. Коноваловъ1) (род. въ 1858 г.; въ 1896 г. назначенъ проф. Моск. Сельско-Хоз. Института, а въ 1899 г. перешелъ въ Кіевскій Политехн. Инст.; ум. въ 1896 г.) началъ свою научную дћятельность подъ руководствомъ В. В. Марковникова.
Его первые труды посвящены изслћдованію углеводородовъ нефти (нафтеновъ), нононафтена С9H18 и его производныхъ (1887—1891). Изучая дћйствіе различныхъ реактивовъ на нононафтенъ, М. И. сдћлалъ наблюденіе, послужившее исходной точкою для весьма важнаго открытія, разработкћ котораго и посвящена была вся плодо творная дћятельность М. И. (съ 1892 до 1906 г.): это — дћйствіе азотной кислоты на параффины. Въ противоположность господствовавшему въ химической наукћ мнћнію, слабая азотная кислота способна непосредственно нитровать всћ углеводороды предћльнаго характера (1892); она нитруетъ параффины, напримћръ, гексанъ, гептанъ, октанъ, гексагидробензолы (1895), жирныя цћпи ароматическихъ углеводородовъ (1895) (см. его диссерт.: Нитрующее дћйствіе азотной кислоты на углеводороды предћльнаго характера. Москва, 1893). Наряду съ приложеніемъ своего метода къ различнымъ классамъ органическихъ тћлъ, М. И. изучалъ съ химической и физической сторонъ открытые имъ нитропродукты; возстановленіе послћднихъ дало новый методъ полученія оксимовъ, а равно аминовъ, и методъ превращенія {514} нитросоединеній въ альдегиды и кетоны и т. д. (1898), а физическое изученіе дало матеріалы относительно свћтопреломляющей способности азотистыхъ соединеній (1895). Вмћстћ съ В. Плотниковымъ М. И. Коноваловъ описалъ новый классъ комплексныхъ соединеній, состоящихъ изъ галоидныхъ соединеній алюминія и сћрнистыхь соединеній (18989). Прибавимъ, что нитрованіе по методу Коновалова продолжаетъ С. С. Наметкинъ (съ 1908 г.), а соединенія, напримћръ, бромистаго алюминія съ бромомъ и сћроуглеродомъ изучалъ съ электрохимической точки зрћнія В. Плотниковъ (съ 1901 г.).
Хлористый нитрозилъ служиль главнымъ реактивомъ при изслћдованіяхъ В. А. Солонины: „О замћщеніи амидогруппы галоидовъ въ первичныхъ аминахъ”... (Москва, 1898), относящихся къ 15 моноаминамъ и содержащихъ также результаты взаимодћйствій различныхъ двубромозамћщенныхъ предћльныхъ углеводородовъ на фенолятъ натрія. Послћдняя реакція протекаетъ различно, въ строгой зависимости отъ строенія взятыхъ феноловъ. Вслћдствіе этого Солонина распространяетъ свои изслћдованія и на другіе классы соединеній, а именно на амины. Сводка этихъ трудовъ дана въ его монографіи: „О дћйствіи вторичныхъ аминовъ на дибромиды предћльныхъ углеводородовъ” (Варшава, 1907); здћсьтоже оказалось, что строеніе характернымъ образомъ вліяетъ на ходъ и продукты реакціи.
Надъ полученіемъ жирныхъ аминовъ1) съ третичнымъ радикаломъ работалъ (1879) В. М. Рудневъ въ лабораторіи А. Бутлерова; Рудневъ изслћдовалъ вновь амины (CH3)3C(NH2), (CH3)2(C2H5)C(NH2) (послћдній былъ полученъ А. Вышнеградскимъ въ 1874 г.), затћмъ дибутиламинъ, бутиламиламинъ и выдћлилъ впервые третичное бутиловое и третичное амиловое горчичное масло (маг. диссерт.: Объ амидныхъ соединеніяхъ третичныхъ углеводородныхъ радикаловъ 1879).
Ціанъ вмћстћ съ амміакомъ служили уже Н. Н. Любавину (1881) для разъясненія реакціи Штреккера — синтеза глициновъ изъ альдегидовъ. Любавинъ впервые ввелъ въ употребленіе дћйствіе ціанистаго аммонія на альдегиды и получилъ такимъ образомъ α-амидокислоты, изъ ацетальдегида — аланинъ, изъ валеріановаго — лейцинъ. {515}
В. Гулевичъ и Ќ. Васмусъ примћнили эту реакцію (1906) къ кетонамъ предћльнаго ряда, а Явеловъ къ кетонамъ алифатическижирнаго ряда съ цћлью приготовленія нитриловъ амидокислотъ. Н. Зелинскій и Стадниковъ (1906) упростили эту реакцію, замћиивъ ядовитый ціанистый аммоній хлористымъ аммоніемъ и ціанистымъ каліемъ, и создали удобный методъ добыванія амидокислотъ (α-аминокислотъ). Стадниковъ (1907 г.), объяснилъ механизмъ этой реакціи.
Интересный способъ приготовленія нитриловъ жирнаго ряда открылъ А. Арбузовъ (1913); имъ было установлено, что гидразоны альдегидовъ съ большими жирными радикалами даютъ при каталитическомъ разложеніи, напримћръ, въ присутствіи CuCl, PtCl2, ZnCl2, почти исключительно нитрильный типъ (вмћсто образованія замћщенныхъ индоловъ). На другой путь полученія нитриловъ жирнаго ряда съ малыми радикалами, а равно роданидовъ и нитросоединеній указалъ П. Вальденъ (1907), примћнивъ обмћнную реакцію между эфирами сћрной кислоты и водными растворами ціанистыхъ, роданистыхъ и азотистокислыхъ солей.
По вопросу о строеніи изонитросоединеній работалъ С. Наметкинъ, пришедшій къ заключенію (1913), что формула Михаэла-Нефа 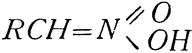 вполнћ удовлетворительно объясняетъ всћ превращенія изонитротћлъ. Уже М. И. Коноваловъ открылъ (1898) способъ перехода изонитросоединеній (въ моментъ ихъ выдћленія) посредствомъ возстановленія хлористымъ оловомъ въ кетоны. С. Наметкинъ показалъ, однако, что тотъ же лереходъ осуществимъ и посредствомъ окисленія хамелеономъ (1913).
вполнћ удовлетворительно объясняетъ всћ превращенія изонитротћлъ. Уже М. И. Коноваловъ открылъ (1898) способъ перехода изонитросоединеній (въ моментъ ихъ выдћленія) посредствомъ возстановленія хлористымъ оловомъ въ кетоны. С. Наметкинъ показалъ, однако, что тотъ же лереходъ осуществимъ и посредствомъ окисленія хамелеономъ (1913).
Теорія бензола, созданная въ 1865 г. геніемъ 36лћтняго А. Кекуле, составила новую эпоху въ изслћдованіи ароматическихъ соединеній; бензольное кольцо оказалось магическимъ кольцомъ, посредствомъ котораго чисто научная и техническая органическая химія пріобрћли непредвидћнное развитіе и экономическое значеніе.
Однимъ изъ виднћйшихъ работниковъ въ области изученія {516} бензола и его гомологовъ является Ф. Ф. Бейльштейнъ. Въ числћ тћхъ друзей Кекуле и приверженцевъ его теоріи, благодаря трудамъ которыхъ послћдовала быстрая и широкая провћрка теоріи бензола и блестящее ея подтвержденіе, Бейльштейнъ занимаетъ, какъ неутомимый экспериментаторъ, одно изъ первыхъ мћстъ. Плодотворная новая идея не всегда встрћчаетъ въ химіи тотчасъ же поклонниковъ и защитниковъ; вспомнимъ хотя бы другую великую идею,— асимметрическій углеродъ Вантъ-Гоффа (1874), идею, первоначально встрћченную съ ироніей!
Ф. Ф. Бейльштейнъ1) родился въ 1838 г. въ Петроградћ; 15ти лћтъ (1853) онъ поступилъ въ Гейдельбергскій университетъ и работалъ у Бунзена, а въ 1855 г. у Либиха въ Мюнхенћ, гдћ закончилъ у извћстнаго физика Жолли (Jolly) свою первую научную работу „о диффузіи жидкостей” (1856). Пробывъ отъ 1856 до 1857 года снова въ Гейдельбергћ, гдћ онъ познакомился съ молодымъ Кекуле, Бейльштейнъ перећхалъ въ Геттингенскій университетъ къ Вёлеру; здћсь онъ закончилъ свое изслћдованіе о мурексидћ и пріобрћлъ (1858) докторскую степень. Перећхавъ въ Парижъ (1858-9), онъ занимался у Вюрца; ноуже въ 1859 г. мы его встрћчаемъ въ Бреславлћ въ качествћ ассистента, а въ 1860 г. опять въ Гёттингенћ, гдћ онъ состоялъ ассистентомъ Вёлера; въ 1865 году Бейльштейнъ былъ назначенъ экстраординарнымъ профессоромъ и съ этого года вмћстћ съ Фиттигомъ издавалъ „Zeitschrift fur Chemie”. Ho уже въ 1866 г. онъ оставилъ службу въ Гёттингенскомъ университетћ и принялъ предложенную ему профессуру въ Петроградскомъ Технологическомъ Институтћ. Эту должность Бейльштейнъ въ 1896 г. передалъ М. Львову и перешелъ въ Академію Наукъ,— еще въ 1886 г., онъ былъ назначенъ ординарнымъ академикомъ на мћсто Зинина. Умеръ Ф. Ф. Бейлыитейнъ въ 1906 г.
Изъ многочисленныхъ экспериментальныхъ изслћдованій Бейльштейна въ области ароматическихъ соединеній укажемъ на слћдующія:
1864. Олово и соляная кислота, какъ общій возстановитель нитрогруппъ въ амидогруппы (А. 130, 242).
1865. Полученіе амидокоричной кислоты изъ нитрокоричной и Sn+HCl (Z. 1865, 1).
1865. Вальфорсъ (по предложенію Бейльштейна) получаетъ бромированіемъ нафталина чистый α-бромнафталинъ (ibid.). {517}
1866. Открытіе хода хлорированія толуола, въ зависимости отъ температуры: при повышенной температурћ хлоръ замћщаетъ водородъ въ боковой цћпи, при болће низкой температурћ (или, въ присутствіи малаго количества іода, при повышенной температурћ) — въ бензольномъ ядрћ. Это открытіе привело къ широкому техническому приготовленію производныхъ толуола С6Н5СН2Сl, С6Н5СНСl2 и С6Н5ССl3, на которыхъ основана фабрикація бензойнаго альдегида и бензойной кислоты (Z. 1866, 18).
1867. Одинаково идетъ замћщеніе водорода бромомъ въ толуолћ (А. 143, 369).
1867—1873. (Вмћстћ съ А. Кульбергомъ) полученіе и изслћдованіе изомерныхъ хлорозамћщенныхъ толуола, нитро- и амидо-толуоловъ.
1870. Впервые полученъ мета-, а въ 1871 г. орто-толуидинъ изъ соотвћтственныхь нитропродуктовъ (А. 156, 66; 158, 335).
1872. Совмћстно съ А. Кульбергомъ (А. 163, 121) впервые получена ортонитрокоричная кислота (раствореніемъ коричной кислоты въ HNO3) и ортонитробензойная кислота (окисленіемъ предыдущей посредствомъ хромовой смћси); послћдняя возстановленіемъ была превращена въ о-амидобензойную кислоту, т.-е. въ антраниловую кислоту, открытую въ 1841 г. академикомъ Фрицше изъ индиго. Всћ эти кислоты пріобрћли болыіюе значеніе, такъ какъ онћ вскорћ были примћнены А. Байеромъ для синтеза синяго индиго.
1875. Бейльштейнъ и Курбатовъ вводятъ SbCl5, какъ проводникъ хлора при хлорированіи ароматическихъ соединеній, a въ 1876 г. вводятъ для той же цћли SbCl3; въ 1875 г. они предлагаютъ для хлорированія растворъ бћлильной извести (А. 179, 284; 182, 102).
1875—1880. (Вмћстћ съ А. Курбатовымь) изслћдованіе генетической связи между двузамћщенными бензола, какъ хлорнитро-, хлорамидо-, динитробензолы, хлорфенолы и т. д.; впервые получены: ди-, три- и тетрахлорбензолы; полученіе 12 хлорозамћщенныхъ бензола послћдовательнымъ замћщеніемъ водородовъ бензола хлоромъ (Bed. Ber. 13, 1818, 2028; 14, 1626).
1880—1881. (Вмћстћ съ А. Курбатовымъ) изслћдованіе Кавказской нефти; открытіе въ ней углеводородовъ состава СnН2n насыщэннаго характера, идентичныхъ съ гидрогенизованными ароматическими углеводородами Ф. Вредена (1876 г.). {518}
Въ связи съ работами Бейльштейна или изъ его школы появились еще другія изслћдованія ароматическихъ соединеній; укажемъ на работы А. Вальфорса (ретенъ, 1868; галоидопроизводныя бензола и толуола и др.), В. Рихтера (начиная съ 1869 г.), Н. Тавилдарова (производныя ксилола, диссертація 1871), Вл. М. Руднева (динитроанилинъ; изомерныя сульфокоричныя кислоты, 1873 г.) и въ особенности Э. Вроблевскаго (магист. диссер.: Синтезъ бромопроизводныхъ толуола. Спб. 1872). Послћдній ученый изслћдовалъ толуолъ и его производныя, а равно ксилолы; его работы способствовали выясненію строенія производныхъ бензола, такъ какъ ему удалось доказать, что всћ атомы водорода въ бензолћ тождественны, и что каждому водороду соотвћтствуютъ двћ пары другихъ симметрично связанныхъ атомовъ водорода (1873—1878). Экспериментальныя данныя, полученныя Вроблевскимъ, вполнћ соотвћтствовали формулћ Кекуле, но обнаружили противорћчія въ примћненіи призматической формулы Ладенбурга (1883).
Къ тому же періоду относятся также изслћдованія А. Энгельгардта и П. А. Лачинова, столь внезапно оборвавшіяся въ 1870 г., вслћдствіе внћшнихъ обстоягельствъ; ими были получены новыя производныя тимола, виервые изслћдованы всћ три крезола (1869) и тіо- и дитіобензойная кислоты (1868); они изслћдовали хлоронитропроизводныя бензола и впервые показали, что присутствіе нитрогруппы рядомъ съ хлоромъ въ бензолћ сутественно уменьшаетъ прочность соединенія хлора: хлоръ, какъ оказывается, легко замћщается группою НО, 1870; ими была приготовлена дифенилсульфокислота и ея соли и т. д. (1871).
Г. Г. Густавсонъ наблюдалъ въ 1877 г., что въ присутствіи бромистаго алюминія бромъ замћщаетъ всћ водороды въ бензольномъ ядрћ, давая, напримћръ, съ бензоломъ C6Br6, съ толуоломъ — С6Br5.СН3. Каталитическое дћйствіе бромистаго алюминія, слћдовательно, представляетъ новый методъ бромированія ароматическихъ углеводородовъ. Съ цћлью объяснить причину этого дћйствія бромистаго алюминія, а равно и хлористаго, Густавсонъ изолировалъ двойныя соединенія его съ углеводородами, напримћръ Аl2Br6.6С6H6, или Аl2Br6.6С6H5CH3; такого же типа продукты присоединенія даетъ Аl2Сl6 (1878); однако, съ другими углеводородами получаются другіе типы, напр., Аl2Сl6.С6Н3(С2Н5)3. Густавсонъ показалъ, что подобныя соединенія могутъ образоваться и при реакціи Фридель-Крафтса, что они могутъ присоединять еще новыя {519} количества углеводородовъ, а равно и хлористаго водорода, разлагающіяся отъ воды и при нагрћваніи1); поэтому онъ отвергаетъ взглядъ этихъ двухъ французскихъ ученыхъ (1877-8) на механизмъ реакцій въ присутствіи Аl2Сl6 и Al2Br6, — взглядъ, основанный на чисто гипотетическомъ принятіи существованія соединеній, напримћръ, Аl2Br5.С6Н5. Идея о ферментативномъ дћйствіи соединеній хлористаго и бромистаго алюминія была подробно разработана Густавсономъ въ новћйшее время (1903-5).
Вообще въ изученіи циклическихъ соединеній русскіе химики принимали выдаюіцееся участіе. Приведемъ изслћдованія В. Гемиліана, впервые получившаго (1874) трифенилкарбинолъ окисленіемъ трифенилметана хромовой смћсью и трифенилметанхлоридъ дћйствіемъ РСl5 на (С6Н5)3СОН, а равно производныя его, и дифенилтолил- и дифенилксилилметаны и др. (см. его магист. диссерт.: О нћкоторыхъ производныхъ, гомологахъ и аналогахъ трифенилметана. Спб., 1886).
В. Н. Редзко представилъ цћнные экспериментальные матеріалы по вопросу объ изостильбенћ, доказавъ его строеніе, какъ несимметрическаго дифенилэтилена (188994). Надъ строеніемъ гидропипериновыхъ кислотъ работалъ К. Регель (1890).
Примћнивъ открытый С. Н. Реформатскимъ (1890) методъ полученія β-оксикислотъ къ ароматическимъ соединеніямъ, Г. Даинъ (1897) дћйствіемъ цинка и α-бромоэфировъ предћльныхъ монокарбоновыхъ кислотъ на бензойный альдегидъ получилъ рядъ вторичныхъ ароматическихъ β-оксикислотъ, выдћливъ также промежуточные продукты этой реакціи. Та же новая реакція была примћнена еще въ лабораторіи С. Реформатскаго къ другимъ ароматическимъ альдегидамъ (напр., пипероналу, коричному альдегиду, салициловому, анисовому и др., — см. Сборникъ работъ лабораторіи органической химіи Унив. Св. Влад., Кіевъ 1907).
Спирты съ циклическими радикалами были получены въ лабораторіи С. Реформатскаго, напримћръ, дћйствіемъ магнія на бромистый аллилъ и бензоинъ (В. Якубовичъ, 1912) или фталевый ангидридъ (А. Орловъ, 1912).
М. Ненцкій далъ (1897) новый способъ полученія оксикетоновъ и кетоновъ конденсаціей, посредствомъ FeCl3 хлоридовъ жирныхъ кислотъ съ фенолами. {520}
Изслћдованія въ тіофеновомъ ряду были произведены Н. Д. Зелинскимъ (1889), изучившимъ изомерныя карбоновыя кислоты и алкилпроизводныя тіофена (маг. диссер.: Къ вопросу объ изомеріи въ тіофеновомъ ряду. Одесса, 1889). Посредствомъ магній-іодтіофена Е. Гришкевичъ-Трохимовскій (1911) синтезировалъ α-аллилтіофенъ и α-тіофенальдегидъ.
Къ особой и еще не выясненной группћ гидроароматическихъ (или терпеновыхъ) соединеній принадлежатъ столь важныя съ физіологической точки зрћнія тћла, какъ холестеринъ и кислоты желчи. Въ этой темной области химіи работалъ П. А. Лачиновъ1), посвятившій много энергіи выдћленію и изученію строенія этихъ продуктовъ (1877—1887); окисленіемъ холестерина онъ получилъ нейтральный тріоксихолестеринъ, далће: моно-, ді- и тріоксихолестеновую кислоту; изъ холевой и холеиновой кислоты также былъ полученъ длинный рядъ новыхъ кислотъ, — всћ онћ до сихъ поръ еще нуждаются въ дальнћйшемъ научномъ изслћдованіи.
Изученію гидрогенизованнаго бензола и нафталина были посвящены труды преждевременно умершаго Ф. Вредена2) (докт. диссер.: О гидрогенизаціи монобензоловыхъ углеводородовъ и продуктахъ гидрогенизаціи и строеніи нафталина. Спб. 1876), впервые получившаго при нагрћваніи, напримћръ, нафталина съ HJ и Р, нафталингекса-, окто- и декагидридъ Cl0H14, C10Hl6 и С10H18 (1876), а равно: гексагидро-бензолъ, -толуолъ, -изоксилолъ (1877). Такимъ образомъ, Вреденъ впервые доказалъ переходъ бензоловъ въ циклическіе параффины. Лишь Н. Кижнеру удалось (1894-7) доказать, что такъ называемый гексагидробензолъ Вредена не есть циклогексанъ, а метилциклопентанъ. Что и другіе бензольные углеводороды изомеризуются при гидрированіи въ производныя циклопентана, показалъ также В. Марковниковъ, a H. Зелинскій прямымъ путемъ доказалъ превращеніе (въ присутствіи HJ при высокой температурћ) циклогексанола въ метилциклопентанъ (1895-7) и метилциклогексана въ диметилциклопентанъ.
Къ подобнымъ же результатамъ пришелъ О. Асканъ (1902), превратившій циклогексанъ въ метилциклопентанъ. {521}
Цћнный методъ гидрогенизаціи, приложимый къ ароматическимъ соединеніямъ (углеводородамъ, нитриламъ, аминамъ), былъ впервые предложенъ Вышнеградскимъ (1880), а именно дћйствіе металлическаго натрія въ абсолютномъ алкоголћ. Впослћдствіи Ладенбургъ (въ 1884 г.) разработалъ этотъ методъ и далъ ему свое имя, тогда какъ А. Байеръ изобрћтеніе того же метода приписываетъ себћ.
Для окончательнаго выясненія этого вопроса приведемъ слћдующія историческія справки.
А. Байеръ (Berl. Ber. 12, 459, 1879) впервые примћнилъ дћйствіе натрія въ спиртћ для замћщенія хлора водородомъ, a именно для превращенія хлороксиндолхлорида въ индолъ; при этомъ однако, онъ не выдћлилъ чистаго продукта. A. H. Вышнеградскій, изучая продукты распада цинхонина, въ томъ числћ хино лина, подвергнулъ хинолинъ дћйсгвію возстановителей (Ж. 11, 186, 1879); на VI съћздћ естествоиспытателей и врачей, 27го декабря 1879 г., онъ сдћлалъ докладъ (Ж., 12, II, 16, 1889) о своемъ „изслћдованіи надъ возстановленіемъ хинолина и этилпиридина”. Наилучшіе результаты съ хинолиномъ даетъ Sn съ НСl при кипяченіи, a для возстановленія этилпиридина былъ употребленъ металлическій натрій и спиртъ; полученный продуктъ — гексагидроэтилпиридинъ. Въ 1880 г. въ Bed. Ber. 13, 2401, Е. Е. Вагнеръ далъ рефератъ объ этомъ съћздћ и о сообщеніи Вышнеградскаго. Наконецъ, въ 1884 г., А. Ладенбургъ (Berl. Ber. 17, 154. 1884), производя синтезъ гомологовъ пиридина, предпринялъ возстановленіе пиридина въ пиперидинъ, при чемъ олово и соляная кислота оказались непригодными; „наконецъ, я нашелъ, что дћйствіемъ натрія на спиртовый растворъ пиридина послћдній, хотя только въ малой долћ, можетъ быть превращенъ въ пиперидинъ”. Вотъ и все.
Въ примћчаніи къ этому краткому сообщенію говорится: „Вышнеградскій превратилъ подобнымъ же образомъ этилпиперидинъ въ этилпиридинъ, а Вальденъ—въ гексагидропроизводное”. Черезъ мћсяцъ А. Ладенбургъ (Berl. Ber. 17, 388, 1884) сообщаетъ, что благодаря маленькому видоизмћненію этого метода, ему удалось достигнуть количественнаго выхода гидрогенизованныхъ продуктовъ пиридина и его гомологовъ; — въ прямой методъ дћйствія натрія въ спиртћ, однако, никакихъ измћненій имъ не было внесено, а лишь въ обработкћ продуктовъ возстановленія. Много лћтъ спустя, А. Байеръ, по поводу юбилея синтетическаго полученія индиго, {522} приписалъ этотъ методъ себћ (Веrl. Веr., 33 приложеніе, 1900); на это Ладенбургъ возразилъ (Berl. Веr. 34, 200, 1901), что способъ возстановленія посредствомъ натрія въ спиртћ разработанъ имъ.
Историческая справедливость требуетъ, однако, чтобы имя Вышнеградскаго, впервые предложившаго этотъ способъ и успћшно примћнившаго таковой, было связано съ именемъ того, кто за нимъ, въ той же группћ соединеній, сначала даже не вполнћ удачно, сталъ примћнять способъ гидрированія натріемъ въ спиртћ, опираясь на указанія своего предшественника. Этотъ способъ не можетъ быть названъ способомъ Ладенбурга, а лишь способомъ Вышнеградскаго — Ладенбурга.
Важными и новыми каталитическими способами гидрогенизаціи характеризуются изслћдованія Вл. Ипатьева (1907) о дћйствіи окисловъ никкеля, при давленіи до 120 атмосферъ и въ присутствіи сухого водорода, на бензолъ, дифенилъ, нафталинъ, дибензилъ, нафтолы, бензофенонъ, антраценъ, анилинъ, пиридинъ, хинолинъ и т. д., давшіе гексагидробензолъ С6H12, дициклогексилъ (С6Н11)2, декагидронафталинъ С10Н18, дициклогексилэтанъ (С6Н11СН2)2, декагидронафтолы С10Н17ОН, дифенилметанъ С6Н5СН2С6Н5, гидроантраценъ С14Н24, гидроанилинъ, гидропиридинъ и гидрохинолинъ.
Примћняя тотъ же способъ высокихъ температуръ и давленій къ алифатическимъ соединеніямъ съ этиленной связью, въ присутствіи водорода и окиси мћди, достигаюгъ полной гидрогенизаціи; напримћръ, этиленъ С2Н4 переходитъ въ этанъ, триметилэтиленъ въ изопентанъ, амиленъ въ предћльный С5Н12, олеиновая кислота въ стеариновую (Ипатьевъ, 1909).
Въ присутствіи катализатора окиси никкеля полициклическіе углеводороды подвергаются полной гидрогенизаціи: флуоренъ
С6H4 |
|
СH2 |
||
| |
||||
С6H4 |
переходитъ въ пергидрофенантренъ
С6H10 |
|
СH2, |
||
| |
||||
С6H10 |
аценафтенъ въ декагидроаценафтенъ С12Н20, ретенъ въ додека- и пер-гидроретенъ С18H30 и C18H32 (1909), инденъ въ октогидроинденъ С9Н16 (Ипатьевъ, 1913).
Новћйшіе опыты (1911 г.) гидрогенизаціи терпенныхъ кетоновъ въ присутствіи окиси никкеля показали Ипатьеву, что при этомъ происходитъ закрытіе двойной связи какъ въ ядрћ, такъ и въ боковой цћпи, при чемъ группа CO возстановляется при 260°—280°. {523}
Употребляя въ качествћ катализатора возстановленный никкель и ведя гидрогенизацію подъ давленіемъ, Ипатьевъ достигъ (1913) сначала насыщенія двойной связи въ боковой цћпи, работая при 95—100°; начиная же съ 185—190°, можно присоединить къ ароматическому ядру шесть атомовъ водорода. Такъ, напримћръ, анетолъ С6H4(OCH3).СН2.СН=СН2 даетъ дигидроанетолъ С6Н4(ОСН3)С3Н7 и, наконецъ, гексагидропропилбензолъ С6Н11(С3Н7); эйгенолъ переходитъ въ дигидроэйгенолъ и октагидроэйгенолъ, и т. д.
Полиметиленовые углеводороды представляютъ группу соединеній, въ высшей степени интересныхъ съ научной точки зрћнія и важныхъ вслћдствіе ихъ отношенія къ цћлымъ группамъ природныхъ продуктовъ, какъ, напримћръ, терпеновъ и камфорообразныхъ тћлъ, углеводородовъ кавказской нефти, гидрированныхъ производныхъ бензола и т. д.
Изученіемъ простћйшихъ полиметиленовыхъ углеводородовъ, т.-е. ихъ синтезомъ, превращеніемъ и изомеризаціею въ углеводороды съ открытой цћпью, занимался Г. Г. Густавсонъ. Онъ впервые далъ простой методъ добыванія открытаго Фрейндомъ въ 1882 г. своеобразнаго триметилена, а именно дћйствіемъ на бромистый триметиленъ цинковой пыли и спирта (1887). Приготовивъ охлоренные продукты триметилена и подћйствовавъ на нихъ, напримћръ, цинковой пылью и спиртомъ, онъ впервые наблюдалъ изомеризацію въ аллильныя соединенія; затћмъ Густавсонъ совмћстно съ Н. Я. Демьяновымъ получили и изслћдовали алленъ СН2=С=СН2 (1888), бромистый пентаметиленъ и тетраметиленъ (1889); въ 1896 г. Густавсонъ, дћйствуя цинковой пылью на тетрабромидъ эритрита, открылъ замћчательный углеводородъ С5Н8 (винилтриметиленъ), переходящій въ изомерный углеводородъ этилидентриметиленъ. Въ 1897 г. онъ наблюдалъ изомеризацію бромюра винилтриметилена въ кетопентаметиленъ и вмћстћ съ О. Попперомъ получилъ диметилтриметиленъ, гомологъ триметилена (1898).
Оба углеводорода, открытые Густавсономъ, послужили предметомъ многократныхъ изслћдованій. Инатьевъ и Тихоцкій (1904) получили изъ „винилтриметилена” нитрозохлоридъ идр.; на основаніи своихъ изслћдованій они считаютъ вћроятнымъ, что это соединеніе есть смћсь двухъ изомеровъ; Н. Зелинскій и В. Кравецъ считаютъ углеводородъ Густавсона бициклическимъ и называютъ его просто спироцикланомъ (1911-13); послћдній добывается ими синтетически; {524} Н. Демьяновъ и М. Дояренко (1912-13) превратили „винилтриметиленъ” въ этилтриметиленъ, черезъ іодюръ третичнаго спирта, а равно возстановленіемъ въ присутствіи платиновой черни и сжатаго водорода. Подробно изучалъ строеніе этихъ углеводородовъ Густавсона О. Г. Филипповъ (см. его монографію: Строеніе углеводородовъ Г. Г. Густавсона, полученныхъ изъ пентаэритрита. Птр. 1914); на основаніи этихъ тщательныхъ изслћдованій можно считать вопросъ рћшеннымъ: „винилтриметиленъ” есть смћсь метиленциклобутана и метилциклобутена, а „этилидентриметиленъ” есть метилциклобутенъ.
Переходъ отъ полиметиленовыхъ углеводородовъ — черезъ нитросоединенія,полученныя нитрованіемъ по методу М. И. Коновалова — къ соотвћтствующимъ аминамъ былъ многократно осуществленъ въ лабораторіи В. В. Марковникова, имъ самимъ и М. И. Коноваловымъ; ими, напримћръ, были получены амины ряда пентаметилена (1895), гексаметилена (1895), гексаметилена-октонафтена (1895), гептаметиленамина (1893) и нононафтена (1893). Асканъ получилъ(1891) гептанафтенаминъ, а Андреевъ впервые изолировалъ (1891) возстановленіемъ оксима лћваго ментона лћвый ментиламинъ. Затћмъ Н. М. Кижнеръ произвелъ подробное изслћдованіе праваго ментиламина, этил- и діэтилпроизводныхъ его, а равно этилментилгидразина и бром-ментиламина; дћйствуя на послћдній окисью серебра, онъ открылъ методъ перехода отъ бромаминовъ къ гидразинамъ. Въ общемъ существуетъ большое сходство между полиметиленовыми и жирными аминами (Н. М. Кижнеръ: Амины и гидразины полиметиленоваго ряда, методы образованія ихъ и превращенія. Москва, 1895). Реакція перехода отъ бромаминовъ къ гидразинамъ (посредствомъ окиси серебра) и открытая имъ же реакція превращенія гидразиновъ (окисленіемъ красной кровяной солью) въ предћльные углеводороды была распространена Н. М. Кижнеромъ на жирные и полициклическіе1) амины (и гидразины), а равно изучена новая реакція между гидроксиламиномъ и дибромаминами, которые {525} переходятъ при этомъ въ непредћльные углеводороды (см. монографію о превращеніяхъ бромаминовъ подъ вліяніемъ окиси серебра и гидроксиламина... Москва, 1899). Н. Демьяновъ далъ способъ перехода отъ циклическихъ аминовъ съ боковой цћпью CH2NH2, дћйствіемъ азотистой кислоты, къ соединеніямъ, содержащимъ въ циклћ на одинъ атомъ углерода болће (1907); такъ, напримћръ, была произведена изомеризація съ переходомъ трехчленнаго цикла къ четырехчленному. Съ другой стороны, четырехчленный спиртъ С4H7.СН2ОН черезъ бромидъ и возстановленіемъ послћдняго цинкпалладіевой парою изомеризуется въ пентаметиленъ (Демьяновъ, 1907). Прибавимъ, что метилтриметиленаминъ
СH2 |
|
СH.CH(NH2).СН3 |
||
| |
||||
СH2 |
азотистой кислотою не изомеризуется (Н. Демьяновъ и С. Пинегинъ, 1914).
Къ синтезу сложныхъ полиметиленовъ, въ связи съ своими капитальными изслћдованіями нафтеновъ, Вл. Марковниковъ приступилъ впервые въ 1890 г. Исходя изъ суберона, онъ примћнилъ для его возстановленія металлическій натрій въ абсолютномъ спиртћ (способъ Вышнеградскаго и Ладенбурга) и получилъ пинаконъ, который былъ превращенъ въ хлориды С7Н12Сl2, С7Н13Сl, дающіе циклогептенъ С7H12 и циклогептанъ, или гептаметиленъ, С7Н14 (1893, 1895). Исходя изъ бромистаго суберилена С7Н11Br, Марковниковъ получилъ (1895) дћйствіемъ спиртовой щелочи новый углеводородъ состава С7Н10, суберенъ и суберогерпенъ, въ которомъ онъ принялъ тройную связь въ семичленномъ кольцћ (1902). Въ связи съ вопросомъ о возможности существованія подобной тройной связи въ кольцћ, недавно (1913) А. Фаворскій и В. Божовскій доказали, исходя изъ циклогексанона, что въ шестичленномъ циклћ не существуеть тройной связи.
Скоро затћмъ, начиная съ 1895 г., послћдовали работы Н. Зелинскаго, исходившаго также изъ двукарбоновыхъ кислотъ (алкилированныхъ {526} пимелиновой, адипиновой и т. д.), легко дающихъ циклическіе кетоны,— послћдніе были возстановлены во вторичные спирты, дающіе посредствомъ НBr или HJ соотвћтственный бромюръ или іодюръ. Для возстановленія послћднихъ въ углеводороды Зелинскій видоизмћнилъ (1898) методъ прямого возстановленія водородомъ въ присутствіи палладія, испытанный впервые М. Зайцевымъ (1872): реакція велась посредствомъ цинкъ-палладія въ спирту въ присутствіи соляной кислоты и дала новые циклическіе углеводороды, напримћръ, метилпента- и диметилпентаметиленъ, метил-, ди- и триметилгексаметиленъ и т. д. (1898). По тћмъ же реакціямъ оптически дћятельныя кислоты дали оптически дћятельные алкилированные углеводороды циклопентеноваго и циклогексеноваго рядовъ (1901-2), а равно циклогексановаго ряда, т. е. нафтеновъ (1902). Въ 1907 г. былъ также полученъ изъ себациновой кислоты циклононанъ С9H18.
Вслћдъ затћмъ Зелинскій синтезировалъ изъ метиловаго эфира себациновой кислоты даже циклоэйкозанъ (CH2)20 и циклотессароконтанъ (CH2)40! (1909).
Исходя изъ акгивныхъ алкилированныхъ циклогексеновъ, Зелинскій получилъ активный дигидротолуолъ (1908). Въ 1911 г. Зелинскій открылъ интересный способъ дегидрогенизаціи, т. е. перехода иолиметиленовыхъ углеводородовъ въ производныя бензола, въ присутствіи катализатора палладіевой черни при температурћ отъ 200°; эта реакція оказывается обратимой, такъ какъ тотъ же катализаторъ въ атмосферћ водорода при 100—110° легко гидрогенизируетъ бензолъ.
Простой переходъ этиленныхъ углеводородовъ въ циклическіе (бензольные, многоядерные, полиметиленовые) достигается посредствомъ метода В. Ипатьева: примћненіе давленія вмћстћ съ высокой температурой даетъ полимеризацію этиленныхъ углеводородовъ; напримћръ, этиленъ (при 70 атмосферахъ и температурћ 380—400°) полимеризуется въ предћльные и непредћльные углеводороды, непредћльные (этиленовые) состоятъ изъ амиленовъ и гексиленовъ, а предћльные изъ гексана и октана, а остальные 80% полученнаго полимеризованнаго продукта принадлежатъ къ полиметиленовымъ углеводородамъ (нафтенамъ) С9H18, С10H20,... С15H30 и др. Аналогично совершается полимеризація изобутилена (1911). Слћдовательно, уплотненіе этилена при высокой температурћ и высокомъ давленіи даетъ по {527} преимуществу гексаметиленъ и его производныя. Параллельные опыты дћйствительно показали, что гексаметиленъ въ присутствіи глинозема (давленіе доводилось до 120 атмосферъ, а температура приблизительно до 500°) разлагается (изомеризуется), давая метилпентаметиленъ, бензольные и многоядерные углеводороды (1911). Природа катализатора оказываетъ при этомъ вліяніе на родъ и выходъ уплотненныхъ углеводородовъ; напримћръ, алюминій даетъ значительно менће нафтеновъ, чћмъ катализаторъ хлористый цинкъ (1913).
Вполнћ самостоятельнымъ и проницательнымъ химикомъ былъ А. Н. Вышнеградскій (ученикъ А. Бутлерова, родился въ 1851 году, умеръ въ 1880 г.), столь трагически прервавшій свою жизнь1). Онъ сперва вмћстћ съ А. Бутлеровымъ приступилъ къ трудной задачћ выясненія строенія алкалоидовъ. За сравнительно короткое время (1878—1880) ему удалось открыть факты фундаментальнаго значенія для дальнћйшаго развитія химіи алкалоидовъ и подготовить путь къ замћчательнымъ синтезамъ Ладенбурга и др. A. H. получилъ изъ цинхонина этилпиридинъ и хинолинъ и впервые высказалъ взглядъ, что алкалоиды, вообще, являются производными пиридина и хинолина, — взглядъ, подтвердившійся позднћйшими синтетическими работами другихъ химиковъ. Попутно, для своихъ дальнћйшихъ синтезовъ, Вышнеградскій первый получилъ (1880) тетрагидрохинолинъ и этилтетрагидрохинолинъ (возстановленіемъ хинолина посредствомъ олова +НСl) и дћйствіемъ натрія въ спиртћ возстановилъ этилъ-пиридинъ до этилъ-пиперидина и этилированнаго этилъ-пиперидина; прибавимъ, что по взглядамъ Вышнеградскаго, коніинъ есть не что иное, какъ аллилпиперидинъ (1879), а Ладенбургъ (1886 г.) далъ намъ синтезъ коніина, какъ пропилпиперидина, полученнаго возстановленіемъ изъ аллилпиперидина!
Изъ дальнћйшихъ изслћдованій въ области пиридина и хинолина назовемъ еще работы: Н. Н. Любавина „опиридинныхъ соединеніяхъ” (докторская диссертація 1887); Г. К. Деккера о дћйствіи щелочей на галоидоалкильныя соединенія хинолина и его гомологовъ (1894), впослћдствіи о хинолинахъ, пиридонахъ, акридинћ, производныхъ папаверина и т. д.; А. Е. Чичибабина о продуктахъ {528} дћйствія галоидныхъ соединеній (алкиловъ) на пиридинъ и хинолинъ (диссертація, 1902).
Пирролу посвящена монографія Г. Коршуна: „Методы полученія пиррола и его произволныхъ” (Харьковъ, 1907), содержащая подробный обзоръ методовъ полученія пиррольныхъ производныхъ, а равно новые синтезы, произведенные авторомъ частью вмћстћ съ И. П. Осиповымъ, начиная съ 1903 г. Прибавимъ, что Н. Н. Любавинъ еще въ 1869 г. установилъ кислотный характеръ пиррола, приготовивъ соль C4H4N.K.
Пиридины съ непредћльной цћпью въ уположеніи были синтезированы путемъ конденсаціи непредћльныхъ алдегидовъ съ амміакомъ и ацетоуксуснымъ эфиромъ (Е. Гришкевичъ-Трохимовскій и И. Павловская, 1913).
П. Петренко-Критченко синтезировалъ (1910) интересныя соединенія γ-пиперидоннаго типа, содержащія четыре асимметрическихъ углерода и поэтому дающія стереоизомерныя формы; окисленіемъ (CrO3) эти соединенія были переведены въ λ-пиридонный рядъ. Н. Цоневъ подвергъ дћйствію амміака (1912) нћкоторыя производныя пиперидона, пиридона и гидропирона; дальнћйшія изслћдованія Цонева и Петренко-Критченко касались вопроса о взаимномъ вытћсненіи амміака и аминовъ въ углеродистыхъ (пиридонныхъ) соединеніяхъ (1913).
П. Шестаковъ и Н. Казаковъ занимались изученіемъ пиримидиновъ и реакціи амидиновъ съ ацетоуксуснымъ эфиромъ (1912 г.).
Продукты конденсаціи формалина съ анилиномъ изслћдовали А. М. Настюковъ (1904 и 1912) и Е. И. Орловъ (1905).
Замћщенные индолы были получены А. Арбузовымъ и В. Тихвинскимъ изъ гидразоновъ посредствомъ открытой ими (1913) реакціи каталитическаго разложенія въ присутствіи CaCl2, CuCl и другихъ.
Основанная трудами Вантъ-Гоффа и Лебеля (1874) смћлая гипотеза объ асимметрическомъ углеродћ и созданная ими стереохимія, — „chimie dans Tespace”, no Вантъ-Гоффу, или Stereochemie, no предложенію {529} В. Мейера, — первоначально распространялась въ Россіи медленно. Изъ знаменитыхъ представителей органической химіи какъ чуткій ко всему новому въ области теоріи Бутлеровъ, такъ и Бейльштейнъ, не говоря уже о Зайцевћ и Меншуткинћ, ученикахъ Германа Кольбе, холодно встрћтили стереохимію, хотя она представляетъ лишь дальнћйшее развитіе структурной химіи.
Но несмотря на то, русскіе химики уже сравнительно рано занялись изслћдованіемъ различныхъ тћлъ и группъ тћлъ, принадлежащихъ къ категоріи стереоизомерныхъ и оптически дћятельныхъ соединеній. Такъ, напримћръ, Е. Ф. Клименко (1876, 1880 г.) подробно изслћдовалъ активную молочную кислоту; И. П. Осиповъ уже съ 1879 г. и особенно С. М. Танатаръ (1890-1911 г.) изучали кислоты фумаро-малеиновыя и ихъ взаимные переходы; Ф. Флавицкій съ 1878 г. и М. Канонниковъ (1888-90) изслћдовали оптически соединенія камфорной и сахарной группъ. Однако, изслћдодованія въ духћ стереохиміи съ цћлью ея провћрки и приложенія начинаются лишь съ работъ К. А. Бишофа1) (1885-1901 г.), ученика извћстнаго поборника стереохиміи Вислиценуса. Въ 1887 г. Бишофъ былъ назначенъ профессоромъ химіи въ Рижскомъ Политехническомъ Институтћ, гдћ онъ создалъ русскій центръ стереохиміи; уже въ Вюрцбургћ К. Бишофъ и М. Конрадъ начали (1880) синтезы съ малоновымъ эфиромъ, давшіе новыя поликарбоновыя кислоты. Въ 1885 г. Бишофъ вмћстћ съ Рахомъ далъ синтезъ первой двузамћщенной янтарной кислоты, а въ 1887 г. онъ занялся систематическимъ синтезированіемъ моно-, ди- и тризамћщенныхъ янтарныхъ и глутаровыхъ кислотъ, въ сотрудничествћ съ Е. Фойтомъ, Гьельтомъ (въ Гельсингфорсћ), П. Вальденомъ, Н. Минцомъ и А. фонъ-Кульбергомъ. Эти изслћдованія, законченныя въ 1891 г., дали ідъ новыхъ стереомерныхъ кислотъ и побудили Бишофа ввести въ науку такъ называемую динамическую гипотезу и новые пріемы изображенія этихъ изомеровъ въ плоскости. Динамическая изомерія впослћдствіи была оставлена, но въ качествћ „рабочей гипотезы” оказала Бишофу большія услуги. Параллельно съ упомянутыми синтезами шли работы по синтезу непредћльныхъ двукарбоновыхъ кислотъ, т. е. малеино-фумаровой группы (18901 гг.). Новый рядъ стереомеровъ открылся потомъ въ области диаципиперациновъ {530} (1890); одновременно Бишофъ коснулся и стереохиміи азсла и далъ пространственную формулу для пятивалентнаго азота. Наконецъ, съ 1895 по 1907 г. Бишофъ предпринялъ методическое изученіе роли различныхъ радикаловъ при реакціяхъ сцћпленія (sterische Hinderung1), прерванное его смертью на 71омъ сообщеніи; общей сводки результатовъдатьонъ неуспћлъ. Стереохимія пятивалентнаго азота была далће разработана Э. Ведекиндомъ (съ 1895до 1899 г. ассистентъ въ Рижскомъ Политехническомъ Институтћ), успћшно начавшимъ еще въ 1898 г., по предложенію Бишофа, изслћдованіе асимметрическаго азота. Въ этой же области независимо работали Э. Фрелихъ въ Ригћ (съ 1905 г.) и О. Асканъ (1899), изучавшіе стереохимію азота. Въ частности Э. Фрелихъ занимался приготовленіемъ соединеній съ однимъ и съ двумя асимметрическими атомами азота и ихъ расщепленіемъ на активные изомеры (см. его магист. диссертацію: Стереохимія асимметрическаго атома азота. Рига, 1911 г.).
Одновременно съ работами Бишофа въ Ригћ, стереохимія углерода, въ частности стереохимическія отношенія ди- и трикарбоновыхъ кислотъ, съ успћхомъ разрабатывалась экспериментально въ Одессћ Н. Д. Зелинскимъ. Исходной точкой этихъ изслћдованій, начатыхъ въ 1888 г. и продолжавшихся въ томъ же направленіи до 1896 г., является своеобразная реакція конденсаціи бромо- (хлоро-) замћщенныхъ эфировъ жирнаго ряда съ ціанистымъ каліемъ; варіируя бромо-эфиръ, Зелинскій получилъ симметричныя стереоизомерныя диметили триметил, диэтил и этилметил, фенил-метил-янтарныя кислоты, диметилглутаровыя, адипиновыя и пимелиновыя кислоты, диметил-діоксиглутаровыя кислоты (см. докторскую диссертацію: Изслћдованіе явленій стереоизомеріи въ рядахъ предћльныхъ углеродистыхъ соединеній. Одесса, 1891 г.), и, наконецъ, стереоизомерныя диметилтрикарбаллиловыя кислоты (1896). Имъ вмћстћ съ С. Крапивинымъ была изслћдована также электропроводность этихъ кислотъ въ водномъ растворћ (1891) и метиловомъ спиртћ (1896). Н. Зелинскій далъ также матеріалы „Къ вопросу объ изомеріи въ тіофеновомъ ряду” (маг. диссер. Одесса, 1889). {531}
Другія стереоизомерныя группы были изучены П. Меликовымъ (тиглиновая иангеликовая кислоты, 1886-90), Ив. Кондаковымъ (монографія: Къ строенію ангеликовой и тиглиновой кислотъ. Варшава, 1891). Кондаковъ показалъ, что ангеликовая кислота есть не α-этилакриловая, a α-метилизокротоновая кислота. Сюда же относятся работы П. Вальдена (рициноловая и элаидиновая кислота, 1894), A. M. Зайцева (реакція окисленія марганцовокаліевой солью: олеиновая и элаидиновая кислоты и ихъ переходъ въ двћ изомерныя диоксистеариновыя кислоты, съ 1885 г.) и работы Н. и А. Зайцевыхъ (1903), и въ особенности А. Альбицкаго, который далъ образцовое изслћдованіе стереоизомеріи и взаимныхъ переходовъ, частью посредствомъ присоединенія катализатора, напримћръ SO%, и распаденія промежуточнаго продукта, олеиновой и элаидиновой, эруковой и брассидиновой кислотъ (маг. диссер.: О нћкоторыхъ превращеніяхъ олеиновой и другихъ близкихъ къ ней кислотъ. 1898; докт. диссер.: Къ вопросу о стереоизомеріи въ ряду непредћльныхъ одноосновныхъ кислотъ. 1902). Надъ строеніемъ оксистеариновыхъ кислотъ работали также А. Жуковъ и П. Шестаковъ (1903), изучившіе строеніе открытой А. Зайцевымъ (1887) изолеиновой кислоты. Недавно (1912) С Фокинъ увеличилъ число этихъ структуризомерныхъ олеиновыхъ кислотъ еще двумя новыми.— Въ ряду изомеріи фумармалеиновой кислоты были произведены изслћдованія С. Танатаромъ, изучившимъ условія взаимнаго перехода въ присутствіи катализаторовъ, продукты хлорированія и т. д. (съ 1890 до 1911 г.). Благодаря работамъ А. Горбова (1887) и П. Вальдена (1891) такъ называемая „окситетровая” кислота Демарсэ и ея гомологи, полученные изъ двуобромленныхъ ацетоуксусныхъ эфировъ при дћйствіи спиртовой щелочи, были опознаны, какъ двукарбоновыя кислоты фумароваго ряда. Къ области изомерныхъ винныхъ кислотъ относятся работы С. Пржибытка, получившаго (1880 и слћд.) мезовинную кислоту окисленіемъ эритрита посредствомъ азотной кислоты, а также платиновой черни. П. Вальдень опредћлилъ вновь точки плавленія и электропроводность всћхъ четырехъ изомерныхь формъ винной кислоты (1889-91) и далъ богатый физическій матеріалъ для характеристики рацемическихъ, недћятельныхъ и активныхъ формъ стереоизомерыыхъ кислотъ вообще (1896-7).
Подробное изслћдованіе гомологовъ мезаконовой, цитраконо вой и итаконовой кислотъ далъ В. Семеновъ, исходя изъ диобромленныхъ ацетоуксусныхъ эфировъ (см. диссертацію: Изслћдованія въ {532} ряду непредћльныхъ двуосновныхъ кислотъ и продуктовъ ихъ соединенія съ бромистоводородной кислотой. Варшава, 1898, а равно: Изслћдованія въ ряду гомологовъ мезаконовой, цитраконовой и итаконовой кислотъ. Варшава, 1901 г.). Недавно В. Семеновъ открылъ способъ полученія стереоизомеровъ акриловаго ряда, дћйствуя содою на симметрично дибромированные кетоны1).
П. Вальденъ приступилъ къ изслћдованіямъ по стереохиміи съ. другой точки зрћнія. Въ противоположность предыдущимъ работамъ, относящимся къ оптически недћятельнымъ стереомерамъ, изслћдованія Вальдена касаются оптической вращательной способности, связанной съ присутствіемъ асимметрическаго углерода въ частицћ. Вальденъ изслћдовалъ слћдующія проблемы: 1) Появленіе активности при асимметрическомъ углеродћ не зависитъ отъ природы 4 группъ (1895); галоидозамћщенныя до этого времени представляли какъ бы исключеніе, но Вальденъ впервые получилъ изъ оптически активныхъ яблочной, винной, молочной, миндальной и др. кислотъ оптически дћятельныя хлоро и бромопроизводныя. 2) При обратномъ превращеніи галоидокислотъ2) въ оксикислоты Вальденъ открылъ (1895) оптическую (стереохимическую) превращаемость въ противоположный исходному окситћлу антиподъ и установилъ „оптическій круговой процессъ” (такъ называемая Waldensche Umkehrung), который и нынћ еще изучается Э. Фишеромъ3), А. Вернеромъ и другими. 3) Вальденъ установилъ на своихъ активныхъ галоидопроизводныхъ самопроизвольный переходъ въ рацемическую модификацію („Авторацемизированіе”, 1898 г.); переходъ этотъ Ведекиндъ впослћдствіи открылъ и у производныхъ активнаго азота. 4) Физическая характеристика оптическихъ формъ и соотвћтствующихъ {533} рацемическихъ модификацій (1896-7). 5) Вліяніе массы и природы четырехъ группъ вокругъ асимметрическаго углерода на величину вращательной способности; въ противоположность гипотезћ Гю удалось доказать, что для разнородныхъ типовъ активныхъ тћлъ знакъ и величина вращенія опредћляются не столько массой, сколько химической природой и строеніемъ этихъ группъ (1894—1898). 6) Изслћдованіе дисиерсіи вращательной способности однородныхъ тћлъ и вліянія растворителя, температуры и концентраціи на вращеніе вообще (1903-7). Наконецъ, Вальденъ далъ рядъ примћровъ оптической суперпозиціи (1894-5); этотъ принципъ, высказанный впервые Вантъ-Гоффомъ, былъ подтвержденъ одновременно Вальденомъ и Гю. Недавно М. А. Розановъ (1906) и Паттерсонъ (1905-7) высказали сомнћніе относительно его правильности, но новћйшія изслћдованія Л. Чугаева и А. Глћбко доказали, что онъ во всякомъ случаћ вћренъ въ первомъ приближеніи (1911-3).
Вопросу о величинћ вращенія, напримћръ въ зависимости отъ гомологіи (наступленіе максимума въ молекулярномъ вращеніи, „правило Чугаева”), были посвящены прекрасныя изслћдованія Л. А. Чугаева (1898-1902), который въ новћйшее время, съ 1909 г., началъ систематическое изслћдованіе и далъ интересные примћры анормальной вращательной дисперсіи въ зависимости отъ сгроенія тћла, а равно отъ растворителя (1912), температуры, цвћта и т. д. Съ другой стороны, гипотезћ Гю посвящены изслћдованія Д. А. Хардина (1907-11 г.), давшаго „произведенію асимметріи” новую формулировку, относящуюся къ производнымъ активнаго амиловаго спирта.
Въ заключеніе укажемъ еще на изслћдованія, имћющія цћлью выясненіе соотношенія между оптически дћятельными тћлами и ихъ кристаллической формою. Два вопроса связаны съ кристаллизаціею: 1) Вћрна ли теорема Пастера, что всћ оптически дћятельныя тћла кристаллизуются изъ раствора въ геміэдрическихъ формахъ, т. е. что два оптическихъ антипода (напримћръ d- и l-винная кислоты) всегда имћютъ энантіоморфную форму? Противъ этого обобщенія высказались Григ. Н. Вырубовъ (1886 и 1894) и П. Вальденъ (1896), а равно И. Остромысленскій (1910). 2) Какіе предћлы существованія имћютъ въ растворћ рацемическія модификаціи? И здћсь Вырубовъ1) {534} впервые указалъ на особую температуру превращенія, характерную для каждаго рацемическаго тћла; для рацемата
CHOH.COONa |
CHOH.COONH4 |
онъ установилъ 28°С, какъ температуру перехода, а для рацемата 3°С (1884-61)
Къ твердому состоянію оптическихъ антиподовъ и соотвћтствующихъ имъ раиемическихъ соединеній относятся работы П. Вальдена (1896) объ удћльномъ вћсћ, растворимости, точкахъ плавленія и электропроводности. Къ такимъ критеріямъ рацемическихъ формъ и оптическихъ антиподовъ принадлежитъ также триболуминисценція (испусканіе свћта при треніи или, вообще, нарушеніи цћлости кристалловъ). Л. А. Чугаевъ (1901-4) подробно изслћдовалъ это явленіе и установилъ, что это конститутивное свойства по отношенію къ оптическимъ изомерамъ обнаруживаетъ слћдующую правильность: оба антипода триболуминисцируютъ, а ихъ рацемическая форма лишена этой способности. Вопросъ о причинахъ триболуминисценціи (отсутствіе центра симметріи въ кристаллахъ) былъ изученъ В. И. Вернадскимъ и И. И. Остромысленскимъ (1910); послћдній ученый примћнилъ найденную Чугаевымъ (и Андреоччи) закономћрность для распознаванія рацемическихъ формъ (нетриболуминисцируюшихъ) отъ ихъ конгломератовъ, а равно для установленія точки перехода первыхъ во вторыя. Остромысленскій предпринялъ также попытку доказать, что встрћчающіяся въ природћ оптическидћятельныя тћла могутъ образоваться изъ соотвћтственныхъ недћятельныхъ формъ безъ содћйствія организованнаго вещества (напримћръ, посредствомъ кристаллизаціи, 1908).
Недавно (1913) Г. Тамманъ предложилъ интересный методъ различія рацемическихъ тћлъ отъ псевдорацемическихъ; при этомъ онъ пользовался „правиломъ Вальдена”, согласно которому измћненіе энтропіи при плавленіи есть величина постоянная.
Спеціальный и сложный отдћлъ органической химіи представляютъ камфорообразныя соединенія и терпены; этотъ классъ {535} природныхъ соединеній характеризуется способностью отклонять плоскость поляризованнаго свћта и обладаетъ, слћдовательно, асимметрическимъ углеродомъ, вслћдствіе чего непосредственно относится къ стереохиміи.
Эта группа изучалась русскими учеными съ большимъ успћхомъ. Начнемъ съ трудовъ Фел. Ром. Вредена (род. 1841 г., ум. 1878 г.), который изучалъ съ 1869 до 1878 г. камфору и камфорную кислоту (см. монографію: О камфорной кислотћ. Спб. 1873) и получилъ новыя производныя и новые изомеры, частью до сихъ поръ еще не провћренные. Эти труды замћчательны уже тћмъ, что они относятся къ періоду, когда эти тћла изучались лишь немногими смћлыми піонерами, а Ереденъ сразу приступилъ къ вопросу о строеніи камфорной группы.
Далће упомянемъ объ изслћдованіяхъ Ф. М. Флавицкаго (съ 1878 г.), изучившаго впервые правый и лћвый пиненъ (терпенъ, 18789) и камфенъ; онъ открылъ правый и лћвый изотерпенъ (1879) и т. д. и опредћлилъ ихъ вращательную и свћтопреломляющую способность. На основаніи свћтопреломляющей способности И. И, Канонниковъ далъ въ 1883г. физическій методъ, впослћдствіи примћнявшійся постоянно для опредћленія строенія камфоры и терпеновъ, и предложилъ впервые для камфоры циклическую формулу съ внутренней пара-связью. М. И. Коноваловъ (съ 1895 до 1906) изслћдовалъ дћйствіе азотной кислоты на рядъ ментана, терпена и др., а И. Л. Кондаковъ, начиная съ 1898 г., посвятилъ много труда выдћленію въ чистой формћ и изслћдованію производныхъ этой важной группы, напримћръ, туена, камфена, фелландрена, пинена, борнилена, фенхена и т. д.
Особое значеніе имћютъ изслћдованія Е. Е. Вагнера, которому, посредствомъ разработаннаго имъ раньше метода окисленія марганцовокислымъ каліемъ (Къ реакціи окисленія непредћльныхъ углеродистыхъ соединеній. Варшава, 1888), удалось выяснить строеніе лимонена, терпинеола, терпина, карвона и т. д. (1892, 1894, 1897) и внести поправки въ выводы А. Байера. По его предложенію гексагидроцимолъ получилъ названіе ментана, а тетра- и дигидроцимолы {536} названы ментенами и ментадіэнами. Къ числу извћстныхъ сотрудниковъ-учениковъ Е. Е. въ области терпеновъ принадлежитъ А. С. Гинзбергъ. Цћнные матеріалы были также даны О. Асканомъ1) (Гельсингфорсъ), представившимъ новыя экспериментальныя и теоретическія изслћдованія по стереохиміи камфорной группы (1895-1901). Выдающееся значеніе имћютъработы Г. Компа (Гельсингфорсъ), давшаго полный синтезъ камфорной кислоты и камфоры посредствомъ взаимодћйствія эфировъ щавелевой и β-диметилглутаровой кислотъ и окончательно установившаго строеніе камфоры (1903, 1909, 1911). Новый методъ приготовленія и изслћдованія непредћльныхъ углеводородовъ вообще былъ данъ трудами Л. А. Чугаева (начиная съ 1899 г.), создавшаго „ксантогеновый” методъ,— не только извћстные уже терпены могутъ быть получаемы посредствомъ этого метода въ индивидуальной формћ, но получаются и новые терпены (открыта новая группа терпеновъ съ точкой кипћнія 150° и новыя соотношенія между терпенами и соотвћтственными спиртами и кетонами, см. монографію: Изслћдованія въ области терпеновъ и камфоры. Москва, 1903). Оригинальныя изслћдованія В. Н. Ипатьева дали съ 1906 г. новые методы деструкціи камфоротћлъ путемъ дегидратаціи съ помощью катализатора (глинозема), а равно посредствомъ гидрогенизаціи.
Цћнное значеніе имћютъ также изслћдованія Н. Кижнера въ области полученія и изомеризаціи новыхъ циклическихъ углеводородовъ, частью относящихся къ классу терпеновъ; приведемъ лишь нћсколько примћровъ изъ его новћйшихъ изслћдованій (1911): бициклическій углеводородъ каранъ C10H18 (изъ пулегогидразина) изомеризуется присоединеніемъ НBr и его обратнымъ отщепленіемъ въ различные ментены; туйанъ, полученный окисленіемъ изъ туйилгидразина, изомеризуется въ непредћльный углеводородъ С10H18; псевдоіонанъ С13Н22 (изъ псевдоіонона) изомеризуется въ іононъ С13Н22; далће были открыты факты изомеризаціи (перехода четырехчленнаго кольца въ пятичленное) при превращеніяхъ циклобутилдиметилкарбинола, посредствомъ щавелевой кислоты, въ диметилциклопентенъ, а изъ бромюра или іодюра этого же алкоголя дћйствіемъ спиртовой щелочи полученъ изомерный углеводородъ; одинаковыя превращенія далъ и циклобутилдиэтилкарбинолъ (1911). {537}
Н. Кижнеръ примћнилъ свой методъ каталитическаго разложенія гидразиновъ также къ камфорообразнымъ тћламъ съ открытой цћпью, напримћръ, къ цитралю и цитронеллалю, изъ которыхъ онъ выдћлилъ углеводороды С10H18, превращенные въ С10H20 и С10H22 (оптически активные и недћятельные диметилоктаны, 1911-3).
Циклическіе спирты и углеводороды были синтезированы М. Зайцевымъ, исходя изъ циклическихъ кетоновъ съ помощью алифатическихъ іодидовъ (1909-13), напримћръ, дћйствіемъ цинка на смћсь ментона или фенхона, или циклогексанона съ іодистымъ аллиломъ. Подобнымъ образомъ и И. Мацуревичъ получилъ въ 1911 г. синтетическіе третичные метилксилоловые и гидроароматическіе аллиловые спирты. Дальнћйшія доказательства примћнимости этого способа, открытаго A. M. Зайцевымъ для алифатическихъ кетоновъ, также и къ циклическимъ были даны В. Яворскимъ въ 1908 г., получившимъ третичный спиртъ аллил-ментанолъ дћйствіемъ смћси аллиліодида и ментона на магній (см. М. Зайцевъ), а равно благодаря работћ И. Ванина (1912), получившаго третичный спиртъ метилментанолъ (изъ ментона).
Дћйствуя магніемъ и галоиднымъ аллиломъ на камфору, М. Хойна получилъ (1912) аллилборнеолъ и окисленіемъ его — соотвћтственный глицеринъ.
На основаніи температуръ плавленія и микрографическихъ наблюденій Н. Ефремовъ установилъ въ 1913 г., что камфора образуетъ съ тремя діоксибензолами молекулярныя соединенія состава 1:1, а равно твердые растворы и эвтекгическія смћси.
Природныя богатства нефти въ Россіи имћютъ не только огромное экономическое и техническое значеніе, но представляютъ также глубокій научный интересъ. Съ обћихъ точекъ зрћнія, можетъ быть, на первомъ мћстћ должно быть поставлено имя Алекс. Ал. Лћтняго (1848-84), счастливаго техникаизобрћтателя, который своими техническими и научными трудами обратилъ всеобщее вниманіе на нефтяное дћло; онъ построилъ первый асфальтовый заводъ въ г. Сызрани, изслћдовавъ передъ тћмъ {538} мћсторожденія асфальта въ Симбирской губерніи (1874); въ 1879 г. онъ построилъ въ Петроградћ заводъ для приготовленія смазочныхъ маселъ изъ остатковъ бакинской нефти; въ 1880 г. онъ построилъ близъ Баку заводъ для приготовленія антрацена изъ нефтяныхъ остатковъ, затћмъ построилъ въ Баку заводъ для переработки озокерита въ церезинъ. Являясь иниціаторомъ въ этихъ техническихъ задачахъ, онъ вмћстћ съ тћмъ былъ также выдающимся теоретикомъ. Его книга „Сухая перегонка битуминозныхъ ископаемыхъ” (1875) есть первый учебникъ нефтяного дћла на русскомъ языкћ. Въ 1877 г. появилась его работа „Изслћдованіе продуктовъ древеснонефтяного газа”, въ которой впервые было доказано, что при пропусканіи кавказской нефти и нефтяныхъ остатковъ черезъ накаленныя желћзныя трубы съ углемъ образуются ароматическіе углеводороды: антраценъ, фенантренъ, нафталинъ, бензолъ, толуолъ и др. (болће подробно изложено въ 1879 г.). — Нћтъ надобности распространяться здћсь о громадномъ научномъ и техническомъ значеніи этихъ первыхъ шаговъ фабрикаціи бензола и его производныхъ для возникшей потомъ русской промышленности органическихъ красокъ и т. д. Прибавимъ, что въ томъ же направленіи производилъ опыты В. Марковниковъ (1892), a A. H. Никифоровъ (1902) выработалъ методъ для фабрикаціи изъ сырой нефти и нефтяныхъ остатковъ бензола и толуола (12%) рядомъ съ антраценомъ и нафталиномъ.
Несомнћнно, труды и успћхи Лћтняго послужили духовнымъ катализаторомъ для цћлаго ряда одновременно появившихся новыхъ изслћдованій нефти и правительственныхъ мћропріятій.
К. И. Лисенко, профессоръ Горнаго Института (род. въ 1836 г., ум. въ 1903 г.), первый высказалъ предположеніе (1876), что русская нефть по своему химическому составу должна отличаться отъ американской, такъ какъ перегоны обћихъ нефтей съ одинаковыми точками кипћнія обладаютъ различной плотностью.
Одновременно Вреденъ, основываясь на большей плотности нашей нефти, разсматриваетъ углеводороды послћдней, какъ гидрогенизованныя ароматическія соединенія.
Въ 1877 г. Д. И. Менделћевъ, который еще раньше живо интересовался нефтяными дћлами въ Россіи, издалъ свой трудъ „Нефтяная промышленность”, въ которомъ онъ высказалъ свою гипотезу о происхожденіи нефти изъ карбидовъ желћза. Съ 1880 г, вплоть до 1889 г. онъ предпринял ь рядъ физико-химическихъ {539} изслћдованій нефти (перегонка, удћльный вћсъ, треніе и т. д.) и выдћлилъ при этомъ пентанъ изъ бакинскаго бензина; указывая на богатства бакинской нефти, онъ энергично ратовалъ за развитіе нефтяной промышленности въ Россіи. Одновременно съ тћмъ Ф. Ф. Бейльштейнъ и А. Курбатовъ (1880-3 г.) приступили къ химическому изслћдованію бакинской нефти; они впервые показали, что въ отличіе отъ пенсильванской нефти бакинская по преимуществу состоитъ изъ насыщенныхъ углеводородовъ ряда СnН2n, идентичныхъ съ гидрогенизованными ароматическими углеводородами, напримћръ, изъ бензола, полученными Вреденомъ (1876). Независимо В. В. Марковниковъ и В. Оглоблинъ (1881-3) предприняли свои извћстныя цћнныя изслћдованія кавказской нефти; Марковникову1) химическая наука обязана всестороннимъ изученіемъ и номенклатурою составныхъ частей нефти: нафтены (полиметилены), нафтеновыя кислоты — термины, имъ введенныевъ науку; имъ же были выдћлены нафтены, начиная отъ гексанафтена до тетрадеканафтена, и предприняты опыты ихъ синтетическаго приготовленія. Начиная съ 1881 г. и до конца своей жизни, онъ трудился надъ разработкою химіи нафтеновъ; въ 1883 г. появилась его первая обширная сводка результатовъ: „Изслћдованіе Кавказской нефти”. Въ 1892 г. онъ напечаталъ вторую сводную работу: „Нафтены и ихъ производныя въ общей системћ органическихъ соединеній”; въ 1898 г. вышла новая сводная работа подъ заглавіемъ: „Изслћдованія въ области циклическихъ соединеній изъ ряда гексаметилена или нафтеновъ”, — а послћдній его трудъ, опубликованный въ 1904 r., является продолженіемъ той же темы: „Изъ области циклическихъ соединеній. О гептанафтиленахъ или метилциклогексенахъ”. — Изъ числа учениковъ В. Марковникова главнымъ образомъ М. И. Коноваловъ принялъ живое участіе въ изслћдованіи нафтеновъ (нононафтенъ 1884-90; см. его брошюру: Нафтены, гексагидробензолъ и ихъ производныя. Тверь, 1889).
Независимо отъ названныхъ ученыхъ въ синтезћ нафтеновъ живое и успћшное участіе принималъ также Н. Д. Зелинскій (съ {540} 1895 г.), еще недавно получившій циклононанъ (1907 г.). Вопросъ о составћ нефти, такимъ образомъ, получилъ всестороннее освћщеніе въ трудахъ русскихъ химиковъ.
Изслћдованія Марковникова и его учениковъ, Зелинскаго, а равно О. Аскана (1891-1902) окончательно выяснили, что господствовавшій въ первое время взглядъ на нафтены и нафтеновыя кислоты, какъ на продукты, идентичные съ гексагидробензолами и ихъ производными, неправиленъ. Основываясь на теоріи напряженія Байера, О. Асканъ настойчиво проводилъ мысль, что въ нефти должны преобладать циклопентаны, вслћдствіе легкости ихъ образованія, за ними циклогексаны и циклобутаны и въ еще меньшей мћрћ циклопропаны. Строеніе нафтеновыхъ кислотъ Асканъ объясняетъ тћми же соображеніями, считая ихъ продуктами вторичной конденсаціи сухой перегонки въ нћдрахъ земли.
Вопросъ о строеніи русской нефти представляетъ одну сторону нефтяной проблемы; онъ можетъ быть рћшенъ непосредственно и опытнымъ путемъ; другая сторона этой проблемы касается вопроса о происхожденіи нефти, но тутъ мы должны ограничиться лишь заключеніями по аналогіи. Этотъ вопросъ интересовалъ уже М. В. Ломоносова, давшаго въ своей книгћ „Первыя основанія металлургіи”, прибавленіе второе, § 155 (1761-3) для веществъ „каменное масло, жидовская смола, нефть, гагатъ и симъ подобныя” теорію происхожденія изъ растительныхъ веществъ; послћднія при „тихомъ горћніи” образуютъ тонкую матерію, которая собирается „въ какую теплую полость и передвояется вторичнымъ дћйствіемъ, кое химики ректификаціею называютъ”. (Ломоносовъ).
По гипотезћ Соколова нефть космическаго происхожденія; она возникла изъ атмосферы и поглотилась впослћдствіи землею. Надъ тћмъ же вопросомъ трудился Д. И. Менделћевъ, выдвинувшій (1877) свою карбидную теорію происхожденія нефти: внутри земли находятся карбиды металловъ, напримћръ, желћза, которые отъ дћйствія воды, проникающей къ нимъ черезъ щели земной коры, разлагаются на окислы металловъ и насыщенные углеводороды. Эта карбидная теорія получила новыя подтвержденія въ опытахъ Клоеца (187496), Муассана (1899), Сабатье и Сендеренса (1902). Ея защитникомъ явился также Н. Н. Бекетовъ (1896).
Изъ противоположныхъ предположеній исходитъ органическая теорія происхожденія нефти, напримћръ, теорія К. Энглера, {541} усматривающая источникъ образованія нефти въ организмахъ животныхъ, и т. д.
По мнћнію О. Аскана (1902) нефть образовалась изъ болће бћдныхъ углеродомъ олефиновъ, продуктовъ сухой перегонки органическихъ остатковъ животнаго міра, а эти олефины и частью ихъ карбоксильныя производныя, подвергаясь медленной конденсаціи при воздћйствіи сильнаго давленія и высокой температуры, перешли въ нафтены и нафтеновыя кислоты.
Упомянемъ еще, что Аскану удалось конденсировать олефиньг въ нафтены посредствомъ хлористаго алюминія. Что дћйствительно уплотненіемъ этилена и бутилена при высокомъ давленіи и высокой температурћ получаются продукты, чрезвычайно похожіе на сырую нефть, показали недавніе опыты В. Ипатьева (1911), установившаго также вліяніе природы катализаторовъ (Al2O3, АlСl3, ZnCl2) на выходъ нафтеновъ (1913).
Новый факторъ былъ внесенъ въ эту спорную область со стороны стереохиміи. Уже въ 1899 г. П. Вальденъ подчеркнулъ фактъ вращательной способности нефти, впервые установленный Біо въ 1835 г., но впослћдствіи вполнћ забытый, и обратилъ вниманіе на это физическое свойство, говорившее явно противъ карбидной теоріи. Особенно живой интересъ вызвалъ вопросъ о вращательной способности въ 1904-6 г., когда Л. Чугаевъ, М. Ракузинъ и П. Вальденъ снова вернулись къ нему. Въ частности М. Ракузинъ посвятилъ этому вопросу длинный рядъ экспериментальныхъ и теоретическихъ изслћдованій, создавъ науку о поляриметріи нефти (1904-14); онъ опубликовалъ цћнный трудъ: Die Polarimetrie des Erdols. Berlin, 19101).
Къ области циклическихъ соединеній принадлежатъ также органическія краски. Всеобщій интересъ къ этимъ соединеніямъ, интересъ научный, связанный съ техническимъ и коммерческимъ, былъ вызванъ первыми анилиновыми красками: „фуксиномъ” (1855) и „мовеиномъ” (1856, Перкинъ). Честь открытія фуксина несомнћнно {542} принадлежитъ русскому химику Натансону, сдћлавшему свое открытіе случайно; случайно же и Перкинь, въ поискахъ за искусственнымъ хининомъ, открылъ свой фіолетовый анилиновый пигментъ.
Въ 1855 г. Як. Натансонъ (родился въ 1832 г. въ Варшавћ, изучалъ съ 1850 до 1854 г. фармацію и химію въ Дерптскомъ университетћ у профессора К. Шмидта, получилъ тамъ же, въ 1855 г., степень магистра химіи, былъ до 1866 г. профессоромъ химіи въ Варшавскомъ университетћ, а впослћдствіи занимался техническими вопросами; умеръ въ 1884 г. въ Варшавћ) работалъ въ лабораторіи К. Шмидта надъ изслћдованіемъ производныхъ ацетамида; параллельно онъ изучалъ отношеніе анилина къ двухлористому этилену: при нагрћваніи обоихъ веществъ до 200° образуется кровянокрасная жидкость (розанилинъ!). Но это наблюденіе не вызвало вниманія (Lieb. Ann. 98, 1297).
Черезъ два года (1858) знаменитый A. B. Гофманнъ сообщилъ Парижской Академіи о новомъ красномъ продуктћ, полученномъ имъ при нагрћваніи анилина съ четыреххлористынъ углеродомъ, т.-е. онъ вновь открылъ тотъ же розанилинъ (Jahresber. 1858, 351).
Дальнћйшее развитіе какъ теоретической, такъ и технической химіи органическихъ красокъ совершалось безъ видимаго участія русскихъ химиковъ. Лишь съ девяностыхъ годовъ замћчается въ этомъ отношеніи перемћна.
Цћнный вкладъ въ ученіе о роли различныхъ группъ въ краскахъ далъ О. Н. Виттъ (родился въ 1853 г. въ Петроградћ, сынъ профессора Технологическаго Института Н. Витта). Его теорія хромофорныхъ и хромогенныхъ группъ (1877 г. Bed. Ber. IX) существуетъ еще въ настоящее время; введеніемъ нафтоловъ въ азосоединенія (1878) онъ оказалъ сильное вліяніе на развитіе азокрасокъ.
Въ области ализариновыхъ1) красокъ (производныхъ діокси-антрахинона) русскими химиками были сдћланы технически цћнныя открытія; упомянемъ здћсь о динитроантрахинонћ, такъ называемомъ реактивћ Фрицше, открытомъ имъ въ 1869 г. Въ 1892 г. П. Лохтинъ ввелъ въ практику крашенія ализариномъ чрезвычайно важный реактивъ рициноловокислый амміакъ. Въ 1892 г. М. А. Ильинскій въ Москвћ впервые наблюдалъ, что сульфурованіе антрахинона происходитъ легко въ присутствіи ртути и ртутныхъ {543} солей; это открытіе нынћ (съ 1903 г., см. Berl. Ber. 36, 4194) использовано техникою; прибавимъ, что тотъ же катализаторъ (Hg) играетъ рћшающую роль и въ фабрикаціи искусственнаго индиго, a именно въ первой стадіи процесса, въ окисленіи нафталина въ ортофталевую кислоту. — Что касается крашенія посредствомъ индиго, заводомъ Цинделя въ Москвћ въ 1902 г. было сдћлано открытіе новаго способа, а именно примћненія соединенія, получаемаго дћйствіемъ формалдегида на гидросћрнистый натръ. — Одновременно началась и научная разработка вопроса объ искусственныхъ краскахъ; укажемъ лишь на изслћдованія Г. Деккера и Б. Солонины, изучившихъ краски нитрозофенола и нитрозотимола (1902-5), В. Г. Шапошникова, давшаго классификацію красящихъ веществъ (1898), изслћдованія изъ области азиновыхъ и азоніевыхъ красящихъ веществъ (диссертація, Кіевъ, 1904) и занимающагося теоріею явленій крашенія (1911), далће на работы A. E. Порай-Кошица (изучившаго связь между окраскою и строеніемъ и вліяніе акридиноваго кольца на цвћтъ красящихъ веществъ, 1910), С. Г. Шиманскаго, обработавшаго практическую сторону вопроса и напечатавшаго нћсколько учебниковъ1) и т. д..
Вопросу о выцвћтаніи красокъ (см. фотохимія) посвящены изслћдованія В. Н. Оглоблина (1894) и П. П. Лазарева (1907-12), а зависимость окраски отъ температуры изучалась В. Курбатовымъ (1907).
Новую желтую краску канаринъ, которая краситъ бумажную ткань безъ протравы въ щелочномъ растворћ, О. Миллеръ и Прохоровъ (1883 г.) получили посредствомъ окисленія роданистаго калія бертолетовой солью и соляной кислотою. По изслћдованіямъ А. Лидова (Ж. 16, 271. 1884) „канаринъ” есть псевдо-сульфоціанъ C3N3S3H, полученный уже Н. А. Бунге (1870) электролизомъ и вновь добытый электролитически самимъ Лидовымъ изъ роданистаго аммонія; Пономаревъ (1876) получилъ псевдосульфоціанъ изъ роданистыхъ солей окисленіемъ посредствомъ хлора (см. также В. Марковниковъ, Ж. 16, 380). О. Миллеръ изслћдовалъ изодибромантраценъ, открылъ изомерную нитрофталевую кислоту (1877) {544} и изомерные нафтохиноны (1881 и слћд.) и дибромиды (1876), бромоксинафтохиноны и т. д. (1884). Дальнћйшее изслћдованіе бромоксинафтохиноновъ дало (1913) подтвержденіе формулы Эрленмейеръ-Грэбе для нафталина. О. Миллеръ изучилъ также производныя нафтохинона: нафталиновую кислоту, диимидонафтолъ, диацетилдиимидонафтолъ и его превращеніе (1909-13). О. Миллеромъ былъ данъ также усовершенствованный методъ опредћленія индиготина въ продажномъ индиго (1892).
Дисульфоиндиговая кислота (ея обезцвћчиваніе отъ щелочи или ОНіонз. и обратный переходъ въ синій цвћтъ отъ кислорода) была изслћдована М. Чиликинымъ и В. Милановскимъ (1912).
М. Чиликинъ примћнилъ теорію Тиле къ реакціи индиго (1912) и представилъ матеріалы по химіи ализариновыхъ маселъ, давъ новыя производныя рицинолеиновой кислоты (1912).
Онъ же получилъ (1913) бензилпроизводныя антрахинона и индиго и выдвинулъ новую формулу строенія послћдняго, принявъ лейкоиндиго за таутомерное соединеніе (кето-эноль-изомерія).
Изслћдованію краснаго конго посвящены труды С. Шиманскаго (1900), а въ новћйшее время (1912) Ќ. Богоявленскаго и В. Шапошникова, изучившихъ условія кристаллизаціи, электропроводность и роль нейтральныхъ солей и кислотъ на диссоціацію и выяснившихъ переходы отъ красной (азоидной) формы въ синюю (хиноидную).
Недавно В. Шавринъ (1913) получилъ новыя синефіолетовыя краски; дћйствуя анилиномъ на эозинъ, онъ получилъ гексафенилгексаамидофлюорянъ, а тетрабромфенолфталеинъ далъ гексафенилгексаамидофталофенонъ.
В. Шапошниковъ издалъ превосходный курсъ: Обшая технологія волокнистыхъ и красящихъ веществъ. Кіевъ, 1912.
Въ 1900 г. американскій химикъ Гомбергъ, уроженецъ Россіи, открылъ соединеніе, которое онъ принялъ за свободный радикалъ трифенилметилъ (С6Н3)3С. Трехатомный углеродъ какъ бы получилъ реальную форму, а его производное трифенилметилъ {545} представляется аналогичнымъ металлу, т. е. обладающимъ свойствами положительнаго радикала, дающаго основанія и соли. Въ 1902 г. П. Вальденъ доказалъ, дћйствительно, по электропроводности въ жидкомъ сћрнистомъ ангидридћ, что трифенилкарбинолъ, его хлористое и, главнымъ образомъ, его бромистое соединеніе (С6Н3)3СBr отличаются электропроводностью, аналогичной солямъ сульфо нія и аммонія; вслћдствіе этого трифенилкарбинолъ представляетъ собой основаніе „карбоній”; равнымъ образомъ трифенилметилъ обнаружилъ значительную электропроводность въ сћрнистомъ углеродћ (1903).
Дальнћйшія изслћдованія трифенилметила касались фундаментальнаго вопроса: существуетъ ли онъ, какъ таковой, вообще, или же онъ имћетъ строеніе другого рода?
Видное мћсто въ этихъ изслћдованіяхъ занимаютъ работы А. Е. Чичибабина; сводку своихъ многолћтнихъ (съ 1905 г.) изслћдованій онъ далъ недавно въ монографіи: „Изслћдованія по вопросу о трехатомиомъ углеродћ и о строеніи простћйшихъ окрашенныхъ производныхъ трифенилметана” (Москва, 1912). Въ этомъ критико-экспериментальномъ трудћ Чичибабинъ разбираетъ всћ доводы за и противъ трехатомности углерода, даетъ рядъ новыхъ фактовъ и, между прочимъ, удобный методъ возстановленія іодистоводородной кислотой въ уксусной кислотћ карбиноловъ ряда ди- и трифенилметана. Изъ общихъ выводовъ укажемъ, что въ окрашенныхъ трифенилметилахъ нужно признать соединенія трехвалентнаго углерода, что тетра-фенил-бифено-хинодиметанъ по своимъ свойствамъ напоминаетъ трифенилметилъ Гомберга, и отмћтимъ неудовлетворительное состояніе современнаго ученія о „двойной связи” углерода въ такъ называемыхъ „ненасыщенныхъ” соединеніяхъ.
Уже Менделћевъ (1869 г.) разсматриваетъ возможность четырехатомности кислорода; въ 1891 г. Флавицкій допускаетъ шестиатомность, въ 1893 г. Курнаковъ и въ 1894 г. И. Шредеръ — четырехатомность атома кислорода.
[Объ исторіи поливалентности кислорода см. П. Вальденъ, Berl. Ber. 34, 4185 (1901), 35, 1764 (1902)]. {546}
Открытыя въ 1899 г. англійскими химиками Колли и Тикклемъ соли диметилпирона съ галоидоводородными кислотами получили всеобщее значеніе, когда А. ф. Бейеру и Виллигеру (въ 1901 г.) удалось доказать, что кислородъ вообще, а не только въ исключительныхъ случаяхъ, обладаетъ основными свойствами, т. е. на подобіе соединеній основанія сульфонія обладаетъ четырьмя валентностями и образуетъ соединенія основанія оксонія
|
O |
|
. |
П. Вальденъ (1901-2) изслћдовалъ впервые съ физико-химической точки зрћнія диметилпиронъ и опредћлилъ его константу сродства, какъ основанія и какъ кислоты, разсмотрћвъ четырехатомный кислородъ, какъ амфотерный элементъ. На основаніи спектрометрическихъ изслћдованій дћйствительной плотности Канонниковъ въ 1901 г. вывелъ присутствіе четырех- и шестиатомнаго кислорода во многихъ спиртахъ, альдегидахъ, кислотахъ и т. д. Посредствомъ электропроводности, а равно кристаллизаціи В. Плотниковъ (1905-8) установилъ еще новые типы — основную, одно- и двукислотныя соли соединеній диметилпирона съ трибромуксусною кислотою.
Вопросы о четырехатомности кислорода, въ связи съ введенной въ 1900 г. чрезвычайно плодотворной реакціею Гриньяра, прекрасно изслћдовалъ В. В. Челинцевъ, начиная съ 1904 г.; сводку своихъ трудовъ онъ далъ въ монографіи: „Индивидуальныя магній-органическія соединенія и ихъ превращенія въ оксоніевые и аммоніевые комплексы” (Москва, 1908), содержащей литературу и опыты опредћленія индивидуальности теплотъ образованія и разложенія этихъ соединеній, которыя, въ зависимости отъ исходныхъ соединеній, могутъ давать и изомерные1) оксоніевые комплексы; въ {547} результатћ обнаруживается четырехатомность кислорода, пятиатомность азота и трех- и пятиатомность галоидовъ.
Для гипотетичнаго оксоніеваго комплекса, являющагося промежуточнымъ звеномъ въ реакціи Гриньяра, Бэйеръ и Виллигеръ въ 1902 г. предложили формулу
|
O |
|
; |
прибавимъ, что Челинцевъ поддерживаетъ эту формулу, допускающую изомерные комплексы.
Челинцевымъ были изучены также съ 1909 г. „оксоніевые дибромюры” эфировъ
|
O |
|
. |
Еще до появленія ученія о четырехатомности кислорода Шютценбергеръ въ 1873 г. получилъ твердый пербромидъ эфира (С2Н5)2O.Вr3 въ 1905 г. Макинтошъ выдћлилъ при низкой температурћ дибромидъ (С2Н5)2O.Вr2 съ точкой плавленія –40°, разлагающійся легко при повышеніи температуры. A. E. Арбузовъ (1913–4) повторилъ опыты и не могъ подтвердить указанія Челинцева о существующемъ при обыкновенной температурћ дибромидћ.
Далће В. Челинцевъ изслћдовалъ оксоніевыя соединенія алкоголей ROH жирнаго ряда, феноловъ и алкоголей терпеннаго ряда (1913), измћривъ тепловые эффекты при образованіи алкогольныхъ комплексовъ магній-органическихъ алкоголятовъ трехъ типовъ ROMgJ.1ROH (или 2, или 3ROH) онъ измћрялъ реакцію вытћсненія феноловъ жирными алкоголями и установилъ параллельность между теплотами образованія этихъ комплексовъ и скоростями этерификаціи тћхъ же алкоголей (по H. Меншуткину). Въ связи съ оксоніевыми соединеніями В. Челинцевъ изучалъ (1912) тіоновые дибромиды сульфидовъ R2S.Br2, опредћляя ихъ растворимость, молекулярный вћсъ, теплоту образованія и т. д.; съ той же точки зрћнія были изучены аммоніевые дибромиды третичныхъ аминовъ R3N.Br2 и взаимное ихъ отношеніе. Теплоты образованія возрастаютъ отъ оксоніевыхъ къ сульфоніевымъ и къ аммоніевымъ дибромидамъ, и согласно этому амины вытћсняютъ сульфиды и простые эфиры, а сульфиды вытћсняютъ эфиры изъ ихъ соединеній (1912).
А. Фаворскій (1913) изучалъ оксоніевыя соединенія спиртовъ съ галоидоводородами; онъ получилъ достаточно стойкія соединенія нћкоторыхъ вторичныхъ спиртовъ съ галоидоводородами, типа (ROH)2.HX, гдћ Х=Сl, Вr и J; при низшихъ температурахъ удается констатировать и соединенія состава ROH.НХ. Эти типы {548} вполнћ соотвћтствуютъ извћстнымъ кристаллогидратамъ Н2O.ХН и 2Н2O.НХ (Х=Сl и Br). Въ связи съ этими оксоніевыми соединеніями спиртовъ Фаворскій разбираетъ вообще механизмъ реакцій между спиртами и минеральными кислотами. Какъ показали опыты А. Волкова (1889), эти реакціи протекаютъ различно въ зависимости отъ характера спирта: первичные спирты даютъ простые эфиры, образованіе которыхъ по Фаворскому происходитъ черезъ промежуточныя оксоніевыя соединенія, напримћръ, путемъ простого распада сложнаго оксоніеваго соединенія спирта; вторичные и третичные спирты, давая этиленовые углеводороды и воду, распадаются какъ черезъ простыя, такъ и черезъ сложныя оксоніевыя соединенія; для третичныхъ спиртовъ эта реакція обратима, напримћръ,
(СH3)3 С—O |
|
H |
|
||
—H |
|||||
X |
на это указываютъ опыты Бутлерова (1887) съ третичнымъ амиловымъ спиртомъ, а равно опыты Волкова (1889) съ триметилкарбинолами.
Упомянемъ еще, что и Г. Деккеръ (1901 г. и слћд.) внесъ новыя экспериментальныя данныя въ области оксоніевыхъ соединеній.
Магній-органическія соединенія и синтезы посредствомъ нихъ. Сюда относятся работы Ж. И. Гоцича (съ 1902 г.), напримћръ, о дћйствіи магнія на дибромбензолъ (растворяется лишь одинъ атомъ Мg), на бромацетиленъ СНСBr (получается
CMgBr |
| | | |
CMgBr |
изъ MgBrC2H5 и бромацетилена); далће изслћдованія Н. Зелинскаго (19013, Mg и циклическіе кетоны, магній и ацетобутиліодидъ); работы К. Бишофа (1905, магній и бромистый этиленъ и т. д.) и С. Н. Реформатскаго (съ 1902 г., магній взамћнъ цинка при открытой имъ реакціи полученія оксикислотъ, — эта замћна оказалась невыгодной, такъ какъ получались анормальные продукты реакціи). С. Н. Реформатскій и I. Цельтнеръ (1906) изучали также дћйствіе магнія на α-бромизомасляный эфиръ; въ частности, реакція между магніемъ и сложными галоидоэфирами была весьма обстоятельно изслћдована Ю. С. Залкиндомъ (190513), изучившимъ α-бромозамћщенные эфиры ряда жирныхъ кислотъ, отъ уксусной до изовалеріановой; при этомъ по разложеніи водой получился, напримћръ, изъ бромуксуснаго эфира γ-бромацетоуксусный эфиръ. Бромоэфиры съ ароматическими радикалами реагируютъ также съ магніемъ {549} и даютъ эфиры кетокислотъ, напримћръ эфиръ α-бромфенилуксусной кислоты даетъ дифенилацетоуксусный эфиръ (см. диссертацію Ю. С. Залкинда О дћйствіи магнія на эфиры галоидозамћщенныхъ карбоновыхъ кислотъ. Спб. 1913).
Къ предћльной области между органической и неорганической химіею относятся обстоятельныя изслћдованія Н. А. Меншуткина о строеніи фосфористой кислоты, о кислотныхъ функціяхъ водорода, (см. магистерскую диссертацію: О водородћ фосфористой кислоты, не способномъ къ металлическому замћщенію... Спб. 1865). Изучены были, напримћръ, продукты взаимодћйствія хлористаго ацетила съ фосфористой кислотой, дћйствіе РСl3 на безводные спирты и соли ацетопирофосфористой кислоты. Далће назовемъ здћсь изслћдованія Ќ. Ќ. Селиванова (диссертація: Къ вопросу о галоидныхъ соединеніяхъ азота. Спб. 1895), имћвшія главной цћлью изученіе химической природы неорганическихъ галоидамидовъ (іодистаго и хлористаго азота), а равно хлорил-, бромил- и іодиламидовъ органическаго ряда. Къ той же области можно причислить обширныя изслћдованія А. Е. Арбузова: „О строеніи фосфористой кислоты и ея производныхъ” (Спб. 1905), „Объ эфирахъ сћрнистой кислоты” (1909) и въ связи съ этимъ вопросомъ: о существованіи изомерныхъ двойныхъ солей сћрнистой кислоты (1909).
Въ первой работћ, напримћръ, установлено, что всћ несомнћнныя производныя трехатомнаго фосфора вступаютъ въ реакцію соединенія съ СиСl, СиBr и CuJ, что производныя пятиатомнаго фосфора такихъ соединеній не даютъ, и что фосфористая кислота и ея кислые эфиры относятся, какъ производныя пятиатомнаго фосфора.
Соединенія этиловаго эфира фосфористой кислоты P(OR)3 съ галоидными солями серебра были изучены А. Арбузовымъ и А. Карташевымъ (1913), а изобутиловаго съ CuJ Э. Арбузовымъ и А. А. Ивановымъ (1913); они доказали также изомеризацію нейтральнаго изобутильнаго эфира фосфористой кислоты въ эфиръ изобутилфосфиновой кислоты P(OC4H9)3 → C4H9PO(OC4H9)2.
П. Пищимука произвелъ всестороннее изслћдованіе о превращеніяхъ тіо- и селенофосфорныхъ эфировъ (1912); тіоэфиры, {550} напримћръ, образуются лишь при дћйствіи PSCl3 на алкоголяты и отличаются способностью къ присоединеніямъ — комплекснымъ соединеніямъ, представляющимъ производныя четырех- и шестиатомной сћры и разлагающимся при нагрћваніи съ образованіемъ изомерныхъ эфировъ: SP(XR)3 → OP(SR)(XR)2.
Въ связи съ полученными Эрлихомъ мышьяковыми производными бензола и съ ихъ медицинскимъ примћненіемъ Н. Андреевъ получилъ нћкоторыя производныя нафтиларсиновой кислоты (1913).
Интересны также попытки А. Лидова изолировать новые вћроятные продукты окисленія ціана: CNO (газъ, оксанъ 1909), CNO2, CNO3, оксановой соли Me2CNO2 (1912).
(См., напримћръ, монографію А. П. Лидова: О существованіи другихъ, кромћ ціана, азотоуглеродистыхъ газовъ. Харьковъ, 1909).
Сюда относятся также: кристаллическія молекулярныя и комгь лексныя соединенія неорганическихъ тћлъ съ органическими (см. изслћдованія Б. Меншуткина и отдћлъ комплексныхъ соединеній), напримћръ, соединенія галоидоводородныхъ кислотъ со спиртами (см. оксоніевыя соединенія).
Въ первую половину прошлаго вћка неорганическая химія подверглась на западћ весьма интенсивной и успћшной разработкћ. Были усовершенствованы методы анализа неорганическихъ тћлъ; произведены точныя опредћленія эквивалентныхъ (атомныхъ) вћсовъ и стехіометрическихъ отношеній; открыты новые элементы и изучены ихъ соединенія, а равно открыты аллотропическія измћненія извћстныхъ элементовъ. Около половины XIX вћка въ изученіе неорганическихъ тћлъ вносится новое начало: теоріи и факты органической химіи начинаютъ отражаться на способахъ толкованія неорганическихъ соединеній. {551} Понятія объ ангидридахъ, амидахъ, эфирахъ и хлорангидридахъ органическихъ тћлъ переносятся съ пользою въ область неорганическихъ соединеній. Равнымъ образомъ понятія о гомологичныхъ рядахъ органической химіи, о составћ и правильномъ измћненіи химическихъ и физическихъ свойствъ отдћльныхъ членовъ этихъ рядовъ примћняются въ неорганической химіи. Извћстный химикъ Н. Соколовъ пишетъ по этому поводу слћдующее (Химич. Журн. I, 83. 1859): „Но самый замћчательный и въ высшей степени интересный результатъ дћятельности химиковъ въ этомъ направленіи есть несомнћнное убћжденіе въ томъ, что металлы и другія простыя тћла, или такъ называемые элементы, суть тћла сложныя... He подлежитъ ни малћйшему сомнћнію, что многіе изъ элементовъ по своимъ химическимъ и физическимъ свойствамъ, по всему своему характеру образуютъ совершенно натуральныя группы, точно такіе же ряды, какіе существуютъ въ органической химіи и называются гомологами. Законность, существующая въ измћненіи вћса ихъ паевъ, совершенно удовлетворяетъ общей формулћ a + nd для гомологовъ, гдћ a — вћсъ пая перваго члена, d — разница въ вћсахъ паевъ двухъ сосћднихъ членовъ, n — цћлое число, показывающее, сколько разъ къ вћсу пая надо придать разность d. Доказывается это на группахъ Li—Na—K; Ca—Sr—Ва; Cl—Br—J; S—Se—Te”. Представленіе о сложности элементовъ, слћдовательно, является распространеннымъ въ эту эпоху развитія химіи въ Россіи; о сложности элементовъ трактуетъ также статья Страхова, напечатанная въ оффиціальномъ журналћ (Журн. Минист. Народн. Просвћщ. 1859).
Съ другой стороны интересно отмћтить тотъ фактъ, что органическая химія является учительницею неорганической химіи, давая въ своихъ гомологическихъ рядахъ какъ бы прототипы для естественныхъ группъ элементовъ, объединенныхъ 10 лћтъ спустя въ періодическую систему элементовъ Д. И. Менделћевымъ (въ 1869 г.).
Для характеристики взглядовъ этой эпохи укажемъ еще на третій фактъ. Напомнимъ, что въ 1854 г. И. Сенъ-Клеръ-Девиль, видоизмћнивъ способъ Вёлера (1845), сталъ получать металлъ алюминій (глиній) посредствомъ отнятія хлора отъ хлористаго алюминія дћйствіемъ металлическаго натрія1). Вотъ что Н. Соколовъ {552} пишетъ по этому поводу въ 1859 г. (ibid. стр. 79): „Блестящая будущность, предсказываемая вначалћ глинію, не осуществилась до настоящаго времени и вћроятно не осуществится никогда или, по крайней мћрћ, заставитъ себя ждать очень долго”. Это, по мнћнію Н. С, зависитъ не только отъ высокой цћны хлористаго алюминія; равнымъ образомъ методъ Розе, исходящій изъ кріолита, не даетъ дешеваго алюминія. „Конечно, могутъ со временемъ найти способъ дешево готовить хлористый глиній или могутъ найти удобную методу приготовленія глинія изъ кріолита”...1). „Нельзя утверждать только, что эти открытія невозможны, но возможно также и открытіе метода дешеваго искусственнаго приготовленія золота и серебра, и это послћднее открытіе не менће вћроятно, чћмъ всћ другія, необходимыя для того, чтобы глиній (алюминій) сдћлался дешевымъ металломъ”.
Такъ опредћленно высказывалъ Н. Соколовъ въ 1859 г. Дћйствительность, однако, пошла другимъ путемъ: въ 1886 г. вводится электротермическій способъ фабрикаціи алюминія изъ глинозема, a въ 1912 г. стоимость 1 кг техническаго алюминія — металла составляла около 50—70 коп., и за годъ было получено алюминія 50 милліоновъ килограммовъ2).
Неорганическая химія. Выдающіяся научныя работы въ области неорганической химіи имћютъ въ Россіи характеръ періодическихъ явленій. Въ началћ XIX вћка химики Западной Европы были поглощены выработкою аналитическихъ методовъ, установленіемъ стехіометрическихъ отношеній и эквивалентныхъ (атомныхъ) вћсовъ элементовъ,— въ Россіи же отсутствуютъ представители этого направленія. Неорганическая химія или самостоятельныя {553} работы въ этой области какъ бы обусловлены четырьмя случайными причинами: въ 30ые годы открытіемъ платины въ Сибири, около 1870 г. появленіемъ періодической системы Менделћева, въ концћ XIX вћка комплексными соединеніями и теоріею Вернера и, наконецъ, новыми методами изученія металлическихъ сплавовъ.
Платина и платиновые металлы. Въ 1819 г. на Уралћ, въ дачћ Верхъ-Исетскихъ заводовъ, а въ 1825 г. въ дачћ Нижне-Тагильскихъ заводовъ было открыто „бћлое золото”, или платина, и платиновые минералы. Это открытіе представляетъ одинъ изъ яркихъ примћровъ возникновенія въ странћ цћлой серіи научныхъ изслћдованій и весьма важныхъ открытій въ зависимости отъ природы, т. е. отъ случайной встрћчи въ данной странћ опредћленныхъ природныхъ продуктовъ. Выше мы упоминали о трудахъ графа Мусина-Пушкина, перваго русскаго химика, изслћдовавшаго платину (1797-1804). Съ момента открытія русской платины, однако, число русскихъ изслћдователей увеличивается съ поразительной быстротою.
Первое описаніе новыхъ открытыхъ металловъ осмія, иридія, родія и палладія далъ профессоръ Харьковскаго Университета И. Гизе въ 1809 г. (Mem. Soc. des Natural, de Moscou, t. II).
Г. Осаннъ (1824-48) подробно изслћдовалъ уральскія платиновыя руды, описалъ три, якобы новыхъ, платиновыхъ элемента и указалъ на нахожденіе платины въ метеорномъ желћзћ. А. Купферъ (1827-30) и М. ф. Энгельгардтъ (1828) дали описаніе мћсторожденія платиновыхъ рудъ на Уралћ; Архиповъ описалъ новый способъ извлеченія золота изъ этихъ рудъ (1827). Г. Гессъ сообщилъ о свойствћ измельченной платины вызывать соединеніе водорода съ кислородомъ (1831). Ф. Гебель изучалъ отношеніе къ муравьиной кислотћ (1834), П. Соболевскій1) (1834) и Тепловъ (1835) {554} дали описаніе добыванія платины и природныхъ богатствъ Россіи; Р. Германъ открылъ и изслћдовалъ минералы иритъ и осмитъ (1836), описалъ тройную соль изъ Os, Ir, Pt (1836), опредћлилъ уралъортитъ и иритъ, какъ новые минералы (1841); М. Якоби измћрилъ электровозбудительную силу элемента Pt—Zn (18401), М. Козицкій сообщилъ о способћ отдћленія Ir въ монетномъ дворћ (1844); К. Клаусъ открылъ элементъ рутеній (1844) и произвелъ свои классическія изслћдованія уральскихъ платиновыхъ остатковъ (родія и др., 184462); Ю. Фрицше сообщилъ о новомъ методћ растворенія осмійиридія (1846) и вмћстћ съ Г. Струве изучилъ османъосміевую кислоту OsO(NO)OH (1846); Раевскій изслћдовалъ производныя зеленой соли Магнуса (1846) и описалъ соединенія платины съ органическими основаніями(1848);Максимиліанъ Герцогъ Лейхтенбергскій открылъ платину въ черномъ анодномъ остаткћ при электролизћ CuSO4 (1847); П. Евреиновъ описалъ черную двойную соль К—Іr—Сl (1849) и способы покрытія желћза и мћди платиною (1853); А. Бутлеровъ описалъ окислительное дћйствіе осміевой кислоты на органическія тћла (1851); Скобликовъ сообщилъ о новыхъ иридистоаммоніевыхъ основаніяхъ и соляхъ(1852); I. Якоби издалъ монографію о новыхъ соединеніяхъ осмія (1863, Спб.); Г. Драгендорфъ предложилъ ІrСl3 и RuCl3, какъ новые реактивы на алкалоиды (1866); В. фонъ-Шнейдеръ1) предложилъ новый способъ отдћленія иридія отъ другихъ Pt металловъ посредствомъ дробнаго возстановленія водородомъ (1867-8); Шнейдеръ далъ (1871) также методъ полученія чистой платины изъ смћси платиновыхъ металловъ, въ видћ многохлористыхъ соединеній, при нагрћваніи съ избыткомъ ћдкаго натра: всћ металлы, кромћ платины, переходятъ въ низшіе хлориды, не осаждаясь посредствомъ NH4Cl, и лишь хлористая платина осаждается послћдней солью; К. Дьяконовъ нашелъ новыя соединенія ціанистой платины съ бћлками (1868); П. Овсянниковъ описалъ дћйствіе осміамовыхъ соединеній на животныя ткани (1869); К. Лисенко опредћлилъ количество водорода въ водородистомъ палладіи (1871); Ф. Точинскій изучилъ новыя соли бериллія съ ціанистой платиной (1871); М. Зайцевъ примћнилъ адсорбированный {555} палладіемъ водородъ для возстановленія органическихъ соединеній (1872); С. Кернъ описалъ реакціи солей палладія съ роданистыми солями и іодомъ (1875) и металлическимъ магніемъ (1876), а также металлъ девій, открытый имъ въ уральскихъ платиновыхъ рудахъ (1877); Г. Вырубовъ далъ кристаллографическое описаніе новыхъ комплексныхъ солей платины (1877); Н. Бекетовъ опредћлилъ теплоемкость водорода въ водородистомъ палладіи (1878); Ќ. Вильмъ1) далъ новые экспериментальные матеріалы къ платиновымъ металламъ (1880); онъ получилъ новыя комплексныя соли родія, напримћръ, R2Cl6.4NH3.2Н2O, изучилъ отдћленіе платины отъ родія, выдћленіе чистаго палладія въ видћ PdCl2.2Н2O, получилъ закись палладія PdO (1892) и т. д.; въ 1883 г. онъ сообщилъ о новомъ платиновомъ металлћ; Ф. Бейльштейнъ указалъ на потерю вћса платиновыхъ тиглей при нагрћваніи (1880); А. Чириковъ работалъ надъ примћненіемъ палладія для опредћленія водорода (1881), a A. Судаковъ примћнилъ для той же цћли палладій-асбестъ (1886); Д. Коноваловъ разсмотрћлъ роль платины, какъ контактнаго вещества, въ явленіяхъ диссоціаціи (1885); П. Вальденъ опредћлилъ молекулярный вћсъ хлоро- и ціаноплатиновыхъ солей и кислотъ (1888); А. Кракау измћрилъ электропроводность и упругость диссоціаціи водородистаго палладія (1892-5); сћрнистыя соединенія палладія составили предметъ работы П. Петренко-Критченко (1893), a новыя комплексныя платиновыя основанія (съ сћрнистой мочевиною) были добыты Н. Курнаковымъ (1893-5).
Въ 1897 г. Г. Тамманъи фонъ-Буксгевденъ изслћдовали гидратную соль платино-синеродистаго магнія, измћняющую непрерывно содержаніе воды, сохраняя, однако. однородность и прозрачность кристалла. Н. С. Курнаковъ наблюдалъ (1897-8) тотъ же важный фактъ на хлорокобальтатћ лутео-этилендіамина. Новыя комплексныя соединенія платины и палладія (гліоксимины) были открыты Л. А. Чугаевымъ (начиная съ 1905 г.); имъ же были изучены платиновые комплексы съ пропилендіаминомъ (1909 и слћд.); В. Я. Бурдаковъ (1910) изучалъ кристаллгидраты хлористыхъ солей платино- и палладодіамина и наблюдалъ также фактъ непрерывнаго измћненія состава съ сохраненіемъ внћшней индивидуальности. Другія {556} комплексныя платино-соли были изучены Остромысленскимъ и Бергманомъ (1910). Сплавы платины съ желћзомъ изучалъ Г. Тамманъ (1907), съ оловомъ Подкопаевъ (1908), съ свинцомъ Пушинъ и Лащенко (1909). Въ 1906 г. С. А. Фокинъ началъ свои превосходныя систематическія изслћдованія о гидрированіи органическихъ (этиленовыхъ) соединеній въ присутствіи палладія или платины, а равно рутенія, родія и осмія; олеиновая кислота, напримћръ, присоединяетъ водородъ въ присутствіи платиновой черни уже при обыкновенной температурћ; съ 1908 г. Фокинъ перешелъ къ изслћдованію окислительныхъ реакцій въ присутствіи платины и другихъ металловъ. Въ 1911 г. Н. Зелинскій началъ изслћдованіе дегидрогенизаціи и избирательнаго катализа посредствомъ палладія. Въ 1913 г. Ю. Залкиндъ приступилъ къ изслћдованію гидрированія ацетиленовыхъ соединеній (гликолей) посредствомъ катализатора платины.
Остановимся на К. Клаусћ и открытомъ имъ элементћ рутеніи. Карлъ Карловичъ Клаусъ родился въ 1796 г. въ городћ Юрьевћ(Дерптћ); четырнадцати лћтъ онъ поступилъ ученикомъ въ одну изъ петроградскихъ аптекъ, сдалъ экзаменъ на званіе аптекарскаго помощника, а затћмъ провизора; въ 1826 г. онъ открылъ въ Казани собственную аптеку. Однако, уже въ 1831 г. мы встрћчаемъ его въ Дерптскомъ Университетћ, въ качествћ ассистента при химической лабораторіи; здћсь онъ пополнилъ свое ботаническое и химическое образованіе и получилъ степень кандидата и магистра философіи (1837). Въ 182734 гг. онъ участвовалъ въ качествћ ботаника въ научныхъ экскурсіяхъ по Заволжскимъ степямъ. Въ 1837 г. Клаусъ былъ назначенъ адъюнктомъ химіи въ Казанскомъ Университетћ, гдћ онъ завћдывалъ химической лабораторіею; въ 1839 г. назначенъ экстраординарнымъ и потомъ (1844) ординарнымъ профессоромъ химіи; здћсь же онъ пріобрћлъ докторскую степень (диссертація: Химическое разложеніе Сергіевскихъ минеральныхъ водъ» 1839). Въ 1840 г. онъ началъ изслћдованіе платиновыхъ рудъ, получивъ при содћйствіи графа Канкрина большой запасъ матеріала изъ монетнаго двора; въ 1844 г. онъ открылъ рутеній. Упомянемъ мимоходомъ, что тотъ же графъ Канкринъ передалъ также Берцеліусу 1/2 фунта платиноваго песка и этимъ способствовалъ появленію классическаго Берцеліусова изслћдованія русскихъ платиновыхъ рудъ (1828).
Значительное количество платиноваго песка было передано также Осанну въ Дерптћ и Александру Гумбольдту, который вручилъ {557} матеріалъ Лодье въ Парижћ. Этой щедрой раздачей платиновыхъ рудъ русское правительство оказало существенныя услуги химической наукћ вообще, которая обязана ему такимъ образомъ почти всћми обширными научными изслћдованіями того времени, посвященными платинћ и ея спутникамъ. Первая работа Клауса „О платинћ и платиновыхъ остаткахъ” появилась въ 1844 г. (Bullet, phys. math., т. Ill, 38, Акад. Наукь въ Петроградћ).
Первое сообщеніе о рутеніи, въ формћ письма на имя академика Гесса, было доложено Академіи Наукъ 13го сентября 1844 (Bullet. III, 311—315) и въ болће подробной формћ 25го октября 1844 (Bullet., III, 353—371). Одновременно Клаусъ выпустилъ брошюру: „Химическое изслћдованіе остатковъ уральской платиновой руды и новаго металла рутенія”. Казань, 1844.
Какъ встрћтилъ ученый міръ эту вћсть о новомъ русскомъ элементћ? Вотъ что пишетъ по этому поводу самъ Клаусъ: „Это открытіе, сдћланное на границћ Европы и Азіи, разсматривалось химиками съ большимъ недовћріемъ, потому что авторъ его былъ еще мало извћстенъ и имћлъ смћлость исправить нћкоторые факты великаго Берцеліуса, и, кромћ того, самъ Берцеліусъ заявилъ, по полученіи пробы новаго металла отъ автора, что это — нечистая проба иридія”. Но съ другой стороны сейчасъ же появились претенденты, приписывавшіе себћ славу открытія рутенія еще д о Клауса. Такъ, напримћръ, Осаннъ заявилъ (1845), что рутеній Клауса не что иное, какъ открытый Осанномъ въ 1828 г. полинъ; но уже Берцеліусъ показалъ, что этотъ „полинъ”, а равно „рутеній” Осанна состояли изъ смћси кремнезема, титановой кислоты, цирконовой земли и окисловъ иридія, а самъ Клаусъ (Bullet. V, 182 — 186, 1845) энергично возсталъ противъ претензій Осанна; въ новой работћ (1846) онъ далъ дальнћйшіе матеріалы, относящіеся къ свойствамъ чистаго рутенія сравнительно съ иридіемъ (Bullet. V, 241—262). Скоро и Берцеліусъ отказался отъ своего взгляда. убћдившись въ правильности данныхъ Клауса, и далъ для рутенія новыя реакціи. Императорская Академія Наукъ отнеслась съ полнымъ довћріемъ къ открытію рутенія и, на основаніи отзыва, составленнаго академиками Гессомъ и Фрицше, присудила Клаусу полную Демидовскую премію (1000 p.). Изученію платиновыхъ металловъ, въ частности рутенія, иридія, родія и осмія Клаусъ посвятилъ 20 лћтъ своей жизни, опубликовавъ рядъ отдћльныхъ статей и монографій. Всћ его научные интересы были сосредоточены на этомъ вопросћ, несмотря на перемћну {558} мћста и рода дћятельности; въ 1851 г. онъ оставилъ Казанскій Университетъ и снова перећхалъ въ Дерптскій Университетъ, на каќедру фармаціи, — здћсь онъ умеръ въ 1864 г. Послћднія его работы еще касались высшихъ окисловъ рутенія (1859), солей рутенія (1861), окисей и солей родія (1860) и осмія (1863). Подъ редакціею А. М. Бутлерова и по порученію Академіи Наукъ въ 1883 г. былъ изданъ неоконченный посмертный трудъ Клауса1), найденный среди рукописей ея членакорреспондента, подъ заглавіемъ : Fragment einer Monographie des Platins und der Platinmetalle. Petersburg, 1883.
Изъ приведеннаго списка изслћдованій, произведенныхъ русскими учеными впродолженіе одного столћтія въ области платиновыхъ металловъ, нетрудно убћдиться, что эта группа металловъ дала замћчательно обильную научную жатву, дћйствуя съ начала XIX вћка по настоящее время какъ бы въ родћ катализатора также въ царствћ духовныхъ реакцій, вызывая все новыя изслћдованія и доставляя постоянно новые неожиданные результаты.
Но, несмотря на открытые въ этой группћ 6 самостоятельныхъ элементовъ, врядъ ли будетъ правильно утверждать, что въ данную минуту намъ извћстны всћ существующіе платиновые металлы. Имћется цћлый рядъ указаній, нуждающихся въ точной провћркћ или заслуживающихъ таковой, такъ какъ вопросъ идетъ о замћченныхъ новыхъ или еще недостаточно изслћдованныхъ, а частью и мнимыхъ элементахъ, обнаруженныхъ опытными изслћдователями то въ платиновой рудћ, то въ другихъ рћдкихъ минералахъ. Приведу хронологическій списокъ этихъ элементовъ:
Vestium, который былъ обнаруженъ въ платиновой рудћ А. Снядецкимъ въ 1808 г. (профессоръ химіи въ Виленскомъ Университетћ), — вћроятно рутеній. {559}
Pluranium, Ruthenium и Polonium, три новыхъ платиновыхъ элемента Г. Осанна (1826-8), изъ нихъ, однако, рутеній и его окиси и „полинъ” составляли (по Берцеліусу) смћси SiO2, TiO2, ZrO2 и окиси иридія, а плуранъ (no Берцеліусу) — окись новаго еще неизвћстнаго элемента. По Клаусу вопросъ о плуранћ является еще открытымъ: „плуранъ еще теперь является нерћшенной проблемою химіи”, писалъ Клаусъ передъ своей смертью.
Ilmenium — металлъ ильменій, земли котораго были впервые въ 1845 г. выдћлены въ ніобатахъ Ильменскихъ горъ Р. Германомъ; впослћдствіи, съ 1865 до 1870 г., Германъ отстаивалъ индивидуальность ильменія противъ Мариньяка [Journ. prakt. Ch. 95, 65, 99, 21, 103, 127; 110, 108 (1870)].
Neptunium — новый элементъ, признанный P. Германомъ въ 1877 г. въ колумбитћ и ферроильменитћ (Journ. pr. Ch. 123, 105. 1877).
Davyum — элементъ девій, по утвержденію С. Керна открытый въ платиновой рудћ съ острова Борнео, въ 1877 г. (Журн. 9, 294, 343).
При анализћ платиновыхъ рудъ Ќ. Вильмъ (1883. Журн. 15, 361) получилъ элементъ, реакціи котораго не соотвћтствовали реакціямъ извћстныхъ элементовъ.
К. Д. Хрущовъ наблюдалъ (1887) при анализћ „монацитовыхъ песковъ” изъ Сћверной Каролины, новый элементъ руссій (эквивалентный вћсъ 70.5), спектръ котораго характеризуется группою зеленыхъ и фіолетовыхъ линій (Журн. 29, 206. 1897). Далће онъ разложилъ (ibid., 1897):
церій на фракціи съ атомнымъ вћсомъ 138—156.5.
дидимъ (кромћ празео- и неодима Ауэра) еще на третій компонентъ „глаукодимъ”, вслћдствіе синеватой окраски солей, и
иттрій съ атомнымъ вћсомъ 85—89.
Новые элементы, существованіе которыхъ точно установлено русскими учеными:
Рутеній, открытый К. Клаусомъ (1844).
Уранъ-Y, промежуточный продуктъ дезинтеграціи урана, открытый Г. Антоновымъ (1911-3); существованіе урана-Y было подтверждено работами Содди и Гана (1914).
| {560} |
Дальнћйшее развитіе ученія о химическихъ элементахъ неразрывно связано съ возникновеніемъ періодической системы элементовъ и съ именемъ Дмитрія Ивановича Менделћева. Въ связи съ этимъ смћлымъ научнымъ обобщеніемъ находится возрожденіе неорганической химіи въ концћ XIX вћка.
Блестящіе успћхи органической химіи, неожиданные и технически столь цћнные синтезы этой отрасли химіи сдћлали одно время органическую химію модной и излюбленной отраслью, на которой сосредоточивались всћ интересы и къ которой тяготћли химики. Но въ продолженіе десятилћтія 1875-86 стали очевидными успћхи Менделћевской системы, благодаря открытію предсказанныхъ Менделћевымъ въ 1870 г. трехъ новыхъ элементовъ: экаалюминія, экабора и экакремнія. Послћ этого чрезвычайно возросъ научный интересъ къ этой системћ и къ неорганической химіи, давшей возможность сдћлать такія предсказанія: вћдь до этого періода только астрономія могла гордиться такими научно обоснованными предсказаніями, подтвердившимися наблюденіемъ! Періодическая система непосредственно вызвала возникновеніе особаго научнаго журнала по неорганической химіи, основаннаго Крюссомъ въ 1892 г. (Zeitschrift fur anorganische Chemie), особыхъ каќедръ и лабораторій по неорганической химіи въ нћкоторыхъ заграничныхъ университетахъ и т. д.
Въ 1895 г. знаменитый Викторъ Майеръ назвалъ періодическую систему „краегольнымъ камнемъ новой неорганической химіи”, и еще въ 1908 г. Б. Браунеръ писалъ о періодической системћ, что „ею Менделћевъ основалъ новую неорганическую химію, которая во второй половинћ своего существованія получила сильный импульсъ со стороны физической химіи”.
Д. И. Менделћевъ родился въ 1834 г. въ г. Тобольскћ; по окончаніи Тобольской гимназіи, пятнадцати лћтъ отъ роду, онъ былъ отвезенъ матерью въ Петроградъ для поступленія въ Медико-хирургическую Академію; однако, присутствуя при вскрытіи трупа, онъ упалъ въ обморокъ и вслћдствіе непригодности къ врачебной карьерћ перешелъ въ Главный Педагогическій Институтъ. Здћсь, на физико-математическомъ факультетћ, онъ изучалъ физику у профессора Ленца, химію у Воскресенскаго, математику у Остроградскаго. Окончивъ курсъ наукъ (1855), онъ былъ назначенъ учителемъ гимназіи въ Симферополћ, затћмъ въ Одессћ. Однако, уже въ 1856 г. онъ {561} возвращается въ Петроградъ, для сдачи экзамена на степень магистра химіи; осенью онъ представляетъ и защищаетъ свою диссертацію „объ удћльныхъ объемахъ” и назначается приватъ-доцентомъ химіи при Петроградскомъ университетћ; здћсь онъ читаетъ лекціи по теоретической и органической химіи. Въ 1859 г. наступаетъ перерывъ въ учебной дћятельности Д, И., вслћдствіе заграничной командировки для дальнћйшаго усовершенствованія у научныхъ свћтилъ Бунзена и Кирхгоффа въ Гейдельбергскомъ университетћ. Здћсь сразу сказалась самостоятельность Д. И.: вмћсто того, чтобы заниматься у Бунзена, Менделћевъ занимался у самого себя, въ собственной крошечной лабораторіи!
О цћляхъ своихъ научныхъ работъ Д. И. пишетъ слћдующимъ образомъ въ письмћ на имя Л. Н. Шишкова (1859 г.):
„Сущность же вопроса, меня интересующаго теперь, состоитъ изъ нћсколькихъ тћсно связанныхъ частей. Съ одной стороны, хотћлось бы приложить, если возможно, механическую теорію теплоты къ опредћленію отношенія между расширеніемъ и сцћпленіемъ или, по крайней мћрћ, увидать, приложима ли она здћсь. Съ другой стороны, желательно найти истинную мћру для сцћпленія жидкости и найти зависимость отъ вћса частицъ”.
Рћшенію этихъ намћченныхъ вопросовъ посвящены тћ четыре работы, которыя являются плодомъ его уединенной научной дћятельности въ Гейдельбергћ (1859-61). Въ первой и второй онъ даетъ измћренія удћльнаго сцћпленія нћкоторыхъ органическихъ жидкостей и вводитъ понятіе о молекулярномъ сцћпленіи M.а2.d (M молекулярный вћсъ, а2 удћльное сцћпленіе, d плотность при 15°), отыскивая связь между послћднимъ и химическимъ составомъ тћлъ1). Третья работа, появившаяся также въ 1860 г., касается расширенія гомологическихъ жидкостей, а четвертая, являясь естественнымъ продолженіемъ предыдушихъ, носитъ названіе: „О расширеніи жидкостей отъ нагрћванія выше точки кипћнія” (1861). Послћдняя работа является фундаментальной, т. е. одной изъ тћхъ, которыя открываютъ наукћ новые горизонты, какъ съ теоретической, такъ и съ экспериментальной точки зрћнія. Въ ней сообщается новая и смћлая идея, дается новый физическій {562} терминъ и вводится для жидкостей новая физическая константа: абсолютная точка кипћнія,— для каждой жидкости существуетъ такая температура абсолютнаго кипћнія, выше которой она существуетъ только, какъ паръ, независимо отъ давленія и объема; при этой температурћ сцћпленіе = 0 и скрытая теплота испаренія = 0. Какъ извћстно, лишь въ 1869 г. появились изслћдованія Эндрюса, давшія рядомъ съ экспериментальнымъ матеріаломъ и терминъ „критическая температура”.
Въ 1861 г. Менделћевъ вернулся въ Петроградъ и возобновилъ свою дћятельность въ университетћ; въ 1864 г. онъ былъ утвержденъ профессоромъ химіи въ петроградскомъ Технологическомъ институтћ. Въ 1865 г. онъ защитилъ свою диссертацію на степень доктора химіи, а въ декабрћ того же года онъ уже состоитъ ординарнымъ профессоромъ первоначально технической, a съ 1867 г. чистой (неорганической) химіи въ Петроградскомъ университетћ. Въ этой должности онъ состоялъ безпрерывно до 1890 г., когда, по выслугћ 35 лћтъ, былъ уволенъ. Послћ увольненія изъ университета Д. И. занимается составленіемъ „Толковаго Тарифа” (18912), выработкою бездымнаго пороха для русской арміи и т. д., а въ 1892 г. онъ переходитъ на новую службу, въ Главную Палату Мћръ и Вћсовъ, въ качествћ завћдывающаго и организатора; на этой службћ онъ состоялъ до конца своей жизни. Онъ скончался отъ разрыва сердца 20 января 1907 г. въ Петроградћ1).
Приведемъ перечень главнћйшихъ научныхъ трудовъ Д. И. Менделћева: {563}
1854. Химическій анализъ ортита изъ Финляндіи.
1855. Изоморфизмъ въ связи съ другими отношеніями формы къ составу (Горн. Журн.).
1856. Удћльные объемы. Диссертація на степень магистра. 224 стр.
1858. О связи нћкоторыхъ физическихъ свойствъ тћлъ съ ихъ химическими реакціями (Изв. Имп. Акад. Н.).
1860. О сцћпленіи нћкоторыхъ жидкостей (Химич. Журн. 3 и 4); здћсь уже встрћчается понятіе „абсолютная температура кипћнія”.
1860. Замћтка о расширеніи гомологическихъ жидкостей (Lieb. Ann. 114, 165).
1861. О расширеніи жидкостей отъ нагрћванія выше точки кипћнія („абсолютная точка кипћнія”) (Lieb. Ann. 119, 1—11. Pogg. Ann. 141, 618 (1870)).
1861. Органическая химія. Спб. 502 стр. II изд. 1863.
1865. О соединеніи спирта съ водою. Диссертація на степень доктора химіи. Спб. 119 стр. (начало гидратной теоріи).
186871. Основы химіи, въ 2 томахъ, 816 + 951 стр.
1869. (6 марта). Связь между свойствами и атомнымъ вћсомъ элементовъ (Ж. 1, 35, 60—77, 229). (Первая формулировка „періодической системы элементовъ”).
1870. (3 декабря). Естественная система элементовъ и примћненіе ея къ указанію свойствъ нћкоторыхъ элементовъ {564} (Ж. 3, 7, 25—56, см. также Ж. 2, 14, 91; Изв. Имп. Акад. Н. 16, 45; Ж. 5, 119; 7, 316; 11, 86; 13, 516; 18, 66; 21,233—257; 27, 69, 508. Bed. Ber. 13, 1796).
1871. О періодической законности химическихъ разрядовъ (Lieb. Ann. Supplem. 8, 133—229).
1872. Начало изслћдованій о сжимаемости газовъ.
О пульсирующемъ воздушномъ насосћ (совмћстно съ М.Кирпичевымъ и Г. Шмидтомъ). Ж. 4, 139—204.
О сжимаемости газовъ. Ж. 4, 102—103, 309—352.
1875. Объ эластичности газовъ. I часть, I—XVI, 1—263 стр. Спб.
О коэффиціентахъ расширенія газовъ (совмћстно съ Н. Каянде. ромъ), Ж. 7, 316, II, 323; 8, II, 287.
О сжимаемости газовъ (совмћстно съ I. Богускимъ и съ В. Гемиліаномъ). Annal. chim. phys. (5), 9, 111.
1877. O настоящемъ коэффиціентћ расширенія газовъ (совмћстно съ Н. Каяндеромъ). Ж. 9, 11, II, 215.
1881. Объ опытахъ надъ упругостью газовъ. Труды Импер. Техн. Общ., 1881, 25 стр.
1877. О происхожденіи нефти (карбидная теорія). Ж. 9, 36.
Нефтяная промышленность въ СћвероАмер. Штатћ. Пенсильваніи и на Кавказћ. 304 стр.
О перегонкћ Бакинской нефти, Ж. 13, 454; изслћдованіе дистиллятовъ нефти, Ж. 14, 54, 54—56, 199; 15, 3, 189, 270, 367.
1880. О сопротивленіи жидкостей, Ж. 12, XV; 14, 199, II, 209.
1884. О расширеніи жидкостей (модуль расширенія V = 1/(1—kt). Ж. 16, 110; II, 282, 475.
Объ отношеніи модуля расширенія къ критической температурћ жидкостей, Ж. 16, 452.
1884-7. Изслћдованіе удћльнаго вћса растворовъ (гидратная теорія).
1884. Замћтка о сжимаемости растворовъ, Ж. 16, 93.
О связи между удћльнымъ вћсомъ растворовъ и молекулярнымъ вћсомъ растворенныхъ солей, Ж. 16, 184.
Объ удћльномъ вћсћ нормальнаго гидрата Н2СО4 Ж. 16. 455; 18, 4, 64; 19, 242 (и ассоціаціи сћрной кислоты съ водою).
1887. Изслћдованіе водныхъ растворовъ по удћльному вћсу, Спб. I—XXII, 521 стр. {565}
1888. Каменный уголь Донецкаго бассейна:
О поћздкћ по Донецкой области, Ж. 20, 536.
Будущая сила, покоящаяся на берегахъ Донца.
О мћрахъ для развитія Донецкой каменноугольной промышленности.
1889. Два лондонскихъ чтенія. Попытка приложенія къ химіи одного изъ началъ естественной философіи Ньютона и періодичеческая законность химическихъ элементовъ. Спб. (II изданіе 1895).
1891-2. Толковый тарифъ. Спб. 720 стр.
1894. О вћсћлитра воздуха. Врем. Глав. Пал. Мћръ и Вћсовъ, 1.
1895. Вћсъ опредћленнаго объема воды; тамъ же, II.
Объ измћненіи удћльнаго вћса воды при нагрћваніи отъ 0° до 30°; тамъ же, II.
Ходъ работъ по возобновленію прототиповъ мћръ длины и вћса; тамъ же, II.
1897. Основы фабричнозаводской промышленности. Вып. I.
1898-9. Опытное изслћдованіе колебанія вћсовъ.
1899-900. Календарное объединеніе.
1900. Уральская желћзная промышленность въ 1899.
1902. Попытка химическаго пониманія міроваго эфира (II изд. 1905, Спб.).
1904-5. Завћтныя мысли. Спб. 428 стр.
1906. Къ познанію Россіи (Дополненіе: 1907).
1907. Подготовка къ опредћленію абсолютнаго напряженія силы тяжести въ Главной Палатћ Мћръ и Вћсовъ. В. Гл. П. М. и В., VIII.
Узкія рамки нашей краткой исторіи не позволяютъ намъ вдаваться въ разсмотрћніе содержанія и значенія всћхъ многочисленныхъ трудовъ Менделћева; на I Менделћевскомъ съћздћ (1907) потребовалось для этой цћли болће десятка ученыхъ-спеціалистовъ (см. выше). Отмћтимъ лишь немногіе изъ всего числа его печатныхъ трудовъ (полный перечень данъ мною въ указанной выше біографіи Д. И.). Его классическое руководство неорганической (общей) химіи, „Основы химіи”, вышло въ восьми изданіяхъ; на немъ воспитывалось нћсколько поколћній молодыхъ химиковъ и натуралистовъ (съ 1868-9 по 1906 г.), проникаясь философскимъ и критическимъ духомъ великаго автора „Основъ”.
Его докторская диссертація „О соединеніи спирта съ водою” (1865) нашла свое продолженіе и теоретическое расширеніе въ {566} капитальномъ трудћ: „Изслћдованіе водныхъ растворовъ по удћльному вћсу” (1887), представляющемъ настоящій standard work гидратной теоріи растворовъ. Его изслћдованія газовъ и однородныхъ жидкостей, начатыя въ 1860 г. и продолжавшіяся до 1884 г., привели его къ открытію температуры абсолютнаго кипћнія (критической температуры) въ 1861 г., къ изслћдованію расширенія газовъ (1872-81) и къ открытію модуля расширенія жидкостей (1884). Но самой выдающейся изъ его работъ, сдћлавшей его имя однимъ изъ популярнћйшихъ въ Россіи и создавшей его славу въ химической наукћ вообще, является періодическая система химическихъ элементовъ. Въ главнћйшихъ своихъ чертахъ она была изложена 6 марта 1869 г., а въ законченной формћ она появилась въ августћ 1871 г. Первое приложеніе она получила въ „Основахъ химіи”, въ которыхъ еще и въ настоящее время можно найти самое авторитетное и всестороннее освћщеніе этой системы самимъ ея творцомъ. Нынћ же значеніе періодической системы Менделћева является настолько общепризнаннымъ и ея примћненіе настолько общимъ во всћхъ учебникахъ и руководствахъ по неоргаческой химіи, на всћхъ языкахъ, что въ этомъ очеркћ будетъ излишнимъ останавливаться на деталяхъ.
Что касается вопроса о пріоритетћ, то таковой былъ подробно разобранъ мною въ біографіи Д. И. Менделћева. Здћсь мы ограничимся лишь приведеніемъ мнћній нћсколькихъ авторитетныхъ европейскихъ ученыхъ. Напомнимъ, что пріоритетъ открытія періодической системы Менделћевымъ оспаривался, главнымъ образомъ Ньюландсомъ и Лотаромъ Мейеромъ. Ихъ имена и заслуги должны быть отмћчены въ исторіи химіи. „Но главная заслуга безспорно принадлежитъ... Менделћеву, впервые выдћлившему въ общей формћ эти зависимости и, что особенно важно, выяснившему преимущества подобнаго метода разсмотрћнія” (А. Ладенбургъ). А англійскій ученый Паттисонъ Мюръ пишетъ (1907), что подробное изслћдованіе Менделћева о періодической системћ (1871) „is one of the most important contributions ever made to the advancement of accurate knowledge of natural phenomena... Mendeleeff's memoir of 1871 remains the foundation, and also the elucidation of the periodic classification of the homogeneous substances” (есть одинъ отъ важнћйшихъ вкладовъ, когда-либо сдћланныхъ для споспћшествованія точнагопознаніяестественныхъ явленій... Менделћевскій мемуаръ 1871 г. остается основой и ключомъ классификаціи гомогенныхъ веществъ). Приведемъ еще слова сэра М. А. {567} Тильдена, которыми онъ заключаетъ свое „Mendeleeff Memorial Lecture” (1909): „...The name of Mendeleeff will be for ever preserved among the Fathers or Founders of Chemistry” (Имя Менделћева сохранится навсегда между отцами и основателями химіи).
На основаніи періодической системы самъ Д. И. Менделћевъ въ 1871 г. предсказалъ новые элементы (Ж. 3, 34 и слћд.):
Экаборъ — оказался тождественнымъ со скандіемъ Нильсона (1879); экаалюминій — идентиченъ съ элементомъ галліемъ, открытымъ въ 1875 г. Лекокъ-де-Буабодраномъ; экакремній — элементъ германій, открытый въ 1886 г. Винклеромъ.
Далће: |
экацезій (Ес=175) и двицезій (Dc = 220) эканіобій (= 146), экатанталъ (=235), экамарганецъ ( = 100), тримарганецъ (=190). двиборъ. |
Въ 1889 онъ же предсказываетъ еще (въ трудћ „Два лондонскихъ чтенія”):
двителлуръ (Dt = 212).
Въ 1905 г. („Попытка химическаго пониманія мірового эфира”) Д. И. предсказываетъ вћроятное открытіе элемента галоида1) съ атомнымъ вћсомъ около 3; далће, онъ признаетъ свћтовой эфиръ за элементарное вещество (можетъ быть, смћсь элементовъ), „ньютоній”, съ атомнымъ вћсомъ отъ 0.000 000 960 до 0.000 000 052; a въ солнечной коронћ, основываясь на спектрћ, принимаетъ элементъ „короній” съ атомнымъ вћсомъ ≤ 0.4.
По нашему мнћнію нћкоторые изъ этихъ предсказанныхъ элементовъ относятся по всей вћроятности къ группћ радіоактивныхъ и неустойчивыхъ элементовъ; напримћръ, двицезій ( = 220) находится около радія, экатанталъ (= 235) между торіемъ и ураномъ (можетъ быть, уранъ-Х?). Ньютоній по своему атомному вћсу приближается къ электрону; для коронія въ новћйшее время Никольсонъ {568} (1911) принимаетъ атомный вћсъ = 0.513, а однимъ изъ трехъ первичныхъ элементовъ онъ же считаетъ галоидъ протофторъ Pf = 2.3607 (т. е. новый галоидъ Менделћева съ атомнымъ вћсомъ около 3).
Періодическая система Менделћева вошла въ составъ библіотеки классиковъ точныхъ наукъ” (№ 68), издаваемой В. Оствальдомъ въ Лейпцигћ. Эта система явилась исходной точкою для нћсколькихъ сотъ ученыхъ мыслителей, пытавшихся дать новую группировку элементовъ и искавшихъ новыя закономћрности и т. д. Она создала цћлую литературу, посвященную изложенію и разбору этихъ періодическихъ системъ, напримћръ, F. P. Venable, The Development of the Periodic Law (1895), G. Rudorf, Das Periodische System (1904).
Изъ числа русскихъ ученыхъ, принявшихъ участіе въ развитіи, объясненіи или измћненіи періодической системы элементовъ, ириведемъ слћдующія имена:
1870. А. Троицкій.
1885-6 В. Ранцовъ, 1887 Ф. Флавицкій, 1888 Б. Чичеринъ подробно разработанная система), 1887 А. Базаровъ, 1896 И. Шенрокъ.
Вполнћ оригинальную теорію образованія химическихъ элементовъ далъ Н. Морозовъ въ своемъ обширномъ трудћ: „Періодическія системы строенія вещества” (Москва, 1907). Эта теорія интересна по внћшнимъ условіямъ возникновенія и замћчаіельна по самостоятельности и смћлости изложенія, но нуждается въ экспериментальной разработкћ и провћркћ.
Въ рамкахъ существующихъ системъ лежатъ періодическія системы Ю. Радика (1901) и Э. ф. Штакельберга (1911), имћющія своей цћлью цать болће раціональную группировку элементовъ.
Интересную попытку толкованія періодическаго закона недавно предпринялъ С. Войничъ-Сяноженцкій (1912), приложившій къ нему положенія теоріи резонанса и сравнившій естественную систему элементовъ съ музыкальной гаммою; такимъ образомъ, онъ возвращается къ идећ Ньюландса объ октавахъ и даетъ подробно разработанную теорію.
Въ заключеніе приведемъ еще сочиненіе Л. А. Чугаева: „Періодическая система химическихъ элементовъ” (Птр. 1913). Въ этомъ трудћ подробно излагается современное состояніе періодическаго {569} закона и нашихъ знаній объ атомномъ вћсћ элементовъ въ связи съ ихъ химическими и физическими свойствами.
Вопросъ о пассивности металловъ былъ изученъ В. Кистяковскимъ (190610); онъ открылъ (1907) вліяніе движенія на магніевый, алюминіевый, хромовый и желћзный электродъ (мотохимическія и электро-мотохимическія явленія), изучилъ эти явленія и далъ разработку фарадэевской теоріи пленки для явленій пассивности металловъ, періодическихъ и мотохимическихъ явленій и т. д. Періодическія явленія разсматриваются, какъ борьба между аморфнымъ стекловиднымъ состояніемъ пленки окисловъ, покрывающей ихъ сплошнымъ слоемъ и проводящей гальваническій токъ, что соотвћтствуетъ пассивному состоянію металла, — и кристаллическимъ, соотвћтствующимъ активному состоянію.
Измћряя тепловой эффектъ при взаимодћйствіи сћрнокислаго серебра и желћза, Л. Писаржевскій наблюдалъ (1908) непостоянство, которое указываетъ на выпаденіе при этой реакціи вћроятно двухъ (или больше) модификацій сћраго серебра. Изучая скорость растворенія цинка въ кислотахъ, М. Центнершверъ установилъ существованіе недћятельной и активной модификацій цинка съ „періодомъ индукціи” (1914).
Упомянемъ также объ изслћдованіяхъ В. Курбатова, касающихся теплоты испаренія и удћльной теплоты ртути (1903-8), температуры плавленія металловъ (вмћстћ съ И. Жуковымъ, 1908).
Относительно металлоидовъ укажемъ на слћдующіе интересные факты:
Для кристаллическаго іода былъ найденъ полиморфизмъ; В. Курбатовъ установилъ (1908) температуру перехода 46.5° ± 0.5°, a Е. Федоровъ далъ (1905) кристаллографическое опредћленіе обћихъ модификацій. Своебразное отношеніе фосфора къ кислороду (явленія фосфоресценціи) въ зависимости отъ положительныхъ и отрицательныхъ катализаторовъ было изучено М. Центнершверомъ (1898-1913). Коллоидальныя (цвћтныя) модификаціи сћры {570} изслћдовалъ П. ф.-Веймарнъ (1910 и слћд.). Полиморфизмъ твердаго кислорода былъ открытъ В. Валемъ (1913), а температурой перехода оказалась температура въ —227°, принимавшаяся до сихъ поръ за температуру плавленія.
Атомный вћсъ — по физико-химическимъ методамъ и въ лабораторіи Ф. А. Грю — опредћлили: Г. Теръ-Газаріанцъ для хлора (1907) и фосфора (1909), Е. Вурцель для азота (1912) и хлора (1912-3).
Въ 1871 г. Д. И. Менделћевъ высказалъ слћдующее мнћніе: «Законъ сохраненія вћса можно разсматривать, какъ частный случай закона сохраненія силы или движеній. Причину вћса очевидно составляетъ особый родъ движенія вещества, и нћтъ никакой причины отрицать возможность превращенія этихъ движеній въ химическую энергію или въ какой бы то ни было другой видъ движенія». Но тогда принципіально нельзя отрицать возможности обратнаго превращенія энергіи въ матерію. Такое превращеніе могло бы имћть мћсто, напримћръ, при переходћ одного и того же элемента изъ одной атомности въ другую (высшую), изъ одной модификаціи въ другую. Въ результатћ получился бы, можетъ быть, другой атомный вћсъ? Дћйствительно, А. Бутлеровъ уже въ 1881-2 гг. считался съ такой возможностью и предпринялъ опредћленіе атомнаго вћса, при прочихъ равныхъ условіяхъ, краснаго и бћлаго фосфора, а равно ртути, въ видћ двухлористой ртути, полученной дћйствіемъ а) обыкновеннаго хлора, б) хлора, предварительно подвергнутаго дћйствію солнечнаго или магнезіальнаго свћта. По мнћнію Бутлерова могло произойти приращеніе «количества вћсомой матеріи вслћдствіе того, что то, что мы называемъ силою, энергіею, превратилось въ то, что является для насъ веществомъ», т. е. могла произойти матеріализація энергіи, — или абсолютное количество вещества осталось безъ измћненія, но прибылъ его вћсъ вслћдствіе того, что временно увеличилось притяженіе его землею. Прибавимъ, что эти соображенія были подвергнуты Бутлеровымъ и Рицца опытной провћркћ, но, къ сожалћнію, вопросъ остался нерћшеннымъ. Однако, интересно отмћтить тотъ фактъ, что вполнћ {571} независимо В. Рамзай и Астонъ (1897) снова подняли тотъ же вопросъ, исходя изъ предположенія, что, напримћръ, эндотермическія соединенія могутъ содержать элементы съ другимъ эквивалентнымъ вћсомъ, нежели экзотермическія соединенія того же элемента. Съ цћлью провћрки были произведены анализы соединеній азота въ видћ солей азотистоводородной кислоты N3H; полученный атомный вћсъ азота, меньшій въ сравненіи съ атомнымъ вћсомъ азота изъ другихъ солей и т. д., по мнћнію Рамзая (1903) указываетъ на возможность «вліянія рода связи на относительный вћсъ элемента».
Упомянемъ, что Н. Н. Бекетовъ (19039) высказалъ мысль о возможности перехода эфира, при посредствћ радія и гелія, въ вћсомое вещество. — Закончимъ эти умозрительныя соображенія указаніемъ на тотъ фактъ, что О. Хвольсонъ вывелъ изъ термодинамики и ученія Эйнштейна объ относительности формулу μ = E/с2, гдћ μ масса, Е форма энерпи, с скорость свћта; согласно этой формулћ, всякая форма энергіи Е обладаетъ массою, или масса и энергія другъ другу эквивалентны. Масса тћла должна зависћть отъ его температуры. Такъ какъ при всякой химической реакціи происходитъ измћненіе энергіи, напримћръ, выдћленіе или поглощеніе тепла, выдћленіе или поглощеніе лучистой, электрической энергіи и т. д., то параллельно измћняется и масса всей химической системы, или законъ постоянства массъ (или вћса) при химическихъ реакціяхъ оказывается неточнымъ1). Далће, такъ какъ при превращеніи одинаковыхъ массъ, или вћсовыхъ количествъ, напримћръ, краснаго и бћлаго фосфора (содержащихъ различныя количества энергіи), въ одно и то же химическое соединеніе выдћляются неодинаковыя количества энергіи, то полученный взвћшиваніями продуктовъ до и послћ реакцій эквивалентный или атомный вћсъ обћихъ модификацій принципіально долженъ быть неодинаковъ. Этотъ результатъ современной термодинамики, слћдовательно, сходится съ вышеупомянутыми взглядами химиковъ второй половины прошлаго вћка. Принципіально возможное непостоянство массъ при химическихъ реакціяхъ, однако, практически обыкновенно не имћетъ значенія. Возможно, для примћра, соединеніе сильно экзотермическое: 2 г водорода съ 16 г кислорода. Вслћдствіе {572} выдћляюшихся 2.87 × 1012 эрговъ тепла произойдетъ убыль вћса нa 3.2 × 10–6 мг. При классическихъ изслћдованіяхъ Г. Ландольта (1906-10) наибольшая точность взвћшиваній была ±3 × 10–2 мг. Значитъ, обыкновенными способами взвћшиванія мы не можемъ установить убыли въ 3.2 × 10–6 мг. Но не забудемъ, что этотъ лишь временный предћлъ точности взвћшиваній можетъ быть превзойденъ технически. Уже теперь мы обладаемъ микровћсами Рамзая и Грэя (1910), чувствительность и точность которыхъ доведена до ±2 × 10–6 мг; въ этомъ случаћ вышеприведенная убыль на 3.2 × 10–6 мг могла бы быть опредћлена эспериментально, какъ выходящая изъ предћловъ погрћшности. Но не забудемъ, что микровћсы работаютъ съ чрезвычайно малыми количествами, а эта убыль относится къ массћ 2+16=18 граммовъ взятаго вещества!
Чрезвычайно плодотворнымъ изслћдователемъ неорганическихъ соединеній (минераловъ, а въ частности рћдкихъ элементовъ) былъ Г. Р. Германъ, прославившійся также, какъ изобрћтатель ледянаго калориметра (1834).
Германъ родился въ 1805 г. въ Дрезденћ, получилъ фармацевтическое образованіе и въ 1827 г. переселился въ Москву; здћсь онъ устроилъ заведеніе для изготовленія искусственныхъ минеральныхъ водъ, которымъ завћдывалъ до своей смерти (1879 г.). Будучи химикомъ-практикомъ и самоучкою онъ производилъ съ 1829 до 1879 г. въ этой заводской лабораторіи свои многочисленныя цћнныя изслћдованія. Ему принадлежатъ анализы русскихъ минераловъ, въ томъ числћ лаксманита, лавровита, купферита, кокшаровита, багратіонита1), также чернозема; открытіе новыхъ минераловъ: меланохроита, осмита, уралъ-ортита, планерита, ирита, асперолита, ванадіомита и др.; изслћдованіе соединеній цера, лантана, циркона, дидима, ніобія, тантала, титана. Онъ изучалъ минералы, содержащіе эти рћдкія земли, и работалъ надъ отдћленіемъ послћднихъ. Кромћ того, онъ изслћдовалъ {573} Кавказскія минеральныя воды (анализы которыхъ были сдћланы также Зининымъ, Фрицше и другими), интересовался вопросомъ объ удћльныхъ объемахъ элементовъ и органическихъ соединеній, гетеромеріи и гомеоморфизма минераловъ, о химическомъ сродствћ и т. д.
Минералъ MnSiO3 былъ названъ въ честь Германа «германнитомъ» (Kenngott). Онъ указалъ на существованіе двухъ новыхъ элементовъ ильменія и нептунія.
Бериллій и его соединенія были изслћдованы Авдћевымъ (1842); онъ приписалъ окиси бериллія формулу окиси магнія и опредћлилъ атомный вћсъ Ве = 9.26. Извћстно, что взглядъ Авдћева черезъ полвћка оказался правильнымъ. Новыя соли бериллія, а именно платино-ціанистыя и виннокислыя, приготовилъ Ф. Точинскій (магистерская дессертація, Дерптъ, 1871).
Надъ металлическимъ индіемъ работалъ Д. И. Менделћевъ; въ связи съ періодическою системою онъ опредћлилъ для индія мћсто въ третьей группћ (между Аl и Fl) и далъ атомный вћсъ In = 113; съ цћлью провћрки этой величины посредствомъ закона Дюлонгъ-Пти, онъ опредћлилъ (1870) экспериментально теплоемкость индія c = 0.055 (что совпадаетъ съ числомъ Бунзена, нашедшаго c = 0.057), откуда In = A · c/0.055 = 6 · 5/0.055 = 119.
Элементы литій, натрій, калій, рубидій и цезій были изучены Н. Н. Бекетовымъ (частью вмћстћ съ А. Щербачевымъ) впродолженіе 1879-94 гг.; онъ изслћдовалъ ихъ возстановляемость изъ окисей посредствомъ водорода, теплоты образованія окисей и т. д., а равно физическія свойства цезія и солей этого металла.
Тотъ же ученый впервые изучилъ роль алюминія, какъ возстановителя по отношенію къ окисламъ металловъ (1859, 1865 и слћдующйхъ гг.).
Въ новћйшее время Г. П. Черникъ весьма энергично занимался изслћдованіемъ рћдкихъ земель. Имъ были опредћлены составъ и природа церитовыхъ минераловъ изъ Батумской области, кавказскаго фергюсонита (1902), кавказскаго монацитоваго песка (1904) и пирохлора (1909), скандинавскихъ гадолинитовъ (1906), a
равно разновидности иттрогранита, иттроцерита и граната, паризита и малакона, иттротанталита и ортитовъ, графита съ корундомъ и ксенотимомъ, эшинита, магнетита, кнолита, мозандрита и вёлерита, {574} а въ новћйшее время урановыхъ минераловъ съ острова Борнео и минераловъ Цейлонскаго гравія (190414).
Присутствіе аргона въ цирконћ обнаружилъ А. Антроповъ (1908); онъ же опредћлилъ растворимость газовъ ксенона, криптона, аргона, неона и гелія въ водћ (1910).
К. Д. Хрущовъ нашелъ германій въ ніобовыхъ и танталовыхъ минералахъ (1892); онъ приготовилъ синтетически кварцъ (мокрымъ путемъ) и тридимитъ (сухимъ путемъ), роговую обманку, цирконъ, амфиболь и т. д.; онъ же показалъ, что серебро при температурћ кипћнія растворяетъ углеродъ, который при быстромъ охлажденіи выдћляется частью въ видћ алмаза. Упомянемъ здћсь же, что алмазъ былъ впервые найденъ (1887) въ метеорномъ камнћ П. А. Лачиновымъ и М. В. Ерофеевымъ; этотъ метеоритъ состоялъ изъ металлическаго желћза и никкеля (съ кремнеземными породами) и упалъ около выселка Новый Урей (Пензенской губ.). Прибавимъ, что новоурейскій метеоритъ рћзко отличается отъ извћстныхъ метеоритовъ, вслћдствіе чего Ерофеевъ далъ ему названіе урейлита (1888).
Полезное руководство: „Отношеніе важнћйшихъ рћдкихъ земель къ реактивамъ” было составлено I. П. Панаевымъ (Спб. 1909).
Изслћдованія взаимодћйствія между металлами, напримћръ, хромомъ, алюминіемъ, титаномъ, и азотомъ въ зависимости отъ температуры были произведены И. И. Жуковымъ (1910); параллельно онъ изслћдовалъ электропроводность азотистыхъ металловъ.
Въ связи съ азотомъ упомянемъ о новыхъ способахъ приго товленія азоимида N3H: изъ гидразина и хлористаго азота (С. Танатаръ, 1899), разложеніемъ азотнокислаго гидразина (А. Сабанћевъ, 1898) и окисленіемъ смћси солей гидразина и гидроксиламина (Танатаръ, 1902).
Радій, какъ извћстно, былъ открытъ (1898) Маріей Кюри1), урожденной Склодовской. Г-жа Кюри родилась въ 1868 г. въ Варшавћ, гдћ и окончила III женскую гимназію; послћ 6-лћтней {575} дћятельности въ качествћ учительницы въ деревнћ и Варшавћ, она перећхала въ 1891 г. въ Парижъ для изученія физики и математики. Въ 1895 г. вышла замужъ за П. Кюри (умеръ въ 1906 г.). Нынћ состоитъ профессоромъ физики въ Парижскомъ Университетћ. Изъ русскихъ химиковъ пока лишь немногіе принимали участіе въ разработкћ этой вполнћ новой области.
Съ теоретической стороны объяснить свойства радія попытался Н. Н. Бекетовъ (1903-4, 1909), разсматривавшій радій, какъ по средникъ между настоящей вћсомой энергіею и эфиромъ. Съ экспериментальной стороны новыя данныя въ радіохимію внесъ Г. Н. Антоновъ (1910), изслћдовавшій радій D и продукты его превращенія, а равно (1911) распаденіе урана (новый элементъ Ur-Y). Сводку своихъ цћнныхъ изслћдованій Г. Н. Антоновъ далъ въ своей магистерской диссертаціи: „Продукты дезинтеграціи урана” (Птр. 1913), содержащей описаніе методовъ полученія и свойствъ урана-Х и новаго урана-Y. Далће отличился своими работами В. А. Бородовскій (f 1914), который произвелъ не менће цћнныя изслћдованія о „поглощеніи бета-лучей радія” растворами и жидкостями и доказалъ, напримћръ, аддитивный характеръ поглощенія химическими соединеніями (см. его монографію: Поглощеніе β-лучей радія. Юрьевъ, 1910). Имъ же были изучены радіоактивные минералы Ильменскихъ мћсторожденій (эшинитъ, самарскитъ, пирохлоръ, монацитъ, малаконъ и др.) и установлено содержащееся въ нихъ количество активныхъ элементовъ урана и торія.
Э. Свинне далъ новую формулировку связи между скоростью распада и начальной скоростью α-частицъ данной радіосемьи (1912) и примћнилъ принципъ относительности въ радіохиміи (1913).
Интересными и требующими еще дальнћйшей разработки являются изслћдованія Н. Зелинскаго (1912), опредћлившаго абсорбцію ультрафіолетовыхъ колебаній радіоактивными элементами и продуктами ихъ распада. Недавно Н. Розановъ экспериментально доказалъ {576} (1913), что это поглощеніе короткихъ волнъ радіоактивными веществами обусловливается двумя факторами: выдћляемой эманаціей и въ значительной мћрћ перекисью водорода, которая образуется подъ вліяніемъ этой эманаціи. Медицинское значеніе и примћненіе радія было изслћдовано Е. С. Лондономъ, издавшимь трудъ: Das Radium in der Biologie und Medizin (Leipzig, 1912).
Радіоактивность нћкоторыхъ цћлебныхъ грязей изслћдовалъ И. И. Боргманъ (1904-5), кавказскихъ минеральныхъ источниковъ А. П. Соколовъ (1904-5), Э. Э. Керстенсъ (1908), Н. Соколовъ (1911), воздуха Э. Е. Лейстъ, а въ новћйшее время радіоактивность минеральныхъ (сћрнистыхъ) водъ Прибалтійскаго края Р. Свинне (1914), который изучалъ воды непосредственно при выходћ ихъ изъ земли; активность всћхъ водъ оказалась, въ общемъ, незначительной. въ случаћ сћрнистыхъ водъ — ниже одной единицы Махе.
Въ виду выдающихся лечебныхъ свойствъ радія и радіоактивныхъ веществъ вообще, вопросъ о русскихъ мћсторожденіяхъ радіоактивныхъ минераловъ имћетъ крупное значеніе. Еще въ 1909 г. А. П. Соколовъ выступилъ на XII съћздћ естествоиспытателей въ Москвћ (дек. 1909) съ призывомъ ревностно заняться изученіемъ Россіи въ отношеніи ея радіоактивныхъ горныхъ породъ, рудъ, почвъ и т. д.; Императорская Академія Наукъ взяла на себя иниціативу и благодаря правительственной матеріальной поддержкћ организовала соотвћтственныя изысканія, которыя ведутся подъ руководствомъ академика В. И. Вернадскаго.
В. И. подробно разъяснилъ „необходимость изслћдованія радіоактивныхъ минераловъ Россійской Имперіи” (1911) и опубликовалъ статьюрћчь „Радіоактивныя руды въ земной корћ”. Въ новћйшее время (19134) Императорская Академія Наукъ представила правительству новый подробный проэктъ изслћдованія радіоактивныхъ рудъ въ Россіи. К. Егоровъ сообщилъ (1914) уже о находкћ радіоактивныхъ минераловъ на Байкалћ; торіанитовыя розсыпи были открыты (1911) С. Кузнецовымъ и И. Бћлоусовымъ въ Забайкальской области, а въ Ферганской области уже раньше открыты были ванадіевоурановыя соединенія; составъ одной кавказской урановой руды былъ опредћленъ Н. Соколовымъ (1911).
| {577} |
Обстоятельно изслћдованную группу неорганическихъ соединеній составляютъ перекись водорода, металлическія перекиси вообще и продукты соединенія перекиси водорода съ кислотами (см. молекулярныя соединенія). Уже въ 1871 г. Д. Менделћевъ предпринялъ классификацію перекисей, отдћливъ въ особый классъ истинныя перекиси, способныя давать перекись водорода, отъ соединеній, неправильно названныхъ перекисями, напримћръ, марганца, свинца. Въ 1875 г. Э. Б. Шёне открылъ новый классъ соединеній перекиси водорода съ двуокисями щелочныхъ и щелочноземельныхъ металловъ (напримћръ, Na2O2.Н2O2; К2О2.2Н2O2; BaО2.2H2O2) и впослћдствіи изучалъ образованіе перекиси водорода (и озона?) при разнородныхъ химическихъ процессахъ.
В. Куриловъ продолжалъ эти изслћдованія и въ 1890 г. получилъ перекиси цинка, кадмія и магнія; при этомъ оказалось, что способность образовать перекиси у этихъ элементовъ находится въ зависимости оть ихъ атомнаго вћса, возрастая съ увеличеніемъ послћдняго. Перекись бериллія было получить труднће всего; она получена лишь недавно посредствомъ основнаго карбоната бериллія (А. Комаровскій, 1913).
Въ 1898 г. начали свои изслћдованія П. Меликовъ и Л. Писаржевскій, давшіе новую гидроперокись аммонія, надніобовой и надтанталовой кислоты и цћлый рядъ солей уже извћстныхъ надкислотъ урановой, вольфрамовой, молибденовой, борной, титановой, ванадіевой.
П. Меликовъ и Л. Писаржевскій изучили также строеніе этихъ солей. Они пришли къ выводу, что „прочность надкислотъ (а также и перекисей) находится въ зависимости отъ атомнаго вћса элементовъ, ихъ образующихъ”: съ увеличеніемъ послћдняго въ одной и той же группћ періодической системы увеличивается также стойкость (1899).
Писаржевскій подробно изслћдовалъ перекиси цирконія, церія и торія и произвелъ въ 1902 г. физико-химическое изслћдованіе перекисей и надкислотъ, изучилъ, напримћръ, электропроводность, ско рость каталитическаго разложенія. {578}
С. Танатаръ далъ способы полученія надборной кислоты (электролитическимъ путемъ, 1898), надугольной (1899), надоловянной (1905). Новую перекись ртути НgO2 получилъ А. Антроповъ (1908).
С. Танатаръ получилъ твердыя соединенія перекиси водорода съ солями, напримћръ, съ Na2CO3 (1899), съ KF, NaHSO4, NaNO3 (1901), съ фосфорно- и мышьяковокислымъ натромъ (Патренко, 1902, и Ю. Руденко, 19121).
А. Баху мы обязаны изученіемъ вопроса о происхожденіи перекиси водорода въ атмосферћ, о роли ея въ процессахъ медленнаго окисленія и въ живыхъ клћткахъ. Бахъ принимаетъ еше высшую перекись Н2O4 (1900), а въ живыхъ клћткахъ еще особые энзимы: 1) оксигеназу, способную образовать изъ молекулярнаго кислорода перекиси, 2) „пероксидазу”, вызывающую передачу кислорода отъ перекисей на окисляемые продукты, и 3) „каталазу”, разлагающую избытокъ перекиси на молекулярный кислородъ (1903-10).
Новыя субокиси или недокиси свинца, висмута, кадмія (Pb2O, ВіО и Сd3O2 и Cd2O) посредствомъ разложенія щавелевокислыхъ солей этихъ металловъ получилъ С. Танатаръ (1900-2). Еще до изслћдованія группы перекисей, русскими химиками были открыты новые полисульфиды. Академикъ Фрицше первый выдћлилъ въ кристаллическомъ видћ: (NH4)2S3, (NH4)2S4, (NH4)2S5 и (NH4)2S7 (1841; 1844). Потомъ Э. Б. Шёне получилъ новые кристаллическіе полисульфиды натрія, кальція, стронція, барія, напримћръ, Na2S3, Na2S4 и Na2S5 (1866); CaS4, SrS4, BaS3, BaS4, BaS7 (1861-2).
Эти соединенія создали новые типы сћрнистыхъ соединеній съ металлами.
Сюда мы отнесемъ также извћстную „соль Шлиппе”2): Na2SbS4+9H2O (1821).
| {579} |
Съ точки зрћнія іонной теоріи В. Оствальдъ впервые (1889 г.) отличаетъ комплексныя соли и соединенія отъ двойныхъ или молекулярныхъ соединеній солей закиси желћза или поло жительнаго іона Fe; желћзо вошло, слћдовательно, въ составъ новаго прочнаго комплекса, т. е. іона отрицательнаго [Fe(CN)6]""; однако въ соли Мора желћзо сохраняетъ всћ свои свойства солей закиси,— двойная соль гидролитически разлагается на компоненты. Индивидуальность сложныхъ солей или ихъ гидролизъ были изучены П. Вальденомъ по электропроводности (1887-8; 1900), В. Кистяковскимъ по электропроводности, потенціалу разложенія и опредћленію переноса іоновъ (1890-8; 1901) и, наконецъ, Сперанскимъ (1895-6) и В. Ковалевскимъ (1900). Въ противоположность этимъ измћреніямъ, относящимся къ извћстнымъ уже сложнымъ типамъ, Н. С. Курнаковъ начинаетъ (1899) рядъ экспериментальныхъ изслћдованій, имћвшихъ цћлью полученіе новыхъ сложныхъ соединеній изъ тіомочевины — тіацетамида, ксантогенамида — съ платиновыми солями (см. монографію Н.Курнакова: О сложныхъ металлическихъ основаніяхъ. Птр. 1893). Онъ изучилъ также этилендіаминовыя соединенія никкеля и палладія (1898-1900). Въ 1904 г. Е. В. Биронъ закончилъ свои обшириыя изслћдованія хлоростаннатовъ типовъ Me2SnCl6 и MeSnCl6, изучивъ ихъ составъ, диссоціацію въ водныхъ растворахъ, а равно гидролизъ хлорнаго олова и распредћленіе его между двумя хлористыми металлами; впослћдствіи (1908) имъ были изслћдованы хлорокадмиты щелочныхъ металловъ („Изслћдованіе хлоростаннатовъ”. Птр. 1905).
Наконецъ, Л. А. Чугаевъ въ 1905 г. приступаетъ къ экспериментальному изслћдованію комплексныхъ соединеній; открытое имъ свойство α-діоксимовъ давать съ металлами VIII группы прочныя соли является исходной точкой для изолированія и изученія {580} этого новаго типа солей съ Ni, Pt, Pd, Cu, Fe и Co: соединеніе никкеля NtC8O14N4O4 можетъ служить, вслћдствіе нерастворимости въ водћ, чувствительнћйшимъ реактивомъ на Ni. Далће были изучены новыя металлопроизводныя платины и сукцинимида, діоксиминовъ, органическихъ моно- и дисульфидовъ, l-пропилендіамина, амидокислотъ, органическихъ селенидовъ (Э. Фрицманъ 1912; В. Субботинъ 1910; В. Хлопинъ 1913-4; Д. Френкель 1912; А. Коблянскій 1913, и т. д.).
И. И. Остромысленскій вмћстћ съ А. Бергманомъ началъ въ 1910 г. изслћдованія въ области изомеріи комплексныхъ соединеній, впервые изучивъ асимметричные комплексы платины; цћлью этихъ изслћдованій было отысканіе „новыхъ случаевъ изомеріи, въ томъ числћ и оптической” (Ж. 42, 615, 1910). Къ сожалћнію, эта серія опытовъ не была продолжена, а тћмъ временемъ А. Вернеръ уже открылъ асимметрическія оптически дћятельныя соединенія кобальта и хрома (1911), желћза и родія (1912).
Посредствомъ термическаго метода опредћленія кривыхъ плавкости Н. Пущинъ и А. Басковъ установили въ 1913 г. существованіе соединеній типа кріолита АlF3.3MF, гдћ М = Li, Nа, К, Rb, Cs; кромћ того существуетъ еще рядъ 2AlF3.MF, гдћ М = Na, K, Rb.
Въ заключеніе приведемъ еще двћ цћнныя монографіи1) Л. А. Чугаева: „Изслћдованія въобласти комплексныхъ соединеній” (Москва 1906) и „О химическомъ строеніи комплексныхъ соединеній” (Птр., 1910). Послћдній трудъ даетъ также основанія теоріи А. Вернера. Структурныя представленія Вернера не отличаются простотой, нопринесли, однако, очевидную пользу наукћ.
Въ органической химіи ароматическихъ углевородовъ своеобразное дћйствіе хлористаго и бромистаго алюминія,— реакція Густавсона, называемая реакціею Фриделя и Крафтса, — играетъ выдающуюся роль.
Густавсонъ уже въ 1878 г. самъ обьяснилъ механизмъ этой реакціи, показавъ, что одновременно образуются болће или менће прочныя комплексныя соединенія Al2Cl6 или Аl2Br6 съ углеводородами. Затћмъ В. Плотниковъ открылъ соединенія бромистаго алюминія съ бромомъ и сћроуглеродомъ и др. (см. монографію: {581} О сложныхъ соединеніяхъ хлористаго и бромистаго алюминія. Кіевъ 1902). Недавно И. А. Каблуковъ и А. Сахановъ (1909) дали новый рядъ такихъ комплексныхъ соединеній бромистаго алюминія съ анилиномъ, сложными эфирами и др., a B. Плотниковъ далъ новые кристаллическіе типы, состоящіе изъ АlBr3 и H2S, съ которыми еще комбинируются С2Н5Br, СНBr3, С2Н4Br2 (1913).
Допуская, что комплексныя соединенія въ смыслћ Оствальда представляютъ лишь предћльный типъ двойныхъ или молекулярныхъ соединеній вообще, отличающійся, напримћръ, въ водныхъ растворахъ, выдающейся прочностью, и что въ рядахъ этихъ комллексныхъ соединеній существуетъ постепенный переходъ отъ индивидуумовъ съ большей прочностью къ индивидуумамъ съ меныией прочностью, и, наконецъ, что „прочность” зависитъ — какъ относительное понятіе — отъ природы растворителя, характера реактива и условій работы, напримћръ, отъ температуры и давленія — допуская все это, мы не только можемъ, но и должны отнести къ разсмотрћнной выше группћ соединеній двойныя соли, гидраты со лей, амміакаты, алкоголяты и т. д. (т. е. молекулярныя соединенія). Съ этой точки зрћнія мы упомянемъ здћсь объ открытыхъ Э. Б. Шёне1) соединеніяхъ металлическихъ окисей съ перекисью водорода Н2O2. Вопросъ объ озонћ и перекиси водорода занималъ Э. Б. впродолженіе почти трехъ десятилћтій (1866-94) и составилъ предметъ его магистерской диссертаціи: „Опытныя изслћдованія надъ перекисью водорода” (Москва 1875), а равно и докторской: „Объ отношеніи перекиси водорода къ соединеніямъ калія”. 1878. Достойнымъ продолженіемъ этихъ превосходныхъ работъ Шёне являются изслћдованія П. Меликова и Писаржевскаго (1898-1902, 1905), которые изучили надкислоты и перекиси, получили новыя соединенія и выяснили строеніе этихъ тћлъ (см. „Изслћдованія надъ перекисями”. Зап. Ак. Н. VIII, т. IX, 1900; {582} Л. Писаржевскій: „Перекиси и надкислоты”. Одесса 1902). Равнымъ образомъ С. Танатаръ открылъ новыя соединенія перекиси водорода съ нћкоторыми неорганическими соеаиненіями (1901), a также двойныя соединенія ея съ органическими веществами (1908).
А. Яковкинъ приложилъ методъ распредћленія между водою и CS2 или ССl4, или СНBr3, къ рћшенію вопроса о состояніи металлическихъ полиіодидовъ въ водныхъ растворахъ (1893-6), согласно системћ равновћсія, напримћръ KJ.mJ2  KJ + mJ2. Существованіе въ растворћ КJ3 было доказано съ несомнћнностью, была также изучена диссоціація менће устойчивыхъ KBr3, LiJ3, NaJ3, KBrJ2. Яковкинъ установилъ посредствомъ того же метода существованіе въ водныхъ растворахъ также кислотъ НJ3 (1896) и НСl3 (1897-9).
KJ + mJ2. Существованіе въ растворћ КJ3 было доказано съ несомнћнностью, была также изучена диссоціація менће устойчивыхъ KBr3, LiJ3, NaJ3, KBrJ2. Яковкинъ установилъ посредствомъ того же метода существованіе въ водныхъ растворахъ также кислотъ НJ3 (1896) и НСl3 (1897-9).
Здћсь же можно указать на взгляды Фл. Флавицкаго на шестиатомность кислорода и предпринятую имъ остроумную попытку установить связь формъ кислородныхъ и водородныхъ соединеній элементовъ (1891). Его „теорія химическихъ формъ” была имъ приложена также къ классификаціи галоидныхъ солей (1893) и дала ему возможность предсказать существованіе новыхъ соединеній и классифицировать „сотни неизвћстныхъ молекулярныхъ соединеній, отводя имъ мћсто въ системћ на ряду съ атомными соединеніями” (1893). Дћйствительно, впослћдствіи имъ и его учениками — назовемъ лишь имена А. В. Богородскаго, И. Панфилова, Е. Любарскаго — были найдены многіе изъ предсказанныхъ кристаллическихъ гидратовъ солей (ср. его трудъ „Общая или неорганическая химія”, 1898).
Независимо отъ этого подробно изслћдовалъ эту область А. Потылицынъ; какъ сторонникъ гидратной теоріи, въ связи съ работами о пересыщенныхъ растворахъ онъ изучаетъ гидраты хлористаго кобальта (измћненіе розоваго цвћта въ зависимости отъ перехода высшихъ гидратовъ въ одноводный, 1885) и получаетъ гидраты солей хлорной, хлорноватой и бромноватой кислотъ. Затћмъ онъ переходитъ къ изученію пересыщенныхъ растворовъ гипса (1893-4) и останавливается на полуводномъ гидратћ CaSO4.½H2O и безводной соли CaSO4, которая существуетъ, по крайней мћрћ, въ двухъ видоизмћненіяхъ и обусловливаетъ затвердћваніе гипса. Параллельно была изслћдована аналогичная соль селеновой кислоты,
Вліяніе количества воды на природу полученной при гидратаціи окиси кальція СаО изслћдовалъ С. Чумаковъ (1912). {583} Ќ. Селивановъ далъ (1912-3) подробное опытное изслћдованіе какъ состава и свойствъ аморфнаго гидрата окиси кальція, такъ, вообще, и гидратовъ этой окиси; кромћ извћстнаго кристаллическаго Са(ОН)2 имъ были открыты кристаллическіе 2Са(ОН)2.Н2O и Са(ОН)2.Н2O. Кромћ того, были получены и изучены: фенолятъ Са(ОН)2.2С6Н5ОН, крезоляты, напримћръ, Са(ОН)2.С7Н8О и алкоголяты гидрата окиси кальція (см. монографію: Къ вопросу о гидратахъ окиси кальція и ихъ молекулярныхъ соединеніяхъ. Одесса 1913).
Другой продуктъ гидратаціи представляетъ „цементъ Сореля”, т. е. затвердћвшая въ смћси съ растворомъ хлористаго магнія безводная окись магнія. Недавно А. Байковъ произвелъ обстоятельное изслћдованіе процесса отвердћванія каустическаго магнезита, полученнаго обжиганіемъ при температурћ около 900° изъ мощныхъ мћсторожденій магнезита MgCO3 въ Уфимской губ.; согласно этимъ опытамъ процессъ отвердћванія каустическаго магнезита заключается въ томъ, что примћненный растворъ хлористаго магнія рacтворяетъ безводную окись магнія и выдћляетъ гидратъ окиси магнія: первая во много разъ легче растворима, нежели гидратъ окиси магнія, и, слћдовательно, растворъ, насыщенный по отношенію къ безводной магнезіи, является пересыщеннымъ по отношенію къ гидрату магнезіи (см. Байковъ: Каустическій магнезитъ, его свойства и отвердћваніе. Птр. 1913).
Сюда можно отнести также соединенія галоидоводородныхъ кислотъ со спиртами и т. д., разсмотрћнныя нами при оксоніевыхъ соединеніяхъ.
При помощи методовъ новћйшей физической химіи были изучены еще другіе типы солей. Классъ метафосфатовъ, ихъ изомерія и полимерія, былъ изслћдованъ Л. Ю. и А. Э. Тилло (1889) кріоскопически, а Г. Г. Тамманъ (1890-2) изучилъ ихъ электропроводности и кріоскопическое отношеніе.
Интересный рядъ структурноизомерныхъ неорганическихъ солей приготовилъ впервые А. П. Сабанћевъ (1898-9), исходя изъ фосфорной, фосфористой и фосфорноватистой кислотъ и амміака, гидразина и гидроксиламина, какъ основаній, напримћръ (N2H4.H)(PO3H2) и
(NH4) |
[ |
P—NH |
], |
O3H |
(NH2OH.H)(PO2H2) и (NH4)(PO3H2). {584}
Пользуясь методами новћйшей физической химіи, т. е. методами, основанными на законћ дћйствія массъ и правилћ фазъ, и въ частности посредствомъ измћренія упругости диссоціаціи въ твердомъ состоянін и растворимости, В. Куриловъ производилъ съ 1893 г. изслћдованіе амміакатовъ („Разложеніе (диссоціація) химическихъ соединеній, образованныхъ поглощеніемъ амміака солями” (1895); „Къ ученію объ амміакатахъ”. Екатеринославъ, 1905). Третій крупный трудъ Курилова касается вообще продуктовъ присоединенія, по отношенію къ которымъ, слћдовательно, амміакаты составляютъ лишь частный случай. Этотъ трудъ носитъ заглавіе: „Опытное изученіе химическихъ равновћсій въ системахъ изъ двухъ и трехъ веществъ” (1899) и касается β-нафтолпикрата1).
Химическая теорія растворовъ принимаетъ образованіе болће или менће прочныхъ сольватовъ, или молекулярныхъ соединеній, между растворителемъ и раствореннымъ тћломъ, т. е. диссоціацію или сольватацію между молекулами обоихъ компонентовъ раствора; органическая химія все болће и болће обращаетъ вниманіе на промежуточные продукты, предшествовавшіе продуктамъ окончательнаго замћщенія и т. д., — въ обћихъ областяхъ скрытыя атомности многоатомныхъ элементовъ способствуютъ происхожденію — при реакціяхъ растворенія и происхожденія новыхъ тћлъ — ассоціированныхъ системъ; поэтому выдћленіе такихъ молекулярныхъ соединеній представляется необходимостью, а подробное изученіе условій образованія и существованія этихъ системъ между раствореннымъ тћломъ и растворителями разнороднћйшаго строенія должно быть признано весьма цћннымъ обогащеніемъ химіи вообще. Съ этой точки зрћнія систематическія изслћдованія молекулярныхъ соединеній неорганическихъ солей и органическихъ соединеній, предприиятыя Б. Н. Меншуткинымъ съ 1903 г., представляются цћнными и образцовыми. Б. Н. Меншуткинъ изолировалъ и изслћдовалъ соединенія бромистаго и іодистаго магнія съ эфиромъ (эфираты), со спиртами (алькоголяты), съ аминами, алдегидами, кетонами, ацеталями, {585} кислотами, сложными эфирами, амидами, нитрилями и др. и открылъ чрезвычайно богатый отдћлъ такихъ сольватовъ (см. его сводку: Объ эфиратахъ и другихъ молекулярныхъ соединеніяхъ бромистаго и іодистаго магнія. Птр. 1907; 267 + XLVIII стр.). Въ томъ же направленіи были изслћдованы системы съ хлористымъ кальціемъ, хлористымъ и бромистымъ алюминіемъ (съ 1909 г.), съ трехлористой и трехбромистой сурьмою (съ 1906 г.) и др., причемъ въ новыя системы были введены также бензольныя и нафталиновыя производныя (углеводороды и т. д.). Общая сводка дана въ Journ. de Chim. Phys. IX, 539, 641, (1911). Одновременно Меншуткинъ изучалъ процессъ вытћсненія однихъ веществъ другими въ молекулярныхъ соединеніихъ и прочность этихъ соединеній (1907); было также изслћдовано вліяніе замћстителей и изомеріи на способность замћщенныхъ бензола давать молекулярныя соединенія съ SbCl3 и SbBr3, напримћръ, вліяніе алдегидной и ціанистой группъ. Замћна атома водорода группами СОН и CN сказывается совершенно одинаково, составъ молекулярныхъ соединеній вмћсто С6Н6.2SbX3 становится C6H5COH.SbX3, a равно C6H5CN.SbX3 (1912). Галоиды и нитрогруппа въ весьма сильной степени понижаютъ способность бензола ассоціироваться съ SbX3; лишь SbCl3 (но не SbBr3) даетъ непрочныя соединенія C6H5Cl и C6H5NO2SbCl3 (1911); введеніе метила на мћсто водорода оказываетъ очень незначительное вліяніе на ассоціаціонную силу бензола (1911). При изученіи нитро- и хлортолуоловъ оказалось, что обћ группы, какъ при бензолћ, рћзко понижаютъ ассоціаціонную силу толуола, что хлоръ сильно вліяетъ на нитрогруппы, и что ортохлор- (и нитро-) толуолъ образуетъ прочныя молекулярныя соединенія съ SbCl3 и SbBr3, a пара- и мета-соединенія не даютъ таковыхъ (1912). Дальнћйшія изслћдованія касались хлористаго бензола и др. (1913).
Въ первой половинћ XIX вћка физическая химія въ Россіи имћла лишь отцћльныхъ представителей. Правда, послћдніе отличались своей научной самостоятельностью и творческой силою и {586} заложили основанія новыхъ отдћлозъ физической химіи, — электрохиміи, фотохиміи и термохиміи. Благодаря этому физическая химія могла бы сдћлаться въ Россіи господствующей отраслью химической науки и опередить, въ этомъ отношеніи, развитіе химіи на Западћ. Но эти великіе піонеры оказались изолированными: они не имћли ни учениковъ, ни послћдователей. Возникшая на западћ органическая химія въ связи съ тћмъ случайнымъ обстоятельствомъ, что Воскресенскій и Зининъ обучались именно въ Гиссенской школћ Либиха, создали и въ Россіи школу органической химіи.
Возобновленіе интереса къ физической химіи въ Россіи тћсно связано съ именемъ и трудами Д. И. Менделћева. Уже въ своихъ первыхъ научныхъ трудахъ онъ высказываетъ явный интересъ къ основнымъ вопросамь физической химіи; уже въ нихъ онъ намћчаетъ программу своей будущей работы! И при выполненіи этой программы онъ самъ выдвинулъ рядъ новыхъ проблемъ, привлекъ къ нимъ общее вниманіе химиковъ-изслћдователей и сталъ, такимъ образомъ, центромь, около котораго группировались новые экспериментаторы, новыя идеи и самостоятельная школа физико-химиковъ.
Труды Д. И. Менделћва объ аггрегатныхъ состояніяхъ тћлъ показываютъ психологически интересное развитіе: они начинаются съ твердыхъ тћлъ, затћмъ охватываютъ жидкое состояніе и останавливаются на газaxъ, затрагивая также растворы. Въ своей первой обширной работћ, диссертаціи при окончаніи Главнаго Педагогическаго Института, — онъ разсматриваетъ „Изоморфизмъ въ связи съ другими отношеніями кристаллической формы къ составу” (Петроградъ 1856). Этотъ трудъ заканчивается слћдующими характерными словами: «Подъ конецъ пожелаю изоморфизму или ясно раздћлить, или слить химическую свою сторону съ физической, опредћливъ отношеніе къ замћщенію (металепсіи), и тогда приносить плоды, справедливо обћщанные Берцеліусомъ», Въ своей магистерской диссертаціи „Удћльные объемы” (Петроградъ 1866) Менделћевъ пишетъ, ссылаясь на опыты Кагура (анормальныя плотности паровь уксусной и масляной кислотъ) и КаньяръДелатура (объ отношеніи эфира, въ замкнутомь сосудћ, при повышенной температурћ): „Всћ эти факты сближаютъ три состоянія тћла, показываютъ, что правильность въ измћненіяхъ газа есть только кажущаяся, трудно наблюдаемая, что всћ тћла, въ строгомъ смыслћ, не подчиняются ни Маріоттову, ни Дальтонову законамъ” (стр. 76). {587} И здћсь поражаютъ насъ научное чутье и критицизмъ Менделћева: вћдь ученіе Ванъ-деръ-Ваальса о непрерывности аггрегатныхъ состояній было создано лишь черезъ 25 лћтъ (1881), а собственныя провћрки закона БойльМаріотта начаты были лишь въ 1872 г.! На Менделћевъ правильно отмћтилъ пробћлы и уже намћтилъ себћ пуіи къ ихъ опытному устраненію.
Къ опытному выполненію этихъ плановъ онъ пристулаетъ въ 1860 г., начавъ свои изслћдованія съ вопроса о сцћпленіи жидкостей, ихъ расширеніи, абсолютной температурћ кипћнія и т. д.
Изслћдованія газовъ, подготовленныя имъ уже раньше, были начаты въ 1872 г. и пріостановлены въ 1881 г. Руководимый частью научнымъ интересомъ, частью техническимъ значеніемъ вопроса объ упругости газовъ, Д. И. ставитъ себћ цћлью выяснить опытнымъ путемъ, насколько сжимаемость различныхъ газовъ слћдуетъ закону Бойль-Маріотта. По его взглядамъ всћ „постоянные” газы, начиная съ опредћленнаго высокаго давленія, должны быть менће сжимаемы, нежели это требуется закономъ Бойль-Маріотта. Напротивъ, при весьма малыхъ давленіяхъ и весьма малой плотности газовъ можно ожидать, что ихъ упругость исчезаетъ, т. е. дальнћйшее ихъ расширеніе прекращается, — это будетъ предћльная форма вещества, а дальнћйшее изслћдованіе этой формы дастъ намъ возможность понять природу мірового эфира.
По словамъ Менделћева, «къ тремъ состояніямъ вещества, твердому, жидкому и газообразному, очевидно, должно прибавить еще четвертое — эфирное, подразумћвая подъ нимъ вещество въ крайнемъ возможномъ для него разрћженіи».
Рћшенію этихъ широкихъ задачъ посвящены работы Менделћева за цћлое десятилћтіе (1872-81), произведенныя имъ при содћйствіи многихъ искусныхъ сотрудниковъ: Г. Шмидта, М. Кирпичева, А. Еленева, Г. Праца, Н. Каяндера, Н. Іорданскаго, Ќ. Капустина, В. Гемиліана, I. Богускаго, К. Гутковской. Удивительно много изобрћтательности, терпћнія и труда было вложено въ эти серіи измћреній, произведенныхъ при высокихъ и низкихъ температурахъ, высокихъ и малыхъ давленіяхъ! Но проблема оказалась сильнће воли и генія Менделћева. Чћмъ дальше подвигалась работа, тћмъ отдаленнће казались намћченныя цћли, тћмъ сложнће становилась сама работа. Вотъ почему она осталась незаконченной, а во второй части своихъ результатовъ даже неопубликованной. Рядомъ съ деталями можно установить, какъ главный результатъ этихъ {588} измћреній, фактъ отступленія газовъ при малыхъ давленіяхъ отъ закона Бойль-Маріотта.
Къ открытой Д. И. Менделћевымъ (1860-1) абсолютной температурћ кипћнія, впослћдствіи на основаніи изслћдованій Эндрюса (съ 1869 г.) превратившейся въ критическую температуру, съ критическими давленіемъ, объемомъ и плотностью примыкаютъ замћчательныя изслћдованія русскихъ ученыхъ о критическихъ явленіяхъ вообще.
Михаилъ Петровичъ Авенаріусъ (род. 1835, профессоръ физики Кіевскаго Университета, ум. 1895) ранће другихъ съ успћхомъ занимался вопросомъ о критическомъ состояніи (1870-4 г.); онъ создалъ въ Кіевћ школу, изъ которой вышли спеціалисты, впервые методически изслћдовавшіе критическую температуру по собственнымъ методамъ, напримћръ Зайончевскій (1878), Страусъ (1880-2), Жукъ (1881-4), Надеждинъ (1882-7), Павлевскій (1882-8), Каннегисеръ (1884) и др. Зайончевскій первый подвергъ изслћдованію рядъ сложныхъ жидкостей, Страусъ первый изучилъ смћси жидкостей и вывелъ опредћленное правило для критическихъ температуръ въ зависимости отъ температуръ и концентраціи компонентовъ, Павлевскій пришелъ къ тому же правилу и впервые изслћдовалъ вліянія строенія (изомеріи, гомологіи) на критическую температуру. Упомянемъ также о трудахъ Столћтова (1892-4). Кн. Б. Б. Голицынъ неоднократно касался критическихъ явленій (1893, 1895, 1899), изслћдовалъ свћтопреломляемость (1895) и плотность вмћстћ съ Вилипомъ (1899).
Новый вопросъ былъ затронутъ въ изслћдованіяхъ П. Вальдена и М. Центнершвера (1901), опредћлившихъ электропроводность электролитовъ въ растворахъ жидкаго сћрнистаго ангидрида до критической температуры.
Цћннымъ продолженіемъ работъ вышеупомянутой кіевской школы являются обширныя изслћдованія М. Центнершвера (въ Ригћ), съ 1903 по 1909 г., давшаго новые пріемы опредћленія критической температуры, критическихъ объемовъ, критическаго давленія, изслћдовавшаго примћнимость правила Страуса-Павлевскаго и впервые предпринявшаго попытку приложенія осмотической теоріи растворовъ при точкћ кипћнія — къ критической температурћ растворовъ („молекулярное повышеніе критической температуры”, см. Критическая температура растворовъ. Магистерская диссертація, Птр. 1903). {589}
Съ другой стороны подошелъ къ критическимъ константамъ П. Вальденъ (1908-9); онъ старался установить соогношенія между модулемъ расширенія и критической температурой, между температурнымъ коэффиціентомъ капиллярныхъ константъ и критической температурой, между поверхностнымъ натяженіемъ и критическимъ давленіемъ, между крическимъ объемомъ и объемомъ при температурћ кипћнія и т. д. Онъ далъ также новую формулу для правила Томаса Юнга.
А. Бачинскій, начиная съ 1900 г., занимался выясненіемъ числовой связи между внутреннимъ треніемь η, температурою Т и химическимъ строеніемъ тћлъ; имъ была дана (1901) формула ηТ3 = E = пост. (Е — „параметръ внутренняго тренія”), примћнимая въ широкомъ температурномъ интервалћ для многихъ неассоціированныхъ жидкостей. Далће, онъ далъ связь между Е и другими физическими константами (напримћръ, молекулярнымъ вћсомъ М, дћйствительнымъ объемомъ, критической температурой, критической плотностью) и отсюда вывелъ формулу для опредћленія степени ассоціаціи изъ критической плотности, внутренняго тренія и поверхностнаго натяженіл при данной температурћ (1911).
А. Щукаревъ опредћлилъ остроумнымъ способомъ критическую теплоту тћлъ, т. е. теплоту, необходимую для нагрћванія 1 мола отъ комнатной температуры до критическаго состоянія, и сдћлалъ открытіе, что для всякаго тћла существуетъ однa совершенно опредћленная температура, при которой измћненіе внутренней энергіи его съ концентраціей строго слћдуетъ уравненію ВанъдеръВаальса; эта температура лежитъ значительно выше критической теипературы изслћдованныхъ тћлъ.
Для температурнаго расширенія жидкостей Д. Менделћевъ далъ (1884) уравненіе
V = |
1 1 – Кt |
, |
въ которомъ К — „модуль расширенія”. Менделћевъ приписывалъ своему модулю расширенія большое значеніе, такъ какъ модуль К вћроятно связанъ съ сжимаемостью, сцћпленіемъ, точкою кипћнія и т. д. жидкостей. Впослћдствіи многіе ученые занимались изученіемъ уравненія Менделћева; такъ, напримћръ, Д. Коноваловъ (1886) вывелъ его изъ уравненія Ванъ-деръ-Ваальса, Краевичъ (1887) и Р. Лутеръ (1893) вывели его изъ механической теоріи тепла; И. Каблуковъ (1887) попытался установить зависимость между модулемъ К и температурнымъ коэффиціентомъ сцћпленія, исходя изъ формулы Торпа {590} и Рикера, давшихъ (1884) впервые зависимость между К и критической температурою. Подробное изслћдованіе модуля расширенія К далъ П. Вальденъ (1908), изучившій его примћнимость на 49 жидкостяхъ и жидкихъ газахъ; въ общемъ получилось удовлетворительное совпаденіе экспериментальныхъ данныхъ съ вычисленными изъ уравненія Менделћева, а температурный интервалъ приложимости варіируетъ въ зависимости отъ природы жидкостей. Вальденъ указалъ также на новую связь между К и критической температурою K.τ = 0.94 = пост. Е. Биронъ далъ новую формулировку температуры расширенія, точнће соотвћтствующую опытнымъ даннымъ:
V = |
V0 1 – К1t – К2t2 |
, |
Капиллярныя константы жидкостей. Опытное опредвленіе капиллярныхъ константъ, способы измћренія, новыя числовыя данныя, а равно установленіе связи между ними и другими физическими константами, — всћ эти вопросы получили, біагодаря трудамъ русскихъ химиковъ, очень существенное и успћшное освћщеніе. Піонеромъ въ этой области является Д. И. Менделћевъ, уже въ 1860 г. опредћлившій для нћкоторыхъ (20) органическихъ жидкостей частичное сцћпленіе а2 и попытавшійся установить связь между а2, молекулярнымъ вћсомъ (см. стр. 591), изомеріею, удћльнымъ вћсомь и т. д. Свою работу онъ заканчиваетъ слћдующими пророческими словами: „Мћра сцћпленія тћлъ, безъ сомнћнія, есть свойство болће характеристическое, чћмъ, напримћръ, точка кипћнія... Впослћдствіи, вћроятно, откроется зависимость между сцћпленіемъ и многими другими физическими свойствами, напримћръ, удћльнымъ вћсомъ, расширеніемъ, теплоемкостью, скрытою теплотою и т. д. При развитіи молекулярной механики мћра сцћпленія должна войти, какъ необходимое данное, при рћшеніи большинства вопросовъ” (Химическій журналъ I, 169. 180).
Русскіе физики занимались разработкою теоріи, провћркой методовъ сцћпленія и т.д., напримћръ, А. Давыдовъ (1851), Н.Пильчиковъ (1888), А. Брюхановъ (1898); роль температуры изслћдовали:
Б. Вейнбергъ (1892), Н. Кастеринъ (1892-3), Казанкинъ (1891-3); послћдніе два ученыхъ, а равно и Б. Срезневскій (1881) изслћдовали также сцћпленіе водныхъ растворовъ.
Дальнћйшее развитіе вопроса о связи капиллярныхъ константъ съ другими физическими константами, въ смыслћ Менделћева, исходило отъ физико-химиковъ, въ частности отъ Вл. Кистяковскаго и {591} П. Вальдена. — В. Кистяковскій (впервые въ 1904 г., затћмъ въ 1906 г.) открылъ важное для молекулярной химіи правило, связывающее молекулярный вћсъ М, удћльное сцћпленіе а2 и температуру кипћнія Т, а именно М · а2/Т = 1.16 = const, для нормальныхъ, т. е. неассоціированныхъ тћлъ: этимъ былъ данъ способъ вычисленій молекулярнаго вћса подобныхъ жидкостей, такъ какъ собственныя измћренія на нћкоторыхъ тћлахъ, а равно данныя прежнихъ изслћдователей дали подтвержденіе формулы. Недавно (1913) онъ снова далъ вывоцъ этой формулы и показалъ ея примћнимость къ 141 неассоціированной жидкости, а именно къ углеводородамъ, галоидозамћщеннымъ, эфирамъ, аминамъ и т. п. Въ 1909 г. Дютуа предложилъ формулу для опредћленія молекулярнаго вћса изъ удћльнаго сцћпленія и упругости паровъ, исходя изъ правила Кистяковскаго.
Изученіемъ физическихъ константъ жидкостей, въ частности органическихъ іонизующихъ соединеній, занимался также П. Вальденъ; онъ опредћлилъ внутреннее треніе 40 жидкостей-растворителей и температурный коэффиціентъ внутренняго тренія, доказавъ практическое совпаденіе этихъ коэффиціентовъ съ температурнымъ коэффиціентомъ молекулярной электропроводности соли N(C2H5)4J въ этихъ же растворителяхъ (1906). Подробное изслћдованіе Вальденъ посвятилъ (1908) константамъ капиллярности, т. е. удћльному сцћпленію а2 и поверхностному натяженію γ, причемъ былъ доказанъ линейный характеръ температурнаго коэффиціента обћихъ величинъ,— оба коэффиціента приведены въ связь съ критической температурою и данъ способъ вычисленія послћдней изъ первыхъ; этотъ методъ недавно былъ упрощенъ Лив. Морганомъ (1911). Вальденъ (1910), частью совмћстно съ Р. Свинне (1912-3), опредћлилъ для многихъ органическихъ соединеній капиллярныя константы, а равно температурные коэффиціеты молекулярнаго сцћпленія (такъ Вальденъ назвалъ произведеніе М · а2) и молекулярной поверхностной энергіи γV2/3 = Е0 установивъ, что, вопреки Рамзаю-Шильдсу, температурный коэффиціентъ
K = |
d(γV2/3) dt |
можетъ быть ≥ 2.121 для нормальныхъ жидкостей, въ зависимости отъ сложности частицъ, или, иными словами, что температурный коэффиціентъ молекулярной поверхностной энергіи dE0/dt, а равно коэффиціентъ молекулярнаго сцћпленія dMa2/dt складываются {592} аддитивно въ зависимости отъ числа и рода атомовъ,составляющихъ частицу жидкости. Въ 1908 г. П. Вальденъ открылъ эмпирическое правило, устанавливающее при температурћ кипћнія Т связь междускрытой теплотой испаренія и удћльнымъ сцћпленіемъ
|
Λ a2 |
= const. |
для нормальныхъ (неассоціированныхъ) жидкостей; отсюда онъ, при помощи правила Троутона, пришелъ, независимо отъ В. Кистяковскаго, къ отношенію
|
M · a2 T |
= постоянной. |
Принявъ во вниманіе линейный характеръ температурнаго коэффиціента удћльнаго сцћпленія, Вальденъ далъ общую формулу для опредћленія молекулярнаго вћса жидкостей
M = |
0.435 T a2 |
log T, |
провћренную при температурахъ отъ —196° до +310° (1908-13).
Молекулярный вћсъ жидкостей можетъ, слћдовательно, быть опредћленъ изъ капиллярныхъ константъ какъ по правилу Кистяковскаго при температурћ кипћнія, такъ и по правилу Вальдена при любой температурћ съ экстраполяціей на температуру кипћнія. Молекулярный вћсъ, или ассоціацію молекулы при точкћ плавленія, можно опредћлить изъ другого правила, даннаго также Вальденомъ (1908), для молекулярной теплоты плавленія Mλ при температурћ плавленія Т. Вальденъ нашелъ, что для не ассоціированныхъ молекулъ измћненіе молекулярной энтропіи при плавленіи независимо отъ химическаго состава:
|
Mλ Т |
= 13.5 = const. |
Недавно Г. Тамманъ, подвергнувъ это „правило Вальдена” провћркћ (1913), показалъ на 157 соединеніяхъ, что въ общемъ оно можетъ быть формулировано слћдующимъ образомъ:
|
Mλ Т |
+ |
Δx.W.M Т |
= 11—16 калорій, |
а въ случаћ отсутствія диссоціаціи или полимеризаціи
|
Mλ Т |
= 13.0—13.5. |
Внутреннему тренію посвященъ рядъ цћнныхъ ислћдованій. Кромћ упомянутыхъ работъ А. Бачинскаго и П. Вальдена слћдуетъ назвать еще сообщенія М. Гольдштейна (1884-90), давшаго приборъ для измћренія. Г. Тамманъ изслћдовалъ (1899) переохлажденныя жидкости и вліяніе давленія. Изъ физиковъ назовемъ Н. Петрова (1883-96). Н. Жуковскаго (1886-91) и Б. {593} Вейнберга, изучавшихъ теорію вязкости, приборы для ея опредћленія, техническое примћненіе и т. д. Въ новћйшее время (съ 1912 г.) Н. Курнаковъ и С. Ф. Жемчужный и Н. Ефремовъ примћнили внутреннее треніе къ двойнымъ системамъ, съ цћлью установить опредћленныя соединенія въ жидкихъ смћсяхъ.
Въ случаћ неассоціированныхъ опредћленныхъ соединеній максимумы на изотермахъ внутренняго тренія отвћчаютъ разрыву сплошности кривыхъ, пересћкающихси подъ угломъ въ „сингулярныхъ” или „дальтоновскихъ” точкахъ; составъ такихъ точекъ подчиняется закону кратныхъ пропорцій и остается постояннымъ при измћненіи температуры и другихъ факторовъ химическаго равновћсія (Курнаковъ и Жемчужный). А. Сахановъ показалъ, что какъ вязкость η, такъ и флуидность 1/η смћсей, напримћръ, двухъ неассоціированныхъ жидкостей, не являются линейной функціей состава смћсей, а подчиняются сложной формулћ (1914).
По вопросу о диффузіи, въ частности электролитовъ и неэлектролитовъ въ растворахъ, слћдуетъ назвать Л. Эгольма, въ Гельсингфорсћ, давшаго (1904-10) методъ изслћдованія и превосходное изслћдованіе диффузіи (въ водћ) солей, основаній, кислотъ и неэлектролитовъ, въ связи съ теоріею диффузіи В. Нернста.
П. Вальденъ показалъ (1906), что константа диффузіи пропорціональна флуидности растворителя и обратно пропорціональна квадратному корню изъ молекулярнаго вћса диффундирующаго тћла (что позднће было выведено теоретически Ванъ-Ларомъ, 1907).
Интересный фактъ наблюдалъ И. Ф. Шредеръ (1908) при опредћленіи теплоемкости растворовъ спиртовъ въ анилинћ, бензолћ, толуолћ и хлороформћ. Въ этихъ растворахъ вычисленная теплопроводность спирта возрастаетъ въ зависимости отъ концентраціи, стремясь къ нћкоторому предћльному значенію. Шредеръ предполагаетъ, что причина этого явленія заключается въ измћненіи молекулы спирта, — въ дезаггрегаціи ассоціированной молекулы на болће простыя молекулы, вплоть до С2Н5ОН; теплоемкость смћси, слагаясь вообще аддитивно, въ данномъ случаћ получается аддитивно изъ теплоемкости одного компонента (неизмћнившагося углеводорода и т. д.) и изъ теплоемкости спирта, претерпћвающаго постепенное измћненіе; растворъ, разсматриваемый со статической точки зрћнія, является, слћдовательно, {594} простой смћсью ассоціаціонно-диссоціаціонныхъ продуктовъ-компонентовъ даннаго раствора.
Тепловое расширеніе жидкостей изучалось много разъ. Упомянемъ о работахъ обоихъ Ленцовъ (Э. Ленцъ, 1831, и Р. Ленцъ, 1868 и 1881) и С. Макарова (1891) надъ морской водою, Д. И. Менделћева (1861) о расширеніи воды, спирта, эфира до высшихъ температуръ, его же (1865) о расширеніи спирта съ водою, В. Оствальда (1877, водные растворы солей), И. Шредера (1885, HgCl2 въ водћ и спиртћ), Д. Менделћева (1895, чистая вода отъ 0 до 30°), Г. Таммана (1895) вмћстћ съ Р. Гассельбладтомъ, Лерхе и Цеперникомъ (водные соляные растворы, отъ 0°—30°, 110°—150°). Г. Ландезенъ далъ (1902) подробное изслћдованіе теплового расширенія воды между 30° и 80°, а также (1904) водныхъ растворовъ минеральныхъ солей, сахара и мочевины между 30° и 80°. По теоріи Г. Таччіча (1893-7) внутреннее давленіе K(= a/V2 въ уравненіи Ванъ-деръ-Ваальса) растворителя меньше внутренняго давленія (К+ ΔК) раствора, а приращеніе ΔК даетъ возможность вычислять, исходя изъ свойствъ растворителя, любое свойство раствора. Тамманъ вывелъ слћдующую закономћрность: Термодинамическая поверхность раствора совпадаетъ какъ по положенію, такъ и по формћ съ термодинамическою поверхностью растворителя въ томъ случаћ, если для первой (т. е. раствора) перенести начало координатъ въ точку на оси давленія, лежащую ниже начала координатной системы на число единицъ, выражающее приращеніе ΔК давленія въ растворћ. Работа Ландезена имћла цћлью провћрить эту закономћрность. Съ болће общей точки зрћнія обширныя изслћдованія водныхъ растворовъ произвелъ Ф. Дрейеръ (см. его монографію: О температурћ максимальной плотности водныхъ растворовъ. Птр. 1913). Послћ критическаго разсмотрћнія теоріи Таммана Дрейеръ произвелъ опредћленіе величины ΔК посредствомъ измћренія пониженія температуры максимальной плотности раство ровъ 46 электролитовъ — солей и нћсколькихъ спиртовъ; онъ нашелъ эмпирическую связь между пониженіемъ температуры максимальной плотности и пониженіемъ температуры замерзанія растворовъ электролитовъ, установивъ, что въ разбавленныхъ растворахъ однћ и тћ же причины вызываютъ уклоненіе какь осмотическаго цавлекія, такъ и прироста внутренняго давленія ΔК отъ простой пропорціональности концентраціи, — причиною тому могутъ служить измћненія {595} молекулы раствореннаго тћла (электролитическая диссоціація солей или полимеризація неэлектролитовъ) или молекулъ воды.
Цћнные экспериментальные матеріалы по вопросу о расширеніи растворовъ солей отъ теплоты (1888-9), о наибольшей плотности растворовъ хлористаго водорода (1908), объ удћльныхъ вћсахъ и коэффиціентахъ расширенія насыщенныхъ растворовъ солей (1912-4) были добыты Н. Чернаемъ (см. его біографію, Журн. 46, 1. 1914).
И. М. Сћченовъ1) началъ свои замћчательныя изслћдованія о поглощеніи углекислоты соляными растворами съ точки зрћнія физіолога въ 1873 г.; имъ было изучено вліяніе давленія, температуры, а равно концентраціи и природы растворовъ, разсматривавшихся авторомъ, какъ родъ весьма слабаго химическаго соединеиія между солью и водою; изслћдованію были подвергнуты также кровь (1877) и вещества крови, поглощающія углекислоту. Эти работы, законченныя лишь въ 1892 г., выяснили вліяніе природы солей на поглощеніе и доказали, что коэффиціентъ поглощенія растворовъ меньше коэффиціента воды и что поглощеніе слћдуетъ закону Дальтона-Генри.
Для измћренія коэффиціента поглощенія газовъ В. Ќ. Тимофеевъ построилъ (1890) въ лабораторіи В. Оствальда остроумный приборъ, посредствомъ котораго онъ опредћлилъ абсорбцію водорода и кислорода въ водћ и спиртћ; этотъ образцовый приборъ примћняется еще и въ настоящее время.
Адсорбція газовъ. Въ 1777 г. Шееле и Фонтана одновременно открыли новое явленіе, а именно способность угля поглощать и удерживать газы изъ окружающей среды. Т. Ловицъ въ Петроградћ открылъ (1785) способность угля поглощать изъ жидкой среды растворенныя красящія и т. п. вещества. Поглощеніе и раствореніе газовъ твердыми веществами впослћдствіи {596} было названо по предложенію Э. Дюбуа-Реймона „адсорбціей”. Явленія адсорбціи разсматриваются или съ химической точки зрћнія, или какъ физическій процессъ. Въ первомъ случаћ мы имћли бы дћло съ непрочными химическими соединеніями, во второмъ — либо съ твердыми растворами, либо со сгущеніемъ газа въ поверхности твердаго тћла вслћдствіе уменьшенія поверхностнаго натяженія послћдняго. Послћднему взгляду отдаетъ предпочтеніе А. Титовъ въ своемъ подробномъ экспериментальномъ изслћдованіи „Объ адсорбціи газовъ углемъ” (1910). Титовъ опредћлилъ адсорбцію водорода, азота, угольнаго ангидрида и амміака коксовымъ углемъ при температурахъ отъ —79° до +151.5°; для водорода оказалось, что при постоянной температурћ адсорбированныя количества возрастаютъ пропорціонально давленію (законъ Генри), азотъ же повинуется этому закону лишь при высокихъ температурахъ. Титовъ опредћлилъ также теплоты адсорбціи. Опыты Титова принадлежатъ къ числу самыхъ точныхъ въ данной области.
Вопросъ о взаимной растворимости жидкостей вообще, а равно о зависимости ея отъ температуры былъ поднятъ сравнительно поздно и впервые подвергнутъ экспериментальному изслћдованію Д. Абашевымъ (1829-80), опредћлившимъ (1857) какъ величину растворимости, такъ и возрастаніе ея съ температурою, а равно то выдћленіе, то поглощеніе тепла, въ зависимости отъ природы взятыхъ жидкостей. Изслћдованія эти имћютъ значеніе, какъ первыя въ своемъ родћ, хотя методъ и числовые результаты измћреній были неточны. Впродолженіе почти трехъ десятилћтій этотъ вопросъ не нашелъ новаго экспериментатора, пока за него не взялся другой русскій химикъ.
Вполнћ самостоятельныя и классическія работы въ области растворимости тћлъ принадлежатъ В. Ф. Алексћеву.
В. Алексћевъ далъ (1885) оригинальный и точный методъ опредћленія температуры нолнаго иасыщенія, изслћдовалъ растворимость при разныхъ температурахъ тћлъ, взаимно растворимыхъ и обладающихъ предћльной взаимной растворимостью, опредћлилъ {597} эти „критическія точки” и далъ типы кривыхъ для этихъ отношеній, изучивъ, кромћ температуры и природы веществъ, также вліяніе на растворимость давленія. Кромћ жидкостей, Алексћевъ изслћдовалъ также твердыя тћла, напримћръ, своеобразные случаи съ жидкою салициловою кислотою въ водћ при температурахъ ниже температуры плавленія. Изслћдованія Алексћева были начаты въ 1875 г., первую сводку ихъ онъ далъ въ своей диссертаціи „О взаимной растворимости жидкостей” (Птр. 1879), затћмъ въ Wiedem. Ann. 28, 305 (1886). Причиной растворимости Алексћевъ считаетъ силу сцћпленія; для образованія раствора требуется, чтобы существовала нћкоторая опредћленная разница между сцћпленіями жидкостей. Если эта разница очень велика, то раствора вовсе не образуется, если очеиь мала, то получается растворъ во всћхъ пропорціяхъ. Въ случаћ образованія непрочныхъ соединеній между растворяющимся тћломъ и растворителемъ растворимость уменьшается съ температурою, получается минимумъ, открытый Алексћевымъ, а послћ разрушенія этого соединенія явленіе идетъ нормально. Пересыщенные растворы суть такіе, въ которыхъ растворенное вещество переохлаждено, т. е. находится въ жидкомъ состояніи (18831).
О связи между растворимостью, теплотою растворимости и теплотою плавленія представилъ цћнныя изслћдованія И. Ф. Шредеръ2) въ монографіи: О зависимости между температурами плавленія твердыхъ тћлъ и ихъ растворимостью въ жидкостяхъ (Птр. 1890). Исходя изъ тћлъ, взаимно не дћйствующихъ, и пользуясь выраженіемъ концентраціи
c = |
n N + n |
, |
гдћ n и N обозначаютъ число молекулъ обоихъ компонентовъ раствора, т. е. примћняя пріемъ, названный В. Оствальдомъ „Molenbruch” (1899), Шредеръ первый далъ термодинамически выведенный законъ, по которому теплота растворенія переходитъ въ теплоту плавленія твердаго вещества и который устанавливаетъ зависимость растворимости отъ температуры (возрастаніе растворимости пропорціонально {598} абсолютной температурћ); этотъ законъ былъ провћренъ опытами надъ производными бензола и нафталиномъ въ органическихъ растворителяхъ.
За экспериментальными и теоретическими работами Шредера хронологически слћдуютъ обширныя изслћдованія Вл. Тимофеева (см. диссертацію: Изслћдованія надъ растворимостью веществъ въ органическихъ растворителяхъ. Харьковъ 1894). Значеніе этого труда заключается въ богатствћ точнаго опытнаго матеріала, относящагося къ растворимости при различныхъ температурахъ органическихъ веществъ, а именно кислотъ и углеводородовъ, въ органическихъ растворителяхъ, по преимуществу спиртахъ, отъ метиловаго до изобутиловаго, и въ нћкоторыхъ жирныхъ кислотахъ. Продолженіемъ этой серіи измћреній является слћдующій капитальный трудъ Вл. Тимофеева: „О теплотћ образованія неводныхъ растворовъ” (докторская диссертація. Кіевъ 1905). Въ этомъ трудћ, замћчательномъ по тщательности измћреній и обилію наблюденій и изслћдованныхъ системъ и содержащемъ изслћдованіе вліянія концентраціи и природы компонентовъ на тепловой эффектъ при раствореніи, авторъ разсматриваетъ тћ физическіе и химическіе процессы, которые даютъ положительный или отрицательный тепловой эффектъ при образованіи растворовъ.
Вопросу о растворяющей силћ органическихъ растворителей, въ связи съ іонизующей способностью послћднихъ по отношенію къ бинарнымъ солямъ, посвятилъ рядъ изслћдованій П. И. Вальденъ (1906-8, 1913); при этомъ была изучена степень диссоціаціи въ насыщенныхъ растворахъ одной и той же соли (она оказалась практически одинаковой, независимой отъ растворителя), измћрена теплота растворенія солей и удћльная теплота растворителей и сопоставлена съ формулой Вантъ-Гоффа-Лешателье; впервые указана была также связь между растворяющей способностью и діэлектрической константой растворителей (1908), а равно пропорціональность между константой скорости реакціи и діэлектрической константою для соли N(C2H5)4J (1907).
Выясненію вопроса о взаимодћйствіи веществъ въ растворахъ посвящены изслћдованія Е. В. Бирона; труды этого ученаго являются цћнными не только вслћдствіе точности добытыхъ имъ экспериментальныхъ данныхъ, но и благодаря оригинальности теоретической обработки этихъ данкыхъ. Биронъ выбираетъ для своихъ измћреній такія жидкости, которыя съ химической точки {599} зрћнія, практически говоря, неспособны вступать въ взаимодћйствіе, т. е. жидкости неассоціированныя; растворы такихъ молекулъ обладаютъ аддитивностью свойствъ, представляя изъ себя простыя жидкія смћси. Назвавъ такую способность двухъ веществъ „изофлуидизмомъ”, Биронъ останавливается — съ цћлью изученія изофлуидныхъ жидкостей — на измћреніи сжатія при образованіи растворовъ: величина сжатія, положительная или отрицательная, характеризуетъ собой степень отступленія отъ изофлуидизма, а сжатіе можетъ быть выражено характерной константою К. Для этой „константы сжатія” К Биронъ выводитъ уравненіе D = K.m1.m2 = К.х.(1—х), гдћ D обозначаетъ сжатіе при образованіи растворовъ, а m1 и m2 или х и (1—х), — молекулярные проценты. Измћренія показали, что, напримћръ, для жидкихъ паръ C2H5J+CH3COOC2H5 или C6H6 + C2H4Сl2, или C6H5Сl + C6H5Br, данное уравненіе дћйствительно выражаетъ зависимость сжатія отъ состава растворовъ, отъ 0 до 100%, далће вытекаетъ, что максимумъ сжатія имћетъ мћсто всегда въ растворахъ, въ которыхъ оба компонента входятъ молекула на молекулу, хотя о химическомъ взаимодћйствіи жидкостей въ изслћдованныхъ примћрахъ не можетъ быть рћчи (1909). Затћмъ Биронъ перешелъ къ точнымъ измћреніямъ расширенія, въ зависимости отъ температуры, тћхъ же неассоціированныхъ жидкостей и ихъ растворовъ (1910). Отвергнувъ простую формулу Менделћева, Биронъ вывелъ для температурнаго измћненія расширенія новыя уравненія, давшія точные коэффиціенты расширенія. Для растворовъ онъ вновь изслћдуетъ „константу сжатія” K иизучаетъ измћненіе сжатія съ температурою. Затћмъ онъ разсматриваетъ константы сжатія съ точки зрћнія теоріи бинарныхъ смћсей Ванъ-деръ-Ваальса и устанавливаетъ связь между закономъ сжатія и внутреннимъ давленіемъ. Для провћрки послћднихъ заключеній Биронъ (1912) приступаетъ къ непосредственному измћренію сжимаемости жидкостей посредствомъ построеннаго имъ особаго пьезометра и даетъ новыя данныя о сжимаемости для варіирующихъ давленій, пользуясь особымъ уравненіемъ для выраженія изотермъ жидкостей какъ ассоціированныхъ, такъ и неассоціированныхъ. Дальнћйшія его измћренія касались сжатія при смћшеніи анормальныхъ жидкостей, т. е. опредћленія формы кривыхъ сжатій. Съ этой цћлью Биронъ вмћстћ съ О. Моргулевой изучалъ (1913) смћси слабо диссоціированныхъ жидкостей, напримћръ, нитробензола и анилина (или бензола), давшихъ при преобладаніи {600} одного изъ компонентовъ (отъ 100 до 70 мол. %) анормальное сжатіе. Изъ сильно ассоціированныхъ жидкостей были изучены смћси алифатическихъ спиртовъ, отъ метиловаго до изобутиловаго; они дали при смћшеніи весьма разнообразныя формы кривыхъ, въ зависимости отъ положенія компонентовъ въ гомологическомъ ряду: чћмъ ближе въ ряду, тћмъ скорће подходятъ они къ смћсямъ нормальныхъ жидкостей. Далће Е. Биронъ перешелъ (1913) къ измћренію сжатія при смћшеніи жидкостей, образующихъ химическія соединенія, напримћръ, анилинъ (ортотолуидинъ) и феночъ (или крезолы) и т. д.; при этомъ оказалось, что рядомъ съ явнымъ химизмомъ необходимо принимать во вниманіе и физико-механическое взаимодћйствіе частицъ компонентовъ, иногда даже превышающее вліяніе химизма.
Интересный и технически важный вопросъ, напримћръ, для отопленія, былъ поднятъ и изученъ П. П. Лазаревымъ, установившимъ, что при теплопроводности или при передачћ тепла отъ твердаго тћла къ газу на границћ возникаетъ скачекъ температуры (1910),
Вл. Смирновъ изслћдовалъ подъ руководствомъ Д. Коновалова явленія образованія слоевъ въ растворахъ изомасляной кислоты въ водћ подъ вліяніемъ солей и показалъ, что причину, вызывающую образованіе слоевъ въ упомянутыхъ растворахъ, можно усматривать въ гидратаціи прибавленной соли (ассоціаціи съ водою); при данной температурћ эта гидратаціонная склонность возрастаетъ въ каждой группћ элементовъ съ уменьшеніемъ атомнаго вћса металла (1907).
Общее ученіе. Гидраты (сольваты). Ученіе о растворахъ связано въ Россіи съ возникновеніемъ научной химіи вообще. Напомнимъ, что уже Ломоносовъ около 1750 г. остановился на изслћдованіи растворовъ, намћреваясь основать новую, a именно, физическую химію. Въ концћ XVIII вћка Ловицъ произвелъ свои замћчательныя изслћдованія растворовъ, изучивъ пересыщенные растворы, условія кристаллизаціи, теплоты растворенія и охладительныя смћси и т. д. Девятнадцатый вћкъ принесъ намъ, между прочимъ, теорію Гротгуса (1805) о механизмћ электропроводности {601} въ растворахъ, о состояніи раствореннаго тћла (круговые гальваническіе токи, причины растворенія и др., 1819 г.), а равно не менће важный законъ Гесса о термонейтральности въ растворахъ (1842). Всћ эти фундаментальныя изслћдованія были сдћланы надъ водными растворами. Абашевъ въ 1857 г. начинаетъ изученіе неводныхъ растворовъ, а въ 1865 г. Д. Менделћевъ присоединяетъ къ нимъ третій отдћлъ, смћшанные растворы (вода и спиртъ), и, развивая взгляды Коппа, Юра, Рудберга, создаетъ свою гидратную теорію растворовъ. Дальнћйшее развитіе химіи растворовъ въ Россіи группируется около имени Менделћева.
Растворъ есть настоящее химическое соединеніе,— такъ училъ уже Бертоллэ (1803), „опредћленіе химическаго соединенія должно обнимать и растворы”, писалъ С. Клэръ-Девилль въ 1857 г. „Есть поводы думать, что основной законъ паевъ, проявляющійся не только въ моментъ образованія новыхъ опредћленныхъ соединеній, но имћющій свое значеніе и для состоянія химическаго равновћсія, что этотъ законъ принимаетъ участіе и въ образованіи даже такихъ характерныхъ неопредћленныхъ соединеній, какъ растворы”, вотъ какъ формулировалъ свои взгляды Д. И. Менделћевъ ете въ 1865 г. („О соединеніи снирта съ водою”).
Уже Г. Г. Густавсонъ (1873) выставилъ среди тезисовъ своей магистерской диссертаціи слћдующій: одна и та же соль можетъ существовать въ водномъ растворћ, смотря по условіямъ, въ видћ различныхъ гидратовъ. Равнымъ образомъ В. Ф. Алексћевъ (1879) въ своей диссертаціи выставляетъ слћдующее положеніе: „На основаніи существующихъ свћдћній растворы нельзя разсматривать, какъ смћси”.
Уже А. Бутлеровъ — въ интересной статьћ „о полисоединенія къ въ минеральной химіи” (Ж. 12, 37, 1880) — пришелъ къ заключенію, что „и растворы не будутъ неопредћленными соединеніями и не могутъ быть отграничены отъ химическихъ соединеній съ рћзко выраженной кратностью въ составћ”. Къ этому времени относится экспериментальное изслћдованіе А. Щербачева, произведенное подъ руководствомъ Н. Н. Бекетова, „объ отноиіеніи кристаллизаціонной воды къ растворимости солей” (Ж. 6, 60, 1874). Въ этой работћ авторъ приходитъ къ заключенію, что при раствореніи солей, содержащихъ кристаллизаціонную воду, послћдняя всегда {602} остается химически связанной съ солью и существенно разнится1) отъ воды растворяющей, и что эти соли могутъ диссоціироваться въ растворћ и въ нћкоторыхъ случаяхъ, теряя часть своей кристаллизаціонной воды, переходятъ въ низшіе, болће растворимые гидраты, т. е. образуютъ „пересыщенные растворы”2).
Наконецъ появляются выдающіяся работы Д. И. Менделћева о растворахъ, приведшія къ гидратной теоріи. „Растворы суть химическія соединенія, опредћляемыя силами, дћйствующими между растворителемъ и раствореннымъ тћломъ... Такъ какъ при дћйствіи химическихъ силъ частичные вћса дћйствующихъ веществъ играютъ явную роль, то за самое раціональное выраженіе состава растворовъ должно считать представленіе ихъ состава химическими формулами или частичными количествами дћйствующихъ веществъ”. „Раствореніе основывается на способности растворителя образовать диссоціирующую систему съ раствореннымъ тћломъ, и растворъ есть среда, въ которой находится ассоціація частицъ, образуемыхъ системою растворителя и раствореннаго тћла”.
Гидратная теорія Менделћева была подробно изложена въ его классическомъ трудћ: „Изслћдованія водныхъ растворовъ по удћльному вћсу” (Птр. 1887). Въ этой книгћ изложены также методы и результаты физическаго изслћдованія растворовъ, съ цћлью открыть въ послћднихъ опредћленныя химическія соединенія между водою и раствореннымъ тћломъ. Методъ заключается въ измћреніи удћльнаго вћса въ зависимости отъ концентраціи растворовъ; изученіе производныхъ ds/dp или приращенія удћльнаго вћса s при возрастаніи процентнаго содержанія р раствореннаго тћла обнаружило изломанность кривыхъ, выражающихъ эти производныя, а мћсту этого перелома соотвћтствовали упомянутыя опредћленныя соединенія, т. е. гидраты, въ растворћ. Въ экспериментальномъ изученіи {603} вопроса участвовали ученики Д. И. Менделћева, напримћръ, B. Е. Павловъ, В. Е. Тищенко, В. Я. Бурдаковъ, И. Ф. Шредеръ, C. П. Вуколовъ1).
Дальнћйшая судьба гидратной теоріи Менделћева чрезвычайно своеобразна; она представляетъ поучительный примћръ неустойчивости научныхъ взглядовъ вообще, измћняемости отношенія современниковъ и зависимости научной оцћнки отъ господствующихъ модныхъ теченій въ наукћ.
Главной ошибкою химической гидратной теоріи было, что она появилась не во время: трудъ Менделћева вышелъ одновременно (1887) съ появленіемъ механической осмотической теоріи растворовъ Вантъ-Гоффа и электролитической теоріею Арреніуса. Послћднія имћли то большое преимущество, что были строго обоснованы законами термодинамики, облечены въ математическую форму, легко доступны экспериментальной провћркћ и чрезвычайно богаты новыми научными проблемами. Онћ нашли рядъ выдающихся послћдователей-экспериментаторовъ, примћнившихъ и развившихъ эти теоріи во всћхъ областяхъ химіи. Теорія Менделћева должна была уступить мћсто болће строгимъ и болће плодотворнымъ теоріямъ; она была отвергнута и осмћяна.
Но при дальнћйшихъ изслћдованіяхъ растворовъ, по преимуществу водныхъ и разбавленныхъ, наступилъ моментъ, когда запасъ вопросовъ, связанныхъ съ этими „идеальными” растворами, былъ практически исчерпанъ, и необходимо было вернуться къ болће концентрованнымъ водпымъ растворамъ и заняться изслћдованіемъ неводныхъ растворителей. При этомъ постепенно стали выступать „аномаліи”, отклоненія отъ механическихъ теорій, требующія вспомогательныхъ теорій и выдвигающія отвергнутыя въ свое время представленія о химическомъ взаимодћйствіи при раствореніи. Постепенно стали повторяться взгляды на сольватацію при раствореніи, т. е. на образованіе соединеній между растворителемъ и раствореннымъ тћломъ; появилась сольватная теорія Джонса и снова начали разными способами опредћлять составъ „сольватовъ”, напримћръ, гидратовъ, алкоголятовъ, въ растворћ. А въ настояшее время вопросъ о существованіи этихъ „сольватовъ” не подлежитъ сомнћнію! {604}
Это своеобразное развитіе „гидратной теоріи” и вмћстћ химической теоріи растворовъ вообще послужило предметомъ историческихъ изслћдованій. Укажемъ лииіь на слћдующія:
П. Вальденъ, О трудахъ Д. И. Менделћева по вопросу о растворахъ (I Менделћевскій съћздъ, Ж. 41, 58 88, 1909).
П. Вальденъ, О сущности процесса растворенія и роли среды. (Въ сборникћ: Успћхи химіи. Вып. 1. Одесса, Mathesis, 1912)
П. Вальденъ, Die Losungstheorien in ihrer geschichtlichen Aufeinanderfolge Stuttgart 1910.
(Въ новћйшее время появился обзоръ Н. Дара, дающій всћ доводы ръ пользу химическаго взаимодћйствія при раствореніи, Zeitschr. f. Elektrochemie, 1914, 57—81).
Представляютъ ли растворы химическія соединенія опредћленнаго или неопредћленнаго состава, или они должны быть разсматриваемы, какъ механическія или физическія смћси? Обусловливается ли раствореніе химическимъ сродствомъ обоихъ компонентовъ раствора или же физическими силами? Отвћта, который удовлетворилъ бы всћхъ, мы до сихъ поръ еще не имћемъ. Невольно возникаетъ сомнћніе: да правильно ли формулированъ вопросъ? He допущенъ ли нами произволъ при такой постановкћ вопроса о природћ раствора? Существуетъ ли дћйствительно такая рћзкая граница между химическими и физическими силами, между химическими соединеніями и физическими смћсями? или, можетъ быть, нами выбраны лишь два предћльныхъ примћра, двћ предћльныя области для большаго удобства и для упрощенія схемы при классификаціи результатовъ? He существуютъ ли въ природћ постепенные переходы, не будетъ ли правильнће считаться и въ въ ученіи о растворахъ съ такими, во всякомъ случаћ мыслимыми, переходами, промежуточными дћйствіями и ихъ продуктами, начипая отъ продуктовъ опредћленнаго постояннаго состава, переходя черезъ всћ видоизмћненія химическаго постоянства и кончая другимъ крайнимъ случаемъ, — физическими смћсями? Всћ гипотезы цћнны, если онћ приводятъ насъ къ обобщеніямъ извћстныхъ фактовъ и ставятъ нашей экспериментальной пытливости новые вопросы. Успћхъ рћшаетъ участь гипотезъ, а успћхъ зависитъ не только отъ числа добытыхъ новыхъ фактовъ, но и отъ распространенія ихъ среди представителей науки даннаго періода,— такъ сказать, отъ научнаго резонанса. Поэтому иногда случается, что, въ зависимости отъ модныхъ теченій въ наукћ, вћроятныя и сами по {605} себћ плодотворныя гипотезы остаются незамћченными и черезъ многія десятилћтія какъ бы открываются снова и встрћчаютъ живой отголосокъ въ научномъ мірћ. Но исторія химіи даетъ намъ примћры и обратнаго, когда модныя въ свое время гипотезы, встрћченныя съ энтузіазмомъ, черезъ нћсколько десятилћтій, съ перемћной взглядовъ, вызываютъ лишь сожалћніе.
Интересную физическую теорію растворенія и растворовъ далъ В. Ф. Алексћевъ (1883). Исходя изъ предположенія, что раствореніе слћдуетъ отнести къ явленіямъ не химическаго сродства, а сцћпленія, Алексћевъ разсматриваетъ растворы, какъ аггрегатъ частицъ физическихъ, удерживаемыхъ между собою сцћпленіемъ. „Условіе растворенія тћла въ жидкости есть смачиваніе”... „Растворы жидкостей въ жидкостяхъ слћдуетъ признать за совершенныя эмульсіи, т. е. что растворъ жидкости въ жидкости такъже составленъ изъ разнородныхъ частицъ, какъ каждая жидкость изъ однородныхъ”.
Въ дальнћйшемъ развитіи науки новћйшая физическая химія переставила роль дћйствующихъ силъ, измћнивъ также названія. Но фундаментальная идея Алексћева сохранилась. Вмћсто прежняго сцћпленія, напримћръ, выступила роль поверхностнаго натяженія. Въ связи съ этимъ разсмотримъ еще слћдующую теорію, появившуюся лииіь въ 1913 г.
На основаніи явленій дисперсоидной пептизаціи и условій устойчивости дисперсоидныхъ растворовъ П. ф. Веймарнъ даетъ слћдующую физико-химическую теорію истинныхъ растворовъ: твердыя вещества практически нерастворимы въ тћхъ жидко стяхъ, съ которыми они неспособны сольватироваться, къ которымъ они, вообще, химически индифферентны; только вода, напримћръ, прикрћпленная къ веществу ослабленными связями, обусловливаетъ гомогенное распредћленіе высоко-дисперсныхъ (истинно растворенныхъ) частицъ вещества въ растворителћ и мћшаетъ обратной конденсаціи ихъ въ грубодисперсную фазу, — напротивъ, полное ослабленіе или уничтоженіе гидратныхъ связей, какъ и полное прочное закрћпленіе ихъ, знаменуетъ паденіе растворимости до нулевого значенія. Основываясь на изслћдованіи Г. Антонова (1906-7) объ измћненіи поверхностнаго натяженія при взаимномъ раствореніи жидкостей на границћ слоевъ (это измћненіе равно разности иоверхностныхъ натяженій этихъ слоевъ и постепенно убываетъ да нуля при приближеніи къ критической области) Веймарнъ объясняетъ {606} механизмъ растворенія, какъ состоящій изъ двухъ процессовъ: во-первыхъ, изъ поглощенія воды (гидратаціи) поверхностью кристалла и образованія слоя изъ гидратныхъ частичекъ (т. е. уменьшенія поверхностной энергіи вслћдствіе уменьшенія поверхностнаго натяженія) и, вовторыхъ, изъ процесса дисперсіи, сообразно съ Броуновскимъ движеніемъ, вслћдствіе постоянныхъ движеній частицъ въ жидкомъ слоћ на поверхности кристалла (П. П. фонъ-Веймарнъ, Основы дисперсоидологической теоріи истинныхъ растворовъ. Птр. 1913)1).
Кромћ старой химической теоріи растворенія, типичнћйшимъ примћромъ которой является гидратная теорія Менделћева, давшая много цћнныхъ результатовъ, и упомянутой сейчасъ физикохимической теоріи, не успћвшей еще проявить свое значеніе въ наукћ, мы имћемъ еще чисто физическую теорію растворовъ, разсматривающую процессъ растворенія, какъ чисто механическій процессъ диффузіи. Это — осмотическая теорія Вантъ-Гоффа2).
Первымъ ученымъ, занимавшимся осмотическими явленіями, былъ дерптскій професоръ Г. Фр. Парротъ, который уже въ 1802 г. въ своей диссертаціи на степень профессора физики описываетъ осмотическія явленія, пользуясь пузыремъ, какъ перегородкой, и двумя жидкостями, водой и спиртомъ или водой и мочой. Онъ знаетъ уже оба рода движенія, эндосмозъ и экзосмозъ, указываетъ на роль этихъ явленій въ медицинћ и патологіи3) и {607} пытается измћрить величину давленія (Ср. П. Вальденъ, Изв. Акад. Н., 1912, 455).
Когда въ 1885-7 гг. появилась осмотическая теорія растворовъ Вантъ-Гоффа, возникла новая богатая область какъ теоретическихъ, такъ и практическихъ изслћдованій. Одна часть ученыхъ была заинтересована приложеніемъ осмотической теоріи къ опредћленію молекулярныхъ вћсовъ, къ выработкћ практическихъ методовъ въ этой области (кріоскопическихъ, эбулліоскопическихъ, тензиметрическихъ) и къ опредћленію такихъ молекулярныхъ вћсовъ. Другая часть ученыхъ занялась выясненіемъ теоретической стороны новой области, напримћръ, выясненіемъ природы осмотическаго давленія, функціи полупроницаемой перепонки, непосредственнаго измћренія давленія и причинъ отступленія эмпирическихъ данныхъ отъ требованій Вантъ-Гоффа. Конечно, при этомъ предпринимались попытки согласовать старое ученіе о растворахъ, т. е. гидратную теорію, съ новымъ. Эти двћ теоріи въ дћйствительности противоположны: первая теорія считала раствореніе химическимъ явленіемъ, обусловленнымъ дћйствіемъ химическаго сродства растворителя и раствореннаго тћла, тогда какъ вторая разсматривала раствореніе, какъ механическое явленіе диффузіи растворяемаго тћла въ растворителћ. Фанатическіе приверженцы новаго ученія во всћ времена наталкивались на воинственныхъ защитниковъ стараго ученія. Такъ было и въ первое время при появленіи новаго ученія Вантъ-Гоффа, и положеніе вещей еще болће обострилось при появленіи въ Россіи теоріи Арреніуса (См. П. Вальденъ, Двадцатипятилћтіе теоріи электролитической диссоціаціи. Рћчь, произнесенная на XII съћздћ Русскихъ Естествоиспытателей и Врачей, Москва 1910).
Любопытно, что первымъ химикомъ, который въ Россіи занимался опредћленіемъ осмотическаго давленія, опять былъ (1887-8) дерптскій ученый Г. Г. Тамманъ; примћняя оптическій методъ (Schlierenmethode) наблюденія разнородности концентраціи раствора (методъ, выработанный А. Тёплеромъ (1867), бывшимъ профессоромъ химіи въ Рижскомъ Политехникумћ), онъ установилъ, что изосмотическіе растворы имћютъ одинаковую упругость паровъ (1888), и наблюдалъ проницаемость этой полупроницаемой перепонки для различныхъ солей. Затћмъ (въ 1890 г.) В. Оствальдъ въ Лейпцигћ сдћлалъ рядъ выводовъ по отношенію къ этимь пленкамъ съ точки зрћнія іонной теоріи,— между прочимъ, онъ формулировалъ {608} положеніе, что эта проницаемость относится не къ отдћльнымъ солямъ, a только къ опредћленнымъ іонамъ. Въ 1892 г. П. Вальденомъ1) была произведена провћрка этого вывода, а равно провћрка теоріи Траубе о свойствахъ этихъ перепонокъ, какъ „молекулярныхъ ситъ”,— оказалось, что діосмируютъ не іоны, а соли, или электролиты, какъ таковые, и это діосмированіе зависитъ не столько отъ величины молекулы, сколько отъ природы ея, напримћръ, отъ атомности основаній или кислотъ. Равнымъ образомъ оказалась неосновательной Грэмова классификація тћлъ на коллоиды и кристаллоиды, такъ какъ не существуетъ рћзкаго различія между обоими классами соединеній. Прибавиыъ еще, что Вальденъ относитъ явленія діосмированія черезъ иленки къ категоріи твердыхъ растворовъ2) аморфныхъ тћлъ. Одновременно и Г. Тамманъ (1892) изслћдовалъ эти полупроницаемыя перепонки, разсматривая ихъ, какъ гидратныя тћла, подобныя тонкимъ слоямъ жидкостей3). Къ этому періоду относятся также осмо тическія изслћдованія А. Владимірова (1891) надъ ядовитостью бактерій.
Принявъ существованіе въ крћпкихъ растворахъ опредћленныхъ гидратовъ и допустивъ, что частицы послћднихъ и вообіие молекулярныхъ соединеній могутъ въ растворахъ принимать „газоподобное” состояніе, Ф. Флавицкій (съ 1893 г.) вывелъ эмпирическіе законы Рауля и старался объединить термодинамическіе выводы Вантъ-Гоффа для молекуляркой депрессіи точки замерзанія водныхъ растворовъ съ гидратной теоріей растворовъ, давъ при помоти уравненія Планка (1887)формулу для извћстнаго коэффиціента і въ зависисти отъ образованія гидратовъ (1897). Принявъ шестиатомность кислорода, Флавицкій полагаетъ, что теорія водныхъ растворовъ должна вступить въ новую фазу развитія, примкнувши непосредственно къ опредћленнымъ гидратамъ въ расплавленномъ состояніи (1893).
A. А. Яковкинъ (1894, 1897, 1909) съ другой точки зрћнія задался цћлью примирить осмотическую (механическую) теорію {609} растворовъ съ представленіем ь о растворахъ, какъ химическихъ соединеніяхъ.
Яковкинъ старается объяснить осмотическое давленіе съ точки зрћнія химической теоріи растворовъ и установить зависимость этого давленія отъ величины сродства раствореннаго тћла къ растворителю. Исходя изъ термодинамики и изъ идеи Мекделћева объ ассоціаціи растворовъ и примћняя къ нимъ законъ активныхъ массъ, Яковкинъ находитъ, что осмотическое давленіе фактически не отличается отъ газоваго, — каждое растворенное въ водћ вещество обнаруживаетъ явленіе постепенной гидратаціи, а осмотическое давленіе зависитъ отъ притяженія растворителя раствореннымъ веществомъ; слабое сродство обоихъ компонентовъ раствора является съ формальной стороны равносильнымъ полимеризаціи молекулъ раствореннаго вещества.
Яковкинъ выводитъ законы Рауля и Вантъ-Гоффа, пользуясь представленіемъ Менделћева о растворахъ, какъ о диссоціирующихъ химическихъ соединеніяхъ, и сопоставляя ихъ съ дћйствительно диссоціирующими соединеніями съ полигалоидами металловъ.
Д. П. Коноваловъ, однако, придерживается того мнћнія, что осмотическое давленіе не измћряетъ кинетической энергіи раствореннаго вещества, а опредћляется потерей упругости пара при раствореніи (1890; 1897).
В. А. Кистяковскій, приверженецъ осмотической теоріи Вантъ-Гоффа, работалъ надъ осмозомъ газовъ (1897) и показалъ, что для смћсей газовъ возможно установить понятіе „осмотическаго давленія”. Онъ ввелъ въ уравненіе осмотической работы поправку, которая относится къ теплотћ разбавленія раствора (1898) и позволяетъ вычислить пониженіе точки замерзанія раствора.
Интересно, что связь между теплоемкостью растворовъ и осмотическимъ давленіемъ получила конкретную форму съ двухъ различныхъ сгоронъ. Уже въ 1890 г. И. Шредеръ1) обратилъ вниманіе на тотъ фактъ, что пониженіе температуры замерзанія (температуры насыщенія) парааибромбензола въ спиртовыхъ растворахъ уменьшается съ разбавленіемъ, тогда какъ въ растворахъ въ углеводородахъ оно подчиняется закону Рауля: въ первомъ случаћ {610} теплоемкость раствора болыііе суммы теплоемкостей компонентовъ, т. е. теплоемкость спиртовыхъ растворовъ слагается аддитивно изъ постоянной теплоемкости одного компонента и теплоемкости спирта (молекулы котораго ассоціированы), растущей съ разбавленіемъ вслћдствіе деполимеризаціоннаго процесса. Впослћдствіи Шредеръ (1908) доказалъ экспериментальнымъ измћреніемъ теплоемкостей правильность своихъ взглядовъ. Одновременно Е. В. Биронъ (1908) независимо пришелъ къ аналогичнымъ заключеніямъ, имћющимъ болће широкія рамки и выраженнымъ въ точной математической формћ, а именно:
|
dC' dV |
= T |
d2P dT2 |
, |
т. е. измћненіе теилоемкости C' раствореннаго вещества съ измћненіемъ объема V раствора пропорціонально второй производной осмотическаго давленія Р по абсолютной температурћ Т. A priori возможны три случая: dC'/dV = 0 или > 0, или < 0. Первый случай даетъ аддитивность теплоемкости, и эти нормалькые растворы точно слћдуютъ уравненію PV=RT, а равно закону Рауля. Второй случай требуетъ d2P/dT2 >0, осмотическое давленіе не есть линейная функція отъ Т и теплоемкость увеличивается съ разбавленіемъ раствора,— такой случай имћетъ мћсто въ водныхъ растворахъ органическихъ гидроксильныхъ соединеній (напримћръ, спиртовъ). Такъ какъ dC'/dV характеризуетъ величины осмотическаго давленія, а это послвднее связано съ парціальными упругостями паровъ растворовъ, „то невольно напрашивается сама собою зависимость между этимъ асимметрическимъ измћненіемъ величины С' для обоихъ компонентовъ и асимметріею кривыхъ парціальныхъ упругостей пара растворовъ ассоціированныхъ жидкостей, на которую указалъ (1907) Д. Коноваловъ” (Биронъ). Третій случай, наконецъ, даетъ отношеніе, характеризующее электролитическіе растворы; теплоемкость уменьшается съ разбавленіемъ раствора, въ связи съ этимъ осмотическое давленіе увеличивается съ температурою медленнће, чћмъ это требуется линейной зависимостью; параллельно съ измћненіемъ С' при разбавленіи растворовъ идутъ измћненія степени электролитической диссоціаціи α.
Весьма подробныя и цћнныя изслћдованія о соотношеніи между внутренними силами и свойствами растворовъ были произведены Г. Г. Тамманомъ (съ 1893 г.). Имъ были изучены внутреннія давленія {611} растворовъ (1893); корреспондирующіе растворы (1894); вліяніе внћшняго давленія на свойства растворовъ(1894); измћненія объема отъ давленія (1895) и температуры (1896), а равно при образованіи раствора (1896); теплоемкость (1895) и т. д.
Оказалось, что растворы различныхъ тћлъ ведутъ себя во многихъ отношеніяхъ такъ, какъ растворитель, когда онъ находится лодъ высокимъ давленіемъ. Сводку своихъ работъ Тамманъ представилъ въ книгћ: Ueber die Beziehungen zwischen den inneren Kraften und Eigenschaften der Losungen. Ein Beitrag zur Theorie homogener Systeme. 1907. Развитая здћсь теорія вызвала много экспериментальныхъ изслћдованій (см., напримћръ, названные выше труды Ландезена и Дрейера) и принесла очевидную пользу, хотя существуегъ рядъ свойствъ растворовъ (напримћръ, оптическое вращеніе, поверхностное натяженіе, осмотическія свойства растворовъ), къ которымъ она неприложима и съ которыми внутреннее давленіе не находится въ простомъ отношеніи.
Е. Волхонскій разсматриваетъ (1910) растворы съ точки зрћнія общихъ началъ динамики, а Я. Михайленко примћняетъ „физикомеханическую точку зрћнія на растворы” (1912), принимая свойства раствора, какъ результатъ механическаго дћйствія на растворитель силъ, приложенныхъ къ поверхности раздћла между жидкостью и паромъ, между жидкостью и льломъ. „Силы эти — давленіе разсћянія раствореннаго тћла”.
Закончимъ нашъ обзоръ указаніемъ на недавнюю работу А. Ф. Антропова (1911), предпринявшаго попытку устранить разницы между экспериментально найденными и теоретически требуемыми осмотическими давленіями (напримћръ, въ опытахъ Когена); онъ вводитъ поправку въ фундаментальную формулу Вантъ-Гоффа, принимая во вниманіе разницу въ скоростяхъ прохожденія черезъ перепокку растворителя и раствореннаго тћла.
| {612} |
Въ 1883 г. В. Оствальдъ (въ Ригћ), при составленіи I тома своего учебника общей химіи (Lehrbuch der allgemeinen Chemie), впервые вывель изъ старыхъ измћреній Вюлльнера (185660) заключеніе, что для растворовъ, содержащихъ эквимолекулярныя количества раствореннаго вещества, пониженіе упругости пара, т.е. „молекулярное” пониженіе, приблизительно постоянно1). Къ этому же результату независимо пришелъ Г. Тамманъ (въ Юрьевћ), предпринявшій систематическое экспериментальное измћреніе упругости пара водныхъ соляныхъ растворовъ (1885). Упомянемъ, что простыя отношенія были открыты лишь въ 1886 г., когда Рауль замћнилъ воду эфиромъ, а соли органическими веществами. Весьма обширный рядъ точныхъ измћреній (180 солей) въ водныхъ растворахъ былъ представленъ въ 1887 г. Тамманомъ, но благодаря электролитической диссоціаціи настоящая картина молекулярнаго пониженія упругости была затемнена.
Однако, еще до вышеупомятыхъ крупныхъ изслћдованій, въ 1881 г. Д. П. Коноваловымъ была опубликована работа, которая и нынћ считается классической и сразу освћщаетъ измћненіе упругости пара смћси двухъ жидкостей 1) лишь частью растворимыхъ одна въ другой, или 2) во всћхъ пропорціяхъ растворяющихъ одна другую (ср., напримћръ, Ostwald, Lehrbuch, I, 644, 1891; II, 616, 697, 1902). Въ этой работћ, одинаково выдающейся съ теоретической, какъ и съ экспериментальной стороны, выводится рядъ законовъ и дается ихъ опытная провћрка (концентрація болће летучаго {613} компоненга больше въ парћ, чћмъ въ жидкости; при изотермическомъ измћненіи объема системы, состоящей изъ пара и жидкости, давленіе и объемь измћняются въ противоположныхъ направленіяхъ, т.е. при увеличеніи объема уменьшается давленіе, и наоборотъ; для жидкостей, лишь частью растворимыхъ одна въ другой и поэтому легко дающихъ два слоя, послћдніе имћютъ одинаковую упругость паровъ, несмотря на разность въ составахъ обоихъ слоевъ, и т. д.). Коноваловъ впервые доказалъ. что для однородныхъ смћсей двухъ жидкостей разнообразіе формъ кривыхъ упругостей фактически ограничено и сводится къ тремъ типичнымъ случаямъ (ср. также Gibbs, Thermodynamische Studien. 1861). Этотъ трудъ (вышедшій въ русской редакціи, Журн. 19, 11—84, 1884) характеренъ еще тћмъ, что онъ содержитъ теоретическіе взгляды Д. П. Коновалова на растворы, которыхъ онъ придерживался до послћднихъ работъ (1907 г.), несмотря на появпеніе новыхъ теорій растворовъ Вантъ-Гоффа и Арреніуса. „Между химическими соединеніями и растворами нћтъ границы; послћдніе представляютъ лишь особое состояніе химическикъ создиненій” (1884). ...„Растворы представляютъ собою системы взаимодћйствія тЬлъ, подлежащіи тћмъ же силамъ, которыя обусловливаютъ образованіе химическихъ соединеній” (1907). „Измћненіе упругости пара при образованіи раствора можетъ служить характеристикою взаимодћйствія тћлъ” (1884), а послћдняя работа Д. Коновалова (Journ. Chim. Phys. V, 1907) носитъ заглавіе: О взаимодћйствіи тћлъ въ растворћ, по даннымъ упругости ихъ паровъ1).
Въ связи съ этими трудами Д. Коновалова и по его предложенію В. Куриловъ (1893 г.) произвелъ измћреніе упругости диссоціаціи амміакатовъ, напримћръ, NH4Br.NH3 имћя въ виду установить признакъ индивидуальности этихъ соединеній; „изученныя жидкія системы могутъ обладать въ одно и то же время и свойствами растворовь, и свойствами химическихъ соединеній”. Дальнћйшая разработка этого вопроса, въ частности изученіе равновћсія между различными фазами въ системахъ, построенныхъ изъ амміака и азотнокислаго аммонія, была дана Куриловымъ въ его магистерской диссертаціи (1895, Зап. Ак. Н., XIII. т. 1). {614}
Д. Коноваловъ производилъ свои измћренія по методу, дававшему лишь общую упругость пара раствора; для теоріи растворовъ вообще желательно измћреніе парціальнаго давленія составныхъ частей даннаго раствора. Я. Завадскій (1900) впервые, съ помощью статическаго метода, произвелъ, въ лабораторіи В. Оствальда, опредћленіе парціальныхъ давленій смћсей такъ называемыхъ индифферентныхъ жидкостей. Его методъ изслћдованія, а равно добытыя имъ числовыя данныя можно считать образцовыми; они послужили для многихъ изслћдованій другихъ ученыхъ. Теоретически важную обработку своихъ экспериментальныхъ результатовъ Завадскій далъ частью въ 1900 г., частью въ 1909 г. Динамическій методъ опредћленія парціальныхъ упругостей обоихъ компонентовъ раствора быль примћненъ А. А. Яковкинымъ (вмћстћ съ А. Маковецкимъ, 1908); добытыя имъ данныя вошли въ составъ развитой (1909 г.) имъ химической теоріи растворовъ (см. осмотическое давленіе). Цћнныя изслћдованія объ упругости пара растворовъ воды и лредћльныхъ спиртовъ1) произвелъ еще недавно (19101) А. Дорошевскій, а равно М. Вревскій (см. диссертацію: О составћ и упругости пара растворовъ. Птр. 1911). При помощи нћсколько измћненнаго метода Завадскаго Вревскій изучалъ водные растворы метиловаго, этиловаго и пропиловаго спиртовъ и экспериментально подтвердилъ выведенное имъ уравненіе, по которому при сообщеніи тепла раствору (при повышеніи температуры раствора) увеличивается въ парахъ относительное содержаніе того тћла, испареніе котораго требуетъ затраты энергіи2).
По вопросу объ испареніи при дћйствіи внћшнихъ силъ работалъ Н. Шиллеръ, а также В. Кистяковскій, давшій выводъ соотвћтствующей формулы термодинамическимъ путемъ (1897).
Въ новћйшее время A. B. Сперанскимъ была начата серія изслћдованій объ упругости паровъ насыщенныхъ растворовъ (1909, 1912-3) и общей теплоты растворенія, въ связи съ извћстною формулою Бертрана; роль температуры при этомъ изучали А. Войташевскій (1912) и П. Павловичъ (1913). Въчастности А. {615} Герасимовъ опредћлилъ (1913) упругость паровъ насыщенныхъ растворовъ соды.
Примћчаніе. Въ связи съ отдћломъ объ упругости паровъ упомянемъ объ извћстномъ приборћ Г. Глинскаго для фракціониро ванныхъ перегонокъ (1874 г.), оказавшемъ наукћ значительныя услуги.
Необходимо также указать здћсь на остроумный приборъ Д. П. Коновалова (1884) для дробной перегонки жидкостей подъ уменьшеннымъ давленіемъ, упрощенный въ 1885 г. А. Горбовымъ и А. Кесслеромъ, — форма прибора и его принципъ примћняются еще въ настоящее время заграницею, хотя имена первыхъ конструктуровъ забыты! Они называются приборами Бильтца (1895), Брюля (1888) и т. л.
Далће напомнимъ о простомъ способћ опредћленія упругости паровъ въ капиллярной трубочкћ А. Сиволобова (1885) и укажемъ на изслћдованія М. М. Тихвинскаго (1909) о новыхъ дефлегматорахъ и фракціонированной перегонкћ высококипящихъ веществъ. Особый интересъ вызываетъ также трудъ Д. Д. Гадаскина о новыхъ методахъ раздћленія близкокипящихъ жидкостей путемъ перегонки съ помощью дефлегматора съ алюминіемъ (1909). Вопросъ о фракціонированной перегонкћ и новыхъ ректификаціонныхъ приборахъ былъ разработанъ также А. Голодцемъ (1911), изучившимъ новые способы раздћленія близкокипящихъ смћсей и т. д., а равно фракціонированную перегонку посредствомъ водяныхъ паровъ (1911).
Вантъ-Гоффъ положилъ въ 1890 г. основаніе ученію о твердыхъ растворахъ2). Несмотря на большой научный интересъ и практическое значеніе этого ученія для минералогіи, технологіи и {616} т. д., оно въ Россіи нашло лишь немногихъ приверженцевъ, своими изслћдованіями внесшихъ въ эту область новый матеріалъ.
Изъ относящихся сюда работъ упомянемъ объ изслћдованіяхъ A. A. Кракау (1894) надъ упругостью диссоціаціи и электропроводностью твердой системы палладій-водородъ, объ изслћдованіяхъ Р. Холльмана (1901-5) объ уменьшеніи упругости пара и диссоціаціи смћшанныхъ кристалловъ квасцовъ и другихъ, содержащихъ маленькія примћси, и въ особенности о работахъ A. B. Сперанскаго, изучившаго упругости пара бинарныхъ системъ органическихъ тћлъ и установившаго, что „упругости наровъ твердыхъ растворовъ слћдуютъ тћмъ же законамъ, какъ упругость паровъ жидкихъ растворовъ”, причемъ молекулярный вћсъ вещества въ твердомъ состояніи не отличается отъ молекулярнаго вћса въ газообразномъ состояніи. Подробный обзоръ ученія о твердыхъ растворахъ и сводку своихъ собственныхъ изслћдованій А. Сперанскій далъ въ трудћ: „О твердыхъ растворахъ, образуемыхъ двумя компонентами”, Москва 1904. Сюда относятся частью и сплавы металлическіе, представляющіе примћры образованія 1) чистыхъ соединеній, соотвћтствующихъ закону кратныхъ отношеній, и 2) соединеній перемћннаго состава; „мы, слћдовательно, поставлены въ необходимость допустить нћчто среднее между соединеніями и растворами”, пишетъ Бруни. Такіе иримћры были открыты между сплавами С. Курнаковымъ и его сотрудниками, а равно Г. Тамманомъ и его сотрудниками. Къ той же категоріи соединеній съ перемћннымъ составомъ относятся кристаллическіе гидраты, постепенно лишающіеся своей воды, напримћръ, зеолиты и платино-синеродистая соль магнія, сћрно-азотно- и щавелево-кислыя соли и т. д. (Тамманъ, Буксгевденъ, 1897-8, Левенштейнъ, 1909). Къ твердымъ растворамъ принадлежатъ изоморфныя смћси солей, напримћръ, изученныя С. Курнаковымъ и С. Жемчужнымъ (1906) смћси КСl + NaCl, NaBr + KBr и др.; термохимическое изслћдованіе этихъ смћсей, произведенное Н. Н. Бекетовымъ въ 1903 г., подтвердило найденный уже В. Оствальдомъ (1882) результатъ, что быстро охлажденныя расплавленныя смћси имћютъ меньшую теплоту растворенія, чћмъ механическія смћси тћхъ же солей: изъ расплавленной смћси получается непрерывный рядъ смћшанныхъ изоморфныхъ кристалловъ.
Подобные непрерывные ряды изоморфныхъ смћсей, составленныхъ изъ органическихъ (бензольныхъ) производныхъ, еще {617} недавно были изслћдованы Курчаковымъ, Жемчужнымъ, Н. Н. Нагорновымъ (1908-10). Другіе сплавы хлористыхъ солей щелочныхъ металловъ (LiCl, KCl, RbCl, NaCl, CsCl) были точно изучены С. Жемчужнымъ и Ф. Рамбахомъ (1906); опредћлены были молекулярныя депрессіи, а равно теплоты образованія твердыхъ растворовъ.
Къ твердымъ растворамъ относятся, можетъ быть, также явленія адсорбціи газовъ, напримћръ, углемъ.
Послћ того какъ В. Оствальдъ самъ (1887-8) обратилъ вниманіе на кріоскопическій методъ опредћленія молекулярнаго вћса и примћнилъ его, Г. Бекманнъ, по предложенію Оствальда, приступилъ (1888) къ выработкћ удобныхъ практическихъ приборовъ, нынћ примћняемыхъ во всћхъ лабораторіяхъ.
Независимо Н. Клобуковъ (1886) построилъ соотвћтственный приборъ и предпринялъ рядъ измћреній, напримћръ, искусственныхъ гексозъ. Одновременно Г. Тамманъ затронулъ весьма интересную и новую область — кріоскопію сплавовъ и растворовъ металловъ въ ртути; впослћдствіи онъ опредћлилъ молекулярный вћсъ перекиси водорода въ водћ (1890-4) и метафосфитовъ (1890), — послћдніе уже въ 1889 г. были впервые изучены кріоскопически Явейномъ и Тилло. Другая новая область примћненія кріоскопіи была затронута А. Н. Сабаићевымъ, начавшимъ въ 1890 г. свои изслћдованія молекулярныхъ вћсовъ коллоидовъ.
По теоріи кріоскопическихь измћреній концентрированныхъ растворовъ В. А. Кистяковскій (1890, 1897-8) далъ новую цћнную формулу, въ которой принимается во вниманіе теплота растворенія и которая приводитъ наблюденныя величины къ согласованію съ вычисленными по теоріи Вантъ-Гоффа и Арреніуса. Противъ теоріи Арреніуса какъ бы говорять кріоскопическія изслћдованія Д. Коновалова.
Области смћшанныхъ растворовъ (спирта съ водою, ацетона съ водою, бензэла и спирга) касаются изслћдованія С. М. {618} Танатара1) (1895), установившаго для электролитовъ отступленіе отъ теоріи Арреніуса.
Къ методикћ кріоскопическихъ измћреній и къ теоріи Арреніуса относятся также замћчательныя изслћдованія П. Д. Хрущова (частью совмћстно съ А. Ситниковымъ, 1898). Хрущовъ выработалъ методъ измћренія температуры замерзанія электрическимъ термометромъ и опредћлилъ посредствомъ этого чувствительнаго и точнаго аппарата пониженіе точки замерзанія С въ зависимости отъ процентнаго количества Р вещества (на 100 г раствора): величина коэффиціента пониженія С/P оказалась постоянной для растворовъ данной соли въ водћ, т. е. независимой отъ степени разбавленія (n/4 до n/128), хотя степень диссоціаціи по Арреніусу значительно мћняется. Къ сожалћнію, эти выводы до сихъ поръ не нашли ни провћрки, ни подтвержденія или опроверженія.
Въ смыслћ теоріи Арреніуса могутъ быть истолкованы изслћдованія А. В. Сперанскаго (1892-3) о температурахъ замерзанія водныхъ растворовъ фтористыхъ соединеній и цвћтныхъ видоизмћненій солей хрома.
Хлорокись фосфора РОСl3 была изучена для цћлей кріоскопіи П. Вальденомъ (19102); Вальденъ (1911) также ввелъ въ науку новый кріоскопическій растворитель солей: формамидъ, давшій, въ согласіи съ теоріею Арреніуса, величины диссоціаціи, иногда превышающія таковыя въ водћ. Вальденъ изучалъ также (1902) бромистый мышьякъ AsBr3 какь кріоскопическій растворитель, дающій аномаліи и ассоціированныя молекулы электролитовъ.
Бромистый алюминій АlBr3, какъ растворитель, былъ предложенъ И. Каблуковымъ (1898) и примћненъ В. Избековымъ (1911-3); электролиты оказались и здћсь, какъ, напримћръ, въ бромистомъ мышьякћ, ассоціированными.
| {619} |
Изслћдованіе металловъ и ихъ сплавовъ было начато въ Россіи очень давно, а именно академиками, которые изучали ихъ съ физической точки зрћнія. Эти изслћдованія относятся хронологически къ старћйшимъ въ химической литературћ вообще (1736 и 1737 г.). Академики по химіи Хр. Эрег. Геллертъ (см. выше) впервые изслћдовалъ явленія капиллярности расплавленнаго свинца, а также ртутй въ зависимости отъ формы, цилиндрической и призматической, и величины трубокъ изъ стекла и фарфора (Comm. Acad. Petrop. XII, 243—251, 251—261); далће, онъ произвелъ цћлый рядь изслћдованій удћльнаго вћса сплавовъ: De densitate mixtorum ex metallis et semimetallis factorum (Comm. Acad. Petropol. XIII, 382—399), чтобы установить законы расширенія или сжатія при смћшеніи бинарныхъ системъ, состоявшихъ изъ золота, серебра, мћди, цинка, олова, свинца, желћза, бисмута, сурьмы; наконецъ онъ указалъ отношенія различныхъ сплавовъ къ магниту. Въ то же время другой петербургскій академикъ Георгъ-Вольфъ Крафтъ, маматикъ и физикь, (1727-44) занимался изслћдованіемъ вопроса: De densitate metallorum secum permixtorum (Comm. Acad. Petrop. XIV, 252—272), стараясь математически и экспериментально рћшить вопросъ о плотности этихъ металлическихъ смћсей.
Научныя изслЬдованія этого рода возобновляются въ Россіи лишь по истеченіи цћлаго столћтія! Исходной точкою снова явился вопросъ о плотности сплавовъ, а изслћдованіемъ его занялся Адольфъ Яковлевичъ Купферъ (род. 1799 г. въ Митавћ, съ 1823 до 1828 г. былъ профессоромь химіи и физики въ Казанскомъ университетћ, съ 1828 г. состоялъ ординарнымъ академикомъ Императорской Академіи Наукъ; умеръ въ 1865 г.), извћстный русскін физикъ, минералогъ и метеорологъ. Въ 1826 г. имъ была опубликована подробныя работа объ удћльныхъ вћсахъ сплавовъ олова — свинца, въ которой онъ установилъ фактъ, что эти сплавы образуются съ расширеніемъ, а наименьшее расширеніе соотвћтствуетъ приблизительно составу PbSn2 (Kastner's Archiv f. d. ges. Naturlehre, VIII, 331—350, 1826). Въ 1829 г. Купферъ напечаталъ новое изслћдованіе объ удћльныхъ вћсахъ и точкћ плавленія сплавовъ олова-свинца, ртутиолова, ртути-свинца; эти амальгамы {620} образуются съ сжатіемъ (Ann. Chim. Phys. (2) 40, 285—302. 1829). Упомянемъ также о его изслћдованіи казанскаго воздуха — первомъ, вообще, анализћ воздуха Россіи; согласно полученному имъ результату, 21.0—21.2 объемныхъ частей кислорода прихолится на 100 частей воздуха (Ann. Chim. Phys. 41, 423, 1829). По предложенію Купфера, дћйствовавшаго сообща съ знаменитымъ Александромъ ф. Гумбольдтомъ, въ 1830 г. была построена первая магнитная обсерваторія въ Петроградћ, а въ 1848 г. основана Николаевская Главная физическая Обсерваторія, директоромъ которой былъ назначенъ Купферъ. Кромћ того Купферъ занимался установленіемъ и приготовленіемъ нормальныхъ русскихъ мћръ и вћсовъ, узаконенныхъ Высочайшимъ указомъ 1835 г. Для выработки точныхъ алкоголометровъ и контрольныхъ приборовъ на винокуренныхъ заводахъ была учреждена правительственная комиссія подъ предсћдательствомъ Купфера; научнымъ результатомъ этихъ трудовъ является посмертный трудъ Купфера: Handbuch der Alkoholometrie. Berlin, 1865 (Объ его заслугахъ no кристаллографіи упомянуто въ другомъ мћстћ).
Послћ попытки Купфера опять наступаетъ затишье, интересъ науки къ металламъ еще не пробудился. Такъ, еще въ пятидесятыхъ годахъ прошлаго вћка знаменитый Р. Бунзенъ на своихъ лекціяхъ неорганической химіи весьма подробно излагалъ всћ металлоиды, а при переходћ къ лишь краткому разсмотрћнію металловъ, бывало, приговаривалъ: „Was kann man denn von den Metallen sagen”.
Въ развитіи ученія о сплавахъ въ Россіи видную роль игралъ Д. И. Менделћевъ, неустанно указывавшій какъ на связь этого класса тћлъ съ растворами, такъ и на сходство обоихъ классовъ съ химическими соединеніями опредћленнаго (пайнаго) состава.
Въ 1861 г. онъ пишетъ: „Сущность этого явленія (растворимости) вовсе не ясна для насъ, потому что составляетъ переходъ между чистомеханическими явленіями (образованіемъ смћсей) и чистохимическими явленіями (образованіемъ кристаллическихъ сплавовъ, изоморфныхъ смћсей, соединеній съ кристаллизаціонной водой и т. д.)” (Органическая химія). Заканчивая свое изслћдованіе „О содиненіи спирта съ водою”, онъ пишетъ (1865), что „опредћленныя химическія соединенія составляютъ только частный случай неопредћленныхъ химическихъ соединеній, что болће полное изученіе послћднихъ отразится въ теоретическихъ воззрћніяхъ на всю {621} совокупность химическихъ воззрћній”. А въ 1869 г., въ первомъ изданіи „Основъ химіи” мы читаемъ: „... Есть цћлый рядъ другихъ соединеній, въ которыхъ отношеніе между соединяющимися тћлами можетъ измћняться, но которыя могуіъ также давать, подобно растворамъ, опредћленныя, постояннаго состава соединенія. Таковы, напримћръ, такъ называемыя изоморфныя смћшенія тћлъ, таковы, напримћръ, сплавы металловъ между собою, таковы, по всей вћроятности, и соединенія окисловъ между собою. Изученіе этого рода соединеній должно послужить къ разрћшенію химическихъ вопросовъ въ самой общей ихъ формћ”. Наконецъ въ 1887 г., окончивъ свое „Изслћдованіе водныхъ растворовъ по удћльному вћсу”, Менделћевъ пишетъ: „Теперь мнћ ясно и уже несомнћнно, что растворы управляются обычными законами химическаго воздћйствія... и что впередъ химія растворовъ произведетъ свое вліяніе не только на пониманіе сплавовъ, изоморфовъ и тому подобныхъ, такъ называемыхъ неопредћленныхъ соединеній, но и на пониманіе обычнћйшихъ явленій химической природы...”.
Это — научное credo Д. И. Менделћева, которое онъ безъ измћненія повторялъ, начиная съ 1861 г., и отстаивалъ еще въ послћднемъ изданіи своихъ „Основъ” (1906 г.).
Но подробному и успћшному научному изслћдованію металловъ, взаимныхъ ихъ соединеній и измћненій, предшествовалъ рядъ технически важныхъ открытій, связанныхъ съ важнћйшими и своеобразнћйшими изъ металловъ — съ желћзомъ и сталью. На первомъ мћстћ стоятъ имена двухъ русскихъ практиковъ-ученыхъ, Аносова и Чернова.
Павлу Петровичу Аносову (1797-1851) наука и техника обязаны многими цћнными изслћдованіями и практическими усовершенствованіями въ стальномъ производствћ; онъ далъ, напримћръ, установку производства графитовыхъ тиглей и способъ закалки стали въ сгущенкомъ воздухћ (1827), произвелъ точное изслћдованіе состава и условШ произзодства и выплавки булатовъ (О булатахъ, 1841), причемъ онъ уже въ 1831 г. примћниль микроскопъ къ опредћленію структуры стали. Лишь въ 1864 г. появились изслћдованія Сорби о структурћ стали и способахъ ея изслћдованія. А въ 1868-9 г. появились классическія работы Д. К. Чернова относительно изслћдованія кристалловъ стали посредсівомъ камерылюциды и микроскопа; онъ впервые далъ критическія точки {622} измћненія структуры стали (точка „а” и точка „b”), — если температура стали переходить за точку b, сталь быстро переходитъ изъ кристаллическаго или зернистаго состоянія въ аморфное, которое сохраняется до плавленія; — если, обратно, произвести быстрое охлажденіе до температуры ниже b, то аморфное состояніе можетъ быгь фиксировано; точка а характеризуется явленіемъ самонагрћванія, или рекалесценціею желћза, при ней охлаждекіе какъ бы пріостанавливается вслћдствіе выдћленія тепла (образованіе карбида). Значеніе этихъ открытій Чернова признано новћйшей металлографіей; такъ, еще недавно Соверъ писалъ: „Если Сорби былъ піонеромъ металлографіи, а Черновъ — ея отцомъ, то Осмондъ несъ ея факелъ...” („Металлографія желћза и стали”). Изъ другихъ спеиіалистовъ назовемъ еще В. Ф. Желћзнова, Лаврова, Калакуцкаго, Ржешотарскаго.
Съ наступленіемъ XX вћка въ Россіи возникла школа химиковъ-металлографовъ.
Нынћ химія металловъ и ихъ сплавовъ, смћсей и соединеній, или металлидовъ, какъ называетъ ихъ Н. Курнаковъ, составляетъ одну изъ самыхъ интересныхъ частей химіи вообще, давшую уже и сейчасъ чрезвычайно богатый и съ научной точки зрћнія важный матеріалъ. Такая перемћна послћдовала въ связи съ развитіемъ экспериментальной техники (пирометріи и металлографіи) и благодаря термодинамикћ и разработанному Рузебумомъ ученію о разнородныхъ равновћсіяхъ съ точки зрћнія теоріи фазъ.
Въ Россіи новая металлохимія достигла выдающихся успћховъ; русскими учеными былъ произведенъ рядъ образцовыхъ изслћдованій, представляющихъ дћйствительно цћнное обогащеніе науки и проложившихъ во многихъ отношеніяхъ новые пути.
Были выработаны или усовершенствованы методы полученія сплавовъ въ чистой формћ, созданы методы ихъ физическаго изслћдованія, изученъ составъ сплавовъ. Первымъ представителемъ этого новаго направленія въ Россіи является Н. С. Курнаковъ, который съ 1899 г. и до нашихъ дней проявляетъ примћрную по интенсивности научную дћятельность и успћлъ создать русскую школу изслћдователей по металлографіи. Онъ далъ раціональную номенклатуру этихъ взаимныхъ соединеній металловъ, введя терминъ „металлидовъ” (1905), усовершенствовалъ для термическаго {623} анализа региструющій пирометръ (1904), примћнивъ и выработавъ также методы электропроводности и потенціала (1906), твердости (съ 1908), давленія истеченія (съ 1908) и внутренняго тренія (съ 1912) для характеристики соединеній, образующихся въ этихъ металлическихъ системахъ. Подъ его редакціею были изданы „Матеріалы для изученія металлографіи” (I—III, 1902-6) Вмћстћ со своими учениками (С. Ф. Жемчужный, Н. Ефремовъ, Н. Константиновъ, Н. Нагорновъ, Н. Подкопаевъ, Н. Пущинъ1), Н. Степановъ, Г. Уразовъ и др.) Курнаковъ изслћдовалъ бинарныя и тернарныя системы многочисленныхъ металловъ и установилъ — посредствомъ кривыхъ плавкости, электропроводности и потенціаловъ2), давленій истеченія и внутренняго тренія3) — факты химическаго взаимодћйствія и присутствіе типическихъ опредћленныхъ соединеній между металлами. Среди этихъ „химическихъ соединеній”, однако, были обнаружены соединенія перемћннаго состава, не подчиняющіяся закону простыхъ кратныхъ отношеній, т.е. какъ бы подтверждающія давно отвергнутый взглядъ Бертолле (1803 г.), что химическія соединенія могутъ происходить во всћхъ пропорціяхъ (ср. Н. Курнаковъ, Жемчужный и Татаринъ, Ж. 45, 326 (1913) и Н. С. Курнаковъ, Изв. Имп. Акад. Наукь, 1914, 321).
Болће съ технической точки зрћнія и со значительной пользою для практической металлургіи4), начиная съ 1900 г. были {624} произведены изслћдованія сплавовъ мћди A. A. Байковымъ (см. его монографію: Изслћдованіе сплавовъ мћди и сурьмы и явленій закалки, въ нихъ наблюдаемыхъ. Птр. 1902), о плавкћ мћдныхъ рудъ въ шахтенныхъ печахъ (1908), о структурћ стали при высокихъ температурахъ (1909) и т. д. Къ вопросу о строеніи закаленной стали относятся также изслћдованія В. Я. Курбатова (1903-5), изучившаго различные растворы-реактивы для отличія различныхъ фазъ стали. Н. М. Витторфъ далъ (1911) экспериментальное изслћдованіе кристаллизаціи сплавовъ желћза, содержащихъ отъ 4 до 10% углерода, въ зависимости отъ температуры (см. монографію: Предварительное изслћдованіе первичной кристаллизаціи и послћдующихъ физико-химическихъ превращеній въ желћзо-углеродныхъ сплавахъ, содержащихъ болће 4% углерода. Птр. 1911).
He менће успћшно, можетъ быть, разрабатывается металлохимія въ другомъ научномъ центрћ, который возникъ около Г. Таммана1) въ Гёттингенћ, начиная съ 1903 г., когда Тамманъ перешелъ изъ Юрьевскаго университета на каќедру неорганической химіи въ Гёттингенскій университетъ. Г. Тамманъ проявляетъ замћчательно плодотворную дћятельность въ области металлохиміи, о чемъ свидћтельствуютъ напечатанныя имъ и его учениками многочисленныя работы (болће 80) Ими изслћдованы діаграммы плавкости разнородныхъ сплавовъ, электропроводности и т. д.2).
Во всћхъ вышеупомянутыхъ фундаментальныхъ изслћдованіяхъ главную роль играютъ максимумы въ діаграммахъ плавкости; А. Горбовъ (1909) въ своей статьћ „Объ инваріантныхъ системахъ и о закономћрности состава нћкоторыхъ эвтектикъ” указываетъ и {625} на эвтектическія точки, требуя выясненія состава эвтектикъ также химическими формулами. Ф. М. Флавицкій еще въ 1896 г. выработалъ методъ плавленія для полученія эвтектическихъ сплавовъ солей и кріогидратовъ (1909); А. Васильевъ (1909) примћнилъ этотъ методъ для установленія гидратовъ, взаимодћйствія расплавленныхъ гидратовъ, опредћленія кріоацетатовъ. Замћтимъ мимоходомъ, что этотъ методъ приложимъ вообще къ изученію кріосольватовъ. ФлавицкіЙ уже въ 1896 г. (Ж. 28, 86; 33, 175) развивалъ гипотезу, согласно которой кріогидраты (кріосольваты вообще) и эвтектическіе сплавы разсматриваются, какъ продукты химическаго взаимодћйствія твердыхъ веществъ на счетъ образованія строго опредћленныхъ химическихъ соединеній. А. Васильевъ (1910) предпринялъ попытку примћненія законовъ эвтексіи къ опредћленнымъ химическимъ соединеніямъ.
Въ области кристаллохиміи русскими учеными произведены классическія работы, открывшія новую эру въ изслћдованіи явленій кристаллизаціи. На первомъ мћстћ мы должны назвать Т. Ловица, открывшаго (1794) явленія пересыщенія и переохлажденія и способы устраненія пересыщенія прививкою; открытая имъ (1789) кристаллическая уксусная кислота является исходной точкою для этихъ опытовь. Уже въ 1798 г. Ловицъ пользовался микроскопомъ для изслћдованія явленій кристаллизаціи и примћнялъ формы кристалловъ, какъ средство для анализа солей (О работахъ Ловица смотри: В. Оствальдъ, Lehrbuch d. allgem. Chemie. II, 2, Verwandtschaftslehre, 382, 705, 710. 1896—1902).
Затћмъ упомянемъ извћстнаго физика Ааольфа Яковлевича Купфера, своими трудами внесшаго новые матеріачы въ область точнаго измћренія кристалловъ; уже его диссертація (1821, въ Гёттингенћ) посвящена этому вопросу; въ 1826 г. Берлинская Академія Наукъ премировала его работу „О точномъ измћреніи угловъ кристалловъ”; далће идутъ: „Handbuch der rechnenden Krystallonomie” Спб. 1831; изслћдованія о кристаллической формћ сћры (1824), мћднаго купороса (1826), авгита (1827), красной свинцовой руды (1827), адулара (1828). Купферъ открылъ и измћрилъ минералъ ильменитъ (Kastner's Ar. Ch. X, 1. 1827). Въ честь Купферакристаллографа получилъ свое названіе минералъ „купферитъ”. {626}
Среди работъ, существенно способствовавшихъ окончательному установленію систематики кристалловъ, на первомъ мћстћ стоятъ труды Акселя Вильгельмовича Гадолина, а равно Евграфа Степановича Федорова.
Гадолинъ (род. 1828; генералъ-отъ-артиллеріи, съ 1875 г. экстраординарный, а съ 1890 г. ординарный академикъ Академіи наукъ, ум. 1892 г.) издалъ въ 1867-71 гг. классическій трудъ о выводћ всћхъ кристаллографическихъ системъ... лишь изъ одного принципа1).
Федоровъ, горный инженеръ (род. 1853 г., съ 1901 до 1905 г. ацъюнктъ Академіи наукъ), далъ въ 1885 г. въ общей формћ законъ выполненія пространства многогранниками; въ 1889 г. появилось его классическое изслћдованіе о симметріи предћльныхъ фигуръ. Давши обоснованіе 32 классовъ кристалловъ и новую номенклатуру, онъ создалъ также новый методъ ихъ изслћдованія и т. д. Его „кристаллохимическій анализъ” появился недавно въ видћ мо нографіи (Новыя идеи въ химіи. Сборникъ № 5. Птр. 1914).
Около того же времени А. Потылицынъ началъ свои изслћдо ванія причинъ пересыщенія растворовъ (1888, 1893): пересыщенные растворы образуются веществами, способными выдћляться въ видћ различныхъ гидратовъ или видоизмћненій. Затћмъ слћдуютъ работы, обратившія всеобщее вниманіе на эту область. Благодаря изслћдованіямъ Г. Ф. Вульфа (съ 1895 г.), В. Оствальда (съ 1897 г., см, выше), Г. Таммана (съ 1897 г.) впродолженіе немногихъ лћтъ были подняты и всесторонне разработаны вопросы о скорости кристаллизаціи, о переохлажденіи, дћйствіи ядеръ, предћлахъ твердаго состоянія и т. д.
Особенно много сдћлалъ въ этой области Тамманъ какъ экспериментальными изслћдованіями, частью при содћйствіи Богоявленскаго2), Фридлендера, такъ и самостоятельною теоретическою {627} разработкою. Сводку своихъ работъ Тамманъ далъ въ трудћ: Kristallisieren und Schmelzen (Braunschweig 1903). Имъ были открыты новыя полиморфныя1) формы общеизвћстныхъ тћлъ, напримћръ, воды: дедъ I, II, III, IV, V и VI, и изучены предћлы ихъ постоянства. Еще недавно (1911) Тамманъ опубликовалъ капитальное изслћдованіе „О термодинамикћ равновћсій въ системахъ изъ одного вещества”. Онъ далъ также новые матеріалы „Къ атомистической теоріи полиморфизма” (1913), сопоставивъ послћдній съ ассоціаціею тћхъ же тћлъ въ жидкомъ состояніи („неассоціированнымъ жидкостямъ всегда соотвћтствуетъ лишь одна кристаллическая группа, ассоціированнымъ жидкостямъ могуть соотвћтствовать нћсколько кристаллическихъ группъ”). Развивая дальше теорію полиморфизма, онъ далъ методъ опредћленія молекулярнаго вћса кристалловъ, расширивъ открытое (1908) П. Вальденомъ правило, согласно которому для нормальныхъ тћлъ при температурћ плавленія Т измћненіе молекулярной энтропіи M.λ/T = 13.5 = const (M.λ = молекулярной теплотћ плавленія). Если при плавленіи происходитъ диссоціація или полимеризація молекулъ, измћненіе энтропіи должно быть увеличено или уменьшено на Δα.ω/T. Отсюда, напримћръ, получается, что разница шести формъ льда заключается въ изомеріи, такъ какъ ихъ молекулярный вћсъ одинаковъ М = (H2O)3 (G. Tammann, Die Naturwissenschaften I, 1021, 1064, 1913).
Въ новћйшее время цћнные факты о скорости роста и растворенія кристалловъ были даны И. И. Андреевымъ (1908) и {628} особенно М. В. Фишеромъ (начиная съ 1912 г.). Обстоятельныя и тщательныя экспериментальныя работы Фишера касаются вопроса о постоянствћ пересыщенныхъ растворовъ и о механизмћ кристаллизаціи солей изъ послћднихъ (см. его диссертацію: Изслћдованія надъ пересыщенными растворами солей. Рига 1913). — Упомянемъ также о работахъ Вульфа по „жидкимъ кристалламъ” Лемана; Вульфъ пытается доказать, что послћдніе не представляютъ самостоятельной фазы, а являются лишь смћсью или растворомъ съ выдћлившимся въ раздробленномъ состояніи твердымъ тћломъ (1909). Неоднородность, т. е. несуществованіе въ видћ жидкихъ кристалловъ, была доказана Т. Ротарскимъ вмћстћ съ Ф. Дрейеромъ и Л. Ротинянцомъ на примћрћ параазофенетола(1906) ианизолазоксифенетола (1906). Уже раньше Г. Тамманъ (1905-6) изслћдовалъ вопросъ „о такъ называемыхъ жидкихъ кристаллахъ” и высказалъ сомнћнія относительно химической ихъ однородности. Въ послћднее время (съ 1906) П. Н. Павловъ занимался тћмъ же вопросомъ и пришелъ къ заключенію, что „жидкій кристаллъ” не есть кристаллическій индивидумъ, а представляетъ жидкій аггрегатъ мельчайшихь кристалликовъ, т. е. какъ бы четвертое гилотропное общее сОстояніе матеріи — дисперснокристаллическое. Вообще Павловъ изучалъ вліяніе поверхностной энергіи или величины твердыхъ кристаллическихъ зеренъ на испареніе, плавленіе и превращеніе въ кристаллическую жидкость (см. его диссертацію: Вліяніе поверхностной энергіи на гилотропныя превращенія твердаго кристаллическаго тћла. Одесса 1912).
Въ протиположность этой (термодинамической) теоріи плавленія дисперсныхъ системъ П. ф. Веймарнъ даетъ молекулярно-кинетическую, „векторіальную” (начиная съ 1908 г.): молекуламъ присущи векторіальныя конденсирующія силы; съ увеличеніемъ степени дисперсности твердыхъ кристаллическихъ системъ послћднія все болће и болће приближаются къ жидкому состоянію, проходя всћ состоянія, и, какъ существуетъ критическая точка жидкостьгазъ, такъ же существуетъ, при соотвћтственныхъ условіяхъ давленія и температуры, критическая точка твердое тћложидкость.
Среди русскихъ ученыхъ интересъ къ коллоидамъ проявился уже давно. Такъ, напримћръ, И. Борщовъ (1833-78; профессоръ ботаники въ Кіевскомъ университетћ) въ подробномъ трудћ (Ж. 1, {629} 194—212. 1869) развилъ интересные взгляды на строеніе коллоидовъ и произвелъ опредћленіе скорости диффузіи ихъ; изъ его результатовъ приведемъ слћдующіе: коллокды не представляютъ явленій настоящаго растворенія и всћ такъ называемые растворы коллоидныхъ тћлъ суть только болће или менће подвижныя, полужидкія массы; напомнимъ, что понятіе о псевдорастворахъ развилось гораздо позднће и что въ новћйшее время ультрамикроскопъ далъ намъ объективное подтвержденіе разнородности коллоидальныхъ растворовъ; далће, „несмотря на аморфность коллоидовъ форма ихь сложныхъ частицъ должна быть кристаллическою” и „между величиною частицъ различныхъ коллоидовъ и скоростями ихъ диффузіи существуетъ опредћленное отношеніе, а именно обратное”.
Когда около 1888 г. въ лабораторіяхъ для опредћленія молекулярныхъ вћсовъ сталъ примћняться кріоскопическій способъ Рауля, Сабанћевъ первый предпринялъ (1889) систематическое опредћленіе молекулярнаго вћса многочисленныхъ неорганическихъ и органическихъ коллоидовъ и далъ классификацію ихъ (1889-95). Одновременно Н. Н. Любавинъ (1889) изучалъ разнородные коллоиды и свертываніе ихъ при замораживаніи (вопросу о коагуляціи коллоидовъ подъ дћйствіемъ электролитовъ посвятилъ вниманіе также В. А. Волжинъ, 1910).
Когда въ началћ XX вћка изъ общей химіи выдћлилась „химія коллоидовъ”, какъ новый самостоятельный отдћлъ, съ собственнымъ журналомъ, спеціальными учебниками и каќедрами, русскіе ученые своими теоретическими и экспериментальными работами способствовали развитію этой новой отрасли. Назовемъ здћсь С. Я. Левитеса (1868—1911), А. В. Думанскаго (съ 1904 г.) и П. П. фонъ-Веймарна (съ 1907 г.). Въ особенности послћдній ученый зарекомендовалъ себя, какъ вполнћ самостоятельный и смћлый теоретикъ, плодотворный изслћдователь и писатель. Онъ первый формулировалъ (1906) положеніе, что каждое твердое кристаллическое или жидкое вещество можетъ являться въ коллоидальномъ состояніи и, vice versa, каждый коллоидъ можетъ быть превращенъ въ кристаллъ. Установленное Томасомъ Грэмомъ (1861) раздћленіе тћлъ на кристаллоиды и коллоиды должно быть, слћдовательно, оставлено, а „коллоидная химія” должна быть превращена въ ученіе о „коллоидномъ состояніи” вещества. Веймарнъ далъ общіе методы и способы превращенія тћлъ въ дисперсоидное или коллоидное состояніе, въ зависимости отъ природы растворителя (малая сила растворенія) {630} и концентраціи; онъ предложилъ новую номенклатуру (напримћръ, дисперсоидологія = коллоидная химія) и новую систематику аггрегатныхъ состояній и т. д.
Изъ его монографій назовемъ: Къ ученію о состояніяхъ матеріи. Птр. 1910.
Значеніе коллоидной химіи для различныхъ отраслей естествознанія. Птр. 1911.
Grundzuge der Dispersoidchemie. Dresden 1911. Новая систематика аггрегатныхъ состояній. Птр. 1913.
Основы дисперсоидологической теоріи истинныхъ растворовъ, Птр. 1913.
Успћхи коллоидной химіи за 50 лћтъ. Птр. 1913.
Интересные теоретическіе взгляды „о переходћ отъ кристаллическихъ къ коллоидальнымъ тћламъ” (1906 и 1908) были высказаны В. Б. Куриловымъ; его „эволюціонный принципъ въ химіи” (1908) даетъ химическую цћпь, начинающуюся съ первичной матеріи и кончающуюся коллоидными веществами и плазмою (см. также новћйшія работы этого ученаго, 1912).
Изученію коллоидовъ, въ частности ученію объ адсорбиіи посвятилъ рядъ цћнныхъ работъ A. B. Раковскій (1911); онъ изучалъ (1913) адсорбцію щелочей и солей коллоидомъ-крахмаломъ, примћнивъ ученіе о гидролизћ къ адсорбціоннымъ соединеніямъ („крахмалатамъ”, напримћръ, щелочныхъ металловъ).
Созданная Д. И. Менделћевымъ (1869-71) періодическая система элементовъ устанавливаетъ законъ, что свойства элементовъ являются періодическими функціями ихъ атомныхъ вћсовъ или „химическія и физическія свойства соединеній, образуемыхъ элементами, находятся въ періодической зависимости отъ величины атомнаго вћса элементовъ”. Эта закономћрность требовала провћрки и вызвала рядъ экспериментальныхъ изслћдованій о вліяніи атомнаго вћса на химическія реакціи, равновћсіе, прочность {631} тћлъ и т. д. Подъ вліяніемъ Менделћева появляются классическія изслћдованія въ этомъ направленіи Г. Густавсона (1871-3), которыя, въ связи съ изслћдованіями Н. Бекетова (съ 1865 г.), оказываютъ вліяніе на превосходныя работы А. Л. Потылицына (начиная съ 1872-4 г.). Остановимся на всћхъ этихъ изслћдованіяхъ.
Вполнћ независимо, и еще до опубликованія закономћрности Менделћева, Н. Н. Бекетовъ въ 1859 г. предпринимаетъ изслћдованіе вліянія массы (атомнаго вћса) элементовъ на прочность составленныхъ ими соединеній: „наиболће прочными соединеніями оказываются тћ, въ которыхъ вћсъ обоихъ паевъ наиболће приближается къ равенству, и съ увеличеніемъ разницы въ вћсћ соединенныхъ паевъ уменьшается прочность соединеній”. Выводъ этотъ получается, какъ результатъ двухъ серій изслћдованій надъ явленіями вытћсненія однихъ элементовъ другими, а именно 1) вытћсненія металловъ изъ водныхъ растворовъ ихъ солей водородомъ и 2) вытћсненія металловъ изъ ихъ кислородныхъ соединеній алюминіемъ. Впослћдствіи (1872) Бекетовъ доказалъ, что водородъ возстановляетъ окись натрія въ металлическій натрій, а равно окиси калія (1881), литія (1883), рубидія (1884) и цезія (1894) въ свободные металлы,—послћдняя окись даетъ цезій уже при обыкновенной температурћ. Полученные такимъ образомъ окиси и металлы первой группы были изучены Бекетовымъ. Прибавимъ, что эта замћчательная реакція Бекетова многократно изучалась съ новыхъ точекъ зрћнія не только иностранными, но и русскими химиками, напримћръ, А. Потылицынымъ (187980), Тамманомъ и Нернстомъ (1892), наконецъ, В. Ипатьевымъ (съ 1909 г.).
He менће важное значеніе имћетъ другая реакція Бекетова — возстановленіе окисловъ посредствомъ алюминія: это „большое сродство алюминія къ кислороду” привело Гольдшмидта къ открытію (1898) его извћстнаго „алюминотермическаго способа”. Водородъ, какъ возстановитель, примћнялся Н. Н. Бекетовымъ (1869) и къ угольной кислотћ, которая при этомъ переходитъ въ муравьиную кислоту, — явленіе, важное для физіологіи растеній (ассимиляція углекислоты) и вызвавшее труды Байера (1874), А. Баха (1893), Либена (1895) и др.
Перейдемъ теперь къ разсмотрћнію работъ Густавсона и Потылицына; работы эти частью связаны съ изслћдованіями Н. Бекетова, частью касаются новаго фактора, отсутствія растворителя — воды.
| {632} |
Уже Гротгусъ въ 1816 г. вывелъ заключеніе, что необходимо обращать вниманіе на среду, въ которой происходитъ реакція; вслћдствіе этого всћ реакціи обмћна, изслћдованныя въ водныхъ растворахъ, являются односторонними и не даютъ намъ полной картины мћры перемћщеній и сродства атомовъ.
Поэтому реакціи, произведенныя въ отсутствіи воды, т.е. строго говоря, въ присутствіи неводнаго растворителя (такъ какъ одно изъ дћйствующихь тћлъ или оба всетаки могутъ функціонировать въ роли растворителя или взаимно растворяющихся вещесгвъ), имћютъ существенное значеніе. Г. Густавсонъ первый (1871-2) произвелъ подобныя изслћдованія (его магистерская диссертація: Опыты изслћдованія реакцій взаимнаго обмћна въ отсутствіи воды. Птр. 1873); онъ примћнялъ температуры до 210°, нагрћваніе велось отъ 14 до 60 сутокъ, а взаимодћйствіе относилось къ жидкимъ соединеніямъ хлора и брома съ боромъ, углеродомъ, оловомъ, кремніемъ, титаномъ, фосфоромъ и мышьякомъ. Оказалось, что въ хлористыхъ соединеніяхъ элементовъ В, Si, Ti, As, Sn замћщеніе хлора бромомъ тћмъ больше, чћмъ больше атомный вћсъ этого элемента1).
Дальнћйшая серія опытовъ взаимодћйствія тћлъ въ безводной средћ, однако не гомогенной, какъ у Густавсона, а гетерогенной, была произведена А. Л. Потылицынымъ, ученикомь и приверженцемъ взглядовъ Менделћева (Алексћй Лаврентьевичъ Потылицынъ родился въ 1845 г. въ Красноярскћ; отъ 1881 до 1883 былъ профессоромъ химіи въ Сельско-Хозяйственномъ Институтћ въ Новой Александріи, отъ 1883 до 1895 профессоромъ Варшавскаго Университета, отъ 1895 до 1900 директоромъ Сельско-Хозяйственнаго Инстигута, ум. 1905 г.). Назовемъ его работы о вытћсненіи — въ отсутствіи воды — хлора бромомъ изъ хлористыхъ металловъ и брома изъ бромистыхъ металловъ — хлоромъ (съ 1875 г.), о вытћсненіи галоидовъ кислородомъ, о дћйствіи хлористаго водорода на бромистые металлы, сухого водорода на сухія галоидныя соли (1879), о разложеніи сухихъ солей галоидокислородныхъ кислотъ (съ 1888 г.) {633} и др. Потылицынъ изучалъ также вліяніе атомнаго вћса на вытћсненіе, напримћръ, бромомъ хлора изъ хлористыхъ металловъ: количество вытћсняемаго хлора возрастаетъ съ увеличеніемъ атомнаго вћса металла. Приведемъ классическія диссертаціи Потылицына: О способахъ измћренія химическаго сродства (Птр. 1880, магистерская диссертація); О значеніи теплоты образованія солей при реакціяхъ двойныхъ разложеній (докторская диссертація, Варшава 18861).
Въ этой области работалъ еще третій выдающійся русскій химикъ, Н. Н. Бекетовъ. Въ изслћдованіи (произведенномъ вмћстћ съ В. Н. Бекетовымъ) „О взаимномъ обмћнћ галоидныхъ солей въ расплавленномъ состояніи” (1903) Н. Н. исходитъ изъ своихъ взглядовъ о вліяніи атомныхъ вћсовъ и эквивалентовъ на ходъ сочетанія элементовъ между собою (съ 1859-65 г.); результаты дћйствительно показываютъ, что соединеніе элементовъ между собою регулируется принципомъ: элементы съ большимъ атомнымь вћсомъ стремятся къ болыиимъ, а элементы съ меньшими атомными вћсами къ меньшимъ.
Къ классу реакцій въ отсутствіи воды относятся также изслћдованія И. Каблукова (1908) о взаимодћйствіи между расплавленнымъ азотнокислымъ серебромъ и галогенидами калія, дающемъ полный обмћнъ,—равнымъ образомъ работы В. Мостовича (1907-11) объ отношеніи CaSO4, BaSO4, PbO при высокой температурћ и въ присутствіи кремнезема, окиси углерода и т. д. Сюда относятся продолжительныя и цћнныя изслћдованія М. Глазенапа о цементахъ и гипсћ. Новую теорію затвердћванія пуццолановыхъ и трассовыхъ строительныхъ матеріаловъ (переходъ изъ ложнаго равновћсія, прп быстромъ охлажденіи, въ устойчивое, благодаря каталитическому дћйствію извести и воды) далъ К. Илькевичъ (1914).
Новћйшая исторія измћренія химическаго сродства навсегда связана съ именами Гульдберга и Вааге, которые первые, въ 1864-7 гг., дали количественную теорію ученія о сродствв и вновь вернулись къ ней въ 1879 г.; въ основаніе этой теоріи легъ законъ дћйствія массъ, который гласитъ, что химическое дћйствіе прямо пропорціонально количеству дћйствующаго вещества. Первая попытка {634} провћрки этой теоріи была предпринята Юл. Томсеномъ (1869) посредствомъ термохимическихъ методовъ. Но лишь съ 1876 г., съ того момента, какъ къ экспериментальному приложенію этой теоріи приступилъ В. Оствальдъ, начинается удивительное оживленіе этой области; появляются одна за другой классическія работы Оствальда, которыя создали новые количественные методы измћренія, скоро перекинулись въ область электрохиміи и остановились на теоріи электролитической диссоціаціи Арреніуса (1887). Первыя изслћдодованія Оствальда относительно распредћленія даннаго основанія между двумя кислотами даютъ „объемно-химическій” методъ, затћмъ (1878) — также въ однородной средћ — примћняется спектрометрическій методъ (свћтопреломляемость), а съ 1879 г., въ разнородной средћ, взаимодћйствіе растворимыхъ веществъ съ нерастворимыми (сћрнистый цинкъ, щавелевокислый кальцій (1880), хромокислый барій и др.). Въ 1882 г. начаты измћренія скоростей; первый рядъ такихъ измћреній по химической динамикћ относится къ превращенію ацетамида, подъ вліяніемъ кислотъ, въ уксуснокислый аммоній; въ 1883 г. сюда присоединяется методъ обмыливанія метилацетата, въ 1884 г. слћдуетъ методъ инверсіи сахара. Параллельно производится (1883-4) измћреніе электропроводности тћхъ же кислотъ. Всћ эти методы даютъ относительныя константы сродства кислотъ, независимые другъ отъ друга ряды числовыхъ данныхъ, обнаруживающіе несомнћнное сходство.
1884 годь сразу внесъ новыя идеи и новыя формы изслћдованія въ область измћренія сродства. Появился трудъ Вантъ-Гоффа: Etudes de dynamique chimique; появилась докторская диссертація молодого шведскаго физика Сванте Арреніуса, посвященная химической теоріи электролитовъ, провозгласившей про порціональность между химической активностью и электропроводностью. Тотчасъ (1884) Оствальдъ опубликовалъ результаты своихъ измћреній, подтвердившіе эту пропорціональность. Дальнћйшія изслћдованія Оствальда касаются роли строенія и состава на величины сродства кислотъ (1885) и основаній (1886-7), а равно явленій окисленія и возстановленія (1888), наконець (1888-9) онъ далъ „законъ разбавленія” и „константы сродства”, выведенныя изъ электропроводности на основаніи приложенія закона дћйствія массъ къ іонамъ1). {635}
Попутно Оствальдъ открылъ (1879) также своеобразное вліяніе нейтральныхъ солей на скорость реакціи кислотъ; напримћръ, присутствіе хлористыхъ и азотнокислыхъ солей увеличиваетъ яћйствіе свободныхъ кислотъ — явленіе, до сихъ поръ не нашедшее удовлетворительнаго объясненія, хотя оно изучалось, напримћръ, Ив. Шпоромъ (въ Ригћ) въ 1885-8 г. весьма обстоятельно, также Г. Треемъ (1886 г.), а равно Арреніусомъ (1887-8), А. Сперанскимъ (1891) и др. Въ новћйшее время, главнымъ образомъ, Богданъ Шишковскій своими изслћдованіями (1907-13) далъ новые цћнные матеріалы для выясненія этого феномена,—въ связи съ работами Вальдена и др. онъ показываетъ, что это вліяніе оказываетъ молекула соли, какъ таковой.
Школа и взгляды В. Оствальда сказались въ цћломъ рядћ изслћдованій другихъ русскихъ химиковъ. В. А. Кистяковскій (началъ свои работы въ 1890 г.) успћшнће и интенсивнће другихъ изучалъ какъ съ теоретической, такъ и съ экспериментальной стороны ходъ реакцій (напримћръ, разложеніе эстеровъ) подъ вліяніемъ неорганическихъ кислотъ, въ частности въ смћсяхъ спирта съ водою (1895, 1898). Въ 1891 г. С. Н. Реформатскій изслћдовалъ то же явленіе — разложеніе метилацетата кислотою — въ растворћ коллоидальномъ (агаръагаръ), а И. А. Каблуковъ, частью вмћстћ съ А. Цакони, измћрялъ жадность кислотъ и скорость инверсіи сахара въ водно-спиртовыхъ растворахъ.
Вліяніе давленія на скорость реакцій въ однородныхъ жидкихъ системахъ составляетъ предметъ изслћдованія Г. Таммана и А. Богоявленскаго (1897), а И. Плотниковъ (1905) впервые изслћдовалъ подробно скорость реакцій при очень низкихъ температурахъ (до —98° Ц.); изученная реакція С2Н4 + Br2=С2Н4Br2 оказалась реакціей второго порядка и дала необыкновенно большой температурный коэффиціентъ = 6.2. Въ частности вліяніе природы растворителя и природы солей составляло предметъ изслћдованія П. Вальдена и М. Центнершвера (1909), изучившихъ скорость обмћнныхъ реакцій между диметилсульфатомъ и солями.
Вліяніе растворителя на константу равновћсія изучалъ также Л. Писаржевскій (1909-12),— имъ изслћдована роль растворителя {636} (воды, смћшанныхъ спиртоводныхъ, ацетоно- и глицериноводныхъ и др. растворителей), его внутренняго тренія, растворимости, степени диссоціаціи реагирующихъ веществъ, роли сольватаціи и т. д. (см. его диссертацію: Свободная энергія химической реакціи и растворитель. Москва 1912).
Выдающееся значеніе имћютъ работы A. A. Яковкина „о гидролизћ хлора” (1897-9); изученная имъ реакція хлора съ водою интересна сама по себћ и съ ней связанъ цћлый рядъ работъ другихъ авторовъ, напримћръ Е. и Б. Клименко, производившихъ очень обстоятельныя изслћдованія въ этой области и изучившихъ роль солей, температуры, а равно фотохимическій эффектъ (1889-98). Мало того, примћненіе новыхъ методовъ изслћдованія (методъ распредћленія : Н2O—ССl4 электропроводность), теоретическая обработка всего вопроса и окончательное выясненіе равновћсія между хлоромъ и водою придаютъ работамъ Яковкина особую цћнность. Въ настоящее время онћ могутъ служить „школьнымъ примћромъ” приложимости и доказательства теоріи электролитической диссоціаціи, роли водородныхъ іоновъ, увеличенія концентраціи іоновъ хлора прибавленіемъ нейтральныхъ солей съ одинаковымъ аніономъ и т. д.
Дћйствительно, „гидролизъ хлора” соотвћтствуетъ слћдующей реакціи:
+ |
– |
||||
Cl2 + Н2O2 |
 |
Н |
+ |
Сl |
+ НСlO |
и опыты показали хорошее согласіе съ выводами, вытекающими изъ теоріи электролитической диссоціаціи.
Исторія происхожденія крупныхъ научныхъ теорій и ихъ примћненія показываеть, что часто онћ рождаются въ головћ не одного лишь великаго человћка, а появляются въ нћсколькихъ пріемахъ и у нћсколькихъ лицъ. Чтобы быть жизнеспособной и принести наукћ пользу, новая идея должна быть развита въ теорію, обоснованную извћстными уже фактами и предугадывающую новые факты. Столь своеобразная и плодотворная теорія электролитической диссоціаціи Арреніуса имћетъ предшественницъ въ Россіи: о теоріи Гротгуса мы уже говорили въ своемъ мћстћ1), а сейчасъ скажемъ нћсколько словъ о работахъ Н. Каяндера. На основаніи своихъ изслћдованій Каяндеръ пришелъ къ выводамъ, близкимъ къ теоріи Арреніуса; но онъ не обладалъ ни рћшимостью, ни способностью переработать крайнія слћдствія своихъ измћреній въ новую теорію. Внћшнимъ поводомъ къ работамъ Каяндера послужили изслћдованія I. Богускаго (1876) надъ растворимостью мрамора (см. ниже). {637} Каяндеръ, трудившійся много лћтъ (1880-5) надъ рћшеніемъ вопроса о силћ кислотъ, примћнялъ методъ Богускаго, замћнивъ, однако, мраморъ магніемъ. Изслћдованія Каяндера цћнны не
столько по добытымъ числовымъ даннымъ, сколько по идеямъ, которыми руководился этотъ ученый: скорость реакціи обратно
пропорціональна внутреннему тренію среды и въ связи съ этимъ прямо пропорціональна повышенію температуры; на эту скорость вліяетъ природа кислотъ, а равно присутствіе нейтральныхъ солей (1881): для органическихъ кислотъ скорость меньше, чћмъ для неорганическихь, но авторъ предполагаетъ, что въ дћйствительности эквивалентныя количества всћхъ кислотъ растворяютъ въ единицу времени одно и тоже количество магнія. Затћмъ авторъ устанавливаетъ аналогію въ реакціяхъ растворенія магнія и въ электропроводности кислотъ и солей, такъ какъ послћдняя также зависитъ отъ диффузіи или внутренняго тренія. Онъ развиваетъ по этому поводу рядъ интересныхъ взглядовъ, исходя изъ того факта, что въ отсутствіи воды, напримћръ, электропроводность и скорость реакціи кислотъ равны нулю, природа растворителя имћетъ такое же вліяніе на химическую энергію тћлъ, какъ и на ихъ способность проводить электричество; онъ доказываетъ что зависимость скорости реакцій отъ концентраціи подобна такой же зависимости электропроводности, что максимумы и минимумы въ кривыхъ показываютъ одинаковое отношеніе, и ищетъ объясненія этихъ сходствъ въ обоихъ рядахъ явленій. Разобравъ возможныя причины, онъ видитъ объясненіе въ разложеніи кислоты или ея соединеній съ растворителемъ; однако, гидратація одна недаетъ объясненія, поэтому „естественнће, кажется, было бы положить объясненіе механическаго вліянія среды въ слћдующемъ (хотя и это предположеніе должно быть оставлено). Много есть данныхъ за то представленіе, что между частицами многихъ тћлъ, находящихся въ растворахъ, происходитъ постоянный обмћнъ ихъ составныхъ частей... Если мы предположимъ далће, что въ данномъ объемћ раствора кислоты количество частицъ, получившихъ способность обмћна (назовемъ ихъ хоть разомкнутыми частицами), пропорціонально количеству прибавленнаго растворителя и что реагируютъ легко только такія разомкнутыя частицы, то измћненіе величинъ s (количества магнія, раствореннаго одной грамммолекулою кислоты) съ концентраціею сдћлается, повидимому, лонятнымъ. Это измћненіе будетъ зависћть, такимъ образомъ, не отъ измћненія {638} свойствъ даннаго количества частицъ кислоты, а отъ измћненія числа частицъ, обладающихъ даннымъ свойствомъ”... (Ж. 13, 471, 474. 1881 г.).
Дћйствительно любопытный документъ! Замћнимъ терминъ „разомкнутая частица” выраженіемъ „электролитически диссоціированная частица” и откинемъ ограниченіе „хотя и это предположеніе должно быть оставлено”,— и мы видимъ передъ собою электролитическую теорію диссоціаціи Арреніуса! Очень жаль, что Каяндеръ отступилъ передъ этими крайними выводами своихъ взглядовъ, столь логически имъ проведенныхъ. Но тћмъ не менће, эта попытка остается исторически знаменательнымь памятникомъ, знаменательнымъ для исторіи возникновенія новыхъ ученій вообще и для исторіи развитія ученія Арреніуса въ Россіи въ частности. Это ученіе встрћтило въ Россіи весьма энергичный отпоръ, хотя именно русскій ученый пришелъ къ нему логическимъ путемъ еще раньше (1881) Арреніуса; но первый не рћшился на послћдній шагъ, тогда какъ Арреніусъ смћло вывелъ всћ послћдствія изъ такого ученія, хотя и былъ вынужденъ исключить временно изъ своей диссертаціи эти еретическія заключенія, пока наконецъ въ 1887 т. не назрћло время для ихъ обнародованія!
Совершенно обособленно стоятъ изслћдованія Н. А. Меншуткина. Въ качествћ піонера онъ самостоятельно создалъ какъ предметъ, такъ и методъ своихъ экспериментальныхъ изслћдованій; обработанная имъ область — органическая химія, методъ — физическій, цћль — опредћленіе строенія тћлъ динамическими способами, a именно по скорости реакціи ихъ съ другими соединеніями. Являясь однимъ изъ важнћйшихъ изслћдователей химической динамики, Меншуткинъ долженъ считаться однимъ изъ реформаторовъ органической химіи: онъ расширилъ цћли послћдней, поставивъ на мћсто препаративной органической химіи — измћрительную и количественную. Изслћдованія Н. А. въ области химической динамики продолжались около тридцати лћтъ (1877-1906) и отличаются разнообразіемъ изученныхъ реакцій и многочисленностью изслћдованныхъ тћлъ.
Исходной точкой послужили (1877) реакціи эстерификаціи (скорость и предћлъ реакціи) ROH+HOOC.R1 = H2O + R1COOR; затћмъ идутъ изслћдованія вліянія изомеріи спиртовъ и кислотъ на образованіе тћхъ же сложныхъ эфировъ (1878-82) и обратное приложеніе эстерификаціонныхъ данныхъ къ опредћленію изомеріи спиртовъ и кислотъ. {639}
Въ 1882 г. вводится новая реакція: образованіе и разложеніе ацетанилида C6H5NH2 + СН3СООН  C6H5NH.ОССН3 + Н2O. Въ 1882 г. Меншуткинъ изучаетъ реакцію распада уксуснаго третичнаго амила СН3СООС5Н11
C6H5NH.ОССН3 + Н2O. Въ 1882 г. Меншуткинъ изучаетъ реакцію распада уксуснаго третичнаго амила СН3СООС5Н11  СН3СООН + С5Н10. Изслћдованіе образованія амидовъ кислотъ начато въ 1883 г. Затћмъ идутъ изслћдованія реакціи образованія сложныхъ эфировъ изъ спиртовъ и ангидридовъ кислотъ: напримћръ, C2H5OH + (СН3СО)2O = СН3СООС2Н5 + СН3СООН (1886), и наблюдается громадное вліяніе индифферентныхъ растворителей на скорость реакціи (1887). Въ 1890 г. начинается серія опредћленій коэффиціентовъ сродства предћльныхъ іодгидриновъ и бромгидриновъ на амины, напримћръ, N(C2H5)3 + C2H5J = N(C2H5)4J и снова устанавливается вліяніе недћятельной среды. Эти изслћдованія сдћлали имя Меншуткина популярнымъ въ физической химіи вообще. Онъ замћчаетъ также вліяніе разбавленія на скорость реакціи, a равно изучаетъ вліяніе строенія (числа цћпей) на скорость образованія аминовъ (1895). Дальнћйшія изслћдованія имћли цћлью выяснить вліяніе боковыхъ цћпей (1897-1902), циклическаго строенія и полиметиленовыхъ рядовъ (1902-6). — Изъ числа сотрудниковъ-учениковъ Н. А. назовемъ: М. Васильева, С. Астафьева, В. Омелянскаго, Д. П. Коновалова (разложеніе эфировъ третичнаго амиповаго спирта), В. Доброхотова, В. Ковалевскаго, Б. Н. Меншуткина, Н. Нагорнова, С. Прокофьева, С. Брусова, Б. Дыбовскаго, Л. Мусселіуса и др.
СН3СООН + С5Н10. Изслћдованіе образованія амидовъ кислотъ начато въ 1883 г. Затћмъ идутъ изслћдованія реакціи образованія сложныхъ эфировъ изъ спиртовъ и ангидридовъ кислотъ: напримћръ, C2H5OH + (СН3СО)2O = СН3СООС2Н5 + СН3СООН (1886), и наблюдается громадное вліяніе индифферентныхъ растворителей на скорость реакціи (1887). Въ 1890 г. начинается серія опредћленій коэффиціентовъ сродства предћльныхъ іодгидриновъ и бромгидриновъ на амины, напримћръ, N(C2H5)3 + C2H5J = N(C2H5)4J и снова устанавливается вліяніе недћятельной среды. Эти изслћдованія сдћлали имя Меншуткина популярнымъ въ физической химіи вообще. Онъ замћчаетъ также вліяніе разбавленія на скорость реакціи, a равно изучаетъ вліяніе строенія (числа цћпей) на скорость образованія аминовъ (1895). Дальнћйшія изслћдованія имћли цћлью выяснить вліяніе боковыхъ цћпей (1897-1902), циклическаго строенія и полиметиленовыхъ рядовъ (1902-6). — Изъ числа сотрудниковъ-учениковъ Н. А. назовемъ: М. Васильева, С. Астафьева, В. Омелянскаго, Д. П. Коновалова (разложеніе эфировъ третичнаго амиповаго спирта), В. Доброхотова, В. Ковалевскаго, Б. Н. Меншуткина, Н. Нагорнова, С. Прокофьева, С. Брусова, Б. Дыбовскаго, Л. Мусселіуса и др.
Какъ Д. И. Менделћевъ, такъ и Н. А. Меншуткинъ принадлежали къ числу сотрудниковъ-основателей журнала Оствальда Zeitschrift fur physikalische Chemie. Оствальдъ въ извћстіи о кончинћ Н. А. пишетъ: „Ему мы обязаны основаніемъ стехіометріи химической динамики” (Zeitschr. phys. Ch. 58, 256).
В. М. Петріевъ1) представилъ богатый экспериментальный матеріалъ, относящійся къ вопросу о распредћленіи кислотъ между основаніями (Матеріалы къ вопросу объ измћреніи силы химическаго сродства. Одесса 1885) и скорости химическихъ реакцій (О скоростяхъ реакцій при двойныхъ разложеніяхъ. Одесса 1891); онъ установилъ нћкоторую связь между атомнымъ вћсомъ металловъ и ихъ взаимной вытћсняемостью въ водныхъ растворахъ; съ другой {640} стороны, для солей органическихъ кислотъ скорость реакцій съ углекислымъ баріемъ уменьшается съ увеличеніемъ молекулярнаго вћса кислотъ. Имъ была изучена также скорость растворенія алюминія въ щелочахъ,— та же реакція была измћрена I. Г. Богусскимъ и С. I. Залћскимъ (1890), и скорость растворенія оказалась, въ общемъ, пропорціональною концентраціи кислоты. Еще ранће I. Богусскій (вмћстћ съ Н. Каяндеромъ) опредћлилъ скорость растворенія каррарскаго мрамора въ HNO3, НСl и НBr, въ зависимости отъ ихъ молекукулярнаго вћса (1876). Въновћйшее время (1914) М. Центнершверъ приступилъ вновь къ изслћдованію скорости растворенія металловъ въ кислотахъ, принимая во вниманіе концентрацію и диссоціацію кислотъ, температуру, природу растворителя и т. д.
Оригинальную новую серію изслћдованій представляютъ работы А. Фаворскаго подъ названіемъ „Явленія равновћсной изомеріи при нагрћваніи бромгидриновъ общаго состава СnН2n+1Br и СnН2nBr2 (Э. Фрицманъ, Н. Соковнинъ, Л. Кучеровъ, 1907).
П. И. Петренко-Критченко и В. Канчевъ изслћдовали скорость образованія кетоксимовъ въ спиртовыхъ растворахъ (1906).
По вопросу о вліяніи давленія р при различныхъ температурахъ Т на равновћсіе въ бинарныхъ системахъ Н. Пущинъ иИ. Гребенщиковъ произвели экспериментальныя изслћдованія (1912), изучивъ смћси органическихъ тћлъ и сплавы въ отношеніи температуры плавленія, состава эвтектической смћси и растворимости вещества, въ зависимости отъ измћненія производкой dp/dT.
Хотя первый классическій примћръ каталитическаго (или контактнаго) дћйствія кислотъ вообще былъ открытъ въ Россіи Кирхгофомъ въ 1811 г., однако, столћтній юбилей этого чрезвычайно важнаго для теоріи и техники наблюденія прошелъ въ Россіи незамћченнымъ!
Константинъ Готлибъ-Сигизмундовичъ Кирхгофъ родился въ 1764 г. въ Тетеровћ, (Мекленбургъ-Шверинъ), состоялъ фармацевтомъ при Главной Спб. Аптекћ (когда Т. Ловицъ былъ старшимъ аптекаремъ); Академія Наукъ избрала его своимъ корреспондентомъ (1807), адъюнктомъ (1809) и экстраординарнымъ академикомъ (1812-8); онъ умеръ въ Петроградћ 1833 г. Уже въ {641} 1797 г. Кирхгофъ открылъ мокрый способъ приготовленія киновари; въ 1811 г. имъ былъ открыто превращеніе крахмала въ сахаръ при кипяченіи съ сћрной кислотою, — открытіе, которое то оспаривалось, то подтверждалось и скоро вызвало цћлую литературу, заинтересовавъ Деберейнера, Каде, Біо и Персоца, и послужило исходной точкою для возникновенія цћлой промышленности (крахмальнаго сахара). По своей простотћ эта реакція является классическимъ примћромъ катализа. Въ 1814 г. Кирхгофъ открылъ другую каталитическую реакцію, не менће важную, а именно дћйствіе діастаза на крахмалъ, дающаго аналогично сћрной кислотћ сахаръ. Впослћдствіи Персоцъ и Пайенъ (1823) выдћлили діастазъ.
Психологически интересны причины, вызвавшія это открытіе; вотъ, что сообщаетъ самъ Кирхгофъ: „...Высокая цћна арабскаго гумми побудила меня искать дешеваго суррогата послћдняго. И казалось мнћ возможнымъ и достижимымъ устранить желатинообразное состояніе кипяченаго крахмала посредствомъ разбавленныхъ минеральныхъ кислотъ и теплоты; а если это удалось бы, предполагалъ я, тогда онъ (крахмалъ) долженъ былъ быть похожъ на арабское гумми”. Дћйствительно „...сћрная кислота, азотная кислота, соляная кислота и щавелевая кислота уничтожаютъ желатинообразное состояніе крахмала, и дћйствіемъ ихъ при продолжительномъ нагрћваніи крахмалъ превращается въ виноградный сахаръ. Но посредствомъ винной, лимонной, фосфорной, уксусной и сћрнистой кислотъ желатинообразное состояніе крахмала не могло быть уничтожено”1) (Кирхгофъ, О приготовленіи сахара изъ крахмала. Технол. Журн. IX, ч. I, 3 — 26 (1812); Memoir, de l'Acad. Imper. des Sciences, StPetersb. IV, 27). Для исторіи происхожденія этого открытія важно отмћтить, что въ 1810 г. Кирхгофъ напечаталъ работу „о камеди изъ каменныхъ мховъ...” (Техн. Журн. VII, ч. II, 134 (1810)). Въ бытовомъ отношеніи важно отмћтить, что открытіе Кирхгофа сразу было оцћнено въ Россіи: Академія наукъ избрала его въ экстраординарные академики, а правительство наградило его пенсіей въ 5000 руб., орденомъ св. Анны II степ. и т. д. {642}
Прошло сто лћтъ, и въ 1909 г. другой, бывшій русскій, химикъ Вильгельмъ Оствальдъ, былъ удостоенъ Нобелевской преміи за выдающіеся труды по катализу! Начавъ свои изслћдованія (каталитическое дћйствіе кислотъ на скорость омыленія метиловаго эфира уксусной кислоты и инверсіи сахара1) въ 1882 г. (въ Ригћ), Оствальдъ создалъ своими дальнћйшими трудами современное ученіе о катализћ, давъ новыя опредћленія каталитическаго дћйствія: катализаторъ не вызываетъ реакціи, а лишь ускоряетъ таковую своимъ присутствіемъ (положительный катализаторъ, но бываютъ также отрицательные катализаторы, бываетъ также автокатализъ (1890)). Въ своей рћчи „О катализћ”2) (1901) Оствальдъ далъ обзоръ и новыя перспективы ученія о катализћ, — въ нобелевской рћчи „О катализћ” (1910) онъ знакомитъ насъ съ генезисомъ своихъ личныхъ трудовъ въ этой области.
Изъ школы Оствальда и Бредига, успћшнће другихъ продолжавшаго труды Оствальда по катализу, вышелъ цћлый рядъ цћнныхъ экспериментальныхъ изслћдованій, напримћръ, М. Центнершвера (каталитическое дћйствіе газовъ и паровъ на окисленіе фосфора, 1898, 19123), Кёлихена (конденсація ацетона, 1900), Д. Турбаба (альдегидъ  паральдегидъ; см. его трудъ: Изъ области катализа. Томскъ 1901), А. Титова (отрицательный катализъ въ однородной системћ, 1903), Н. Шилова (см. его диссертацію: О сопряженныхъ реакціяхъ3) окисленія, Москва 1905), А. Ф. Антропова (о разложеніи перекиси водорода металлическою ртутью, гдћ удалось выдћлить промежуточный продуктъ реакціи, непрочную перекись ртути, 1908), И. Телетова (о разложеніи перекиси водорода платиной, 1906, 1911), Е. Шпитальскаго (подробно изучившаго каталитическое разложеніе перекиси водорода въ гомогенной системћ, 1910).
паральдегидъ; см. его трудъ: Изъ области катализа. Томскъ 1901), А. Титова (отрицательный катализъ въ однородной системћ, 1903), Н. Шилова (см. его диссертацію: О сопряженныхъ реакціяхъ3) окисленія, Москва 1905), А. Ф. Антропова (о разложеніи перекиси водорода металлическою ртутью, гдћ удалось выдћлить промежуточный продуктъ реакціи, непрочную перекись ртути, 1908), И. Телетова (о разложеніи перекиси водорода платиной, 1906, 1911), Е. Шпитальскаго (подробно изучившаго каталитическое разложеніе перекиси водорода въ гомогенной системћ, 1910).
Независимо отъ этого новаго направленія, Д. П. Коноваловъ еще въ 1885 г. приступилъ къ изученію каталитическаго вліянія твердыхъ {643} аморфныхъ тћлъ въ газообразномъ состояніи; въ зависимости отъ природы и поверхности этихъ твердыхъ (контактныхъ) веществъ изучено разложеніе уксуснаго третичнаго амила, хлористаго третичнаго амила, муравьиной кислоты и др. и изслћдована роль давленія пара (см. диссертацію: Роль контактныхъ дћйствій въ явленіяхъ диссоціаціи. Спб. 1885). Дальнћйшія работы Коновалова касались каталитическаго дћйствія кислотъ на разложеніе жидкаго уксуснаго эфира третичнаго амиловаго спирта, а равно на обратную реакцію (соединеніе амилена съ кислотами, 18878, 1907).
Что такое катализъ и каталитическая сила? По этому вопросу возникла борьба мнћній, начиная со временъ Берцеліуса, создавшаго (1836) терминъ и понятіе (катализаторъ дћйствуетъ однимъ своимъ присутствіемъ, не принимая никакого другого участія въ химическомъ процессћ), Мульдера, Деларива, Либиха, Фарадэя и др., вплоть до временъ Оствальда, своею теоріею временно пріостановившаго этотъ споръ, но не разрћшившаго загадки о катализаторћ; въ этой борьбћ, между прочимъ, принялъ участіе А. Ходневъ1) (1852). Взгляды послћдняго, впослћдствіи забытые, представляются интересными съ современной точки зрћнія, когда вновь поднятъ вопросъ о катализаторћ, какъ химически активномъ веществћ, дающемъ промежуточные продукты. Дћйствіе платины, напримћръ, при соединеніи водорода съ кислородомъ Ходневъ объясняетъ предварительнымъ образованіемъ слоя окисла платины, раскисляющагося водородомъ (въ сжатомъ состояніи) съ выдћленіемъ тепла; каталитическое дћйствіе кислотъ на крахмалъ и превращеніе послћдняго въ виноградный сахаръ объясняется предварительнымъ образованіемъ „парныхъ соединеній”: напримћръ, сћрная кислота присоединяется къ крахмалу, а это соединеніе легко распадается при нагрћваніи съ водою опять на сћрную кислоту и углеводъ, который „въ минуту выдћленія поглощаетъ воду и переходитъ въ виноградный сахаръ”, и т. д.; дћйствіе діастаза на крахмалъ также, по всей вћроятности, „состоитъ въ постепенномъ образованіи и разложеніи парныхъ соединеній”.
Довольно близкіе взгляды высказаны И. Кондаковымъ въ его трудћ „о взаимной связи контактныхъ явленій съ гидратаціонными и ферментативными” (Юрьевъ 18948). По этому взгляду катализаторъ {644} предварительно соединяется съ тћмъ веществомъ, которое должно быть присоединено, напримћръ, кислота при гидратаціи передаетъ соединенную съ ней воду гидратируемымъ тћламъ. Гипотеза о такихъ непрочныхъ промежуточныхъ продуктахъ присоединенія, какъ мы видћли, стара, но сама по себћ вћроятна. Защитникомъ ея является Д. И. Менделћевъ (Основы химіи)1). Д. X. Завріевъ разсматриваетъ (1910) катализаторъ, какъ вещество, устраняющее пассивное сопротивленіе въ реакціяхъ, которыя должны были бы идти сами собою. Катализаторъ, напримћръ, вода (влажность), платина, растворяетъ образующуюся первоначально неустойчивую систему, a изъ такого раствора выдћляется менће растворимая устойчивая система. Примћромъ каталитическаго вліянія воды можетъ служить сухая известь, не соединяющаяся съ углекислымъ газомъ даже при повышенной температурћ (А. Шуляченко).
Выдающимися по своей постановкћ и научнымъ, а равно практическимъ результатамъ являются систематическія изслћдованія Вл. А. Ипатьева; введеніемъ и послћдовательнымъ примћненіемъ двухъ новыхъ факторовъ, высокихъ температуръ и давленій, онъ расширилъ кругъ этихъ каталитическихъ реакцій вообще и основалъ новую область органической химіи. Сводку своихъ изслћдованій (1901-7) В. Ипатьевъ представилъ въ видћ отдћльнаго труда: „Каталитическія реакціи при высокихъ температурахъ и давленіяхъ”. Птр. 1907. Эти изслћдованія выдвинули, кромћ того новыя стороны каталитическихъ явленій, требующія пересмотра нашихъ теоретическихъ взглядовъ на катализъ.
В. Ипатьевъ продолжаетъ свои опыты и по настоящее время, присоединивъ (съ 1909 г.) къ органическимъ соединеніямъ также неорганическія. Въ частности, начатая имъ серія изслћдованій о вытћо неніи металловъ изъ водныхъ растворовъ ихъ солей водородомъ при высокихъдавленіяхъ итемпературахъ заслуживаетъ нашего {645} интереса еще и по той причинћ, что она является продолженіемъ и дополненіемъ изслћдованій, произведенныхъ Н. Н. Бекетовымъ. На ходъ реакціи вліяетъ давленіе, температура и концентрація растворовъ (1911); равнымъ образомъ происходитъ вытћсненіе уксусной кислоты изъ ея солей угольнымъ ангидридомъ (1913).
Примћняя большія давленія (до 100—116 атмосферъ), В. Ипатьевъ осуществилъ (1913) каталитическій синтезъ метана изъ угля и углерода въ присутствіи возстановленнаго никкеля, при температурахъ 510—520°. Онъ произвелъ также синтезь метана изъ угля или углекислаго газа и водорода въ присутствіи окисловъ металловъ, напримћръ NiO. Роль окисловъ сводится по Ипатьеву къ химическому воздћйствію, напримћръ, окись металла окисляетъ уголь въ СO2, который водородомъ возстановляется въ метанъ, а металлъ разлагаетъ воду, самъ окисляется и выдћляетъ водородъ и т. д. Что при тћхъ же условіяхъ высокаго давленія и температуры, въ присутствіи катализаторовъ происходитъ гидрогенизація (полная), изомеризація и конденсація соединеній, было указано уже при углеводородахъ (непредћльныхъ, полиметиленовыхъ и т. д.).
Важное значеніе имћютъ также изслћдованія Е. И. Орлова (1906—8) о контактномъ окисленіи посредствомъ мћди, ванадіевыхъ окисловъ, окисей торія и церія, платины и т. д. — углеводородовъ, амміака. органическихъ основаній, спиртовъ, эфира и т. д.; эти работы дали съ технической точки зрћнія цћнныя указанія на фабрикацію формалдегида посредствомъ мћди, какъ катализатора. Орловъ составилъ и издалъ первую вообще обширную монографію: О формалдегидћ (Кострома 1908); эта работа вышла также въ нћмецкомъ переводћ въ Вћнћ, — она необходима и для техника.
Одновременно были произведены замћчательныя изслћдованія по катализу еще другимъ русскимъ ученымъ: С. Фокинъ изучилъ роль гидрюровъ металловъ при возстановленіи (1906—7), разсматривая водородъ, какъ поглощенный металлами; интенсивность возстановленія зависитъ отъ легкости и величины поглощенія водорода металлами и присоединеніе водорода по мћсту двойной связи въ присутствіи платины соотвћтствуетъ законамъ мономолекулярныхъ реакцій; онъ же изслћдовалъ также каталитическую реакцію окисленія (съ 1908 г.). Его опыты объ индивидуальной роли различныхъ металловъ при каталитической реакціи окисленія, при высокихъ {646} температурахъ, напримћръ, при окисленіи метиловаго спирта въ формалдегидъ, рћзко демонстрируютъ эту роль природы металла-катализатора; такъ, напримћръ, имъ было установлено, что выходъ формалдегида изъ метиловаго спирта возрастаетъ отъ Ni... до Ag и Аu, а именно:
1.1% при Ni<Al<Mn<Co<Pt<Cu<Ag<Au< [Cu+Ag] (послћдняя пара даетъ 84%).
М. Кузнецовъ изслћдовалъ (1909) ту же реакцію, главнымъ образомъ, зависимость выхода отъ природы катализатора и температуры; при этомъ онъ обнаружилъ распадъ образовавшихся алдегидовъ съ образованіемъ окиси углерода, — послћдняя реакція оказалась общей реакціей для всћхъ алдегидовъ и была изучена (1913) количественно.
Затћмъ слћдуютъ оригинальныя и цћнныя изслћдованія Н. Зелинскаго (1911) о дегидрогенизаціи (полиметиленовыхъ углеводородовъ) катализаторомъ Pd, причемъ описанъ интересный случай избирательнаго дегидрогенизаціоннаго катализа, а равно работы Н. Зелинскаго и Н. Глинки (1911) объ одновременно протекающемъ возстановительноокислительномъ катализћ палладіевой чернью.
Н. Зелинскій и Б. Щербакъ (1912) изучали „избирательный возстановительный катализъ” на винилтриметиленћ (спироцикланћ) и доказали, что палладій (на холоду) въ присутствіи водорода размыкаетъ лишь одно кольцо, давая этилтриметиленъ; никкель (при 100°) вполнћ разрушаетъ спироцикланъ и пассивно относится (при 100°) къ этилтриметилену,— при 200° онъ переводитъ послћдній въ изопентанъ и на холоду превращаетъ спироцикланъ въ этилтриметиленъ(?). О. Филипповъ (давшій настоящее строеніе винилтриметилена, см. выше) возстановилъ тотъ же углеводородъ, въ присутствіи PtCl2 и при охлажденіи, въ метил-циклобутанъ (1914).
Съ своей стороны Н. Кижнеръ подмћтилъ для циклопропановыхъ производныхъ правило, что при своемъ разрывћ и одновременной гидрогенизаціи онћ присоединяютъ водородъ къ наиболће гидрогенизованнымъ атомамъ цикла (1912). Недавно Б. Мережковскій установилъ фактъ, что добытый имъ метилциклопропенъ переходитъ при гидрогенизаціи въ присутствіи никкеля не въ метил-циклопропранъ, а съ разрывомъ цћпи въ изобутанъ (1914).
Этимъ избирательнымъ дегидрогенизаціоннымъ катализомъ рћзко отличаются пентаметиленовые углеводороды, {647} а равно и гептаметиленовые отъ гексаметиленовыхъ: при 300° и въ присутствіи катализатора палладія или платины лишь послћдніе подвергаются дегидрогенизаціи (въ бензолъ), а первые два класса совершенно не отщепляютъ водорода (Зелинскій, 1913). Легко происходигъ каталитическая дегидрогенизація (Pd-чернью; и съ гексагидробензойной кислотою, этиловый эфиръ которой (а равно и кислота) даетъ этиловый эфиръ бензойной кислоты (Зелинскій и Н. Уклонская, 1913).
Скорость разложенія при катализћ солей надкислотъ (ванадіевой, борной) изучалъ Л. Писаржевскій (1902), a C. Танатаръ изслћдовалъ продукты катализа (Pt) гидроксиламина и гидразина въ водныхъ растворахъ (1902).
Упомянемъ еще объ изслћдованіяхъ П. И. Чейшвили (диссертація: Изученіе возстановленія растворовъ перманганата въ присутствіи катализаторовъ, 1909-11. Каталитическія свойства азбеста, 1910), а также „О пирогенетическомъ разложеніи нефтей въ присутствіи катализаторовъ” И. Остромысленскаго и И. Буржанадзе (1910).
Изъ области органической химіи приведемъ еще изслћдованія Н. Кижнера (начиная съ 1911) о каталитическомъ разложеніи алкилиденгидразиновъ (полученіе углеводородовъ); A. E. Арбузовъ и В. М. Тихвинскій установили (1913) каталитическое разложеніе фенилгидразина (на анилинъ) въ присутствіи CuCl, СuBr и CuJ; они воспользовались этимъ фактомъ для полученія замћщенныхъ индоловъ изъ гидразоновъ кетоновъ и алдегидовъ; эта реакція была примћнена къ моно- и дикетонамъ и дала пропил- и этил-пропилиндолъ (1913 г., Арбузовъ и А. Фріауфъ, Р. Вагнеръ и Н. Хруцкій).
Гидрогенизаціей (посредствомъ водорода + Pt или Pd, какъ катализатора) ацетиленовыхъ соединеній, въ частности ацетиленовыхъ гликолей, занимается Ю. С. Залькиндъ (съ 1913 г.). Посредствомъ реакціи Ж. И. Іоцича (дћйствіе кетоновъ или алдегидовъ на димагній дибромацетиленъ, 19123) Залькиндъ приготовилъ алифатическіе и ароматическіе діоксигексины (и бутины); при соединеніе къ нимъ водорода протекло въ двћ фазы, черезъ гексены въ предћльные гексаны.
Къ вышеупомянутымъ катализаторамъ-металламъ, способствующимъ реакціямъ гидрированія и окисленія, металлическимъ окисламъ (напримћръ, Al2O3), увеличивающимъ скорость дегидратаціи и т. д. (Ипатьевъ), а равно галоиднымъ соединеніямъ {648} алюминія (Густавсонъ), мћди и т. д. (Арбузовъ) присоединимъ еще изъ катализаторовъ-металлоидовъ іодъ, а равно іодистыя соединенія; такъ, напримћръ, Н. Зелинскій (1903) наблюдалъ, что индифферентные къ магнію хлориды реагируютъ (въ присутствіи этиловаго эфира) энергично, если прибавить немного іода, HJ, АlХ3 или іодмагній метила; равнымъ образомъ кристалликъ іода вызываетъ бурную реакцію магнія съ бромоуксуснымъ эфиромъ, а нћсколько капель хлористаго ацетила тотчасъ замедляютъ ее (Ю. Залькиндъ. 1913). Но и „индифферентныя” вещества сильно дћйствуюгъ на скорость реакціи магнія; напримћръ, прибавленіе ацетона и другихъ кетоновъ, а равно сложныхъ эфировъ къ раствору бромистаго этилена въ этиловомъ эфирћ замедляетъ или пріостанавливаетъ энергичную реакцію магнія съ бромистымъ этиленомъ (К. Бишофъ, 1905). Интересное ускоряющее дћйствіе галоидосоединеній открылъ Ю. Залькиндъ (1906-13) на реакціи магнія со спиртами: чистые спирты, съ магніемъ не реагирующіе, тотчасъ начинаютъ реагировать, если прибавляется немного іода или минимальныя количества органическихъ галоидопроизводныхъ, напримћръ СНСl3, CHBr3, CHJ3, C6H4BrCOOC2H5 и др.,— при этомъ іодюры дћйствуютъ сильнће бромюровъ, а эти сильнће хлорюровъ (Залькиндъ, 1913). Этоуско ряющее каталитическое дћйствіе вызывается также прибавленіемъ цћлаго ряда неорганическихъ солей къ смћси спиртовъ съ магніемъ (Я. Михайленко и П. Мушинскій, 1907-9). Продуктомъ взаимодћйствія магнія со спиртами ROH являются соединія Mg(OR)2 метиловый спиртъ даетъ кристаллоалкоголятъ Mg(OCH3)2.3СН3ОН (Залькиндъ).
Что же касается природы катализаторовъ, то напомнимъ что таковыми могутъ быть какъ кислоты (ихъ дћйствіе было открыто Кирхгофомъ, 1811), такъ и основанія, а равно соли, т. е. какъ водородные, такъ и гидроксильные іоны, а равно іоны нейтральныхъ солей вообще. Катализаторами могутъ быть какъ простые элементы, такъ и сложныя соединенія изъ элементовъ, какъ металлы, такъ и металлоиды, а изъ сложныхъ соединеній — какъ электролиты, такъ и неэлектролиты. Иными словами: катализаторомъ можетъ быть всякое тћло. Однако, какъ не всякое тћло способно реагировать со всякими другими (избирательное сродство), такъ и каждому катализатору присуще каталитическое дћйствіе лишь въ зависимости отъ природы опредћленныхъ соединеній и реакцій. {649}
Къ области каталитическихъ реакцій слћдуетъ отнести также явленія биротаціи (мультиротаціи) нћкоторыхъ сахаровъ; обширныя и цћнныя изслћдованія по этому вопросу произвелъ Г. Г. Трей (въ Ригћ), который изучалъ (1895-1903 г.) условія измћненія вращательной способности глюкозы (магистерская диссертація, 1903) и лактозы (докторская диссертація: Матеріалы для изученія оптическаго вращенія лактозы. Рига 1904). Катализаторомъ въ этомъ случаћ является отчасти растворитель — вода, дающая гидроксильные іоны. Но и дћйствіе растворителей вообще какъ индифферентныхъ, такъ и активныхъ, сказывающееся въ измћненіи скорости реакцій, прочности двойныхъ солей, измћненіи вращательной способности растворенныхъ (оптически дћятельныхъ) тћлъ, вплоть до авторацемизаціи, автокатализа и т. д., во многомъ приближается къ вліянію катализаторовъ. Но не дћйствуетъ ли та же сила въ растворителћ и на степень іонизаціи раствореннаго электролита? He есть ли каталитическое дћйствіе лишь иная форма проявленія того запаса энергіи, которая присуща вообще каждому тћлу и въ химіи разсматривается, какъ химическое сродство? А это сродство приводитъ къ образованію соединеній самыхъ разнообразныхъ типовъ и самой разнообразной прочности.
Интересными предметами изслћдованія — какъ по своему широкому распространенію въ природћ, такъ и вслћдствіе своей крупной роли въ физіологіи, техникћ и т. д. — являются катализаторы-ферменты или энзимы. Обстоятельныя и образцовыя экспериментальныя изслћдованія произвелъ съ точки зрћнія ученія о химическомъ равновћсіи Г. Тамманъ (1889, 1895), a C. Фокинъ подробно изучилъ (1906) ферментативное расщепленіе жировъ. Длинный рядъ цћнныхъ работъ о присутствіи и выдћленіи, а равно о химической (аналитической и синтетической) работћ ферментовъ въ растеніяхъ былъ произведенъ русскими физіологами; укажемъ лишь на Буткевича (1900), Петрушевскаго (1907), М. Крассовскаго (1910), А. Лебедева (Химическія изслћдованія надъ внћклћточнымъ спиртовымъ броженіемъ. Новочеркасскъ 1913), С. Л. Иванова (Образованіе и превращеніе масла въ растенія. Москва 1913), Палладина и Львова (о „редуктазћ” въ дрожжахъ, 1908-13) и т. д. {650}
Особенно отмћтимъ труды В. И. Палладина, изучившаго также процессъ дыханія растеній, зависимость его отъ температуры, концентраціи растворовъ (роль свћта была обнаружена уже Бородинымъ, 1876), отъ кислорода (вмћстћ съ Костычевымъ); разсматривая дыханіе растеній, какъ рядъ ферментативныхъ процессовъ, Палладинъ вводитъ понятіе о дыхательныхъ хромогенахъ (1908). Изъ трудовъ Палладина упомянемъ здћсь о слћдующихъ: Дыханіе растеній, какъ сумма ферментативныхъ процессовъ (Изв. Имп. Ак. Наукъ, 1907 и 1910), Работа ферментовъ въ живыхъ и убитыхъ растеніяхъ (XII съћздъ Русскихъ Естествоиспытателей и Врачей, Москва 1910), Физіологія растеній (VII изд., Птр. 1914).
Въ связи съ вышеизложеннымъ упомянемъ еще объ изслћдованіяхъ В. Садикова (1912), имћющихъ цћлью изучить при обыкновенной температурћ біолитическое расщепленіе посредствомъ бактерій глутина: на основаніи своихъ наблюденій Садиковъ считаетъ аминокислоты вторичными продуктами гидролиза бћлковъ, a не ихъ первичными строительными элементами.
Съ технической точки зрћнія (съ цћлью примћненія въ красильномъ дћлћ) энзимы въ ихъ дћйствіи на волокнистыя вещества были изучены С. Шиманскимъ (монографіи: Энзимная обработка волокнистыхъ веществъ. Рига 1912-3-4; Примћненіе діастафора. Рига 1910; Опредћленіе достоинства діастафора. Рига 1912). Упомянемъ также о трудћ П. Дурилина: Біологическій способъ очистки сточныхъ водъ. Москва 1911.
Полезнымъ и интереснымъ является очеркъ В. Омелянскаго „О примћненіи бактеріологическаго метода при химическомъ изслћдованіи” (1906).
Въ связи съ энзимами приведемъ еще нћсколько оріентирующихъ данныхъ по физіологической химіи.
Къ первой половинћ прошлаго вћка относятся классическія работы Карла Шмидта1). Въ 1845 г. онъ открываетъ новую форму клћтчатки (названную впослћдствіи тунициномъ), затћмъ слћдуетъ {651} микрохимическій анализъ соковъ и экстрактовъ животнаго организма (1846), янтарная кислота, какъ нормальный продуктъ спиртового броженія (1847), а въ 1852 г., вмћстћ съ Ќ. Биддеромъ, открытіе въ желудочномъ сокћ свободной соляной кислоты; кромћ того Шмидтъ произвелъ сотни анализовъ почвъ, цћлебныхъ источниковъ и водъ. Далће приведемъ имена извћстныхъ ученыхъ второй половины XIX вћка: Марцелія Вильгельмовича Ненцкаго (1847—1901), начавшаго свои изслћдованія по физіологической и органической химіи еще въ 1870 г.1) Ненцкій (частью совмћстно съ Н. Зиберъ) изслћдовалъ примћрнымъ образомъ процессы пищеваренія (мочевину, мочевую кислоту), скатолъ, индолъ, триптофанъ, желудочный сокъ, пигменты крови, строеніе пепсина и т. д.; въ изслћдованіи кристалловъ гемина и строенія пигментовъ крови, связи гематопорфирина съ филлопорфириномъ (въ растеніяхъ) участвовалъ И. А. Залесскій (частью и Н. Зиберъ, а равно М. Шалфћевъ).
Упомянемъ также о работахъ Г. ф. Бунге, касающихся сыворотки, кровяныхъ шариковъ и свойствъ крови, роли желћза въ организмћ, желудочномъ сокћ, потребности организма въ минеральныхъ веществахъ и т. д.
Процессъ пищеваренія (образованіе мочевины и мочевой кислоты) были изслћдованы еще В. Ф. Книримомъ, С. Салазкинымъ и И. Залесскимъ, О. Мооромъ („уреинъ”). Сюда относятся также изслћдованія знаменитаго физіолога Ивана Петровича Павлова2), изучившаго „работу главныхъ пищеварительныхъ железъ” (1897), образованіе и выдћленіе энзимовъ въ пищеварительномъ каналћ, зависимость состава слюны и желудочнаго сока отъ психическихъ факторовъ, роль желчи и т. д. По вопросу о составћ желчи (кислотъ желчи) работалъ Лачиновъ.
Въ области бћлковыхъ веществъ трудился А. Я. Данилевскій; его изслћдованія начинаются еще въ 1869 г. и касаются выдћленія составныхъ частей бћлковъ, опредћленія ихъ свойствъ и {652} т. д.; въ 1896 г. онъ установилъ важное физіологическое дћйствіе лецитина на ростъ юнаго организма; Данилевскій впервые наблюдалъ превращеніе пептоновъ подъ вліяніемъ энзимовъ въ нерастворимыя соединенія (синтетическій бћлокъ? пластеинъ Завьялова или коагулеза Лаврова).
Цћнныя изслћдованія о выдћленіи и свойствћ глутиновъ и „глутеиновъ” далъ В. Садиковъ; лецитины изучалъ Дьяконовъ (а также Сиверцовъ, Гликинъ). Составъ и строеніе амилоида, а равно природа хитина были изучены Н. Кравковымъ. Новыя основанія въ мясномъ экстрактћ открылъ В. Гулевичъ (карнозинъ и карнитинъ), онъ же изслћдовалъ аргининъ, тиминъ, холинъ, трипсинъ. Надъ сложными нуклеиновыми кислотами изъ различныхъ источниковъ работали С. Костычевъ, а равно К. Ковалевскій.
| {653} |
Въ 1838 году Императоръ Николай I съ Наслћдникомъ Александромъ Николаевичемъ посћтили Стокгольмъ; удостоивъ знаменитаго Берцеліуса особымъ отличіемъ, Государь сказалъ ему, что, хотя химія еще не сдћлала въ Россіи большихъ успћховъ, онъ надћется, что, вслћдствіе принятыхъ имъ мћръ, она скоро будетъ давать хорошіе плоды. — Съ этого времени прошло 75 лћтъ. Нынћ же только краткій обзоръ этихъ плодовъ, т. е. перечисленіе главнћйшихъ научныхъ результатовъ умственной работы химиковъ въ Россіи, занимаетъ болће двухсотъ страницъ.
Другая историческая справка: Въ 1893 г. несторъ русскихъ химиковъ, Н. Н. Бунге, обратился къ Русскому Физико-Химическому Обществу съ письменнымъ предложеніемъ предпринять изданіе „Біографій умершихъ русскихъ химиковъ”... „Все же, что дћлалось въ Россіи по химіи до основанія Русскаго Химическаго Общества, равно какъ и свћдћнія даже о важнћйшихъ представителяхъ химіи до 1868 года, мало разработано и трудно доступно, и всякая попытка къ составленію исторіи развитія химіи въ Россіи должна быть оставлена за отсутствіемъ доступнаго сырого матеріала...” Призывъ Н. Н. Бунге остался безъ отзвука.
Третья историческая справка: Въ 1911 году, на II Менделћевскомъ съћздћ, я имћлъ честь произнести рћчь „о развитіи химіи въ Россіи”, давъ бћглый обзоръ возникновенія химіи и ея развитія до начала XIX вћка. Въ заключеніе я обратился ко всћмъ химикамъ съ призывомъ способствовать возбужденію интереса къ исторіи химіи вообще и къ прошлому химіи въ Россіи. Мы должны писать нашу исторію химіи; м ы должны составлять біографіи нашихъ великихъ учителей химіи; мы должны собирать всћ матеріалы, относяшіеся къ возникновенію и развитію химіи въ разныхъ пунктахъ нашего отечества... {654}
Всћ слова оказались до сихъ поръ тщетными. Поэтому я рћшился на смћлое дћло и приступилъ самъ къ составленію этой первой исторіи развитія химіи въ Россіи. Совмћстными силами не удалось осуществить (впродолженіе двухъ десятилћтій) планъ Н. Н. Бунге; слабыми единоличными силами, руководимый глубокимъ убћжденіемъ въ необходимости подобнаго труда, я предпринялъ его выполненіе въ болће скромныхъ размћрахь. Пусть мой трудъ послужитъ оріентирующимъ пособіемъ для начинающихъ, возбуждая уваженіе къ творческой силћ великихъ старыхъ мастеровъ русской химіи и вызывая усиленное проявленіе творческой силы нашихъ молодыхъ химиковъ; пусть онъ послужитъ поводомъ къ появленію новыхъ и болће совершенныхъ трудовъ по исторіи химіи въ Россіи!
Рига, Свћтлое Воскресенье,
6го апрћля 1914 г.
1) Пять лћтъ спустя послћ опубликованія перваго изданія этой книги Коппъ выпустилъ свое „Entwicklung der Chemie in derneueren Zeit”.
2) Въ моемъ докладћ „Die vіеr Elemente des Aristoteles” я показалъ, что эти четыре элемента представляютъ состояніе аггрегаціи и теплоты.
3) Корр, Geschichte der Chemie III, 102.
4) Корр, Geschichte der Ghemie I, 179.
5) Ibid. I, 188.
6) Kopp, Geschichte der Chemie I, 166.
7) Корр, Geschichte der Chemie III, 123.
8) Ibid. Ill, 127.
9) Корр, Geschichte der Chemie III, 156.
10) Ibid. III. 149.
11) Корр, Geschichte der Chemie III, 143.
12) Корр, G der Ch. IV, 27.
13) Корр, G. der Chemie III, 152.
14) Ibid. I, 242.
15) Корр, G. der Ch. Ill, 201.
16) Dumas, Legons, 133.
17) Корр, G. der Ch. III, 129.
1) Новћйшіе опыты Ландольта, Zeitschr. f. phys. Chem. 55, 589 (1906), могли бы быть такъ истолкованы, если только мы не признаемъ съ нимъ, что матерія можетъ быть измельчена на такія малыя частицы, что можетъ проходить черезъ стекло.
2) Nordenskiold: Carl Wilhelm Scheele, Nachgelassene Briefe und Aufzeichnungen. Stockholm.
3) The doctrine of Phlogiston established and that of the composition of water refuted.
4) Thorpe, Essays on historical Chemistry. London 1902.
5) Пристлеи пишетъ: „Случаю, т. е говоря философски, наблюденію фактовъ, обусловленныхъ неизвћстными причинами, мы обязаны больше, чћмъ своей преднамћренности или предвзятой теоріи” (ср. Thorpe, Essays on historical Chemistry, London 1902).
6) Priestley, Experiments and observations on different kinds of air. Birmingham 1790, v. II 102, 110, 113 и сл.
7) Kopp, Q. d. Ch. I, 242.
8) Dumas, Lemons de phil. chim. 115.
9) Kopp, G. der Ch. I, 239.
10) Корр, G. der Ch. I, 262.
11) Ibid. III, 261.
12) Меншуткинъ указалъ недавно, что Ломоносовъ еще въ 1756 году высказалъ объ увеличеніи вћса при горћніи такіе же взгляды, какъ впослћдствіи Лавуазье (Ostwald Annalen der Naturphilosophie IV).
13) Корр, G. der Ch. III, 131.
14) Lavoisier Oeuvres II, 339.
15) Crell Annalen I, 58.
16) Kopp, Die Entdeckung der Zusammensetzung des Wassers 271.
17) Dumas, Lemons de phil. chim. 157.
18) Lavoisier Traite elementaire de chimie, 2 edition I, 140. Paris 1793; cm. еще Lavoisier Oeuvres I, 101.
19) Lavoisier Oeuvres II, 1.
20) Dumas, Lemons p. 129.
21) Lavoisier Oeuvres II, 103.
22) Ibid. II, 105.
23) Ibid. II, 125.
24) Ibid. II, 226.
25) Ibid. II, 129.
26) Корр, G. der Ch. III, 231.
27) Lavoisier Oeuvres II, 248.
28) Ibid. II, 619.
29) Ibid. II, 623.
30) Ср. еще Lavoisier: Traite de chim. I etc.
31) Lavoisier Oeuvres II, 289.
32) Ibid. II, 318 и 724.
33) Lavoisier Oeuvres II, 285.
34) Ibid. II, 647.
35) Ibid. 11, 654.
36) Корр, G. der Ch. 11, 275.
37) Nomenclature chim. 16.
38) Tageblatt der Naturforscherversammlung in Innsbruck 1869, 37.
39) Lavoisier Oeuvres 11, 623.
40) О долћ участія каждаго изъ нихъ въ этихъ столь важныхъ открытіяхъ cm. H. Kopp: Ober die Entdeckung der Zusammensetzung des Wassers. 1875.
41) Lavoisier Oeuvres II, 342.
42) Ibid. II, 360.
43) Ibid. III, 403.
44) Ibid. II, 586.
45) См. стр. 17.
46) Lavoisier Oeuvres II, 331.
47) Lavoisier Oeuvres II, 703.
1) Methode de Nomenclature chimique Paris 1787, 67
2) I. c 85.
3) I. c. 87.
4) I. с. 93 и 97.
5) Ibid. 52; стр. 235 онъ названъ „tartrite de potasse antimoine”.
6) Annates de Chimie XXXVI. 302; XXXVII, 151 и 221; XXXIX, 1 и 113.
7) Корр, G. der Ch. II, 296.
8) Корр. G. der Ch. II, 299.
9) Ibid. II, 301.
10) Lavoisier Oeuvres II, 546.
11) Berthollet, Stat. chim. I, 71.
12) Kopp. G. der Ch. II, 314.
13) Berthollet, Stat. chim. I, 72.
14) Ibid. I, 16.
15) Ibid. 75.
16) Berthollet, Stat. chim. I, 82.
17) Ibid. 78.
18) Ann. de Chim. XXXVI, 314.
19) Berthollet, Stat. chim. I, 79.
20) Berthollet, Stat. chim. I, 100 и 130.
21) Ibid. 1, 373.
22) Ibid.I, 367.
23) Ibid. I, 374.
24) Ann. de Chim. XXXVII, 221.
25) Berthollet, Stat. chim. II, 370.
26) Ibid. I, 87.
27) Ibid. I, 1.
28) Ann. de Chim. XXXII, 41; Journ. de Phys. LIX. 347.
29) Journ. de Phys. LI, 173; LIT, 409; LV, 325. 457. Ann. de chim. XXXII, 26; XXXVIIII, 146; LX, 260.
30) Journ. de Phys. LIX, 321; Schwefelverb. ibid. LIII, 89, LIV. 89; LIX, 265.
31) Journ. de Phys. LIX, 260.
32) Ann. de Chim. XXXII, 31.
33) Journ. de Phys. LX1V, 168.
34) Ibid. LIX, 329.
35) ibid. LX1V, 181.
36) Journ. de Phys. LXI, 352.
37) ibid. LX, 347.
38) Ann. de Chim. XXXIX, 119.
39) Proust, Journ. de Phys. LIX, 385.
40) Mem. d'Arcueil II, 440.
1) Memoir of John Dalton and history of the atomic theory 214.
2) Bergmann, Chemische Werke III, 25 и сл.
3) Lavoisier Oeuvres II, 528.
4) Richter, Uber die neueren Gegenstande der Chemie 1795.
5) Berzelius, Versuch iiber die Theorien der chem. Prop, und uber die chera. Wirkungen der Elektrizitat, Dresden 1820, 2.
6) Memoir of John Dalton 160.
7) Венцель опредћлилъ отношенія для соединенія основаній съ кислотами въ соли. Но онъ открылъ какъ разъ противоположное тому, что ему приписываетъ Берцеліусъ. См. Венцель: Uber die Verwandschaft der Korper, Dresden 1782. именно стр. 450.
8) Richter, Uber die neueren Gegenstande der Chemie, 1795, II, 66, 4ый отдћлъ.
9) Richter, Ueber die neueren Gegenstande der Chemie II, 69.
10) Ibid. II. 70.
11) Ibid. II, 92; 176.
l2) Ibid. Ill, восьмой отд. 83.
13) Richter, Ueber die neueren Gegenstande der Chemie III, восьмой отдћлъ, 127.
14) Berthollet, Versuch einer chemischen Statik; нћмецкій переводъ съ разъясненіями Fischer I, 135.
15) См. въ приведенномъ выше трудћ Smith.
16) Dalton. New system of chemical philosophy 1, 141.
17) Experiments and observations on the atomic theory by W.Higgins, 1814.
18) A comparative view of the phlogistic and antiphlogistic theories.
19) Roscoe и Harden въ своей монографіи: Entstehung der Dalton'schen Atomtheorie in neuer Beleuchtung (переводъ Kahlbaum'a, 1898) считаютъ доказаннымъ, что Дальтона привело къ атомистической теоріи его изслћдованіе диффузіи газовъ, и ссылаются на различныя мћста изъ труда Дальтона: „New system of chemical philosophy (cp. также Zeitschrift phys. Chem. 20, 359 и 22, 241).
20) Дальтонъ повидимому не излагалъ своего закона въ этой общей формћ. Ср. Memoirs of John Dalton by W. Henry, 79 и сл.
21) Dalton, New system etc. I, 212.
22) Dalton, New system etc. I, 213.
23) Ibid. I, 214.
24) Dalton, New system etc. I, 125.
25) Journal de phys. LX, 129.
26) Lavoisier, Oeuvres II, 360.
27) Ann. de Chimie VIII, 230; IX, 30.
28) Mem. de la Soc. d'Arcueil II, 207.
29) Ann. de Chimie XLIII, 137.
30) Dalton, New system of chemical philosophy I, 188.
31) New system etc. II, 556.
32) Journal de physique LXXIII, 58.
33) Ann. de Chimie XC, 43.
34) Phil. Trans. 1808, 96.
35) Ibid., 63.
36) Корр, G. d. Ch. II, 373.
37) Phil. Trans. 1814, 1, Ann. de Chim. XC. 138.
38) Уже Волластонъ замћтилъ, что анализы Венцеля не согласуются съ закономъ нейтральности.
1) Въ послћднихъ лекціяхъ мы займемся разсмотрћніемъ новћйшихъ электрохимическихъ теорій.
2) De viribus el. in motu musculari commentarius въ Commentariis Acad. Bononiae таб. VII, 1791.
3) Giornale Physicomedico di D. Brugnatelli II, 146—241.Gren's Journal fur Physik Bd. II.
4) Brugnatelli, Giornale phys. medico, томы 13, 14, переведенные Риттеромъ.
5) Beweis. dass ein bestandiger Galvanismus den Lebensprozess im Tierreich begleite. Weimar 1798.— Gilbert, Ann. der Physik II, 80, Beitrage zur naheren Kenntnis des Galvanismus. Jena 1800.
6) Ritter, Das elektrische System der Korper, 62, Leipzig 1805.
7) Berlin, Reimer 1847.
8) Gilbert, Ann. der Physik VI, 350. Уже въ 1789 году разложеніе воды было получено Дейманномъ и Петцомъ фонъ Труствикомъ съ помощью большой электрической машины.
9) Annales de chimie Ll, 167.
10) Phil. Trans. 1807, 2.—
11) Nicholsons Journ. IV, 183.—
12) Ann. de chim. ХХХVІІ, 233.
13) Phil. Mag. IX, 181.—
14) Gilbert Ann. der Physik. 1801, 5ая тетрадь; Ann. de chim. XLVI, 106. —
15) Bakerian Lecture, 1806.—
16) См. стр. 21.
17) Brugnatelli, Ann. di Chim. XIII и XIV; cp. также Ann. de chimie XL, 225.—
18) Phil. Trans. 1807, 32.
19) Phil. Trans. 1807, 39.
20) Davy, Elements of chem. philosophy, 165. —
21) Ritter, Elektrisches System, 62; cm. еще Gehlert, Physik. Wbrterbuch IV, 795.
22) Phil. Trans. 1808, 1. —
23) Ann. de Ghim. LXV, 325. —
24) Phil. Trans 1808, 6. —
25) Ibid 19. —
26) Ibid 8.
27) Phil. Trans. 1808, 32.—
28) Memoires de TAcademie 1785. 324; Stat. chim. II, 280.—
29) Phil. Trans. 1808. 35. —
30) Ibid. 1810, 59. —
31) Ibid. 1810, 16, 62 и друг. —
32) Ibid. 1809, 67, и друг.; Ann. de Chimie LXXVI, 145. —
33) Rech. physico-chimiques I, 187. —
34) Phil. Trans. 1810, 37. —
35) Qehlen Journal fur Chemie und Physik V, 482. —
36) Bibliotheque brit. 1809, 122, Nr. 323 и 324.
37) Ann. de chim. LXVi, 203.
38) Ibid. LXX, 244, Anm. —
39) Ibid. LXXV, 168 и сл., 264.—
40) Ann. de chim. LXXV, 299.—
41) Mem. de la Soc. d'Arcueil II, 53.—
42) Ann. de chim. LXVIII, 175. —
43) Rech. phys. chim. II, 250 и друг.
44) Ibid. I, 125. —
45) Ann. de chim. LXXIII, 229. —
46) Mem. de la Soc. d'Arcueil II, 268. —
47) Ann. de chim. I, 30. —
48) Бертолле, Stat, chimique, JI, 8.
49) Phil. Trans. 1800, 191. —
50) Ibid. 1809, 91. —
51) Ibid. 1809, 93.
52) Rech. phys. chim.II. 118. —
53) Ibid. II, 159.
54) Mem. de la Soc. d'Arcueil II, 339; Bullet, de la Soc. phil., No. 18, Mai 1809.
55) Mim. de la Soc. d'Arcueil II, 357. —
56) Ann. de chim. LXXVI, 112 и 129. —
57) Rech. phys. chim. II, 94.
58) Ann. d. chim., XCL, 5. —
59) Moniteur 1813, No. 336 и 346. —
60) Schweigger's Journ. f. Chemie XIV, 66. —
61) Ann. de chim. CV, 136.
62) Phil. Trans. 1810, 231. —
63) Ann. de chim. XCL 148; XCV, 162. —
64) Phil. Trans, 1815, 218.
65) Ibid. 1811, 155.—
66) Mém. de l'Acad. 18131815; Histoire СХСVIII; см. также Schweigger's Journ. f. Chem. XVII, 229.—
67) Ann. de chim. et de. phys. 1, 157 (1816).
1) Essai sur la theorie des proportions chimiques et sur 1 influence de l'Electricite, 1819,26. Cm. также Berzelius, Lehrbuch der Chemie, 1е изд., 3й т. 1й отд.; ср. еще Schweigger's Journal für Chemie und Physik VI, 119, 1812.
2) Essai etc., 85. —
3) Въ Schweigger's Journal f. Chemie VI, 129. гдћ Берцеліусъ подробно излагаетъ свою электрохимическую теорію, онъ называетъ кислородъ электроположительнымъ.
4) Lehrb. d. Chem., Dresden 1827, III., 1. Abt, 73.
5) Ibid. III., 1. Abt., 76. —
6) Lehrb. d. Chem. Ill, 1. Abt., 770—
7) Ibid. 79.
8) Lehrbuch der Chemie III, 1. Abt., 80.
9) Journal de Physique LXIII, 253.—
10) Essai sur la theorie etc. III.—
11) Cp. 34. —
12) Gilbert, Ann. Physik XLII, 45.
13) Lehrbuch der Chemie III, 1. Abt. 108.—
14) Ibid. 88.—
15) Essai sur la theorie etc. 28.
16) Lehrbuch d. Chemie III. 1, Abt. 89.—
17) Lehrbuch der Chemie HI, 1 Abt. 44.
18) Берцеліусъ, конечно. называетъ атомомъ соляной кислоты HCl = 36.5 и говоритъ, что HCl будетъ двойнымъ атомомъ (cm. Lehrbuch d. Chem.), но въ дћйствительности онъ употребляетъ большей частью формулу HCl ниже я вернусь къ этому. —
19) Essai sur la théorie etc. 30.
20) Lehrbuch d. Chemie 3. Aufl. V, 35.—
21) Essai sur la theorie etc. 118.
22) Jahresbericht tiber die Fortschritte der physikalischen Wissenschaften von Jacob Berzelius. Aus dem Schwedischen ubersetzt von Wohler 1828, 73. —
23) Lehrb. d. Chemie III, 1. Abt, 90. —
24) Annales de Chemie et de Phys. X, 395.
25) Ibid. (2) LXXIII, 5; (3) I, 139; IX, 322 и т. д. —
26) Ann. der Chem. u. Pharm. Supplementband III. 291. —
27) Pogg. Ann. Phys. Chem. XX11I. 1.
28) Traite de mineralogie. —
29) Statique chimique I, 433. —
30) Kopp, Gesch. der Chemie II, 406. —
31) Annales de Chim. et de Phys. IV, 72; VII, 399; VІІІ, 5; XIV, 326. —
32) Schweig. Journ. XIX, 133.—
33) Schweigger Journ. der Chem. und Phys. XV, 383. Прим.
34) Annales de Chimie et de Phys. XIV, 172; XIX, 350; XXIV, 264 и 355.
35) Литература, указанняя въ статьћ „Isomorphismus” въ Handworterbuch der Chemie, herausgeg. von Liebig, Poggendorff u Wohler. Въ статьћ „Isomorphic” 2-го изданія этого „Handworterbuch'a” Arzruni излагаетъ новћйшее развитіе ученія объ изоморфизмћ.—
36) Lehrbuch der Chemie III, 1 Abt. 91.
37) Lehrbuch d. Chemie III, 1. Abt. 97. —
38) Ibid. 3. AufL V. 89.
39) Berzelius Jahresbericht 1828, 73; тамъ же приведены и атомные вћса. вычисленные относительно Н = 1.
40) Lehrbuch der Chemie, 3. Aufl. II. 187 и 344.
41) Annales de Chemie et de Phys. (2) XLIX, 210; L, 170.—
42) Lehrbuch der Chemie 3. Aufl. V, 82.
43) Thomson, Annals of phil. VI, 321. —
44) An attempt to establish the first principles of Chemistry by experiment.—
45) Berzelius, Jahresbericht II, 39. —
46) Annales de Chim. et de Phys. (3) LV, 129.
47) Recherches sur les lois des proportions chimiques etc. Bruxelles 1865, и Recherches sur les rapports reciproques des poids atomiques 1860. —
48)Дюма, Handbuch der Chemie, aus dem Franz, iibersetzt. Niirnberg 1830. —
49) Ders, 1. c. I, 37.
50) Berzelius, Jahresbericht VII, 80.
51) Annates de Chimie et de Phys. XXXIII, 337; XLIV, 288; XLIX, 210; L, 170.—
52) Lemons sur la philosophie chimique, 268 и 270. —
53) См. 86.
54) Annales de Chimie et de Physique (2) XXIV, 264. —
55) Ibid. (2) L, 171.—
56) Exper. Researches Serlll, №377; Ser, VII, № 783 и сл., 1833.—
57) Handbuch der theoretischen Chemie, 2. Aufl., 1821.
1) Корр, Gesch. d. Chemie IV, 241. —
2) Cm. стр. 10. —
3) Journ. de Phys. XXVIII, 272. 1786. —
4) Gmelin, Handbuch der Chemie, 4 Aufl., IV, 3.
5) Essai sur la theorie etc., 96: сравн. еще Lehrbuch. d. Chemie III, I. Abt, 151. —
6) Cm. 26. —
7) Journal de Physique LXIV, 316; Bibliotheque britannique LIV, Nr. 4; Ann. of phil. IV, 34; Bibl. brit. LVI, 314. —
8) Mem. de la soc. d'Arcueil III, 64; Mem. de l'Acad. 1810, 121.
9) Gilbert, Ann. der Phys. XL, 46. —
10) Rech. physicochimiques II, 265. —
11) Ann. of phll. IV, 330 и 401.
12) Schweigger, Journ. XVI, 16. —
13) ibid. XVIII, 369; ср. еще Chevreul, Rech. chim. sur les corps gras.—
14) Poggendorff, Ann. d. Phys. XXI, 1; подробно въ „Anleitung zur Analyse organischer Кбгрег”. Braunschweig 1837.
15) Recherches chim. sur les corps gras d'origine animate, 1823.
16) Gilbert, Ann. der Phys. LXXI, 95.—
17) Schweigger, Journ. Chem. Phys. LIV, 440. —
18) Cp. напр. Dumas, Handbuch der Chemie. —
19) Ann. der Chemie und Pharrn. LIV, 145.
20) Berthelot, Chimie fondee sur la Synthese; cm. также его дальнћйшія изслћдованія; Bulletin de la soc chim. VII, 113, 124, 217, 274, 303, 310 и т. д. —
21) Annales de Chimie et de Phys. (2), XXIV, 264.—
22) Annates de Chimie etde Phys. (2), XXIV, 294: XXV, 288; Schweigger, Journal Chem. Phys. XL VIII, 376.
23) Phil. Trans. 1825. Ann. of. phil. XI, 44 и 95. Schweigger, Journal Chem. Phys. XLVII, 340 и 441. —
24) Замћчу здћсь кстати, что Фарадэй при этомъ случаћ открылъ также и бензолъ. —
25) Edinb. Journ. of Science VII, 298. Schweigger, Journ. Chem. Phys. LVII, 421.—
26) Ibid. VI, 284. —
27) Pogg. Ann. Phys. Chem. XIX, 305.—
28) Какъ видно отсюда, Берцеліусъ считалъ въ то время, что и въ соединеніяхъ плотность пара опредћляетъ собою атомный вћсъ. —
29) Berzelius, Jahresbericht XII, 63.
30) Ibid. XX, 2. Abt., 13. —
31) Cm. стр. 73. —
32) Cm. стр. 80 (?)—
33) Annates de Chim. et de Phys. (2) XXXIV, 337; Journ. de Pharm. XII, 630.
34) Berzelius, Lehrbuch der Chemie, 3 Aufl., IV, 6. —
35) Атомные вћса Берцеліуса см. стр. 93 —
36) Berzelius, Lehrb. der Chemie, 3 Aufl., II, 4. —
37) Journ. de Physique LXXIII, 253.—
38) Rech. physicochimiques II, 265.
39) Essai sur la theorie etc., 96. —
40) Berzelius, Lehrbuch der Chemie, 1. Aufl. Ill, 1. Abt., 149.
41) Schweigger, Journ. Chem. Phys. XVI, 105. —
42) Ann. de Chimie XCI, 160 и XCV, 311. —
43) Annales de Chimie et de Phys. (2) XXXVII, 15. —
44) Цитирую здћсь, какъ всегда, формулы автора, и потому употребляю на этомъ мћстћ атомные вћса Дюма, сведенные на Н = 1: О = 16, C = 6 и т. д.
45) Въ таблицћ вышеприведенной статьи имћются, очевидно, опечатки; ср. Dumas, Handbuch der Chemie, перев. Engelhardt, Nurnberg, V, 89.
46) Berzelius, Jahresb. VIII, 286. —
47) Ann. der Pharm. Ill, 282. —
48) Annates de Chimie XCV, 136.
49) Nomenclature chimique par Lavoisier, Guyton de Morveau etc. 35* Lavoisier, Oeuvres I, 138.—
50) Ann. der Pharm. Ill, 249. —
51) Berzelius, Atomgewichte.
52) Ann. der Pharm. Ill, 282.
53) Mem. de Math, et de Phys. des.savants etrangers 111, 633. —
54) Dumas, Handbuch der Chemie, iibersetzt von Engelhardt, V, 177; vgl. Ann, der Chemie und Pharm. XXVII, 148. —
55) Ann. der Chemie und Pharm. XXIV, 271 (1837). —
56) Ibid. XXXI, 175; XXXVII, 1; XLII, 14; XLVI, 1.
57) Ann. dcr Chemie und Pharm. XXV, 3. —
58) Compt. rend. V, 567.
1) См. стр. 70. —
2) Ann. de Chimie et de Phys. (2) II, 16. Anm. —
3) Gilbert, Ann. der Phys, XLVI, 131; Berzelius. Lehrbuch. d. Chem., 3. Auflage.
4) Берцеліусъ считаетъ атомомъ аммоній NH4, но послћдній не встрћчается въ соединеніяхъ, какъ и атомъ амміака NH3, но всегда встрћчается двойной атомъ NH4 = N2H8. Уже изоморфізмъ хлористаго аммонія съ хлористымъ каліемъ долженъ былъ побудить его писать NH4· Cl2, а не (NH4)2Сl2. —
5) Pogg. Ann. de Phys. u. Chem. XXVIII, 626. —
6) Ann. der Chem. u. Pharm. VI, 152. —
7) Ann. de Chem, u. Pharm. I, 37. —
8) Magnus. 1. c
9) Compt. rend. V, 567. —
10) Ann. der Chem. u. Pharm. IX, 1 —
11)Pogg. Ann. der Phys. u. Chem. XIV, 282. —
12) Бертело впослћдствіи показалъ, что сильнымъ встряхиваніемъ можетъ быть вызвано поглощеніе газа.
13) Mag. f, Pharm. XXXV, 105; Pogg. Ann. XXI. 533. —
14) Ann. de Chem. etdePhys. XXXVII, 15. —
15) Ann. d. Chem. u Pharm. IX, 16.
16) Ann. d. Chem. und Phar. XXIII. 1. —
17) Ann. de Chem. et de Phys. LIV, 225. Ann. d. Chem. u. Pharm. X, 277; Ibid. XV, 52. —
18) Повидимому, Дюма въ своихъ предыдущихъ опытахъ считалъ 1 атомомъ воды болће; анализы не даютъ точнаго рћшенія. —
l9) Ann. derChem. u. Pharm. IX, 15.
20) Ibid. XI, 1.—
21) Ibid. XI, 10. —
22) Ibid. XIX, 270, Anmerkung.
23) Annales de Chim. et de Phys. LV11I, 5; Ann. der Chemie u. Pharm. XIII, 78; XV, 1. —
24) Дюма и Пелиго думали, что возможво изолировать метиленъ. —
25) Compt. rend. V, 567.
26) Ann. der Chem. u. Pharm. XV, 60.
27) Ibid XXX. 139.
28) Книга Wurtz'a, Histoire des doctrines chimiques, появилась лишь во время печатанія перваго изданія этихъ лекцій, книга Kopp'a, Entwicklung der Chemie in der neueren Zeit, появилась лишь спустя нћсколько лћтъ, a Geschichte der Chemie E. v. Meyer'a лишь 20ью годами позже.
29) Gay-Lussac, Lemons de Chemie.
30) Ann. der Pharm. Ill, 263, 1832.—
31) Ann. de Chim. et de Phys. (2) LVI, 140. —
32) Ibid. lvi, 113.—
33) Phil. Trans. 1821, 47.
34) Ann. de Chim. et de Phys. (2) LV1, 143.—
35) Ann. der Chem. und Pharm. XII, 24; XIII, 76; XIV, 50; XXVIII, 246.—
36) Ibid. XVII, 157; XXVIII, 84; XXXIII, 310 XXXIV, 24 и др. —
37) Ibid. XXIV, 40; XXV, 272; ХХХII, 15; LVI, 268 и т. д.
38) Ann. der. Chemie und Pharm. VIII, 8; XIX, 38; XXXV, 292; XLI, 98; LXXII, 297; LXXVI, 298 и т. д.
39) Ibid. XII, 187; XVIII, 165; XXII, 292. —
40) Ibid XXII, 292. —
41) Ibid. XXII, 292; XXIII, 60; XLIII, 200 и т. д. —
42) См. стр. 136. —
43) Methode de Chemie par Laurent, 242; These de docteur, Paris, 20. decembre 1837, 11, 88 и 102; Ann. de Chim. et de Phys. (2) LXIII, 384; Compt. rend, X, 413; Revue scientifique I, 161.
44) Я напоминаю здћсь объ этомъ, потому что относительно этого пункта возникъ споръ о пріоритетћ, ср. Compt. rend. X, 409 и 511: уже Либихъ и Вёлеръ въ своемъ изслћдованіи о горькоминдальномъ маслћ предполагаютъ, что при образованіи хлористаго бензоила хлоръ становится на мћсто водорода. —
45) Ann. de Chemie et de Phys. (2) LX1; сравн. Gmelin, Handbuch der Chemie IV, 16.
46) Ann. der Chemie und Pharm. XXII, 303. —
47) Принципъ прилагаемой номенклатуры принадлежитъ Дюма (Ann. der Chem. und Pharm. XIV, 50). Лоранъ почти всегда ею пользовался. —
48) Bo Франціи тогда, да и теперь еще часто обозначали атомъ азога знакомъ Az (отъ Azote). Я употребляю его по причинћ, которая станетъ ясна ниже. —
49) Annales de Chim. et de Phys. (2) LXII, 23.
50) Ann. de Chemie et de Phys. (2) LXVII, 225, —
51) Annalen der Chemie und Pharm. XXV, 1.
52) Сравн. Compt. rend. VI, 629, 1838 и Berzelius' Jahresbericht 1840 XIX, 361.—
53) Journal fur praktische Chemie XV, 17.—
54) Phil. Trans. 1821, 47.
1) Dumas, Handbuch der angew. Chemie, iibersetz von Engelhardt, V, 97. —
2) Ann. der Chemie und Pharm. XII, 187.
3) Schweigger, Journ. Chem. Phys. LVII, 421. —
4) Cm. также Stromeyer, Schweigger's Jahrb. d. Chemie und Physik 1830, I, 125. Schweigger, Journal 1830, LVIII, 123. —
5) Срав. Berzelius, Lehrb. der Chemie, 3, Aufl. II, 60.—
6) Phil. Trans. 1833, 253. Ann. der Chem. und Pharm. XII, 1.
7) Berthollet, Stat. Chim. I, 117.
8) Ann. der Chemie und Pharm. ХХVІ, 113; cp. Compt. rend. V, 863.—
9) Либихъ пишетъ формулу гремучей кислоты такъ: 2H2O.Cy4O2 (H = 1, C = 12, O = 16).
10) Подъ кислотой здћсь, какъ и въ предыдушемъ изложеніи, подразумћвается ангидридъ.—
11) Liebig, 1. с. стр. 144. —
12) Гальгидратной водой Либихъ называетъ воду, которая содержится въ соляхъ и можетъ быть выдћлена или замћщена эквивалентными количествами нейтральныхъ солей.
13) Liebig. 1. с. 169. —
14) Для Либиха способность образовать пирокислогы, также является основаніемъ считать соотвћтствующія кислоты многоосновными (1. с. 169)
15) Compt. rend. V, 863. Изъ одного письма Либиха въ Французскую Академію (1838 г.) (Compt. rend. VI, 823, Ann. der Chemie und Pharm. XLV, 57), видно, что въ этомъ изслћдованіи заслуга Дюма была очень невелика. —
16) Ср. стр. 77. —
17) Griffin, The Radical Theory in Chemistry. London 1858.—
18) Ann. der. Chemie und Pharm. XXVII, 160. —
19) Cp. стр. 87.
20) Liebig, Ann. der Chemie und Pharm. XXVI, 159.
21) Статья, о которой идетъ рћчь, принадлежитъ перу Дюма и Либиха, Compt, rend. V, 863. —
22) Ann. der Chemie und Pharm. XXVI, 179.
23) Ann. der Chemie und Pharm. XXVI, 181.
24) Jahresbericht von Berzelius, Jahrgang 1838, XVIII, 264; Ann. der Chemie und Pharm. XXXI, 1.
25) Во французской статьћ Дюма считаетъ атомный вћсъ С = 6.—
26) Ann. der Chemie und Pharm. XXXII, 101. —
27) Compt. rend. VI; 689. Относительно теоріи Лорана Дюма тогда говорилъ, что за это расширеніе своихъ идей онъ не отвћчаетъ. —
28) Ann. der Chemie und Pharm. XXV, 1.
*) Слова Мефистофеля въ „Фаустћ”.
29) Berzelius, Jahresbericht XIX, 367 и др.—
30) Ann. der Chemie und Pharm. XXV, 1. —
31) Эта реакція была ранће открыта Persoz'oмъ (Introduction a TEtude de la Chimie moleculaire). Ha это указываютъ Pelouze и Millon (Ann. der Chemie und Pharm. XXXIII, 1.—
32) Ann. der Chemie und Pharm. XXXIII. 187 и 275. —
33) Ibid. ХХХIII, 259,; XXXV, 129 и 281; XLIV, 66. —
34) Ibid. XXXIV, 45.
35) Ann. der Chemie und Pharm. XXXIII, 279.—
36) Ibid. XXXIII, 261. —
37) Срав. стр. 131.
38) Ann. der Cheraie und Pharm. XXXIII, 264. —
39) Ann. der Chemie und Pharm. ХХХІІІ, 269. —
40) Ibid. XXXIII, 308. —
41) Ibid. XXXVI, 59. —
42) Ibid. CXXVII, 268.
43) Compt. rend. LXI, 792, также Ann. der Chemie und Pharm. CXXXV1II, 19; cp. далће Friedel и Ladenburg, Ann. d. Chemie und Pharm. CXLIII. 118; CXLV, 174 и 179; CXLVII, 355 и Compt. rend. LXVI, 816. —
44) Ladenburg. Ann. der Chemie und Pharm. CLX1V, 300.
45) Meyer, Ber. chem. Ges. XVI, 1465.
46) Ann. der Chemie und Pharm. XXXIII, 291. —
47) Ann. der Chem. und Pharm. XXXIII, 294.
48) Berzelius' Jahresbericht XVIII, 358.
49) Ann. der Chemie und Pharm. XXXI, 13. —
50) Berzelius Lehrbuch der Chemie, 3 Aufl. VI, 205. —
51) Poggendorff. Ann. Phys. Chem. XXVII. 573. —
52) Dumas, Handbuch der Chemie, ubersetzt von Engelhardt. I. 589. —
53) Ann. der Chemie und Pharm XXXI, 12.
54) Berzelius' Jahresbericht XIX, 375; и здћсь также Берцеліусъ пишетъ еще H вмћсто Н2. —
55) Ann. der Chemie und Pharm. XXXI, 113; XXXII, 72. —
56) Ann der Chemie und Pharm. XXXVI, 233. —
57) Ann. de Chimie et de Physique (3) X, 233. —
58) Lehrbuch der Chemie, 5 Aufl. I, 460 и 709. —
59) Берцеліусъ здћсь пользуется терминомъ, введеннымъ въ науку Жераромъ.
1) Авторъ называетъ ученіе Берцеліуса то электрохимической гипотезой, то теоріей. Прим. ред.
1) Ср. Liebig, Ann. der Chemie und Pharm. XXXI, 36.
2) Gmelin, Handbuch der theoretischen Chemie, 1. Aufl. стр. 34. Гмелинъ дћлитъ пополамъ также атомный вћсъ фосфора, и фосфорную кислоту онъ пишетъ такъже, какъ и Берцеліусъ: Р2O5. —
3) Въ Анналахъ Либиха знакъ двойного атома не употребляется, такъ что вмћсто HО писали H2O; по словамъ Либиха это было вызвано недостаткомъ соотвћтственнаго шрифта. —
4) См. стр. 99.
5) Berzelius въ Liebig's Annalen XXXI, 17; Тамъ же Dumas XLIV, 66 —
6) Jahresbericht 1835, XIV, 348.
7) Ann. der Chemie und Pharm. XXVI, 176.
8) Такъ, Жераръ начинаетъ изложеніе своихъ теоретическихъ взглядовъ (Gerhardt, Traite de Chimie IV, 561) указаніемъ на различныя формулы, возможныя для сћрнокислаго барія, т.-е. онъ высказываетъ взгляды, совершенно сходные съ вышеприведенными воззрћніями Берцеліуса. —
9) Ann. der Chemie und Pharm. XXXI, 119, примћчаніе.
10) Ann. der Chem. und Pharm. XXIII, 308. Слово Schwindler обозначаетъ шарлатанъ. Въ письмћ, написанномъ на французскомъ языкћ и адресованномъ въ „АннальГ, мнимый Виндлеръ сообщаетъ, что въ уксуснокисломъ марганцћ онъ замћстилъ хлоромъ не только водородъ, но и металлъ, и кислородъ, и даже углеродъ. Полученный при этомъ продуктъ, составленный исключительно изъ хлора, сохранилъ все-таки свойства уксуснокислаго марганца. Далће онъ добавляетъ „Хотя я знаю хорошо, что при обезцвћчивающемъ дћйствіи хлора происходитъ замћщеніе водорода хлоромъ и что вещества, къ которымъ примћняютъ законъ замћщенія и которыми такимъ образомъ бћлятъ, теперь въ Англіи, сохраняютъ свой типъ, я считаю, тћмъ не менће, что фактъ замћщенія хлоромъ углерода атомъ на атомъ, есть мое открытіе”. Далће слћдуетъ „Я узналъ, что въ Лондонћ въ магазинахъ уже появились издћлія изъ волоконъ хлора. Ихъ охотно употребляютъ въ госпиталяхъ и предпочитаютъ всћмъ другимъ матеріаламъ для ночныхъ колпаковъ, кальсонъ и проч.”. (Заимств. изъ франц. изд.).—
11) Ann. der Chemie und Pharm. XXX, 129, сравн. стр. 128. —
12) Handbuch der Chemie von Justus Liebig, Heidelberg 1843 главнымъ образомъ II, 1 и др. —
13) Сравн. стр. 119.
14) Journal für praktische Chemie XV, 37. —
15) Annates de Chimie et de Physique LXXII, 184. —
16) Compt. rend. XX, 1031. —
17) Poggendorff, Ann. der Phys. XXX, 625. —
18) Mitscherlich, Pogg. Ann. der Phys. XXXI, 628. —
19) У Дюма атомные вћса равны: С = 6, O = 16, S = 32 и т. д.
20) Poggendorff, Ann. der Phys. LIU, 95. —
21) Annales de Chimie et de Physique LXXII, 196. —
22) Poggendorff's Annalen XXXI, 283 и 634.
23) Dumas und Piria, Ann. der Chem. und Pharm. XL1V, 66. Annales de Chimie et de Phys. V, 353. —
24) Compt. rend. 1845, XVII, 312. —
25) Compt. rend, de travaux de Chimie par Laurent et Gerhardt 1845, 161.
26) Жераръ употреблялъ тогда терминъ эквивалентъ въ смыслћ Гмелина, такъ что для насъ онъ обозначаетъ иногда атомъ, иногда молекулу. —
27) Ann. der Chemie und Pharm. LXVIII, 51. —
28) Штрекеръ принимаетъ эквивалентъ воды = 9, а эквивалентъ водорода = 1.
29) Бекетовъ, Bulletin phys.math. de TAcademie de St. Petersbourg XII, 369, 1854. —
30) Kekule, Ann. der Chemie und Pharm. CIV, 130. —
31);Compt. rend. 1845, XX, 1032. —
32) Ann. der Chemie und Pharm. XLV, 250; XLVII, 37.
33) Journ. de Pharm. (3) IX, 401 и X, 5; также Ann. der Chemie und Pharm. LX, 308.
34) Compt. rend. I, 39. —
35) Gerhardt, Introduction a l'etude de la Chimie 1848. —
36) Baudrimont, Compt. rend. 1845. —
37) Ann. der Chemie und Pharm. XXXI, 36. —
38) Journal fur praktische Chemie LIII, 257. —
39) Мимоходомъ замћтимъ, что нћсколько лћтъ спустя Жераръ опять замћнилъ имидъ NH амидомъ NH2; это произошло послћ того, какъ въ 1844 г. Лоранъ (Journal für prakt. Chemie XXXVI, 13) согласился съ мнћніемъ Гофманна объ анилинћ, какъ фенамидћ, и старался его доказать.
40) Annales de Chim. et de Phys. (3) XVIII, 266, 1846. —
41) Journal fur praktische Chemie XXVII, 439; Ann. de Chim. et de Phys. (3) VII, 129; VIII, 238.
42) Berzelius, Jahresbericht XXIII, 319. —
43) Либихъ указываетъ(Апп. d. Chemie u. Pharm. XXXI, 36), что никогда не удастся опредћлить дћйствительные атомные вћса, и что поэтому лучше пользоваться эквивалентами. —
44) C = 6, O = 8, N = 14, H = 1.
45) Ср. стр. 123. —
46) Ср. стр. 124.—
47) Ср. также Griffin, Chemical Recreations.—
48) Ann. de Chim. et de Phys. (3) XV1I1, 266. —
49) Ann. de Chim. et de Phys. (3) VII, 129. —
50) Ibid. (3) VII, 140.
51) Ibid. (3) XVIII, 266.—
52) Ann. de Chimie et de Phys. (2) LXVIII, 416.
53) Ann. de Chimie et de Phys. (3) XVIII, 289.
54) Ibid. (3) VII, 129.—
55) Ibid. (3) ХVIII. 266; также Laurent, Methodc de Chimie, 77. —
56) Ann. de Chimie et de Phys. (3) ХVIII, 296; далће Compt. rend, des travaux chimiques par Laurent et Gerhardt 1840, 257. —
57) Compt. rend., des travaux chimiques par Laurent et Gerhardt 1849, 1 и сл.
58) Сравн. стр. 96. —
59) Взгляды Лорана относительно того. какъ можно объяснить существованіе нћсколькихъ эквивалентовъ одного и того же элемента, высказаны имъ въ его „Methode de Chimie”, 127.
60) Laurent и Gerhardt, Compt. rend, mensuels des travaux chimiques 1851, 129; Journal fur praktische Chemie LIII, 460. —
61) Cp. стр. 172.—
62) Annates de Chimie et de Phys. (3) ХVIII, 266.—
63) Эти соображенія считались опровергнутыми, послћ того какъ Жераръ открылъ уксусный ангидридъ и др. Но принципіально съ этимъ нельзя согласиться. Названіе ангидридъ удалось примћнить къ соединеніямъ, открытымъ Жераромъ, лишь расширивъ значеніе этого понятія. Отношенія между C2H4O2 и C4H6O3, съ одной стороны, и между C4H6O4 и C4H4O3 — съ другой, не вполнћ одинаковы. —
64) Онъ, повидимому, не зналъ, что Авогадро впервые предложилъ эту гипотезу.
1) Compt. rend. XXIII, 200. —
2) Philos. Trans. 1850. II, 759.
3) H = 1, O = 8, K = 39, Ag = 108. C = 6 и т. д. —
4) Доказано теперь, что это невћрно. Срав. Gay-Lussac, Ann. de Chimie et de Phys. LXIII, 219. —
5) Я не могъ найти въ работахъ Милона этого факта, цитируемаго Броди. —
6) Ann. der Chemie und Pharm. LII, 256. —
7) Cp. Wurtz, Lemons sur quelques points de philosophic chimique, 64.
8) Phil. Trans. 1850. II. Abt., 759. —
9) Ср. также объясненіе этого факта по Вюрцу; онъ указываетъ, что соединеніе азота съ кислородомъ происходитъ значительно легче въ присутствіи водорода (Wurtz, Lemons, 65). —
10) Pogg. Ann. der Phys. und Chem. L, 616; LIX, 240; LX1II, 250; LXV, 69161, 190 и т. д.; cp. „fiber das Ozon”, Basel 1844. —
11) Marignac и De la Rive. Archives des sciences phys. et natur. Geneve XII, 315; XVII, 61; XVIII, 153.—
12) Ann. der Chem. und Pharm. CIV, 128; CXII, 185; Annales de Cnini. et de; Phys. (3) LII, 333 и LXII, 101. —
13) Ann. der Chem. und Pharm. CXXXVIII,45 Supplementband V, 148. —
14) Cm. Dumas: Annales de Chimie et de Phys. (2) L, 170 и Deville и Troost, Compt. rend. XLIX, 239.
15) Poggendorff, Ann. der Phys. und Chem. C, 353. —
16) Cp. стр. 135.
17) Journal für praktische Chemie XXVII, 439. —
18) Ann. der Chem. und Pharm. XXVI, 154. —
19) Ann. der Chemie und Pharm. LXV, 279.
20) Ann. de Chim. et de Phys. (3) XVIII, 283. —
21) Ann. der Chern. und Pharm. LXIX, 257. —
*) Кольбе подвергалъ электролизу не свободныя кислоты, а ихъ соли. Ня полюсћ получался не свободный радикалъ, a углеводородъ, состоящій изъ двухъ радикаловъ (Прим. ред.). —
22) Compt. rend, mensuels des travaux chim. 1850.—
23) Ann. der Chem. und Pharm. LXXVII, 161. —
24) ibid., 221. —
25) Ann. der Chem. und Pharm. LXXVII, 37.
26) Compt. rend. XXVIIL 223. —
27) Ann. der Chem. und Pharm. LXVI, 129 и т. д. —
28) Ibid. LXXI, 213; LXXXV, 329. —
29)lbid. LXXXV, 354. —
30) Ann. de Chim. et de Phys. (3) XVIII, 266. —
31) Griffin претендуетъ на пріоритетъ въ воззрћніи, что щелочи не содержатъ никакой воды. Cm. Griffin, Radical Theory, 9.
32) Ср. особенно Fourcroy и Vauquelin, Scherer, Journal VI, 436; далће GayLussac, Ann. de Chim. XCV, 311 и Ann. de Chim. et de Phys. (2) II, 98.
33) Ann. de Chim. et de Phys. (2) XL1X, 190.—
34) Ann. der Chem. und Pharm. IX, 31; XIII, 27; XXIII, 31. —
35) Berzelius' Jahresbericht XV, 245.—
36) Poggendorff, Ann. der Phys. und Chem. LIII, 95; LV, 209.
37) Ann. der Chemie und Pharm. LXXXV, 108; cp. Journal de pharm. (3) XVIII, 124. —
38) Ann. der Chemie und Pharm. LXXXI. 73.
39) Ann. der Chemie und Pharm. XXII, 278.
40) Journal of the chemical Society IV, 350. —
41) Annales de Chimie et de Phys. (3) XXXVII, 332; Ann. der Chemie u. Pharm. LXXXII, 127; LXXXIII, 112; LXXXVII, 57 и 149. —
42) Ann. der Chemie u. Pharm. XCVI, 364. —
43) Ann. de Chimie et de Phys. (4) IX. —
44) Compt. rend. XXXI, 521.
45) Compt. rend. XXVIII, 224, 323; XXIX, 169, 186; Ann. der Chemie und Pharm. LXXI, 330.
46) Ср. Laurent, Annales de Chim. et de Phys. XVIII, 266. —
47) Hand worterbuch der Chemie von Liebig, Poggendorff u. Wohler, I, 698. —
48) Ann der Chemie und Pharm. LXVI, 129; LXVII, 61 и 129; LXX. 129; LXXIII. 180 LXXIV, 1,33, 117; LXXV, 356; LXXVIII, 253; LXXIX, 11. —
49) Compt. rend XXI, 145; XXV, 892. —
50) Frankland, Ann. der Chemie u. Pharm. LXXI, 215.
51) Ibid. LXX, 39; Либихъ и Вёлеръ получили бензоилъхлоридъ и бензоилъамидъ уже 20ю годами ранће; cm. Ann. der Chem. und Pharm. III, 249. —
52) Compt rend. XXXVII, 86. —
53) Ann. der Chemie und Pharm. XCU 198. —
54) Annales de Chimie et de Phys. XXXVII, 332.
55) Journal of the chemical Society IV. 350. —
56) Annales de Chimie et de Phys. (2) LXIX, 170; LXX1, 445.
57) Proc. Roy. Soc. VII, 11; Ann. der Chemie u. Pharm. ХСИ, 242.—
58)Compt. rend XXXVI, 1050. —
59) Ibid. ХХХVII, 86; XXXVIII, 457.—
60) Gerhardt, Traite de Chimie organique, t. IV, quatrieme partie.
61) Ann. der Chemie u. Pharm. XLIII, 107.
62) ibid. XLI, 79. —
63) Ibid. XLV. 330. —
64) Ibid. XLI, 169; L, 71; LV, 166; LXIV. 212; XCII, 1; XCIV, 257; XCV, 121. 307; CXV1. 153, 303; XCVIII, 367; C. 19 и т. д.
65) Относительно участія Гёнта въ развитіи теоріи типовъ см. Hunt въ Silliman's Americ. Journ. of science V, 265; VI, 173; VIII, 92; IX, 65; далће Phil. Mag. (4) III, 392. Его рекламація напечатана въ Compt. rend. LII, 247, a отвћтъ Вюрца въ Repert. de chimie pure III, 418.
66) Gerhardt, Traite de Chimie organique IV, 569. —
67) Cp. стр. 170.
68) Срав. стр. 139.
1) Gerhardt, Traite IV, 604.
2) Ср. стр. 171. —
3) Ann. der Chem. und Pharm. СШ, 39. —
4) Ibid. CII, 239. —
5) Cp. стр. 201.—
6) Ann. der Chemie und Pharm. CIV, 129.
7) Ann de Chim. et de Phys. (3) XLIV, 304; cp. также Hunt. 1 c. —
8) Pogg. Ann. der Phys. und Chem. XXVII, 367. —
9) Annales de Chimie et de Phys. XXXIX, 153; XLII, 222; Pogg. Ann. der Phys. und Chem. XV, 20. —
10) Ann. der Chemie und Pharm. XIII, 28. —
11) Cp. стр. 122.
12) Ann. der Chemie und Pharm. XXVIII, 1. —
13) Ibid. IX, 39; Pogg. Ann. XXXI, 283; Cp. также Mitscherlich, Lehrbuch, 3. Aufl. I, 107 и 586.
14) Ann. der Chemie und Pharm. LIV, 145.
15) Gilbert, Ann. XLVIII, 161.
16) Ср. стр. 159.
17) Journal of the chemical Society IV, 350. —
18) Ann. der Chemie und Pharm. LXV, 271.
19) Ibid. LXIX, 257. —
20) Compt. rend. XXV, 383 и 473; Ann. der Chemie und Pharm. LX1V. 332.—
21) Ann. der Chemie und Pharm. LXV, 288. —
22) Ibid. LXXL 171. —
23) Ibid. LXX1V, 63.—
24) Ann. der Chem.und Pharm. LXXI, 213.
25) Pebai и Freund, Ibid. СХVIII, 1; Wurtz, Compt. rend. LIV, 387; Ann der Chem. imd Pharm. CXXIII, 202; Rieth и Beilstein CXXIV,242, CXXVI, 241; Алексћевъи Beilstein, Compt. rend. LVII1, 171; Бутлеровъ, Zeitschrift fiir Chemie 1864, 384 и 702; Friedel и Ladenburg, Ann. der Chemie und Pharm. CXLH, 310; Lieben, Ibid. CXLVI, 180 и т. д.
26) Ann. der Chemie und Pharm. XXXV, 111 и LXXXIV, 69. —
27) Ibid. LXXV, 315. —
28) Ibid. LXXXV, 332.
29) Ibid. LXXXIV, 308. —
30) ibid. LXXVII, 224. —
31) ibid. CX1V, 227 и 354. —
32) Ibid. Supplementband IV, 109. —
33) ibid. CVII1, 67. —
34) Ibid. CXXVII, 31.
35) Ann. der Chem. und Pharm. LXXV,211 и LXXVI, 1. —
36) Cp. стр. 128.
37) Ann. der Chem. und Pharm. XXXI11, 319. —
38) Ann. de Chim. et de Phys. (3) X, 212.
39) Ann. der Chemie und Pharm. XLIV, 66.
40) Ann. der Chem. und Pharm. LXXXV, 330.
41) Ibid. LXXXV, 368 (1853).
42) Ann. der Chem. und Pharm. LXXXV, 371. —
43) Ann. der Chemie und Pharm. LIII, 1. —
44) Compt. rend, par Laurent et Gerhardt 1845. —
45) Ann. der Chem. und Pharm. XXIV, 40; LVL 268.
46) Kolbe, Lehrbuch der Chemie 1854, I. 20. —
47) Какъ доказательство этого положенія, которое Кольбе оспаривалъ (Journal f. prakt. Chemie (2) ХХIII, 365), какъ неправильное, я приведу слћдующее мћсто изъ руководства Кольбе (I, 23). „Франкландъ считалъ себя вынужденнымъ заключить, что въ какодилћ, въ метиловомъ соединеніи сурьмы (стибметилъ) и въ этиловомъ соединеніи олова (станэтилъ) и др. происходитъ настоящее замћщеніе различныхъ атомовъ кислорода равнымъ числомъ атомовъ метила или этила, т.-е. другими словами, что какодиловая кислота есть мышьяковая кислота, содержащая 2 атома метила, вмћсто двухъ атомовъ кислорода и что окись станэтила должна быть разсматриваема, какъ составленная по раціональной формулћ
Sn |
С2H5 |
, |
O |
выражающей замћщеніе атома кислорода атомомъ этила. Хотя съ этимъ нельзя согласиться, однако, не подлежитъ сомнћнію, что здћсь существуетъ извћстная закономћрность, Можетъ быть, слћдуетъ обратить вниманіе на то обстоятельство, что, какъ извћстно, именно тћ элементы, которые въ рядћ электрохимическаго напряженія стоятъ наиболће близко къ калію (щелочные и щелочноземельные металлы), соединяются лишь въ немногихъ отношеніяхъ съ кислородомъ, тогда какъ элементы, стоящіе на противоположной сторонћ, какъ хлоръ, сћра, азотъ, фосфоръ и др., могутъ, наоборотъ, соединяться съ кислородомъ въ весьма многихъ отношеніяхъ. Поэтому, если одинъ изъ этихъ элементовъ вслћдствіе сочетанія съ водородомъ или съ радикалами эфира, становится ближе къ калію по своей электрохимической природћ и по своимъ средствамъ, то, быть можетъ, менће страннымъ покажется его свойство соединяться теперь съ меньшимъ числомъ атомовъ кислорода, чћмъ раньше, свойство, явившееся слћдствіемъ измћнившагося положенія въ электрохимическомъ рядћ напряженій, хотя этимъ, никакъ нельзя объяснить, какимъ образомъ число атомовъ сочетанной группы и кислорода закономћрно дополняется до одного опредћленнаго числа”.
48) Ann. der Chem. und Pharm. CI, 257. —
49) Ibid., CXIII, 293. —
50) Ibid. LVII1, 337. —
51) Ibid. IX, 39. —
52) Ibid. CVII, 125.
53) Ann. der Chem. und Pharm. CXIII, 305, 1860.
54) Гипотезой многоатомныхъ спиртовыхъ радикаловъ мы обязаны не Кольбе, но, какъ будетъ ясно изъ послћдующаго изложенія, Вильямсону и Вюрцу.
55) Ann. der Chemie und Pharm. C, 129. —
56) Ann. der Chem. und Pharm. СХШ, 324.
57) Ср. стр. 200. —
58) Ann. der Chem. und Pharm. XC, 309.
59) Ann. der Chem. und Pharm. XC, 314.
60) Journal of the Chem. Soc. VII, 1, 1854. —
61) Одлингъ обозначаетъ небольшими штрихами надъ символами атомовъ ихъ валентность.
62) Proceed. Roy See. VII, 135.
63) Compt. rend. XXXVIII, 668; Ann chim. et phys. (3) XLI, 216; Ann. derChem. und Pharm. LXXXVIII, 304; XCII, 30L
64) Philos. Mag. (4) XVIII, 368, 1859.
65) Ann. de Chimie et de Phys. (3) XL1II, 492. —
66) Cp. Odling, Journal of the royal Inst. 1855. —
67) Compt. rend. XXXV, 310; XXXIX, 335. Ann. chim. phys. (3) XLII, 129. —
68) Zinin, Ann. der Chem. u. Pharm. XCVL 361; Cahours u. Hofmann C, 356. —
69) Compt. rend. XLI11, 199. 1856; cp. также XL11I, 478; XLV, 306; XLV1, 244; XLV1I, 346.
70) Compt. rend. XUV, 1306. —
71) Ann. der Chem. u. Pharm. LX, 1. —
72) Ibid. LXVI1I, 55; cp. Socoloff u. Strecker LXXX, 38.—
73) Compt. rend. XLVI, 1228.
74) Штреккеръ считалъ формулу молочной кислоты вдвое большей (Ann. der Chem. und Pharm. LXXXl, 247) —
75) Compt. rend. XLVIII, 101; XLIX, 813; L, 1195; LIV, 277. —
76) Ibid. XLIX, 813. —
77) Ibid. XL1X, 619. —
78) Ann. de Chimie et de Phys. (3) LXIX, 317.
79) Repert. de Chimie pure II, 449; cp. также Lecons sur quelques points de philos. chim., Paris. 1864, 181. —
80) Compt. rend. XLIX, 898; LIII, 388.
81) Ibid. LXV, 1015. —
82) Ibid. XLV1, 255. —
83) Instit. 1853, 213; Jahres ber. 1853, 468. —
84) Proc. Roy. Soc. X, 224 и 594; Compt. rend. XLIX 781; LI, 234; Proc. Roy. Soc. XI 278; Compt. rend. LIU, 18 etc.—
85) Ann. der Chem. und Pharm. XCVI, 302; Proc. Roy. Society, 10. Juni 1856, vol. VIII, 188.
86) Ann. der Chem. u. Pharm. C, 129.
1) Ann. de Chimie et de Phys. (3) XLIV, 306. —
2) Lehrbuch der Chemie I, 50.
3) Ann. der Chem. und Pharm. CI, 200. —
4) (C=6, 08). Теперь Keкуле снова пользуется тћми атомными вћсами, которые онъ четыре года передъ тћмъ считалъ неправильными. Кольбе (Journ. f. prakt. Chem. XXIII, 734) придаетъ значеніе тому, что Кекуле, какъ онъ самъ указываетъ, „употребляетъ слово типъ не въ смыслћ унитарной теоріи Жерара, а въ томъ смыслћ, въ какомъ оно было впервые употреблено Дюма въ его плодотворныхъ изслћдованіяхъ отипахъ”. Я считаю это несущественнымъ, особенно въ виду дальнћйшихъ словъ Кекуле: „Главнымъ образомъ, яхочу указать этимъ отношенія. въ которыхъ находятся другъ къ другу ыазванныя вещества: подъ вліяніемъ благопріятныхъ агентовъ одно изъ нихъ можетъ быть получено изъ другого или же превращено въ него”.—
5) Ann. der Chemie und Pharm. ХХХVIII, 16.
6) Ann. der Chem. u. Pharm. CIV, 130.
7) Ibid. CVI, 129.
8) Ann. der Chemie u. Pharm. XCII, 1; XCV, 121; XCV1, 1, 153. 303; XCV1I, 374, и особенно С, 19. —
9) Gerhardt, Traite de chimie organique IV, 632 и 805.
10) Compt. rend. XLVI, 1157; Ann. de Chimie et de Phys. (3) LIII, 469, 1858; въ извлеченіи: Ann. der Chem. u.Pharm. CX, 46.
11) Куперъ строитъ своеобразныя гипотезы о свойствахъ атома кислорода, очевидно, для того, чтобы не быть принужденнымъ при образованіи солей допустить замћщеніе водорода металломъ (возстановленіе окиси). По его мнћнію, 0=8 и двухатоменъ; но одна валентность должна быть всегда насыщена кислородомъ. Предћлъ способности къ соединенію предполагается равнымъ 5. —
12) Ср. стр. 221 и др.
13) Zeitschrift fur Chemie 1861, 549; 1863, 500. —
14) Ibid. VII, 1.
15) Gerhardt, Traite I, 682. —
16) Ann. der Chem. und Pharm. LXXV, 27. —
17) Compt. rend. XLV, 306. —
l8) Ibid. XLVI, 1228. —
19) Ann. der Chem. und Pharm. CIX, 257. —
20) Ibid. XCI, 185.
21) Ann. der Chemie und Pharm. CVIII, 106. —
22) Ibid. C1X, 268.
23) Ibid. CV, 289; ср. также R.Hoffmann, ibid. CII, I.
24) Cp. также Неіdelberger Jahrbucher 1858, 339. —
25) Compt. rend. XLVIII, 1092.
26) Ann der Chemie und Pharm. LXIII, 93. —
27) Ibid. CIV, 192.
28) Ibid. CXIII, 217.
29) Kolbe, ibid. CXIII, 220. —
30) Ibid. CXII, 241.
31) Annales de Chimie et de Phys. LIX, 161. —
32) Cp. Ann. der Che. mie und Pharm. CIX, 262 и т. д. —
33) Ibid. CXIII, 306. —
34) Bulletin de la Soc. chim. 13 mai 1859; Annales de Chimie et de Phys. LVI, 342.
35) Kekule, Lehrbuch der Chemie I, 130 и 174.
36) Ann. der Chem. und Pharm. CXXX, 11. —
37) Zeitschr. Chem. Pharm. 1861, S 161. —
38) Kekule, Lehrbuch der Chemie I, 739.
39) Compt. rend LV, 53; Ann. der Chem. und Pharm. CXX1V, 324.
40) Compt. rend. XLIV, 1350.
41) Zeitschrift fur Chem. und Pharm. 1862, 687.
42) Cp. стр. 223.
43) Ann. der Chemie und Pharm. LXXXVII, 127.
44) Rep. Chimie pure V, 247. —
45) Zeitschrift fut Chem. und Pharm. 1864, 30; Ann. der Chem. und Pharm. CXXXII. 102.
46) Proc. Roy. Soc. XII, 396; Ann. der Chem. und Pharm. CXXVI, 109.
47) Ann. der Chemic und Pharm. CXI, 320. —
48) ibid. CXXXIX, 211.
49) Zeitschrift fur Chemie u. Pharm. 1864, 642. —
50) Compt. rend. LV, 370; LV1, 715, 793; LVII, 479.
51) Zeitschr. fur Chem. u. Pharm. 1864, 419. —
52) Ann. der Chem. und Pharm. CXXXU, 102. —
53) Compt. rend. LVI1I, 971. —
54) Ibid. LXVI, 1179. —
55) Ann. der Chemie und Pharm. CXC, 328. —
56) Bulletin de la Soc chim. 1864, 484; II, 106; V, 582; Ann. der Chem. und Pharm. CXLIV, 1. —
57) Zeitschrift fur Chem. u. Pharm. 1864, 462.
58) Ann. der Chemie u. Pharm. CXXXVIII, 361. —
59) Zeitschr. fur Chem. 1867, 434. —
60) Ann. der Chem. und Pharm. CXXXIII, 80; CXXXV, 25; CXXXVI, 1; CXLII, 1.
61) Jahresbericht 1963, 323. —
62) Ann. der Chem. und Pharm. CXXXV, 217; СХХХVIII, 204 и 328. —
63) Ibid. CXXXI, 76, cp. также Carius, ibid. CXXXI, 173, и Schoyen, ibid. CXXX, 233.
64) Journ. fur prakt. Chem. XXII, 353. —
65) Rose, Ann. der Chemie und Pharm. CCV, 227.
66) Ср стр. 133. —
67) Ср. напр. Karius, Ann. der Chemie und Pharm. CXXXI, 172; Tollens, ibid. CXXXVII. 311; Fridel u. Ladenburg. ibid. CXLV, 190; Linnemann u. Siersch, ibid. CXL1V, 137; Бутлеровъ и Осокинъ, ibid. CXLV, 257; Simpson u. ibid. CXLV, 373; Erlenmeyer, ibid. CXLV, 365 и т. д.—
68)Berchem. Ges. IV, 742; V, 704 и т. д. —
69) ibid. XI. 315, 1302 и 1307.
70) Ann. Chim. Phys. (3) XXIV. 442; XXVIII, 56; XXXVIII. 437; ср. таюке Пастеръ, Recherches sur la dissymetrie moleculaire des prociuits organiques naturels.Le^cnsde chiirie, Paris 18L1. —
71) Ann. derChtm. CXXXVI.212.
72) Lewkowitsch, Ber. XVI, 1565 и 2721.
73) Ann. der Chem. СХХVІ, 214 и СХХХШ, 130. —
74) Bullet, soc. chim. (2) XXIII, 295; ср. La chimie dans, l'espace. Rotterdam 1875, издано на нћм. яз. Herrmann'омъ Braunschweig 1877. —
75) Bull. soc. chim (2) XXII, 337,
76) Sitzungsberichte der Wiener Akademie XI, 852; XII, 727; далће ibid. XLIX (2 отд.), 115.
77) Annales de Chim. et de Phys. (3) LIIl, 459, cp. стр. 238.
78) Lemons sur quelques points de phil. chim , стр. 136. —
79) Lehrbuch der organischen Chemie I, 738; II, 576. —
80) Ibid. I, 166.
81) Ann. der Chem. u. Pharm CXVI1, 120; Suppl. 1, 129, 338; Suppl. II, 85; CXXX, 1.
82) Ann. der Chem. und Pharm. CXXIV, 265; CXXVI, 195; CXX1X, 167.
83) Ibid. CLXXXVI1I. 95, 1877.
84) Ann. der Chem. u. Pharm. CXLIV, 114; CXLVi, 107. —
85) Compt. rend. LXV,468; Ann. der Chemie und Pharm. CXLVI, 119. —
86) Compt. rend. LXV, 901.
87) Ann. der Chemie und Pharm. CXXXVII, 129. —
88) Ibid. CXXXI, 303.
89) ibid. CXXXVI, 303 и т. д. —
90) Ann. de Chim. et de Phys. (3) XL1V, 275.
91) Ann. der Chem. und Pharm. CXXXII, 309. —
92) Kolbe u. Lautemann Ann. der Chemie und Pharm. CXV, 183; Kekule, Ann. der Chemie und Pharm. CXVII, 158; Griess, ibid CXVII, 34; Cannizzaro, ibid. Supplementb. I, 274. —
93) Beilstein u. Schlun, Ann. der Chem. und Pharm. CXXXIII, 239.
1) Bull. soc. chim. 1865, 104; Ann. d. Chem. u. Pharm. CXXXV11 129; Lehrbuch der organischen Chemie II, 493.
2) Ladenburg, Ann. der Chem. u. Pharm. CLXXII, 331. —
3) Beilstein u Kurbatow, Ann. Chem. CXCI1, 228.
4) Fittig. Ann der Chem. u. Pharm. CXXXVI.301; Kekule, ibid. CXXXVII, 192. —
5) Beilstein und Geitner. ibid. CXXXIX, 331. —
6) Korner, Zeitsclir. Chem. 1868, 326.
7) Ann. der Chem. u. Pharm. XII/311. —
8) Ibid. CVI, 123; ibid. CiX, 286; CXIII, 334 CXVII, 1 Suppl. I, 100; CXXI, 257 и т. д. Ср. также Phil. Trans. 1864, HI, 667 и т. д.
9) Lehrbuch II, 703.
10) Ann. der Chem. u. Pharm. CXXXVII, 174. —
11) Ibid. CXL, 306.
12) Zeitschrift Chem. 1866, 518. —
13) Ladenburg, Ann. der Chem. und Pharm. ClXXIX, 16 5. —
14) Ibid. CIL, 22. —
15) Ann. chem. Pharm. CIL, 129.
16) Ber. chem. Ges. II, 140. —
17) Gazzetta chimica italiana 1874, IV, 305; Jahresber. 1875, 299. —
18) Ber. chem. Ges. 1874, 1226.
19) Ladenburg, Theorie der arom. Verbind., Braunschweig 1876; и Ladenburg, Ber. chem. Ges. X, 1224; Wroblewsky, Ann. Chem. CXCII, 196. —
20) Ladenburg, Ber. chem. Ges. II, 140. —
21) Ladenburg, Ber. chem. Ges. XIII, 1808; см. также Thomsen, Thermochemische Untersuchungen, IV. Band; далће, Schiff, Ann. Chem. CCXX, 303. По мнћнію Шредера (Wiedem. Ann. XV, 667) это относится также къ молекулярной рефракціи, тогда какъ по мнћнію Брюля (Ann. СС, 229) имћетъ мћсто обратное. —
22) Baeyer, Ann. Chem. CCXXXXV, 103; CCLI, 257; CCLVI, 1; CCLVIII, 145; CCLXV1, 169; CCLX1X, 145.
23) Ann. der Chem. u. Pharm. XXVII, 268. —
24) Ibid. CXXXVII, 134.
25) Ibid. CXLVI, 1. —
26) Petersen, Ber. chem. Ges. VI, 368 и 400. —
27) Ann. Chem. CXL, 295. —
28) Ber. chem. Ges. I, 49. —
29) Ber. chem. Ges. I, 49. —
30) Ber. chem. Ges. III, 359.
31) Perkin, Zeitschr. Chem. 1861, 700; Ann. Chem. CXXXI, 201.
32) Dingl. polyt Journ. CL1V, 235 и 397. —
33) Ann. der Chem. u. Pharm. XCVIII, 297. —
34) Jahresber. 1858. 351. —
35) Zeitschr. Chem. 1868, 557; ibid. 1869, 190. —
36) J. pr. Chem. LXXXVII, 226; Jahresber, 1863, 417; ibid. 1864, 819; Ann. Chem. Pharm. CXXX1I, 160 и 289. —
37) Ann. Chem. CXCIV, 242. —
38) Ibid. CX1X, 169. —
39) Franz. Patent, v. 21. Juli 1862.
40) Ann. Chem. CLXXXHI, 1 и CC11, 36. —
41) Ibid CXXXVI1, 327.
42) Ann. Chem.CXLIX, 1. —
43) Ibid. CLXXI,233. —
44) Fittig и Erdmann, Вег. chem. Ges. XVI, 43; Ann. Chem. CCXXVI1,242. —
45) Ann. chim. phys. XXXIV, 164.
46) Cp.Reverdin und Nolting, Ober die Konstitution des Naphtalins, Genf 1880; далће, Liebermann und Dittler, Ann. Chem. CLXXXliJ, 228. —
47) Ber. chem. Ges. I, 49. —
48) Ibid. V, 861 и 968; Ann. Chem. CLXVII, 131. —
49) Ber. chem. Ges. V, 933; Ann. Chem CLXVI, 361; cp. еще Hayduck, Ann. Chem. CLXVII, 177.
50) Ber. chem Ges. V, 908. —
51) Ibid. VII, 972 и VIII, 152. —
52) Ibid. VII, 1785. —
53) Ann. Chem. Suppl. V, 371. —
54) Ber. chem. Ges. VI, 187: Ann. Chem. CXCII1, 134. —
55) Ber. chem. Ges. X, 2022. —
56) Fittig и Gebhardt, Ber. chem. Ges. X, 2143; Ann. Chem. СХСШ, 142; Fittig и Liepmann, ibid. CC, 3. —
57) Ber. chem. Ges. XII, 1078. —
58) Bamberger и Chattaway, ibid. XXVI, 1751 и Ann. Chem. CCLXXX1V, 52; Hirn, Ber. chem. Ges. XXXII, 3341.
59) Ber. chem. Ges. XVIII, 1024 и 1750; Ann. Chem. CCXXIX, 102.
60) Bamberger и Philip, Ann. Chem. CCXXXX, 158.
61) Zeitschr. Chem. 1871, 117.
62) Ann. Chem. LX. 86; LXX, 32; LXXV, Ь2; LXXX, 44; ХСІд, 358; cm. также Unverdorben, Pogg. Ann. XI. —
63) Weidel, Ber. chem. Ges. XII, 1889; Ladenburg и Roth, ibid. XVIII, 47 и 913. —
64) WilHams, Jahresber. f. Chem. 1855, 549; 1864, 437i Cahours и Etard, Compt. rend. XCII, 1079; Ladenburg, Ber. chem. Ges. XVI, 2059; XVII, 772 и 1121, XVIII, 1587; Hofmann, ibid. XVII, 825. —
65) Ber. chem. Ges. XII, 2012. —
66) Huber, Ann. Chem., CXLI, 271; Ber. chem. Ges. Ill, 849; Weidel, ibid. XII, 1989; Straup, ibid. XII, 332. —
67) Weidel, Ber. XII, 1989; Bermann и Hofmann, ibid. XVII, 2681. —
68) Wischnegradsky, ibid. XII, 1480; Ladenburg, ibid. XVI, 2059. —
69) Skraup u. Cobenzl, Monatsh. IV, 450; cp. также Ladenburg, Ber. chem. Ges. ХVIIІ, 2967. —
70) Ber. chem. Ges. X, 736. —
71) Ann. Chimie et Physique (4) IX, 469. —
72) Hantzsch, Ann.Chem. CCXV, 1; Pehmann u. Welsh, Ber. chem. Ges. XVII, 2384; Behrmann и Hofmann, ibid. XVII, 2681.
73) Ladenburg, Ber. chem. Ges XVI, 2050. —
74) Вег. chem. Ges. XII 453. —
75) Ibid. XII, 460. —
76) Monatsh. I, 317; 11, 141. —
77) Ann. Chem. CCI, 333. —
78) Laurent, Ann.der Chem. u. Pharm. XIX. 38, и XL1, 98. —
79) Ber. chem. Ges. XII. 747. —
80) Rec. trav. chim. Pays.Bas IV, 125 и 285 (1885).
81) Gabriel, Ber. chem. Ges. XIX. 1655 и 2361; Le Blanc, ibid. XXL 2299; E. Fischer, ibid. XXVI, 764 и т. д. —
82) Ann. der Chem. u. Pharm. XLII, 310; XLVI 279.
83) Ann. Chem. СХЫ, 271. —
84) Ber. chem. Ges. Ill, 849.—
85) Weidel, Ann. Chem. CLXV, 328, и Laiblin, ibid. CXCVl, 129. —
86) Ibid. L1V, 254 и LXX, 58. —
87) Ibid. LXXXIV, 342. —
88) Ibid. LXXXIV, 345. —
89) Ber. chem. Ges. XII, 986. —
90) Ibid. XII, 2341; Schotten, ibid. XV, 421; Hofmann, ibid. XVI, 586; Ladenburg, ibid. XVII, 156, 388; Ladenburg и Roth, XVII, 513. —
91) Weidel, Ann. Chem. CLXXIII, 76, Ramsay и Dobbie, Ber. Chem. Ges. XL 324. —
92) Ber. chem. Ges. XII, 1506; cp. еще Ladenburg, ibid. ХІІ, 947. —
93) Studien uber die Alkaloide, Munchen 1880. —
94) Ber. chem. Ges. XII, 410. —
95) Ann. Chem. CCX, 101. —
96) Ibid. CCXVII, 148. —
97) Ber. chem. Ges. XVII, 825. —
98) Ladenburg, Ann. Chem. CCCI, 117 прим.
99) Ber. chem. Ges. II, 679. Oes. III, 517. —
100) Baeyer, ibid. I, 17.
101) Ber. chem. Ges. III, 517.
102) Ibid. III. 90.
103) Ber. chem. Ges. XVI, 1465.
104) Journal f. pr. Chem. LXXIII, 286; CI, 342. —
105) Ann. Chem. CLXV1I, 125 и CLXXIV, 180. —
106) Ibid. CLVIII, 265. —
107) Riedel, Ber. chem. Ges. XVI, 1609; Bernthsen и Bender, ibid. XVI, 1803. —
108) Ladenburg, ibid. XVI. 2061; Grabe, ibid. XVII, 1370. —
109) Buchner, Ber. chem. Ges. XXII, 2165; Balbiano, ibid. XXIII, 1106.—
ll0) Ber. chem. Ges. Chem. CCCI, 1.—
111) Ladenburg и Abel, Ber. chem. Ges, ibid. XXVI, 724. —
112) Ladenburg, ibid. XXVII, 2952. —
113) E. Fischer, ibid. XXXI, 2550.
114) Chimie organique fondee sur la Synthese, Paris 1860. —
115) Ann. der Chem. u. Pharm. LXXV, 29.
116) Ann. d. chem. u Pharm. XCV, 128. —
117) Ibid. LV, 297. —
118) Ibid. CVIII, 112. —
119) Hiifner, Journ. pr. Chem. (2)1, 6. —
120) Chem. Soc. XIII, 102; Ann. derChem. CXVII. 130. —
121) Ann. der Chem. CXVII, 120. —
122)KoIbe, Ann. CXXII, 33. —
123) Ann. CXXXIX, 308. —
124) Ber. chem. Ges. I, 145. —
125) Ann. der Chem. CXLVI, 259. —
126) Zeitschr. f. Chem. 1869., 318. —
127) Ann. der Chem. CLV, 283. —
128) Ibid. CLXII, 92. —
129) Bullet, soc. chim. XX, 98. —
130) Ann. Suppl. VI, 116. —
131) Ber. chem. Ges. IX, 420. —
132) Ann. chim. phys. (5) XI, 389. —
133) Jahresber. 1878, 361. —
134) Compt. rend. XC, 1252. —
135) Ann. Chem. CCXIX, 161. —
136) Ber. chem. Ges. XVIII, 2956 и ЗЮ0. —
137) ibid. XIX, 439 и 2578; ibid. XXXIX, 786. —
138) Monastshefte d. Chem. 1882, 796; 1885, 356. —
139) Ber. chem. Ges. 1880, стр. 2254.
140) Ann. der Chem. LXXI, 171; LXXIV, 41 и LXXVII, 221. —
141) Ann. der Chem. XCV1, 364. —
142) Ann. CXXXI, 303. —
143) Ann. chim. pliys. (4) XII, 81. —
144) Ann. der Chem. u. Pharm. CLIX, 367. —
145) Ber. chem. Ges. V, 1094. —
146) Compt. rend. LXXXIV, 1392, 1450 и LXXXV, 74 и т. д. —
147) Ann. der Chem. X, 249. —
148) Ibid. LXV, 288; см. также Fehling, ibid. XL1X, 95. —
149) Ibid. C. 104; cp. также и Limpricht, ibid. XCVII, 368. —
150) Ibid. CXXIII, 140.
151) Ann. tfer Chem. CLXV, 109, —
152) Mendius, Ann. der Chem. CXXI. 129. —
153) Jahresber. 1849. 391. —
154) Compt. rend. LXIV. —
155) Conrad und Bischoff, Ann. d. Chem. CCIV, 121. —
156) Baeyer, Ber. chem. Ges. XV, 2705; Baeyer u. Perkin, ibid. XVI, 2128. —
157) Cp. Hantzsch, Ann. der Chem. CCXV, 1; Knorr, Ber. chem. Ges. XVII, 148, 540, 1635 и т. д.; Rugheimer, ibid. XVII, 736. —
158) Ber. chem. Ges. VIII, 1599; cp. также Fittig, Ann. der. Chem. CCXVI, 115 и CCXXVII, 48. —
159) Ann.d. Chem. C, 126. —
160) Ibid. CXLVII, 230. —
161) Ibid. СХVIII, 373; CXXI, 153.
162) Ibid. CXXXI, 348. —
163) ibid. CXXXI, 350. —
164) Ann. chim. phys. XLVIII, 395. —
165) Ann. der Chem. XVIII, 310.
166) Ibid. XVIII, 319. —
167) ibid. CXLIX, 215. —
168) Kolbe u. Lautemann, ibid. CXV, 201; Kolbe, J. pr. Chem. (3) X, 93. —
169) Ber. chem. Ges. IX, 423. —
170) Ann. der Chem. LXVI, 129; LXVII, 61 и 129; LXX, 129; LXX1II, 180; LXXIV, 1, 33 и 117; LXXV, 356; LXXVIII, 253; LXXIX, 11. —
171) Ber. chem. Ges. XIV, 2725 и XV, 407, 752 и 762. —
172) Ber. chem. Ges. XVII, 156, 388, 772, XVIII, 1587, 2956 и т. д. —
173) Bull. soc. chim. VI, 268.
174) Ann. der Chem., Suppl. V, 79. —
175) Ibid. XXII, 278. —
176) Ibid. XCVII, 350. —
177) Ann. der chem. CXLV, 283 и 297 —
178) Ibid. CLXII, 77. —
179) Ibid. CVI.336 и Suppl. I, 114. —
180) Jahresb. 1872, 449; 1873,474; 1876, 483; 1878, 612. —
181) Ann. der Chem. CLXXX, 1; ibid. CCXVIII, 121.
182) Ber. chem. Ges. V, 920.—
183) Ibid. VIII, 471; Ann. d. Chem. ССVIII, 278; CCIX, 339; CCX, 328. —
184) Ibid. VIII, 677; IX, 219 и 1524; X, 1123, 1260 и далће.
185) Ber. chem. Ges. IX, 1345. —
186) Ibid. XIII, 288. —
187) Ibid. XIII, 2259
1) Ср. Gerhardt, Introduction a Tetude de la chimie, 1848, 29. —
2) Ann. chim. phys. (2) LXXXIII, 5; Ann. d. Chem. u. Pharm. XXXVI, 110. —
3) Ann. chim. phys. (3) XXVI; 261. —
4) Poggend, Ann. Phys. C, 270. —
5) Nuovo Cimento VII, 321; далће Rep. Chim pure I, 201 и Sunto di un corso di filosofia chimica 1558, 35. Ostwald's Classiker der exakten Wissenschaften, Nr. 30. —
6) Compt. rend. XLIX, 239: Ann. d. Chem. u. Pharm. CXIII, 42.
7) Wurtz, Le^. prof. 1863, 172.
8) Ber. chem. Ges. VIII, 945. Pogg. Ann. Phys. CLVII, 353. —
9) Ibid XIII, 394. —
10) Comt. rend. XCII, 39. —
11) Ann. Chim. Phys. (2) LXVIII, 434; LXX, 272. —
12) Pogg. Ann. Phys. XXIX, 227. —
13) Phil. Mag. (3) XXXV, 345. —
14) Ann. Chim. Phys. (3) XX, 369. —
15) Ann. d. Chem. u. Pharm. LXIII, 1.
16) Ann. Chim. Phys. (2) LXII, 367. —
17) Ann. d. Chem. u. Pharm. XLII, 233. —
18) Compt. rend. LVI. 195. 322. 729, 873; cp. лалће Deville, lemons sur la dissociation, 1864
19) Ann. d. Chem. u. Pharm. CV, 383.
20) Ср. Horstmann, Theor. Chem., 666. —
21) Compt. rend. LXIV, 603: Bull. soc. chim. VII, 194. —
22) Ber. chem. Ges. IV, 779. —
23) Isambert, Handworterbuch d. Chem. von Ladenburg, HI, 400 и Horstmann, Ber. chem. Ges. IX, 749. —
24) Compt. rend. XCII, 919; XCIII, 731. —
25) Debray, Compt. rend. LXV1, 194; G. Wiedemann, Pogg. Ann. Jubelband 1873, 474. —
26) Pogg. Ann. CXXXI, 60. —
27) Ann. d. Chem. u. Pharm., Suppl., V, 341. —
28) Ber. chem. Ges. I, 210. —
29) Phil. mag. (4) XIX, 22; XXXV, 185. —
30) Sillim. Journ. XVI, 441; XVIII, 277. —
31) Ann. d. Chem. u. Pharm., Suppl. VIII, 112 и Ann. Chem. CLXX, 193. —
32) Ibid. CLXXXVII, 48. —
33) Cp. также Boltzmann, Wiedem. Ann. Phys. XXII, 31. —
34) Berl. Akad. Ber. 1882, 22 и 825 и также 1883, 647.
35) Nuovo Cimento VI, 428; VII, 375; VIII, 71. Ср. также Bull. soc. chim. 1858, I, 201. —
36) Ann. Chem. Pharm. CV, 390. —
37) ibid. CVI, 142. —
38) Ann. d. Chem. u. Pharm. CXXIII, 199. —
39) Bunsen, Gasometrische Methoden, 1857. —
40) Compt. rend. LVI, 547. —
41) Ibid. LVI, 729. —
42) Deville, lemons sur la dissoc, 365.
43) Compt. rend. LVI, 729. —
44) Ibid. LVI, 1237.
45) ibid. LIX, 1057.
46) Ann, d. Chem. u. Pharm. CXXX1, 129. —
47) Deville, lecons, 364. —
48) Cp. Naumann, Ann. d. Chem. u. Pharm., Suppl. V, 341. —
49) Compt. rend. LXV1I, 877. —
50) Cahours, Ann. Chim. Phys. (3) XX, 369. Deville, Compt. rend. LXII, 1157. —
51) Horstmann, Ann. d. Chem. u. Pharm., Suppl. VI, 74. —
52) Naumann, ibid. CLX, 1.
53) Compt. rend. LXXXIV, 977, 1183, 1262, 1347; LXXXV, 49; LXXXVI, 1170; LXXXIX, 190, 337, 429, 1062; XC, 24, 118, 337, 572. —
54) Ibid LXXXIV, 708; LXXXV, 32, 144, 400; LXXXVI, 331, 1394. —
55) Ibid. LXXXIV, 711, 1108, 1256. —
56) Compt. rend. LXXXIV, 1189, 1269; LXXXV, 8; XC, 112,491. —
57) Lehrbuch der. Chemie I, 142 и 443; Compt. rend. LVIII, 510.
58) Ann. d. Chem. u. Pharm. CLXXXII, 204. —
59) Cp. стр. 253 и Horstraann, Theor. Chem., 295. —
60) Cp. стр. 216 и 266. —
61) Cp. Horstmann, Theor. Chem., 327 и далће; Van t'Hoff: Ansichten uber die organ. Chem. I, 3; относительно теоріи Вернера и предположеній Бодлэндера и Абегга будетъ рћчь дальше.
62) Michael и Adair, Ber. X, 583 и XI, 116.—
63) Michaelis и Lacoste, ibid. XVIII, 2118. —
64) Ср., однако, Kekule, Ann. Chem. CLXII, 86 и Ваеуег, Ber. Chem. Ges. XVIII, 2277. —
65) Ann. d. Chem. u. Pharm., Suppl. VI, 77. —
66) Ann. chim. phys. (4) VIII, 5 и 49; Ann. d. Chem. u. Pharm. CXXXV, 49 и Ann. Chim. Phys. (4) IX, 249. Ann. d. Chem. u. Pharm., Suppl. IV, 350.
67) Rep. chimie pur II, 449; lecon sur quelques points etc., 181. —
68) Pogg. Ann. Phys. CXXV, 139. —
69) Ann. d. Chem. u. Pharm. LXXVIII, 253; LXXIX, 11. —
70) Ibid. XCVII, 19. —
71) Ibid. CXXIII, 1. —
72) Bull. soc. chim. VII, 12; XV, 161; XVI, 203; XVII, 100 и 294. —
73) Cp. стр. 95.
74) Pogg. Ann. XV, 301. —
75) Handbuch, 3. Auflage, I, 35. —
76) Ann. Chem. CV, 87.—
77) c. стр. 111. —
78) Ann. d. Chem. u. Pharm. CIII, 121; CIV, 177. —
79) Chem. News X, 59, 94 и XIII, 113. —
80) Moderne Theorien, 1. Aufl., стр. 136 и др.; Ann. d. Chem. u. Pharm., Suppl., VII, 345. —
81)Zeitschr. Chem. 1869, стр. 405 и Ann. d. Chem. u. Pharm., Suppl. VIII, 133. —
82) По вопросу о пріоритетћ cp. Newlands, Chem. News XXXII, 21 и 192. L. Meyer., Ber. chem. Ges. XIII, 259 und Mendelejeff, ibid. XIII, 1796.
83) Pogg. Ann. LVI, 101; ср. также Klatzo, Journ. f. prakt. Chem. CVI, 227.
84) Nilsonund Pettersson, Ber. XI, 381; XIII, 1451 и XVII. 987. L. Meyer, ibid. XIII, 1780; Reynolds, Ber. XIII, 2412. Nilson, Ber. XIII, 2035. —
85) Pogg. Ann. CXLL 1. —
86) Bull, de l'Acad. de St. Petersbourg 1870. 445. —
87) Ann. der Chem. u. Pharm. CCXIII, 285; CCXVI, 1. —
88) Brauner, Ber. chem. Ges. XVI, 3055. —
89) Monatsh. Chem. X, 448. —
90) Ann. Chem. CCCXIX, 1. —
91) Ber. XXXV, 2275 (1902). —
92) Kothner. Ann. Chem. CCCXXXV1I, 142 и Baxter, Proc. Amer. Acad. XL, Nr. 8. —
93) Recherches sur les lois des prop. chim. Bruxelles, 1865.
94) Вег. chem. Ges. XII, 550. 554; XIII, 1439. —
95) Compt. rend. LXXXI, 493 и 1100; LXXXVI, 475 и друг. —
96) Journ. f. prakt. Chem. XXXIV, 177. —
97) Cp. стр. 33. —
98) Etudes sur les affinites chimiques. Christiania 1867 и Journ. f. prakt. Chem. XIX, 69.
99) Вантъ-Гоффъ, Ber. chem. Ges. X, 669.
100) Pogg. Ann. LXXXI, 413. Klassiker d. exakten Wissenschaften № 29.
101) Phil. Trans. 1866, 193. —
102) Ibid. 1867, 117. —
103) Ann. Chim. Phys. (3) LXV, 385; LXVI, 5; LXV1II, 225. —
104) Ber. chem. Ges. X, 1728 и 1898; XI, 1507, 2117, 2148; XIII, 162, 1812; XIV, 2630. Ann. d. Chemie u. Pharm. CXCV, 334; CXCVII, 193. Ann. Chim. Phys. (5) XX, 289; XXIII, 14 и XXX, 81.
105) Pogg. Ann. СХХХVIII, 65 и Thermochem. Untersuchungen I. —
106) Jo urn prakt. Chem. (2) XVI, 385; XVIII, 328; XIX, 468; XXV, L Pogg. Erg. VIII, 154Wiedem. Ann. II, 429 и 671. —
107) Ann. d. Chem. u. Pharm. CXC, 228.
108) Wiedem. Ann. V, 45. —
109) Trans. Roy. Irish Acad. XXV, 371.—
110) Cp. статью Affinitat E. Wiedemann'a въ Ladenburg, Handworterb. d. Chem. I, 114. —
111) Pogg. Ann. CX, 161 и CXIII, 337; cp. далће Kirchhoff, Abhandl. der. Berl. Akad. 1861 и Untersuchungen iiber das Sonnenspektrum und die Spektren der chem. Elemente. —
112) Connaissance sur le spectre; Bibl. univers. de Geneve (2)X,221. —
113) Phil. Mag. (4) XXII, 155. —
114) Pogg. Ann. CXVIII, 94. —
115) Phil. Trans. 1802. —
116) Gilbert, Ann. Phys. LVI, 278. —
117) Treatise on light. —
118) Brewster, Journ. of science V, 77; Phil. Mag. (3) III, 36; IV, 114; IX, 3. —
119) Pogg. Ann. Phys. 1836, XXXVIII, 61; cp. Compt. rend. LXII, 17. —
120) Edinb. Trans, for 1856.
121) Ann. chim. phys. (3) LVIII, 478. —
122) Pogg. Ann. XCIV, 141.
123) Trans. Roy. Soc. Edinburgh 1858. —
124) Pogg. Ann. CIX. 275.
125) Phil. Mag. (4) XXI, 301; Ann. der Chem. und Pharm. CXXIV, 203.
126) Journ. prakt. Chem. LXXXIX, 441. —
127) Cp. стр. 295. —
l28) Pogg. Ann. CXVI. 499 и CXXI, 459. —
129) Phil. Trans. CLV, 1. —
130) Anwendung des Spektralapparates zur Photometrie der Absorptionsspektren. Tubingen 1873.
131) Wiedem. Ann. 1877, I, 351; cp. также Hufner, Journ. f. prakt. Chem. XVI, 290. —
132) Compt. rend. LXIX, 445, 606, 657 и т. д. —
133) Wiener Ber. LXXVI, (2), 499; LXXIX, (2), 8 и LXXXII, (2), 425. —
134) Journal of the chem. soc. 1882, стр. 130. —
135) Ber. chem. Ges. XVI, 2051; XVIII, 1426. —
136) Wiedemann's Ann. 25, 18 (1885). —
137) Abhandl. Berl. Acad. 1890 и 1891 г.
138) Uber kristall. Huttenprodukte. —
139) Gehlen. Journ. Chem. I, 271.
140) Ann. chim. phys. XXIV, 355. —
141) Ann. Pharm. XXIII, 234; cp. также Fremy и Feil, Compt. rend. LXXXV, 1029.
142) Ann. chim. phys. LXXX. 163; ibid. I, 33. —
143) Compt. rend. XXV, 661 и Ann. chim. phys. XXlI, 213. —
144) Ann. chim. phys. LI, 101.
145) Ann. der Chem. und Pharm. LXXX, 212. —
146) Caronu. Deville, ibid. CVIII, 55; CIX, 242 и далће. —
147) Compt. rend XC, 830. —
148) Ann. chim. phys. XXI, 127, 180 и XXII, 410. —
149) Ibid. (3) XLIX, 265. —
150) Ibid. (3) LVI, 33. —
151) Ann. d. Chem. u. Pharm. CXIX 1. —
152) Phil. Trans. 1869 (2), 575; Jahresber. 1870, 27.
153) Недавно Вроблевскій подвергъ критикћ понятіе о критической температурћ (Monatshefte VII, 383), но здћсь мы не можемъ входить въ разсмотрћніе этого вопроса. —
154) Ср. Ostwald, Allgem. Chemie I, 267. —
155) Phil. Trans. 1823, 160, 189. —
156) Ann. chim. phys. LX, 427. —
157) Phil. Trans. 1845, 1; Pogg. Erg. II, 193. —
158) Pogg. Ann. XCIV, 436.
159) Compt. rend. LXXXV, 1214, 1220; Ann. chim. phys. (5) XIII, 445. —
160) Compt. rend. LXXXV, 851, 1016, 1213; Ann. chim. phys. (5) XV, 132.
161) Monatshefte 1885, VI, 204. —
162) Ср. стр. 25.
163) Oeuvres de Lavoisier II, 287. —
164) Pogg. Ann., L, 385; LII, 97; cm. также Ostwald's Klassiker № 9. —
165) Ann. chim. phys. (3) XXXIV, 357; XXXVI, 1; XXXVII, 406—
166) Pogg. Ann. LXXXVIII, 349; ХС, 261; CXI, 83; СХІІ, 34; СХХХVІІІ, 65; СХХХІХ, 193. См. также Ber. chem. Ges. II, 482, 701; III, 187, 496, 716, 927; IV, 308, 586,591, 597, 941; V, 170, 181, 508,614,1014; VI, 233, 423, 697, 710, 1330, 1434; VII, 31, 397, 452, 996, 1002; IX, 162, 268, 307; X, 1017 и далће. Затћмъ Thermochem. Untersuchungen. Leipzig, 4 тома. —
167) Horstmann, Theor. Chem. 612 и далће. —
168) Ср. стр. 270. —
169) Ann. chim. phys. (4) VI, 290; XVIII, 103; XXIX, 94; (5) IV, 5 и далће. Mecanique chimique fondee sur rhermochimie 1879. Два тома.
170) Thomsen, Вег. chem. Ges. VI, 423; Berthelot, Bull. soc. chim. XIX, 485; Ostwald, Allgem. Chem. II, 20. —
171) Cp. Rathke, Uber die Principien der Thermochemie, Halle 1881, и особенно Helmholtz: Zur „Thermodynamik chemischer Vorgange”, Akad. Ber. 1882, 22 и 825. —
172) Pogg. Ann. LXXXVIII, 351. —
173) Mecan. chim. II, 18.
174) Phil. Trans. 1834, 77; Pogg. XXXIII, 301 —
175) Ladenburg, Ber. chem. Ges. V, 753. —
176) Pogg. Erg. I, 565; Pogg. Ann. LXIV, 18. —
177) Pogg. Ann. LXXXIX, 176; XCVIII, 1; GUI, 1; CVI, 337, 513.
178) Wiedem. Ann. VI, 1 и 145. —
179) Wiedem. Ann. V, 182; XVI, 561 и XVII, 593. —
180) Ber. Berlin. Akad. 1882, 22 и 825. Gesamm. Abhandl. II, 985.
181) Czapski, Wiedem. Ann. XXI, 209; Gockel, ibid. XXIV, 618.—
182) Jahn, ibid. ХХVIII, 21. —
183) Scheele, Von der Luft und dem Feuer, 72; Senebier, Memoires phys. chim.; Draper, Phil. Mag. (3) XIX, 195 и др. —
184) Senebier, 1. c; Ingenhousz, Versuche mit Pflanzen, Leipzig 1780; Daubeny, Phil. Trans. 1836, 149; Draper, Phil. Mag. (3) XXIII, 161; Sachs, Bot. Zeitung 1864; Muller, Bot. Untersuchungen, 1872; Pfeffer, Pogg. Ann. CXLVIII, 86; Pringsheim, Ber. d. Berl. Akad. 1881; Engelmann, Bot. Zeitung 1882, 1883, 1884; Reinke, Bot. Zeitschr. 1884, 1 и др. —
185) Bunsen и Roscoe, Pogg. Ann. C, 43; CI, 254; СХVII, 529; Pogg. Erg. V, 177. —
186) Eder, Handbuch der Photographic Halle 1884.
187) Essai de stat. chim. des etres organises, 24. —
188) Pogg. Ann. CXLIII, 581. —
189) Lichtwirkung und Chlorophyllfunktion in der Pflanze, 1879.
190) Pflanzenphysiologie, 2oe изд. 1897, 1,327.—
191) Bot. Zeitung 1882, 1883, 1884, 1886, 1887. —
192) Cp. Jahrbucher f. wissensch. Botanik XVII, 1, 162. Bot. Zeitung 1886, IV, 84.
193) Ann. der Chem. und Pharm. XLI, 86 и 169; L, 71; Pogg. Ann. LXIII, 283; Ann. der Chem. und Pharm. XCIV, 257; XCV, 121, 307; XCVI, 1, 153, 303; ibid. Suppl. V, 323 и др.
194) Ср. A. Pierre, Ann. d. Chem. u. Pharm. LVI, 139; LXIV, 158; LXXX, 125; XCII, 6; Buff, ibid. Suppl. IV, 129; Ramsay, Ber. chem. Ges. XII, 1024; Thorpe, Chem. Soc. 1880, 141 и 327; Lossen, Ann. Chem. CCX1V, 138; Elsasser, ibid. CCXVII1, 302; R. Schiff, ibid. CCXX, 71 и далће. —
195) Ann. der Chem. und Pharm. CC, 166. Въ недавно появившейся статьћ (Ann. ССХХХV, 1) Брюль отказывается отъ этого коэффиціента преломленія Коши и вновь возвращается къ показателю преломленія, зависящему отъ дисперсіи. —
196) Mecanique celeste IV, 232.
197) Phil. Trans. 1858 и 1863. —
198) Pogg. Ann. CXVII, 353; СХХІІ, 545; СХХІІІ, 595. —
199) Ibid. СХХХІ, 117. —
200) Proc. Roy. Soc. XVI, 439; XVIII, 49 и XXXI, 327.
201) Wiedem Ann. IX, 641. —
202) Ibid. XI, 70.
203) Веr. chem. Ges. XV, 1031. —
204) Ann. Chem. CC, 139; ССІІІ, 1, 255, 363; ССХІ, 121, 371.
205) Beibl. zu Pogg. Ann. 1883, 528; Accad. dei Lined (3) ХVIII, XIX и дал. —
206) Ber. chem. Ges. XIV, 1697; XVI, 3047; Journ. prakt. Chem. XXXI, 321; XXXII. 497. —
207) Ann. Chem. CCXXXV, 1. —
208) Ber. chem. Ges. XIX, 2837. —
209) Monatsch. f. Chem. VI, 249. —
210) Ann. chim. phys. (4) XXIII; 366; XXV, 502; XXVI, 98. —
211) Compt. rend. XCIV, 1517; XCV, 180 и 1030; Ann. chim. phys. (5) XXVIII, 133; (6) II, 133; IV, 99 и 115; VIII, 289 и 317.
212) Blagden, Phil. Trans. 1788, LXXVIII, 277; Rudorff, Pogg. Ann. CXVI, 55; CXLV, 599. —
213) Pogg. Ann. CXXVI, 1; CXXXV, 177. —
214) Phil. Trans. 1846, 573 и 1849, 349. —
215) Pogg. Ann. CXXV, 586; CXXVII, 253 и 353. —
216) Phil. Trans. 1866, 249. —
217) Wiedem. Ann. VII, 497; XIII, 1. —
218) Ann. chim. phys. (3) LIX, 206. —
219) Das optische Drehungsvermogen organischer Substanzen 1879. 2oe изд. 1898. —
220) Journ. prakt. Chem. XXXI, 481; XXXII, 523 и дал.
221) Pogg. Ann. CXLI, 31; Ber. chem. Ges. III, 449; cp. также Laurent, Compt. rend. XV, 350 и XX, 357; Methode de chimie, 156. —
222) Hintze, Poggend. Erg. VI, 195. —
223) Habilitationsschrift. Bonn 1884.
1) Compt. rend. LXIV, 618. —
2) Ann. chim. phys. (5) XII, 145. —
3) Zeitschr. f. phys. Chem. XIII, 56. —
4) Ibid. XXII, 1. —
5) Natanson, Wiedem. Ann. XXIV, 454 и XXVII, 606. —
6) Friedel, Bull. soc. chim. XXIV, 241 (1875). —
7) Zeitschr. f. phys. Chemie II, 782. —
8) Transactions Connecticut Academy III, 108 и 343, 1876; нћмецкій переводъ В. Оствальда, Лейпцигъ 1892. —
9) Rec. Trav. Chim. VI, 265, сообщ. Рузебумомъ.
10) Здћсь я слћдую изложенію Планка (см. статью Thermochemie, Ladenburg, Handworterbuch der Chemie XI, 636). —
11) Zeitschr. f. phys. Chem. II, 449, 513; IV, 31; V, 198; X, 477;. Rec. Trav. Chim. IV ff. —
12) Cp. сопоставленія Мейергоффера, Leipzig 1893, Банкрофта, Leipzig, 1897, Вантъ-Гоффа, Uber das Gleichgewicht kondensierter Systeme, стр. 47. —
13) Копtinuitat des gasformigen und fltissigen Zustandes. Нћмецкій переводъ Рота, 1881.
14) Lois de l'equilibre chimique dans Tetat diloue ou dissous. Стокгольмъ1886, извлеченіе въ Zeitschr. f. phys. Chem. I, 481. —
15) Phil. Mag. XXXIII, 154 и XXXIV, 505. —
16) Osmot. Unters., Лейпцигъ 1877. —
17) Archiv f. Anat u. Phys. 1867, 87.
18) Ann. Chim. Phys. (6) II, 66, 99; VlII, 289 и 317; XX, 297; Gompt. rend. LXXXVII, 167; Zeitschr. f. phys. Chem. IX, 343 и дал. Литература предшественниковъ Рауля подробно указана въ книгћ Оствальда; Allgemeine Chemie I, 705 и 741. —
19) Ср. особенно Бекмана, Zeitschr. f. phys. Chem. JI, 638; IV, 532; VIII, 223; XVIII, 473 и дал. —
20) Zeitschr. f. phys. Chem. I, 631. Предшественниками Арреніуса являются Клаузіусъ (Pogg. Ann. CI, 138) и Гельмгольцъ (Wiedem. Ann. XI, 737). Мысль о диссоціаціи солей въ водномъ растворћ была одновременно съ Арреніусомъ ясно выражена также Планкомъ (Zeitschr. f. phys. Chem. I, 577).
21) Zeitschr. f. phys. Chem. II, 491. —
22) Wiedem. Ann. XXXIV, 139. —
23) Zeitschr. f. phys. Chem. II, 36 и 270. —
24) Cp. между прочимъ Оствальда Lehrb., 2. Aufl. II, 989. —
25) Pogg. Ann. LII. 79. —
26) Thermochem. Unters. I, 63. —
27) Ann. Chim. (5) VI, 325. —
28) Ср. Л. Мейеръ, Zeitschrf. phys. Chem. I, 134. —
29) Wiedem. Beibl. IX, 635. —
30) Ber. deutsch. chem. Ges. VI, 1073.
31) Jahn, Wiedem. Ann. XLIII, 280. —
32) E. Видеманнъ въ Handworterbuch Ладенбурга VII, 31, —
33) Оствальдъ, Zeitschr. f. phys. Chem. IX, 579, —
34) Гладстонъ, Phil. Trans. 1868. Канонниковъ, Journ. f. prakt. Chem. (2) XXXI, 339. —
35) Арреніусъ, Bihang Svenska Akad. VIII, Nr. 13, 1884. Оствальдъ, Journ. f. prakt. Chem. XXX, 93. —
36) Zeitschr. f phys. Chem. I, 631; II, 491.
37) Voigfs Magazin VI, 105. Ср. еще Готеро Сю, Hist, du galvanisme II. 209. —
38) Compt. rend. XLIX, 402; L, 640; Recherches stir l'electricite, Paris 1879. —
39) D. R. P. 1871. —
40) Pogg. Ann. CXLIX, 546(1873). —
41) Zeitschr. f. phys. Chem. II, 613 (1888); IV, 129.—
42) Sitzungsb. Bed. Akad. 1877. —
43) Nichols Journ. phil. IV, 254. —
44) Cp. Дэви Gilb. Ann. IV, 364 и VII, 103; Беккерель, Mem. de l'Acad. 284; Фишеръ, Gilb. Ann.XLII,92; Gaultier de Claubry, Journ. Pharm. Chim. (3) XVII, 125; Никлесъ, Jahresber. 1862, 610; Беккерель, Ann. Chem. Phys. XLIII, 380 (1830), и др. —
45) Pogg. Ann. Phys. CII, 1.
46) Zeitschr. f. anal. Chem. III, 334. —
47) Dingler's Polyt. Journ. CLXXVII, 231; CLXXVIII, 42. —
48) Handbuch der Electrolyse, Ber. d. deutsch. Chem. Ges. XXVII, 163 и 2060.
49) Lehrbuch d. anal. Chem. Miinchen. —
50) J. Amer. Soc. 1891 и 1895; Elektrochem Zeitschr. I, 186 и 290, 313; Zeitschr. f. anorg. Chem. IV, V, VI. —
51) Elektrochem Zeitschr. I, 138; Monatshefte XIV, 536. —
52) Berg u. Huttenmannische Zeitschr. 1883. —
53) Ann. d. Chem. LXXXII, 137; Pogg. Ann. XCI, 619; XCII, 648; Ann. d. Chem. XCIV, 107 etc. —
54) Pogg. Ann. XCII, 648. —
55) D. R. P. декабрь 1887. —
56) Le Four electrique, Paris 1897; Compt. rend. CXV, 988 и 1031; CXVI, 218, 1429; CXVII, 425, 679; CXVIII, 320 и 501 и т. д. —
57) Ann. Chem. Pharm. CXXIV, 20.
58) Ср. также Шютценбергера. Compt. rend. CX1V, 1089. —
59) Hare, Phil. Mag. 1847, 356; далће Девилль и Дебрей, Ann. Chim. Phys. '3) LVI, 385. —
60) Ann. d. Chem. CCCI, 19; Zeitschr. f. Elektrochem. 189798, Heft 21.
61) Ber. chem. Ges. XIII, 1010. —
62) Compt. rend. XC, 183; XCII, 39; Ber. chem. Ges. XIII, 851. —
63) Ibid. XI, 1867 и 1946; XII, 609 и 681 и т. д.
64) Compt rend. XC, 183; XCII, 39. —
65) Лангеръ и Викторъ Мейеръ, Pyrochem. Untersuchungen; Braunschweig. 1885.
66) Wiedem. Ann. XX, 243 и 860, и Wiener Acad. Ber. (1885), ХСІ. 667; Monatshefte IX, 1067 (1888). —
67) Ср. Гольборнъ и Винъ, Wiedem. Ann. LIX, 220; Ладенбургъ и Крюгель, Ber. chem. Ges. XXXII, 1818. —
68) Royal Institution 1878, 1883, 1884, 1885, 1892, 1893, 1894, 1895. 1896, 1897, 1898 и 1899, —
69) Zeitschr. d. Vereins deutscher Ingenieure XXXIX, 1157 (1895). —
70) Англ. патентъ, апрћль 1896.
*) Ko времени появленія настоящаго русскаго изданія это примћчаніе автора оказывается уже не соотвћтствующимъ дћйствительности. Прим. ред.
71) Ольшевскій, впрочемъ, первый получилъ жидкій водородъ. Compt. rend. CI, 238. —
72) Brit. Assoc. 1899. —
73) Phil. Mag. XLV, 513. —
74) Ann. chim. phys. (7) XXIII, 423 (1901). —
75) Pogg. Ann. (4) ХVІІ, 994 (1905).
76) Compt. rend. XCIV, 1249. —
77) Ibid. CXXVI, 1751. —
78) Ber. d. deutsch. chem. Ges. XXXI, 2508, 2830; XXXII, 221. —
79) Ann. d. Chem. CXXXVIII, 45, Suppl. V, 148. —
80) Ber. chem. Ges. XXXVI, 3042 (1903). —
81) Nature LX, 512 (1892).
*) Сжиженіе гелія удалось въ 1908 г. Каммерливгъ Оннесу. Прим. ред.
82) Rayleigh und Ramsay, Proc. Roy. Soc, LVII, 265; Zeitschr. f. phys Chem. XVI. 344; Trans. Roy. Soc, CLXXXVI, 187 (1895); Berthelot, Compt. rend. CXX, 581 и CXXIX, 71. —
83) Ber. d. deutsch. chem. Ges. XXXI, 3121.
84) Bull. U. S. Geological Survey LXXVIH, 43. —
85) Nature LIII, 319.
86) Ber. d. deutsch. chem. Ges. XXXI, 3111.—
87) Brauner, Journ. chem. Soc. 1895, I, 549; Kolliner, Ann. Chem. CCCXIX, 1. —
88) Cp. стр. 284. —
89) Ber. chem. Ges. XXXI, 3116.
90) Zeitschr. f. phys. Chem. XXXVIII, 683. Противоположныя данныя Ладенбурга (Berliner Akad. Ber. 1900) требуютъ объясненія. —
91) Ber. d. deutsch. chem. Ges. XXXI, 3120. —
92) Cp. Brauner, ibid. XXXII. 708,
93) Compt. rend. CHI, 202 и 256. —
94) Chem. Soc. 1890. I, 749. —
95) Zeitschr. f. Chem. I. 551; Ann. d. Chem., Suppl. VI, 220; CLX, 24 2 CLXI, 347 и др —
96) Meyer, u. Janny, Ber. d. deutsch. chem Ges. XV, 1324; Janny, ibid. XV, 27?8; Petraczek. ibid. XVI, 170; Meyer, ibid. XVI, 822* Petraczek, ibid. XVI, 823 и далће. —
97) H. Goldschmidt. Ber. d. deutsch. chem. Ges. XVI, 2176; Auwers u. Meyer, ibid. XXI, 784, 3150; XXII, 537 и др. —
98) Ber. d. deutsch. chem. Ges. VIII, 589; cp. также Strecker u. Roemer, ibid. IV, 784 und Zeitschr. f. Chem. 1871, VII, 481. —
99) Ber. d. deutsch. chem. Ges. XVIL 579. —
100) Curtius u. Jay, Journ. prakt. Chem. XXXIX, 27.—
101) Curtius, Ber. d. deutsch. chem. Ces. XXIII, 3023. — 101) Ibid. XXVII, 1880, XXVIII, 855 и 1682. —
101a) Ibid. XXVII, 1880, XXVIII, 855 и 1682. —
102) Ann. d. Chem. CCLXX, 1; CCLXXIII, 133; Ber. d. deutsch. chem. Ges. XXVI. 2598, 2645 и т. д.
103) Ann. d. Chem. CCXLI, 161. —
104) Hellriegel u. Wilfahrt, Biederm. Centr. XVIII. 179. —
105) Compt. rend. CVI, 569. —
106) Zt. f. angew. Chem. XIX. 835 (1906), Zeitschr. f. Elektrochemie XII, 434. —
107) Patent. Nr. 1170, 11. мая 1860. —
108) Zeitschr. f. Elektrochemie XII, 532. —
109) Ber. d. deutsch. chem. Ges. XXX, 117, 1110, 2668 и далће. —
110) Ann. Chem. CCCXLIX, 125 и 140.
111) Van't Hoff u. Deventer, Ann. Chem. XIX, 2142. —
112) Нћмецкій переводъ Dr. Paul, Leipzig 1897. —
113) Bed. Akad. Ber. 1897, 1898, 1899, 1900, 1901, 1902 до 1906.
114) Compt. rend. LXXXVII, 213, LXXXIX, 312; Bull. soc. chim. (3) VII, 551; Compt. rend. XCII, 532. —
115) Ladenburg, Ber. d. deutsch. chem. Ges. XIX, 2578; Ann. d. Chem. CCXLVII, 83. —
116) Ber. d. deutsch. chem. Ges. XXIII, 2114 u. XXVII, 3189. —
117) ibid. XXIV, 1836 u. 2683. —
118) Ibid. XXVIII, 2766; XXIX, 133; XXX, 2795 u. 3164. —
119) Uber die raumliche Anordnung der Atome in organischen Molekulen und ihre Bestimmung in geometrischisomeren ungesattigten Verbindungen. Leipzig 1887. —
120) Ann. d. Chem. CXXV, СХХVIII, СХХХШ, CXLVI, CLXVI и въ особенности CLXVII, 345. —
121) Ibid. CCXLVI, 53; CCXLVIII, 1 и 281; CCL, 224; CCLXXII, 1; CCLXXIV, 99.
122) Pfaff въ Berzelius' Jahresber. 1828, 216. —
123) Pelouze, Ann. Chem. XI, 263. —
124) Ann. d. Chem. Suppl, II, 111; Zeitschr. f. Chem. (2) III, 654.
125) Journ. prakt. Chem. ХХХVIII, XLIII, XLVI, LII и др. —
126) Ann. d. Chem. ССЫV, 168. —
127) Kekule u. Anschutz, Ber. d. deutsch. chem. Ges. XIII, 2105 u. XIV, 713. —
128) La chimie dans Tespace. —
129) Ann. d. Chem. CCXLV, 103; CCLI, 257; CCLVI, 1; CCLVI1I, 1 и 145; CCLXVI, 169; CCLXIX, 245; CCLXXVl, 255. —
l30) Ber. d. deutsch. chem. Ges. XVIII, 2278. —
131) Hofmann, Ber. d. deutsch. chem. Ges. XVII, 1915 и XVIII, 1825; Jacobsen, ibid. XXII, 1219; XXV, 992; XXVI, 681 и 699 и т. д.; Pinner, ibid. XXIII, 2917; Raster u. Stallberg, Ann. d. Chem. CCLXXVIII, 207. —
132) Ber. d. deutsch. chem. Ges. XXVII, 510, 1580, 3140; XXVIII, Ref. 301 и 916; XXIX, 830 и др. —
133) Ibid. XXIII, 11; Werner, Raumliche Anordnung in stickstoffhaltigen Molekulen, 1890. Ср. также появившіяся ранће работы Willgerodt'a, Journ. f. prakt. Chem. XXXVII, 49; Brush и Marsh, Journ. chem. soc. Trans. 1889, 656 и особенно van't Hoff, Ansichten liber organische Chemie, Braunschweig 1878.
134) Fehrlin u. Krause,Ber. d. deutsch. chem. Ges. XXIII, 1574 und 3617; Hantzsch u. Kraft, ibid. XXIV, 3511; Marckwald, ibid. XXV, 3100. —
135) Ibid. XXVII, 1702, 1726, 1857, 2099, 3527, 2968; XXVIII, 741, 1124, 1734 и др. —
136) Compt. rend. CXII, 724. —
137) Bed. Acad. Ber. 1892, 1067; Ber. d. deutsch. chem. Ges. XXVI, 854: XXVII, 853 и 859. —
138) Marckwald u. DrosteHiilshoff, ibid. XXXII, 560; Wolffenstein, ibid. XXIX, 1956. —
139) Le Bel, Compt. rend. 1899, 548; Ladenburg, Ber. d. deutsch. chem. Ges. XXXII, 511 и 722; Pope и Peachey, Compt. rend. LXX1X, 167. —
140) Trans, chem. Soc» 1900, 1072. —
141) Proc. chem. Soc. 1900, 42. —
142) E. Fischer, Ber. d. deutsch. chem. Ges. XXVII. 3226; Landolt, Drehvermogen, 2 Aufl. 85. —
143) Ladenburg u Herz, Ber. d. deutsch. chem. Ges. XXXI, 937; Ladenburg u. Doctor, ibid. XXXI, 1969. —
144) Ladenburg u. Doctor, ibid. XXXII, 50. —
145) Roozeboom, Вег. d. deutsch. chem. Ges. XXXII, 537; Ladenburg, ibid. XXXII, 864; Pope, Trans, chem. Soc. 1890, 1111.
146) Ber. d. deutsch. chem. Ges. XX1I1, 568. —
147) Ibid. XVIII, 648 и XIX, 730; cp. также Бутлеровъ, Ann. Chem. CLXXXIX, 76. —
148) Ber. d. deutsch. chem. Ges. XVII, 3030. —
149) Ann. der Chem. u. Pharm. CCXCI, 147. — 149a) Ann. der Chem. CCXCI, 25. —
149a) Ann. der Chem. CCXCI, 25. —
149b) Ibid. CCXCIII, 70. —
149c) ibid. CCLXXIX, 188. —
150) Cp. впрочемъ Grimaux, Ann. Chim. Phys. (5) XI, 356 и XVII, —
151) Ber. d. deutsch. chem. Ges. XXX, 549, 559, 1839, 1846, 2220, 2226, 2400, 3009; XXXI, 104, 431, 542, 2550, 2619, 2622; XXXII, 435276; Horbaczewsky, Monatshefte d. Chem. 1882, 796; 1885, 356; 1887, 201; Behrend и Roosen, Ann. d. Chem. CCLI, 235; W. Traube, Ber. ХХХIII, 1371 и 3035.
152) Ann. d. Chem. CCXXV — CCCXX (52 статьи). —
153) Ibid. CCCXX—CCCXLVII, 30 статей. —
154) Ibid. CCLXXVIII, 88; Ber. chem. Ges. XXV, 2122; ibid. XXVI, 232. —
155) Ber. chem. Ges. XXVII, 1652. —
156) Ibid. XXVIII, 1773. —
157) Trans. Chem. Soc. LXXXVII, I, 639 (1905) и LXXXIX, 839 (1906).
158) Ber. chem. Ges. XXXIX, 2582. —
159) Ibid. XXXIX, 2504. —
l60) Ibid. XXXVI, 4332. —
161) ibid. XXVI, 3047. —
162) Compt. rend. CXX1I, 146; CXXX, 376; Bredt и Rosenberg, Ann. Chem. 289, 1. —
163) Journ f. prakt. Chem. XXXIII, 154; Ber. d. deutsch. chem. Ges. XXV, 3495 u. XXVI, 1802. —
164) Ber. d. deutsch. chem. Ges. XXV, 2632; XXVI, 1354; XXVII, 1592; XXVIII, Ref. 80. —
165) Ber. d. deutsch. chem. Ges. XVII, Pat. 148 и 149; далће стр. 2032 и др. —
166) Ann. Chem. CCLXXIX, 188; ССХСІІІ, 1. —
167) D. R.-P. 71261. —
168) d. R.-P. 32958, 1884. —
169) Ber. d. deutsch. chem. Ges. XXIII. 3043, 3431.
170) Вег. d. deutsch. chem. Ges. XXXIII, LXXI. —
171) Ibid. XXXIV, 4069.
172) Ostwald, Elektrochem. Zeitschr. VII, 995. —
173) Ann. d. Chem. CLII, 25. —
174) Ber. d. deutsch. chem. Ges. XXVI, 2675; XXVIII, 1754. —
175) Cp. докладъ Тиманна. Вег. d. deutsch. chem. Ges. XXVI, 1595.
1) Compt. rend. (1896) СХХІІ, 420,501, 559, 609, 762, 1086. —
2) J. Curie, These de doctorat 1880.
3) P. et S. Curie, Compt. rend. 1898. —
4) S. Curie, ibid, апрћль 1898. —
5) Ея же, Untersuchungen über die radioaktiven Substanzen, iibersetzt von W. Kaufmann, Braunschweig, S. 17. —
6) P. et S. Curie et G. Bemont, Compt. rend. Декабрь. 1898. —
7) Compt. rend., іюль 1898. —
8) Ibid., октябрь 1899 и апрћль 1900. —
9) Радіотеллуръ, отдћленный Марквальдомъ отъ висмута,который былъ извлеченъ изъ смоляной руды, повидимому идентиченъ съ полоніемъ (Веr. chem. Ges. XXXV, 2285 и 4239; XXXVI, 2662).
10) M-me Curie, Compt. rend., ноябрь 1899, августъ 1900 и іюль 1992; cm. Untersuchungen 33. —
11) Trans. Roy. Soc. CLXXXXVI, 55 (1901). —
12) Compt. rend. CXXXVI, 673 (1903).
*) Это удалось Г-жћ Кюри въ 1910 г. Прим. ред.
13) Phil. Mag. XLVII, 109 (1899). —
14) Compt. rend. CXXX, 1010 (1900). —
15) Недавно открыты еще и δ-лучи, они обладаютъ свойствами катодныхъ лучей малой скорости (ср. J. J. Thomson, Proc. Cambridge Soc. ХШ, 1, 49 и Rutherford, Phil. Mag. (6) X, 193; Slater, ibid. (6) X, 460.
16) P. et S. Curie , Compt. rend. CXXIX, 714 (1899). —
17) Phil. Mag. (5) XLIX, 1 и 161 (1900). —
18) Ber. chem. Ges. XXXII, 3608 (1902), cp. также Rutherford u. Soddy, Phil. Mag. (6) VI, 569 (1902). —
19) Phil. Mag. (6) V, 561 (1903). —
20) Proc. Roy. Soc. LXXII, 204 (1903). Verhandlungen der Naturforscherversammlung zu Cassel 1903, 62. —
21) Soddy, die Radioaktivitat. Leipzig 1904, 123. Въ послћднее время Ретгерфордъ принимаетъ, что алучи радія идентичны съ геліемъ.
22) Rutherford и Soddy, Trans. Chem. Soc. LXXXI, 321 и 837 (1902); Phil. Mag. (6) IV, 378 (1902); cp. также Hoffmann и Zerban, Ber. chem. Ges. XXXVI, 3093 (1903). Въ этой статьћ указывается, что торій изъ гадолинита нерадіоактивенъ. —
23) Phil. Mag. (6) IV, 579; V. 576; Rutherford, ibid. 5) IL, 170. —
24) Cp. Soddy, 1. c. 119. —
25) Soddy, Radioaktivitat, 179; Rutherford, Radioactivity, 2oe изд. Cambridge 19c 6. J. J. Thomson. Elektrizitat und Materie, tibersetzt von Siebert, Braunschweig 1904.
26) Soddy: Wilde'a, лекція читанная въ литературнофилософскомъ обще ствћ въ Манчестерћ въ 1904 г. J. J. Thomson, въ книгћ Elektricity and Matter предложилъ подобную же гипотезу и примћнилъ ее для объясненія валентности и періодическаго закона. —
27) Phys. Zeitschr. 1900, 1901 и 1902. —
28) Wilson, Proc. Roy. Soc. 1901; Rutherford и Allen, Phil Mag. 1902, IV, 701; Mc. Lennan, Phil. Mag. V, 419; VI, іюнь 1903 и далће. —
29) Walkhoff, Phot. Rundschau Okt. 1900; Giesel, Ber. chem. Ges. XXXIII, 3569; Becquerel et P. Curie, Compt. rend. CXXXII, 1289; Himstedt u. Nagel, Ann. d. Physik IV (1901) и далће. —
30) Neuere Anschauungen auf dem Gebiet der anorg. Chemie, Braunschweig 1905. Beitrage zur Theorie der Affinitat und Valenz. Vierteljahrschrift der Zuricher Naturf. Gesellschaft 1891, 36; Lehrbuch der Stereochemie; Bloch, Werner's Theorie des Kohlenstoffatoms, Wien и Leipzig 1903. и др.
31) Werner, Neuere Anschauungen и т. д. 58. —
32) Ibid. стр. 26.
33) van't Hoff, Lagerung der Atome im Raum, 4. —
34) Werner, 1. c., 98.
35) Werner, 1, с. стр. 110 и слћд.
36) Надо, впрочемъ, замћтить, что такое пониманіе возможно только въ томъ случаћ, если допустить, что NH3 можетъ быть замћщенъ эквивалентнымъ количествомъ Сl, но Вернеръ считаетъ это невозможнымъ, см. выше.
37) Zeitschr. f. anorg. Chemie XXXIX, 330. стр. 185 и сл.
38) Ср. стр. 79 и сл.
39) Ср. стр. 180 и сл.
40) Электросродство это понятіе, введенное Абеггомъ и Бодлендеромъ; оно означаетъ сродство атома къ электрону и по ихъ мнћнію можетъ лучше, чћмъ валентность, служить основой систематики. Zeitschr. f. anorg. Chemie XX, 453 (1899).
41) Ann. Chem. CCCVI, 87. —
42) Nachr. Ges. Wissensch. Gottingen 1906, Heft. 1. —
43) Zeitschr. f. phys. Chem. V, 323 (1890). —
44) Cp. Bruni, Uber feste Losungen, Ahrens1 Sammlung VI, 415.
45) Beckmann и Stock, Zeitschr. phys. Chem. XVII, 120; XXII, 612. Bruni Gazz. chim. I, 259 и 277 (1898). —
46) Juptner, Handbuch der Siderologie. Его же Ber. chem. Ges. XXXIX, 2376. Van't Hoff, Vortrage uber phys. Chemie, Braunschweig 1902. Backhuis lloozeboom, Zeitschr. phys. Chem. XXX1V.437. K. Austen, Proc. of the Inst, of Mech. Engineers, 1897, 70 и 90. Le Chatelier, Kevue gen. des sciences pures et appHquees, 1897, 11.
47) Zeitschr. phys. Chem. XXX, 602; ХХХIII, 571; XXXV, 588; XXXVI, 513; XLV1II, 243; L, 225 (1904).
48) Zeitschr. anorg. Chem. XXXVII, 459; XLVIII, 393; U 446. Ber. chem. Ges. XXXIX, 197. —
49) Bronstedt, Zeitschr. phys. Chem. LV, 371. —
50) Ber. chem. Ges. XXXV, 351; XXXVI, 979. —
51) Ibid. XXXVI, 4202.
52) Веr. XXVII. 3230 (1894). —
53) Journ. Chem. Soc. (1901), LXX1X, 1305; Proc. chem. Soc. 1900, 226.—
54) Ber. XXXVI, 2575 (1903). —
55) Ibid. XXXVII, 349. —
56) Ср. стр. 260. —
57) Marckwald и McKenzie, Ber. XXXII, 30; XXXIII, 218; XXXIV, 469.
58) Ber. XXXVI, 976 (19C3). —
59) Ibid. XXXVI, 1192. —
60) Ber. XXXVII. 3688 (1904) и XXXIX, 2486 (1906). —
61) Trans. Chem.Soc. LXXV, 1127; LXXVII, 1072 и LXXIX, 828. —
62) Trans. Chem. Soc. LXXX1II, 1418; LXXXV, 223. —
63) Ber. XXXII, 511, 517,722, 1408, 3561; XXXIV, 3986, XXXV, 178,766, 1075, 3580, 3907; XXXVI, 1158, 1163, 3791; XXXVII, 2712, 3894; XXXVIII, 436, 1838, 3438,3933. далће Ann. Chem. CCCXVUI. 90; Ber. XXXIX, 481. —
64) Ber. XXI, 818 (1888).
65) Chem. Soc. Trans. LXXXVI1, 1721 (1905).
66) Ber. Chenr Ges.XXXVIII, gx38. —
67) Ibid. XXIX, 2718 (1896).
68) Compt. rend. CXXVIII, 110 (1899). —
69) Ibid. CXXX, 1322 (1900); CXXXIL 336, 558, 1182; CXXXIV, 107 etc. Ann. Chim. Phys. (7) XXIV, 437 (1901) etc. Перечень литературы занялъ бы много страницъ; довольно полный перечень можно найти въ книгћ Schmidt: Die organischen Magnesiumverbindungen und ihre Anwendung zu Synthesen (Ahrens, Sammlung X, 67).
*) Выясненію этой реакціи весьма много способствовалъ Челинцевъ* Прим. ред.
70) Ber. XIV, 494, 659 и 705 (1881). —
71) Ср. напр. Ladenburg, Bar. XV, 1024; Willstadter. ibid. ХХVІІІ, 3271; Knorr, ibid. XXXII. 736. —
72) Ber. XXXVII, 2812, 2915, 3210, 3583 (1904); ХХХVIII, 109, 956, 2336, 3083.
73) Ann. Chem. CLXXXIV, 1; ССХІV, 193, 257. —
74) Ber. XXI, 566 (1888).
75) Ibid. XXI, 1049, 2664; XXII, 224, 1139. 2220, 2223; XXIII. 2489; XXIV, 1110, 3098, 3104, 3231; XXV, 2415 и далће. —
76) Compt. rend. CXXIV, 1358 (1897); ibid. (1899) 1270; ibid. СХХVIII, 1173; СХХХ, 1559, 1628 и др. —
77) Bull, soc. chim. (3) 33, 1 до ХVIII.
78) Compt. rend. СХХІІ, 244 (1896). —
79) Ann. Chim. Phys. (7) XXVII, 349 и тамъ же (8) VI. 289. —
80) Ann. Chem. CCCXXV, 261. —
81) Ber. ХХVIII, 1904; XXXI, 2018; XXXIII, 2353; XXXIV, 696. —
82) Ibid. XXXVII, 1225.
83) Ibid. XXVI. 294. —
84) Ann. Chem. Pharm. CCXVII. 74 и СССХХVІ, 379; Ber. XX, 1647, XXI, 3099; XXIII, 1780 и 2225; XXIV, 1628; XXIX, 421; XXXV. 1159 и 2295. —
85) Ann. Chem. Pharm. CCCXVI1. 204. 267 и 307; CCCXXVI, 1. —
86) Cp. стр. 335.
87) Skraup, Ber. XII, 230, 1104; XXVI, 1968. Wiener Monatshefte IV, 699; VI, 762; IX, 783; XII, 431; XV, 37. Ann. Chem. CXCVII, CIG, 344; CCI, 291. Konigs. Ber. XII, 97; XVII, 1992; XIX, 2853; XX, 235, 2516; XXIII, 2679; XXV, 1539; XXVIII, 1988, 3143; XXIX, 372. Ann. Chem. Pharm. CCCXXXXVII, 143. —
88) Knorr, Ber. XXII, 1113; XXXII, 736 и 742; XXXVI, 3074; XXXVII, 3494 и 3499; XXXVIII, 3153 и 3172; XXXIX, 3252. —
89) Съћздъ естествоиспытателей (1906) въ Штутгартћ. Ztsch. Elektrochem. XII, 778. —
90) Вег. XXXIX, 689 (1906). —
91) Ср. стр. 328. —
92) Ср. Brodie, Proc. Roy. Soc. 1873, № 143; онъ уже за 33 года передъ тћмъ получилъ соединеніе С4O3, что подтвердилъ Бертело, Ann. Chim. (8) IX, 173. —
93) Корр, Gesch. d. Chem. IV, 88. —
94) Ann. Chem. II, 5. —
95) Gilb. Ann. LII, 197, 339. —
96) Ann. Chim. phys. (2) XLV, 270. —
97) Ann. Chem. Pharm. CXXI, 346. —
98) Compt. rend. LXXXVI, 20, 71, 277 (1878); XC, 269, 331; CXII, 1481. —
99) Chem. Soc. J. 1891, 771.
99a) Ann. Chem. Pharm. GXXIX, 282. —
100) Zeitsch. angew. Chemie 1898, 845. —
101) Ваеуег и Villiger, Ber. XXXII, 3625; XXXIII, 124, 858, 1569, 2479, 2488, 3387; XXXIV, 738, 749, 755, 762, 853. —
101a) Ber. XXX, 3144 и XXXI, 446. —
102) Ber. XXVIII, 2265. —
103) Ber. Chem. Ges. 1903 до 1905. Изслћдованія объ аминокислотахъ, полипептидахъ и протеинахъ, Ber. XXXIX, 330 (1906). Ann. CCCXL, 123. Ber. XXXIX, 2893 и 2942.—
104) Hoffmeister. Съћздъ естествоиспытателей въ Карлсбадћ 1902. Verhandlungen, 33—
105) Ср. стр. 272. —
106) Ср. стр. 273. —
107) Ср. стр. 351. —
108) Ср. стр. 251. —
109) Ср. Fischer, Ber. XXX1X, 530 и 553. —
110) Дикетопиперазины, открытые Курціусомъ, надо считать діангидридами аминокислотъ, напримћръ
NH2 |
|
NH. |
111) Ср. стр. 193.
112) Нћкоторые изслћдователи, напримћръ Оствальдъ (Ztschr. f. Elektrochemie VII, 995 (1901), распространяютъ понятіе катализа на реакціи, при которыхъ катализаторъ, какъ можно доказать, принимаетъ участіе въ промежуточныхъ реакціяхъ, какъ, напримћръ, окислы азота въ камерномъ процессћ, или сћрная кислота при полученіи эфира. При опредћленіи, установленномъ здћсь, катализъ ограничивается, какъ и прежде, реакціями, вызываемыми дћйствіемъ контакта. —
113) Ср. стр. 329. —
114) Knietsch, Ber. XXXIV, 4069 (1901). —
115) Brunck, Вег. 33, LXXI (5. Anlage) 1900. —
116) Schonbein, J. prakt. Chem. LXV, 96. Pogg. Ann. C, 1; J. prakt. Chem. LXXV, 78; LXXX, 257, LXXXVI, 65; LXXXIX, 24; Pogg. Ann. CV, 265 и далће. —
117) Phil. Trans. 1817, 79. —
118) Berzelius, Jahresber. V, 166. —
119) Friedel и Ladenburg, Ann. Chem. CXXXXIII, 124; Pringsheim, Pogg. Ann. Phys. (2) XXXII, 384; Dixon, Ber. chem. Ges. XXXVIII, 2426; J. Chem. soc. XLIX, 94, 384; Baker, ibid. 1894, 603; 1898, 422; 1902, 40. —
120) Frankland и Duppa. Ann. Chem. CXXX, 105.
121) Cp. стр. 274. —
122) Cp. стр. 351.
123) Wilhelmy, ср. стр. 297. —
124) Berthelot, ср. стр. 297. —
125) Ostwald, Journ. prakt. Chem. XXVIII, 449; XXIX, 385. —
126) Zeitschr. Elektrochem. XI, 525. —
127) Zeitschr. phys. Chem. XXXIII, 129. —
128) Zeitschr. phys. Chem. XXXIII, 129. —
129) Kuster, Ztschr. anorg. Chem. XXXXII, 453. —
130) Ztschr. phys Chem. XXXI, 258; cp. также Herz, Katalyse: Ahren's Sammlung XI, Heft 3 (1906). —
131) Zeitschr. phys. Chem. XXXXVI, 725.
132) Ann. Chem. Pharm. CXXI, 1 (1862). —
133) Ср. напр. Bechhold, Chem. Zeitschr. IV, 170 (1905). —
134) Siedentopf и Zsigmondy, Ann. phys. (4) X, 1, (1903). —
135) Ann. Phys. (2) CXIII, 513 (1861).
136) Zeitschr. phys. Chem. XXXIII, 316 (1900). —
137) Zeitschr. f. physiol. Chem. XIV, 165 (1889); VII, 431 (1891). —
138) Beitr. z. chem. Phys. u Path. Ill, 5. —
139) Holborn и Wien. Wiedemann's Ann. LIX, 213. Ladenburg и Krugel, Ber. XXXII, 1818. —
140) Pogg. Ann. CI, 316. —
141) Jahresber. 1889, 578 и 581; 1891, 595 и дал.; 1894, 698 и дал. —
142) Muthmann, Ber. XX, 983; Schneider, Ber. XXIV, 3370; XXV. 1440 и дал. —
143) Zeitschr. Elektrochem. IV, 514. —
144) Crede, Merck's Jahresber. 1897, 1898, 1899 и др.
145) Вег. XXXV, 2195 (1902). —
146) Kuzel, Journ. f. Gasbel. XLIX, 336 (1906). —
147) Rohland, Zeitschr. anorg. Chem. XXXXI, 325. —
148) v. Bemmelen, J. f. prakt. Chem. (2) XXIII, 324, 379; (2) XXVI, 227. Ber. XIII, 466; Ztschr. anorg. Chem. V, 466; XIII. 233; XVIII, 14, 98; XX, 185; XXIII, 111, 321; XXXVI, 380 и др. —
149) Fischer, Habilitationsschrift, Breslau 1907. —
150) Ber. XXXVI 3417 (1901).
1) По исторіи алхиміи: cm. H. Kopp, Die Alchemiel и II. Heidelberg, 1886. М. Beithelot, Les Origines de l'Alchemie. Paris, 1885. Berthelot et Ruelle, Collection des anciens alchimistes grecs. 4 vols. Paris, 1888. H. Stanl. Redgrove, Alchemy, Ancient and Modern. London, 1911.
1) Ср. трудъ М. Булгакова, Исторія Кіевской Академіи. Спб. 1843. —
2) Пекарскій, Введеніе въ исторію просвћщенія въ Россіи, стр. 3. Спб. 1862. —
3) Н. Костомаровъ, Очерки Торговли Московскаго Государства. Спб. 1862.
1) См. М. Хмыровъ, Металлы и металлическія издћлія и минералы въ древней Руси. СПб. 1875; Н. Аристовъ, Промышленность древней Руси. Спб. 1866. —
2) См. V. Hehn, Das Salz. Berlin, 1901.—
3) Cp., напримћръ, интересную статью A. M. Васильева, Происхожденіе названій химическихъ элементовъ. Казань, 1912.
1) Въ связи съ этимъ я укажу на старинныя мћсторожденія и добычу мћди чудскими племенами на Алтаћ и на доисторическое добываніе (не кельтами ли?) ртути въ Никитовкћ (Бахмутскаго ућзда, Екатеринославской губ.). —
2) Въ 1569 г. англичане исходатайствовали у царя Ивана IV позволеніе устроить на свой счетъ заводъ на Вычегдћ для добычи желћза изъ русской руды (Хмыровъ, стр. 150).
1) Новомбергскій, Врачебное строеніе въ доПетровской Руси, стр. 77, 78, 81 (Томскъ, 1907). —
2) Ibid.. 118, 149, 151, 156, 165.
1) Новомбергскій 88, 297, 299, 155.
1) Рихтеръ, Исторія медицины въ Россіи, т. II, 301. —
2) Новомбергскій, 88 и слћд. —
3) Новомбергскій, Матеріалы по исторіи медицины въ Россіи, т. IV, 442 (1907) Рихтеръ, Исторія медицины въ Россіи, т. II, 301. —
4) Новомбергскій, Врачебное строеніе, 168, 90, 297. —
5) Мамонтовъ, Матеріалы, т. IV, стр. 1290 и 1277, Новомбергскій, Матеріалы по исторіи медицины, т. I, 23.
1) Новомбергскій, Врач. стр., 247, 256. —
2) Новомбергскій, Матеріалы т. III, II, 79, 81, 82 (1906). —
3) Новомбергскій, Врач. стр., 229.
1) Новомбергскій, Врач. стр. 154 и слћд. —
2) Новомбергскій, Матеріалы, т. IV, 548 (1907). —
3) ibid. т. IV, 588. —
4) Ibid. т. I, 23, 81 (1905). —
5) Новомбергскій, Врач. стр., 208, 243, 187.
6) Ibid.
1) Новомбергскій, Врач. стр., 90, 203. 204, 262. —
2) Новомбергскій, 1. с, 150, 203, 227, 243. —
3) Рихтеръ, Исторія медицины въ Россіи, т. II, 295.
4) Соболевскій, переводная литература Московской Руси, стр. 47, 157, 442 (1903). —
5) Schmieder, Geschichte der Alchemie, 139, 178 (1832). —
6) Рихтеръ. 1. c., т. II, 34 и приложенія V и VI.
1) См. Новомбергскій, Врач. строеніе, 139, 150, 160—162; Костомаровъ, Очерки торговли..., 230.
1) См. Хмыровъ, стр. 181—184. 237—253. —
2) Въ 1631 г.на Уралћ былъ построенъ первый желћзодћлательный заводъ, названный Кицинскимъ. Кн. Абамелекъ-Лазаревъ, Вопросъ о нћдрахъ и развитіе горной промышленности въ XIX стол. Спб. 1902, стр. 186.
1) По анекдотамъ Г. Штелина, см. Рихтеръ, Исторія медицины, т. III, 420.
1) Ср. Briefe von Christian Wolff aus den Jahren 1719—1753. Спб. Акад. Н. 1860.
1) Упомянемъ, какъ интересный фактъ, что въ 1726 году знаменитый основатель флогистонной теоріи и лейбъ-медикъ прусскаго короля G.E. Stahl былъ въ Петербургћ у больного князя Меньшикова (ср. Матер. для Истор. Импер. Акад. Н., VI, 90). Относительно молодого Шталя см. Матер. для Истор. Имп. Акад. Н., т. I, 271, 273, 282; Briefe von Chr. Wolff, 198.
1) Заслуга открытія М. В. Ломоносова принацлежитъ Б. Н. Меншуткину; благодаря его заботамъ были извлечены изъ архивовъ Академіи Наукъ рукописные труды Ломоносова, а равно его лабораторные журналы, программы изслћдованій и др. Б. Н. Меншуткинъ перевелъ таковые и издалъ въ видћ обширнаго труда: М. В. Ломоносовъ, какъ физико-химикъ. (Спб. 1904). Благодаря Меншуткину, химики запада успћли ознакомиться съ работами Ломоносова (см. В. N. Menschutkin, W. M. Lomonossow, der erste russ. Chemiker und Physiker, Ann. d. Naturphil. IV, 204, 1905 и Diergart, Beitrage, стр. 73, 1909; Ostwald's Klassiker, № 178, 1910, Chem. News, 105, 75, 85, 1912). Къ 200лћтнему юбилею дня рожденія Ломоносова. 8 ноября 1911 г., Импер. Академія Наукъ устроила торжественное собраніе, на которомъ были произнесены рћчи, посвященныя оцћнкћ Ломоносова, какъ физико-химика и естествоиспытателя (П. Вальденъ, Ломоносовъ, какъ химикъ. Спб. 1911; Б. Н. Меншуткинъ; Ломоносовъ, какъ естествоиспытатель. Спб. 1911). Ломоносовскій сборникъ, Спб. 1911. Труды Ломоносова въ области естественно-историческихъ наукъ (Спб. 1911). И. Каблуковъ, Ломоносовъ, какъ физико-химикъ. Рћчь. Москва, 1912.
1) Diergart, Mitteil. zur Gesch. d. Med. u. Naturw. X, 420 (1911), Arch, f. Gesch. d. Naturw. Ill, 313 (1911); Speter, Lavoisier und seine Vorganger, Stuttgart (1910), Ostwald's Klassiker, № 178 (1910); S. Gunther, Gesch. d. Naturw., II, Leipzig. 1909; W. Ostwald. Grosse Manner, 330 (1910); E. Cohen, Zeitschr. f. Electrochemie.XVII, 489 (1911); Fr. Dannemann, die Naturwissenchaften in ihrer Entwickelung, III, 48. 117, 118 (1911). —
2) Alex. Smith, Journ. of Amer. Chem. Soc. 34, 109—119, 1912.
1) См. Пекарскій, Ист. Имп. Акад., II, 555, (1873). —
2) Cm. Poggendorff s Biograph.literar. Worterb., I, 1409 (1863); Гр. Геннади, Справочный Словарь, II, 229 (1880); Е. v. Berg, Repertorium der Literatur, 166 (1862); Пекарскій,1. с, II, 750. 842; Tableau general des matieres contenues dans les publications de l'Acad. Imp. de St.Petersb, I part., p. 185, 194 (1872).
1) Ср. сочиненіе В. Лагуса: Эрикъ Лаксманъ. Спб. (Акад. Н.), 1890; 488 стр.; P. Walden: Erik Laxman, Annal. Acad. Scient. fennicae, ser. A., t. V, 1—28 (1913). Helsingfors.
1) Ср. сочиненіе В. Лагуса: Эрикъ Лаксманъ. Спб. (Акад. Н.), 1890; 488 стр. —
2) Лаксманъ остроумно характеризуетъ эту слабость тогдашнихъ ученыхъ въ одномъ письмћ отъ 1770 г.: „Неудивительно потому, что болћзнь печатанія свирћпствуетъ въ неслыханной мћрћ въ Геттингенћ”. —
3) Лаксманъ былъ выдающимся коллекціонеромъ минераловъ; онъ самъ характеризовалъ себя, какъ человћка, „который до безумія и мученичества влюбленъ въ камни”, — послћдняя автохарактеристика находится въ письмћ отъ 1786 г. изъ Талцынска, въ которомъ онъ извћщаетъ объ открытыхъ имъ въ Култукћ (у БаЙкала) трехъ новыхъ минералахъ: тремолитћ, байкалитћ и лазуревомъ камнћ. Знаменитый камень Lapis lazuli привозился въ XVIII вћкћ въ Россію изъ Бухары, и за каждый фунтъ его платили по фунту серебра! Лаксманъ открылъ сибирское мћсторожденіе этого замћчательнаго минерала, и изъ образцовъ, присланныхъ имъ въ Петроградъ, Екатерина II приказала устроить Лазурную Комнату въ Царскосельскомъ дворцћ. Минералъ тремолитъ былъ анализированъ Ловицемъ, байкалитъ — Ренованцемъ, давшимъ ему это названіе. Въ 1790 г. Лаксманъ открылъ на рћкћ Вилюћ два минерала: вилюитъ, впервые анализированный Ловицемъ, и гроссуляръ. У Лаксмана былъ цћлый йинералогическій музей, который посћтилъ въ 1777, во время пребыванія въ Петроградћ, знаменитый путешественникъ Ж. Бернулли; въ 1786 г. эта коллекція была куплена для Горнаго Института и присоединена къ его минералогическому кабинету.
1) Евгеній, 1. с. I, 111, Poggendorff, I, 875.
1) Соколовъ: см. Евгеній, 1. с. II, 173, Корр, Gesch. d. Chem.. IV. 93; Сухомлиновъ, т. III, 123158, 348 — 364.
1) О химическихъ трудахъ Захарова не сохранилось указаній ни въ исторіи химіи Gmelin'a (3 тома, 1797—1799) и Kopp'a, ни у Poggendorffa. —
2) Сухомлиновъ, Исторія Рос. Академіи, I, 30 (1874).
1) Cm. P. Walden, Diergarfs Beitrage aus der Gesch. der Chemie, 533 — 544 (1909). Геннади, Справочный Словарь, II, 245 (1880). Poggendorffs Biog.~ liter. Worterb. I, 1503 (1863). Неустроевъ, Истор. розысканіе о русск. поврем. изданіяхъ. Спб. 1874.
1) Матеріалы для Исторіи Акад. Н., т. VI, 155. —
2) Сухомлиновъ, Исторія Рос. Акалеміи, т. II, 328.
3) См. Евгеній, Словарь, I. lib (1845).
4) См Евгеній, 1. с, 112. Joh. Gotti. Georgi: Geograph.physik. Beschreibung des Russichen Reichs. Konigsb. 1798.
1) Евгеній, II, 250.
1) См. болће подробныя данныя о Севергинћ: Сухомлиновъ, Исторія Рос. Академіи, т. IV, 6185, 339395, 418468 (1878).
1) См. Сухомлиновъ, Ист. Рос. Акад., I, 29; Евгеній, I, 157.
1) Сухомлиновъ., Исторія Рос. Акад. I, 31.
1) См. Ходневъ, Ист. Имп. Вольн. Экон. Общ. Спб. 1865.
1) См. Рихтеръ, т. III, 429. Интересна судьба этой знаменитой тинктуры, которую скоро стали выдавать за открытіе французскаго бригадира Ламотта ,.Elixir d'or et blanc”; этотъ элексиръ, содержащій лишь желћзо, продавался въ Парижћ по луидору за полунціи! Споръ о пріоритетћ и составћ этой тинктуры былъ рћшенъ указомъ Императрицы Екатерины II. —
*) Бест.Рюминъ открылъ тайну своей тинктуры Моделю, который съ его разрћшенія опубликовалъ ея составъ (1762).
2) Cm. Poggendorff, 1. с, t. II, 247 (1863), Евгевія Словарь русскихъ свћтскихъ писателей, т. II, 98 (1845). —
3) См. также Евгенія, 1. с, т. I, 150 (1845), Геннади, Справочный Словарь, т. I, 236 (1880). Сухомлиновъ, Исторія Рос. Акад. I, 369 (1874).
1) См., напр., замћтку Любавина, Журн. Р. Ф.Х. О. 43, II, 173 (1911). —
2) L. Darmstadter, Handbuch zur Geschichte d. Naturwiss., II изд., 193 (1908). —
3) Darmstadter, 1. c, 208. Cm. подробно: Лермантовъ, Ж. P. Ф.Х. О., ч. П, 263 — 266 (1884). —
4) Рихтеръ, Исторія медицины, т. III, 419 — 429 (1820).
1) См. Біограф. Словарь Имп. Моск. Унив., т. I, 151, 340, 407 (1855),. Ломоносовскій Сборникъ, 24 (Москва, 1901). —
2) Poggendorffs Biogr.litt. Handworterbuch, I, 192 (1863). —
3) Poggendorff, 1. c. II, 164 (1863); Gmeliu Gesch. d. Chemie, т. II и III (1798 и 1799).
1) См. Чистовичъ, Исторія первыхъ медиц. школъ въ Россіи. Спб. 1883.
1) См. Научно-историч. Сборникъ, изд. Горн. Институтомъ ко дню 100л. юбилея въ 1873 г. Спб. 1873.
2) Евгеній, II, 113; Poggendorff, II 607; Е. v. Berg, 179. —
3) Евгеній, II, 99; Е. v. Berg. 173.
*) Построенные казною Горо-Благодатскіе желћзные заводы были въ 1754 г. отданы гр. Петру Ив. Шувалову.
1) Соловьевъ началъ печатать (въ 1824 г.) особую статью „О россійской номенклатурћ химіи”, которая, однако, осталась незаконченною. —
2) Оберъбергъпробиреръ при Горномъ Институтћ; занимался обработкою платины.
1) Викторъ Юльевичъ Рихтеръ род. въ 1841 г. въ Курляндской губ ; переселившись съотцомъ, впослћдствіи евангелическимъ епископомъ, въ Петроградъ, онъ тамъ же окончилъ школу Св. Анны; дальнћйшее образованіе получилъ въ Дерптскомъ универснтетћ, гдћ учился у Карла Шмидта и пріобрћлъ кандидатскую степень (1863). Съ 1864 до 1872 г. состоялъ ассистентомъ при Пгр. Технологическомъ Институтћ (въ 1867 пріобрћлъ степень магистра, а въ 1872 г. степень доктора химіи въ Пгр. университетћ). Съ 1872—1874 г. состоялъ профессоромъ химіи Сельско-Хозяйственнаго Института въ Новой Александріи; здћсь онъ написалъ свои русскіе учебники неорганической и органической химіи, предпринявшіе впослћдствіи, въ изданіяхъ на иностранныхъ языкахъ, свое путешествіе по всему міру. Вслћдствіе болћзни, требовавшей пребыванія въ южномъ климатћ, Р. вышелъ въ отставку (1874), Послћ временнаго возстановленія своего здоровья, Р. поселился въ Бреславлћ, гдћ онъ и провелъ всю остальную жизнь (съ декабря 1875 по 1879 г. въ качествћ приватъдоцента, a 1879—1891 въ качествћ профессора технической химіи). Послћ продолжительной и тяжкой болћзни Р. умеръ въ 1891 г. (см. некрологъ въ Ж. 23, 519. и Вегі. Вег. 24, II ч., 1123—1130, 1891).
1) Біографическія данныя объ Оствальдћ имћются въ монографіи: P. Walden, Wilh. Ostwald (Leipzig 1904). B. Оствальдъ родился въ г. Ригћ въ 1853 г., среднее образованіе получилъ въ Рижской городской гимназіи, съ 1872— 1875 состоялъ студентомъ Дерптскаго университета, гдћ подъ руководствомъ Карла Шмидта и Лемберга изучалъ химію, а физику изучалъ у А.фонъЭттингена. Преподавательскую дћятельность онъ началъ сейчасъ no полученіи степени кандидата химіи (1875), занявъ должность ассистента физики (до 1880 г.), а впослћдствіи должность ассистента химіи въ Дерптскомъ университетћ, гдћ въ 1877 г. онъ былъ удостоенъ степени магистра химіи, въ 1878 г. степени доктора химіи. Въ 1881 г. Оствальдъ былъ назначенъ профессоромъ химіи въ Рижскомъ Политехникумћ, гдћ имъ было написано упомянутое классическое руководство физической химіи и основанъ журналъ „Zeitschrift fiir physikalische Chemie (188687). Въ 1887 r. онъ былъ избранъ профессоромъ физической химіи (первая самостоятельная каќедра по этой наукћ!) въ Лейпцигскомъ Университетћ; изъ русскихъ ученыхъ его учениками въ Лейпцигћ были: Асканъ, Вальденъ, Зелинскій, Каблуковъ, Кистяковскій, Лутеръ, И. Плотниковъ, С. Реформатскій, Тимофеевъ и др. Въ 1906 г. Оствальдъ оставилъ по своей волћ каќедру, чтобы посвятить все свое время и энергію ряду вопросовъ, имћющихъ общенаучное и общественное значеніе.
1) Жизнь Гринделя съ современной точки зрћнія весьма замћчательна. Изучивъ практическую фармацію въ гор. Ригћ. онъ изучаптъ медицину и естественныя науки въ Іенскомъ Университетћ, гдћ и получаетъ степень доктора филссофіи. Вернувшись [(1802) въ Ригу, онъ снова сдћлался аптекаремъ. Въ 1804 г. онъ былъ назначенъ профессоромъ химіи и фармаціи въ Дерптскомъ Университетћ, съ 1810 до 1812 г. состоялъ ректоромъ университета, а въ 1814 г. —вслћдствіе паденія курса (Наполеоновская война) —изъза недостатка въ средствахъ къ существованію, сложилъ съ себя профессуру. Вернувшись въ Ригу, онъ снова сдћлался аптекаремъ. Въ 1820 г. онъ, однако, перећхалъ въ Дерптъ, гдћ онъ, бывшій ректоръ университета, поступилъ въ студенты медицинскаго факультета! Сдавъ въ 1823 г. экзаменъ, онъ поселился въ качествћ вольнопрактикующаго врача въ г. Ригћ, гдћ и скончался въ 1836 г. Гриндель развилъ очень обширную и полезную дћятельность какъ учитель, литераторъ и организаторъ. Такъ, напримћръ, въ 1802 г. онъ издалъ трудъ „О приготовленіи свекловичнаго сахара”, удостоенный преміи Императорскимъ Вольн. Экономич. Обществомъ; онъ писалъ „О различныхъ способахъ очистки воздуха” (1802), сочинилъ рядъ учебниковъ по фармаціи (1804), по теоретической химіи (1808, см. выше), по органической химіи („Die organischen Кбгрег chemisch betrachtet”, I и II часть. Рига, 1811); онъ пёреиздалъ трудъ К. Ф. Венцеля, впервые открывшаго законъ дћйствія массъ: „Ученіе о химическомъ сродствћ”, и снабдилъ его примћчаніями (1800). Изъ его экспериментальныхъ работъ интересны аналитическія изслћдованія хины, кофе, хмћля, дрожжей, минеральныхъ водъ и т. д.; интересны его опыты „искусственнаго приготовленія крови'* гальванизмомъ („искусственная гематоза”). 1811—1812.
1) Еще въ 1857 г. Энгельгардтъ лелћялъ мысль объ изданіи „Jahresberichte fur Chemie” на русскомъ языкћ (см. Ж. 42, 1343).
1) Ник. Ник. Соколовъ род. 1826 г. въ Яросл. губ., окончилъ Пгр. Университетъ въ 1847 г., по юридич. и физ.матем. факультету, послћ чего спеціализовался у Либиха въ Гиссенћ и у Жерара^въ Парижћ. Въ 1858 г. сталъ преподавателемъ въ Горномъ Институтћ и редакторомъ хим. отдћла Горнаго Журнала, въ 1859 г., послћ защиты докторской диссертаціи „О водородћ въ органическихъ соединеніяхъ” сдћлался приватъдоц. и потомъ орд. профессоромъ въ Пгр. унив., съ 1865 до 1871 состоялъ проф. Новор. Универ.. съ 1872 до 1877 г. (до смерти) въ Лћсномъ Институтћ въ Петроградћ (см. біогр. подробности въ статьяхъ Н. Меншуткина и П. Логинова, Ж. Р. Ф.Х. О. 10, 8. 15 (1878).
2) Алекс. Никол. Энгельгардтъ (18281893) окончилъ Артиллер. Академію и состоялъ первоначально на службћ въ артиллер. вћдомствћ. Подъ вліяніемъ Н. Н. Соколова и Н. Н. Зинина сталъ усердно заниматься химіею, и впослћдствіи основалъ съ Н. Н. Соколовымъ частную химическую лабораторію и первый русскій журналъ по химіи (см. выше). Съ 1866 — 1869 г. состоялъ профессоромъ химіи въ Пгр. Лћсномъ и СельскоХоз. Институтћ. Укажемъ лишь на его работы „Объ изомерныхъ крезолахъ”, „О производныхъ тћлахъ”, „О нитросоединеніяхъ” и т. д. Въ 1870 г. онъ вынужденъ былъ поселиться въ родовомъ имћніи Батищево (Смоленской губ.), гдћ занимался практическимъ хозяйствомъ и пріобрћлъ извћстность, какъ сельскій хозяинъ и публицистъ. (См. Ж. 25, 43. 1883).
1) См. Ж. Р. X. О. I, 60 — 77, 212, 229 (1869). —
2) При нашихъ ссылкахъ на этотъ журналъ мы будемъ употреблять сокращенное обозначеніе Ж. Р. Ф.Х. О.
*) О состояніи химическихъ лабораторій мы приведемъ нћсколько историческихъ данныхъ въ другомъ мћстћ.
1) Cm. Ostwald's Klassiker. 152(1906); Ostwald: Elektrochemie, 307 (1896). —
2) Приведемъ еще любопытный фактъ: въ 1814 г. Гротгусу желали предложить каќедру химіи въ бывшемъ Дерптскомъ университетћ; министерство, однако, рекомендовало харьковскаго профессора Гизе. который и занялъ эту каќедру.—
3) Cm. P. Walden, Losungstheorien, стр. 80 и слћд. (1910).
1) Біогр. Слов. Моск. Импер. Унив., II, 329 (1855); Ломоносовскій Сборникъ, 44 (1901). —
2) Впервые сообщено въ засћданіи (ноябрь, 1807) Моск. ФизикоМедиц. Общ.; напечатано въ Mem. de la Soc. Imp. des Natural, de Moscou 2, 327, 332 (1809): „Notice sur un nouvel effet de I'electricite galvanique”. —
3) Cm., напр., Хвольсонъ, Курсъ физики, IV, 1, 480 (1907); G. Wiedemann, Die Lehre von der Elektricitat, I, 993 (1893). —
4) Cm. Freundlich, Kapillarchemie, 222 (1909). —
5) F. Forster, Elektrochemie, 87 (1905); Le Blanc, Lehrbuch der Elektrochemie, 143—147 (1911). —
6) Біографич. данныя и оцћнку замћчательныхъ трудовъ Якоби далъ академикъ Вильдъ, Bullet, de l'Acad. Imper, 29, (1876). Ho болће интересною представляется переписка Б. Якоби съ его знаменитымъ братомъ математикомъ С. G. Jacobi; cm. W. ”Ahrens, Briefwechsel zwischen C. G. Jacobi und M. H. Jacobi (Leipzig 1907).
1) Тћ-же константы сродства — посредствомъ электропроводности— были опредћлены Н. Д. Зелинскимъ (1891) для ряда стереоизомерныхъ кислотъ (двукарбоновыхъ), впослћдствіи (вмћстћ съ А. Изгарышевымъ) и для нћкоторыхъ циклопараффиновыхъ кислотъ (1908). Съ той же цћлью Б. Шишковскій изслћдовалъ (1896) рядъ органическихъ оксикислотъ. —
2) Ср. напр. J. J. van Laar, Theoretische Elektrochemie, 63—73, (1907); Le Blanc, Lehrbuch der Elektrochemie, 123—135 (1911). Sv. Arrhenius, Theorien der Chemie, 216—220 (1909); Carrara, Elektrochemie der nichtwassrigen Losungen (1908).
1) Г. Джонсъ, Основы физической химіи, 438 (Спб. 1911). —
2) С. Н. Jones, A New Era in Chemistry. New York, 1913, стр. 225.
1) He лишено интереса то обстоятельство, что I. Г. Шульце въ 1727 г.— тоже случайно, въ поискахъ „фосфора Балдуина” — нашелъ посредствомъ смћси азотнокислаго серебра и мћла фотохимическое измћненіе солей серебра и произвелъ первыя фотографіи вырћзанныхъ буквъ. Какъ третій курьезъ, приведемъ тотъ фактъ, что именно этотъ профессоръ „медицины, греческаго и арабскаго языка” и т. д. Альтдорфскаго университета числился въ свое время кандидатомъ на каќедру химіи, въ Академіи Наукъ.
1) Эта работа перепечатана полностью въ Ostwald's Klassiker, 152, подъ редакціею Р. Лутера и А. фонъ-Эттингена, Лейпцигъ 1906.
1) Онъ устроилъ (въ 1913 г.) въ Московскомъ Университетћ первую русскую фотохимическую лабораторію.
1) Интересно, можетъ быть, напомнить, что выдающійся нћмецкій спектрохимнкъ Юл.Вильг. Брюль — русскій уроженецъ; онъ родился въ 1850 г. въ г. Варшавћ, получилъ среднее коммерческое образованіе и затћмъ поступилъ въ Цюрихскій Политехникумъ для изученія технической химіи. Въ 1880 г.онъ былъ назначенъ профессоромъ химіи въ Львовскомъ Политехникумћ, а съ 1888 г. состоялъ почетнымъ профессоромъ въ Гейдельбергскомъ Университетћ; умеръ въ 1911 г. Совмћстно съ Эдв. Гьэльтомъ и О. Асканомъ издалъ (въ Roscoe—Schorlemmer's Lehrbuch der organischen Chemie): „Die Pflanzenalkaloide, von Jul. Wilh. Briihl, Edv. Hjelt u. Ossian Aschan” (Braunschweig, 1900).
1) Ср. также: P. Walden, Losungstheorien, 123 (1910).
1) См. напр. W. Ostwald, Lehrbuch der allgem. Chemie (Chemische Energie), II. 1, 203 (1893). —
2) Термохимическія изслћдованія Гесса были впервые опубликованы въ Бюллет. Академіи Наукъ, V, 302 (1839); VII, 257 (1840); VIII, 81 (1841); IX, 13 (1841); X, 161 (1842); Bullet, phys.-math. I, 148 (1842); IV, 34 (1844). —
3) W. Ostwald, Lehrbuch der allgem. Chemie, II, стр. V и 12 (1887).
4) Гессъ, Journ. prakt. Ch. 24, 420 (1841).
1) Термохимическія изслћдованія Гесса вышли въ нћмецкомъ изданіи (pstwald's Klassiker. № 9 (1890) подъ редакціей В. Оствальда. —
2) См. И. Каблуковъ, Влад. Ќеодор. Лугининъ. Москва, 1912. Памяти Вл. Ќ. Лугинина. Рћчи И. П. Осипова и А. Н. Щукарева. Харьковъ, 1913. —
3) Опредћленіемъ скрытой теплоты испаренія занимался также В. А. Курбатовъ (1908).
1) У Либиха, напримћръ, учились А. Воскресенскій, Н. Зининъ, И. Ходневъ, П. Ильенковъ, Н. Соколовъ, Лясковскій, а равно Вюртцъ.
1) Воскресенскій окончательно установилъ точный составъ хинной кислоты С7Н12O6 и ея солей; Либихъ въ примћчаніи къ этой работћ пишетъ, что она была произведена „Воскресенскимъ, молодымъ химикомъ, одинаково отличающимся талантомъ и рвеніемъ”. Точность работы Воскресенскаго очевидна изъ слћдующаго факта: на основаніи элементарнаго анализа, онъ вывелъ составъ хинона (С8HO)4 или, въ современныхъ атомныхъ вћсахъ, С6Н4O2 (А. 27, 270 и Journ. pr. Ch. 18, 419). Въ противоположность этому, Wohler (A. 51, 150, 1844) вывелъ изъ своихъ анализовъ формулу С25H8O8, но потомъ (А. 65, 349, 1848) онъ убћдился въ невћрности своихъ выводовъ, послћ того какъ Лоранъ (1845) на основаніи своихъ изслћдованій нашелъ 24 атома углерода; Вёлеръ пишетъ формулу хинона C24H8O8. Какъ видимъ, Воскресенскій сразу установилъ формулу, соотвћтствующую современной. —
1) Некрологъ, написанный Бутлеровымъ: Журн. Р. Ф.-Х. О. IV, 52 (1872); Веrl. Веr. V, 132 (1872).
1) Біографія Зинина написана Бутлеровымъ и Бородинымъ: Ж Р. Ф.Х. О. 12, 215 (1880); Bed. Ber. 13, 449; 14, 2887 (1881).
1) П. Алексћевъ первый предложилъ цинковую пыль для возстановленія нитросоединеній.
1) Бородинъ, род. 1834 г.. профессоръ химіи МедикоХирургической Академіи (1862 г.),преподавалъ съ 1863 химію въ Птр. Лћсной Академіи, а съ 1872 г. наЖенскихъ Врачебныхъ Курсахъ;ум. 1887 г. Изъ химическихъ трудовъ Бородина наибольшее значеніе имћетъ открытый имъ способъ бромированія жирныхъ кислотъ дћйствіемъ брома на серебряныя соли кислотъ уксусной, масляной и валеріановой, 1861. способъ фторированія дћйствіемъ KHF2 на хлористый бензоилъ. 1862, а равно реакціи уплотненія альдегидовъ (1870/3; см. некрологъ, составленный А. П. Діанинымъ: Ж. 20, 367, 1888). — Александръ Павловичъ Діанинъ(род. 1851 г., состоитъ съ 1887 г. профессороиъ химіи при ВоенноМедицинской Академіи). Особенное значеніе имћютъ его работы надъ окисляющимъ дћйствіемъ хлорнаго желћза на нафтолы (1874) и фенолы (1882), дающіе дифенолы, а равно произведенная имъ конденсація кетоновъ съ фенолами въ двухатомные фенолы (1891).— A. A. Загуменный частью продолжалъ работу своего учителя Зинина надъ бензойнымъ альдегидомъ (производныя дезоксибензоина, 1872 5), частыо изслћдовалъ бензпинаконъ и бензпинаколины (1874, 1880); характернымъ можно считать его способъ возстановленія дезоксибензоина цинкомъ въ спиртовомъ растворћ ћдкаго кали, 1872.
1) Напомнимъ, что употребляемый съ той же цћлью НСl былъ предложенъ Либихомъ (Lieb. Ann. 65, 351. 1848).
1) Названіе „карбинолъ” предложилъ также Кольбе (А. 132, 103, 1864).
1) Хотя А. Зайцевымъ былъ открытъ первый представитель новаго класса лактоновъ, слава объясненія строенія и заслуга дальнћйшаго изученія лактоновъ выпала на долю Р. Фиттига, съ 1880 г. начавшаго свои работы по лактонамъ. Изслћдованіемъ скоростей образованія лактоновъ изъ γ-оксикислотъ занимался впослћдствіи Э. Гьельтъ въ Гельсингфорсћ (1891-3, 1897).
1) Прочувствованную біографію А. Зайцева написалъ С. Реформатскій (при содћйствіи А. Альбицкаго) Ж. 43, 857 (1911).
2) Е. Е. Вагнеръ род. въ 1849 г. въ Казанской г., ученикъ А. Зайцева въ Казанскомъ унив., въ 1875 г. работалъ у А. Бутлерова, съ 1876 г. состоялъ ассистентомъ у Н. Меншуткина въ Птр. универс., перешелъ въ 1882 г. въ Институтъ сельскаго хозяйства и лћсовод. въ Новой Александріи, а въ 1886—1902 занималъ каќедру химіи въ Варшавскомъ университетћ; одновременно, съ 1898 г., состоялъ профессоромъ въ Варшавскомъ Политехническомъ Институтћ; ум. въ 1903 г. Біографическія данныя: Ж. 35, 1255; 36, 31 (1904).
*) Повидимому, уже Кондаковъ получилъ (1889) изъ непредћльнаго хлорида С5Н9Сl нечистый изопренъ С5Н8.
1) α-окись трлмегилена была изслћдована А. Ипатьевымъ въ 1914 г.; дћйствіе ћдкой щелочи и сухой окиси серебра на бромистый триметиленъ изучалъ Б. Фортинскій (1913), получившій при этомъ β-гликоль и т. д.
*) Очень полный критико-историческій очеркъ всћхъ типовъ органическихъ минеральныхъ амидо- и ціаносоединеній далъ А. Крупскій (Монографія, Спб. 1868).
1) Знаменитый сэръ Генри Роско, ученикъ и сотрудникъ Бунзена (фотохимическія изслћдованія обоихъ: 1855-57, 1859, 1862) перечисляетъ въ своемъ жизнеописаніи (1906) всћхъ извћстныхъ учениковъ Бунзена за этотъ періодъ времени и говоритъ о Шишковћ слћдующее: „Schischkoff, the Russian officer, who worked with Bunsen on the product of decomposition of gunpowder, and who always said to me when I was talking English to my English friends, „Take the potato out of your mouth”, he thought, we mumbled so”.
2) Біографическій очеркъ Шишкова составилъ В. Ипатьевъ: Ж. 42. 1335 (1910).
1) Біографію Н. К. Якубовича составилъ Н. А. Чернай, Ж. 44 493 (1912). —
2) Подробная и цћнная біографія Н. А. Меншуткина издана его сыномъ, Борисомъ Николаевйчемъ Меншуткинымъ, подъ заглавіемъ: Жизнь и дћятельность Ник. Алекс. Меншуткина Сиб. 1908. Н. А. Меншуткинъ родился въ 1842 г. въ Петроградћ и умеръ тамъ же въ 1907. Окончивъ въ 1857 г. (15 лћтъ) училище Св. Петра въ Птр., онъ поступилъ на физико-математическій факультетъ Петроградскаго Университета. гдћ изучалъ химію подъ руководствомъ Воскресенскаго, Менделћева и Соколова. По окончаніи курса въ 1362 г., Н. А. отправился заграницу, и въ продолженіе трехъ лћтъ работалъ у Штрекера въ Тюбингенћ, у Вюрца (1864-65) въ Парижћ и Кольбе въ Марбургћ. Вернувшись въ 1865 г. въ Петроградъ, Меншуткинъ началъ свою академическую дћятельность при Университетћ въ 1866 г. въ качествћ доцента, съ 1876 г. — ординарнаго профессора аналитической химіи. Въ 1885 г. онъ взялъ на себя преподаваніе органической химіи и завћдываніе органпческой лабораторіей и съ 1891 г. состоялъ заслуженнымъ профессоромъ. Совмћстно съ Д. Менделћевымъ онъ возбуждалъ ходатайства о постройкћ новой химической лабораторіи при Петроградскомъ Университетћ. но лишь въ 1894 г. при содћйствіи Д. П. Коновалова, ему удалось осуществить эту мечту. Въ 1902 г. Н. А. перешелъ на службу въ новооткрытый Петроградскій Политехническій Институтъ, гдћ онъ читалъ лекціи аналитической и органической химіи, и состоялъ деканомъ металлургическаго отдћленія этого Института. Судьба Р. Физико-Химическаго Общества тћсно связана съ именемъ Н. А. Меншуткина; онъ былъ однимъ изъ основателей этого Общества и состоялъ его секретаремъ до 1891 г. Онъ же былъ душою журнала Общества, редакторомъ котораго онъ состоялъ съ года его возникновенія (1869 г.) до 1900 г. включительно.
1) Н. Чернай далъ біографію И, М. Пономарева, Ж. 44, 485 (1912).
1) Тћ же продукты получилъ Б. Фортинскій при дћйствіи ћдкихъ щелочей на бромистый триметиленъ (1913). —
2) Что переходъ высшихъ непредћльныхъ кислотъ (напр., элаидиновая, эруковая, ундециленовая, рициноловая, льняная, линоленовая) въ предћльныя протекаетъ очень гладко при работћ съ монобромопроизводными и нагрћваніи ихъ съ цинковой пылью и водою. показалъ С. Фокинъ (1912).
3) Тетранитрометанъ С(NO2)4, какъ реактивъ (интенсивное желто-красное окрашиваніе) на органическія соединенія, содержащія этиленовую связь, былъ предложенъ И. И. Остромысленскимъ (1909). Л. Чугаевъ (1911) установилъ, однако, что и соединенія безъ двойной связи, но имћющія триметиленовый циклъ, даютъ такую же реакцію. Далће было показано О. Филипповымъ (1914), что циклобутановыя производныя этой окраски не даютъ.
1) Біографическій очеркъ М. И. Коновалова составленъ В. П. Ижевскимъ (Ж. 39, 1477. 1907).
1) Амины и гидразины полиметиленоваго ряда (1895; см. дальше), a равно бромамины жирнаго и циклическаго ряда подробно изучены (1899) Н. М. Кижнеромъ.
1) Біографическія данныя о Ф. Ф. сообщилъ Е. Hjelt: Berl. Веr. 40 5041-5078 (1908).
1) Напомнимъ, что дћйствіемъ Аl2Сl6 на смћси ароматическихъ углеводородовъ и хлоралкиловъ, т.-е. реакціей Густавсона-Фридель-Крафтса, синтезируются замћщенные ароматическіе углеводороды.
1) Біографію П. А. Лачинова написалъ М. Кучеровъ. Ж. 24, 567—614 (1892).
2) Краткую біографію Вредена далъ Н. Меншуткинъ. Ж. 11, XII (1879).
1) Разложеніемъ пиразолиновыхъ основаній, полученныхъ дћйствіемъ гидразина на алдегиды и кетоны, Н. Кижнеръ воспользовался для синтеза циклическихъ углеводородовъ, напримћръ, производныхъ циклопропана (1912 и слћд.), напримћръ
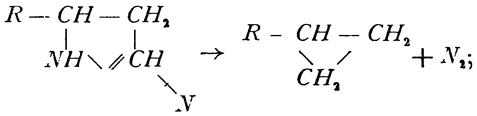
изъ нихъ, присоединеніемъ НВr, можно было придти къ производнымъ пропилена R.СН.СНСН2; далће Н. Кижнеръ приготовилъ (1913) алкилированные циклобутанъ, пентанъ и т. д.
1) Краткую біографію Вышнеградскаго далъ Д. Павловъ. Ж. 13, 370 (1881).
1) Біографическія данныя о К. А. Бишофћ см. И. А. Телетовъ, Ж. Р. Ф.-Х. О. 42, 1501 (1910).
1) Вставимъ сюда, что „тормозящее вліяніе” опредћленныхъ группъ при замћщеніи наблюдалось Э. Гьельтомъ уже въ 1892 г. при изслћдованіи скоростей замыканія лактоннаго кольца и основательно изучено П. Петренко-Критченко (см. его монографію, Одесса, 1896 г., а равно работы о роли циклической связи, 1907).
1) А. Лћпинъ получилъ (1912) два стереоизомерныхъ углеводорода
|
СН.СН |
|
и осуществилъ переходъ жидкой формы въ присутствіи кристаллика іода въ твердую, рацемическую. Имъ же были синтезированы (1915) два стереоизомерныхъ симметрическихъ діэтилдифенилэтана.
2) Реакціи замћщенія галоида амміакомъ и аминами въ этихъ активныхъ янтарныхъ кислотахъ была подробно изслћдована О. Луцомъ (монографія: Стереохимическія изслћдованія дћйствія амміака и его производныхъ на галоидозамћщенныя кислоты. 1908, Рига).
3) Э. Фишеръ оцћниваетъ слћдующимъ образомъ „Вальденовское обращеніе”: „Это открытіе послћ фундаментальныхъ изслћдованій Пастера было самымъ удивительнымъ наблюденіемъ въ области оптически дћятельныхъ веществъ”.
1) Вырубовъ родился въ 1843 г. въ Москвћ, переселился въ 1863 г. во Францію и состоялъ профессоромъ исторіи наукъ въ College de France въ Парижћ. Его научныя работы касаются вопросовъ химической кристаллографіи, изоморфизма, вращательной способности и рћдкихъ земель. Умеръ 30-го ноября 1913 г. въ Парижћ.
1) По стереохиміи и вращательной способности cm.: A. Werner, Lehrbuch der Stereochemie. Jena, 1904; W. Meyerhoffer, Gleichgewicbte der Stereomeren. 1906; Landolt, Das optisclie Drehungsvermogen. 1898; L. Mamlock, Stereochemie. 1907 (переводъ Л. Мамлокъ, Стереохимія. Одесса, „Матезисъ”, 1911).
1) Капитальный трудъ О. Аскана вышелъ подъ заглавіемъ: Ossian Aschan, Structur- und stereochemische Studien in der Camphergruppe. Helsingfors (1895).
1) Влад. Вас. Марковниковъ родился въ Нижегородской губ. въ 1838 г. скончался 30го января 1904 г.; ученикъ A. M. Бутлерова, Кольбе (въ Лейпцигћ), Эрленмейера и Байера, съ 1869 до 1871 г. проф. Казанскаго университета, съ 1872 до 1873 г. проф. Новороссійскаго университета, а съ 18734 г. до своей смерти — проф. Московскаго Университета. Интересныя біографическія данныя сообщилъ И. А. Каблуковъ, Ж. 37, 247—303 (1905).
1) Многочисленныя изслћдованія относительно нефти. свойствъ нафтеновыхъ кислотъ и т. д. принадлежатъ К. Харичкову (съ 1895 г.), предложившему также особую „асфальтовую теорію нефтеобразованія” (1912).
1) Изслћдованіе состава такъ называемыхъ ализариновыхъ маселъ далъ въ 1884 г. П. Лукьяновъ (Ж. Р. Ф.Х. О.).
1) Напримћръ: Анализы колориста. Вып. I и II, Рига, 190910; Руководство къ практическимъ занятіямъ въ красильной лабораторіи; вып. I и II, Рига, 191112, а равно Руководство къ практическимъ занятіямъ въ учебно-красильныхъ лабораторіяхъ (вмћстћ съ П. Будниковымъ); вып. I, II, III, Рига, 1914.
1) По изслћдованіямъ Г. Л. Стадникова (1911) „Объ оксоніевыхъ соединеніяхъ” упомянутая изомерія между Гриньяръ-Бэйеровскими оксоніевыми соединеніями является еще недоказанной. По Стадникову моноэфираты магній-органическихъ соединеній имћютъ формулу
|
O |
|
; |
считая реакцію Гриньяра каталитической, Стадниковъ принимаетъ эфиратъ іодистаго магнія за катализаторъ (1912). Далће Стадниковъ и 3. Кузьмина Аронъ изслћдовали дћйствіе СO2 на эфираты алкилмагнійгалогенидовъ и нашли, при разложеніи продукта воздћйствія слабой сћрной кислотой, вмћсто различныхъ органическихъ кислотъ, углекислый газъ и газообразные углеводороды, что дћйствительно соотвћтствуетъ данной сейчасъ формулћ моно-эфиратовъ.
*) А. М. Васильевъ написалъ статью „О происхожденіи названій химическихъ элементовъ”. Казань, 1912.
1) Въ 1865 г. Н. Бекетовъ замћнилъ натрій магніемъ (а впослћдствіи Грецель получилъ англійскую привиллегію на добываніе Al изъ кріолита посредствомъ магнія). Металлическій алюминій, какъ возстановитель окисловъ металловъ вообще, былъ предложенъ и примћненъ впервые Н. Бекетовымъ въ 1859 и 1865 г., a въ 1898 г. Гольдшмидтъ выработалъ свой техническій алюминотермическій способъ.
1) Посредствомъ кріолита, въ присутствіи легкоплавкихъ средствъ и металлическаго катода, Богусскій (1884) получаетъ алюминіевые сплавы. Другими методами пользуется Д. А. Пеняковъ, давшій способъ превращенія бауксита Na2SO4 въ алюминатъ натрія (1892), а соединеній алюминія въ сћрнистый алюминій (1895). —
2) Упомянемъ здћсь о характерномъ дћйствіи слћдовъ ртути, попавшихъ на поверхность алюминія и вызывающихъ быстрое окисленіе алюминія; на этотъ своеобразный фактъ указалъ сперва Коса (1870), а потомъ А. Соколовъ (1892).
1) По иниціативћ министра финансовъ графа Канкрина въ 1827 г. была предпринята чеканка русской платиновой монеты, прекращенная, однако, въ 1845 г. вслћдствіе вывоза этой монеты заграницу для цћлей техники. Способъ обработки платиновыхъ рудъ и добыванія чистой платины въ Россіи былъ выработанъ самостоятельно П. Соболевскимъ. Бреанъ и Вокленъ въ Парижћ и Волластонъ въ Лондонћ, устроившіе заводы для обработки платины, держали свои способы въ тайнћ. Соболевскій исходилъ изъ чистой соли (NH4)2PtCl8, которую разлагалъ накаливаніемъ въ платиновыхъ тигляхъ; полученный порошокъ подвергался сильному давленію въ стальныхъ прессахъ и накаливанію, съ цћлью превращенія въ ковкую платину.
1) В. фонъ-Шнейдеръ родился въ 1843 г., получилъ степень доктора химіи въ Дерптскомъ университетћ въ 1869 г. за упомянутыя изслћдованія платиновыхъ металловъ, состоялъ ассистентомъ (1870) у Либиха; основалъ Тентелевскій заводъ въ Петроградћ и состоялъ его директоромъ (1875), умеръ въ 1914 г.
1) Ќ. Вильмъ родился въ 1845 г.; въ 1882 г. Дерптскимъ Университетомъ удостоенъ степени магистра химіи за диссертацію: Zur Chemie der Platinmetalle. St.Petersburg, 1882. Состоялъ преподавателемъ Инженерной Академіи въ Петроградћ, умеръ въ 1893 г.
1) Клаусъ, какъ химикъ, принадлежалъ къ нынћ исчезнувшему типу оригиналовъ-самоучекъ, которые отличались широкими познаніями и интересами. Этотъ химикъ, фармацевтъ и ботаникъ зналъ всћ эти науки одинаково основательно, и съ увлеченіемъ занимался какъ химіею, такъ и ботаникою. „To онъ сидћлъ почти безвыходно въ лабораторіи, причемъ имћлъ привычку, при раствореніи платиновыхъ рудъ въ царской водкћ мћшать кислоты прямо всћми пятью пальцами и опредћлялъ крћпость непрореагировавшихъ кислотъ на вкусъ. Потомъ онъ вдругъ бросалъ лабораторію и съ такимъ же увлеченіемъ начиналъ ботанизировать въ окрестностяхъ Казани” (В. Марковниковъ, Ж. 19, 72).
1) Упомянемъ, что лишь въ XX вћкћ этотъ вопросъ былъ снова обработанъ и значительно разъясненъ, благодаря работамъ В. Кистяковскаго (начиная съ 1904 г.) и П. Вальдена (начиная съ 1908 г.); послћдній далъ произведенію М.а2 названіе „молекулярнаго сцћпленія”.
1) Біографическія данныя о Д. И. Менделћевћ:
Краткій біографическій очеркъ написалъ В. Е. Тищенко (Ж. 41, 8—32, 1909).
Подробный некрологъ составилъ П. Вальденъ (Berl. Ber. 41, 4719—4800, 1908).
Mendeleeff Memorial Lecture представилъ Sir W. A. Tilden, Journ. Chem. Soc. 95, 125153 (1909).
Въ болће популярномъ изложеніи:
Д. И. Менделћевъ и значеніе его періодической системы для химіи будущаго, Н. Морозова, 1907.
Семейная хроника, Н. Я. Губкиной. Спб. 1908.
Значеніе его научныхъ трудовъ рельефно очерчено на I Менделћевскомъ съћздћ, состоявшемся въ Петроградћ 20—30 декабря 1907 г. въ докладахъ слћдующихъ ученыхъ:
Н. Н. Бекетовъ: Значеніе періодической системы Д. И. Менделћева, (Ж. 41, 33—35, 1909).
В. Я. Курбатовъ: Общій обзоръ дћятельности Д. И. Менделћева, 36—45. Г. Г. Густавсонъ: Д. И. Менделћевъ и органическая химія, стр. 50—57. П. И. Вальденъ: О трудахъ Д. И. Менделћева по вопросу о растворахъ, 5888.
Б. П. Вейнбергъ: Работы Д. И. по капиллярности и температурћ абсолютнаго кипћнія, 89—106.
Ќ. Я. Капустинъ: О трудахъ Д. И. по вопросамъ объ измћненіи объема газовъ и жидкостей, 107—115.
Н. Е. Жуковскій: О работахъ Д. И. по сопротивленію жидкостей и воздухоплаванію, 116—124.
А. И. Воейковъ: Работы Д. И. по метеорологіи, 134—146.
К. В. Харичковъ: Заслуги Д. И. въ области изученія нефти и нефтяной техники, 147—151.
П. П. Рубцовъ: Очеркъ дћятельности Д. И. въ области изученія взрывчатыхъ веществъ, 152—161.
1) На основаніи правильности измћненія атомныхъ вћсовъ извћстныхъ уже галоидовъ В. Ранцовъ (1893) указываетъ на необходимость существованія элемента галоида съ атомнымъ вћсомъ 3; тотъ же элементъ („антигидрогеній”) предсказалъ Ю. Радикъ, Ж. 33, 197 (1906). Радикъ предсказываетъ также экародій и экапалладій (ат. в. = 148—150) и экасеребро (ат. B.153).
1) См. П. Вальденъ, О законћ сохраненія вћса (массы). Ж. 44, вып. 3. (1912).
1) Названныхъ въ честь нашихъ ученыхъ: Лаксмана (см. выше), Лаврова (одного изъ основателей Птр. Минералогическаго Общества), А. Купфера (извћстнаго физика и минералога), Кокшарова (извћстнаго минералога), князя Багратіона.
1) Любопытно отмћтить, что это величайшее научное открытіе въ химіи конца XIX вћка было сдћлано въ лабораторіи-сараћ съ попорченной стеклянной крышею. Этотъ сарай не обладалъ никакими приспособленіями необходимыми для химическихъ работъ. Здћсь было переработано около 20 килограммовъ остатковъ урановой смоляной руды; посредствомъ электрометрическаго метода и фотографической пластинки удалось установить накопленіе хлористаго радія въ хлористомъ баріи при методической фракціонированной кристаллизаціи послћдняго. Въ 1899 г. г-жа Кюри открыла элементъ полоній, а въ 1910 г. г-жа Кюри и А. Дебіернъ получили металлическій радій. Еще въ 1903 г. Беккерель и супруги Кюри, втроемъ, удостоились преміи Нобеля, а въ 1911 г. г-жа Кюри одна получила ту же высшую научную награду.
1) Органическія перекиси, напримћръ, гидроперекись бензоила, въ ихъ отношеніи къ производнымъ непредћльныхъ соединеній съ одной и двумя двойными связями были подробно изучены Н. Прилежаевымъ, начиная съ 1910. Двойныя соединенія перекиси водорода съ мочевиною, сукцинимидомъ, аспарагиномъ, маннитомъ, пинакономъ и другими впервые получилъ С. Танатаръ (1908). —
2) Карлъ Фридриховичъ Шлиппе родился въ 1799 г. въ Саксоніи, былъ аптекаремъ и ассистентомъ Митчерлиха въ Берлинћ; въ 1824 г. перећхалъ въ Варшаву, а въ 1826 г. въМоскву, гдћ устроилъ собственный химическій заводъ и состсялъ химикомъ при Императорскомъ Агрономическомъ Обществћ; умеръ въ 1867 г. Имя его получило извћстность благодаря открытой имъ „соли Шлиппе” (1821, Schweigg. Journ. XXXII). Онъ первый примћнилъ въ Москвћ скорый сгюсобъ фабрикаціи уксусной кислоты и ввелъ въ технику сибирскій хромовый желћзнякъ.
1) Полезный обзоръ представилъ М. Соболевъ въ монографіи: „Сложныя неорганическія кислоты”. Москва 1896.
1) Эмилій Богдановичъ Шёне родился въ 1838 г. въ Гальберштадтћ; состоялъ съ 1860 г. ассистентомъ въ Берлинскомъ Технологическомъ Институтћ, а съ 1862 г. въ Шарлоттенбургскомъ Высшемъ Техническомъ училишћ. Въ 1863 г. Шёне переселился въ Москву, гдћ участвовалъ въ устройствћ химической лабораторія во вновь основанной (1865) Петровской академіи; впослћдствіи онъ (1875) получилъ званіе профессора и занималъ эту должность до своей смерти (1896), прослуживъ съ 1875 до 1892 г. одновременно съ Г. Густавсономъ. Въ кругахъ практиковъ извћстенъ своимъ приборомъ (1868) для отмучиванія почвъ („пьезометръ”). Біографическія данныя: Ж. 28, 835 (1896) (см. также о перекисяхъ стр. 577).
1) Дальнћйшія изслћдованія Курилова и его учениковъ, В. Зубковской и В. Волжина, касались системъ изъ Z«S04, NH% и Hft, FeCl2, KAFe(CN)K и Hfi (19078). Классификацію продуктовъ присоединенія no .принципу интенсивности” далъ недавно В. Куриловъ (1912). Дополненіемъ являются изслћдованія равновћсія системъ MgClt. Nll% и HtO (Д. Діонисьевъ, 1913), а равно Cu(NO3)2, NHz и Hfi (H. Стасевичъ, 1913).
1) И. М. Сћченовъ, извћстный физіологъ. родился въ 1829 г.. умеръ въ 1905, состоялъ съ 1860 г. профессоромъ въ Петроградской Меднко хирургической академіи, затћмъ въ Новороссійскомъ, въ Петроградскомъ и въ Московскомъ Университетћ.
1) Интересную кривую растворимости іодистаго калія въ метиловомъ спиртћ далъ М. Центнершверъ (1910), установивъ при 192° максимумъ растворимости.—
2) И. Ф. Шредеръ далъ также рядъ монографій по техническимъ вопросамъ, напримћръ: Шотландская доменная плавка и возможность ея осуществленія на заводахъ Домбровскаго Бассейна (Птр. 1902). Донецкіе каменные угли, ихъ составъ и свойства. I и II ч. (Птр. 1909 и слћд.). Соль. въ Восточной Сибири Птр. 1911).
1) Дћйствіе магнія на кристаллизаціонную воду кристаллогидратовъ (солей, основаній и кпслотъ) было изучено Я. Михайленко и П. Мушинскимъ (1912); происходящее при этомъ выдћленіе водорода можно увеличить, прибавляя активаторы, напримћръ, CuCl2, а интенсивность реакціи зависитъ отъ природы соли кристаллогидрата. —
2) Въ дальнћйшемъ развитіи ученія о пересышенномъ растворћ приняли участіе В. Ф. Алексћевъ, И. Ф. Шредеръ (188790), а въ новћйшее время М. Фишеръ, П. ф. Веймарнъ.
1) Процолженіемъ экспериментальнаго изслћдованія растворовъ въ духћ Д. И Менделћева является трудъ Д. Турбаба: „Матеріалы къ изслћдованію водныхъ растворовъ по удћльному вћсу”. Харьковъ 1893.
1) По ученію Веймарна (1911) существуетъ слћдующій рядъ переходовъ, или промежуточныхъ состояній, отъ грубыхъ суспенсій къ разбавленнымъ растворамъ: суспенсіи → мелкія суспенсіи → солы → мельчайшіе солы → пересыщенные растворы → ненасыщенные растворы.—
2) Памяти Вантъ-Гоффа и оцћнкћ его химическихъ трудовъ посвящена книга Л. А. Чугаева; „Новыя идеи въ химіи”. Сборникъ № 1. Стереохимія. Химическая механика. Растворы. (Птр. 1912). Въ этомъ сборникћ даны очерки научной дћягельности ВантъГоффа, написанные В. Яковлевымъ, Л. А. Чугаевымъ, А. А. Байковымъ, В. А. Кистяковскимъ, Ф. Ю. Левинсонъ-Лессингомъ. —
3) Роль осмоза въ растеніяхъ была изучена Баранецкимъ: Изслћдованіе надъ діосмозомъ по отношенію къ растеніямъ. (Птр. 1870).
1) П. Вальденъ. Опытъ изслћдованія осмотическихъ явленій съ осадочными пленками. Магистерская диссертація. Рига 1893. —
2) Къ этому воззрћнію присоединился и Д. Коноваловъ. Журн. 29, 530; 645 (1897). —
3) Тамманъ изучалъ также электропроводвость полупроницаемыхъ перепонокъ (1891), предпринявъ съ ихъ помощью непосредственное измћреніе осмотическаго давленія (1892), и изслћдовалъ дћятельность почекъ съ точки зрћнія осмотическаго давленія (1896).
1) Въ томъ же трудћ Шредера (О зависимости между темпсратурою плавленія и т, д., 1890) встрћчается слћдующее характерное положеніе: „Осмотическое давленіе есть не что иное, какъ парціальное давленіе”.
1) На основаніи этого, въ лабораторіи Рижскаго Политехникума уже въ то время (около 1884 г.) дћлались попытки выработать методъ опредћленія молекулярныхъ вћсовъ.
Какъ новые растворители для эбулліоскопическаго опредћленія молекулярныхъ вћсовъ солей П. Вальденомъ были предложены: жидкій сћрнистый ангидридъ (18991901), ацето- и пропіовитрилъ, нитрометанъ и метилроданидъ (1906). П. Вальденъ и М. Центнершверъ опредћлили также молекулярный вћсъ солей въ пиридинћ (1906). Вальденъ далъ (1909) также способъ вычисленія молекулярныхъ эбулліоскопическихъ константъ для нормальныхъ жидкостей, когда извћстно лишь ихъ удћльное сцћпленіе α2 при точкћ кипћнія Т, а именно посредствомъ комбинаціи уравненія Вантъ-Гоффа
E = |
0.2T2 λ |
съ правиломъ
|
λ α |
= 17.9 |
(П. Вальденъ)
1) По поводу сообіценій Д. Коіювалова о предполагаемомъ химическомъ взаимодћйствіи высказался въ отрицательнсжъ смыслћ Врочинскій (1908. Journ. Chim. Phys. 6, 500).
1) Упругость пара водноспиртовыхъ растворовъ солей изслћдовалъ И. Каблуковъ (1891).
2) На связь между упругостью пара изъ растворовъ и плотностью растворовъ (опредћленіе молекулярнаго вћса по плотности раствора) указали (1898) Я. Михайленко и Н. Шиллерь.
1) Уже въ 1885 г. В. Алексћевъ началъ изслћдованіе растворовъ твердыхъ тћлъ, напримћръ, системы изъ кислотъ салициловой, бензойной и фенола, а равно металловъ (сплавовъ).
2) См. также переводъ Добросердова: Бруни, Твердые растворы и изоморфизмъ. Ж. 42, II. 1 (1910). Объ изоморфизмћ элементовъ см. Г. Тамманъ, Zeitschr. anorg. Ch. 53, 446 (1907), Zeitschr. f Elektrochemie, 1908, 799.
1) См. монографію Н. А. Пущина: „О сплавахъ ртути” (Птр. 1902).
2) См. монографію Н. А. Пущина: „Потенціалъ и природа металлическихъ сплавовъ”. Птр. 1906. Изучивъ множество сплавовъ посредствомъ кривой потенціаловъ, Пущинъ устанавливаетъ существованіе въ сплавахъ химическихъ соединеній по вполнћ опредћленнымъ типамъ, въ зависимости отъ принадлежности металловъ къ опредћленнымъ группамъ періодической системы. Такъ, напримћръ, металлы 6й группы (Те, Se) образуютъ сплавы по типу сћроводорода, металлы 5й группы — по типу фосфористыхъ водородовъ PH3, РН2 и (РН)х, для бронзъ наиболће типична форма SnX3 (X = Сu, Ag).
1) Совмћстно съ И. Хойна и Д. Козыревымъ.
3) Кургіаковъ и Жемчужный, Внутреннее треніе двойныхъ системъ, Ж. 44, 1964 (1912).
Курнаковъ и Жемчужный, Давленіе истеченія и твердость пластическихъ тћлъ, Ж. 45, 1004 (1913).
4) Н. Н. Бенардосъ впервые предложилъ (1887) гальваническій токъ высокаго напряженія для спаиванія и обработки желћза. С. Кернъ работалъ (1887) надъ хромовой сталью. Сплавы сурьмы съ желћзомъ и фосфора-желћза изслћдовалъ Константиновъ (1908-10); Ф. Саменъ далъ діаграмму сплава желћзо-мћдь (1908); для вытћсненія азота изъ стали Чижевскій (1908) предложилъ титанъ.
Укажемъ также на цћнные труды Н. Т. Бћляева, напримћръ, на его монографію: „О булатахъ”, Птр. 1906, а особенно на его экспериментально-критическую монографію: Кристаллизація, структура и свойства стали при медленномъ охлажденіи. Птр. 1909.
1) Г. Тамманъ далъ сводку работъ по строенію сплавовъ: Zeitschr. f. Elektrochemie, 1908, 789; Physikalische Zeitschr*. 10, 519 (1909).
2) K. Лосевъ въ своемъ недавнемъ изслћдованіи (1911) считаетъ въ сплавахъ переходъ отъ эвтектикъ къ соединеніямъ вћроятнымъ, если для состава первыхъ допустить справедливость закона кратныхъ отношеній.
1) Этотъ трудъ появился въ нћмецкомъ переводћ, подъ редакціею извћстнаго П. Грота, въ Ostwald's Klassiker, Xs 75.
2) А. Богоявленскій (1898) далъ продолженіе упомянутыхъ работъ Г. Таммана, изучивъ скорость кристаллизаціи переохлажденныхъ органическихъ веществъ въ зависимости отъ примћсей, температуры и др. Въ обширномъ трудћ А. Д. Богоявленскій (1904) опредћлилъ измћненіе теплоемкости кристаллическихъ веществъ съ температурою, опредћлилъ удћльную теплоту разнородныхъ органическихъ соединеній и ихъ смћсей: совершенно чистыя однородныя тћла имћютъ удћльную теплоту, выражаемую линейной функціей температуры, а теплоемкости смћсей слћдуютъ правилу смћшенія („Объ измћненіи теплоемкости кристаллическихъ веществъ сътемпературою”. Юрьевъ 1904).
1) По вопросу о полиморфныхъ модификаціяхъ бензофенона, хлор-уксусной кислоты, хлористаго іода экспериментальныя данныя представилъ С. Танатаръ (1892-3).
Температуры и теплоты превращенія нћкоторыхъ полиморфныхъ минераловъ были изучены П. Лащенко, напримћръ, витерита, кварца. халцедона, аррагонита. кальцита (1910-1), касситерита, магнитнаго желћзняка, рутила, анатаза и брукита (1912). Недавно (1913) онъ изслћдовалъ полиморфизмъ цинка, установивъ при 340°—350° переломъ теплотъ остыванія; Г. Тимофеевъ наблюдалъ (1912) рћзкое различіе въ структурћ цинка между 320° и 360°.
Сюда же относятся термическія изслћдованія В. Валя о діаграммћ состоянія фосфора (1911), о четвертой модификаціи бензофенона (1901), а также его оптическія изслћдованія кристаллическихъ водорода и кислорода (1913), а равно азота, аргона, хлора, брома, метана и др. (1913).
1) Назовемъ также изслћдованія К. Сушина „О взаимодћйствіи солей” (дисс., Птр. 1868), калориметрическимъ методомъустановившаго обмћнъ между уксуснокислой солью желћза и ВаСl2, а равно СаСl2 въ водномъ растворћ.
1) Біографическія данныя въ очеркћ Ќ. Ќ. Селиванова, Ж. 40, 1149 (1908).
1) He лишено интереса прослћдить, въ какомъ возрастћ вышеупомянутые ученые совершили переворотъ въ ученіи объ измћреніи химическаго сродства: К. М. Гульдбергъ (род. 1836 г.) опубликовалъ свою работу въ 1864 г., т. е. 28 лћтъ отъ роду; В. Оствальдъ (род. 1853 г.) началъ свои изслћдованія въ 1876 г., т. е. 23 лћтъ отъ роду; С. Арреніусъ (род. 1859 г.) закончилъ свою диссертацію въ 1883 г, т. е. 24 лћтъ отъ роду; Г. Г. Вантъ-Гоффъ (род. 1852) издалъ свой трудъ въ 1884 г., т. е. 32 лћтъ отъ роду.
1) См. стрр. 437, 488 (также Бутлеровъ).
1) В. М. Петріевъ (1845—1908) былъ профессоромъ Новороссійскаго Университета; біографія Ж. 41, 119 (1909).
1) Кирхгофъ установилъ также вліяніе силы кислотъ и ихъ концентраціи, а равно температуры.
l) A. B. Сперанскій (1890) доказалъ отсутствіе каталитическаго дћйствія поверхности стекла на инверсію сахара.
2) См. сборникъ „Успћхи химіи”. Одесса, Mathesis, 1912.
3) Н. Шиловъ далъ очень обстоятельное изслћдованіе „сопряженныхъ” (по терминологіи В. Оствальда) реакцій, т. е. реакцій окисленія кислородомъ, при которыхъ наблюдается образованіе такъ называемаго „активнаго” кислорода, касаясь „химической индукціи” (оказавшейся явленіемъ, обусловленнымъ вовлеченіемъ въ реакцію неустойчивыхъ промежуточныхъ продуктовъ), и далъ примћры перехода отъ индукціи къ катализу, а равно примћры самоиндукціи (автокатализа).
1) Ходневъ произвелъ также термохимическія изслћдованія (теплотъ растворенія водныхъ и безводныхъ солей, 1844), далъ анализы минераловъ и т. д.
1) Г. Орловъ недавно издалъ обширный трудъ: „Изслћдованіе въ области кинетики химическихъ реакцій и катализа”. Харьковъ 1913-4, 346 стр. Этотъ выдающійся трудъ содержитъ богатую литературу и критическій обзоръ ученія о катализћ. Орловъ изучилъ новые случаи замедленія и ускоренія въ ходћ реакцій и вывелъ новыя дифференціальныя уравненія для скорости реакцій dx/dt, причемъ онъ отмћчаетъ, что въ очень многихъ каталитическихъ реакціяхъ участвуетъ самъ катализаторъ, претерпћвая химическое воздћйствіе.
1) Карлъ Генриховичъ Шмидтъ родился въ 1822 г. въ Митавћ, учился въ Гиссенской Лабораторіи у Либиха, съ 1850 г. состоялъ профессоромъ фармаціи, а съ 1852 г. профессоромъ химіи въ Дерптскомъ университетћ, гдћ онъ воспиталъ рядъ выдающихся учениковъ, напримћръ, Г. Ф. Бунге, В. Оствальда, Таммана, Я. Натансона, В. Ф. Рихтера, I. Лемберга, А. Лагоріо, Ст. Залћсскаго. Съ 1873 г. состоялъ членомъ-корреспондентомъ Академіи Наукъ. Умеръ въ 1894 г.
1) Собраніе всћхъ трудовъ Ненцкаго вышло подъ названіемъ: М. Nencki, Opera omnia. 2 тома (1904-5).
2) И. П. Павловъ въ 1904 г. удостоился Нобелевской преміи за выдающіяся работы по медицинской наукћ.
| {655} |
УКАЗАТЕЛЬ ИМЕНЪ
къ
Исторіи химіи
А. Ладенбурга.
Авдћевъ 294.
Авогадро, Avogadro 44, 57, 58, 59, 36, 96-98, 103, 124, 178, 179, 1S2, 188, 197, 281, 317.
Адапръ, Adair 291.
Алексћевъ 213.
Алленъ, Allen 341.
Амперъ, Ampere 59, 86, 122, 128.
Ангстремъ, Angstrom 299.
Аншютцъ, Anschiitz 332.
Арингеймъ, Aronheim 264.
Арреніусъ, Arrhenius 318, 319, 320.
Архпмедъ 8.
Арцруни, Arzruni 90.
Ауверсъ, Auwers 328.
Аустенъ, Austen R. 346.
Ачесонъ, Acheson 323.
Байенъ, Вауеn 12.
Банеръ, Baeyer 260, 261, 262, 263, 265, 268, 269, 273, 274, 275, 277, 278, 279, 291, 332, 335, 354.
Бакстеръ, Baxter 294.
Бальбіано, Balbiano 271.
Бальфуръ-Стюартъ, Balfour-Stewart 299.
Бамбергеръ, Bamberger 266.
Банеръ, Banner 300.
Банкрофтъ, Bancroft 316.
Барбье, Barbier 350.
Бауратъ, Baurath 349.
Бейльштейнъ 213, 255, 257, 258.
Бекеръ, Baker 356.
Бекетовъ 172.
Беккерель, Becquerel 301, 321, 337, 341.
Бемонъ, Bemont 338.
Бендеръ, Bender 271.
Бергманнъ, Bergmann 9, 30, 34, 35, 37, 46, 80.
Берендъ, Behrend 335.
Берманнъ, Behrmann 267.
Бернгеймеръ, Bemheimer 312.
Бернтсенъ, Bernthsen 271.
Бертаньини, Bertagnini 275.
Бертело, Berthelot 108, 109, 123, 227, 228—230, 234, 246, 265, 267, 272, 274, 276, 289, 296, 297, 305, 306, 319, 326, 329, 353, 357.
Бертолле, Berthollet 29, 30, 33—42, 45, 49, 50, 70-72, 80, 81, 83, 89, 104, 105, 115, 143, 295.
Бертолле сынъ 72.
Бертье, Berthier 301.
Берцеліусъ, Berzelius 32, 42, 47, 61, 64, 66, 68, 70, 75, 77—99, 101, 102, 105, 106, 107, 110-113, 115, 116, 117, 122, 123, 124, 126, 127, 128, 133, 139, 140, 142, 147, 151, 153, 157—160, 161—166, 170, 174—177, 193, 206, 209—211, 212, 214, 215, 216, 281, 306, 320, 343, 355, 356.
Бессемеръ, Bessemer 323.
Бехгольдъ, Bechhold 358.
Биркеландъ, Birkeland 329.
Бишофъ, Bischoff 275.
Біо, Biot 312.
Блохъ, Bloch 341.
Блэкъ, Black 10.
Боденштейнъ, Bodenstein 315, 357.
Бодлендеръ, Bodlander 290, 344.
Бодрпмонъ, Baudrimont 173.
Бойль, Boyle 6, 8, 25, 54, 317.
Бокль, Buckle 1.
Больцманъ, Boltzmann 286.
Боме, Beaume 34.
Брауперъ, Brauner 294, 326, 327.
Бредтъ, Bredt 335.
Броди, Brodiel85,186,187,343, 353.
Бронштедтъ, Bronstedt 347.
Бруни, Bruni 345.
Бруньятелли, Brugnatelli 63, 64, 65, 66.
Брушъ, Brush 333.
Брюль, Briihl 261, 310, 311, 312.
Буктонъ, Buckton 213, 224, 232.
Булле, Boullay 111, 114, 115, 116, 124, 128.
Буызенъ, Bunsen 118, 287, 294, 307, 308, 322.
Бутлеровъ 213, 225, 240, 248, 250, 334.
Буффъ, Buff 232, 233, 234, 310.
Бэконъ, Bacon 6.
Вагыеръ, Wagner 335.
Валентинъ, Valentinus 114.
Вальденъ 331.
Валькгофъ, Walkhoff 341.
Вальтеръ, Walter 155.
Ваыъ-Беммеленъ, van Bemmelen 360.
Ванъ-деръ - Ваальсъ, van der Waals 314—317.
Ванъ-Дорпъ, van Dorp 268.
Ванклинъ, Wanklyn 213, 220, 287, 288.
Вантъ-Гоффъ, van't Hoff 252, 290, 314, 316, 317, 318, 321, 330, 331, 332, 333, 342, 345. 346.
Варбургъ, Warburg 283.
Ваттъ, Watt 2Q.
Вахендорфъ, Wachendorff 279.
Вёлеръ, Wohler 90, 102, 108, 116, 117, 122, 130, 134, 155, 158, 199, 213, 272, 322.
Вельтцинъ, Weltzien 292.
Вельшъ, Welsh 267.
Вергьент., Yerguien 263.
Вернеръ, Werner 290, 332, 341, 342, 343.
Видеманнъ Г., Wiedemann G. 286, 298, 312.
Видеманнъ Э., Wiedemann E. 298, 320.
Вильгельми, Wilhelmy 296, 357.
Вильгеродтъ, Willgerodt 333, 335.
Вильсонъ, Wilson 341.
Вильфартъ, Wilfahrt 329.
Вильштедтеръ, Willstadter 351, 353.
Вильямсонъ, Williamson 103, 184, 188, 189, 190—201, 207, 209, 211, 214, 218—220, 222, 224, 226—228, 234.
Вильямсъ, Williams 267.
Вилларъ, Villard 339.
Вислицепусъ, Wislicenus 249, 276, 331, 334.
Вокленъ, Vauquelin 41, 54, 105, 192.
Волластонъ, Wollaston 44. 45, 46, 59—61, 95, 99, 162, 174, 298.
Вольта, Volta 63, 64, 66, 320.
Вольфенштейнъ, Wolffenstein 333, 354.
Вортманъ, Vortman 322.
Воскресенскій 262.
Вроблевскій, Wroblewski 261, 303, 304, 324.
Вюрцъ, Wurtz 129, 186, 187, 191, 196, 197, 198, 200, 203, 209, 213, 219, 224, 227, 229—235, 241—244, 247, 248, 253, 254, 273, 274, 275, 277, 282, 289, 292.
Габрћль, Gabriel 268, 351, 355.
Гагенъ, Hagen 311.
Гайдукъ, Hay duck 264.
Галлеръ, Haller 335.
Гальвани, Galvani 63.
Гампсонъ, Hampson 324.
Ганчъ, Hantzsch 267, 275, 332, 333.
Гарденъ, Harden 51.
Гарди, Hardy 359.
Гаркуртъ, Vernon Harcourt 296, 297.
Гаусманнъ, Hausmann 301.
Гаюи, Hatiy 89.
Гебгардтъ, Gebhardt 265.
Геберъ, Geber 6.
Гейманъ, Heumann 335.
Гейтель, Geitel 341.
Гейтеръ, Geuther 249.
Гейтнеръ, Geitner 258.
Гелертъ, Gehlert 68.
Гелльригель, Hellriegel 329.
Гельмгольтцъ, Helmholtz 25, 64, 284, 286, 306, 307, 318, 321.
Гельмонтъ, Helmont 10.
Герихтенъ, Gerichten 269.
Герландъ, Gerland 241.
Геррманнъ, Herrmann 252.
Геру, Heroult 322.
Гершель, Sir J. Herschel 298.
Гиббсъ, Gibbs 286, 314, 315, 321.
Гиггинсъ, Higgins 50.
Гизель, Giesel 339.
Гпллебрандтъ, Hillebrandt 326.
Гпльбертъ, Gilbert 64, 65, 83, 122, 298.
Гимштецтъ, Himstedt 341.
Гиптце, Hintze 313.
Гирнъ, Hirn 265.
Гитторфъ, Hittorff 300, 306, 320.
Гладстонъ, Gladsron 283, 311, 320.
Глазеръ, Glaser 264.
Гланъ, Glan 301.
Гмелинъ, Gmelin 79, 99, 100, 104, 134, 136, 140, 161—163, 171, 174, 175, 214, 220, 293.
Гобрекеръ, Hobrecker 278.
Годенъ, Gaudin 301.
Гоккель, Gockel 307.
Голлъ, Sir J. Hall 301.
Гольдшмидтъ, Goldschmidt 265, 323, 328.
Гольдштейпъ, Goldstein 325.
Горстмаиъ, Horstmann 286, 288, 290, 297, 305, 314.
Горсфордъ, Horsford 231.
Готеро do, Gautherot Sue 321.
Готфейль, Hautefeuille 302, 315, 325.
Готье, Gautier 254.
Готье де Клобри, Gaultier de Claubry 321.
Гофманъ A., Hoffmann A. 172, 173, 190, 191, 198, 218, 224, 230, 232, 250, 254, 262, 263, 267, 269, 273, 276, 292, 332, 351.
Гофмапъ P., Hoffmann R. 242, 267.
Гофмейстеръ, Hoffmeister 354, 359.
Гоффманъ, Hoffmann 340.
Гребе, Grabe 260, 262, 264, 265, 268, 271.
Грейффъ, Greiff 279.
Гриньяръ, Grignard 350.
Гриссъ, Griess 255, 259, 260, 261, 263.
Гриффинъ, Griffin 147, 177, 191.
Гротъ, Groth 313.
Грэмъ, Graham 140, 142—144, 147, 194, 312, 358.
Гугеверфъ, Hoogewerf 268.
Гукеръ, Hooker 266.
Гульдбергъ, Guldberg 295, 296.
Гумбольдтъ, Humboldt 54.
Гэ-Люссакъ, Gay-Lussac 42, 44, 54—58, 69—77, 85, 86, 89, 94, 97— 99, 106, 107, 111, 112, 114, 115, 116, 130, 131, 182, 186, 191, 301, 317.
Гюптоыъ де Морво, Guyton de Mor-veau 8, 30, 83, 116.
Гюнтцъ, Guntz 352.
Дальтонъ, Dalton 41, 44—46, 50—61, 86, 94, 95, 105, 163.
Даніелль, Daniell 306.
Дарсе, d'Arcet 71.
Даубеыи, Daubeney 307.
Дебереиыеръ, Dobereiner 107, 113, 292, 356.
Дебьернъ, Debierne 338.
Девентеръ, Deventer 330.
Девилль, Сен-Клеръ, St-Claire De-ville 187, 281, 284, 285—289, 302, 323, 330.
Дейманнъ, Deimann 64.
Деларивъ, de la Rive 187, 322.
Демокритъ 44.
Демоле, Demole 250.
Дессень, Dessaignes 251.
Джауль, Joule 284.
Джелетъ, Jelett 298.
Джэй, Jay 328.
Диксонъ, Dixon 366.
Дильсь, Diels 353.
Диттлеръ, Dittler 264.
Добби, Dobbie 269.
Докторъ, Doctor 333.
Дріоыъ, Drion 302.
Дросте-Гюльсгофъ, Droste-Hueishoff 333.
Дэви, Sir H. Davy 62, 65—77, 79—80, 94, 111, 122, 128, 140, 147, 149, 150, 306, 320—322, 356.
Дэль, Dale 311.
Дюлонгъ, Dulong 77, 79, 88, 89, 92, 97, 98, 111, 140, 147—149, 151 281.
Дюма, Dumas 17, 21, 22, 79, 94, 95,
98, 103, 108, 114, 115, 116, 118, 119, 123-129, 131—136, 137, 138—141, 147, 149, 151, 152—158, 164, 166, 167, 170, 176, 184, 187, 189, 193, 197, 202, 203, 211, 212, 214, 217, 225, 235, 282, 293, 308.
Дюппа, Duppa 242, 248, 273, 355, 356.
Дюссаръ, Dussart 275.
Жераръ, Gerhardt 103, 104, 133, 139, 150, 156, 159, 161, 163, 166, 167—182, 184, 188—191, 196, 197, 199—207, 209, 211, 214, 216, 219, 220, 225—227, 234, 236, 237, 238, 241, 268, 276, 281.
Житмонди, Zsigmondy 358.
Заксъ, Sachs 307.
Зеебекъ, Seebeck 70.
Землеръ, Semmlor 335.
Зибертъ, Siebert 340.
Зидентопфъ, Siedentopf 358.
Зильберманпъ, Silbermann 186, 304.
Зиминъ 272.
Зининъ 230.
Зиршъ, Siersch 250.
Изамберъ, Isambert 286.
Ингенгусъ, Ingenhusz 307, 308.
Кавендишъ, Cavendish 10, 11, 18, 21, 23, 26, 71, 329.
Кагуръ, Cahours 199, 213, 230, 267, 269, 283, 288.
Каде, Cadet 118.
Кайзеръ, Kayser 300.
Кальбаумъ, Kahlbaum 51.
Каммерлипгъ Оннесъ, Cammerlingh Onnes 325.
Кашшццаро, Cannizzaro 255, 281—283, 287, 318.
Кантъ, Kant 44.
Каньяръ Делатуръ, Cagniard de la Tour 302.
Кари Ли, Carey Lea 359.
Каріусъ, Carius 249, 250, 252, 253.
Карлейль, Carlisle 64.
Kapo, Caro 262, 265, 271, 329, 354.
Каропи, Caroni 302.
Кауфманъ, Kaufmann 338.
Квинке, Quincke 358.
Кекуле, Kekulé 172, 207, 208, 209, 219, 225, 226, 234—240, 242, 244, 245, 253-263, 265, 273, 275, 277, 287, 289, 291, 318, 332, 334.
Кёллихенъ, Kollichen 375.
Кёнигсъ, Konigs 268, 269, 353.
Кёрнеръ, Korner 258, 260, 267.
Киліапи, KiJiani 322.
Кирхгоффъ, Kirchhoff 298, 299.
Кіоцца, Chiozza 199, 201, 277.
Клатцо, Klatzo 294.
Клаузіусъ, Clausius 188, 284, 318.
Клеве, Cleve 292.
Клеманъ, Clement 75.
Клэцъ, Сіоеz J32.
Книтшъ, Knietsch 356.
Кнорръ, Кпогг 271, 275, 334, 335, 351, 353.
Кобенцль, Cobenz J 267.
Когенъ, Cohen 347.
Кольбе 108, 127, 160, 170, 189, 190, 206, 209—216, 219—225, 234, 235, 241—243, 245—248, 253, 255, 263, 273—275, 276.
Кольраушъ, Kohlrausch 306, 320.
Компа, Котрра 335.
Копрадъ, Conrad 275.
Коппе, Coppet 312.
Коппъ, Корр 4—13, 17, 18, 20,21, 23, 25, 26, 33, 34, 35, 89, 104, 129, 202, 237, 287, 309, 310, 318, 353.
Кохъ, Koch 301.
Коши, Cauchy 310.
Краузе, Krause 333.
Крафтъ, Craft 155, 196, 213, 274, 283, 323, 333, 352, 356.
Креде, Crede 359.
Крепье, Сгёріеих 352.
Круксъ, Crookes 300.
Крюгеръ, Kriiger 336.
Крюикшанкъ, Cruikshank 65, 321.
Крюссъ, Kriiss 300.
Куперъ, Couper 238, 239, 252, 290.
Курбатовъ 257. Куртуа, Courtois 75.
Куцель, Kuzel 360.
Кэй, Кау 228.
Кюри Ж., Curie J. 337.
Кюри П., Curie P. 338, 339, 341.
Лааръ, Laar 334.
Лабардъ, Labarde 338.
Лавуазье, Lavoisier 4, 10,12,13, 14— 16, 19—34, 46, 50, 54,65, 66, 72, 74—77, 83, 94, 101, 104,105, 106* 11, 116, 117, 128,304, 305.
Ладенбургъ, Ladenburg 155, 213, 250, 257, 260, 261, 267-269, 271, 273, 276, 278, 294, 306, 316, 320, 324, 325, 327, 331, 333, 349, 351, 352, 356, 359.
Лайблинъ, Laiblin 269.
Лакостъ, Lacoste 291.
Лангеръ, Langer 323.
Ландольтъ, Landolt 14, 310, 311, 312, 319, 333.
Лапласъ, Laplace 21, 24, 26, 304, 305, 310.
Лауренсо, Laurence 231.
Лаутемапнъ, Lautemann 242, 255, 276.
Левковичъ, Lewkowitsch 252.
Лёвигъ, Lovig 213.
Ледюкъ Leduc 21.
Лейкиппъ 44.
Лекокъ де Буабодранъ, Lecoq de Boisbaudran 295, 300.
Лемуанъ, Lemoine 315.
Ленсепъ, Lenssen -93.
Лешателье, Le Chatelier 346.
Либермапъ, Liebermann 262, 264.
Либихъ, Liebig 90, 102—104, 107, 109, 116, 117, 119, 122—128, 130, 133, 134, 138, 140, 144-152, 158, 162, 163, 165—167, 173, 175, 177, 189, 191—193, 198, 199, 209, 210, 212, 213, 214, 220, 225, 276.
Лимприхтъ, Limpricht 207, 270, 273, 274.
Линде, Linde 324.
Линнеманнъ, Linnemann 250.
Локіеръ, Lockyer 326.
Ломоносовъ 19.
Ломмель, Lommel 308.
Лоранъ, Laurent 103, 119, 127, 129, 132—140, 150—152, 156, 157, 161, 164, 166, 167, 170, 173, 174, 178-182, 184, 188—191, 196, 198, 199, 200, 203, 217, 218, 220, 225, 250, 268, 313.
Лоренцъ Г. A., Lorcnti H. A. 311.
Лоренцъ Л., Lorentz L. 311.
Луковъ, Lukow 321.
Лукрецій, Lucretius 44.
Мадреллъ, Madrell 249.
Майеръ P., Mayer R. 284.
Маккензи, Mackenzie 348.
Маьклонгъ, MacClung 338.
Макленпані, MacLennan 341.
Максвеллъ, Maxwell 284, 286, 312.
Малагути, Malaguti 132, 151, 159, 218.
Маргерптъ, Marguerite 329.
Марппьякъ, Marignac 187, 235, 288, 291.
Марквальдъ, Marckwald 333, 333, 348.
Марковнпковъ 248.
Маркъ, Marc 347.
Mapce, Marcet 210.
Маршалъ, Marshal 353.
Маршанъ, Marchand 209.
Маршъ, Marsh 333.
Маттисенъ, Matthiessen 322.
Мейергофферъ, Meyerhoifer 316.
Мейеръ В., Meyer V. 155, 270, 283, 315, 323, 328, 332, 334, 335.
Мейеръ Л. Meyer L. 96, 293, 294, 312, 319.
Мейеръ Э., Meyer E. v. 130.
Меликовъ 354.
Менделћевъ 96, 293—295, 302, 343.
Менье, Meusnier 54.
Миллеръ В., Miller W. 306, 32 .
Мичерлихъ A., Mitscherlich A. 300.
Мичерлпхъ Э., Mitscherlich E. 88—91, 98, 130, 147, 168, 169, 193, 210, 220, 259, 282, 301, 353, 355.
Михаэлисъ, Michaelis 291.
Мондъ, Mond 328.
Муассанъ, Moissan 322, 328, 352.
Муссонъ, Mousson 298.
Нагель, Nagel 341.
Назини, Nasini 312.
Наттереръ, Natterer 303.
Нейбергъ, Neuberg 349.
Нейманнъ, Neumann 89.
Нёльтинтъ, Nolting 264.
Никлесъ, Nikles 321.
Норденшельдъ, Nordenskiold 15.
Ньютонъ, Newton 7.
Одлингъ Odling 209, 213, 219, 227, 228, 229, 230, 234.
Ольшевскій, Olszewski 324, 325.
Осокинъ 250.
Оствальдъ, Ostwald 297, 303, 306, 314, 315, 318, 319, 320, 336, 356, 357.
Остермеперъ, Ostermeyer 264.
Оудемансъ, Ondemans 319.
Пааль, Paal 360.
Пастеръ, Pasteur 251, 330, 348, 349, 355.
Паули, Pauli 359.
Пауль, Paul 330.
Пеанъ де Сеігъ-Жилль, Реап де Saiut-Gilles 296, 297.
Пелузъ, Pelouze 153, 274, 275, 332.
Перкинъ, Perkin 242, 245, 263, 273, 275, 278, 312, 355.
Перкинъ мл., Perkin jr. 335.
Петтенкофферъ, Pettenkoffer 293.
Петермаынъ, Petermann 260.
Петерсепъ, Petersen 262.
Петтерссонъ, Pettersson 294.
Петцъ фопъ Труствикъ, Petz von Trust-vick 64.
Петрачекъ, Petraczek 328.
Пикаръ, Picard 265.
Писаржевскіп 354.
Плаытё, Plante 321.
Плюккеръ, PI ticker 300.
Поггендорффъ, Poggendorff 90, 107.
Понтенъ, Pontin 70.
Попъ, Pope 333, 334, 349, 350.
Прингсгеймъ Н., Pringsheim N. 307, 308.
Прннгсгеймъ Э., Pringsheim E. 356.
Пристлей, Priestley 10, 11, 14, 15, 16, 17, 23, 24, 26, 27.
Пти, Petit 79, 88, 89, 92. 97, 98, 281.
Пфаундлеръ, Pfaundler 286.
Пфаффъ, Pfaff 332.
Пфефферъ, Pfoffer 307, 308, 317.
Пьеръ, Pierre 310.
Рамзай, Ramsay 267, 269, 310, 326.
Ранкинъ, Kankin 284.
Ратке, Rathke 306.
Рашигъ, Raschig 329.
Ревердинъ, Reverdin 264.
Рёзе, Rose 249.
Рейнке, Reinke 397.
Рейнольдсъ, Reynolds 294.
Рейхенбахъ, Reichenbach 255.
Рейхъ, Reich 300.
Рёмеръ, Roemer 328.
Реньо, Regnault 89, 127, 128, 132, 133, 151, 153, 201, 203, 214, 281, 284.
Рётгерфордъ, Rutherford 338—340.
Ридель, Riedel 271.
Риттеръ, Ritter 64, 68, 320, 321.
Ритъ, Rieth 213.
Рихтеръ Ж., Richter J. 41, 44—49, 60, 143.
Рихтеръ Т., Richter Th. 300.
Розенбергъ, Rosenberg 335.
Розенштиль, Rosenstiehl 263.
Розенъ, Roosen 335.
Роландъ, Rohland 360.
Роско, Roscoe 43, 51, 291, 307, 308, 309, 353.
Poсси, Rossi 275.
Рохледеръ, Rochleder 252, 269.
Рочи, Rotschy 352.
Рузебумъ, Roozeboom 315, 316, 333, 346.
Рунге, Runge 300.
Руффъ, Ruff 360.
Рюгтеймеръ, Rtigheimer 275.
Рюдорфъ, Riidorff 312.
Сабатье, Sabatier 351.
Сандеранъ, Senderens 351.
Сегенъ, Seguin 54.
Сенармонъ, Senarmont 301.
Сенебье, Senebier 307.
Сильва, Silva 273.
Симонъ, Simon 65.
Скраупъ, Skraup 267, 268, 353.
Слатеръ, Slater 339.
Смитъ A., Smith A. 45, 47, 50.
Смитъ Э., Smith E. 322.
Соколовъ 231.
Соссюръ, Saussure 105.
Спенсеръ, Spencer 322.
Стадіонъ, Stadion 353.
Сурдеваль, Sourdeval 329.
Тальботъ, Talbot 298.
Танъ, Than 288.
Тилорье, Thilorier 303.
Тиманъ, Thiemann 273, 335, 336.
Толленсъ, Tollens 250, 254, 274.
Томсенъ, Thomsen 261, 297, 305, 306, 312, 319.
Томсонъ В., Thomson W. 284.
Томсонъ Дж., Thomson J. 338, 340, 341.
Томсонъ Т., Thomson Th. 45, 50, 59, 85, 95.
Траубе, Traube 317.
Траубе М., Traube M. 335.
Тростъ, Troost 187, 281, 289, 325.
Тэнаръ, Thenard 69—74, 106, 111, 112, 118.
Тэнаръ П., Thenard P. 198.
Тэтъ, Tait 187.
Ульрихъ, Ulrich 242.
Унфердорбенъ, Unverdorben 217.
Усларъ, Uslar 207.
Фарадэй, Faraday 99, 110, 131, 186, 264, 303, 306, 320, 359.
Фейль, Feil 301.
Фелингъ, Fehling 274.
Ферлинъ, Ffhrlin 333.
Фестингъ, Festing 300.
Филлигеръ, Yilliger 354.
Филипъ, Philip 266.
Фирордтъ, Vierordt 300.
Фиттигъ, Fittig 253, 254, 258, 260, 264, 265, 274, 275, 278.
Фишеръ В., Fischer W. 360.
Фишеръ Г., Fischer E. G. 49, 321.
Фишеръ О., Fischer O. 263.
Фишеръ Э., Fischer E. 263, 268, 271, 328, 331, 333, 334, 348, 364, 355.
Фольгардъ, Volhard 273.
Форъ, Faure 321.
Франкландъ, Frankland 189, 190, 191, 198, 206, 211, 212, 213, 216—220, 227, 234, 246, 247, 248, 274, 290, 356.
Франкъ, Frank 329.
Франшимонъ, Franchimont 266,
Фраунгоферъ, Fraunhofer 298, 299.
Фреми, Fremy 301.
Френкель, Frankel 367.
Фридель, Friedel 155, 196, 213, 246, 247, 250, 273, 274, 316, 336, 356.
Фритче, Fritzsche 271.
Фуко, Foucault 299.
Фуксъ, Fuchs 89.
Фуркруа, Fourcroy 30, 64, 83, 192.
Цербанъ, Zerban 340.
Циммерманнъ, Zimmermann 294.
Чапскій, Czapski 307.
Чаттавай, Chattaway 265.
Челинцевъ 360.
Чермакъ, Tschermak 292.
Чіамичіанъ, Сіашісіап 300.
Шансель, Chancel 173, 196, 197, 246.
Шаппюи, Chappuis 325.
Швейцеръ, Schweizer 213.
Шееле, Scheele 9, 10, 12, 14, 17—19, 22, 23, 72, 74, 104, 108, 307.
Шёйенъ, Schoyen 249.
Шенкъ, Schenck 347.
Шереръ, Scherer 192.
Шиль, Schiel 202.
Шиффъ Г., Schiff H. 292.
Шлунъ, Schlun 255.
Шмидтъ, Schmidt 350.
Шмиттъ, Schmitt 263.
Шнейдеръ, Schneider 359.
Шорлеммеръ, Schorlemmer 249.
Шоттенъ, Schotten 269,
Шрёдоръ, Schroder 261.
Штальбергъ, Staliberg 332.
Штедлеръ Stadler 247.
Штокх, Stock 346.
Штреккеръ, Strecker 171, 231, 241 272, 328, 355.
Штромейеръ, Stromeyer 142.
Шютценбергеръ, Schützenberger 323.
Эбельменъ, Fbelmen 301.
Эбней, Abney 300.
Эдеръ, Eder 307.
Эйде, Eyde 329.
Экснеръ, Exner 312.
Эльзессеръ, Elsasser 310.
Эльстеръ, Elster 341.
Эммерлингъ, Emmerling 270.
Эмпедоклъ 5.
Энгельгардтъ, Engelhardt 116, 242.
Энтельманнъ, Engelmann 307, 308.
Эрдманнъ, Erdmann 264.
Эрленмейеръ, Erlenmeyer 240, 247, 248, 250, 263, 273.
Эрленмейеръ млад., Erlenmeyer jr. 349.
Эрманнъ, Ermann S3.
Эссонъ, Esson 297.
Этаръ, Etard 267.
Юнгъ, Young 317.
Юптнеръ, Jüptner 346.
Якобсенъ, Jacobsen 332.
Якоби, Jacobi 322.
Янни, Janny 328.
| {664} |
УКАЗАТЕЛЬ ПРЕДМЕТОВЪ
къ
Исторіи химіи
А. Ладенбурга.
Авогадро, его гипотеза 57, 58, 96, 103, 124, 179,182, 188, 197, 281, 317.
Аггрегатныя состоянія 316.
Азо-краски 263.
Азо-соедикенія 259.
Азотная кислота 10, 11, 23, 181, 221, 227, 229.
Азотъ, ассимиляція 329.
— асимметрическій 332, 333, 349.
— въ жидкомъ состояніи 324.
— открытіе его 17.
— эквивалентъ его 138.
Air inflammable 11.
Аккумуляторы 320.
Акрпдинъ 271.
Акролеинъ-амміакъ 277.
Активная масса 296.
Актиній 338.
Аланинъ 242.
Алкалоиды, отношеніе ихъ къ пиридину 268, 269.
Алкоголь, мнћніе Берцеліуса 123.
— — Гэ-Люссака 114.
— — Дюма 131.
— — Либиха 124 и сл.
— радикалы 190.
— формулы 191.
Алкогольный водородъ 245.
Алкогольныя осыованія 276.
Аллантоинъ, синтезъ 273.
Аллоксантинъ. синтезъ 273.
Алмазъ искусствешіый 322.
Алюминій, электролитическое добываніе его 322.
Альдегиденъ 127.
Альдегиды 277.
Альдоль 277.
Амидъ 128.
— калія 71.
— теорія 128.
— двухосновныхъ кислотъ 199, 200.
— эфиръ 194.
Амино-кислоты 172, 201, 207, 351, 354 и слћд.
Амміакъ, открытіе 10.
Амміачиая сода 335.
Амміачно-кобальтовыя соединенія 343.
— — платиновыя соединенія 343.
— амальгама его 70.
— карбамино-кислый, плотностъ его 283.
— перекись его 354.
— соляная кислота, диссоціація 288.
Аммоцій, сульфгидратъ его 286.
Амфидвыя соли 78.
Авализъ органическихъ тћлъ 27. 105 и сл.
— органическихъ тћлъ, содержащихъ азотъ, 107.
Ангидрвдъ хлорноватистой кислоты 181.
— двухосновныхъ кислотъ 199, 201.
— смћшанные 192.
Анилидныя кислоты 172.
Анилиновыя краски 262.
Анисовая кислота 215.
Антипиринъ 335.
Антраннловая кислота 336.
Антрахинонъ 264.
Антраценъ 264.
Аргонъ 326.
Ароматическія соединенія 256 и сл.
— — изомеры 258.
— — окислепіе ихъ 258.
— — теорія 256 и сл.
— — углеводороды, синтезъ 254.
Асимметричный азотъ 332 и сл.
— углеродъ, теорія 252 и сл.
Аспарагпновая кислота 252.
Ассимиляція растеній 30S.
Астраханитъ 330.
Астрохимія 299.
Атомистическая теорія 44 и сл., 50 и сл., 98 и сл., 162 и сл., 189, 281.
Атомность (валентность) 220 и сл., 234 и сл., 238, 242, 289.
— и основность, различіе между ними 243, 244.
Атомные вћса 50 и сл., 85 и сл., 90, 96 и сл., 99, 162, 174 и сл., 226, 281.
— — предположеніе Канниццаро 282.
Атомъ 44, 46, 50 и сл., 54-69, 84 и сл., 90—99, 130, 137, 138, 174, и сл., 211, 217, 280.
Атомы, опредћленіе числа ихъ въ соединеніяхъ 53, 56—59, 85 и сл.,
— перемћщеніе ихъ 250.
Атропинъ, спитезъ 352.
Ацетамидъ 214.
— теорія 128 и сл.
Ацетонитрилъ 235.
Ацетоуксусный эфиръ, синтезъ помощью его 249 и сл., 275.
Баритовая земля 9.
Бензаыидъ 117.
Бензиловый сппртъ 258.
Бензилфенилаллил метилъ-аммоній-іодидъ 349.
Бензилъ хлористын 258.
Бензоилуксусный эфиръ 275.
— — соединеніе его 116.
Бензойная кислота 116, 132, 137, 158, 241, 255.
Бензол-ортодикарболовая кислота 268.
— призматическая формула 261.
— формула Кекуле 256.
Берпллій, атомный вћсъ 294.
Броженіе 329.
Бруцинъ 348.
Валеытность 217, 225, 235, 236, 238, 239, 252, 272, 290, 291, 306.
— главная и дополнительная 341, 342.
— постоянная и измћненная 290, 291.
Валеріановая кислота, активная 348.
Ванилинъ, синтезъ 273.
Взаимное соединеніе углеродныхъ атомовъ (Кекуле, Копаъ) 236, 237, 256.
Винная кислота 144, 146, 148, 177, 251.
— — нодћятельпая 251.
— — правая и лћвая 251.
— — пзомеріи ея, изслћдованія Пастера 251.
— — синтезъ 273.
Внутреннее окисленіе 279.
— въ соединеніяхъ 83.
— превращеніе ея въ землю 21, 22.
— сомнительное присутствіе ея въ соединеніяхъ 148 и сл., 167, 168.
— составъ 26.
Водородистая мћдь 186.
Водородистый лантанъ 352.
— церій 352.
— тождество съ флогистоноыъ 11.
Воздухъ, лишенный флогистона, 17.
Вращеніе магнитное 320.
— плоскостн поляризаціп 251, 312.
Выдћленіе теплоты 304.
Вћсъ смћшенія 99.
Газы, превращеніе ихъ въ жидкое состояніе 303.
— транспирація ихъ 312.
Галловая кислота, открытіе 10.
Галоидная соль 78.
Гальванопластііка 322.
Германій 295.
Гетерологичные ряды 202.
Гидратъ желћза 360.
— хлорсћрной кислоты 200.
Гидроароматическія соединенія 332, 335.
Гидрогели 358.
Гидрозоль 358.
Гпдроперекись этила 354.
Гидрофталевая кислота 332.
Гидрюръ 352.
Гипотеза Авогадро 57, 58, 96, 97, 124, 178, 179, 182, 188, 197, 281.
Гирголь 359.
Гликолевая кислота 231, 243 и сл.
Гликоль 231 и сл., 239, 241—243.
— синтезъ 273.
Глицериновая кислота 244.
Глицеринъ, изслћдованіе Бертело 228.
— открытіе его 108.
— синтезъ 273.
Гліоксалинъ 271.
Глюкоза 252.
Гомологичныя соединенія 202.
Горчичное масло, синтезъ 272.
Горько миндальное масло 102, 116, 132, 137.
— ртуть 235.
Гремучій газъ 356.
Группа углеводовъ 328, 331, 334.
Гуанидинъ, синтезъ 273.
Губчатая платина 357.
Дафнетинъ 278.
— — по Берцеліусу 84.
Двуокись углерода, распаденіе ея на кислородъ и окись углерода 285, 315.
Двухосновныя кислоты 146, 147, 171, 172, 181, 196, 199, 200,215, 224.
— молочнокислыя соли 242.
Десмотропія 334.
Дибромбензолъ 260.
Дибромпиридинъ 269.
Дикетопиперазинъ 355.
Диметиламинъ 276.
Диметилбензолъ 259.
Диметилкарбинолъ 246.
Диметилъ 249.
— синтезъ 274.
Динамомашина 322.
Диссоціація 284.
— аналогія явленіямъ испаренія 330.
— степень ея 319.
Дпсульфобензоловая кислота 224.
Дисульфометоловая кислота 224.
Дисульфэтоловая кислота 232.
Дифениленметанъ 265.
Дифенилъ, синтезъ 276.
Дихлорформилъ - сћриоватая кислота 210.
Діазо-соединенія 259.
Діализъ 360.
Діаминокислота 354.
Діаминъ 279.
Дкксиантрахиноиъ 262.
Діэтилъ (бутанъ), синтезъ 274.
Дуалпзмъ 79 и сл., 102, 112, 158 и сл.
Дћлимость молекулъ элементовъ 184, 185.
Емкость пасыщенія (Франкландъ) 216, 227.
Жадность 297.
Закиси 83.
Закись азота 10.
— желћза 227.
— избирательнаго поглощенія 299
— Кирхгофа 299.
— кратныхъ отношеній 45.
— нейтральности 48.
— опредћленныхъ пропорцій 40, 41.
— Законъ Оудеманса и Ландольта 319.
— постоянства матеріи 2С.
— соединенія газовъ 54.
— сохрапенія силы 65.
— термонейтральности 319.
— химпческаго дћйствія массъ 295, 296.
— четныхъ атомныхъ чиселъ 179, 189.
Законы Фарадэя 306.
Замћщаемость 130, 131, 140, 151, 153, 154, 169, 189, 211, 250.
Замћщеніе 134.
Замћщенный амміакъ 197, 198, 200.
Зимаза 329.
— возстановленіе водородомъ 11.
Изоконіинъ 349.
Изологичные ряды 202.
Изомасляная кислота 247.
Изомеріи въ бензоловыхъ соединеніяхъ 257 и сл.
— въ пирпдиновыхъ соединеніяхъ 267.
— доказательство Кёрнсра 260.
— прежнія изслћдованія 110 и сл., 246 и сл., 271.
— физическія свойства 252.
— амиловаго алкоголя 247, 248.
— валерьяновой кислоты 247.
— окиси трифенилфосфина 291. пропиловаго сппрта 247,248.
Изоморфизмъ 88 и сл., 98, 130.
Изоиитрилъ 254.
Изофталевая кислота 260.
Изэтіоновая кислота 122, 209, 243.
Имидъ 181.
Инверсія тростпиковаго сахара 297.
— пскусствеішын 336.
Индій, атомный вћсъ 294.
— открытіе 300.
Jahresberichte Берцеліуса 95.
Іодистый водородъ, образоваиіе его изъ составныхъ частей 315.
Іодозосоединеніе 335.
Іодосседішеніе 335.
Іодъ, атомный вћсъ 294.
— открытіе 75.
— плотность паровъ 283
Іононъ 336.
Кадмій, плотность пара 282.
Какодиловая кислота 118.
Какодилъ 117, 118, 207, 213, 219.
— окись его 118.
Калій водородистый 352.
— іодистый, формула 323.
— марганцевокислый, возстановленіе его щавелевой кислотой 297.
Калійфталимидъ 351.
Камфора, синтезъ 335.
— строеніе 335.
Карбазолъ 271.
Карбидъ кальція 322.
Карбилаыинъ 254.
Карбонилъ никкеля, открытіе 228, 353.
Карборундъ 322.
Катализъ 356.
Каталитпческая реакція 193.
Кпслородъ, открытіе 10, 15, 23, 24.
— предполагаемое прпсутствіе
его въ соляной кислотћ 72, 77.
Кислота Каро 354.
Кислоты, мнћніе о нихъ Дэви и Дюлонга 76, 77, 147.
— — Лавуазье 23, 29, 32, 72, 101.
— допущеніе Кольбе о существованіи двухосновныхъ кислотъ 223.
— трехосновныя 228.
Классификація элементовъ 291.
Клевеитъ 326.
Колларголь 359.
Коричный альдегидъ, синтезъ 277.
Кофеинъ 271.
Коэффиціентъ сродства 320.
Кратыыя отноіпепія, законъ 45, 51, 85, 99, 105, 163.
Креатииъ, синтезъ 273.
Крезолы 258.
Кремневая кислота 292.
Кремній-этилъ 213.
— какъ замћститель въ углеродћ 155.
Криптонъ 327.
Кристаллопды 358.
Критпческая температура 302, 303, 333.
Критическое давленіе 302.
Кротоновая кислота, синтезъ 273.
Кротоновый альдегидъ 277.
Ксенонъ 327.
Ксилолъ 255.
Лактометанъ 242.
Лактоновая кислота 278.
Лактоны 278.
Лейщшовая кислота 246.
Ленцинъ, синтезъ 273.
Лизпдинъ 271.
— — синтезъ 273.
Литій, соединеіііе его съ водородомъ 352.
Маленовая кислота 332.
Малоновая кислота, ангидридъ ея
353. Малоновый эфиръ 275. Марганецъ 158.
— открытіе 9.
Марганцовпстая кислота 158.
Мартензитъ 346.
Масляная кислота 247.
— — эфиръ ея 248.
Масло голландскихъ химиковъ 127, 139.
Матерія, неразрушимость ея 16, 20.
Мезителепъ 260.
—синтезъ 277.
Мезовинная кислота 331.
Мезосоединенія 331.
Ментолъ 348.
Меркаптанъ, открытіе 125.
Метаболы 340.
Металепсія 132.
Металло-амміачныя и металло-аммонійныя соединенія 292.
Металло-органическія соедіненія 213, 217.
Металлы, многоатомность ихъ 227.
Метамерныя тћла 110.
Метаргонъ — то же, что окпсь углерода 327.
Метафосфорпая кислота 142 u слћд., 228.
Метиламинъ 246.
— -альдегидъ 222.
— -карбинолъ 246
— -пиридинъ 267.
— -пропил-фенантренъ 266.
— -сћрная кислота 224.
— -толуолъ 255.
— -этилмалоновая кислота 348.
Методъ Бессемера 323.
Миндальная кислота 252, 276, 348.
Минералы, синтезъ 301.
Многоосновность 227 и слћд.
Многоосновныя кислоты 140, 141, 146 и сл., 171, 177, 181, 189, 228, 275.
— — теорія 140 и сл.
Мовеинъ 263.
Молекула 57, 58, 182, 216, 225, 227, 281, 289, 290.
— физическая 188.
Молекулярная рефракція 311,
Молекулярпое преломлепіе 311, 312.
Молекуляриые вћса 174, 177 и сл., 182 и сл., 195, 196, 281.
Молекулярный магнитизмъ 312.
Молекуляриыя соединенія 289, 290, 341—345.
Молочная кислота 10, 231, 241, 242.
— — строепіе ея 241 и сл.
Молочнокислый эфиръ 242.
Мононадфталевая кислота 354.
Монохлоруксусная кислота 214.
Морфинъ 353.
Морфотропія 313.
Мочевая кислота, группа ея 334.
— — открытіе 10.
— — синтезъ 273.
Муравьиная кислота 112, 221, 222, 272.
— — трехосновной муравьинокислый эфиръ (Кэй) 228.
Мышьякъ, плотность его 282.
Надбензойііая кислота 354.
Надкислоты 354.
Надмарганцевая кислота 353.
Надсћрная кислота 353.
Надхлорпая кислота 353.
Напряженіе растворовъ 321.
— изомерія 263.
— оклсленіе его 356
Нафтиленфенантренъ 264.
α-Нафтолъ 264.
Недокись углерода 353.
Независимыя составныя части 315.
Нейтральныя соли 150.
Ненасыщенныя кислоты 253.
Неонъ 327.
Непрерывность жидкаго и газообразнаго состояній 303.
Никкель 356.
Никотинъ, синтезъ 352.
Нитробензолъ 168.
Номенклатура Берцеліуса 82, 83.
— новая органической химіи 336.
Нормальныя валентности и контрвалентностп 343, 344.
Объемный законъ газовъ 54 и сл., 85 и сл., 99, 182.
Озонъ въ жидкомъ состояніц 325.
— открытіе 187.
— плотность 325.
Окисленіе ароматическихъ углеводородовъ 258.
— замћщенныхъ пиридиновъ 267.
Окись висмута 227.
— — азотнокислая соль ея 227.
— желћза 227.
— углерода 200, 253, 254, 297.
— — диссоціація 285.
— — открытіе 10.
Оксанилидъ 172.
Оксиаминокислоты 355.
Оксипбензойная кислота 241.
Оксиизомасляная кислота 248.
Оксикумаранъ 278.
Оксиндолъ, синтезъ 279.
Оксипропіоновая кислота 241.
Олово, аллотропія 347.
Опредћленіе мћста въ ароматическомъ ряду 260 и сл.
Органическія кислоты, изслћдованіе Либиха 144.
— — , извћстныя Шееле 10.
— — , классификація Жepapa 202 и сл.
— — , какъ производныя неорганическихъ тћлъ 220.
— — строеніе ихъ 10, 113, 271.
Орто- пиридиндикарбоновая кислота 268.
Ортотолуидинъ 263.
Ортоуплотненіе 279.
Ортринъ 117.
Осмосъ 360.
Осмотическое давленіе 317.
Основность и атомность, законъ ихъ 170, 171.
— — разграннченіе понятія о нихъ 243.
Параоксибензойная кислота 260.
Парціальныя валеитности 345.
«Пары» 159 и сл., 206, 213, 216.
Пережиганіе въ известь 5.
Перекиси 83.
— альдегида 354.
— ацетопа 354.
— — , ея дћйствіе на іодистоводородную кислоту 297.
— діэтила 354.
— марганца 158.
Періодическій законъ 96, 293, 294, 327.
Пиколинъ, синтезъ 277.
Пикриновая кислота 207.
Пиперазинъ 271.
— синтезъ 273.
Пиперональ 336.
Пирамидонъ 335.
Пиренъ 266.
— синтезъ 267.
— -дикарооновая кислота 268.
— -карбоновая кислота 269.
— -трикарбоновая кислота 269.
Пиридиновыя соединенія, изомерія 267.
Пирофосфорная кислота 143, 228.
Пирролъ 270.
Пиценъ 265.
Плотность паровъ 97, 282, 284, 287.
— — и газовъ 323.
Поглощательная способность спектра 299.
Показатель преломленія 310.
Полевой шпатъ, искусственный 302.
— — изслћдованіе Чермака 292.
Полимерія 110.
Полиэтиленовые спирты 231.
Полоній 338.
Полупроницаемыя перепонки 317.
Полухлористая мћдь, формула 323.
Поляризація электрическая 321.
Полярное отношеніе, мнћніе Броди 185.
Пониженіе точки замерзанія 318.
Преломленіе атомовъ 311.
Принципъ Гесса 304.
— максимальной работы 304.
Присоединенія: различные роды, различаемые Жераромъ, 169.
Проинъ 117
Пропилгликоль 241.
Проииленъ 253.
— — синтезъ 220.
Пропорціи, опредћленныя или неопредћленныя, 32, 33.
Процессъ горћнія, воззрћнія на него 5, 6, 23, 24, 27 и сл.
Пурипъ 271.
Пурпуринъ 265.
Равновћсіе полное 315,
Радикалъ 29, 31, 114, 115, 121, 122, 157, 159, 203, 213.
Радикалы, изолированіе ихъ 212.
— многоосновные 200, 206, 225, 226, 229, 230.
— опредћленіе Либиха 119.
Радикалы, содержащіе металлы, 213, 219, 220, 227.
— сложные 102.
— сочетанпые 210 и сл., 213 и сл.
— теорія 101, 114 и сл., 121 и сл., 157, 158, 164,166, 211, 212.
Радіотеллуръ 338.
Растворы твердые 345.
Рацемическія соединенія, частичныя 333.
Рацемичныя соединенія 330, 348.
Рвотный камень 148.
Реакція Гриньяра 350.
— Кольбе 276.
— Перкина 275.
Ретенъ 266.
Ртуть, плотность 282.
Рубидій, открытіе 300.
Рубины искусственные 301.
Салициловая кислота 215.
Свћдћнія послћдователей теоріи флогистона 9.
Свћтъ, химическое дћйствіе его 307, 308.
Синильная кислота 10, 72, 115, 137, 239, 275.
Синтезы ароматическихъ углеводородовъ 274, 275.
— органическихъ тћлъ 108, 109, 272, 273.
— путемъ процессовъ конденсаціи 276 277.
— углеводородовъ 274.
Скорость реакцій 296. 297, 355, 356.
Смоляная руда 338.
Смћшанные типы 207.
Соединительный вћсъ 162.
Соли 145.
— воззрћнія на ихъ прпроду 111, 150, 161.
Солянокислый метиловый эфпръ, разложеніе его 315.
Спектральный анализъ 298, 299.
— — количественный 300.
Спектръ излученія элементовъ 299.
Спирты 221 и слћд.
— превращеніе ихъ въ кислоты (мнћніе Кольбе) 221 и сл.
— многоатомные 230 и сл.
— новый классъ ихъ, предсказанный Кольбе, 222, 223, 247, 248.
Spiritus nitroaereus 19.
— взгляды Бертолле 33 и сл.
— избирательное 238.
— изслћдованія Гульдберга и Вааге 295 и сл.
— степени его 238.
— таблицы его 33 и сл.
Statique chimique Бертолле 33.
Status nascendi 182.
Стереохимія 251, 252, 330, 348.
Стибетинъ 218.
Стильбазолинъ 349.
Стильбазолъ 349.
Строеніе соединеній 239 и сл., 243 и сл., 248.
Субстантивныя азокраски 335.
Сульфанилидовая кислота 172.
Сульфобензойная кислота 169, 170, 208, 224.
Сульфокамфорная кислота 155.
Сульфоуксуспая кислота 215, 224.
Сћра, аллотропія 330.
— плотность ея паровъ 98, 187, 282.
Сћрпая кислота 112, 210, 220, 224, 228, 231, 236, 356.
— — ангидридъ ея 23, 231, 357.
Сћрная кислота дымящаяся 208.
— — какъ двухосновная кислота, 170, 172—174, 200.
Сћрнистая кислота, открытіе 10.
— — дііссоціація 285.
Сћрнистокислый хлоридъ углерода (Кольбе) 210.
Сћрнистый барій 204.
Сћрновинная (этилсћрная) кислота 169, 193.
Сћрнокислая соль закисп желћза 180.
Тавтомерія 334.
Таллій, открытіе 300.
Тауринъ, синтезъ 273.
Теллуръ, атомный вћсъ 294, 326.
— этилъ 213.
Температуры превращенія 316, 330.
Теорія Вольтова столба 321.
— вћроятностей Максвслла 286.
— корреспондирующпхъсостояній 316, 317.
— распада 34G.
— ядеръ Лорана 134 и сл., 156,. 162, 167.
Теплота, взгляды Лавуазье 25, 304.
— нейтрализаціп 319.
Терефталевая кислота 259, 260.
Terme de comparaison 178, 196.
Термическій эффектъ 306.
Термоіндустрія 323.
Термонейтральность 319.
— изслћдованія Бертело 305,. 306.
— изслћдоранія Томсена 297, 305.
Типы механическіћ 154.
— молекулярные 153.
— смћшанные 207.
— теорія Жерара 199, 202 и сл. 207.
Тирозинъ, синтћзъ 273.
Тіоуксусная кислота 226.
Тіофенъ 270.
Толуиловая кислота 269.
Точка абсолютнаго кипћнія 302.
Точки кипћнія 309.
— —, повышеніе ихъ 313.
Трансппрація газовъ и паровъ 312.
Триметиламинъ 246.
Триметилбензолъ 260.
Триметилкарбинолъ 246.
Трихлорметилсульфоновая кислота 210.
Трихлоруксусная кислота 129, 211, 212, 214.
Увеличеніе вћса при горћніи 6, 20, 22, 23.
Углекислый кальцій 316.
— — диссоціація его 286.
— — кристаллическій, синтезъ 301.
Углеродъ асимметрическій 252.
— присутствіе его въ всћхъ органическихъ тћлахъ 104.
— четырехатомность его 236 и сл., 256.
— — диссоціація ея 285.
— — сжиженіе 303.
— — изомеры ея 302.
— — эфиръ 197.
Удћльный объемъ жидкостей 237, 310.
Уксусная кислота 112, 132, 153, 159, 195, 214 и сл., 221 и сл., 239.
— — формула 177.
Уксусный эфиръ 165.
Ультрамикроскопъ 358.
Умбелиферонъ 278.
Унитарная система 166.
Уплотненіе внутреннее 268.
— химическоћ 276 и сл.
Уранъ, атомыый вћсъ 294.
— радіоактивность его 338.
— правило ихъ 315.
— теорія ихъ 315.
Фенилгидраминъ 328.
Фенилендіалинъ 260.
Фенилъ 214.
Феноло-альдегидъ, синтезъ 276.
Феноловая кислота 276.
— краска 263.
Ferricum 180.
Ферритъ 346.
Ferrosum 180.
Флогистированный воздухъ 17.
Флуорантенъ (идрилъ) 265.
Флуоренъ 265.
Формулы графическія 244.
— молекулярныя 179.
— перечеркнутыя 84.
— синодтическія 173.
— строенія 239 и сл., 243 и сл., 249 и сл.
— структурныя 249.
— эквивалентныя 177 и сл.
— эмпирическія 173. Фосгенъ 158.
Фосфористая кислота 228. Фосфорная кислота 221, 229.
— — изслћдованія Грэма 142 и сл.
— — , изомерныя состоянія 110, 142.
— пятихлористый 283.
— пятихлористый, диссоціація его 287.
— трехбромистый 347.
Фотохимическая индукція 309.
Фраунгоферовы линіи 298.
Фталевая кислота 224, 260, 356.
Фталевый ангидридъ 265.
Фтористый кремній, открытіе 10.
Фторъ, открытіе 328.
Фуксинъ 263.
Фумаровая кислота 332.
Фурфуранъ или фуранъ 270.
Химическая масса 35 и сл.. 295, 297.
— система Берцеліуса 79 и сл.
— — Жерара 169 и сл.
— — Кольбе 213 и сл.
Химическое различіе (Броди) 185, 187.
Хининъ 353.
— какъ продуктъ расщепленія алкалоидовъ 268.
Хинонъ 262.
— формула 262.
Хлоралъ-гидратъ, диссоціація его 289.
Хлоридъ 241.
— и двухосновныя ьислоты 200, 201.
— хлорпропіоновой кислоты 242.
Хлориды кислотъ, открытіе 199.
Хлористый алюминій 274.
— метилъ 235.
Хлорокись хрома 158.
Хлоропропіоновая кислота 242.
Хлоросћрная кислота 200.
Хлорофиллъ 308.
Хлоръ, открытіе 9.
— химическая прврода его 73 и сл.
Хлоръ-пикринъ 235.
Хлоръ-толуолы 258.
Хризенъ 265.
Хромъ въ чистомъ видћ 322.
Царская водка 10.
Цезій, открытіе 300.
Zeitschrift für physikalische Chemie 314.
Цементъ 346.
Цинкъ, молекулы его 282.
— -этилъ, открытіе 212.
Ціанметилъ 212.
Ціановая кислота 108, 137, 144, 239.
Ціануровая кислота 244.
— -амидъ кальція 329.
— соединенія 116 и сл.
Щавелевая кислота 10, 113, 211, 228, 239, 244.
Щелочи, разложевіе ихъ 62, 69 и сл.
Экаалюмивій 295.
Экаборъ 294.
Экасилицій 295.
Эквиваленты 46 и сл., 60, 61, 95 и сл., 129, 130, 137, 138, 162, 178, 179, 180, 217 и сл., 226, 226, 289.
— Жерара 174.
— преломленія 311.
Эквивалентъ 46 и сл., 133, 134.
Экзотермвческія и эвдотермическія реакціи 306.
Электрическая вечь 322.
— примћвевіе его въ авализћ 321.
— — въ металлургіи 322.
Электролитическіе заковы 306.
Электромагнитное вращеніе плоскости поляризаціи 312.
Электровроводность 320.
Электросродство 344.
Электрохимическая теорія Берцеліуса 79 и сл., 102 и сл., 113, 157 и сл., 160, 215.
— — Дэви 62 и сл.
Электрохимія 65, 306, 307, 318 и сл.
Элементъ Бехера 6.
— классификація по валентности 291.
— опредћленіе его 26.
Элементъ Эмпедокла 4.
Эманація 339.
Энантіоморфныя формы 251.
Энзимъ 367.
Этенилъ-толуиленъ-діаминъ 278.
— -ксилиленъдіаминъ 278.
Этеринъ 116 и сл., 124, 126, 192.
Этерификація 297.
Этилатъ алюминія 213.
— калія 213.
— натрія 213.
— ртути, открытіе 213. Этиленъ 231, 232, 263, 278.
— синтезъ 272.
— роданистый 232.
— сћрнистая кислота 232.
— хлористый 232.
Этилъ 124, 128, 194, 212, 214.
— -амиловый эфиръ 194.
— -бензолъ 266.
— -гидропероксидъ 354.
— -карбинолъ 246.
— -пиридинъ 267.
Этилъ-сульфоновая кислота 243.
— -сћрная кислота, 169, 193 и сл., 209.
Этиловый спиртъ 221.
Этилъ-метиловый эфиръ 196.
— — угольной кислоты 197.
— — щавелевой кислоты 197.
Этіоновая кислота 122.
Эфиръ 122 и сл., 191 и сл., 194.
— изомасляной кислоты 248.
— малагути 159.
— мнћніе о немъ Берцеліуса 122 и сл.
— — Гэ-Люссака 114.
— — Либиха 123 и сл.
— опытъ Вильямсона 191.
— пропіоновой кислоты 242.
— — синтезъ 273.
Янтарная кислота 224.
| {676} |
Абамелекъ-Лазаревъ 373.
Авдћевъ 673.
Акема Филимонъ 374.
Алексћевъ В. Ф. 463, 696, 597, 601, 602, 605, 615.
Алексћевъ П. П. 417,425, 465,468, 472.
Альбицкій А. 488, 490, 494, 531.
Ананьинъ 369.
Аносовъ П. П. 621.
Антроповъ А. 574, 678, 611 642.
Арбузовъ A. E. 488, 515, 628, 647, 549, 647, 648.
Аренсъ В. (Ahrens) 439.
Аристовъ Н. 364.
Аронъ 546.
Архиповъ 553.
Асканъ О. 423, 453, 520, 624, 630, 636, 640, 541.
Астафьевъ С. 639.
Бабашинъ 382.
Багратіонъ кн. 572.
Базаровъ А. 668.
Баранецкій 606.
Барзировскій Я. 468.
Баташевъ A. P. 402.
Безрћдко Ш. 426.
Бейлыптейнъ Ф. Ф. 419, 421, 422, 430, 473, 476, 483, 494, 499, 616, 617, 529, 532, 555.
Бекетовъ В. Н. 633.
Бекетовъ Н. Н. 430, 460, 461, 462, 465, 470, 483, 540, 551, 662, 555, 662, 571, 573, 676, 601, 616, 617, 631, 632, 633, 645.
Бекманъ Г. 617.
Бекманъ I. 383.
Бенардосъ II. Н. 623.
Берендъ Р. 446.
Беркенгеймъ 603.
Бестюжевъ-Рюминъ Ал. гр. 401, 403, 449.
Биддеръ Ф. 651.
Биронъ Е. В. 442, 579, 590, 698, 600, 610.
Бишоффъ К. 425, 426, 461, 529, 530, 548, 648.
Блюментростъ 376.
Богородскій A. B. 446, 460, 488, 491, 582.
Богоявленскій А. 544, 626, 635.
Богусскій I. 562, 664, 587, 636, 637, 640.
Божовскій В. 625.
Бородинъ И. П. 430, 461, 467, 470, 473, 660.
Бородовскій В. А. 575.
Борщовъ М. 628.
Боянусъ Я. 491.
Брейтенбахъ Ф. Б. 424.
Бріотъ 371.
Брусовъ С. 639.
Брюхановъ 690.
Будниковъ 543.
Булгаковъ М. 363.
Бунге Г. ф. 651.
Бунге Н. Н. 423, 440, 499, 643, 653, 654.
Бурдаковъ В. Я. 551.
Буржанадзе И. 674.
Буткевичъ 649.
Бутлеровъ A. M. 416, 419, 421, 430, 435, 440, 466, 467, 470, 473, 474, 475, 476, 477, 478, 479, 480, 482, 483, 484, 485, 486, 487, 488, 490, 491, 494, 496, 496, 498, 499, 614, 527, 629, 639, 553, 654, 558, 670, 601, 636.
Бызовъ И. 606.
Бћлоусовъ И. 676.
Бћляевъ Н. Т. 624.
Бюргеръ М. 376.
Вагнеръ Е. Е. 488, 489, 490, 491, 499. 507, 621, 527, 535.
Вагнеръ Р. 647.
Вальдгеймъ, Фишеръ Г. И. 428.
Вальденъ П. И, 380, 383, 393, 422, 423, 425, 427, 432, 437, 442, 443, 444, 445, 446, 448, 454, 457, 461, 463, 488, 510, 615, 621, 629, 631, 532, 533, 634, 641, 645, 546, 555, 661, 662, 663, 571, 579, 688, 589, 690, 691, 592, 593, 598, 604, 607, 608, 612, 618, 627, 636.
Валяшко Н. 455.
Ванинъ И. 537.
Васильева А. 463.
Васильева П. 441.
Васпльевъ A. M. 364, 650, 626.
Васильевъ М. 639.
Васмусъ Ф. 515.
Веймарнъ П. 426, 570, 602, 605, 606, 628, 629.
Веніаминовъ 404.
Вернадскій В. И. 427, 534, 576.
Вернеръ Е. В. 460.
Вильде I. де 403.
Виніусъ А. 373.
Винсъ Т. 368.
Виттъ О. Н. 542.
Владиміровъ А. 608.
Воейковъ А. И. 563.
Войничъ-Сяножепцкій С. 668.
Волхонскій Е. 611.
Воронцовъ гр. 400.
Воскресенскій A. A. 436, 464, 465, 466, 471, 476, 510, 660, 586.
Вревскій М. 614.
Вреденъ Ф. Р. 517, 520, 535, 538, 639.
Вроблевскій Э. 518.
Вроченскій 613.
Вуколовъ С. П. 603.
Вурцель Е. 670.
Вуттигъ I. Фр. Хр. 424.
Вышнеградскій А. 486, 491, 499, 614, 516, 621, 522, 626, 527.
Гадаскинъ Д. Д. 615.
Гаддъ П. 382.
Гадзяцкій В. П. 503.
Гадолинъ A. В. 626.
Гансланцъ (Ганслантъ или Гансъ Сланцъ) 368, 369.
Гарницъ-Гарницкій 430.
Гассельблаттъ Р. 594.
Гебель Ф. 553.
Гезехусъ 448.
Гемиліанъ В. 475, 476, 519, 564, 587.
Генкель 376.
Георги I. Г. 386, 387, 394, 396, 400.
Гервагенъ 448.
Германъ Г. Р. 394, 396, 456, 554, 559, 572, 573.
Гессъ Г. Г. 412, 414, 415, 418, 455, 456, 457, 458, 459, 465, 553, 557, 601, 602.
Гизе Ф. И. 414, 418, 428, 437, 456, 553.
Глазенапъ М. 633.
Гликинъ 652.
Глинка Н. 646.
Гладкій 382.
Глћбко А. 533.
Гмелинъ I. Г. 377.
Гнћдичъ А. 491.
Голицынъ Дм. кн. 401.
Головкинскій 430.
Голодецъ А. 615.
Гольдштейнъ М. 592.
Горбовъ А. 425, 447, 531, 615, 624.
Гофмейстеръ Д. 403.
Гребенщиковъ И. 640.
Грипзкевичъ-Трохимовскій Э. 520, 528.
Гротгусъ Ф. 435, 437, 450, 487, 600, 632, 636.
Грузинцевъ А. 464.
Губкина Н. Я. 652.
Гумбольдтъ А. Ф. 620.
Гурьевъ 399.
Густавсонъ Г. Г. 425, 476, 496, 497, 499, 500, 504, 518, 519, 523, 624, 563, 580, 5Ы, 601, 631, 632, 648.
Гутковская К. 587.
Гутменшъ Я. 371.
Гьельтъ Э. 453, 489, 516, 529, 530.
Давыдовъ А. 590.
Даинъ Г. 519.
Дашкова Ек. Р. кн. 388, 389, 396, 398, 399, 400.
Дворжанчикъ С. 441.
Дебу К, И. 502.
Демьяновъ Н. Я. 497, 499, 511, 512, 523, 524, 525.
Дпшлеръ 447.
Діанинъ А. П. 470.
Діонисьевъ 584.
Доброхотовъ В. 639.
Долецкій 503.
Доливо-Добровольскій М. 449.
Дорошевскій А. 441, 444, 455, 614.
Дояренко 524.
Драгендорфъ Г. 554.
Дунаевъ Ив. Ив. 434.
Дурилинъ П. 650.
Дыбовскій Б. 639.
Евгеній 387, 388, 394, 395, 398, 401, 406.
Евреиновъ П. 654.
Егорова В. 602.
Егоровъ К. 576.
Еленевъ А. 687.
Елисафовъ Г. 438.
Ерофеевъ М. В. 674.
Желћзновъ В. Ф. 622.
Жемчужпый С. Ф. 447, 593, 616, 617, 623.
Жуковъ А. 531. Жуковъ И. И. 447, 569, 574.
Жукъ 588.
Завадскій Я. 614.
Завріевъ Д. X. 644.
Завьяловъ 652.
Загуменный A. A. 470.
Зайончевскій 588.
Зайцевъ A. M. 417, 425, 474, 475, 488, 489, 490, 495, 496, 498, 499, 506, 529, 531, 537.
Зайцевъ К. 489.
Зайцевъ М. М. 488, 489, 526, 537, 564.
Зайцевъ Н. 491.
Зайцевы Н. и А. 531.
Залесскій И. А. 651.
Залкиндъ Ю. С. 648, 549, 556, 647, 648.
Зальховъ 393.
Захаровъ Як. Д. 388, 389, 390, 399, 411, 412.
Зеебекъ 448.
Зелинскій Н. 423, 426, 440, 444, 445, 455, 515, 619, 620, 623, 525, 526, 530, 639, 540, 548, 666, 675, 646, 647, 648.
Зеттегастъ Я. (Зеттингастъ, Зеттигастъ) 367, 368.
Зиберъ Н. 651.
Зиловъ 447.
Зининъ Н. Н. 430, 431, 434, 461, 464, 467, 468, 469, 470, 471, 472, 473, 476, 476, 494, 516, 57 3, 586.
Зубковская 584.
Зубовъ П. 460.
Зыбелинъ 404.
Ивановъ С. Л. 649.
Ижевскій В. П. 513.
Избековъ В. 618.
Изгарышевъ А. 444.
Ильинскій М. A 542.
Илькевичъ К. 633.
Ипатьевъ В. Н. 426, 426, 493, 499, 500, 503, 504, 505, 507, 609, 611, 522, 523, 526, 536, 541, 631, 644, 645, 647.
Іорданскій Н. 587.
Каблуковъ И. А. 380, 423, 425, 426, 427, 441, 442, 443, 445, 459, 490, 639, 681, 689, 614, 618, 633, 635.
Казаковъ Н. 528.
Казанкинъ 590.
Калакуцкій 622.
Каменскій Г. 422.
Каннегиссеръ 688.
Канонниковъ И. И. 453, 454, 488, 489, 529, 535, 546.
Канчевъ В. 640.
Карамышевъ 406.
Карташевъ А. 549.
Кастеринъ Н. 590.
Каяндеръ 487, 564, 687, 636, 637, 640.
Келлихенъ 642.
Кесслеръ А. 615.
Кишнеръ Н. М. 507, 514, 518, 520, 624, 525, 536, 537, 646, 647.
Кистяковскій В. А. 423, 441, 452, 561, 669, 579, 590, 591, 592, 606, 609, 614, 617, 635.
Клаусъ К. К. 414, 435, 439, 476, 494, 495, 554, 556, 557, 558, 559.
Клейнъ 439.
Книримъ В. 651.
Коблянскій А. 580.
Ковалевскій В. 441, 455, 579, 639.
Ковалевскій К. 652.
Козицкій М. 554.
Козыревъ Д. 618.
Кокшаровъ 572.
Колли A. P. 448.
Колосовскій Н. 463.
Комаровскій А. 577.
Комлишинскій 418.
Компа 536.
Кондаковъ И. Л. 453, 499, 501, 502, 503, 506, 531, 535, 643.
Коноваловъ Д. П. 445, 446, 510, 555, 589, 600, 608, 609, 610, 612, 613, 614, 615, 617, 639, 642, 643.
Коноваловъ М. И. 455, 511, 513, 514, 515, 524, 535, 539.
Кононовъ 399.
Короваевъ 430.
Косса 552.
Косоноговъ 448.
Костъ П. Г. (Коэтъ, Котъ) 372.
Кравковъ Н. 652.
Краевичъ 689.
Крангальсъ Ф. 441.
Крассовскій М. 649.
Красусскій К. 508.
Крафтъ Г. В. 619.
Крашенинниковъ 452.
Крупскій А. 509.
Кузнецовъ М. 646.
Кузнецовъ С. 576.
Купферъ А. 533, 572, 619, 620 625.
Курбатовъ В. Я. 459, 543, 563, 569, 624.
Куриловъ В. В. 424, 461, 577, 584, 613, 630.
Курнаковъ Н. С. 446, 454, 545, 555, 579, 593, 622, 623.
Кучеровъ М. Г. 500, 501, 502, 520.
Кюри М. (Склодовская) 574.
Лагоріо А. 651. Лагусъ В. 383, 386.
Лагермаркъ Г. 501.
Лаксманъ Э. (К. Г.) 383, 384, 385, 386, 387, 391, 396, 398, 400 402, 572.
Лачиновъ П. А. 500, 518, 520, 574, 651.
Лебедевъ А. 649.
Лебедевъ С. 445, 502, 503, 504, 606, 649.
Левальтъ-Езевскій М. 460.
Левандіанъ А. 374.
Левенштейнъ 616.
Левинсонъ-Лессингъ Ф. Ю. 606.
Левитесъ С. Я. 629.
Лейстъ Э. Г. 576.
Лейтманъ И. Г. 376.
Леманъ I. Г. 382, 394, 395, 400, 407.
Лембергь I. 661.
Лермантовъ 402.
Лерхе 594.
Либенъ 631.
Лобачевскій 469.
Ловицъ Г. М. 390.
Ловицъ Т. Е. 385, 387, 389, 390, 391, 392, 393, 394, 396, 400, 405, 407, 411, 437, 464, 465, 481, 595, 600, 625, 640.
Логиновъ Н. 492.
Логиновъ П. 430.
Ломоносовъ М. В. 376, 377, 378, 379, 380, 381, 382, 393, 395, 403, 427, 455, 464, 540, 600.
Лосевъ К. 624.
Лохтинъ 542.
Лукьяновъ 542.
Луцъ О. 532.
Львовъ М. Д. 453, 488, 501, 507, 516, 649.
Любавинъ Н. Н. 402, 423, 426, 514, 527, 528, 629.
Макаровъ С. 594.
Маковецкій А. 614.
Максимиліанъ, Герцогъ Лейхтенберг-скій 439, 554.
Мамонтовъ 368.
Маріуца 503.
Марковниковъ В. В. 416, 427, 467, 473, 474, 475, 479, 488, 489, 495, 498, 499, 513, 520, 524, 525, 537, 538, 539, 540, 543, 558.
Марко Д. 491.
Марселисъ П. 374.
Мацуревичъ 537.
Менделћевъ Д. И. 412, 418, 419, 420, 422, 427, 430, 431, 432, 460, 465, 481, 497, 510, 538, 540,545, 551, 552, 553, 560, 561, 662, 565, 566, 567, 568, 570, 673, 677, 686, 587, 688, 589, 590, 594, 599, 601, 602, 603, 604, 609, 620, 621, 630, 632, 639, 644.
Меншуткинъ Б. Н. 378, 380, 420, 427, 461, 510, 550, 584, 585, 639.
Меншуткинъ Н. А. 417, 420, 422, 427, 430, 431, 432, 465, 482, 490, 493, 510, 511, 520, 529, 547, 649, 638, 639.
Меныпиковъ П. 489.
Милановскій Б. 544.
Миллеръ 376.
Минцъ Н. 529.
Миткевичъ В. 447.
Модель 394, 400, 401, 404, 405.
Моисеенковъ Ф. 384.
Мокіевскій 503.
Мооръ О. 651.
Моргулева О. 599.
Мосцицкій I. 447.
Мостовичъ В. 633.
Мусннъ-Пушкпиъ A. A. гр. 401, 407, 553.
Мусселіусъ Л. 639.
Мясниковъ 498.
Надеждинъ 588.
Наметкинъ С. С. 607, 514, 515.
Нейдгартъ Л. 374.
Непея О. 365.
Неустроевъ 393.
Нечаевъ 412.
Никифоровъ A. H. 638.
Новомбергскій 366, 367, 368, 369, 370, 371, 372.
Овсянниковъ П. 554.
Оглоблинъ В. Н. 462, 639, 543.
Озаннъ Г. (Осаннъ) 418, 456, 553, 556, 557, 559.
Озерецкій 399.
Орловъ А. 519.
Орловъ Г. 644.
Орловъ гр. 400.
Осиповъ И. П. 425, 469, 460 461, 528, 529.
Осокинъ М. 484.
Оствальдъ В. 380, 381, 422, 423, 426, 427, 432, 437, 440, 441, 443, 444, 450, 458, 459, 610, 668, 679, 594, 595, 597, 607, 612, 616, 617, 625, 626, 634, 635, 639, 642, 643, 651.
Остроградскій 660.
Остромысленскій И. И. 453, 505, 506, 512, 533, 534, 656, 580, 647.
Павлевскій 688.
Павловичъ П. 614.
Павловская И. 528
Павловъ В. Е. 603.
Павловъ Д. 527.
Павловъ И. П. 651.
Павловъ П. Н. 628.
Палладинъ В. И. 451, 649, 650.
Панаевъ I. П 574.
Парротъ Г. Ф. 606.
Пашко Птицкой 372.
Пеняковъ Д. А. 652.
Петренко 578.
Петренко-Критченко П. 528, 530, 555, 560, 640.
Петровъ В. В. 406, 436, 437, 449.
Петровъ Н. 592.
Петрушевскій 649.
Пильчиковъ Н. 590.
Пинегинъ С. 525.
Писаржевскій Л. 440, 442, 445, 460, 462 569, 577, 581, 635, 647.
Пищимука П. 549.
Плотниковъ В. А. 426, 440, 442, 443, 445, 514, 546, 580, 581.
Плотниковъ И. 423, 426, 452, 636.
Пономаревъ II. М. 475, 610, 511, 543.
Поповъ A. H. 449, 483, 484, 488, 491.
Попперъ 523.
Порай-Кошицъ A. E. 543.
Потылицынъ A. JI. 425, 461, 462, 582, 626, 631, 632, 633.
Працъ Г. 587.
Пржибытекъ С. 475, 490, 504, 531.
Прилежаевъ Н. 578.
Прокофьевъ О. 639.
Прохоровъ 543.
Пухнеръ Хр. 368.
Пушинъ Н. 447, 556, 580, 623, 640.
Раевскій 554.
Разумовскій Г. гр. 402.
Раковскій A. B. 630.
Ракузинъ М. А. 541.
Рамбахъ Ф. 617.
Ребоевъ И. 394.
Редзко В. Н. 619.
Ремусъ В. 394.
Ренофанцъ И. М. (Ренованцъ) 387, 406.
Реформатскій A. H. 488, 492, 494, 495.
Реформатскій С. Н. 423, 426, 488, 490, 492, 619, 648, 635.
Ржешотарскій 622.
Рихманъ Г. В. 466.
Рихтеръ В. 367, 368, 371, 376, 401, 402, 661.
Рихтеръ В. Ю, 419, 420, 422, 431, 461, 618.
Рождественскій Д. С. 466.
Розановъ М. А. 633.
Розенбушъ Б. 374.
Ротарскій Т. 628.
Ротинянцъ Л. 628.
Рубцовъ П. П. 663.
Руденко Ю. 678.
Рычковъ 395.
Сабанћевъ А. П. 475, 600, 574, 583, 617, 629.
Савченковъ 417,
Салазкинъ С. 651.
Саменъ Ф. 624.
Сапожниковъ А. 426, 441, 447, 462, 493.
Сахановъ А. 442, 443, 446, 681, 593.
Свћнтославскій В. 460.
Севергинъ В. М. 389, 394, 396, 397, 398, 399, 400, 405, 411, 412, 413.
Селивановъ Ф. Ф. 549, 583, 633.
Семеновъ В. 492, 611, 531, 532, 549.
Сиверцовъ 652.
Сиволобовъ А. 615.
Сидоренко К. 511.
Симоновъ 469.
Ситниковъ А. 618.
Скавронская Н. 504.
Скобликовъ 554.
Смирновъ В. 600.
Смитъ В. 368.
Свядецкій А. 558.
Соболевскій П. 371, 412, 446, 553.
Соболевъ М. 580.
Соковкинъ Н. 640.
Соколовъ А. П. 448, 540, 552, 676.
Соколовъ Н. Н. 429, 430, 464, 466, 473, 474, 600, 610, 561, 562, 576.
Соколовъ Никита 387, 388, 389, 396, 399, 412.
Сперанскій A. B. 440, 579, 614, 616, 618, 636, 642.
Срезневскій Б. 590.
Станкевичъ 448.
Стасевичъ Н. 584.
Столћтовъ 588.
Страусъ 588.
Страховъ 551.
Струве Г. 654.
Субботиыъ В. 680.
Судаковъ А. 656.
Сухомлиновъ 388, 389, 394, 396, 398, 399, 401.
Сушинъ К. 632.
Сћченовъ И. М. 695.
Тамманъ Г. Г. 463, 534, 555, 566, 583, 592, 594, 607, 608, 610, 611, 612, 616, 616, 617, 624, 626, 627, 628, 631, 635, 649, 651.
Танатаръ С. 462, 529, 631, 574, 576, 582, 617, 618, 627, 647.
Татаринъ 623.
Таубертъ И. И. 400.
Теплеръ А. 607.
Тепловъ 652.
Терешинъ 448.
Теръ-Газаріанцъ Г. 670.
Тимофеевъ В. Ф. 423, 461, 463, 696, 598.
Тихвинскій М. М. 528, 615, 647.
Тихоцкій 523.
Томиловъ 406.
Троицкій 568.
Тюринъ В. 442.
Уклонская Н. 647.
Умновъ А. 492.
Фаворскій А. 492, 500, 601, 502, 603, 504, 505, 507, 526, 647, 548, 640.
Фаминцынъ 450.
Ферберъ 394.
Филипповъ О. Г. 504, 506, 612, 524, 646.
Флавицкій Ф. М. 426, 491, 499, 529, 535, 545, 568, 582, 608, 625.
Фокинъ С. А. 512, 531, 666, 645, 649.
Френкель Д. 580.
Фридлендеръ 626.
Фрицше Ю. Ф. 450, 466,467, 468, 471, 472, 476, 479, 481, 610, 617, 642, 654, 557, 573, 578.
Фріауфъ А. 647.
Хардинъ Д. А. 533.
Хвольсонъ О. Д. 426, 438, 464, 571.
Хемнитцеръ 382.
Хотинскій Е. 426.
Христіани 384.
Хруцкій Н. 647.
Цакони А. 635.
Цвћтъ М. С. 461.
Цельтнеръ I. 648.
Центнершверъ М. Г. 444, 569, 588, 597, 612, 635, 640, 642.
Цеперникъ 594.
Циндель 543.
Цоневъ 528.
Цолликоферъ фонъ Алтенъ Клин-геймъ 403.
Чейшвили П. И. 647.
Чернай Н. А. 461, 610, 611, 59..
Черникъ Г. П. 573.
Чернышевъ гр. 400.
Чижевскій 624.
Чиликинъ М. 644.
Чприковъ А. 556.
Чистовичъ 405.
Чичеринъ 568.
Чугаевъ Л. А. 426, 612, 533, 534, 536, 541, 555, 568, 579, 580, 606.
Чумаковъ С. 582.
Чумнинъ 407.
Шавринъ В. 544.
Шалфћевъ М. 651.
Шевремонтъ 403.
Шенрокъ И. 568.
Шереръ А. И. 406, 407, 411, 412, 413, 418, 429, 479.
Шиллингъ ф. 448.
Шиловъ В. 370.
Шиловъ Н. 642.
Шиманскій С. Г. 543, 644, 660.
Шиманъ 394.
Шишковъ Л. Н. 435, 473, 497, 608, 509, 561.
Шлатеръ И. 394.
Шляторъ Фр. (Шлахторъ, Слаторъ, Сляторъ) 368, 370.
Шмидеръ 371.
Шмидтъ К. 419, 422, 479, 481, 542, 660, 651.
Шнейдеръ В. 474, 486, 499, 554. Шоберъ Г. 394.
Шпитальскій 642.
Шпоръ И. 635.
Шредеръ И. Ф. 463, 545, 593, 694, 597, 598, 602, 603, 609, 610.
Шталь 376.
Шуваловъ П. И. гр. 407.
Шуляченко А. 644.
Щегловъ Н. П. 414, 416, 418, 429.
Щегляевъ 448.
Щербакъ Б. 646.
Эглеръ 369.
Эйлеры 400.
Эйхлеръ Хр. 404.
Эльтековъ 475, 490, 499,601, 506, 608.
Эммертъ 438.
Энгельгардтъ А. И. 429, 430, 435, 467, 600, 618.
Энгельгардтъ М. 563.
Яблочковъ П. 449.
Явеловъ 516.
Яворскій В. 637.
Якоби I. 554.
Яковкинъ A. A. 462, 582, 608, 609, 614, 635.
Яковлевъ В. 606.
Якубовичъ В. 519.
Якубовичъ Н. К. 610.
Яцуковичъ 430.
Ќедоровскій Э. Г. 439.
| {686} |
УКАЗАТЕЛЬ ПРЕДМЕТОВЪ
къ Очерку исторіи химіи въ Россіи
П. Вальдена.
Авторацемизированіе 532.
Аггрегатныя состоянія 586.
Адсорбирующая способность угля 390.
Адсорбція газовъ 595.
Академическій періодъ химіи 375—409.
Активный кислородъ 642.
Алкалоиды 527.
Алюминотермическій способъ Гольдшмидта 631.
Амины полиметиленоваго ряда 524—628.
Анормальная вращательная дисперсія 533.
Аптека первая 366.
Аптекарская дћятельность 367.
Ароматическія оксикислоты 519.
Безпроволочный телеграфъ 449.
Биротація (мультиротація) 649.
Біографическія свћдћнія и перечень научныхъ работъ:
Бекетова 460, 461, 571, 674, 631.
Бишофа 529.
Воскресенскаго 466.
Вышнеградскаго 527.
Гесса 456.
Захарова 389.
Клауса 616.
Коновалова М. 563.
Ловица 390.
Лугинина 459.
Марковникпва 539.
Меншуткина Н. 510, 420, .49. 638, 639.
Натансона 542.
Петрова 436.
Попова 491.
Шишкова 509.
Біолитическое расщепленіе 650.
Вальденовское обращеніе 632.
Векторіальная теорія плавленія дисперсныхъ системъ 628,
Взаимодћйствіе веществъ въ растворахъ 698—600.
Взрывчатыя тћла 500.
Винокуреніе 369.
Внутреннее треніе 592.
Внутреннія давленія растворовъ 6] 0.
Выцвћтаніе красокъ 543.
Гальванопластика 439.
Гетероциклическія соединенія 515—524.
Гидратная теорія Менделћева 602.
Гидрогенизованный бензолъ 520.
Гидролизъ хлора 636.
Гипотеза Львова 507.
Горное дћло 361, 373, 374, 383, 394, 407—409.
Дегидрогенизація 646.
Деструкція камфоротћлъ по Ипатьеву 536.
Дефлегматоры 615.
Динамическая гипотеза Бишофа 529.
Дисперсія 454.
Диффузія, константы 593.
Дћйствіе азотной кислоты на парафины 513.
— амміака и его производиыхъ на галоидозамћщенныя кислоты 532.
— энзимовъ на волокнистыя вещества 650.
Дыхательные хромогены 650.
Зависимость между теплоемкостью растворовъ и осмотическимъ давленіемъ 609—610.
Закоыъ разбавленія Оствальда 633.
Законы Гесса 458.
— Коновалова и его теоретическіе взгляды на растворы 613.
Измћреніе температуръ замерзанія электрическимъ термометромъ 617.
Изомеризація 498.
— бромистаго изопропила 500.
— непредћльныхъ углеводородовъ 501.
Изомерія спиртовъ и кислотъ и вліяніе ея на скорость образованія сложныхъ эфировъ 493.
Изопренъ 503.
Изостильбенъ 519.
Изофлуидизмъ 599.
Инверсія сахара 633.
Индивидуальная роль различныхъ металловъ при каталитическихъ реакціяхъ окисленія 645.
Канаринъ 543.
Капиллярныя константы жидкостей 590-592.
— избирательный возстановительный 646.
Катализаторы-металлоиды 648.
Каталитическая сила 643.
Каталитическіе способы гидрогенизазаціи 522.
Каталитическія реакціи при высокихъ температурћ и давленіи 644
Каталптическое дћйствіе бромистаго алюминія 518.
— — твердыхъ аморфныхъ тћлъ въ газообразномъ состояніи 643.
Катафореза 438.
Кислородъ четырехатомный. какъ амфотерный элементъ, 543.
Кислоты желчи 520.
— ихъ коагуляція 629.
— молекулярный вћсъ 629.
Коллоидальныя модификаціи сћры 569, 570.
Комплексныя соединенія сћры 550, 579.
Контактное окисленіе углеводородовъ 645.
Концентраціонныя цћпи 442
Красное конго 544.
Кристаллизація 391.
Кристаллы жидкіе 627.
Кристаллы, опредћленіе молекулярнаго вћса 627.
Критическія явленія 588.
Кріоскопическія измћренія 617—618.
Кріосольваты 625.
Ксантогеновый ыетодъ Чугаева приготовленія непредћльныхъ углеводородовъ 536.
Лабораторіи 366, 379, 429, 452, 459, 493—498.
Магній-органическія соединенія 538, 549.
Металлоиды 569.
Методъ Вагвера окисленія марганцовокислымъ каліемъ 535.
— Вышнеградскаго-Ладенбурга гидроишизаціи 521, 522, 528.
— Егорова опредћленія мћста двойной связи въ непредћльныхъ соединеніяхъ 512.
— Ипатьева простого перехода этиленныхъ углеводородовъ въ циклическіе 526.
— Кижнера каталитическаго разложенія гидразиновъ 537.
— — перехода бромаминовъ къ гидразинамъ 524.
— М. И. Коновалова перехода изонитросоединеній въ кетоны 515.
— раздћленія близко кипящихъ жидкостей 615.
— С. И. Реформатскаго полученія третичныхъ оксикислотъ 492.
Механизмъ реакцій окисленія непредћльныхъ углеводородовъ 506, 507.
Молекулярный вћсъ жидкостей 592.
Молекулярныя эбулліоскопическія константы, ихъ вычисленіе 612.
Московскій періодъ химіи 367—375.
— химическихъ элементовъ 550.
Нафтеновыя кислоты 539.
Непредћльные углеводороды 498.
— теоріи происхожденія 540, 541.
— вращательная способность 541.
— отличіе русской отъ американской 538.
Нитрозиты 509.
Нитроформъ 509.
Оксоніевыя соединенія 545—549.
Опредћленіе показателей преломленія 454.
Оптическая суперпозиція 532.
Органическія красящія вещества 541-544.
Осмотическая теорія и давленіе 606, 607, 609, 610.
Открытіе высшихъ учебныхъ заведеній и медицинскихъ школъ 403—407, 409-10
Отличіе рацемическихъ тћлъ отъ нерацемическихъ 534.
Парабановая кислота 510.
Пассивность металловъ 569.
Перекись водорода 577.
Пересыщенные растворы 628.
Періодическая система 569, 630.
Платина и платиновые металлы 553—559.
Поверхностное натяженіе 591, 605.
Поливалентность кнслорода 545.
— двуэтиленовыхъ углеводородовъ 503, 504.
Полиметиленовые углеводороды Густавсона 523, 524.
Полиморфизмъ іода 509.
— сћры 510.
Полисульфиды 578.
Популярпзація химическихъ наукъ 396, 399.
Правило Вальдена для молекулярной энтропіи 592, 627.
Правило Кижнера 646.
— Кистяковскаго 591.
— Оствальда-Вальдена 443.
— Чугаева 553.
Приборъ Г. Глинскаго для фракціонированной персгопки 615.
— Д. Коновалова для дробной перегонки 615.
Природа катализаторовъ 648.
Производство стекляпыыхъ и глиняныхъ издћлій 372.
Радій и радіоактивность 574—577.
Распредћлепіе кислотъ между основаніями 639.
Растворимость газовъ 595.
— жидкостей 596.
Растворители, вліяніе природы ихъ 632, 636.
— кріоскопическіе 617.
Растворяющая сила органическихъ растворителей 598.
Реактивъ Фрицше 542.
Рћдкіе элементы и земли 572—574.
Свћтопреломляющая способность нитропроизводыыхъ 455.
— — смћсей 455.
Синтезъ горчичнаго масла 468.
— метана 645.
— нитриловъ жирнаго ряда 515.
— первый сахара 480.
— сложныхъ полиметпленовъ 525.
— съ малоновымъ эфиромъ 529.
— циклическихъ углеводородовъ 525.
— оксикетоновъ и кетоновъ 519.
— циклическихъ спиртовъ 637.
Скорость химическихъ реакцій 633.
Сольватъ 584.
«Сопряженныя» реакціи 642.
Спектры поглощенія 455.
Стереохимія ди- и трикарбоновыхъ кислотъ 530.
Стереохимія азота 530.
— и оптическая вращательная способность (изслћдованія Вальдена) 528—535.
Строеніе камфоры и терпеновъ 536.
Теорія электролитической диссоціаціи 607.
Тепловое расширеніе жидкостей 589, 594.
Термодинамическая теорія плавленія дисперсныхъ системъ 628.
Теплоемкость спирта въ различныхъ растворителяхъ 593.
Тетраыитрометанъ 510.
Техническій способъ полученія этилена изъ этиловаго спирта 499.
Тіофеновый рядъ 520.
Требованія на магистерскихъ экзаменахъ 434, 435.
Трехатомный углеродъ 544, 545.
Упругость диссоціаціи амміакатовъ 613
Ферментативное расщепленіе жировъ 649.
Физико-механическая теорія растворовъ А. Михаыленко 611.
Физикохимическая теорія растворенія Веймарна 605.
Физическая теорія растворенія и растворовъ Алексћева 605.
Физіологическая химія 650—652.
Формальдегидъ 645.
Формула Кистяковскаго 617.
Фосфоресценція 569.
Фосфористая кислота, строеніе 549.
Фотохимическая лабораторія Плотникова 452.
Фотохимическій синтезъ каучука 453.
Фотохимическія работы русскихъ химиковъ 452, 453.
Фуксинъ 542.
Химическая литература 394, 395, 418—427.
Химическіе журналы и общества 427—432.
— продукты въ XIII и XIV вв. 363, 364.
— растворы 600.
Химическія лабораторіи въ прошломъ 493—498.
Холестеринъ 520.
Хронологическая таблица важнћйшихъ работъ по алифатическому ряду 472—476.
— — важнћйшихъ работъ по ароматической химіи 471, 472.
Циклическіе алкоголи, реакція Ипатьева 500.
Циклическія соединенія 615—524.
Эбулліоскопія 612.
Эволюціонный принципъ Курилова 630.
Эквивалентная электропроводность 440, 441.
Электрическая свћча Яблочкова 449.
Электрическіе токи индуцированные 449.
Электрическій эндосмосъ 438.
— телеграфъ 448.
Электрическія волны, примћненіе въ химіи 447.
Электрическое сжиганіе воздуха 447.
Электролизъ, теорія Гротгуса 437.
Электромоторъ Якоби 449.
Электропроводность азотистыхъ металловъ 447.
— водныхъ растворовъ (работы Кистяковскаго) 441, 442.
— въ смћшанныхъ растворителяхъ 445.
— неводныхъ растворовъ (изслћдованія Вальдена) 442, 443, 444.
— расплавленныхъ солей 446.
Эстерификація 638.
| {691} |
I. А. ЛАДЕНБУРГЪ. Лекціи по исторіи развитія химіи отъ
Лавуазье до нашего времени.
стр. |
|
Предисловіе къ первому изданію................. | VI |
Предисловіе къ четвертому изданію................ | VIII |
Первая лекція. Введеніе — Теорія флогистона — Ея первоначальное и позднћйшее значеніе — Научныя познанія флогистиковъ — Крушеніе системы....................... | 1 |
Вторая лекція. Переворотъ во взглядахъ на горћніе — Пристлей—Шееле—Лавуазье — Постоянство матеріи........... | 14 |
Третья лекція. Химическая номенклатура — Таблицы сродства. — Взгляды Бертолле — Споръ о постоянствћ состава........ | 29 |
Четвертая лекція. Изслћдованія Рихтера — Атомистическая теорія Дальтона — Объемный законъ Гэ-Люссака — Гипотеза Авогадро — Эквиваленты Волластона................... | 44 |
Пятая лекція. Электрохимическая теорія Дэви — Открытіе щелочныхъ металловъ — Споры относительно ихъ состава — Содержитъ ли соляная кислота кислородъ? — Теорія водородокислотная ... | 62 |
Шестая лекція. Берцеліусъ и его химическая система — Законъ Дюлонга и Пти—Изоморфизмъ—Гипотеза Проута — Опредћленіе плотности пара по Дюма—Гмелинъ и его школа ......... | 79 |
Седьмая лекція. Органическая химія въ началћ ея развитія — Попытки опредћленія элементарныхъ составныхъ частей въ органическихъ соединеніяхъ. — Изомерія и полимерія. — Взгляды на строеніе — Теорія радикаловъ................... | |
Восьмая лекція. Дальнћйшее развитіе теоріи радикаловъ — Взгляды на алкоголь и его производныя — Явленія замћщенія — Правило Дюма — Теорія ядеръ — Эквивалентъ азота............. | 121 |
Девятая лекція. Грэмъ изслћдуетъ фосфорную кислоту — Теорія многоосновныхъ кислотъ Либиха, его взгляды на кислоты вообще — Признаніе гипотезы ДэвиДюлонга — Открытіе трихлоруксусной кислоты — Теорія типовъ — Нападки на электрическую теорію — Возраженія Берцеліуса — Парныя органическія соединенія | 140 |
Десятая лекція. Вліяніе школы Гмелина — Теорія остатковъ — Парныя соединенія — Жераръ опредћляетъ эквивалснты — Лоранъ разграничиваетъ понятія объ атомћ, молекулћ и эквивалентћ — Новые критеріи для многоосновныхъ кислотъ — Молекула элементовъ имћетъ сложный составъ................. . | 161 |
Одиннадцатая лекція. Доводы въ пользу дћлимости элементарныхъ молекулъ — Вильямсонъ опредћляетъ молекулярныя величины при помощи химическихъ реакцій — Теорія образованія эфировъ — Сліяніе теоріи радикаловъ и типовъ Дюма — Замћщенныя амміачныя соединенія — Многоатомные радикалы — Теорія типовъ и классификація Жерара................. | 184 |
Двћнадцатая лекція. Смћшанные типы — Связь между идеями Кольбе и теоріей Берцеліуса о сочетанныхъ соединеніяхъ Содержащіе металлъ радикалы — Сочетанные радикалы Кольбе и Франкландъ сторонники теоріи типовъ — Идея многоосновности. какъ доводъ въ пользу правильности „новыхъ атомныхъ вћсовъ” — Открытіе многоатомныхъ спиртовъ и амміачныхъ соединеній..... | 206 |
Тринадцатая лекція. Идея типовъ — Объясненіе природы радикаловъ валентностью элементовъ — Четырехатомность углерода — Удћльные объемы—Формулы строенія — Разграниченіе понятій атомности и основности — Изомерія спиртовъ и кислотъ — Физическая изомерія — Вещества съ меньшимъ содержаніемъ водорода | 234 |
Четырнадцатая лекція. Теорія ароматическихъ соединеній — Опредћленіе мћста въ. ядрћ — Хиноны Техника красильнаго дћла — Циклическія связи — Строеніе алкалоидовъ — Синтезы — Явленія уплотненія......................... | 256 |
Пятнадцатая лекція. Основныя понятія химіи — Явленія диссоціаціи — Аномальныя плотности пара — Постоянная или перемћнная валентность — Ученіе о валентности въ неорганической химіи — Періодическій законъ — Новћйшее развитіе ученія о сродствћ — Спектральный анализъ” — Синтезы минераловъ — Непрерывность жидкаго и газообразнаго аггрегатнаго состоянія Сжиженіе „постоянныхъ” газовъ — Термохимія — Электрохимія — Фотохимія — Молекулярная физика — Морфотропія............. | 280 |
Шестнадцатая лекція. Законъ дћйствия массъ — Теорія фазъ — Теорія корреспондирующихъ состояній — Теорія растворовъ — Электрохимія — Жидкій воздухъ — Новые элементы въ воздухћ — Химія азота — Температура превращенія — Стереохимія — Тавтомерія — Новыя открытія въ органической химіи............. | 314 |
Семнадцатая лекція. Изслћдованіе радія — Новое понятіе о валентности — Вычисленіе химическихъ равновћсій на основаніи термическихъ измћреній — Твердые растворы — Аллотропія — Методы расщепленія рацемическихъ соединеній — Асимметрическій азотъ — Синтезы и синтетическіе методы — Недокиси и перекиси — Изслћдованіе бћлковъ — Катализъ — Химія коллоидовъ......... | 337 |
| {693} |
II. П. И. BАЛЬДЕНЪ. Очеркъ исторіи химіи въ Россіи.